Monocarbossilici
Bicarbossilici
Tricarbossilici
ACIDI GRASSI sono acidi
carbossilici alifatici a lunga catena,
Saturi o insaturi se vi è almeno un
doppio legame. Quasi
tutti gli acidi
grassi
naturali
contengono
un numero
pari
di atomi di C.
La reazione + importante degli acidi
che avviene però solo se CATALIZZATA, x es. da ACIDI
Saponi : sali di sodio e potassio degli acidi grassi
Saponificazione : IDROLISI DEGLI ESTERI (reazione non reversibile)
e di altri derivati acilici IN AMBIENTE BASICO
Gli esteri sono comunque meno reattivi di aldeidi e chetoni
xchè la carica positiva del C carbonilico può essere
delocalizzata sull’O (3 forme di risonanza contro 2)
ω6
ω3
ω6
Acidi grassi
inibita da alcuni
antiasmatici
x es. sulla
coagulazione
Leucotrieni
hanno un ruolo nelle
risposte allergiche e
infiammatorie
anche
gastroprotettrici
PROSTAGLANDINA H2 sintasi-1
(o prostaglandina-endoperossido sintasi)
Altri esempi di acidi carbossilici
H2=CHCO2H Acido acrilico
Alcuni acidi bicarbossilici
HO2CCO2H
Acido ossalico
HO2CCH2CO2H
Acido malonico
HO2CCH2CH2CO2H Acido succinico
TACHIPIRINA
o PARACETAMOLO
MOMENT
Nelle cellule molti
composti polifunzionali
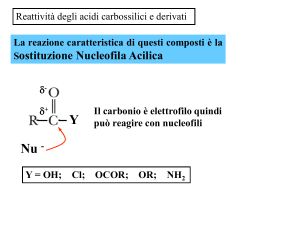
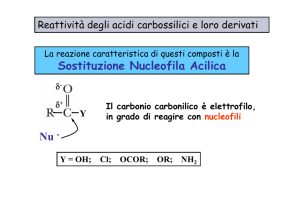
REAZIONI DI Ac. Carbossilici e derivati
REAZIONI DI SOSTITUZIONE NUCLEOFILA con
1) Attacco del nucleofilo e 2) Formazione di un intermedio tetraedrico
3) Fuoriuscita del gruppo uscente
Reazioni 1 e 3 entrambe tanto + veloci quanto + è elettronegativo
il gruppo uscente, infatti c’è maggior polarizzazione del legame
carbonilico, quindi l’attacco è + veloce, inoltre + è elettronegativo + è
stabile come gruppo uscente
REAZIONI DEI DERIVATI DEGLI AC. CARBOSSILICI CON ALCUNI NUCLEOFILI
dai + reattivi ai
Nucleofilo
meno reattivi
O
ll
R’-C-OH
HOH (idrolisi)
R’OH (alcolisi)
NH3 (ammonolisi)
O
ll
R-C-OH + HCl
O
ll
R-C-OR’ + HCl
O
ll
R-C-NH2 + NH4+Cl-
ALOG. ACILICO
O
ll
R-C-Cl
O
O
ll
ll
R-C-O-C-R’ + HCl
ANIDRIDE
O
O
ll
ll
R-C-O-C-R
O
ll
2 R-C-OH
ACIDO CARBOSSILICO
O
O O
ll
ll ll
R-C-OH
R-C-O-C-R
(solo ad alte
temperature)
O
O
ll
ll
R-C-OR’ + RCOOH
O
ll
R-C-OR’ + H2O
(catalizzata)
ESTERE
O
ll
R-C-O-R”
(catalizzata)
O
ll
R-C-OH + R”OH
(transesterificazione)
O
ll
R-C-O-O-R’ + R”OH
AMMIDE
O
ll
R-C-NH2
(assolutamente solo catalizzata)
O
ll
R-C-O-H + NH3
O
O
ll
ll
R-C-NH2 + RCOOH
sale d’ammonio
calore
O
ll
R-C-NH2 + H2O
O
ll
R-C-NH2 + R”OH
Tra i derivati acilici i + stabili sono le ammidi, infatti
•NH2 è un cattivo gruppo uscente
•Vi è delocalizzazione elettronica
Gli ioni alogenuro sono i migliori gruppi uscenti.
Lo ione dell’ac. carbossilico è una base abbastanza forte poiché l’ac.
coniugato è debole.
OH- è una base molto forte, quindi cattivo gruppo uscente.
Ancor + RO-.
Il Coenzima A (CoA)
L’allungamento degli acidi grassi avviene mediante condensazione di Claisen, tra
Esteri (possibile grazie all’acidità degli H in α), si forma un β-cheto estere
+ basica della primaria
- basica della primaria
Le ammine sono basiche e l’N delle amine è un nucleofilo
Leggermente + basiche di NH3 le alifatiche, molto – le aromatiche xchè il doppietto di e è delocalizzato
Nei sali d’ammonio quaternari
tutti e 4 gli H dello ione ammonio
sono sostituiti da gruppi organici
Ammina + Acido (attivato)
Ammide ciclica
= LATTAME
O
C
C
N
Le ammidi non sono basiche, se si
protonano, lo fanno all’O
Hanno la stessa acidità degli alcoli, grazie
alla risonanza dello ione ammidato.
Le ammine si possono ottenere per
1.
Riduzione dei nitrocomposti
R-NO2 + 3 H2 R-NH2 + 2 H2O
2.
Riduzione dei nitrili
R-CN + 2 H2 RCH2NH2
3.
Dalla reazione di un alogenuro alchilico con ammoniaca:
R-Cl + NH3 R-NH2 + HCl
Reazioni:
1.
Formano Basi di Schiff con aldeidi e chetoni
2.
Le amine primarie reagiscono con acido nitroso a dare alcoli e N2
RNH2 + HONO R-OH + N2 + H2O
Le ammine secondarie reagiscono con l’acido nitroso, HONO, per dare le N-nitroso ammine
R-N-N=O, che sono delle potenti sostanze cancerogene
R
3.
Reagiscono con acidi formando Sali d’ammonio
4.
Formano ammidi (vedi diapositive precedenti)
5.
Con i cloruri degli acidi solfonici (R-SO2H) formano sulfonammidi
sostituite (reaz. x la preparazione dei sulfamidici)
R-SO2Cl + H2N-R R-SO2NH-R + HCl
HO
HO
OH
HO
OH
HO
OH
HN
NH2
α−L-Fucosio
O
- P
O
β-D-Glucosamina
-
O
N-acetil-β-D-Glucosamina
O
O
O
-
S
O
O
O OH
O OH
HO
O OH
O OH
OH
O
HO
HO
O
OH
HO
OH
HN
OH
β-D-Glucosio 6-fosfato
O
GlcNAc6S
HO
R=
OH
OH
ZUCCHERI ACIDI
OSSIDAZIONE:
Monosaccaridi
acidi)
Sul
C1
CHO
H
C
OH
HO
C
H
H
C
OH
H
C
OH
CH2 OH
D glucoso
acidi aldonici, uronici, aldarici (zuccheri
COO
OH
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H
C
OH
CH2 OH
HO
C
H
H
C
OH
H
C
OH
Blanda
ossid.
Sul
C6
CH O
H
C
OH
HO
C
H
H
C
OH
H
C
OH
COO
OH
COO
OH
Acido D gluconico
Energica
ossid.
COO
OH
Acido D glucuronico
ACIDO D
GLUCARICO
HO
O
HO
OH
C O
OH
D-Glucono-δ-lattone
Legami estere dei derivati
acidi degli zuccheri
Gli eteropolisaccaridi hanno funzione strutturale:
nella parete batterica componente rigida costituita dalla ripetizione lineare
Mur2Ac(β14)GlcNac(β1,
+ filamenti sono legati tra loro da piccoli peptidi a formare il PEPTIDOGLICANO
nella parete delle alghe rosse c’è l’AGAR che è una miscela di eteropolisaccaridi
di D-gal e derivati dell’L-Gal con legame etere tra il C3 e il C6,
variamente sostituiti con solfato e piruvato, tra cui l’AGAROSIO
nella matrice extracellulare (degli animali)
vi sono i GLICOSAMINOGLICANI, lineari
con un acido uronico e un aminozucchero N-acet. che si ripetono,
che possono essere anche solforati
che per l’alta densità di carica negativa, hanno conformazioni estese e
conferiscono alla matrice proprietà viscose, adesive e di resistenza alla tensione
Glicosoamminoglicani (GAG o mucopolisaccaridi)
Formano una sostanza spessa, viscosa e gelatinosa che ricopre le cellule
Il + abbondante è l’acido ialuronico
Lunghe catene di unità di-saccaridiche
5 classi di GAG
– Acido ialuronico o hyaluronan
– Condroitin solfato
– Dermatan solfato
– Eparina & Eparan solfato
– Keratan solfato (non ha acido uronico ma gal)
Proteoglicani = Proteina + glicosaminoglicani
Gli zuccheri nei
GLICOCONIUCATI (proteoglicani, glicoproteine e glicolipidi)
hanno anche un ruolo informazionale
Proteoglicano = GAG + proteina
• GAG → Ser/Thr
• Segmento costante con
4 zuccheri
• Biosintesi
– Sintesi della
proteina nel reticolo
endoplasmico
ruvido
– Trasporto in Golgi
– + tetrasaccaride
– Allungamento della
catena con glicosil
trasferasi
Glicoproteine
•
Proteine + carboidrati (1-60% in peso)
– Legame covalente
– Catene polisaccaridiche ramificate con 15-20 residui
– Zuccheri in forma D
•
Funzioni:
– Proteine del plasma
• Buona solubilità per la presenza di zuccheri
• Stabili e persistenti nel plasma
– Integrali di membrana
• Recettori
• Mediatori dell’interazione fra cellule
• Processi di riconoscimento
– Residenti nel reticolo endoplasmico
• Chaperoni (aiutano le proteine a conformarsi nel modo corretto)
calnexina, lectine
– Enzimi lisosomiali: degradano le proteine
Carboidrati
Classe di molecole organiche più abbondante in natura
Vengono sintetizzati nelle piante per mezzo della fotosintesi
Dal loro catabolismo si ottiene l’energia che sostiene la vita
animale
Sono i precursori metabolici di quasi tutte le biomolecole
Si legano covalentemente con una grande varietà di molecole
( glicoproteine e glicolipidi)
Sono coinvolti nel processo di riconoscimento cellulare
In forma di polimeri servono come elementi strutturali
Quali sono le proprietà chimiche che rendono
uniche le caratteristiche dei carboidrati ?
1) L’esistenza di uno o più centri di asimmetria
2) La possibilità di assumere sia strutture lineari
che ad anello
3) La capacità di formare polimeri mediante
legami glicosidici
4) La possibilità di formare legami idrogeno con
l’acqua e altre molecole
5) La capacità di subire numerose reazioni in
differenti posizioni della molecola