LA SINCOPE: DALLA DIAGNOSI ALLA TERAPIA
Roberto A. Santilli Dr Med.Vet. D.E.C.V.I.M.-C.A. (Cardiology)
Clinica Veterinaria Malpensa
Viale Marconi, 27
21017 – Samarate – Varese –
Tel. 0331-228155 (ext 3)
Fax. 0331-220255
e-mail: [email protected]
Introduzione
La sincope è un sintomo definito clinicamente come perdita della coscienza transitoria e a fine spontanea, che in genere
causa caduta. Il meccanismo fisiopatologico della sincope è un’ipoperfusione cerebrale globale transitoria. In alcuni
casi la sincope presenta dei prodromi (nausea, vomito, sudorazione, debolezza, ma nella maggior parte dei casi insorge
in modo improvviso senza segni premonitori. La durata dell’episodio sincopale è solitamente inferiore a 20 secondi, con
una fase di recupero solitamente pronta e completa. Per pre-sincope o lipotimia s’intende una condizione nella quale il
paziente avverte l’incombenza di una perdita di coscienza. La lipotimia è caratterizzata in alcuni casi da sintomi poco
specifici quali vertigini e nausea, in altri durante l’episodio può comparire atassia, con decubito sternale o laterale e
coscienza conservata. In quest’ultimo caso si preferisce parlare di debolezza periodica.
Durante la sincope, l’alterazione dello stato di coscienza provoca spesso perdita del tono posturale, altre volte induce
spasmi localizzati o generalizzati con perdita del controllo degli sfinteri. La seconda evenienza descritta può indurre il
clinico a confondere un attacco sincopale con una forma primariamente epilettica
Fisiopatologia
La sincope è causata da una riduzione transitoria e repentina della consegna d’ossigeno al cervello. Tale consegna è
regolata dal flusso cerebrale, dalla tensione parziale arteriosa d’ossigeno e dalla concentrazione d’emoglobina. L’ipossia
per indurre una perdita dello stato di coscienza deve diminuire improvvisamente sotto i 20-30 mmhg con ovvia cianosi.
La più frequente causa di perdita della coscienza è la riduzione del flusso cerebrale per una caduta della pressione
arteriosa o una brusca variazione della portata cardiaca, con cessazione improvvisa del flusso cerebrale per almeno 6-8
secondi. Il flusso cerebrale medio è di circa 50-60 ml/100 g di tessuto cerebrale al minuto pari a circa il 12-15 % della
portata cardiaca. Nei soggetti anziani o nei pazienti con sottostante patologia cardiaca tale flusso risulta compromesso
con facile insorgenza d’episodi sincopali. Riduzioni delle resistenze periferiche e del ritorno venoso con discesa
improvvisa della pressione sistolica sotto i 60 mmhg e un calo dell’apporto cerebrale d’ossigeno del 20 % inducono le
sincopi disautonomiche e neuromediate. Alla base delle sincopi cardiache vanno ricercati invece tutti i fattori che
riducono la gittata cardiaca quali: bradiaritmie, tachiaritmie, cardiopatie ostruttive, malattie valvolari, malattie
pericardiche con tamponamento cardiaco, embolia ed ipertensione polmonare, infarto miocardico acuto.
Classificazione
- Sindrome sincopale riflessa neuromediata: è causata da un riflesso che, quando innescato, dà luogo a vasodilatazione e
bradicardia, di entità e rapporto variabile, con riduzione del flusso cerebrale. In questo gruppo sono incluse la sincope
vasovagale, la seno-carotidea, le situazionali (emorragia acuta, tosse, starnuto, deglutizione, defecazione, dolore
viscerale, la post-minzionale e la post-esercizio). La più comune sincope neuromediata del cane è la situazionale da
tosse. Per questo tipo di sincope due ipotesi sulla fisiopatologia sono state formulate. Secondo la prima l’aumento della
pressione intra-addominale ed intra-toracica aumenta la pressione venosa centrale e conseguentemente intracranica con
ipoperfusione cerebrale. La seconda teoria riferisce che la tosse risulta in una trasmissione attraverso le fibre afferenti
del vago al centro vasomotore con successiva vasodilatazione e bradicardia.
- Sincope ortostatica: si verifica quando il sistema nervoso autonomo non è in grado di attivare i meccanismi
vasocostrittori efficienti con ipotensione ortostatica ed ipovolemia. Esisto diverse forme disautonomiche con
insufficienza neurovegetativa primaria e secondaria (insufficienza renale cronica, diabete, ipotiroidismo). Tra le forme
legate principalmente all’ipovolemia vengono incluse l’emorragia, la diarrea e l’ipoadrenocorticismo. Una particolare
forma di sincope ortostatica è la post-prandiale. Nel cane in terapia cronica con Ace-inibitori e diuretici sono molto
frequenti le intolleranze ortostatiche.
Sincopi aritmiche: In questo gruppo rientrano tutti i disturbi del ritmo che possono indurre una calo improvviso della
gittata cardiaca. Tra le più comuni le disfunzioni sinusali, i disturbi della conduzione atrioventricolare, le tachicardie
parossistiche sopraventricolari o ventricolari con frequenze di scarica superiori a 300 bpm, le sindromi ereditarie come
il QT lungo e la sindrome di Brugada. Nelle disfunzioni del nodo del seno e nei blocchi di terzo grado l’evenienza
morte improvvisa è rara, mentre nelle forme aritmiche ventricolari in particolar modo se associate a disfunzioni
sistoliche (cardiomiopatia dilatativa dei Dobermann), la morte improvvisa risulta frequente.
Sincopi da cardiopatia strutturali: anche in questo caso la causa della perdita della coscienza va ricercata in una brusca
riduzione della portata cardiaca causata da cardiopatie valvolari o ostruttive, infarto miocardico acuto, malattie
pericardiche con tamponamento cardiaco, ipertensione ed embolismo polmonare.
Nel cane la stenosi subaortica è la più comune causa di sincopi cardiache strutturali. In questo gruppo di pazienti
durante l’esercizio la stimolazione dei meccanocettori ventricolari induce uno stimolo vagale con vasodilatazione e
bradicardia e sincope (riflesso di Bezold-Jarish). Tale riflesso insieme all’ipossia sono causa di sincope nei pazienti con
tetralogia di Fallot. L’ipertensione polmonare e l’embolismo polmonare possono indurre sincope in special modo
durante l’esercizio per una riduzione della portata polmonare e quindi sistemica e l’ipossia. Anche la cardiomiopatia
ipertrofica ostruttiva può indurre sincope per l’attivazione del riflesso di Bezold-Jarish. Rare cause di sincopi cardiache
strutturali sono ostruzioni al flusso per la presenza di trombi o tumori endoluminale.
Diagnosi
La valutazione iniziale, con intervista dei testimoni dell’evento sincopale, spesso riesce ad identificare la causa della
sincope e deciderne l’eventuale malignità. La parte più importante è differenziare un evento sincopale da uno epilettico.
Il momento in cui avviene l’evento riveste particolare importanza: gli attacchi a riposo e supini e quelli durante lo
sforzo indirizzano verso una sincope aritmica o cardio-strutturale, l’associazione con tosse o minzione verso le forme
vasovagali situazionali, l’occorrenza al passaggio dalla posizione seduta a quella in piedi le forme ortostatiche. Le
forme epilettiche durano più a lungo, sono preceduta dall’aura e seguite da uno stato confusionale post-attacco di circa 5
minuti, c’e morsicatura della lingua che appare classicamente cianotica, è spesso presente per attivazione sistema
autonomo salivazione, urinazione, defecazione e vocalizzazioni, gli attacchi tonico-clonici sono prolungati (> 15
minuti) e compaiono al momento della perdita di coscienza. Le forme sincopali durano meno di 20 secondi, non sono
precedute da aura, la ripresa è rapida e pronta, solitamente se sono presenti attacchi tonico-clonici seguono di alcuni
secondi la perdita di coscienza, la lingua appare pallida, è possibile avere perdita del controllo degli sfinteri.
Alla visita clinica deve seguire la misurazione della pressione arteriosa con la metodica Doppler in clino- ed
ortostatismo per valutare le intolleranze ortostatiche caratterizzate da una caduta della pressione sistolica al passaggio in
ortostatismo sotto i 90 mmHg o con una differenza di almeno 20 mmHg da una postura all’altra. L’elettrocardiogramma
di base raramente può mostrare aritmie responsabili della sincope: disfunzioni sinusali, blocchi atrioventricolari, blocchi
di branca sinistri completi, tachicardie sopraventricolari o ventricolari. Nella maggior parte dei casi, se si sospetta una
sincope aritmica, è consigliabile usare, per il più alto valore diagnostico, il monitoraggio Holter, il registratore
d’evento2-3 o il registratore impiantabile. Coon questi monitoraggi spesso è possibile cogliere l’evento sincopale e
confermare o escludere la causa aritmica. Per quanto riguarda il monitoraggio dinamico secondo la metodica Holter
occorre tener presente l’enorme variabilità giornaliera del ritmo cardiaco del cane. In condizioni normali è possibile
trovare variazioni della frequenza cardiaca da 20-30 bpm fino a 300 bpm durante l’eccitazione o l’esercizio, pause
sinusali fino a 5,7 secondi in assenza di disfunzioni sinusali, blocchi atrioventricolari di 2 grado e ectopie ventricolari
premature non organizzate. I nuovi registratori permettono inoltre di valutare, con l’elettrocardiogramma ad alta
risoluzione, la presenza di potenziali tardivi ventricolari, indici della possibile occorrenza di aritmie ventricolari fatali.
Da ultimo è sempre consigliabile eseguire un’ecocardiografia al fine di escludere deficit contrattili, malattie del
pericardio o valvolari, miocardiopatie ostruttive ed ipertensioni polmonari che solitamente peggiorano la prognosi della
sincope per l’alto rischio di aritmie fatali.
In casi selezionati sono indicate prove farmacologiche, rispettivamente con isoproterenolo, atropina e/o adenosina, per
svelare aritmie ventricolari catecolaminergiche, disfunzioni sinusali o blocchi atrioventricolari parossistici.
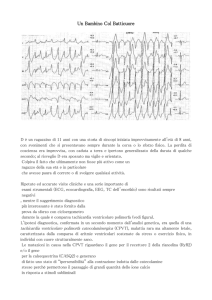
L’elettrocardiogramma di superficie
Un tracciato elettrocardiografico viene sempre effettuato su carta millimetrata al fine di ottenere misurazioni precise.
Dovendo effettuare le misurazioni di una qualsiasi onda elettrocardiografica dobbiamo prendere in considerazione:
- DURATA dell’onda elettrocardiografica
- AMPIEZZA dell’onda elettrocardiografica
La durata di un’onda elettrocardiografica viene misurata in millisecondi. La velocità di scorrimento della carta
millimetrata normalmente in uso in medicina veterinaria è di 50 millimetri al secondo. Ne deriva che la misurazione di
1 millimetro di carta millimetrata corrisponde ad una durata di 20 millisecondi. Quindi, ad esempio, un’onda che
occupa 4 millimetri avrà una durata di 80 millisecondi. Nel caso in cui la velocità di scorrimento sia 25 millimetri al
secondo, 1 millimetro di carta millimetrata corrisponderà a 40 millisecondi.
L’ampiezza di un’onda elettrocardiografica viene misurata in millivolt (mV). Di norma gli apparecchi
elettrocardiografici vengono tarati in modo che 1 centimetro corrisponda a 2 mV. Di conseguenza se , ad esempio,
un’onda R misura 0,8 millimetri avrà un’ampiezza 1,6 millivolt. In alcune condizioni particolari è possibile registrare
un tracciato elettrocardiografico con taratura 1 millivolt per centimetro oppure 0,5 millivolt per centimetro. In questi
casi, se ad esempio un’onda R presenta una misurazione di 1,2 millimetri, il valore in millivolt sarà rispettivamente 1,2
millivolt e 0,6 millivolt.
Modalità di misurazione della frequenza cardiaca
Effettuare la valutazione della frequenza cardiaca è molto semplice.
Il metodo più rapido consiste nell’effettuare la conta del numero di complessi QRS esistenti in uno spazio di 15
centimetri che corrisponde a 3 secondi nel caso la velocità di scorrimento della carta sia 50 mm/sec e a 6 secondi nel
caso sia 25 mm/sec. Il numero di complessi QRS sarà moltiplicato per 20 nel primo caso e per 10 nel secondo. Il
risultato finale saranno il numero di battiti per minuto (bpm) unità di misura della frequenza cardiaca.
L’ONDA P
L’onda P rappresenta la depolarizzazione atriale. Essa è la rappresentazione elettrocardiografica di un vettore che ha
come punto di origine il nodo del seno e come direzione inferiore ed a sinistra, prima anteriormente e successivamente
posteriormente. Ne deriva che la prima porzione ad essere depolarizzata è l’atrio destro alto, seguito dall’atrio destro
basso e dall’atrio sinistro. Quindi, l’onda atriale destra inizia prima e solo successivamente si sovrappone l’onda atriale
sinistra.
La morfologia e l’ampiezza dell’onda P è molto più variabile nei cani che in altre specie di animali. Questa variabilità
risulta generalmente più pronunciata nelle derivazioni degli arti che nelle derivazioni toraciche (rV2 ,V2 ,V4 , V10) in
cui può essere minima o assente.
INTERVALLO PQ
L’intervallo PQ è definito come il segmento esistente fra l’inizio dell’onda P e l’inizio del complesso QRS.
Durante l’intervallo PQ avviene dunque la depolarizzazione atriale, la ripolarizzazione atriale ed il passaggio
dell’impulso elettrico attraverso il nodo atrioventricolare per arrivare al fascio di His.
Il tessuto atriale risulta elettricamente isolato dal miocardio ventricolare dall’anello fibroso formato dagli scheletri di
supporto delle valvole atrioventricolari (mitrale e tricuspide) e della valvola aortica.
Ne consegue che, in condizioni di normalità, l’impulso elettrico può transitare dagli atri ai ventricoli solamente
attraverso il nodo atrioventricolare ed il fascio di His.
IL COMPLESSO QRS
Il complesso QRS rappresenta la fase di depolarizzazione delle fibre ventricolari.
La prima porzione ventricolare ad essere depolarizzata è il setto con direzione sinistra-destra. Segue la depolarizzazione
simultanea delle pareti libere sinistra e destra dall’endocardio in direzione epicardica.
Nomenclatura
ONDA Q: prima deflessione negativa
ONDA R: prima deflessione positiva, può essere preceduta da un’onda Q
ONDA S: prima deflessione negativa che segue un’onda R
ONDA R’: prima onda positiva che segue un’onda R
La presenza e la relativa ampiezza delle diverse possibili componenti del complesso QRS possono essere espresse,
secondo convenzione, con le lettere q, r, s ,Q ,R ,S. Le deflessioni ampie (R>1 mV, Q, S>0,5 mV) sono indicate con la
lettere maiuscola. Le deflessioni ridotte (r<1 mV, q,s <0,5 mV) sono contrassegnate dalle lettere minuscole. I complessi
interamente negativi vengono indicati come qs o QS.
SEGMENTO ST
Nel cane, il segmento ST è nella maggior parte dei casi orizzontale e l’inizio dell’onda T è spesso impercettibile. Ad
eccezione delle derivazioni rV2 e V10, la polarità dell’onda T può essere indifferentemente positiva o negativa.
Deviazioni del segmento ST o della giunzione ST sono comuni in particolar modo nelle derivazioni D II, aVF, V2, V4.
Spesso può accadere che la deviazione del segmento ST rimanga tale nello stesso tracciato elettrocardiografico, ma vari
notevolmente in diversi tracciati elettrocardiografici dello stesso soggetto. Il grado di deviazione del segmento ST varia,
inoltre, in dipendenza delle variazioni degli intervalli R-R dovuti ad una aritmia sinusale respiratoria. In particolare, il
grado di deviazione del segmento ST aumenta quando preceduto da intervalli R-R brevi.
Sul piano elettrofisiologico, il segmento ST riflette la fase 2 o di plateau del potenziale d’azione. In questa fase il
potenziale d’azione si mantiene agli stessi livelli in tutti i miociti ventricolari, non evidenziando di conseguenza alcuna
deflessione a livello di tracciato elettrocardiografico.
L’onda T, invece, riflette i gradienti di voltaggio creati durante la fase di ripolarizzazione rapida (fase 3) quando le
cellule ventricolari si ripolarizzano sequenzialmente.
congenite o di natura ischemica e di patologie polmonari. Nel cane, un’ampiezza dell’onda U superiore a 0,05 mV è
stata associata ad ipertensione. In ogni caso, valori dell’onda U compreso fra 0,08 e 0,15 mV possono essere riscontrati
anche in cani del tutto normali.
IL RITMO SINUSALE
Nel cuore di cane denervato, il nodo del seno ha una frequenza di scarica regolare ad un ritmo intrinseco di 90-120
battiti al minuto. La sola parasimpatectomia risulta in un ritmo persistente con frequenza di 140-160 battiti al minuto.
Un cane adulto a riposo in condizioni cardiache nella norma, la frequenza cardiaca va da 70 a 120 battiti al minuto. In
condizioni di esercizio fisico, il ritmo cardiaci assume frequenza di 220-325 battiti al minuto. Nei neonati e nei cuccioli,
la frequenza cardiaca deve rispettare il range di 140-275 battiti al minuto. Durante la registrazione di un tracciato
elettrocardiografico la frequenza cardiaca tende ad presentare valori superiori rispetto al momento in cui l’animale si
trova a riposo presso il suo domicilio.
Per definire il ritmo di un tracciato elettrocardiografico come ritmo sinusale, deve aderire ai seguenti principi:
• ogni onda P deve essere seguita da un complesso QRS
• ogni complesso QRS deve essere preceduto dall’onda P
• l’intervallo PR deve essere di durata normale e costante
• la morfologia dell’onda P e del complesso QRS deve essere corretta (positiva in DII)
• la frequenza di scarica del nodo del seno deve essere corretta
• la regolarità di scarica del nodo del seno deve essere corretta (variazioni degli intervalli RR minori del 10%)
MISURE ELETTROCARDIOGRAFICHE
VALORI NORMALI NEL CANE
FREQUENZA CARDIACA : 70-160 bpm cani adulti
10-180 bpm razze Toy
70-220 bpm cuccioli
ONDA P: ampiezza < 0,4 mV
durata < 40 msec
ONDA R: ampiezza < 3mV
INTERVALLO PQ: durata 60-140 msec
COMPLESSO QRS: durata 30-70 msec
INTERVALLO QT: durata 150-230 msec
ASSE ELETTRICO MEDIO DEL COMPLESSO QRS NEL PAINO FRONTALE: -20° / +110°
BRADIARITMIE
BRADICARDIA SINUSALE
E’ comunemente indicato con questo termine un ritmo originante da nodo del seno nei casi in cui la frequenza di scarica
risulta inferiore ai limiti della norma, cioè 70 bpm nei cani adulti, 60 bpm nelle razze giganti, 160 bpm nei gatti. La
bradicardia sinusale può costituire un reperto comune in soggetti particolarmente allenati e può manifestarsi per
stimolazione riflessa del vago. Dal punto di vista elettrocardiografico, si nota la presenza di onde P normali per
morfologia durata, ampiezza, intervalli PR e complessi QRS normali. La sola alterazione elettrocardiografia risiede in
una diminuzione della frequenza di scarica del nodo SA.
ARITMIA SINUSALE (respiratoria, non respiratoria)
L’aritmia sinusale respiratoria è un ritmo cardiaco che viene spesso ritrovato nei cani ed è considerato un reperto
auscultatorio ed elettrocardiografico normale. I criteri elettrocardiografici che consentono di emettere diagnosi di
aritmia sinusale sono tutte le caratteristiche che contraddistinguono un ritmo sinusale normale con una variabilità
dell’intervallo PP maggiore del 10% . Il ritmo è regolarmente irregolare e solitamente gli incrementi ed i decrementi
della frequenza cardiaca sono correlati alle fasi della respirazione. Durante l’inspirazione si nota infatti un aumento
della frequenza di scarica del nodo SA, mentre durante l’espirazione la frequenza cardiaca diminuisce; questo perché
aumentano rispettivamente il tono simpatico e parasimpatico nelle due fasi della respirazione. Le pause sinusali che
sono presenti nella fase espiratoria durano meno del doppio del normale intervallo PP. Al contrario, l’arresto sinusale è
elettrocardiograficamente caratterizzato da una pausa sinusale la cui durata è uguale o maggiore del doppio della durata
di un normale intervallo PP. I due ritmi non si escludono totalmente. Infatti, entrambi sono legati ad un aumento del
tono vagale. La regolare fluttuazione della frequenza cardiaca in corso di aritmia sinusale riflette le variazioni del tono
parasimpatico sul nodo SA e sul nodo AV e la somministrazione di farmaci simpaticolitici annulla l’ irregolarità di
frequenza di scarica. Durante le fasi respiratorie, i barorecettori, i chemorecettori intratoracici ed
i recettori di
stiramento polmonari inviano segnali afferenti che modulano il tono vagale. L’aritmia sinusale respiratoria risulta
particolarmente pronunciata nelle razze brachicefale. Infatti, le difficoltà respiratorie di questi cani accentuano l’aritmia
sinusale respiratoria attraverso un meccanismo di stimolazione vagale che origina dalla regione faringea. La terapia di
questa aritmia non è mai indicata tranne nei casi in cui gli arresti sinusali sono particolarmente prolungati ed esitano in
episodi sincopali per scompenso emodinamico.
L’aritmia sinusale non respiratoria è caratterizzata da variazioni del ciclo sinusale indipendenti dalle fasi del respiro.
Può essere dovuta a malattia del nodo del seno o ad intossicazioni farmacologiche (es. digitale).
SINDROME DEL SENO MALATO (SSS)
(bradicardia sinusale inappropriata o incompetenza cronotropica- blocco senoatriale-arresto sinusale-sindrome
bradicardia/tachicardia)
La sindrome del seno malato insorge quando sono presenti alterazioni non fisiologiche del ritmo sinusale. La SSS
comprende sia alterazioni dell’automaticità che della conduzione a livello di nodo SA. Questa sindrome si manifesta
con maggior incidenza nelle razze di piccola taglia, in particolare in cani di razza schnauzer nano, cocker americano,
Westhighland white terrier, carlino e bassotto. Percentualmente risultano più colpiti i soggetti di sesso femminile.
Elettrocardiograficamente, la SSS si evidenzia con la presenza di alcuni o tutti i caratteri seguenti: bradicardia sinusale
inappropriata, pause sinusali (che rappresentano un’alterata automaticità oppure un blocco del nodo del seno), periodi in
cui si alternano una bradiaritmia sinusale ed una tachicardia non sinusale. Questa caratteristica può presentarsi come
una bradicardia seguita da una tachicardia da scappamento (sindrome bradicardia-tachicardia) oppure come una
tachiaritmia che, dopo il suo termine, è seguita da una lunga pausa (sindrome tachicardia-bradicardia). A causa della
concomitante disfunzione di altri segmenti del sistema di conduzione, possono coesistere in associazione alla SSS:
fibrillazione atriale, flutter atriale o disordini della conduzione atrioventricolare. La fibrillazione atriale può
rappresentare un meccanismo di scappamento a pause sinusali eccessivamente prolungate. Il riconoscimento di tale
meccanismo è estremamente importante in quanto nel momento in cui viene corretta elettricamente o
farmacologicamente la fibrillazione atriale, potrebbe emergere una bradiaritmia marcatissima o una asistolia.
Solitamente, in corso di SSS anche l’automaticità del nodo AV è depressa, quindi il ritmo di scappamento risulta più
lento di quanto ci si possa aspettare.
La bradicardia sinusale può essere relativa od assoluta. Si definisce assoluta quando è sempre presente, mentre viene
detta relativa nei casi in cui la frequenza di scarica del nodo del seno non si adatta alle esigenze contingenti (stress,
esercizio fisico). In questo caso, più frequente del primo, si parla di incompetenza cronotropica del nodo SA.
Durante il ritmo sinusale, possono evidenziarsi pause di arresto sinusale o blocco sinusale. In caso di arresto sinusale,
un disordine dell’automaticità, si riconoscono pause che non sono multipli del ciclo cardiaco di base. Questo caso si
differenzia dal blocco sinusale, un disordine della conduzione, in cui l’impulso generato dal nodo del seno non riesce a
propagarsi all’interno del miocardio atriale o riesce ma con una velocità di conduzione estremamente bassa.
Sintomatologia. In caso di bradicardia spinta o pause eccessivamente prolungate, l’apporto sanguigno a livello
muscolare e soprattutto cerebrale risulta ridotto. Ne consegue che i soggetti affetti da SSS presentano una
sintomatologia (episodi sincopali) la cui frequenza e gravità dipende dalla gittata cardiaca e dalle resistenze periferiche.
In caso di SSS con incompetenza cronotropica, la sintomatologia si manifesta con intolleranza allo sforzo ed intensa
dispnea.
Eziologia. I disordini di automaticità e di conduzione del nodo del seno possono essere conseguenti a ipotermia, gravi
squilibri elettrolitici, ischemia o depressione farmacologica, amiloidosi, neoplasie, emocromatosi, miocarditi o
pericarditi.
Diagnosi. La terapia viene solitamente attuata solamente in pazienti sintomatici. Appare quindi di fondamentale
importanza stabilire una precisa correlazione fra sintomatologia ed aritmia. Poiché i sintomi si presentano intermittenti e
di breve durata, l’ECG di superficie non rappresenta una metodica adeguata per la diagnosi della SSS. Nei casi in cui si
sospetta una SSS è quindi consigliata l’esecuzione di un monitoraggio elettrocardiografico secondo la metodica di
Holter oppure di un R-test. Inoltre, l’esecuzione di uno studio elettrofisiologico può fornire preziose indicazione
riguardanti l’automaticità, la conduzioni ed i periodi refrattari.
Terapia. La terapia della SSS si basa sulla sintomatologia. Solitamente, i pazienti completamente asintomatici non
richiedono alcun intervento terapeutico. Nel caso in cui il grado di bradicardia o la durata delle pause sono così gravi da
causare sintomi oppure il paziente risulta a rischio di ritmi di scappamento che possono portare a morte improvvisa si
attua la terapia. Un’indicazione accettabile per l’impianto di un pacemaker è, per esempio, la presenza di pause
maggiori di 3 secondi.
La qualità di vita del paziente risulta notevolmente migliorata dopo l’impianto di un pacemaker.
L’applicazione di un pacemaker tipo VVIR (rate responsive) rappresenta la scelta di elezione nella terapia della SSS.
SILENZIO ATRIALE PERSISTENTE
Il silenzio atriale persistente è una condizione rara riconosciuta nei cani di razza English Sprinter Spaniels e nei gatti di
razza siamese. Clinicamente questi soggetti si presentano con debolezza e dispnea.
Elettrocardiograficamente il
silenzio atriale persistente è caratterizzato da una frequenza cardiaca inferiore ai limiti della norma (60 bpm nel cane,
160 bpm nel gatto), ritmo solitamente regolare, assenza completa di onde P, complessi QRS con normale morfologia,
non si evidenzia aumento della frequenza cardiaca o presenza di onde P dopo somministrazione di atropina. In questi
soggetti gli atri risultano molto aumentati di volume. Gli esami istologici rivelano la presenza di tessuto fibroso,
fibroeleastico, o steatosico a livello di parete atriale e di setto interventricolare. Spesso tale patologia è associata a
patologie muscolari o neuromuscolari. La terapia d’elezione in soggetti affetti da silenzio atriale persistente è l’impianto
di un pacemaker.
RITMO SENOVENTRICOLARE DA IPERPOTASSIEMIA
L’aumento dei livelli serici di potassio causa bradicardie che possono andare da una bradicardia sinusale (6-8 mEq/L di
K+) fino ad un ritmo senoventricolare (7-8 mEq/L di K+). Elettrocardiograficamente, il ritmo senoventricolare ha
caratteristiche sovrapponibili al silenzio atriale persistente. In corso d’iperpotassiemia, il ritmo origina a livello del nodo
SA, ma l’impulso si propaga fino al nodo AV attraverso vie specializzate (approcci), senza che avvenga la
depolarizzazione del miocardio atriale.
BLOCCHI ATRIO-VENTRICOLARI
Per blocco AV s’intende un rallentamento od un’interruzione della conduzione degli impulsi elettrici dagli atri ai
ventricoli. Secondo le caratteristiche elettrocardiografiche, i blocchi AV sono comunemente distinti in:
BLOCCO AV DI 1° GRADO
BLOCCO AV DI 2° GRADO che a sua volta comprende:
Tipo Wenckebach
Tipo Mobitz
Tipo 2:1 fisso
Tipo avanzato
BLOCCO AV DI 3° GRADO
Questo tipo di classificazione, però, non fornisce indicazioni sulla sede del blocco, né sulla gravità. Tali elementi
possono essere valutati correttamente solo in seguito all’elettrocardiografia intracavitaria.
Eziologia. A seconda del fattore eziologico, i blocchi AV possono essere distinti in congeniti o acquisiti. Il blocco
congenito può essere di grado e gravità variabile, nella maggioranza dei casi associato a malformazioni cardiache come,
ad esempio, la trasposizione corretta dei grandi vasi, il difetto interventricolare, il difetto interatriale, la malattia di
Ebstein.
I blocchi acquisiti riconoscono molti fattori causali. La causa che più frequentemente dà origine a blocchi AV consiste
nella degenerazione primaria del tessuto di conduzione. Fattori causali meno frequenti sono: la cardiopatia ischemica, il
diabete mellito e la somministrazione di alcuni farmaci che agiscono a livello nodale fra cui la digitale, il verapamil, il
diltiazem, l’amiodarone, i beta-bloccanti, i chinidino-simili. Tali farmaci evidenziano turbe del sistema conduttivo
preesistenti.
Il blocco AV, indipendentemente dal grado, può essere intermittente o permanente, a seconda dell’evoluzione instabile
o fisso ed infine sintomatico o asintomatico.
1) BLOCCO AV DI 1° GRADO
Il blocco AV di 1° è caratterizzato da un ritardo di conduzione fra atri e ventricoli.
Aspetti clinici. Il blocco AV di 1° è asintomatico. In assenza di altre patologie cardiache, l’unico reperto auscultatorio è
rappresentato da una leggera riduzione di intensità del primo tono.
Elettrocardiogramma. L’ECG mostra onde P e complessi QRS di morfologia normale ed un intervallo PR prolungato,
cioè di durata superiore a 140 ms. Nel caso in cui la frequenza cardiaca sia notevolmente aumentata, l’onda P si può
sovrapporre alla precedente onda T. La durata dell’intervallo PR è prolungata, ma solitamente si mantiene costante,
tranne rari casi in cui presenta modificazioni correlate alla durata dei cicli cardiaci essendo inversamente correlata al
ciclo RR precedente (fluttuazioni dell’intervallo PR). Variazioni regolari od irregolari del ciclo PR possono inoltre
verificarsi in seguito a modificazioni del tono vagale, della postura, ad esercizio fisico, alla somministrazione di
atropina. Nei soggetti in cui il blocco AV complica una patologia cardiaca preesistente, esso di solito è stabile ed ha la
tendenza alla progressione verso gradi di maggior gravità.
2) BLOCCO AV DI 2° GRADO
Il blocco AV di 2° rappresenta un disturbo intermittente della conduzione atrioventricolare in seguito al quale non tutti
gli impulsi elettrici sopraventricolari riescono ad arrivare ai ventricoli.
Aspetti clinici. Il blocco AV tipo Wenckebach è solitamente asintomatico. Il blocco AV di grado avanzato può invece
causare episodi sincopali o d’intolleranza allo sforzo. Nei pazienti con blocco instabile, gli episodi sincopali si
sviluppano ogniqualvolta il blocco diventa completo. All’auscultazione, nel blocco tipo Wenckebach si rileva un
progressivo accorciamento del ciclo cardiaco fino alla comparsa di una pausa, con riduzione progressiva dell’intensità
del primo tono per l’allungamento del PR, mentre nel blocco tipo Mobitz si rileva una bradicardia ritmica.
Elettrocardiogramma. Il blocco AV di 2° può manifestarsi secondo due forme distinte con differenti aspetti
elettrocardiografici: a) tipo Wenckebach b) tipo Mobitz
Blocco AV di 2° grado tipo Wenckebach. Tale blocco, di origine nodale, è caratterizzato da un progressivo
allungamento dell’intervallo PR fino a quando un’onda P non è seguita da un complesso QRS. L’intervallo PR che
segue il complesso non sinusale, si presenta relativamente breve. Gli intervalli PR si allungano sempre meno per cui la
durata degli intervalli RR diminuisce progressivamente. L’intervallo RR corrispondente all’onda P non condotta è
appena inferiore al doppio dell’intervallo RR più breve. L’entità del blocco viene espressa dal rapporto esistente fra il
numero delle onde P ed il numero dei complessi QRS esistenti (es. 2:1, 3:2).
La morfologia dei complessi QRS è normale, solo molto raramente si possono registrare fenomeni di aberranza. Il
fenomeno di Wenckebach alternante si verifica quando il progressivo allungamento dell’intervallo PR è seguito da due
o più onde P non condotte ai ventricoli.
Blocco AV di 2° tipo Mobitz. Meno frequente del precedente, è costituito da un blocco intermittente secondo il quale
l’impulso atriale non è trasmesso ai ventricoli senza modificazioni della durata dell’intervallo PR.
Blocco AV di 2° grado tipo 2:1 fisso. In questo caso, una stimolazione atriale ogni due non viene trasmessa a livello
ventricolare. All’ECG di superficie, alternativamente un’onda P è seguita da un complesso QRS mentre la successiva è
bloccata.
Blocco AV avanzato. È caratterizzato da una trasmissione dell’impulso atriale ai ventricoli solo saltuaria con rapporti di
3:1, 4:1 o superiori .
3) BLOCCO AV DI 3° GRADO
Nel blocco AV di 3° grado nessun impulso atriale riesce ad attivare i ventricoli, che, eccitati da un pacemaker
autonomo, si contraggono in maniera del tutto indipendente dagli atri.
Aspetti clinici. Quasi sempre, in caso di blocco AV di 3° grado è presente una sintomatologia, che può essere differente
da soggetto a soggetto. Spesso si rilevano episodi sincopali, episodi di cedimento degli arti posteriori, intolleranza
all’esercizio fisico. Il reperto principale risulta comunque costituito da una bradicardia ritmica con frequenza cardiaca di
30-40 bpm. All’auscultazione si può rilevare un primo tono d’intensità variabile con rinforzi periodici detti “colpi di
cannone”. Si possono inoltre ritrovare uno sdoppiamento del secondo tono per la ritardata attivazione di uno dei
ventricoli, la presenza di toni atriali deboli, un aumento dell’intensità del terzo tono.
Elettrocardiogramma. L’ECG evidenzia una completa interruzione della conduzione atrioventricolare per cui non esiste
alcuna correlazione fra le onde P ed i complessi QRS (dissociazione atrioventricolare). Alcune volte, a causa di
un’aritmia sinusale ventricolofasica, gli intervalli PP che contengono un complessi QRS hanno durata minore degli
intervalli PP che non contengono un complesso QRS.
La prematurità dell’onda P che segue un complesso QRS è attribuita alla stimolazione dei barorecettori esercitata dalla
contrazione ventricolare che causa riduzione del tono vagale con conseguente aumento della frequenza di scarica del
pacemaker del nodo del seno (effetto cronotropo positivo). Altri Autori ritengono che tale reperto sia più probabilmente
attribuibile ad una migliorata per fusione coronarica in seguito alla sistole ventricolare. Talvolta possono essere presenti
extrasistoli atriali temporalmente correlate ai complessi QRS (extrasistoli atriali ventricolofasiche). La frequenza
ventricolare si presenta solitamente regolare e dipende dalla frequenza di scarica del pacemaker sussidiario. Se tale
pacemaker è situato nel nodo AV ha una frequenza di scarica di 45-55 bpm, se invece risulta situato più distalmente ha
una frequenza di 40 bpm. L’attività del segnapassi è, infatti, tanto più lenta quanto più questo è posto distalmente
rispetto al nodo del seno. In alcuni casi, il pacemaker sussidiario ventricolare subisce un periodo d’arresto. Ciò è dovuto
al meccanismo detto “overdrive suppression” secondo il quale quando le fibre del Purkinje hanno una frequenza di
scarica superiore alla norma per un determinato periodo, poi subiscono un blocco. Tale meccanismo è su base ionica.
Infatti, quando aumenta la corrente in entrata dello ione sodio, viene stimolata la pompa sodio-potassio. Questa pompa
trasporta 2 ioni potassio all’interno della cellula, per 3 ioni sodio che estromette. In tale modo si crea
un’iperpolarizzazione della membrana cellulare. Quindi, le fibre del Purkinje richiedono un tempo maggiore per
sviluppare la loro automaticità (solitamente 5-30 secondi). Questo fenomeno si può verificare anche in caso di blocco
AV completo intermittente. L’overdrive suppression è un meccanismo fisiologico di protezione che, in un cuore sano,
sopprime tutti i pacemaker che non siano il nodo SA e che potrebbero diventare dominanti. Talvolta gli impulsi
ventricolari riescono a catturare gli atri per via retrograda (blocco unidirezionale anterogrado). In medicina veterinaria
sono descritti casi di blocco AV di 3° acquisiti permanenti dovuti a traumi toracici non penetranti. La diagnosi e la
terapia di questi casi sono sovrapponibili ai blocchi AV completi congeniti.
ARITMIE IPERCINETICHE
A) TACHICARDIE A QRS STRETTI
Se l’attivazione ventricolare è normale (complessi QRS < 70 ms), la tachicardia è per la maggior parte delle volte
SOPRAVENTRICOLARE e la diagnosi differenziale si basa sul meccanismo che sta alla base dell’aritmia.
Per individuare tale meccanismo risulta essenziale la valutazione degli intervalli R-R ed il rapporto fra onda P e
complesso QRS. A questo proposito si possono distinguere 4 casi:
Gli atri e di ventricoli sono depolarizzanti contemporaneamente (in direzioni opposte ed a partire dal nodo AV). In
questo caso le P invertite sono nascoste dal complesso QRS;
Gli atri sono depolarizzanti dopo i ventricoli. Le onde PI negative sono evidenti e seguono il complesso QRS.
All’interno di questa categoria è possibile fare un’ulteriore distinzione: l’intervallo R-PI è definito breve quando
l’intervallo R-PI è minore del 50 % dell’intervallo RR che lo comprende, è definito lungo quando l’intervallo R-PI è
maggiore del 50 % dell’intervallo RR che lo comprende;
Gli atri sono depolarizzanti prima dei ventricoli. In questo caso le onde P negative precedono i complessi QRS;
Gli atri non sono affatto depolarizzanti a causa dell’esistenza di un blocco retrogrado della depolarizzazione atriale. In
questo caso gli atri non possono essere depolarizzanti oppure, in rarissimi casi, si può verificare una depolarizzazione
indipendente del nodo SA,
Se non sono presenti onde P, ma onde definite “f” e gli intervalli R-R sono irregolari si tratta di FIBRILLAZIONE
ATRIALE.
B) TACHICARDIA A QRS LARGHI
Se i complessi QRS risultano essere allargati (> 70 ms), è fondamentale la differenziazione fra tachicardie
sopraventricolari e ventricolari.
La distinzione assume grande importanza nel momento in cui si attua una terapia antiaritmica. Infatti, i farmaci
comunemente usati per le tachicardie sopraventricolari (verapamil, diltiazem) possono avere effetti deleteri in caso di
tachicardia ventricolare a causa dei loro effetti emodinamici.
Le tachicardie a QRS larghi possono essere distinti in tre gruppi:
Tachicardia sopraventricolare con blocco di branca o fenomeno d’aberranza
Tachicardia sopraventricolare con conduzione atrioventricolare mediante una via accessoria
Tachicardia ventricolare
Tachicardia ventricolare. Ci sono diversi criteri elettrocardiografici che permettono di definire una tachicardia a QRS
larghi come ventricolare.
a)Dissociazione ventricolare: quando la frequenza ventricolare risulta essere maggiore di quella atriale si tratta di
tachicardia ventricolare, ma ciò è facilmente distinguibile solo nel 30% delle tachicardie ventricolari. La presenza di
complessi di fusione derivanti dal sovrapporsi d’impulsi derivanti dal nodo del seno e di depolarizzazioni ventricolari è
patognomonica di tachicardia ventricolare.
b)Ampiezza dei complessi QRS: un’ampiezza del QRS maggiore di 100 ms con conduzione a blocco di branca destro e
120 ms con conduzione a blocco di branca sinistro è indice di tachicardia ventricolare. L’ampiezza del QRS non è un
criterio da prendere in considerazione nella differenziazione fra tachicardia ventricolare e tachicardia atrioventricolare
con conduzione attraverso una via anomale.
c)Caratteristiche morfologiche del complesso QRS durante la tachicardia:
- Un intervallo RS > 100 ms in tutte le precordiali è altamente suggestivo di tachicardia ventricolare
- Complessi QRS con concordanza negativa (nelle precordiali la morfologia dei QRS è simile in tutte le derivazioni con
complessi del tipo QS) sono indicativi di tachicardia ventricolare. Una concordanza positiva non esclude la possibilità
di una tachicardia AV reciprocante con via accessoria sinistra posteriore.
- La presenza di battiti di fusione è indice di tachicardia ventricolare.
TACHIARITMIE SOPRAVENTRICOLARI
TACHICARDIA SINUSALE
Il nodo del seno in condizioni di normalità ha una frequenza di scarica di 70-180 bpm. Tuttavia, esso è una struttura
versatile che viene influenzata da molti fattori quali l’ipossia, l’acidosi, la temperatura, gli ormoni (es. tri-iodiotironina,
serotonina).
Definizione. La tachicardia sinusale è definita come un incremento della frequenza di scarica del nodo del seno al di
sopra dei 140 bpm nelle razze giganti, 180 bpm nelle razze toy, 220 bpm nei cuccioli dovuta ad uno stress di tipo fisico,
emotivo, patologico o farmacologico.
Diagnosi. L’onda P risulta essere positiva nelle derivazioni I, II, aVF e negativa in aVR. L’asse frontale del QRS nel
piano frontale è compreso fra 0° e + 90°. L’intervallo PR ha durata normale (60-130 ms). L’onda P ha normale
morfologia. La tachicardia sinusale non è parossistica, ciò la differenzia da altre tachiaritmie basate sul meccanismo del
rientro.
FLUTTER ATRIALE
Definizione. Il flutter atriale istmo-dipendente viene mantenuto da circuiti che coinvolgono l’istmo cavo-tricuspidale.
La forma più comune consiste in una tachicardia con impulso che viaggia all’interno del circuito di rientro in senso
antiorario attorno alla valvola tricuspide (FLUTTER ATRIALE TIPICO). Meno frequentemente l’impulso viaggia in
senso orario attorno alla valvola tricuspide (FLUTTER ATRIALE TIPICO INVERSO). Il flutter atriale tipico è
caratterizzato da un ECG di superficie avente onde di flutter (onde F) prevalentemente negative nelle derivazioni
inferiori e positive in V1 che progressivamente diventano negative in V6 ad una frequenza cardiaca di 250-350 bpm.
Il flutter atriale tipico inverso mostra caratteristiche elettrocardiografiche diametralmente opposte (onde di flutter F
prevalentemente positive nelle derivazioni inferiori e negative in V1 che progressivamente diventano positive in V6). Il
coinvolgimento dell’istmo nell’origine del flutter può essere confermato solamente mediante studio elettrofisiologico.
TACHICARDIA ATRIALE FOCALE
Definizione. La tachicardia atriale è caratterizzata da un’attivazione atriale il cui impulso viene diffuso in maniera
centrifuga. La frequenza atriale risulta essere compresa in un range di 100-250 bpm e raramente arriva ai 300 bpm. Né
il nodo del seno, né il nodo AV svolgono un ruolo essenziale nell’inizio e nel mantenimento della tachiaritmia.
La tachicardia atriale focale non sostenuta detta anche a lembi autolimitanti è diagnosticata mediante la metodica Holter
e raramente è associata a sintomi. La forma sostenuta è relativamente rara. La tachicardia atriale focale è in genere
considerata una forma benigna ad eccezione dei casi in cui la tachicardia è incessante e porta ad una miocardiopatia
tachicardia-indotta.
Diagnosi. Nella tachicardia atriale focale, le onde P generalmente cadono nella seconda parte del ciclo di tachicardia,
spesso inscritte nell’onda T. L’intervallo P-R è direttamente influenzato dalla frequenza atriale. La presenza di un
blocco AV porta ad escludere con sicurezza la tachicardia AV reciprocante con via anomala accessoria e rende l’ipotesi
di tachicardia nodale AV reciprocante improbabile. Durante la tachicardia atriale focale, è solitamente presente una
linea isoelettrica tra le onde P, caratteristica fondamentale per la diagnosi differenziale con il flutter atriale tipico ed il
flutter atriale atipico (morfologia a dente di sega o sinusoidale delle onde P). Tuttavia, in alcuni casi, la presenza di una
frequenza molto alta o di conduzione disturbata, le onde P possono essere molto ampie e la linea isoelettrica assente,
così da mimare un flutter atriale. La presenza di onde P non ampie e di una linea isoelettrica ben definita non esclude
con certezza la presenza di una tachicardia da rientro con macrocircuito. Per avere una diagnosi certa di tachicardia
atriale focale occorre eseguire uno studio elettrofisiologico.
TACHICARDIA NODALE ATRIOVENTRICOLARE RECIPROCANTE
La tachicardia nodale AV reciprocante si sviluppa in un circuito composto da due vie funzionalmente ed
anatomicamente distinte. Nella maggior parte dei casi, la via a conduzione veloce è localizzata vicino all’apice del
triangolo di Koch. Questo triangolo è delimitato superiormente dal tendine di Todaro, mentre l’annulus tricuspidale ne
costituisce la base. La via a conduzione lenta, invece, si estende infero-posteriormente al tessuto compatto del nodo AV
passando lungo il margine settale della valvola tricuspide al livello, o poco sopra, del seno coronario.in caso di
TACHICARDIA NODALE AV RECIPROCANTE COMUNE (TIPO SLOW-FAST), la via a conduzione rapida funge
da branca retrograda del circuito di rientro, mentre la via a conduzione lenta costituisce la branca anterograda. In
seguito alla conduzione dell’impulso al fascio di His ed ai ventricoli attraverso la via lenta e la retroconduzione agli atri
attraverso la via rapida, il quadro elettrocardiografico risulta in intervallo R-PI breve (< 70 ms); spesso si nota in V1 la
presenza di una pseudo-rI .
TACHICARDIA GIUNZIONALE FOCALE O AUTOMATICA
Definizione. Un’anormalità di scarica a partire dalla regione della giunzione è stata in passato designata con un molti
termini diversi, ognuno dei quali risulta deficitario per una adeguata descrizione dell’aritmia. Per esempio, alcuni Autori
la hanno nominata “tachicardia ectopica giunzionale”, ma in questo termine è insita una certa ridondanza in quanto tutti
i pacemakers situati all’esterno del nodo del seno sono ectopici. La denominazione “tachicardia automatica
giunzionale” suggerisce che il meccanismo dell’aritmia sia da ricercare in un aumentato automatismo, mentre possono
essere coinvolti anche altri tipi di meccanismi. Il termine “tachicardia giunzionale focale” ha, invece, una connotazione
neutrale rispetto al tipo di meccanismo in grado di innescare la tachiaritmia.
Diagnosi. La caratteristica che unifica le tachicardie focali giunzionali consiste nella loro origine, da ricercare
all’interno del nodo AV oppure nel fascio di His. Le caratteristiche elettrocardiografiche di questa aritmia sono: a)
frequenza cardiaca compresa fra i 110 e i 250 bpm b) complessi QRS stretti oppure condotti tipicamente a blocco di
branca c) spesso è presente dissociazione atrioventricolare anche se occasionalmente si può notare una retroconduzione
atriale d) occasionalmente, alcuni battiti prematuri ectopici giunzionali possono non essere condotti ai ventricoli
produrre blocchi AV transitori dovuti all’intermittente refrattarietà del nodo AV.
TACHICARDIA
ATRIOVENTRICOLARE
ORTODROMICA
RECIPROCANTE
(VIA
ACCESSORIA
EXTRANODALE)
Definizione, meccanismo, diagnosi. Le vie accessorie tipiche sono vie extranodali che connettono il miocardio atriale a
quello ventricolare. Esse possono essere localizzate in base alla loro sede (si estendono lungo l’annulus mitralico o
tricuspidale), al tipo di conduzione (decrementale o non decrementale) ed al fatto se sono in grado di condurre l’impulso
in senso anterogrado, retrogrado od entrambi. Nella maggior parte dei casi le vie accessorie sono a conduzione rapida,
non decrementale e causano la tachicardia AV ortodromica reciprocante con RP breve, La sindrome correlata alla
presenza di una o più vie accessorie è detta di Wolf-Parkinson-White (WPW). Le tachicardie da rientro AV con via
accessoria extranodale sono sottoclassificate in ortodromica ed antidromica. In corso di tachicardia AV reciprocante
ortodromica, l’impulso viene condotto dall’atrio al ventricolo attraverso il nodo AV per poi rientrare dal ventricolo
all’atrio mediante la via accessoria. Questa tachicardia a QRS stretti inizia spesso con CVP, aberranza nei primi battiti e
marcata alternanza elettrica.
Dal punto di vista elettrocardiografico la presenza di vie accessorie determina il riscontro di elementi peculiari:
preeccitazione da fasci di Kent: intervallo PR breve, QRS largo, onda delta (rappresenta la parte di ventricolo che si
depolarizza precocemente tramite la via accessoria). La polarità e la morfologia dell’onda delta e del QRS dipendono
dalla sede della via accessoria
FIBRILLAZIONE ATRIALE (FA)
Definizione. La FA è una tachiaritmia sopraventricolare caratterizzata da un’attivazione atriale incoordinata con
conseguente deterioramento della funzione meccanica atriale. A livello elettrocardiografico, si rileva la sostituzione
delle onde P con onde di fibrillazione (onde f) che variano in morfologia, ampiezza, durata con una frequenza atriale di
350-600 bpm, associata ad una risposta ventricolare irregolare, con conduzione atrioventricolare conservata. La risposta
ventricolare dipende dalle proprietà del nodo AV che funge da filtro (vedi fenomeno della conduzione decrementale del
nodo AV), dal tono simpatico e vagale e dall’eventuale somministrazione di farmaci. Intervalli R-R regolari sono
possibili solamente in caso di blocchi AV o d’interferenza con una tachicardia giunzionale o ventricolare. Nel caso in
cui una FA sia associata a complessi QRS larghi, viene fortemente sospettata la presenza di una FA con conduzione
attraverso una via accessoria oppure di un blocco di branca preesistente.
TACHIARITMIE VENTRICOLARI
DEPOLARIZZAZIONI VENTRICOLARI PREMATURE E TACHICARDIA VENTRICOLARE NON SOSTENUTA
Le depolarizzazioni ventricolari premature e la tachicardia ventricolare non sostenuta possono essere rinvenute
all’esame fisico del paziente od in seguito ad un monitoraggio elettrocardiografico. L’ECG di superficie in caso di
depolarizzazioni ventricolari premature evidenzia complessi QRS di durata superiore a 70 msec, con una morfologia
bizzarra e con onda T che ha direzione opposta rispetto al vettore principale del complesso QRS. La maggior ampiezza
del complesso QRS è spiegata dal fatto che l’attivazione elettrica ventricolare passa in questo caso attraverso le
miofibrille anziché seguire il sistema di conduzione specifico a velocità più elevata. Ciò esita in un complesso QRS più
ampio della norma. Le depolarizzazioni premature ventricolari che iniziano sull’apice o molto in prossimità dell’onda T
sono dette R su T. Tale fenomeno risulta particolarmente rischioso in pazienti che presentano segni di ischemia
miocardica in quanto è stato provato che può indurre fibrillazione ventricolare. Si parla di bigeminismo ventricolare
quando si verifica una persistente alternanza di battiti normali e prematuri. Dal momento che l’intervallo di
accoppiamento fra battiti normali ed ectopici risulta costante, il meccanismo sottostante tale aritmia è costituita da un
rientro. Quando il bigeminismo è presente in pazienti con frequenza cardiaca di base bassa e funzione ventricolare
sinistra compromessa, possono insorgere segni di compromissione emodinamica. Questa è una delle rare situazioni in
cui le depolarizzazioni premature ventricolari possono compromettere la gittata cardiaca. Il ritmo trigemino, invece, e’
caratterizzato dall’alternanza di due battiti normali ed uno ectopico. Si definiscono coppie e triplette due o tre battiti
ectopici vicini, se queste presentano una morfologia diversa (rispettivamente con origine dx e sx) si
chiamano
bidirezionali e possono rappresentare un segno prognostico negativo.
La tachicardia ventricolare non sostenuta descritta come una sequenza di depolarizzazioni premature ventricolari con
una frequenza di scarica superiore a 100 bpm che termina spontaneamente in circa 30 secondi. Tipicamente gli episodi
di tachicardia ventricolare non sostenuta sono brevi, da 3 a 10 battiti, ed hanno una frequenza compresa fra i 100 ed i
200 bpm. La tachicardia ventricolare viene detta sostenuta quando l’episodio ha durata superiore a 30 secondi. La
morfologia alterata dei complessi QRS in corso di tachicardia ventricolare non sostenuta può essere uniforme e costante
(monomorfa) oppure polimorfa. Non sembra ci sia una stretta relazione fra le caratteristiche morfologiche della
tachicardia e la patologia cardiaca sottostante.
Manifestazioni cliniche. La tachicardia ventricolare non sostenuta può causare episodi sincopali nel caso in cui la
frequenza e la durata provocano un deficit di afflusso sanguigno a livello cerebrale.
TACHICARDIA VENTRICOLARE SOSTENUTA MONOMORFA
La tachicardia ventricolare monomorfa viene definita come un’aritmia con frequenza di scarica superiore a 140 bpm
originante dai ventricoli. In corso di tale aritmia i complessi QRS hanno tutti morfologia sovrapponibile. La tachicardia
ventricolare monomorfa viene classificata in base alla durata degli episodi aritmici: viene definita sostenuta se la durata
supera i 30 secondi e non sostenuta se termina spontaneamente entro 30 secondi. La tachicardia ventricolare monomorfa
non sostenuta si può trasformare in tachicardia ventricolare sostenuta o fibrillazione ventricolare. Una tachicardia
ventricolare monomorfa con frequenza di scarica inferiore a 140 bpm è detta ritmo idioventricolare accelerato. Una
tachicardia ventricolare monomorfa con frequenza di scarica superiore a 250 bpm è detta flutter ventricolare. In questo
caso, a causa della frequenza estremamente elevata, la morfologia dei complessi QRS appare sinusoidale ed è
impossibile distinguere i complessi QRS dalle onde T.
La tachicardia ventricolare monomorfa generalmente dà luogo a complessi QRS di durata maggiore di 70 msec. La
presenza di battiti di fusione è patognomonica di tachicardia ventricolare e dimostra la presenza di dissociazione atrioventricolare. Solitamente in corso di tachicardia ventricolare la frequenza di scarica rimane costante. Nel caso in cui si
evidenziano ampi cambiamenti di frequenza e gli intervalli RR non risultano regolari, si può supporre l’esistenza di più
meccanismi che sostengono l’aritmia.
Monitoraggio Holter. Dal momento che le tachicardie ventricolari monomorfe sostenute generalmente si presentano
infrequentemente e sporadicamente, la metodica holter assume estrema importanza nell’iter diagnostico.
Studio elettrofisiologico. Lo studio elettrofisiologico è il mezzo attraverso cui si può raggiungere la diagnosi di
certezza. Con tale metodica, infatti, si ha la possibilità di stimolare il ventricolo ed indurre le tachicardie ventricolari per
poi studiarne con estrema precisione le caratteristiche. In particolare, attraverso lo studio elettrofisiologico è possibile
determinare il meccanismo sottostante l’aritmia e quindi applicare la terapia più adatta.
TACHICARDIA VENTRICOLARE POLIMORFA
La tachicardia ventricolare polimorfa è definita come una tachicardia ventricolare instabile, con continui cambiamenti
della morfologia del complesso QRS in tutte le derivazioni. La frequenza di scarica è variabile fra i 100 bpm ed i 250
bpm, la tachicardia ventricolare polimorfa è definita sostenuta se ha durata maggiore a 30 secondi e non sostenuta se
termina spontaneamente entro 30 sec. molti episodi di tachicardia ventricolare polimorfa sono associati a
compromissione emodinamica, soprattutto se la frequenza cardiaca supera i 200 bpm. Nella maggior parte dei casi,
comunque, tali episodi si esauriscono spontaneamente. La torsione di punta rappresenta una particolare tachicardia
ventricolare polimorfa associata alla sindrome del QT lungo acquisita o congenita avente un pattern elettrocardiografico
costituito da complessi non uniformi con attività elettrica organizzata, con continui cambi di morfologia, ampiezza ed
asse elettrico del complesso QRS.
CARDIOPATIA ARITMOGENA DEL VENTRICOLO DESTRO IN CANI DI RAZZA BOXER
La miocardiopatia aritmogena del ventricolo destro rappresenta un disordine del miocardio ventricolare
patologicamente caratterizzato dalla sostituzione di tessuto miocardico con tessuto fibro-adiposo a livello ventricolare
destro. Solitamente viene osservato un interessamento segmentale del miocardio ventricolare destro, anche se sono
descritti casi in cui vengono interessati l’intero ventricolo destro e sinistro. Le manifestazioni cliniche di tale condizione
patologica includono alterazioni strutturali e funzionali del ventricolo destro, a livello elettrocardiografico modificazioni
delle fasi di depolarizzazione e ripolarizzazione, presenza di aritmie ventricolari di origine destra, morte cardiaca
improvvisa.
MORTE CARDIACA IMPROVVISA NEI CANI DI RAZZA PASTORE TEDESCO
Il sistema nervoso autonomo gioca un ruolo fondamentale nei cani di razza pastore tedesco con aritmie ventricolari a
carattere ereditario e propensione ad episodi morte cardiaca improvvisa. Questi cani non presentano episodi di tipo
sincopale, ma la morte cardiaca improvvisa rappresenta il primo segno clinico della patologia. La morte sopravviene
durante il sonno o durante il periodo di riposo susseguente un esercizio. I pastori tedeschi solitamente giungono a morte
in un periodo variabile da 4 a 18 mesi di età e l’esame autoptico non rivela alcuna causa di morte. L’esame fisico di
base è usualmente nella norma ed talvolta si può apprezzare all’ascoltazione l’aritmia. L’esame elettrocardiografico di
base può rivelare la presenza di aritmie. solamente nei casi in cui la patologia risulta veramente grave, anche perché
questo tipo di aritmia è correlata alla presenza di frequenze cardiache basse, condizione non presente durante la
registrazione di un elettrocardiogramma nella struttura ambulatoriale. Quindi, nella maggior parte dei casi la diagnosi di
certezza si raggiunge con l’esecuzione di un monitoraggio elettrocardiografico dinamico secondo la metodica Holter.
Tuttavia, sebbene il monitoraggio Holter sia l’esame di prima scelta in questi casi, esso può non identificare tutti i
soggetti colpiti in quanto questa aritmia risulta essere età-dipendente. In genere le misurazioni elettrocardiografiche, i
radiogrammi toracici, i parametri ecocardiografici, i valori ematochimici risultano tutti nella norma. I cani affetti da tale
patologia possono presentare diverse aritmie. I cani a rischio di morte cardiaca improvvisa presentano tachicardie
ventricolari ad elevata frequenza di scarica (>300 battiti al minuto), polimorfe, sostenute e precedute da un periodo di
pausa.
A volte, la frequenza di scarica e la gravità dell’aritmia presentano maggiore gravità nei casi in cui la tachicardia
ventricolare è preceduta da una aritmia sinusale pronunciata. Il rallentamento del ritmo di base dato da una stimolazione
vagale diretta o attraverso la stimolazione dei barorecettori da parte di a1-agonisti favorisce l’insorgere della tachicardia
ventricolare. In alcuni soggetti si evidenziano tachicardie monomorfe sostenute a ridotte frequenza cardiache (200-250
battiti al minuto), in altri solamente complessi ventricolari prematuri isolati. L’aritmia sembra esser dipendente dall’età
del soggetto. i soggetti non dimostrano avere aritmie prima delle 12 settimane di età. Dopo la dodicesima settimana
possono essere identificate le aritmie ventricolari che aumentano di intensità fino alla ventiquattresima-trentesima
settimana. Dopo tale periodo una percentuale di cani non fa registrare peggioramenti rimanendo in una situazione
stabile, altri sviluppano aritmie ventricolari progressivamente più gravi fino all’episodio di morte cardiaca improvvisa.
Altri ancora, invece, dimostrano una riduzione della frequenza degli episodi aritmici fino a non far registrare alcuna
aritmia dopo i 18 mesi di età. Le aritmie ventricolari risultano presenti durante i periodi di riposo ed i periodi di sonno.
Una serie di fattori partecipa nel determinare l’insorgere dell’aritmia in determinati periodi della giornata. Le fasi di
eccitazione e lo sforzo fisico sono generalmente accompagnati da un aumento del tono del sistema simpatico e una
diminuzione del tono del nervo vago che porta ad una riduzione delle pause sinusali in queste circostanze. Al contrario,
durante il riposo ed il sonno sono evidenti un ritmo sinusale a frequenza minore e la presenza di lunghe pause sinusali. I
pastori tedeschi con tachicardia ventricolari presentano delle anormalità dell’innervazione del sistema nervoso
autonomo simpatico e post-potenziali precoci
Studi scintigrafici hanno rivelato una alterazione della distribuzione dell’innervazione simpatica di questi soggetti. La
mancanza di fibre nervose risulta inoltre confermata da studi immunocitochimici mediante l’utilizzo di tirosina idrolasi
su sezioni di muscolo cardiaco. L’esame istologico ha evidenziato una marcata riduzione dei terminali nervosi del
sistema simpatico. Le fibre del Purkinje localizzate nelle aree di miocardio ventricolare mancanti di innervazione
simpatica sviluppano attività triggerate secondarie a post-potenziali precoci dando luogo al meccanismo che consente lo
sviluppo della tachicardia ventricolare. Inoltre, studi preliminari hanno evidenziato la presenza nei cani colpiti da
tachicardia ventricolare di un eccessivo numero di recettori ß-adrenergici rispetto a cani normali. Tale situazione può
favorire gli effetti aritmogeni del sistema nervoso autonomo in particolar modo durante situazioni in cui tale sistema
risulta particolarmente attivato.
MORTE CARDIACA IMPROVVISA NEI CANI DI RAZZA DOBERMAN
La morte cardiaca improvvisa è stata riconosciuta in cani di razza doberman sani sin dal 1940. James e Drake
effettuarono i primi studi su questa razza dal 1965 al 1968 e attribuirono gli episodi di morte improvvisa ad una forma
degenerativa focale del sistema Hissiano e susseguente attacco di Adams-Stokes. Più recentemente, Sandusky e
collaboratori hanno riportato che una degenerazione del sistema di His può essere presente in una ampia varietà di razze
di grossa taglia. La morte improvvisa dei cani di razza Doberman è riportata essere correlata ad un quadro di
miocardiopatia dilatativa e può avvenire prima o dopo lo sviluppo dei segni clinici di insufficienza cardiaca congestizia.
Nei cani di razza doberman, la miocardiopatia dilatativa rappresenta una patologia insidiosa, cronica, con uno sviluppo
estremamente rapido caratterizzata dalla graduale e progressiva disfunzione del ventricolo sinistro. Il destino di questi
soggetti è rappresentato dalla morte cardiaca improvvisa o dall’insufficienza cardiaca congestizia. In ogni caso,
solitamente, i cani anziani affetti da miocardiopatia dilatativa muoiono a causa di patologie extracardiache. Invece, i
soggetti in cui si identificano i primi problemi cardiaci all’età di 3-4 anni mostrano avere una progressione della
malattia estremamente rapida e risultano maggiormente esposti al rischio di morte improvvisa. In uno studio effettuato
da CA Calvert nel 1997, riporta che la percentuale di cani doberman affetti da miocardiopatia dilatativa che muoiono in
seguito a morte improvvisa è del 26%, percentuale simile alla medicina umana. Nei cani di razza doberman, la morte
improvvisa sembra essere un evento che richiede un substrato aritmico, fattori di trigger e disturbi di carattere
elettrofisiologico. La sincope, se attribuibile ad un episodio di tachicardia ventricolare, viene identificata come un
fattore di rischio di morte improvvisa. Infatti, nella razza doberman la morte improvvisa si verifica spesso durante il
primo episodio sincopale o durante il sonno e molti cani non sopravvivono al secondo episodio sincopale. Il tempo
intercorrente fra il primo ed il secondo episodio sincopale è solitamente superiore alle 6 settimane nei soggetti non
trattati.
ARITMIE VENTRICOLARI ASSOCIATE A PATOLOGIE EXTRA-CARDIACHE
Aritmie associate a sindrome DTG ed a masse spleniche. Le aritmie ventricolari che si sviluppano in corso di sindrome
DTG hanno alla base come fattore causale la presenza di fenomeni ischemici del miocardio ed ipossia dovuta ad un
minor ritorno venoso causato dalla compressione della vena cava ed al rilascio all’interno del torrente circolatorio di
fattori deprimenti la funzionalità cardiaca in seguito a fenomeni di ipossia pancreatica. Secondariamente, altri fattori
quali un’alterazione dell’equilibrio acido-base ed uno squilibrio elettrolitico possono favorire l’insorgenza di aritmie
ventricolari. Anche in caso di rottura di masse di milza possiamo ritrovare i medesimi fattoti scatenanti le aritmie
ventricolari (ischemia miocardica ed ipossia derivanti da uno stato di shock ipovolemico). Un difficoltoso ritorno
venoso può inoltre essere causato da una massa splenica di dimensioni tali da provocare compressione a livello di vena
cava. Le aritmie che insorgono come complicazioni di tali patologie extracardiache sono rappresentate da ritmo
idioventricolare accelerato, da tachicardie ventricolari non sostenute, da tachicardie ventricolari sostenute.
Trattamento. Se la tachicardia ventricolare ha una frequenza di scarica superiore a 250 bpm il trattamento d’elezione
consiste nell’infusione endovenosa continua di lidocaina alla dose di 25-40 g/kg/h.
Terapia
Le sincopi neuromediate e le intolleranze ortostatiche non presentano rischio di morte improvvisa per cui la terapia deve
essere indirizzata al controllo dei sintomi scatenanti o alla riduzione dei farmaci che inducono ipovolemia. In casi
selezionati in assenza di insufficienza cardiaca è possibile usare fluidrocortisone. Le sincopi aritmiche possono essere
trattate a secondo del tipo con terapia farmacologica, cardiostimolazione nelle bradiaritmie e nei blocchi della
conduzione7, ablazione con radiofrequenza in caso di tachiaritmie, in particolar modo sopraventricolari, da rientro. Nei
soggetti con aritmie ventricolari ad alto rischio di aritmie fatali oltre al controllo del ritmo farmacologico è suggerito
l’impianto di defibrillatori endocavitari. Le sincopi cardiostrutturali vengono trattate, dove possibile, correggendo la
causa scatenante.
TERAPIA DELLE BRADIARITMIE
Il trattamento delle bradiaritmie può essere attuato mediante la terapia farmacologica o la terapia elettrica. La terapia
elettrica si avvale dell’utilizzo di cardiostimolatori (pacemakers) temporanei o permanenti. La terapia farmacologica
prevede l’utilizzo di isoproterenolo.
Dosaggio dell’isoproterenolo:
• per il trattamento dell’arresto sinusale, della bradicardia sinusale, del blocco atrioventricolare completo
- 0,4 mg in 250 ml di D5W per via endovenosa ad effetto oppure Isuprel® Glossets 5-20 mg per via sublinguale o
endorettale q4-6h (Tilley e Miller 1986)
- 0,04-0,08 mg/kg/min in infusione endovenosa oppure 0,1-0,2 mg IM q4h oppure o,4mgin 250 ml di D5W per via
endovenosa lenta (Morgan 1988)
• per ottenere broncodilatazione
- 0,1-0,2 mg q6h IM (Papich 1986)
Altri farmaci utilizzati per ottenere un incremento della frequenza cardiaca sono rappresentati da anticolinergicivagolitici o simpaticomimetici adrenergici (Sisson 1989, Tilley 1992) questi principi attivi risultano efficaci solitamente
per la terapia di soggetti affetti da sindrome del seno malato, mentre non dimostrano efficacia in soggetti affetti da
blocco atrioventricolare o da silenzio atriale. I farmaci anticolinergici includono:
• propantelina bromide 7,5-30 mg q8h PO (Rishniw et al.)
• isopropamide 0,2-0,4 mg/kg q8-12h PO (Rishniw et al.)
•Gli agenti simpaticomemietici comprendono:
• teofillina 9 mg/kg q6-8h PO (Rishniw et al.)
• aminofillina 11 mg/kg q8h PO (Rishniw et al.)
• terbutalina 0,2 mg/kg q8-12h PO (Rishniw et al.)
In soggetti affetti da sindrome del seno malato la frequenza cardiaca e la presenza di arresti sinusali che si evidenziano a
livello sintomatologico con debolezza o episodi sincopali possono essere migliorati con l’utilizzo di questi principi
attivi. Queste molecole risultano solitamente ben tollerate, anche se la loro efficacia risulta spesso relativa e a carattere
temporaneo. Di conseguenza questi farmaci vengono prescritti solamente in casi selezionati che non rappresentano
buoni candidati all’impianto di pacemaker.
Gli effetti collaterali di questi principi attivi sono rappresentati da secchezza delle mucose, vomito, fotofobia causata
dalla dilatazione pupillare, costipazione, cheratocongiuntivite secca.
CENNI SULL’ELETTROSTIMOLAZIONE PERMANENTE
Nell’anno 1967 fu impiantato il primo pacemaker in un cane di razza Basenji di 10 anni affetto da insufficienza cardiaca
congestizia causata da un blocco atrioventricolare completo. Oggi, le tecniche d’impianto e la qualità dei pacemaker si
sono notevolmente evolute.
Modalità di stimolazione
Stimolazione a camera singola
Modalità VVI
Questa tipologia di stimolazione è quella di più largo impiego. Il pacemaker è inattivo quando l’attività cardiaca
spontanea ha frequenza superiore all’attività artificiale. Genera invece l’impulso stimolante quando questa si abbassa al
di sotto dell’intervallo di stimolazione. L’onda R spontanea viene captata dal pacemaker e se entro un certo lasso di
tempo viene sentita una successiva onda R, l’impulso del generatore rimane bloccato. In caso contrario, superato
l’intervallo di sfuggita, lo stimolo viene erogato alla frequenza programmata. Nel momento in cui il ritmo intrinseco
acquisisce frequenza superiore a quella dello stimolatore, il generatore si spegne automaticamente. All’esame
elettrocardiografico, nel momento di ritmo spontaneo non si osservano stimoli artificiali. La stimolazione cardiaca a
domanda, sebbene offra il vantaggio della non competitività con il ritmo intrinseco, presenta alcuni aspetti
inconvenienti. Infatti, la presenza di potenziali elettrici extracardiaci (miopotenziali, interferenze elettromagnetiche) può
interferire con il corretto funzionamento del pacemaker. Inoltre, tale tipologia di stimolazione comporta la perdita del
contributo atriale che si traduce in una riduzione della gittata cardiaca del 20-25%, cui si somma il fatto che la
contrazione atriale a valvole atrioventricolari chiuse provoca un incremento delle pressioni a monte e il possibile
instaurarsi di uno scompenso cardiaco (sindrome da pacemaker). Questa condizione regredisce in genere dopo la messa
in atto di una stimolazione atrioventricolare sequenziale. In genere, in pazienti con disturbi della conduzione
atrioventricolare è preferibile l’impianto di pacemaker con modalità DDD, mentre l’utilizzo dei VVI è preferibile in
pazienti con fibrillazione atriale cronica permanente.
Stimolazione a doppia camera
Modalità DDD
Tale tipologia di pacemaker consente il sensing ed il pacing sia atriale che ventricolare. Gli stimoli artificiali atriali e
ventricolari sono inibiti dalla funzione di sensing. Inoltre, quando è presente attività atriale intrinseca, le naturali onde P
vengono seguite da eventi di pacing ventricolare in caso di disturbi della conduzione atrioventricolare. Di conseguenza,
in soggetti con ritmo sinusale e blocco atrioventricolare, la frequenza di stimolazione ventricolare viene guidata dalla
fisiologica frequenza delle contrazione atriale. Il pacing atriale, invece, interviene nel momento in cui non viene rilevata
attività atriale intrinseca (arresto sinusale e bradicardia sinusale). Tale modalità di stimolazione risulta particolarmente
indicata in pazienti con ritmo sinusale e blocco atrioventricolare in quanto consente di rispettare la fisiologica variabilità
di frequenza. Con questo dispositivo si ottiene quindi il miglior risultato emodinamico. Il pacemaker sequenziale
prevede 5 differenti modalità di intervento:
• nel caso in cui la frequenza atriale risulti inferiore rispetto a quella programmata (“lower rate”) vengono stimolati sia
gli atri che i ventricoli con intervallo AV fisso prestabilito ad una frequenza programmata
• se la frequenza intrinseca atriale sentita rimane entro i range programmati (compresa fra la frequenza più bassa “lower
rate” e la frequenza più alta “upper rate”), viene effettuata una modalità di stimolazione in cui l’atrio guida il ventricolo
(VDD) con rapporto di conduzione atrioventricolare di 1:1
• il pacemaker attiva il fenomeno di wenckebach artificiale nel caso in cui la frequenza atriale risulti superiore alla
“upper rate”
• il pacemaker induce automaticamente un blocco di II° tipo 2:1 nel caso in cui le frequenze atriali raggiungano livelli
ancora più elevati tali da far risultare l’intervallo P-P più breve del circuito atriale del pacemaker
• a scopo di limitare la frequenza ventricolare, vengono simultaneamente indotti un blocco 2:1 ed il fenomeno di
Wenckebach artificiale
Modalità VDD
Tale modalità prevede il fenomeno del sensing atriale e ventricolare con pacing solo ventricolare. Il sensing degli eventi
ventricolari intrinseci risulta in una inibizione della stimolazione ventricolare. Il fenomeno del sensing atriale consente
la stimolazione ventricolare sincrona atrio-guidata. Tale modalità di stimolazione è prevista per la terapia elettrica dei
soggetti con ritmo sinusale e blocchi atrioventricolari. Dal momento che tale tipologia non prevede la stimolazione
atriale, tale dispositivo non può essere utilizzato in soggetti con anormale funzione del nodo del seno. In genere la
modalità VDD viene espletata con un particolare dispositivo che prevede l’utilizzo di un solo elettrodo. La punta di tale
elettrodo posto in apice ventricolare destro effettua le funzioni di sensing e pacing ventricolare mentre lungo il suo
decorso a livello atriale destro funziona come sensing atriale.
La stimolazione “rate responsive” o “a domanda”
Durante l’esercizio, sia la frequenza che la portata cardiaca subiscono un incremento significativo. Un individuo con
sistema nervoso autonomo nella norma è in grado di aumentare la frequenza cardiaca in base alle contingenti esigenze
metaboliche. La modalità di stimolazione a risposta è stato elaborato per permettere al soggetto di far fronte alle
esigenze metaboliche del momento. Per esempio, il pacemaker DDDR permette ai pazienti di raggiungere una adeguata
frequenza cardiaca grazie alla stimolazione atriale superiore alla frequenza di scarica del nodo del seno. Le modalità
secondo le quali il pacemaker aumenta la sua frequenza di scarica sono diverse:
• le variazioni dall’intervallo QT indotte dall’aumento dei valori ematici di catecolamine (Quintech TX)
• le variazioni trasmesse dalle masse muscolari in movimento (Activitrax, Medtronic)
• la frequenza respiratoria (Biorate)
La tipologia di più facile impiego e programmabilità risulta quella che regola la frequenza cardiaca in base ai
movimenti delle masse muscolari. Ad oggi sono in corso studi volti a definire l’utilità di altri parametri quali il volume
sistolico, il contenuto di ossigeno nel sangue venoso per rispondere al meglio alle esigenze metaboliche dell’organismo
allo scopo di rendere le variazioni di frequenza sempre più adeguate alle richieste.
Tecnica d’impianto
Durante l’impianto di un pacemaker risulta essenziale la presenza di un apparecchiatura in grado di esercitare un pacing
esterno nel caso si renda necessario. Il pacing esterno viene effettuato tramite placche applicate a livello di emitorace
destro e sinistro in corrispondenza dell’itto cardiaco. Il pacing esterno può esser modulato sia quanto riguarda la
frequenza di scarica (frequenza cardiaca) che per quanto riguarda la potenza di scarica (in base ai livelli di cattura
ventricolare). La possibilità di esercitare il pacing esterno risulta fondamentale nel momento in cui, in seguito agli
effetti dei farmaci anestetici, si sviluppano fenomeni bradicardici accentuati (ad esempio quando la patologia di base è
rappresentata da un BAV 3° o da una SSS) in grado di provocare ipossia miocardica o di indurre torsioni di punta
bradicardia-dipendenti. La tecnica d’impianto standard consiste nell’isolamento della vena giugulare e nell’inserimento
dell’elettrodo. Utilizzando la fluoroscopia, è monitorato il percorso dell’elettrodo fino al suo arrivo a livello ventricolare
destro. Il punto di posizionamento ottimale dell’elettrodo è rappresentato dal punto in cui è richiesta l’energia più bassa
per ottenere la cattura ventricolare. Una volta accertato il corretto posizionamento dell’elettrodo e testate la soglie e
l’impedenza (parametri che consentono la valutazione del corretto funzionamento), si procede all’esecuzione di una
tasca sottocutanea in cui verrà alloggiato il dispositivo di stimolazione permanente. Dopo aver applicato la sutura, si
esegue una fasciatura a livello del collo. Il paziente, per consentire un corretto posizionamento dell’elettrodo deve
rimanere ospedalizzato per almeno 72 ore.
Complicanze
La dislocazione dell’elettrodo è la più frequente complicanza rilevata ed è presente in circa il 10% dei soggetti. In
medicina umana sono stati effettuati vari studi che hanno provato come l’incidenza di dislocazione dell’elettrodo è
direttamente correlata all’esperienza acquisita dall’operatore. Invece, l’incidenza di dislocazione non viene
significativamente influenzata dalla tipologia di elettrodo utilizzato (fissazione attiva o passiva).
La seconda più frequente complicanza riscontrata in campo veterinario è la presenza di un malfunzionamento del
generatore di impulsi. Le batterie di un pacemaker possono durare da 7 a 12 anni, quindi il problema di insufficiente
batteria non sembra esser di primario interesse, calcolata la vita media di un animale da compagnia, molto inferiore se
comparata ad un paziente umano.
La terza complicanza in ordine di incidenza è rappresentata dall’insorgenza di infezioni in corrispondenza della tasca
cutanea in cui viene alloggiato il pacemaker. Nonostante le infezioni in tale sede siano veramente poco comuni, il loro
sviluppo può portare a conseguenze disastrose per il paziente in quanto richiede la totale sostituzione di tutti gli
elementi coinvolti nel processo infettivo. Al fine di evitare tale complicazione, si effettua un trattamento antibiotico
locale iniettando a livello di tasca sottocutanea ospitante il dispositivo di stimolazione permanente la rifampicina,
mentre per via sistemica il soggetto viene sottoposto a terapia antibiotica rappresentata da amoxicillina e acido
clavulanico associati ad una cefalosporina. Complicanze minori includono lo sviluppo di un seroma in corrispondenza
della tasca sottocutanea. Tale seroma si estingue senza nessun problema in circa 15 giorni e non richiede alcun
trattamento farmacologico, né alcun drenaggio (assolutamente da evitare per il rischio d’infezioni).
TRATTAMENTO DELLE TACHICARDIE SOPRAVENTRICOLARI
TACHICARDIE SOPRAVENTRICOLARI NON DIPENDENTI DA UN MECCANISMO DI RIENTRO
Il trattamento delle tachiaritrmie sopraventricolari non dipendenti da un meccanismo di rientro è volto non tanto alla
conversione in ritmo sinusale, quanto al controllo della frequenza cardiaca. I farmaci da utilizzare in questi casi sono
rappresentati da digossina, calcio-antagonisti o beta-bloccanti.
Terapia antiaritmica in fase acuta (somministrazione endovenosa)
Prima di dare inizio ad un qualsiasi trattamento farmacologico, deve essere effettuato il massaggio del seno carotideo.
Se questo non sortisce alcun effetto, si passa al trattamento farmacologico.
• calcio-antagonisti
I calcio antagonisti maggiormente utilizzati sono il verapamil ed il diltiazem. Il diltiazem può essere utilizzato alla dose
di 0,05-0,3 mg/kg in bolo endovenoso ogni 5 minuti fino al raggiungimento dell’effetto. Il verapamil può essere
utilizzato alla dose di 0,05-0,15 mg/kg in dosi successive di 0,05 mg/kg somministrate ogni 5 minuti. Gli agenti di
blocco dei canali del calcio possiedono azione sulla velocità di conduzione atrioventricolare e funzionano bene in casi
con frequenza cardiaca molto elevata. La differenza clinica fra verapamil e diltiazem risulta veramente minima,
nonostante il diltiazem eserciti azione inotropa negativa meno potente e possieda minori interazioni con i glicosidi
digitalici. La somministrazione in infusione da effettuare dopo il bolo deve rispettare le dosi di 5-15 mg/kg/h. Tali
farmaci sono assolutamente da evitare se presente disfunzione sistolica sinistra.
• beta-bloccanti
I farmaci beta-bloccanti possono essere utilizzati sin dall’inizio come unica terapia oppure nel momento in cui i farmaci
calcio-antagonisti non riescano ad esercitare un adeguato controllo della frequenza cardiaca. L’esmololo è un efficace
beta-bloccante ad azione ultra-rapida. La dose consigliata è di 0,1-0,5 mg/kg /min per 1 minuto, seguito dalla
somministrazione in infusione continua di 0,05-0,2 mg/kg/min. Il propranololo, invece, può essere utilizzato alla dose di
0,02-0,05 mg/kg in vena in 2 minuti da ripetere fino a che non si raggiunge il controllo della frequenza ventricolare. In
alcuni casi, cani con una buona contrattilità miocardica richiedono dosi maggiori di farmaci beta-bloccanti per ottenere
il controllo della frequenza, specialmente quando i beta-bloccanti sono utilizzati in monoterapia. I beta bloccanti devono
essere somministrati con estrema cautela in soggetti con deficit di contrattilità o stati ipotensivi. In questi casi risulta
preferibile l’utilizzo dell’esmololo a causa della sua breve emivita (9 minuti).
Nei casi in cui cani affetti da tachicardie sopraventricolari non rispondono alla monoterapia con calcio antagonisti o
beta-bloccanti, essi possono essere associati. In questo caso devono essere somministrate bassissime dosi di betabloccante.
• digossina
L’efficacia della digossina in fase acuta risulta relativa a causa della sua breve azione. L’azione primaria del principio
attivo è rappresentata da un aumento del tono vagale. Tuttavia in un soggetto stressato con aumento del tono simpatico
risulta preferibile l’utilizzo di altre molecole.
Nell’uomo, per la diagnosi delle tachiaritmie sopraventricolari viene utilizzata l’adenosina che esercita effetto a livello
del nodo atrioventricolare attenuando le correnti di ioni calcio in entrata. A livello diagnostico, l’assenza di un circuito
di rientro viene confermata in base al fatto che dopo somministrazione di adenosina la tachicardia sopraventricolare
continua ma la frequenza ventricolare rallenta. Nonostante l’adenosina sia un principio attivo largamente studiato nel
cane, la sua reale efficacia non è ancora stata provata.
Terapia antiaritmica in fase cronica (somministrazione orale)
La terapia in fase acuta deve essere seguita dalla terapia cronica mirata a rallentare la velocità di conduzione
atrioventricolare in caso di tachicardie sopraventricolari o convertire la tachicardia sopraventricolare in ritmo sinusale.
Questi principi attivi includono: diltiazem (1-3 mg/kg tid), atenololo (0,5-1 mg/kg sid o bid), propranololo (0,3-1,5
mg/kg tid), digossina (0,005-0,01 mg/kg bid). In alcuni casi questi farmaci possono convertire la tachiaritmia in ritmo
sinusale anche se per tale fine vengono solitamente utilizzati altri farmaci quali: chinidina (6-20 mg/kg tid),
procainamide (10-20 mg/kg qid), propafenone (3-4 mg/kg tid), sotalolo (0,5-2 mg/kg bid o tid), amiodarone (dose di
carico 10 mg/kg per 7 giorni, poi 5 mg/kg ogni 24-48 h). L’efficacia della terapia orale può non essere ottimale. La
mancanza della risposta può essere dovuta al dosaggio inadeguato o alla necessità di effettuare una associazione di
farmaci.
Le tachicardie ectopiche atriali possono essere convertite a ritmo sinusale con l’uso di farmaci della classe IA, IC o III.
In campo umano, i principi attivi più frequentemente utilizzati per la terapia delle tachicardie atriali ectopiche sono
propafenone, flecainide, sotalolo, amiodarone. In campo veterinario non esistono studi che comprovino l’efficacia di
questi principi attivi.
• FLUTTER E FIBRILLAZIONE ATRIALE
Terapia acuta
Per il controllo del flutter e della fibrillazione atriale vengono utilizzati i medesimi principi attivi elencati per la terapia
delle tachicardie sopraventricolari. La digossina per via endovenosa non viene solitamente utilizzata quando viene
richiesto un rapido controllo della frequenza ventricolare. La prima scelta per una terapia endovenosa è rappresentata
dall’utilizzo di beta-bloccanti, calcio-antagonisti oppure un’associazione di entrambi.
Cardioversione. La cardioversione è la terapia di elezione in pazienti con FA di tipo persistente. La cardioversione
immediata è essenziale nei soggetti con insufficienza cardiaca congestizia ed ipotensione causate dall’aritmia. Prima di
eseguire la cardioversione è opportuno iniziare circa 24 ore prima una terapia profilattica anticoagulante. La
cardioversione può essere attuata secondo due diversi metodi: elettrica o farmacologica. Il metodo farmacologico risulta
sicuramente meno efficace rispetto allo shock elettrico, ma quest’ultimo richiede sedazione od anestesia generale.
Cardioversione farmacologica: è l’approccio più semplice, ma meno efficace. I maggiori rischi sono legati agli effetti
collaterali dei farmaci antiaritmici. La cardioversione farmacologica sembra avere maggior efficacia se attuata entro 7
giorni dall’inizio dell’aritmia.
Cardioversione elettrica: prevede la liberazione di uno shock elettrico sincronizzato con l’attività intrinseca del cuore, in
genere sensibile alle onde R dell’ECG. Questa tecnica assicura che la liberazione d’energia elettrica non avvenga
durante la fase vulnerabile del ciclo cardiaco, cioè da 60 ad 80 ms prima e da 20 a 30 ms dopo l’apice dell’onda T. la
cardioversione elettrica può esser utilizzata per convertire a ritmo sinusale tutti i ritmi cardiaci anormali tranne la
fibrillazione ventricolare. Una cardioversione di successo dipende dalla natura del problema cardiaco sottostante e
dall’intensità di corrente elettrica che arriva al miocardio atriale; a sua volta quest’ultima dipende dal voltaggio, dalla
forma delle onde, dalla grandezza e dalla posizione delle piastre poste a contatto con il torace dell’animale,
dall’impedenza transtoracica. La cardioversione elettrica deve sempre essere effettuata in soggetti adeguatamente
anestetizzati al fine di evitare il dolore relativo alla scarica elettrica. Il rischio della cardioversione elettrica è
principalmente correlato all’insorgere di aritmie come battiti prematuri ectopici ventricolari e sopraventricolari,
bradicardia, brevi periodi di arresto sinusale.
Terapia cronica
o digossina in monoterapia
La prima scelta per il controllo della frequenza cardiaca è tradizionalmente la digossina che diminuisce la frequenza
ventricolare attraverso il suo effetto indiretto sul nervo vago e attraverso il suo effetto di diminuzione della durata del
potenziale d’azione e del periodo refrattario delle cellule miocardiche atriali. Quest’ultimo effetto risulta in un aumento
delle onde che bombardano il nodo atrioventricolare con conseguente aumento della conduzione atrioventricolare
occulta e diminuzione della frequenza ventricolare. Il controllo della frequenza ventricolare in soggetti in terapia con
digossina non risulta ottimale in particolare durante l’esercizio, lo stress, l’agitazione in quanto in questi momenti il
tono del sistema nervoso simpatico risulta particolarmente elevato. Di conseguenza risulta spesso indispensabile
associare al trattamento con digitale farmaci beta-bloccanti o calcio-antagonisti.
o digossina in associazione ad altri principi attivi
La digossina risulta spesso più efficace se associata ad altri farmaci come i beta-bloccanti (atenololo, propranololo,
metoprololo) oppure calcio-antagonisti (diltiazem) dal momento che entrambi aumentano il periodo di refrattarietà del
nodo atrioventricolare. In medicina umana si ottengono risultati migliori quando la digitale viene associata ai calcioantagonisti piuttosto che a i beta-bloccanti. In corso di fibrillazione atriale in terapia con digitale vanno sempre dosati i
livelli di digossinemia a 7-10 giorni l’inizio della terapia (prelievo di sangue da effettuare 10 ore dopo la
somministrazione della digossina).
TACHICARDIE SOPRAVENTRICOLARI DIPENDENTI DA RIENTRI ATRIOVENTRICOLARI
La terapia di elezione delle tachicardie dipendenti da rientri atrioventricolari è rappresentata dalla ablazione in
radiofrequenza. Come seconda scelta possono essere utilizzati diversi principi attivi per controllare la frequenza
ventricolare o convertire la tachicardia a ritmo sinusale.
Il tessuto di conduzione atrioventricolare risulta sensibile al tono del sistema nervoso autonomo. Di conseguenza, i
farmaci che aumentano il tono parasimpatico o diminuiscono il tono simpatico possono interrompere il circuito di
rientro. La digossina e gli agenti beta-bloccanti possono essere utilizzati per interrompere o prevenire l’insorgenza
dell’aritmia. I principi attivi che rallentano direttamente la velocità di conduzione attraverso la via accessoria come i
calcio antagonisti possono esercitare effetto antiaritmico simile. Per il trattamento in fase acuta possono essere utilizzati
i farmaci appartenenti alla classe Ia (chinidina) , Ic (flecainide) e III.
In fase acuta può essere attuata la manovra del colpo precordiale (chest thump). Tale manovra viene eseguita
esercitando un forte colpo a livello di itto cardiaco sull’emitorace sinistro. Il colpo fornisce a livello cardiaco un
extrastimolo che interrompendo il circuito di rientro consente il ripristino del ritmo sinusale.
Ablazione transcatetere. L’ablazione transcatetere viene attuata nella stessa sede dello studio elettrofisiologico
diagnostico.Lo scopo di uno studio elettrofisiologico è confermare la presenza di una via accessoria extranodale,
determinarne le caratteristiche di conduzione, definirne il ruolo nella sintomatologia manifestata dal paziente. Una volta
identificata la sede della via accessoria, questa viene ablata mediante radiofrequenza. Gli inconvenienti che si possono
presentare sono dati dall’esposizione alle radiazioni, dai danni in corrispondenza dell’accesso venoso (ematomi,
seromi), da un’errata manipolazione dell’elettrocatetere (danni valvolari, microemboli, perforazione del seno coronario
o della parete miocardica, trombosi) o errata erogazione dell’energia in radiofrequenza (blocchi AV, attacchi ischemici
transitori). In ogni caso, la mortalità associata ad ablazione di una via anomala mediante elettrocatetere a radiofrequenza
risulta essere molto bassa (da studi effettuati in medicina umana 0-0,2%).
In linea generale, i pazienti con sindrome di WPW sintomatici, particolarmente quelli emodinamicamente instabili,
devono essere sottoposti ad ablazione della via anomala transcatetere mediante radiofrequenza. I pazienti con episodi di
tachicardia sopraventricolare minimamente sintomatici possono essere sottoposti ad una serie di trattamenti
farmacologici.
TERAPIA DELLE TACHICARDIE VENTRICOLARI
Tachicardie ventricolari che richiedono un trattamento. Un trattamento antiaritmico deve esitare in una marcata
riduzione dell’aritmia, del rischio di morte e in una completa abolizione dei segni e dei sintomi clinici. Bisogna inoltre
considerare gli effetti proaritmici che questi farmaci hanno, l’eventuale impatto sull’insufficienza cardiaca preesistente,
gli effetti collaterali a livello sistemico. Per questi motivi la terapia antiaritmica viene instaurata solamente quando il
soggetto è sintomatico.
In medicina veterinaria, le linee guida per il trattamento delle aritmie ventricolari sono:
Generalmente i complessi ventricolari prematuri non vengono trattati
La tachicardia ventricolare, specialmente se a frequenze di scarica elevate, viene usualmente trattata
Non tutte le tachicardie ventricolari sono considerate pericolose. In particolare, le tachicardie ventricolari con una
frequenza di scarica bassa (simile a quella del ritmo sinusale), non sostenute, con un lungo intervallo di accoppiamento
con il battito precedente, monomorfe sono considerate a basso rischio. Al contrario le tachicardie ventricolari
considerate a rischio elevato sono caratterizzate da: una frequenza elevata, ritmo sostenuto, breve intervallo di
accoppiamento, morfologia polimorfa. Anche l’anamnesi può aiutare nella classificazione di un’aritmia: un boxer con
episodi sincopali ed una tachicardia ventricolare sostenuta è ad alto rischio di morte improvvisa. Un pastore tedesco con
una tachicardia ventricolare non sostenuta polimorfa di età inferiore a 18 mesi è ad alto rischio di morte improvvisa,
mentre un pastore tedesco di età superiore a 18 mesi con complessi ventricolari prematuri è a basso rischio di morte
improvvisa.
Il trattamento di un’aritmia richiede un approccio sistemico. Innanzi tutto, l’aritmia deve essere chiaramente
documentata attraverso un ECG. Sarebbe ottimale l’esecuzione di un monitoraggio holter per valutare le caratteristiche
dell’aritmia e la frequenza. Deve essere effettuato un prelievo per valutare le concentrazioni plasmatiche degli elettroliti
(sodio, potassio, cloro, magnesio). Un’ipokaliemia può indurre o potenziare una tachicardia ventricolare.
Scelta dei farmaci da utilizzare.
Terapia acuta
Infusione continua endovenosa
Per preparare una soluzione per infusione endovenosa sono disponibili molteplici formule. Le due più usate sono
riportate di seguito:
Peso corporeo (Kg) x principio attivo (mg/Kg/min) x 0,36 = dose totale da somministrare per via endovenosa in 6 h
principio attivo (mg/Kg/min) x peso corporeo (Kg) = mg di principio attivo da aggiungere a 250 ml di fluidi
somministrati per via endovenosa ad una velocità di infusione di 15 ml/h
o LIDOCAINA
La lidocaina è il principio attivo più efficace per il trattamento in fase acuta delle tachicardie ventricolari con rischio di
morte o instabili. Iniziare il trattamento con un bolo endovenoso al dosaggio di 2,2 mg/kg sotto monitoraggio
elettrocardiografico. Ripetere se necessario il bolo al medesimo dosaggio con 5 minuti di intervallo fino ad una dose
massima di 8,8 mg/kg. Al fine di mantenere adeguati livelli ematici è necessario proseguire con una infusione
endovenosa costante. Dal momento che la lidocaina in infusione continua necessita di 3-6 ore per raggiungere adeguate
concentrazioni ematiche, è possibile che si renda necessario la ripetizione della somministrazione in bolo. Il dosaggio
della lidocaina in infusione continua è 25-80 mg/Kg/min.
o PROCAINAMIDE
La procainamide rappresenta il farmaco di seconda scelta da utilizzare in caso di tachicardie ventricolari refrattarie al
trattamento con lidocaina. La procainamide è da preferire alla chinidina per i suoi minori effetti gastrointestinali, non
prolunga l’intervallo QT, non interagisce con la digossina e non causa stati ipotensivi. La dose di somministrazione
corrisponde a 10-15 mg/kg in bolo in 1-2 minuti. In seguito la somministrazione deve proseguire in infusione continua
alla dose di 25-50 mg/kg/min.
o AMIODARONE
L’amiodarone somministrato per via endovenosa per il trattamento delle tachicardie ventricolari è stato recentemente
inserito nella pratica clinica. Gli effetti elettrofisiologici dell’amiodarone somministrato per via endovenosa sono molto
differenti rispetto alla somministrazione per via orale. L’amiodarone somministrato per via endovenosa a livello
sperimentale si è dimostrato efficace nelle tachicardie ventricolari e nella fibrillazione atriale alla dose di 10 mg/kg/h. in
caso di necessità di controllo di una tachicardia ventricolare, l’amiodarone può essere somministrato a 5 mg/kg in bolo.
o SOTALOLO
Il sotalolo viene somministrato per via endovenosa in medicina umana al dosaggio di 0,3 mg/kg. In medicina veterinaria
sono stati effettuati solamente studi preliminari sulla somministrazione di sotalolo per via endovenosa.
Terapia cronica
o PROCAINAMIDE-CHINIDINA
La procainamide viene solitamente preferita alla chinidina per la terapia cronica delle tachicardie ventricolari. Se non
viene ottenuto il controllo della tachicardia, è necessario effettuare il dosaggio plasmatico di procainamide (campiono di
sangue da prelevare 4-5 ore dopo la somministrazione orale).
o MEXILETINA
Alcuni clinici utilizzano la mexiletina come farmaco di prima scelta per il trattamento cronico delle tachicardie
ventricolari. Le sue proprietà elettrofisiologiche sono paragonabili a quelle della lidocaina. La mexiletina possiede
inoltre azione di depressione miocardica minore rispetto ad altri farmaci antiaritmici. Ad oggi, la terapia di tachicardie
ventricolari maligne è rappresentata dall’associazione fra mexiletina (4-8 mg/kg q8h PO) ed atenololo (0,5 mg/kg q1224h PO).
o BETA-BLOCCANTI
L’utilizzo di farmaci beta-bloccanti per il trattamento delle tachicardie ventricolari è stato introdotto in medicina umana
a causa della minor mortalità di pazienti in terapia con questi farmaci antiaritmici. La monoterapia con beta-bloccanti
può risultare inadeguata per il controllo dei battiti ectopici ventricolari, ma risulta efficace nel caso in cui la presenza di
battiti ectopici ventricolari e tachicardia ventricolari siano correlati ad elevati livelli serici di catecolamine. In campo
veterinario, sono presenti informazioni minime circa la somministrazione in monoterapia di farmaci beta-bloccanti per
il trattamento delle tachicardie ventricolari.
o AMIODARONE E SOTALOLO
In medicina veterinaria non esistono ancora trials clinici che definiscano l’efficacia di questi farmaci antiaritmici di
classe III. I risultati ad oggi disponibili forniscono risultati controversi probabilmente in relazione alla diversa patologia
trattata, alle diverse dosi utilizzate e ad un incompleto follow-up dei pazienti. Sperimentalmente, il sotalolo risulta
efficace nell’inibizione di tachicardie ventricolari catecolamino-dipendenti. In medicina umana, l’amiodarone ed il
sotalolo sono considerati farmaci di prima scelta per il trattamento delle tachicardie ventricolari. Purtroppo, però, le
patologie cardiache dell’uomo (aritmie associate ad ischemia miocardica) sono veramente rare nella specie canina e
risulta di conseguenza dubbio se questi farmaci dimostrino i medesimi effetti positivi in medicina veterinaria.