Trascrizione e maturazione degli RNA
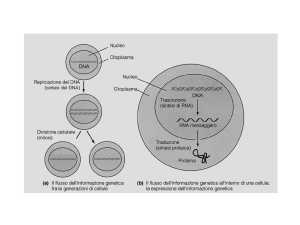
Trascrizione e traduzione: espressione dell’informazione genica
L’RNA veicola l’informazione genica contenuta nel DNA (nucleo) in modo che possa esprimersi
•per dare proteine (mRNA)
•funzionare direttamente in attività correlate all’espressione genica/sintesi proteica (tRNA e
rRNA)
•svolgere funzioni varie (ribozimi, small RNA, micro RNA, …)
L’RNA è sintetizzato a partire dal DNA nel processo della trascrizione
Enzima coinvolto: RNA polimerasi DNA-dipendente;
un tratto di filamento di DNA (“gene”) funziona da stampo
Vengono incorporati nella catena di RNA nascente dei ribonucleosidi
attivati in forma trifosfato (ATP, CTP, GTP, UTP) direzione 5’3’
prima di niziare la trascrizione l’RNA polimerasi riconosce e lega un sito del
DNA: promotore
RNA polimerasi avanzando sul DNA inserisce ribonucleotidi complementari allo
stampo (DNA ss) sulla catena nascente di RNA (direzione 5’3’)
La doppia elica DNA si riforma a valle della RNA polimerasi (regione ibrida RNADNA limitata a pochi nucleotidi)
L’RNA resta associato all’enzima durante tutta la trascrizione
Nei batteri la RNA polimerasi è di un solo
tipo ed è formata da varie subunità
proteiche
Il riconoscimento del promotore è mediato
dalla subunità σ
Il promotore presenta sequenze conservate
(consenso) a – 35 e -10 bp dal sito di inizio
di trascrizione
Fasi della trascrizione
procariotica
•Riconoscimento del promotore
•Inizio trascrizione ed
allungamento
•Terminazione determinata da
fattore ρ dissociazione
dell’enzima dallo stampo e
dall’mRNA
•Nei batteri gli mRNA possono
essere policistronici: portano
informazione per più polipeptidi
(o rRNA o tRNA) sullo stesso
trascritto
La terminazione può essere indotta
da strutture stem and loop che
rallentano la RNA pol
In alcuni casi terminazione
indipendente da fattore rho
A volte l’RNA pol ha bisogno di un attivatore per potersi legare al promotore
Maturazione dei trascritti procariotici
mRNA maturazione quasi assente traduzione contemporanea a trascrizione (solo
in Archea fenomeni di splicing)
tRNA e rRNA maturazione mediante taglio di precursori
Negli eucarioti l’apparato di trascrizione è + complesso
3 enzimi che riconoscono promotori diversi e sintetizzano classi diverse di RNA
RNA pol II è formata da un “core” (con attività polimerasica ) e da varie
subunità che agiscono di concerto per riconoscere il promotore, legare il
DNA e srotolarlo.
Sul promotore viene riconosciuta in particolare la seq TATA box
Altre sequenze a monte (anche 200 nt al 5’) possono attivare o inibire la RNA
pol mediante interazione con coattivatori o corepressori
Altre sequenze ancora più a monte possono attivare/inibire trascrizone (enhancer)
Es: il coattivatore CBP induce la
trascrizione di tutti i geni con seq
attivatrice CREB ( cAMP
responsive element)
Trascrizione di geni controllata
da livelli intracellulari di cAMP
Terminazione di trascrizione
RNA pol II ed altri fattori tagliano l’mRNA a valle del sito di
poliadenialzione rilascio dell’mRNA, degradazione del segmento di RNA
3’ e dissociazione di RNA pol II dallo stampo
Maturazione dei trascritti eucariotici
trascritto primario o pre-mRNA (hnRNA)
•Capping
•Metilazione
•Poliadenilazione
•Splicing
•Editing
mRNA maturo
NUCLEO
La maturazione degli RNA è cotrascrizionale
Capping
L’aggiunta del CAP di metil guanosina (GMP) al 5’P dell’mRNA ne
protegge l’estremità evitando degradazione da parte di ribonucleasi e
lo posiziona correttamente sul ribosoma durante traduzione
Poliadenilazione
aggiunta di 30-200 adenosine (AMP) al 3’OH dell’mRNA
Stabilizza l’RNAm
La poliAdenilazione avviene a valle di sequenza specifica riconosciuta
da vari fattori, subito dopo il taglio che termina trascrizione
Splicing
Rimozione di sequenze prive di significato
(non codificanti) o «introni» e risaldatura degli
esoni
•I componenti dello splicesoma riconoscono
siti di giunzione esone/introne/esone
•Tagliano al 5’ per dare struttura a cappio
(lariat)
•Taglio al 3’ dell’introne eliminazione
e risaldatura tra i 2 esoni
Splicesoma= complesso di proteine e
snRNA snRNP: small nuclear
ribonucleoprotein particle probabilmente
ribozimi
NB in alcuni casi si ha self-splicing introne è
ribozima
RNA Editing
Cambiamento nella seq dell’mRNA a livello post-trascrizionale:
aggiunta-delezione di nt o cambiamento di basi azotate (UC)
•Tipico di geni mitocondriali e di cloroplasti
•Richiede stampi di RNA guida (gRNA) originati da introni
Es editing tessuto specifico del mRNA per apoliporoteinaB
(ApoB)
Sunto dei vari step di maturazione di mRNA eucariotico
Durante maturazione da
hnmRNA ad mRNA
accorciamento
Solo gli mRNA maturi lasciano il nucleo:
selezione a livello del poro nucleare
Maturazione degli rRNA eucariotici
•rRNA 28S, 18S, 5,8S derivano da singolo precursore trascritto da RNA pol I
gene ripetuto in tandem centinaia di volte nella zona NOR zona fibrillare del nucleolo
, attivamente trascritta in alcune fasi della vita cellulare
•rRNA 5S invece trascritto da RNA pol III – cluster di geni ripetuti fuori dal nucleolo e
diverso precursore
Maturazione del precursore di rRNA 28S, 18S, 5,8S
•Modificazione di nucleotidi (metilazione e sostituzione di U con Ψ) mediata
da snoRNA
•Associazione con proteine ribosomali
•eliminazione degli spaziatori intragenici
Maturazione dei tRNA eucariotici
Trascritti da RNA pol III che riconosce promotore interno al gene (su
tratto codificante)
•geni organizzati in cluster
•Precursori con geni singoli sono accorciati al 5’ e 3’, subiscono
modificazione di basi ed eventuale splicing
•La maturazione dei pretRNA coinvolge il ribozima RNasiP
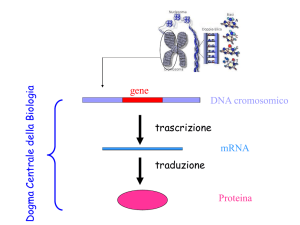
CONCETTO DI GENE
•anni ’40: esperimenti di Beadle & Tatum
Si determina la relazione tra geni ed enzimi grazie a ricerche su alcuni ceppi della
muffa del pane (NEUROSPORA ) definiti «mutanti nutrizionali».
ALTERAZIONE DNA DIFETTO PROTEINA DIFETTO DI CRESCITA
Un gene un enzima
•Un gene un polipeptide
Sono possibili varie definizione di gene!!
1) Il gene è una sequenza di DNA contenente l’istruzione per la produzione
di un polipeptide (fornisce cioè le istruzioni per la sintesi proteica) (questa
definizione non tiene conto dei geni per tRNA, rRNA , ribozimi e small RNA)
2) Il gene è un’unità trascrizionale (questa definizione esclude le seq regolatrici e
la possibilità che gene dia più prodotti mediante splicing e/o inizi/fine di
trascrizione alternativi)
3) Gene: segmento di DNA contenente un’informazione, non sempre univoca
4) Gene: unità ereditaria
Elementi fondamentali di un gene:
•promotore e regioni regolative,
•tratto codificante,
•terminatore di trascrizione
Negli eucarioti il tratto codificante è “interrotto” da introni!! genomi +ampi
Nei procarioti + geni sono trascritti insieme ( mRNA policistronici)
The sequence of a
prokaryotic proteincoding gene is colinear
with the translated mRNA;
that is, the transcript of
the gene is the molecule
that is translated into the
polypeptide.
The sequence of a
eukaryotic protein-coding
gene is typically not
colinear with the
translated mRNA; that is,
the transcript of the gene
is a molecule that must be
processed to remove extra
sequences (introns)
before it is translated into
the polypeptide.
Il codice genetico stabilisce la corrispondenza tra seq nucleotidica (DNA RNA) e
seq. aminoacidica (proteine)
Il codice si basa triplette di basi: CODONI le istruzioni che specificano la
sequenza di amminoacidi di un polipeptide sono scritte nel DNA (e sull’mRNA)
come codoni
64 combinazioni possibili vs 20aa
Seconda base azotata
Prima base azotata
Quasi tutti gli organismi (dai
batteri alle piante agli animali)
condividono lo stesso codice
genetico.
A
G
Cys U
C
UUU
UUC
Phe UCU
UCC
UUA
UCA
UAA Stop
UGA Stop
A
UUG
UCG
UAG Stop
UGG Trp
G
CUU
C CUC
CUA
CUG
CCU
CCC
CAU
CAC
His
CGU
CGC
U
CCA
CCG
CAA
CAG
CGA
Gln CGG
ACU
ACC
AAU
AAC
Asn AGU
AGC
Ser
ACA
ACC
AAA
AAG
Lys AGA
AGG
Arg A
G
GCU
GCC
GAU
GAC
Asp GGU
GGC
U
Il codice genetico è universale!
C
AUU
A AUC
AUA
Piccole differenze solo per geni
mitocondriali e per alcuni
protozoi, funghi
Leu
Leu
Ile
o
AUG Met
inizio
G
GUU
GUC
GUA
GUG
Val
Ser
Pro
Thr
Ala
UAU
UAC
GCA
GAA
GCG
GAG
Tyr UGU
UGC
Arg
C
A
G
Glu GGA
GGG
U
C
U
Gly C
A
G
Terza base azotata
U
Gli esperimenti di Brenner e Crick su fagi mutanti hanno definito le
proprietà principali del codice genetico
Basato su triplette di basi (perché
inserzioni/delezioni multiple di 3 generalm.
non alterano/compromettono significato
genico)
Non sovrapposto (perché mutazioni di
singoli nt cambiano significato di un solo aa)
Continuo senza virgole (perché mutazioni
per inserzione/delezione di basi provocano
slittamento della fase di lettura a valle del
sito mutato)
Degenerato: con più codoni codificanti
per lo stesso aa, ma non ambiguo in q.
ad ogni codone corrisponde un solo aa
(altrimenti nel tratto mutato i codoni di stop
sarebbero molto frequenti) degenerazione
evidente sulla terza base
Il codice è stato decifrato grazie ad esperimenti di sintesi proteica in vitro
usando come stampo RNA sintetici a sequenza nota
•Il messaggio sull’mRNA è letto
in direzione 5’3’
•il polipeptide è sintetizzato
in direzione NH2 COOH (esp di Dintzis)
Il codice genetico mette in relazione seq nucleotidica con seq amminoacidica
Questo codice molecolare consente di decifrare/tradurre in sequenza
aminoacidica l’informazione genetica del DNA
Filamento da trascrivere
T
A
C
T
T
C
A
A
A
A
T
C
A
T
G
A
A
G
T
T
T
T
A
G
U
A
G
DNA
Trascrizione
5’
A
U
G
A
A
G
U
U
U
mRNA
Codone
di inizio
Codone
di arresto
Traduzione
Polipeptide
NH2
Met
Lys
Phe
COOH
3’
La traduzione:
trasferimento dell’informazione genetica
dall’RNA alle proteine
– Il messaggio sull’mRNA è tradotto in sequenza amminoacidica
– avviene nel citoplasma sui ribosomi (gli organuli che
coordinano le operazioni necessarie per passare dalle
sequenze nucleotidiche alle catene polipeptidiche).
L’apparato di traduzione comprende ribosomi e tRNA che
interagiscono con l’mRNA per tradurlo in polipeptide
I ribosomi sono complessi formati da rRNA e proteine: rRNA componente
strutturale e catalitica più importante
Ricerche recenti indicano che gli rRNA hanno attività catalitica (ribozimi)
70S
80S
Le subunità ribosomali si pre-assemblano nella regione granulare del nucleolo
Le subunità magg e min si associano solo durante sintesi proteica
Nobel 2009 Chimica
a scienziati che hanno studiato la
struttura 3D dei ribosomi
applicazioni quali disegno di nuovi
antibiotici
Nobel 2009 Chimica
a scienziati che hanno studiato la struttura 3D dei ribosomi
applicazioni quali disegno di nuovi antibiotici
Il ribosoma ha 4 siti di legame per RNA : 3 per tRNA (E,P, A) e 1 per mRNA
Le due subunità associandosi formano un tunnel nel quale scorre l’mRNA in
traduzione (direzione 5’-3’)
La subunità maggiore ha attività peptidil-trasferasica (forma legami peptidici tra
aa portati dai tRNA) dovuta ad rRNA23S
Subunità minore offre piattaforma di appaiamento tra tRNA e mRNA
tRNA
È un «adattatore»: lega da un lato l’aa (3’OH) dall’altro il codone sull’mRNA
(anticodone) 2 regioni cruciali
Si ripiega su se stesso e ha 4 regioni di appaiamento interno (doppia elica)
Struttura simbolica
a trifoglio
Struttura 3D ad “L”
Il tRNA interagisce con il messaggero a livello del suo anticodone che si
appaia con il codone complementare sul mRNA
La terza base dell’anticodone è spesso vacillante (wobble) in q puo’ non
essere determinante/stringente per l’appaiamento sul codone
Vacillamento: la terza base dell’anticodone (al 5’) si può
appaiare con più di un nucleotide
2 codoni (mRNA) diversi solo per terza base e specificanti stesso
aminoacido possono usare/essere riconosciuti dallo stesso tRNA
stesso aa inserito
Enzima aminoacil-tRNA sintetasi lega specifico aa al 3’OH del sito accettore sul
tRNA corrispondente (la reazione consuma ATP)
Di regola esistono almeno 20 enzimi (1 per aa), ma numero varia tra le specie
Ridondanza del codice wooble: stesso tRNA (aa) riconosce vari codoni
più tRNA (anticodoni) per stesso aa
L’enzima aatRNA sintetasi riconosce il tRNA grazie a seq nt specifiche sul tRNA
Le 3 fasi della traduzione
Inizio: riconoscimento del codone di inizio ed assemblaggio componenti
(ribosoma, tRNA e mRNA)
Elongazione: sintesi della catena polipeptidica e scorrimento del ribosoma
sull’ mRNA
Terminazione: codone di stop e dissociazione tra mRNA, ribosoma e
polipeptide
Inizio traduzione
nei procarioti
•IF-1-2-3 si legano a subunità minore
•Legame di tRNA iniziatore (formil-Met)
•mRNA si posiziona su subunità minore
grazia appaiamento tra seq Shine-Dalgarno
e rRNA 16S
•Idrolisi di GTP e associazione di subunità
maggiore
in eucarioti altri IF legano subunità minore;
riconoscimento del 5’ su mRNA grazie a
CAP e scorrimento verso 3’ fino a primo
AUG
Un aatRNA entra in A e si forma il primo legame peptidico (attività peptidil
transferasi di subunità maggiore)
Elongazione in 4 step: 1) un nuovo aatRNA (scortato da Eftu) si posiziona in A grazie a
riconoscimento codone-anticodone;2) la catena polipeptidica in P (C terminale) si lega all’
aa del tRNA in A; 3) subunità maggiore scivola ; 3) subunità minore scivola avanti (vs 3’) di
un codone e si libera A il tRNA scarico passa in E si dissocia
Il ciclo di elongazione si ripete più volte
per inserire altrettanti aa
Terminazione
•Il codone nonsenso (stop) è riconosciuto da fattori di rilascio
•La catena polipeptidica si stacca dal tRNA liberando stremità C; subunità
ribosomali si dissociano
•Consumo di GTP
Lo stesso mRNA viene “letto “ contemporaneamente da più ribosomi
che scorrono verso il 3’ poliribosoma
Le cellule hanno sistema di sorveglianza
che degrada mRNA prodotti da geni con
mutazioni non senso premature
Il complesso EJC resta associato
all’mRNA fino a suo I° ciclo di traduzione
Se questa si interrompe prematuramente
(mutazione nonsenso:STOP) EJC resta
attaccato a mRNA segnale di
degradazione dell’mRNA
Nei procarioti trascrizione e traduzione sono contemporanee e avvengono in
contiguità spaziale
In eucarioti trascrizione e traduzione sono fasi distinte temporalmente e
spazialmente
Differenze nella traduzione eucariotica
Nella fase di inizio il posizionamento sul mRNA si basa sul cap e meccanismo
di “scansione” dell’mRNA fino a trovare il primo AUG (all’interno della seq
Kozak)
Molti + fattori di inizio coinvolti
mRNA monocistronici vs mRNA policistronici tipici di batteri
Le differenze nel processo di traduzione eucariotica e procariotica sono alla
base dell’uso di farmaci antibatterici selettivi
Molti antibiotici funzionano come inibitori della sintesi proteica batterica
(di origine fungina, perché i funghi occupano stesse nicchie ecologiche dei
batteri e competono con questi)
Ripiegamento, maturazione e traffico delle proteine
Prima di svolgere la sua funzione
biologica il polipeptide deve
ripiegarsi correttamente e, a volte,
subire modificazioni chimiche
specifiche
(legame cofattori, acetilazione,
metilazione, glicosilazione,
fosforilazione, aggiunta di lipidi,
associazione subunità).
Il ripiegamento/folding
proteico può essere assistito
da altre proteine chaperon
Molti chaperon altamente
conservati tra procarioti ed
eucarioti si attivano in
condizioni di shock termico
(HSP)
Alcune patologie neurodegenerative
ripiegamento proteico difettoso
derivano
da
Es Alzheimer, Parkinson, derivano da accumulo di fibrille amiloidi
(depositi di proteine insolubili malripiegate) morte neuroni
Hungtington disease: aggregati proteici di proteina misfolded a
causa di mutazione genica
Malattia da prioni: neurodegenerazione dovuta
ad accumulo di proteina PrP malripiegata
Nella encefalopatia spongiforme le
proteine PrP malripiegate assunte con
l’alimentazione inducono alterazione
strutturale delle PrP endogene in una
reazione a catena
Unico caso noto di agente”infettivo” di
natura proteica