FISICA-TECNICA
Miscela di gas e vapori.
Igrometria
Katia Gallucci
La teoria cinetica della materia
Tra le particelle (atomi, molecole, ioni) che formano le
varie sostanze esistono sempre delle forze, dette forze
di coesione, che tendono a legarle le une alle altre.
L'entità di tali forze, e dunque l'energia con cui le
particelle sono legate tra loro, dipende dalla natura del
legame chimico che intercorre tra di esse.
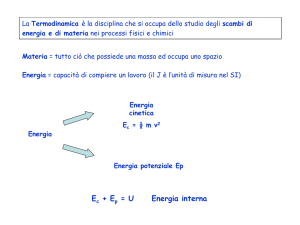
In aggiunta all'energia di coesione, tutte le particelle che
formano la materia possiedono anche un'energia
cinetica, ovvero di movimento, che non dipende dal
legame chimico tra di esse, ma unicamente dalla
temperatura. L'energia di movimento, facendo agitare le
particelle, tende a farle allontanare tra loro, fenomeno
dimostrato anche dal fatto che, all’aumentare della
temperatura, tutti i corpi si dilatano. Lo stato fisico
assunto dalla materia dipende in definitiva da quale delle
due forme di energia (di coesione oppure di movimento)
prevale sull'altra.
Spesso è necessario variare il contenuto di vapore
presente in una corrente gassosa. Lo studio di come si
possono realizzare queste variazioni di contenuto di
vapor d’acqua nei gas costituisce l’oggetto
dell’igrometria.
Le grandezze interessate nei processi di umidificazione
e deumidificazione sono l’umidità assoluta, l’umidità
relativa e l’umidità di saturazione
Stato solido: l'energia di coesione è nettamente
prevalente su quella di movimento, così che le particelle
sono strettamente legate le une alle altre, tanto da
occupare delle posizioni fisse nello spazio. Il movimento
è limitato a piccole oscillazioni intorno a queste posizioni.
I solidi hanno pertanto volume e forma propri.
Stato liquido: L'energia di coesione prevale ancora su
quella di movimento, ma in modo meno netto che nei
solidi. Le particelle del liquido possono scorrere le une
sulle altre, variando così la forma generale del liquido,
ma rimanendo però sempre a contatto tra loro e circa
alla stessa distanza. I liquidi hanno dunque volume
proprio, perché le particelle non possono essere ne'
avvicinate né allontanate tra loro, ma assumono la forma
del recipiente che li contiene.
Stato gassoso: l'energia cinetica prevale su quella di
coesione e le particelle sono del tutto separate le une
dalle altre e libere di muoversi in tutto lo spazio a loro
disposizione. I gas non hanno quindi né forma né
volume proprio, risultando comprimibili.
Passaggi di stato
Qualunque sostanza, al variare della temperatura, può
passare da uno all’altro dei tre stati della materia.
All'aumentare della temperatura le particelle di un solido
oscillano in modo più ampio intorno alle loro posizioni fisse.
Ad una data temperatura, che è caratteristica di ogni sostanza
e che alla pressione di una atmosfera prende il nome di
temperatura normale di fusione, la sostanza solida passa
allo stato liquido, ove le particelle, pur essendo ancora legate
tra di loro, hanno la possibilità di scivolare le une rispetto alle
altre. Tale fenomeno prende il nome di fusione. Aumentando
ancora la temperatura, e dunque l'energia di movimento delle
particelle, queste si separano le une dalle altre, vincendo le
forze di coesione, e passano allo stato gassoso. Quest'ultimo
fenomeno prende il nome di evaporazione.
Il fatto dunque che una certa sostanza, ad una data
temperatura e quindi per una data energia di
movimento delle sue particelle, sia solida, liquida o
gassosa, dipende dalla forza di coesione tra le sue
particelle medesime.
Seguendo il percorso inverso a quello sin qui descritto,
ovvero raffreddando un gas, si riduce l'energia di
movimento delle sue particelle fino al punto in cui il gas
non passerà allo stato liquido. Tale fenomeno prende il
nome di condensazione o liquefazione. Raffreddando
ancora il liquido, ad una certa temperatura, ovviamente
uguale a quella di fusione, questo passerà allo stato
solido. Quest'ultimo processo prende il nome di
solidificazione.
L'evaporazione di un liquido può avvenire a varie
temperature; è infatti noto che, in misura maggiore o
minore, l'acqua evapora sempre da un recipiente tenuto
aperto. In quest'ultimo caso però l'evaporazione avviene
solo alla superficie del liquido. Esiste invece una
temperatura, caratteristica di ogni sostanza, e che, alla
pressione di un'atmosfera, prende il nome di
temperatura normale di ebollizione, alla quale
l'evaporazione avviene anche all'interno del liquido. Tale
fenomeno si dice appunto ebollizione. Infatti le bolle che
si formano nell'acqua in ebollizione sono proprio bolle di
vapore acqueo che si forma all'interno del liquido stesso.
Poiché nell'ebollizione le particelle si separano le une
dalle altre, la temperatura normale di ebollizione di una
sostanza può essere presa come misura della forza di
coesione esistente tra le sue particelle.
Il passaggio di stato che conduce direttamente dallo
stato solido a quello gassoso prende il nome di
sublimazione. Un esempio di sostanza che sublima è
rappresentato dalla naftalina. Anche il passaggio di stato
inverso, ovvero quello che conduce direttamente dallo
stato gassoso a quello solido, prende il nome di
brinamento, proprio perché ne è un esempio la
formazione degli aghetti di ghiaccio della brina, che si
formano di notte nei campi, direttamente dal vapor
acqueo presente nell'aria.
Richiami
Definizione: il gas perfetto (o ideale) è un modello per
rappresentare i gas reali, caratterizzato dall’avere le
molecole così distanti tra loro da non interagire (tranne
che nel caso di urti praticamente elastici); ovvero,
caratterizzato dal possedere una densità abbastanza
bassa.
Per i gas perfetti vale la legge:
pV=nRT
dove:
p è la pressione
V è il volume
n è il numero di moli
R = 8,31J/(mol*K) è la costante universale del gas ideale
T è la temperatura espressa in K
Miscele di gas perfetti: definizioni
Volume totale (legge di Amagat-Leduc): V= Σivi
Volume parziale (vi ): è quello che esso occuperebbe da
solo se fosse sottoposto alle stesse condizioni di
pressione e temperatura della miscela.
Energia interna della miscela: l’energia interna della
miscela è data dalla somma delle energie interne dei
componenti:
E= ΣiEi
Energia interna specifica della miscela: e= Σixiei
Entalpia della miscela: H= ΣiHi
Entalpia specifica della miscela: h = Σi xi hi
Calori specifici della miscela a pressione e a volume
costante:
cp= Σi xi cpi
cv= Σi xi cvi
Massa totale: M=Σi Mi, dove Mi è la massa del
componente i-esimo.
Massa molare: mi=Mi/ni
Massa molare equivalente della miscela: m=
Σimi*ni/n=ΣiMi mi
Frazione massica del componente i-esimo: xi =Mi/M, o
anche xi= Mi mi /m.
Pressione totale (legge di Dalton): la pressione totale di
una miscela eguaglia la somma delle pressioni parziali
dei singoli componenti: P = ΣiPi
Pressione parziale: la pressione parziale di un
componente è la pressione alla quale esso sarebbe
sottoposto se occupasse da solo tutto il volume V alla
temperatura T.
Sperimentalmente si può verificare che se si pone del
liquido in un recipiente chiuso riempiendolo solo
parzialmente, una parte del liquido evapora e si miscela
con il gas che riempie la parte superiore del recipiente.
Dalla termodinamica sappiamo che il processo si arresta
quando la pressione del vapore eguaglia la tensione di
vapore del liquido a quella temperatura, ossia quando si
raggiunge la pressione di saturazione
Miscele gas-vapore
Si definiscono miscele gas-vapore i sistemi
pluricomponenti, che – al variare di temperatura e
pressione entro determinati intervalli – risultano costituiti
da componenti incondensabili o gas e da componenti
condensabili o vapori.
La differenza fondamentale tra le miscele tra gas e
quelle tra gas e vapori è la seguente:
Per le miscele tra gas la composizione non varia al
variare della temperatura.
Per le miscele tra gas e vapori una variazione della
temperatura può portare (secondo che sia in
aumento o in diminuzione) all'ulteriore evaporazione
del liquido presente o alla condensazione di parte
del vapore presente nella miscela.
L’aria che respiriamo, è una miscela che contiene
numerosi composti gassosi, vapor d’acqua e vari
inquinanti
Essa può essere assimilata a un sistema bicomponente
di aria secca e vapor d’acqua, assumendo così il nome
tecnico di aria umida.
Aria secca è l’aria atmosferica privata di tutti i vapori e
agenti inquinanti; l’aria secca è assimilabile a un gas di
composizione costante, dato che il condensato, in
pratica, non scioglie i componenti incondensabili
dell’aria.
Vapor d'acqua è la quantità d’acqua presente nella
miscela allo stato di vapore; essa varia da zero fino a un
massimo che dipende dalla temperatura e dalla
pressione; il contenuto massimo corrisponde alla
saturazione.
Ai fini della nostra trattazione sia l’aria secca che il
vapore possono essere considerati gas perfetti.
La massa molecolare dell’aria secca - ovvero la media
ponderata della massa molecolare di tutti i componenti –
è
mas=28,96 kg/kmole
La costante universale dei gas per l’aria secca è
Ras=287,4 J/kgK
La massa molecolare del vapor d’acqua è
mv=18 kg/kmole
La costante universale dei gas per il vapor d’acqua è
Rv=462 J/kgK
Umidità assoluta
L’umidità assoluta esprime i kg di vapore associati ad
1kg di gas secco (X)
Pv = pressione parziale del vapore
Pas= pressione parziale dell’aria secca
Pv+Pas=PT
nv = moli di vapore nel miscuglio
nas = moli di gas nel miscuglio
nt=nv+nas
n
n
Pv = v PT ; Pas = as PT
nt
nt
moltiplicando per i pesi molecolari del vapore e del gas
secco si ha:
nv PM v
Pv PM v
Pv
kg di vapore
=
= 0, 622
=
=X
nas PM as ( PT − Pv ) PM as
( PT − Pv ) kg di aria secca
Umidità di saturazione:
Ad una data temperatura, quando la pressione parziale
del vapore presente nel miscuglio eguaglia la tensione di
vapore del liquido, allora si dice che il gas ha un
contenuto di umidità pari a quella di saturazione.
Pv nv
Pv
= =
Pas nt PT − Pv
Pertanto, l’umidità di saturazione (X0) si formula
analogamente all’umidità assoluta, solo che in luogo dei
Pv si mette la tensione di vapore che il liquido ha alla
temperatura cui si fa la determinazione dell’umidità:
X0 =
Ps PM v
( PT − Ps ) PM as
Umidità relativa:
L’umidità relativa (Xr) è il rapporto percentuale tra umidità
assoluta e umidità di saturazione valutate alla stessa
temperatura
Xr =
P
X
⋅100 = v ⋅100
X0
Ps
La tensione di vapore di un liquido si può calcolare con
la relazione di Antoine
ln Ps = A −
B
T +C
dove per l’acqua A=18,3036; B=3814,44; C=-46,13
T= temperatura in K
Esempio
Calcolare l’umidità di saturazione dell’aria alla
temperatura di 40°C
X0 =
Ps PM v
( PT − Ps ) PM as
ln Ps = 18,3036 −
X0 =
381, 44
= 55, 2 mmHg
( 273,15 + 40 ) − 46,13
55, 2 mmHg ⋅18
kg di vapore
= 0, 049
kg di aria
( 760 − 55, 2 ) mmHg ⋅ 29
L’entalpia dell’aria umida (essendo considerabile come
miscela di gas perfetti) è
H=Mashas+Mvhv
Essendo l’entalpia definita a meno di una costante, lo
stato di riferimento è convenzionalmente fissato (per
acqua e aria) a t=0°C e alla pressione atmosferica.
Inoltre l’entalpia viene riferita a 1kgas (di aria secca):
h=H/Mas=(Mas/Mas)has+ (Mv /Mas) hv
dove:
has=cpas*t=1*t[kJ/kgas]=0,24*t[kcal/kgas]
hv= r+cpv *t=2501,6+1,9*t [kJ/kgv]=595+0,48*t[kcal/kgv]
r è il calore di evaporazione medio dell’acqua.
L’entalpia della miscela vale pertanto:
h=1*t+X(2500+1,9t) [kJ/kgas]
=0,24*t+X(595+0,48*t) [kcal/kgas]