Timeoutintensiva.it, 9: Technè, Dicembre 2008
MUTAGENESI AMBIENTALE
PROF. MATRANGA URANIA*
PROF. PELI MILENA**
*Docente di Microbiologia e Biotecnologia presso IPC Golgi
di Brescia,
** Laboratorio di microbiologia IPC Golgi di Brescia
*,**:docenti-ricercatori per laboratori didattici presso
IFOM ( Fondazione Istituto FIRC di oncologia molecolare)
GIUGNO 2007
1
MUTAGENESI AMBIENTALE
Si definisce mutagenesi ambientale una disciplina molto vasta e in continua evoluzione che nasce dalla genetica;
attualmente è collegata a diversi settori scientifici quali: la Medicina, l'Ecologia, la Chimica e la Fisica. Tale disciplina
studia i meccanismi molecolari e biochimici responsabili di mutazioni spontanee nel DNA o prodotte da agenti chimici o
fisici e le loro conseguenze
La mutagenesi ambientale nasce all’inizio del 1900 con la scoperta della genetica moderna ed ebbe un forte impulso durante
le guerre in seguito alla scoperta di effetti negativi genetici
di alcune sostanze chimiche.
In Italia il settore classico di applicazione è la tossicologia genetica.
Infatti l'utilizzo dei cosiddetti “test di Mutagenesi” (test che rilevano a vari livelli il danno al DNA), è divenuto obbligatorio
per legge per lo screening preventivo e l'autorizzazione all'immissione sul mercato di sostanze di nuova sintesi, in specifico
per i farmaci.
Un campo in forte espansione, inoltre, è quello dell'eco-tossicologia genetica (eco-genotossicologia): ovvero l'applicazione
dei test di mutagenesi specie “a breve termine” (per cui il rapporto costo/benefici è assolutamente favorevole) alla
rilevazione di sostanze potenzialmente mutagene presenti spesso in miscele complesse nell'ambiente di vita sia esterno
(outdoor) (aria, acqua, suolo etc) che interno (indoor) (aree abitative o ambienti di lavoro)
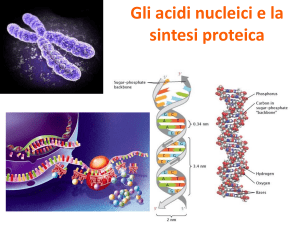
STRUTTURA DEL DNA
La funzione del DNA è quella di contenere tutte le informazioni necessarie per la vita di una cellula, tale funzione è resa
possibile dalla sua composizione chimica e dalla sua struttura molecolare
Il DNA (acido deossiribonucleico) è un polimero costituito da monomeri : i nucleotidi.
Ogni nucleotide è costituito da tre parti:
• un gruppo fosfato
• uno zucchero a 5 atomi di C (il deossiribosio)
• da una base azotata ( una molecola che contiene azoto)
Le basi azotate contenute nel DNA sono di quattro tipi:
Adenina (A)
Citosina (C )
Guanina (G)
Timina (T)
La molecola del DNA ha una struttura particolare, descritta per la prima volta da James Watson e Francis Crick, infatti essa
è costituita da due filamenti avvolti in senso orario e antiparalleli in modo da formare una spirale costituita dal fosfato
legato allo zucchero legato a sua volta alla base azotata.
I due ricercatori scoprirono, inoltre che le basi azotate si “accoppiano” sempre nello stesso modo: l’adenina (A) si appaia
solo con la timida (T) e la citosina (C) solo con la guanina(G); per questo appaiamento caratteristico si dice che le basi
azotate sono complementari
2
Credit:academic.brooklyn.cuny.edu
MUTAZIONI
Le mutazioni sono cambiamenti nel materiale genetico che un individuo o una cellula trasmettono ai propri
discendenti. La mutazione è l’evento responsabile della comparsa di caratteri nuovi e rappresenta la base della
variabilità genetica dell’adattamento genetico di una popolazione al cambiamento delle condizioni ambientali. In
generale si usa definire la mutazione come un evento casuale, raro e improvviso in quanto la probabilità che un
gene possa mutare è piuttosto bassa( tra1/104 e 1/109 ) e inoltre il cambiamento può avvenire in un qualsiasi
punto del genoma in maniera assolutamente casuale.
Le mutazioni avvengono con le stesse modalità in tutti gli esseri viventi, tuttavia negli organismi pluricellulari il
fatto che le mutazioni avvengano in cellule somatiche o in cellule germinali può avere conseguenze ben diverse.
Le mutazioni che avvengono nelle cellule somatiche si manifesteranno solo in alcuni casi, per esempio solo se si
tratta di mutazioni dominanti ( le recessive si manifestano in omozigosi), oppure se avvengono in uno stadio
dello sviluppo o in un tessuto/organo che richiede l’espressione del gene che ha subito la mutazione.
Le cellule germinali rappresentano le cellule che danno origine ai gameti; se una mutazione compare nel DNA
dei gameti e questi partecipano alla fecondazione, tutte le cellule dell’embrione derivante conterranno quella
mutazione. Analogamente un individuo che ha ereditato una mutazione germinale può trasmetterla ai discendenti
delle generazioni successive.
Le mutazioni si dividono in :
1 mutazioni puntiformi
2 mutazioni cromosomiche
3 mutazioni cariotipiche
1. Le mutazioni puntiformi consistono in un cambiamento nella sequenza di una base azotata nel DNA. Il
verificarsi di una mutazione può essere riconosciuto dalle modificazioni che si osservano dal fenotipo. Certe
mutazioni, dette silenti,non hanno alcun effetto sul fenotipo e perciò passano inosservate. Ciò può accadere,
quando si verifica una delle seguenti condizioni:
• la mutazione avviene in una porzione di DNA che non codifica per una proteina e non partecipa ad
eventi di regolazione dell’attività genica
• la mutazione avviene in un gene che controlla la sintesi di una proteina le cui funzioni sono ridondanti
nella cellula (e possono essere espletate da altre proteine)
• il gene mutato non si esprime
• la mutazione porta alla formazione di una nuova tripletta che codifica per lo stesso amminoacido
• la tripletta, che si forma in seguito a mutazione, codifica un amminoacido diverso (ma appartenente alla
stessa classe identificata per caratteristiche chimico-fisiche) che però non altera la funzione della
proteina
• la mutazione viene soppressa da un’altra mutazione
3
Credit: Genomes, Capitolo 14, Figura 11
Le mutazioni che riguardano il cambiamento di una sola base possono essere:
• sostituzioni: può avvenire per un errore di appaiamento delle basi durante la duplicazione del DNA, una
purina può essere sostituita da un’altra purina o una pirimidina da un’altra pirimidina (transizione);
oppure una purina sostituisce una pirimidina o una pirimidina sostituisce una purina (transversione). Se
la sostituzione di una base ha come effetto la formazione di una tripletta che codifica un amminoacido
diverso la mutazione viene detta missense, se invece la nuova tripletta non codifica alcun amminoacido,
la mutazione è detta nonsense. Con la mutazione missense, la proteina prodotta differisce da quella
normale in un amminoacido. Con effetti a seconda dei casi più o meno dannosi; con la mutazione
nonsense invece,si ha l’interruzione della catena polipeptidica in corrispondenza della tripletta nonsense.
• inserzione o perdita :in questo caso si verifica l’aggiunta o la perdita di una base azotata che determina
lo scivolamento della lettura del codice, le triplette da quel punto in avanti cambiano con conseguente
produzione di una proteina alterata; queste mutazioni si chiamano raeding frame shift (o scivolamento
della fase di lettura). Nella maggior parte dei casi lo scivolamento della fase di lettura porta a
interruzione della catena polipeptidica per presenza di triplette non-senso.
2. Le mutazioni cromosomiche sono: modificazione di porzioni più o meno lunghe di DNA (da qualche paia di
basi a decine di kilobasi) e determinano riarrangiamenti o perdita di interi pezzi di cromosoma. Esempi sono
rappresentati dalle traslocazioni cromosomiche, da delezioni di interi pezzi di cromosoma.
Credit: Molecular Cell Biology, Capitolo 8. Genetic Analysis in Cell Biology, Paragrafo 8.1. Mutations: Types and
Causes
3. Le mutazione cariotipiche riguardano il cambiamento, in più o in meno, del numero dei cromosomi che
caratterizzano il genoma di una data specie. La variazione può interessare una sola coppia di cromosomi o
l’intero assetto cromosomico; ciò comporta un aumento sostanziale dell’informazione o, viceversa una perdita
estesa dell’informazione per cui le ripercussioni sul fenotipo sono sempre gravi. L’origine di tutte queste
mutazioni è sostanzialmente associata ai processi connessi con la divisione cellulare.
4
Credit: Cancer Medicine, Capitolo 3: Cancer Etiology . Figura 19. Ionizing Radiation: Principal Cellular and
Tissue Effects of Radiation
ORIGINE DELLE MUTAZIONI
Il problema dell’origine delle mutazioni non è risolvibile in una semplice relazione di causa-effetto, in quanto i
fattori responsabili dei cambiamenti genetici sono diversi, di varia natura e, solo in parte, controllati e
controllabili.I primi lavori di ricerca sulle mutazioni risalgono agli inizi del ‘900; negli anni venti venne
dimostrata la capacità mutagena delle radiazioni ionizzanti e negli anni quaranta si ebbero le prove dell’azione
mutagena di alcuni composti chimici quali l’ossido di etilene e il diazometano.Esperimenti successivi permisero
di confermare l’esistenza di una vasta gamma di sostanze, dette mutageni, in grado di aumentare la frequenza di
mutazioni.Gli agenti mutageni sono presenti e diffusi nell’ambiente in cui si trovano perché provenienti o da
fonti naturali o da fonti artificiali connesse con l’attività umana.
Nel settore delle radiazioni, le fonti naturali (dette radiazioni di fondo) sono costituite principalmente dalle
radiazioni cosmiche, dalle radiazioni terrestri conseguente al decadimento di elementi radioattivi, dalle emissioni
provenienti dagli elementi (potassio 40, carbonio 14 e altri elementi) presenti negli organismi viventi.
Tra le fonti artificiali, collegate all’uso bellico o pacifico, si trovano le radiazioni generate dall’energia nucleare
e dalla diagnostica e terapia medica.
Mutageni chimici
L’ipotesi che agenti chimici fossero in grado di indurre mutazioni nacque all’inizio del Novecento con i tentativi
di T.H. Morgan su Drosophila melanogaster. Diversi ricercatori dimostrarono inequivocabilmente, negli anni
quaranta, la capacità di diversi composti chimici di indurre un’alta frequenza di mutazioni (capacità mutagena).
Si stima intorno a 11 milioni il numero dei composti chimici esistenti, con un incremento annuo di 1000-2000
nuove molecole; di questi 100000 sono prodotti su scala industriale, per una frazione minore, (11000) la
produzione è tale da richiedere un adeguato controllo ambientale per la capacità inquinante e la potenziale
tossicità. (Who 1998).
I mutageni chimici vengono suddivisi in:
1. mutageni diretti:che interagiscono direttamente con il DNA.
2. promutageni: sostanze di per sé non reattive ma possono essere convertite da parte delle diverse vie
metaboliche cellulari in derivati reattivi.
3. mutageni indiretti: non reagiscono né direttamente né come derivati metabolici con il DNA tuttavia
possono causare modificazioni del materiale genetico.
1. Mutageni diretti
Appartengono a questa categoria sostanze in grado di interagire direttamente con il DNA
Analoghi delle basi
5-Bromouracile
2-Amminopurina
Agenti che reagiscono
direttamente con il DNA
Acido nitroso
Idrossilammina
Idrazina
Agenti alchilanti
Epossidi
Aldeidi
Agenti intercalanti
Acridine
5
2. Promutageni
Composti relativamente non polari,possono essere attivati metabolicamente a forme più reattive e interagire con
i centri nucleofili nel DNA.
Ammine aromatiche
Idrocarburi policiclici aromatici e nitroderivati : benzene e stirene
Aflatossine
N-Nitrosammine
Carbammati
Idrocarburi alogenati
3. Mutageni indiretti
A questo gruppo appartengono quei composti che sono in grado di formare specie reattive
dell’ossigeno(mutageni ossidativi) o che interagiscono con la sintesi, la replicazione e il corretto mantenimento
della struttura del DNA
Mutageni ossidativi
Antimetaboliti
Bleomicina
Mitomicina C
Antracicline
Analoghi dell’acido folico
Analoghi pirimidinici
Analoghi purinici
Inibitori mitotici e del ciclo
cellulare
Prodotti di origine vegetale
Principali mutageni nell'ambiente:
ARIA
ACQUA
Benzene
Idrocarburi policiclici
(IPA) e loro derivati
Nitrosostituiti
aromatici
CIBO
Pesticidi
Aflatossine
Idrossifuranoni
Amine aromatiche
Trialometani
Idrocarburi policiclici
aromatici
Idrocarburi alogenati
Autori : Annamaria Buschini, Francesca Cassoni, Clara Bocchi www. arpa emilia romagna
TEST DI GENOTOSSICITÀ
Lo scopo principale delle analisi mutageniche è quello di sviluppare delle metodologie analitiche semplici e di
rapida esecuzione, capaci di identificare correttamente gli agenti mutageni, allo scopo di definire dei piani di
intervento e minimizzare l’esposizione umana ad essi. L’interesse per le sostanze ad attività mutagena nasce dal
fatto che molto spesso esse risultano essere anche cancerogene. Esistono attualmente diverse metodologie
utilizzate per l’esecuzione di questi test, le quali impiegano organismi diversi, tra i quali batteri (test di Ames),
piante superiori ed organismi animali.
I test che valutano la comparsa di un aumento di tali variazioni indotte da xenobiotici possono venir divisi in:
1 test a breve termine (possono fornire risposte anche in sole 48 ore, come ad es. il test di Ames) che utilizzano
organismi sia procariotici (es. Salmonella typhimurium) sia eucariotici semplici (es. Saccharomyces cerevisiae) o
linee cellulari umane
2 test a lungo termine che prevedono lo studio di popolazioni animali (normalmente roditori) nel medio-lungo
periodo
6
3 studi epidemiologici valutano l’esposizione di una parte della popolazione ad un agente(es amianto)
Le mutazioni nei batteri possono essere evidenziate come mutazioni in avanti, spesso consistenti
nell’acquisizione della resistenza a chemioantibiotici (streptomicina) o antimetaboliti (5-metiltriptofano,
deossigalattosio), oppure come retromutazioni. Il principio della retromutazione è il seguente: un ceppo batterico
viene dapprima reso auxotrofo per un determinato fattore di crescita e in tale popolazione di batteri auxotrofi
alcuni individui, per l’azione di sostanze mutagene, riacquistano la primitiva capacità di crescere in assenza del
fattore di crescita in questione.
Nel caso del test di Ames, le prove vengono condotte in vitro su ceppi di Salmonella typhimurium resi auxotrofi
per l’istidina. In questi ceppi sono state introdotte sull’operone che codifica la sintesi dell’istidina delle
mutazioni specifiche in modo da renderli istidino-dipendenti; i ceppi così modificati non sono in grado di
crescere in un terreno privo di questo aminoacido, essendo divenuti geneticamente incapaci di sintetizzarlo e
pertanto possono fungere da indicatori dell’attività mutagena di agenti genotossici poiché, in loro presenza, i
geni alterati deputati alla sintesi dell’istidina riprendono la loro primitiva funzionalità (retromutazione)
consentendo quindi ai batteri di crescere formando colonie visibili. Il numero delle colonie batteriche cresciute in
assenza di istidina (revertenti) fornisce una misura dell’attività mutagena del composto o della miscela in esame.
Autore: Marco Rusnati, Università di Brescia
Recentemente si sono evolute tecniche applicabili
1- su tessuti umani da donatori (es: sangue)
2- su organismi considerati bioindicatori (es: mitili)
per la valutazione diretta dell'interazione tra mutageni e DNA (dose biologicamente efficace).
Tra questi il test dei micronuclei (MN), che permette di dare in tempo reale una indicazione di rischio
genotossico sia ambientale sia occupazionale
E' generalmente accettato che i tumori siano malattie ad eziologia genetica, dovuti cioè ad alterazioni del DNA.
L'accumulo di mutazioni somatiche può dare origine ad eventi cancerogenetici, si presuppone che siano
necessarie numerose mutazioni in geni differenti perché un tumore possa insorgere in un tessuto e progredire
attraverso diversi stadi di malignità. L'incremento quindi di mutageni nell'ambiente è indice di un rischio
genotossico in aumento.Una delle osservazioni a prova di questa tesi è certamente il rapporto dimostrato tra
7
agenti mutageni e cancerogeni. Il test di Ames (test di mutagenesi più utilizzato al mondo per screening
genotossicologici) ha evidenziato una netta correlazione tra mutageni e cancerogeni(60-80%). Viene quindi
generalmente accettato che una evidenza di mutagenicità indichi rischio cancerogeno. Occorre però molta
cautela nell'applicare all'uomo le conclusioni derivanti dallo studio degli agenti mutageni in organismi da
esperimento. L'informazione che tali test forniscono è comunque molto importante in quanto segnalano un
possibile rischio, derivante dall'esposizione a sostanze che agiscono sul DNA, per l'uomo e l'ambiente.
TEST DEI MICRONUCLEI
Il test dei micronuclei (MN) per la valutazione del danno cromosomico indotto o spontaneo è stato proposto nel
1976 da P.I Countryman e da Heddle. I micronuclei appaiono nel citoplasma come nuclei accessori,
morfologicamente identici al nucleo ma di dimensione ridotte. Essi possono essere formati da frammenti di
cromosomi, privi di centromero, che non segregano durante la divisione cellulare; oppure sono interi cromosomi
che ritardando la migrazione durante l’anafase e restano esclusi dai nuclei principali: durante la telofase si
ricostituisce la membrana nucleare anche attorno ai frammenti cromosomici o ai cromosomi non migrati i quali
cominciano a decondensarsi durante l’interfase assumendo il caratteristico aspetto dei micronuclei. Quindi i MN
rappresentano un indicatore diretto di danni cromosomici. E’ necessario per lo studio dei MN individuare le
cellule che abbiano compiuto un ciclo cellulare completo cioè che abbiano effettuato almeno una mitosi.
Il test dei MN valuta anche l’indice di divisione nucleare(IDN), misurando la frequenza di cellule mono-bi-tri
tetranucleate e quindi la proliferazione cellulare. Questo indice fornisce informazioni sugli effetti citotossici di
agenti chimici o fisici e permette di identificare sostanze che possono stimolare la divisione cellulare (Lucia
Migliore: Mutagenesi ambientale, ed. Zanichelli).
I saggi più utilizzati e per i quali esistono protocolli convalidati sono quelli che studiano le aberrazioni
cromosomiche, i micronuclei e gli scambi tra cromatidi fratelli (Sister Chromatid Exchange, SCE) in cellule
radicali di cipolla (Allium cepa- Figura 1 e 2) e di fava (Vicia faba) e i saggi che studiano le mutazioni geniche
in peli staminali o la presenza di micronuclei come indice di avvenuto danno al DNA nelle cellule del polline in
piante del genere Tradescantia
Disgregazione di nuclei
Cromosomi disorganizzati
Figure 1 e 2: Apici radicali di cipolla esposti a 5 mM Pb(NO3)2 per 24 ore e colorati con safranina.
nunuclei
8
TEST DI GENOTOSSICITA’ PER IL MONITORAGGIO DELL’AMBIENTE
Negli ultimi anni si è sempre di più diffuso l’utilizzo di piante come bioindicatori della presenza di
mutageni/cancerogeni di tipo ambientale, soprattutto allo scopo di poter eseguire test di mutagenesi in loco.
Inoltre, poiché le piante sono eucarioti, hanno una risposta biologica più vicina a quella dei mammiferi rispetto
ai procarioti (Constantin, 1978) e sono in grado di metabolizzare sostanze non mutagene dando luogo a composti
mutageni, così come avviene negli animali, e questo ha grande importanza sia come “modello”, sia relativamente
ai rischi connessi alla catena alimentare (De Serres, 1978). Le piante superiori forniscono quindi preziosi sistemi
di test genetici per lo screening e il monitoraggio degli inquinanti ambientali. L’uso di piante per i test di
mutagenesi si basa sul principio(come per i microrganismi)
“consistente nella omogeneità della struttura del DNA e nella generalità dei fenomeni genetici” (Inquinamento
atmosferico e mutagenicità nella città di Bolzano ).
La similarità tra la morfologia dei cromosomi vegetali e dei cromosomi dei mammiferi (tra cui quelli che
utilizzano cellule di mammifero), sono sicuramente fattori che rendono particolarmente interessante l’utilizzo di
questi bioindicatori (Fiskesjo, 1985a; Grant, 1994; Grover et al., 1990). Il principale vantaggio è il loro possibile
utilizzo in situ, consentendo quindi monitoraggi in condizioni reali, poiché gli agenti inquinanti non agiscono
separatamente ma danno luogo a combinazioni di inquinanti e a effetti sinergici che in laboratorio sono
difficilmente realizzabili. Inoltre i test sui vegetali permettono l’utilizzo di campioni “tal quali”, cioè campioni
che non subiscono trattamenti di preparazione.
Anche per i vegetali il campo d’applicazione, per quanto riguarda il monitoraggio ambientale è vastissimo: sono
stati utilizzati per condurre studi per il monitoraggio dei mutageni ambientali nelle acque reflue e nelle acque
potabili (acque profonde, acque superficiali, acque prima e dopo la potabilizzazione, acque condottate) (Duan et
al., 1999a; Duan et al., 1999b; Fiskesjo, 1985a; Fiskesjo, 1985b; Grant et al., 1992; Grover e Kaur, 1999; Helma
et al., 1994; Helma et al., 1998; Ji et al., 1999; Ma et al., 1995; Monarca et al., 1998a; Rank e Nielsen, 1993;
Rank e Nielsen, 1994; Steinkellner et al., 1999), nel suolo (Cotelle et al., 1999; Gill e Sandhu, 1992; Kong e Ma,
1999; Rodrigues et al., 1998), nell’aria relativamente all’inquinamento atmosferico urbano (Batalha et al., 1999;
Gichner e Veleminsky, 1999; Ma et al., 1982; Ma et al., 1996; Monarca et al., 1999) e agli ambienti confinati
(Monarca et al., 1998b; Sadowska et al., 1994), nei fanghi di depurazione, nei biogas e nei percolati delle
discariche (Cabrera e Rodriguez, 1999; Ma et al., 1992; Ma et al., 1996; Rank e Nielsen, 1994; Sadowska et al.,
1994). Sono stati impiegati vegetali anche per condurre studi sugli effetti delle radiazioni ionizzanti (Ichikawa,
1992; Ma, 1979; Ma et al., 1980).
Una pianta largamente utilizzata per i test di mutagenesi è la Tradescantia , una specie estremamente sensibile
all’azione dei mutageni, anche a quelli presenti in basse concentrazioni: la Tradescantia (Ma, 1982, 1983, 1990).
Il suo impiego si è rivelato particolarmente efficace sia per i test di genotissicità di composti chimici tipo
pesticidi ed additivi che per analisi di suoli inquinati, acque reflue, acque destinate ad uso potabile e per il
monitoraggio di inquinanti gassosi. (Ma 1982,Ma 1983, Sadowska 1994). La Tradescanzia appartiene alla
famiglia delle Commelinaceae, si tratta di una pianta proveniente dal sud degli Stati Uniti caratterizzata da una
infiorescenza a spiga composta da 16-20 boccioli di colore blu o blu- porpora di 30-40 cm. Questa pianta è stata
utilizzata per il monitoraggio dell’aria nella città di Bolzano: per l’esecuzione del test dei micronuclei sono state
raccolte per ogni campione 15 infiorescenze di Tradescanzia con uno stelo di 15 cm. Le infiorescenze sono
state esposte in diversi siti della città con lo stelo immerso in un becker contenente una soluzione salina diluita (
soluzione di Hoagland) e posti ad una altezza di circa 2 metri. L’esposizione è stata di 24 ore nei mesi estivi e
primaverili, mentre di solo 6 ore nei mesi invernali per le temperature troppo rigide; contemporaneamente è stato
allestito un saggio di controllo mediante esposizione in un luogo non contaminato. Questa pianta è stata
ampiamente utilizzata per la sua bassa frequenza di mutazioni spontanee e l’alta sensibilità a varie classi di
mutageni, imputabile ad alcune caratteristiche genetiche quali il volume nucleare e le notevoli dimensioni dei
9
suoi cromosomi. La Tradescantia è molto sensibile agli agenti mutageni quando le sue cellule del polline sono
nella profase I della meiosi. Le infiorescenze sono esposte direttamente alla matrice ambientale (aria, acqua
suolo) da esaminare e successivamente si valutano gli eventuali danni al DNA sottoforma di micronuclei (MCN)
nelle cellule madri del polline durante lo stadio di tetrade, alla fine della meiosi.L'estrema sensibilità di questo
test può risiedere nel fatto che i cromosomi meiotici sono più sensibili alle mutazioni rispetto a quelli mitotici
(Sax, 1938) e che le cellule in meiosi sono sincrone nelle infiorescenze di Tradescantia e la durata della meiosi è
nota in modo preciso.
Il test del micronucleo in Tradescantia è stato ampiamente applicato per
studi su matrici ambientali. In particolare è stato applicato per lo studio di
matrici acquose (acque superficiali e reflue). E' stato utilizzato, per
esempio, su due fiumi austriaci per individuare gli effetti clastogeni degli
inquinanti chimici, dei pesticidi e dei metalli pesanti presenti in acque
reflue provenienti da impianti industriali. I dati ottenuti evidenziano un
aumento del numero di micronuclei nelle cellule polliniche di
Tradescantia dovuto alla presenza in queste acque di sostanze
genotossiche, presenza confermata dall'analisi chimica delle acque
contenenti nitrati, nitriti e pesticidi (Steinkellner et al., 1999). In Cina
molte indagini sono state svolte su fiumi per evidenziare come
l'immissione degli scarichi civili ed industriali determinino un aumento
della genotossicità a valle degli scarichi stessi. Duan et al., (1999b) hanno
lavorato lungo il fiume Panlong sottoponendo 20 campioni (raccolti in
diversi siti lungo il fiume) sia al test dei micronuclei (MCN), sia al test
con i peli staminali (SHM). I due test hanno dato risultati concordanti:
tutti i siti a valle della città di Kumming presentano acque di bassa qualità
con un'elevata genotossicità dovuta agli scarichi civili ed industriali.
ALLIUM CEPA TEST
10
Autori: Milena Peli e Urania Matranga, Test di Mutagenesi applicati al monitoraggio dell’aria e dell’acqua
L'Allium cepa test è utilizzato fin dagli anni '30 per valutare la genotossicità di molte sostanze chimiche. Il test
consiste in un saggio preliminare di tossicità in cui si valutano parametri macroscopici come la lunghezza delle
radici ed eventuali modificazioni nella loro forma, colore e consistenza, e in un saggio di genotossicità in cui si
valutano parametri microscopici come aberrazioni cromosomiche e formazione di micronuclei (Fiskesjo, 1985a;
Grant, 1982; Grant et al., 1992; Ma et al., 1995). Il saggio di citotossicità prende in considerazione la lunghezza
delle radici di una serie di bulbi di cipolla fatti crescere nella soluzioni in studio a diversa concentrazione e in
base a tali valori viene valutato il grado di tossicità rispetto ad un appropriato controllo negativo. Si può costruire
una curva dose-risposta individuando l’EC50, cioè la concentrazione che riduce del 50% la crescita radicale
rispetto al controllo: questa concentrazione sarà la massima dose utilizzabile nel successivo test di genotossicità.
Altri parametri macroscopici che aiutano nella valutazione della tossicità riguardano la forma e le condizioni
generali degli apici radicali: il turgore, il colore (le radici assumono una colorazione bruna quando le cellule
vanno incontro a morte), la forma (uncini, tumori apicali rigonfi e apici spezzati), come si osserva dall’immagine
sottostante.
Autori: Milena Peli e Urania Matranga, Test di Mutagenesi applicati al monitoraggio dell’aria e dell’acqua
L'Allium cepa si è dimostrato un sistema affidabile per rilevare anche sostanze premutagene poiché possiede un
sistema enzimatico a funzione ossidasi mista (MFO-system) in grado di metabolizzare diversi composti
(Fiskesjo, 1985a).
Anche questo test sui vegetali, messo a punto inizialmente su diverse sostanze chimiche già ampiamente studiate
dal punto di vista della loro genotossicità, è poi stato utilizzato per indagini ambientali mostrando alta sensibilità
per diversi agenti genotossici, come pesticidi ed altri composti organici. I pesticidi studiati hanno indotto
significativi aumenti nella frequenza delle aberrazioni cromosomiche nelle radici di Allium cepa, dimostrando
un’alta correlazione con test condotti in cellule di mammifero. Infatti gli studi sui meristemi radicali in Allium e
sulle cellule di midollo osseo di ratto sono stati comparati dimostrando una concordanza del 93%.
In campo ambientale l'Allium è stato applicato per indagini in ambiente idrico. L’Allium cepa test è stato
utilizzato per testare acque potabilizzate, destinate all’uso umano provenienti da fonti profonde o da fiumi
(Fiskesjo, 1981; Fiskesjo, 1985; Monarca et al., 1998a). Smaka-Kincl et al. (1996) hanno studiato acque
superficiali di fiume mediante questo test, rilevando un aumento delle aberrazioni cromosomiche di oltre 10
volte rispetto ai controlli. Odeigah et al. (1997) in Nigeria hanno esaminato acque superficiali inquinate dalle
pratiche di produzione, raffinazione e trasporto dei prodotti petroliferi, dimostrando un aumento dell’attività
genotossica. Arkhipchuk et al. (2002) hanno studiato la qualità dell'acqua di fonti superficiali e di rubinetto in
due grandi città dell'Ucraina, rilevando la presenza di sostanze tossiche. E infine, Monarca et al. (2002) hanno
valutato l’influenza di diversi disinfettanti sull’attività genotossica in acque superficiali destinate ad uso potabile.
11
Micronucleo
Micronuclei in apici radicali di cipolla esposti a una soluzione di 5 mM di Pb(NO3)2 per 24 ore e colorati
con safranina.
BIOMONITORAGGIO CON ALLIUM CEPA DELL’ACQUA DEL FIUME MELLA
PRELEVATA A CASTEL MELLA. (PROVINCIA BRESCIA)
Sono stati effettuati alcuni prelievi: il 18/02/08, il 10/04/08 e il 12/05/08. Ciascun campione è stato
sottoposto al test di accrescimento delle radici di cipolle: per ciascun campione sono state messe a
radicare 5 cipolle per cinque giorni (temperatura ambiente, luce indiretta). In parallelo sono state messe
a radicare anche 5 cipolle in soluzione nutritiva di controllo e 5 in soluzione tossica di piombo.
Trascorsi i cinque giorni si sono misurate le lunghezze delle radici ed è stato calcolato il valore medio
per ciascun gruppo di cipolle. Dai risultati si può notare che nell’acqua del Mella le radici si sono
accresciute meno rispetto alla soluzione nutritiva: ciò fa intuire che l’inquinamento dell’acqua è tale da
rallentare la riproduzione delle cellule.
Inizio test 18/02/08, lettura
effettuata il 22/02/08
Inizio test 10/04/08, lettura
effettuata il 15/04/08
Inizio test 12/05/08, lettura
effettuata il 17/05/08
Soluzione Campione Soluzione Soluzione Campione Soluzione Soluzione Campione Soluzione
nutritiva
di
nutritiva
di
nutritiva
di
piombo
piombo
piombo
30 mm
25 mm
5 mm
35 mm
24 mm
5 mm
48 mm
28 mm
4 mm
Da ogni cipolla sono stati allestiti 4 vetrini con gli apici delle radici delle cipolle messe nella soluzione
nutritiva e in quelle messe nell’acqua del Mella. All’osservazione microscopica si sono evidenziate:
soluzione nutritiva: diverse cellule in mitosi, nessun micronucleo o alterazione cromosomica;
acqua del Mella: poche cellule in mitosi, nessun micronucleo, qualche alterazione cromosomica.
12
Autori delle immagini e dei disegni: Urania Matranga e Milena Peli, Test di mutagenesi applicati al
monitoraggio dell’aria e dell’acqua
BIBLIOGRAFIA
Mutagenesi ambientale a cura di Lucia Migliore, Ed. Zanichelli
Quaderni di biologia diretti da L.De Carli Catene metaboliche e mutazioni geniche di G.E. Magni Piccin Editore
Quaderni di biologia diretti da L.De Carli Mutagenesi ambientale di Nicola Loprieno Piccin Editore
Microbiologia M.Polsinelli M.De Felice A.Galizzi E.Galli G.Mastromei P.Mazza G.Viale, Bollati Boringheri
Inquinamento atmosferico e mutagenicità nella città di Bolzano Provincia Autonoma di Bolzano-Alto Adige
Dipartimento Natura e Ambiente, Urbanistica, Acque pubbliche e Energia
Maddalena Casera, Paolo Blasior Editore Laboratorio Biologico dell’Agenzia Provinciale per la Protezione
dell’Ambiente e la Tutela del lavoro
Sito web www arpa emilia romagna
13