Le reazioni avverse ai farmaci: tra nomenclatura e metodiche di determinazione
Si può realisticamente pensare che un medicamento di qualsivoglia natura, ideato,
progettato e modellato per funzionare su un meccanismo molecolare, sia esso brutale
o sofisticato, circoscriva la sua azione al puro effetto terapeutico? Ed ha ancora senso
pensare ad un farmaco ideale, “pulito”, e di rapida eliminazione, che risulti attivo sul
problema clinico senza inficiare altri meccanismi biologici? Quindici anni fa questa
domanda avrebbe assunto le sembianze della più classica tra le coperte un po’ troppo
corte; facendo oscillare ogni strumento terapeutico tra una scarsa efficacia e la
troppa efficacia, con il suo inevitabile corollario di effetti collaterali. Lo stato delle
conoscenze farmacologiche oggi, forse non ha del tutto mutato questa
consapevolezza,
che, in taluni casi, ha trovato valide conferme alla luce della
comprensione di nuovi meccanismi d’azione, portando alla valutazione di alcuni
effetti collaterali come epifenomeno di attività (es nausea da trattamento iniziale con
SSRI, discinesia da antipsicotici, etc); ma ha almeno modificato il rapporto dei clinici
con le “azioni secondarie” dei farmaci e spinto i farmacologi a predisporre nuove
teorie per spiegare quello che prima era un semplice problema di “dose” (è troppo per
te) o di intolleranza (fa male a te).
Recentemente la letteratura scientifica 1 ha evidenziato quanto importante sia il ruolo
che le reazioni avverse (Adverse Drug Reactions o ADRs) occupano nella diagnosi di
ammissione ai reparti ospedalieri. Attualmente, infatti, analizzando in una metanalisi
più di 100000 pazienti, la relazione è stata acclarata nel 5.3% dei casi. Sono proprio
i farmaci maggiormente usati, e quindi quelli che basandosi sulle evidenze, sono
anche clinicamente più efficaci, a produrre il maggior carico di effetti collaterali
quando esaminati per gruppi di età. Non deve stupire pertanto che i farmaci
dell’apparato cardiovascolare, con cui risulta medicalizzata una vasta porzione della
popolazione adulta e la più gran parte di quella geriatrica , o gli antimicrobici se si
considera la popolazione pediatrica, siano corredati da una vasta gamma di reazioni
avverse. Sebbene attualmente esistano delle differenze nelle politiche sanitarie
nazionali in termini di notifica delle reazioni avverse, il problema più grande è
rappresentato dal fatto che lo scenario in cui ci muoviamo è poco decifrabile, e
pesantemente influenzato dalla incoerenza dei dati scientifici, laddove l’unica
certezza sembra essere la tendenza alla sottosegnalazione. Tra i molti fattori che
influenzano questo quadro generale la difficoltà nel porre una diagnosi certa di ADR
sembra occupare un ruolo preminente; come si evidenzia quando si confrontano i dati
di ammissione ospedaliera per ADR (ovvero quelli in cui la diagnosi è posta sulla
base di un iniziale quadro clinico laboratoristico e successivamente confermata da
procedure analitiche o di esclusione) e quelli derivanti dalla segnalazione spontanea (
che appaiono numericamente assai meno importanti)2, oltre che essere influenzata
dalla metodica di identificazione, essendo più certa la diagnosi quando il quadro
clinico che la sottende è di competenza urgentistica3. Ciò equivale a dire che siamo
più capaci di riconoscere una reazione avversa in una situazione clinica
potenzialmente più grave piuttosto che identificarla e segnalarla spontaneamente. E’
plausibile che in questo contesto la disponibilità immediata di esami laboratoristici e
strumentali che escludano altri quadri indirizzino fortemente verso la diagnosi di
ADR. Ma la diagnosi stessa di ADR è fortemente condizionata
da alcune
approssimazioni che sono purtroppo insite nella nomenclatura che le definisce, oltre
che nei limiti stessi della anamnesi farmacologica anche se correttamente effettuata.
Nel tentativo di delineare una migliore comprensione del problema, Edwards ed
Aronson4 hanno riconsiderato interamente il problema ponendo l’accento sulle
criticità presenti nella definizione di adr della Organizzazione Mondiale della Sanità.
Questa ultima, in uso da circa 40 anni, prevede che ogni adr sia “ una risposta nociva
oltre che non voluta che occorre a dosi terapeutiche o profilattiche”. Tale definizione,
sebbene sintetica e completa, non pone l’accento sul ruolo che la gravità della
reazione possa avere nel determinare un disconfort per i paziente. Una successiva
teorizzazione è stata tentata da Laurence5 che al contrario ha evidenziato come la
gravità della reazione sia l’unico criterio per valutarne l’effettiva esistenza. In realtà
però, una reale definizione non può prescindere dal tentativo di delineare se esistano
o meno future possibilità di danno in seguito a future somministrazioni, né di indicare
come il rapporto tra il danno ed il farmaco che lo ha indotto debba essere gestito. In
questo senso Edwards ed Aronson affermano nello specifico che le misure della
sospensione del farmaco, della riduzione di dose oltre che di una opportuna terapia
che limiti o curi il danno ingenerato siano tra gli elementi più distintivi di una
reazione avversa.
E’ suggestivo iniziare a pensare che in fondo proprio dalla applicazione di questo
concetto la farmacovigilanza moderna abbia mutuato i concetti di “cascata
prescrittiva”, e la terapia medica quelli di “tritration” o frazionamento di dose.
Nel tentativo di applicare qualcosa di vago e clinicamente eterogeneo come sono
percepite essere le adr, l’aspetto nosografico e la nomenclatura assumono particolare
importanza, e anche termini che sono generalmente considerati sinonimi, come
effetto tossico od effetto collaterale, assumono sfumature diverse. Tossico, infatti, è
da intendersi come una esagerazione dell’effetto farmacologico principale. In pratica
un effetto tossico è da intendersi come un effetto farmacologico volontariamente od
accidentalmente presente su una serie di organi o tessuti su cui è indesiderato da chi
assume il farmaco, es cefalea da nitroderivati o calcio-antagonisti. Un effetto tossico
è comunque sempre correlato alla dose, non necessariamente nella fase della sua
insorgenza (in un soggetto povero metabolizzatore infatti anche una dose piccola può
risultare esagerata) quanto piuttosto nel mantenimento (ovvero allo steady state). La
caratteristica dipendenza dalla dose non si mantiene per gli effetti collaterali, in cui il
risultato clinico della somministrazione di un farmaco può essere dipendente o no
dalla quantità, ma piuttosto deriva da un complesso di funzioni accessorie, ovvero
non direttamente correlate alla azione principale ma in un certo senso direttamente
conseguenti da essa (es effetto anti-colinergico degli antidepressivi). Per ovviare a
queste ambiguità e sfumature sarebbe preferibile utilizzare il termine di “effetto
avverso” che racchiude in se tutte queste variazioni di significato.
E’ stato stabilito che i termini effetto avverso e reazione avversa possano esser
intercambiabili, per entrambi è chiaro e logico il nesso di causalità con l’assunzione
del farmaco laddove un evento avverso è privo di questa connotazione e caratterizza
il danno solo nel rapporto temporale con l’assunzione del farmaco (es: avere una
trauma in corso di terapia con aspirina).
La soggettività del danno, ovvero la tendenza da parte del paziente ad interpretarlo
sulla base di precedenti esperienze analoghe, oltre che sulla personale capacità di
sopportarlo, determinano spesso anche le azioni che conseguono il presentarsi di una
reazione avversa. Proprio per questo motivo la sterile analisi della medicalizzazione,
è gravata da un tasso di errore molto alto almeno nel senso delle estrapolazioni che ne
possono conseguire. Alcuni soggetti potranno recarsi da uno specialista o fare ricorso
alle cure di un Pronto Soccorso, altri non fare caso a quanto accaduto, altri potranno
non accorgersene.
La presentazione clinica diviene quindi il punto dirimente della intera questione.
Nella conduzione dei trials clinici questo aspetto è gravato da una teorica facilità di
applicazione, ma anche da una difficile applicabilità, ma comunque trova un
meccanismo di codifica attraverso l’utilizzo a del Common Toxicity Criteria.
Molto più complesso appare essere il quadro nella pratica clinica e nel real setting.
Per rendere attendibile il segnale che la segnalazione di ogni reazione avversa genera
è indispensabile che vi sia una categorizzazione della stessa. La nascita delle banche
dati ha notevolmente semplificato il tutto, fornendo un modello di categorie in cui le
reazioni avverse possono essere analizzate per frequenza, o per gravità e
caratterizzate in funzione di vari parametri come per esempio la dose o la età del
soggetto. Allo stato attuale questo sistema è il più accreditato, anche se sono stati
proposti altri metodi tra cui quello per categorie semantiche appare il più intrigante
poiché il più correlato alla presentazione clinica del quadro. Nell’ambito di questo
sistema il principio attivo è posto al centro di un percorso che parte da una condizione
patologica di base, o da un dato laboratoristico associato alla stessa e si correla anche
ad un sintomo. La gravità della reazione, la sua modalità di presentazione ed il suo
decorso divengono elementi caratterizzanti ma accessori6
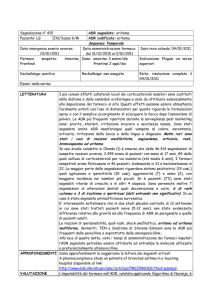
Nella pratica clinica tuttavia rimangono valide le indicazioni di massima che pongono
l’accento sulle caratteristiche differenziali di presentazione di cui la seguente tabella
propone un efficace riassunto.
TIPO
DI ACRONIM CARATTERISTICH
ESEMPIO
TERAPIA
Riduzione
ADR
I
E
Dose
Augmented
Prevedibile
Effetti tossici
Correlata alla FD
Effetti collaterali dose
dipendente
Comune
Bassa Mortalità
Sospensione
Poco comune
Reazioni
indipendent
Non correlata alla Fd
Immunologiche
e
Imprevedibile
Reazioni
Alta Mortalità
Idiosincrasiche
Poco frequente
Soppressione
Dose
Dose
Bizzarre
e Chronic
Riduzione di
tempo
Correlata alla dose corticosurrenalic
dose
dipendente
cumulativa
a
sospensione
Poco frequente
Teratogenesi
Poco
Dose correlata
Discinesia
trattabile
Tempo
Delayed
Dipendente
o
tardiva
Da
End of use
sospensione
Poco frequente
Dipendente
momento
sospensione
Ripristinare
Sindrome
dal d’astinenza
da adeguato
dosaggio
della oppioidi
Ischemia
da
sospensione
B
bloccanti
Da
inefficacia
Failure
Comune
Interferenze
Aumentare la
Dose correlata
metaboliche
dose
terapeutica
Spesso dipendente da
Considerare
interazioni
l’effetto delle
farmacologiche
terapie
cocncomitant
i
Già nel 1977 alcuni autori avevano evidenziato come la diagnosi di ADR fosse
gravata da un notevole grado di
ambiguità7, semplicemente basandosi su un
confronto tra il giudizio di tre farmacologi medici che avevano revisionato
indipendentemente una serie di dati clinici in cui i farmaci avevano avuto un ruolo
più o meno importante nel prolungare il tempo di ospedalizzazione, nel peggiorare la
prognosi o nel contribuire alla morte dei pazienti. E’ inoltre fondamentale considerare
come la natura stessa della manifestazione clinica che il paziente presenta può
condizionare l’orientarsi della diagnosi verso una adr. Se la adr è rappresentata da un
sintomo molto frequente come per esempio la nausea, sarà particolarmente
complicato comprenderne la vera causa, anche in presenza di una terapia con farmaci
che sicuramente generano quel sintomo; analogamente se la frequenza della patologia
con cui la adr va in diagnosi differenziale è molto elevata la accuratezza diagnostica
risentirà del quadro clinico aspecifico. Le adr, infatti, si presentano raramente con
sintomi patognomonici, laddove, i sintomi clinici sono uguali a quelli delle patologie
con cui vanno in diagnosi differenziale; inoltre le manifestazioni da adr risultano
farmaco specifiche solo in una piccola parte dei casi (per esempio più farmaci
possono dare come adr la vasodilatazione periferica). L’attuale metodica di
valutazione di una ADR
8
basata sulla applicazione di una ADR probability scale
consente di riassumere nei vari items elementi di portata più vasta. Per porre una
diagnosi differenziale per esempio, la valutazione della frequenza della reazione
avversa è ancora l’elemento primario, sarà pertanto più facile evidenziare una adr
dose dipendente da amlodipina se nel quadro clinico sono presenti edemi malleolari.
Analogamente è utile indirizzare il sospetto clinico se la manifestazione clinica sulla
quale si indaga corrisponde alla farmacologia classica di quel composto od ad un suo
conclamato pattern allergico (es piastrinopenia da eparina, oppure rush cutaneo da
penicillina). Nella identificazione del quadro farmaco-indotto l’elemento temporale è
logicamente dirimente, ma nel considerarlo si deve anche considerare che questo
dipende strettamente dal tipo di farmaco che si considera, variando quest’ultimo da
mesi od anni nel caso di una tossicità da accumulo, ad alcuni giorni nel caso di una
idiosincrasia metabolica9, o ad una reazione simil allergica ad insorgenza
immediata10. Tuttavia l’informazione cui attingere sui siti specializzati o sulle banche
dati spesso non enfatizza il livello di evidenza del rischio. Quest’ultimo è ovviamente
tanto più attendibile se viene analizzato da studi di metanalisi, da reviews
sistematiche, o da Trials Clinici Randomizzati, piuttosto che case series o da semplici
case reports. Inoltre l’identificazione dell’ entità del rischio risente della adeguata
presenza negli studi che mirano a determinarla di gruppi di confronto tra cui valutare
l’entità delle esposizioni e gli esiti delle stesse.
E’ attualmente possibile applicare dei metodi di tipo quantitativo alla individuazione
di un segnale di ADR, ciò in funzione del fatto che i database clinici di grandi
dimensioni sono passibili di una capacità analitica maggiore rispetto a gruppi molto
nutriti di revisori clinici. I metodi analitici attualmente disponibili includono:
a) relative reporting
b) proportional reporting rate ratio
c) reporting odds ratio
d) Bayesan Confidence Propagation Neural Network.
Si stanno rendendo disponibili anche delle analisi denominate di disproporzioanalità
che usano il rapporto tra la presenza di una adr in funzione del farmaco e la sua
presenza da sola in funzione del puro caso.
Partendo dall’idea che gli effetti dei farmaci siano riflessi in modo considerevole
dagli esami di laboratorio11 molto recentemente alcuni autori12 hanno evidenziato un
ruolo di preminenza per l’analisi effettuata su banche dati mediche utilizzando gli
indici di laboratorio come surrogati della presenza del segnale. In pratica è stato
proposto di interpretare valori estremi di laboratorio (in senso positivo od in senso
negativo) per correlare l’assunzione di un medicamento con la effettiva presenza di
una ADR, valutando un database elettronico di 10 anni e selezionando 10 farmaci in
studio. Sono stati ottenuti dagli autori due gruppi di analisi, ovvero i dati di
laboratorio relativi a prima del trattamento e quelli relativi a dopo il trattamento che
sono stati confrontati con un T-test per ciascun farmaco in studio. Gli stessi risultati
di laboratorio sono stati poi comparati attraverso il McNemar test, assegnando alla
significatività statistica [p<0,05 CI 95%] del dato di laboratorio anomalo il valore di
segnale positivo.
In ogni caso qualsiasi metodica si utilizzi, è indispensabile la valutazione della
coerenza del segnale e quindi l’esecuzione di studi di coorte o di studi di tipo caso
controllo rappresentano delle metodiche fondamentali, i cui risultati consentono al
clinico di valutare la reale entità del rischio associato ad un medicamento ponendo il
tutto in relazione con la presentazione sintomatologica del paziente e con l’evolversi
della patologia di cui egli soffre.
RIFERIMENTI BIBLIOGRAFICI
1. KongKaew C, Noyce PR, Ashcroft DM. Hospital Admissions associated with
adverse drug reactions: a systematic review of prospective observational
studies. Annals of Pharmacotherapy 2008 Jul; 42(7): 1017-2
2. Barrow P, Waller P & Wise L. Comparison of hospital episodes with ‘druginduced’ disorders and spontaneously reported adverse drug reactions. British
Journal of Clinical Pharmacology 2005 61:2 233–237
3. Brvar M, Fokter N, Bunc M and Mozina M. The frequency of adverse drug
reaction related admissions according to method of detection, admission
urgency and medical department specialty. BMC Clinical Pharmacology 2009,
9:8.
4. Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis, and
management. Lancet. 2000 Oct 7;356(9237):1255-9.
5. Laurence D, Carpenter J. A dictionary of Pharmacology and allied topics, 2nd
edn. Amsterdam: Elsevier, 1998:8-9
6. Bousquet C, Trombert B, Kumar A, Rodrigues JM. Semantic categories and
relations for modelling adverse drug reactions towards a categorial structure
for pharmacovigilance. AMIA Annu Symp Proc. 2008 Nov 6:61-5.
7. Koch-Weser J, Sellers EM, Zacest R The ambiguity of adverse drug reactions
Eur J Clin Pharmacol. 1977 Jan 3;11(2):75-8
8. Naranjo A. Clin Pharmacol Ther 1981; 30:239-245
9. Gallelli L, Ferraro M, Mauro G.F, De Fazio S, De Sarro G. NimesulideInduced Hepatotoxicity in a Previously Healthy Woman. Clin Drug Invest
2005; 25(6):1; 1173-77
10. Gallelli L, De Fazio S, Corace E, De Sarro G, Garcia CS, De Fazio P.
Generalised urticaria in a young woman treated with clomipramine and after
ingestion of codfish. Pharmacopsychiatry 2006; 39(4): 154-6.
11. Ramirez E, Carcas AJ, Borobia AM, Lei SH, Piñana E, Fudio S, Frias J. A
pharmacovigilance program from laboratory signals for the detection and
reporting of serious adverse drug reactions in hospitalized patients.Clin
Pharmacol Ther. 2010 Jan;87(1):74-86
12. Man Young Park, Dukyong Yoon, KiYoung Lee, Seok Yun Kang, Inwhee
Park, Suk Hyang Lee, Woojae Kim, Hye Jin Kam, YoungHo Lee, Ju Han Kim
and Rae Woong Park. A novel algorithm for detection of adverse drug reaction
signals
using
a
hospital
electronic
medical
Pharmacoepidemiology and drug safety 2011; 20: 598–607
record
database.