Cellula batterica
THF
Proteine
DHF
DNA
RNA
PABA
Farmacodinamica e terapia di combinazione dei
farmaci antinfettivi
Università degli studi di Cagliari
Facoltà di Medicina e Chirurgia
Dipartimento di Neuroscienze “B. B. Brodie”
Sezione Farmacologia Clinica
Prof.ssa Maria Del Zompo
1
Classificazione
Antibiotici e antifungini
1. Farmaci che inibiscono la sintesi della parete batterica
2. Farmaci che aumentano la permeabilità della membrana cellulare
3. Farmaci che inibiscono la sintesi proteica legandosi alle subunità
ribosomiali 30S e 50S
4. Farmaci che influenzano il metabolismo degli acidi nucleici
5. Farmaci antimetaboliti
Antivirali
1. Analoghi degli acidi nucleici (inibitori della DNA polimerasi virale,
inibitori della transcrittasi inversa)
2. Inibitori non nucleosidici della transcrittasi inversa del virus HIV
3. Inibitori di enzimi virali
4. Inibitori della fusione
La classificazione più comune dei farmaci antimicrobici è basata sulla struttura
chimica e sul meccanismo d'azione: farmaci che inibiscono la sintesi della
parete batterica questi includono le penicilline e le cefalosporine che sono
composti simili, e composti diversi quali cicloserina, vancomicina, bacitracina e
gli antifungini azolici (clotrimazolo, fluconazolo e itraconazolo), farmaci che
agiscono direttamente sulla membrana cellulare del microrganismo,
alterandone la permeabilità e causando la fuoriuscita di composti intracellulari;
questi includono sostanze ad azione detergente come la polimixina, e gli
antifungini polienici nistatina e amfotericina B che si legano agli steroli della
parete cellulare; farmaci che alterano le funzioni delle subunità ribosomiali 30S
e 50S, causando un'inibizione reversibile della sintesi proteica: questi composti
batteriostatici includono cloramfenicolo, tetracicline, eritromicina, clindamicina
e pristinamicina; farmaci che si legano alla subunità ribosomiale 30S alterando
la sintesi proteica e provocando la morte cellulare questi composti includono gli
aminoglicosidi; farmaci che alterano il metabolismo degli acidi nucleici batterici
come le rifamicine (rifampicina), che inibiscono la RNA polimerasi, e i
chinoloni che inibiscono le topoisomerasi; antimetaboliti come il trimetoprim e i
sulfamidici che bloccano gli enzimi essenziali per il metabolismo dell'acido
folico; farmaci antivirali che sono a loro volta suddivisi in molte classi: analoghi
degli acidi nucleici come l'aciclovir o ganciclovir che inibiscono selettivamente
la DNA polimerasi virale, e zidovudina o lamivudina che inibiscono la
transcriptasi inversa; inibitori non nucleosidici della transcriptasi inversa come
nevirapina o efavirenz; inibitori di altri enzimi virali essenziali per esempio gli
inibitori delle proteasi dell'HIV o della neuroaminidasi del virus influenzale.
2
Antibiotici
• Azione batteriostatica: blocca la crescita o la replicazione batterica
senza determinarne la morte
• Azione battericida: i batteri sono in grado di uccidere il batterio
responsabile dell’infezione
Farmaci batteriostatici
Farmaci battericidi
Macrolidi
Betalattamine
Tetracicline
Glicopeptidi
Cloramfenicolo
Cicloserina
Clindamicina
Bacitracina
Sulfonamidi
Fosfomicina
Trimetroprim
Aminoglucosidi
Chinoloni
Isoniazide
Rifampicina
Quinupristin/Dalfopristin
L’azione degli antibiotici può essere classificata come battericida
(che causa morte del batterio) o batteriostatica (che ne previene la
crescita). Le implicazioni dell’azione battericida nelle infezioni
gravi da batteri gram positivi che causano patologie
potenzialmente fatali o ospedalizzazione del paziente sono ancora
materia di dibattito.
Gli antibiotici battericidi, come i beta lattamici (incluse le
cefalosporine e i carbapenemi), glicopeptidi (inclusa la
vancomicina), i fluorochinoloni, le polimixine e il lipopeptide
daptomicina, sono spesso preferiti per il trattamento di patologie
quali neutropenia febbrile, meningite ed endocarditi. Tuttavia, ci
sono delle eccezioni: il cloramfenicolo è stato usato per il
trattamento delle meningiti nonostante sia un antibiotico
batteriostatico. Il cloramfenicolo e altri antibiotici batteriostatici
(macrolidi, tetracicline, sulfonamidi, trimetoprim, tigeciclina e
clindamicina) hanno mostrato anche una certa efficacia contro le
infezioni dermatologiche complicate e la polmonite acquisita in
comunità. Inoltre, la natura battericida non è una proprietà
intrinseca di un certo antibiotico ma può essere influenzata dalle
specie target e/o dalla concentrazione del farmaco.
3
Antibiotici
Antibiotici introdotti nella pratica clinica
Aminoglicosidi
Chinoloni
Cloramfenicolo
Glicopeptidi
Tetracicline
Penicilline
1940
Oxazolidinoni
Trimetoprim
Lipopeptidi
Macrolidi
1950
1960
1970
1980
1990
2000
Figura modificata da Liselotte Diaz Hogberg et al. Trends in
Pharmacological Sciences xx(2010)1–7.
Negli ultimi 30 anni sono state inserite solo due classi
completamente nuove: l’oxazolidinone linezolid e la lipopeptide
daptomicina.
Nonostante la portata del problema e un rapido sviluppo di
resistenze batteriche, sono stati fatti solo piccoli passi verso la
ricerca e lo sviluppo di nuovi agenti antibatterici efficaci contro i
ceppi resistenti. La maggior parte delle classi di antibiotici è stata
scoperta tra gli anni ’30 e i ’60, ma negli ultimi 30 anni sono state
introdotte solo due nuove classi: gli oxazolidinoni e i lipopeptidi.
Tuttavia, queste nuove classi non sono efficaci contro i batteri
gram negativi, in cui la resistenza multifarmaco è un problema
importante e le alternative terapeutiche sono limitate.
4
Costruzione della parete
Sintesi Acido
folico
Bacitracina
β-lattamici
Fosfomicina
Glicopeptide
Struttura e funzione della
membrana cellulare
Colistina
Parete
cellulare
Polimixina B
Cellula batterica
THF
Trimetroprim
Proteine
DHF
Sulfonamidi
DNA
RNA
PABA
PABA= Acido
paraminobenzoico
DHF= Diidrofolato
Struttura o funzione del
DNA
Chinoloni
Nitromidazolo
Membrana
cellulare
Rifampicina
Sintesi delle proteine
Macrolidi
Aminoglicosidi
THF= Tetraidrofolato
Nitrofurantoina
Lincosamide
Tetracicline
Gli antibiotici possono interferire a diversi livelli:
1. A livello della parete cellulare impedendo:
•Il formarsi degli incroci tra pentapeptidi: betalattamine
•La polimerizzazione delle singole catene di muramilpentapeptide: glicopeptidi
•L’incorporazione della D-alanina nel peptidoglicano: amminoacidi
•La fosfoenolpiruvatotransferasi: fosfonici
2. A livello della membrana mediante:
•Legame all’ergosterolo della membrana: antibiotici polienici
•Inibizione della 14 alfa demetilasi: azoli
•Interazione con i fosfolipidi della membrana: polimixina A
•Mediante depolarizzazione: lipopeptidi
3. A livello della funzione ribosomiale:
•Inibendo l’esatta trasduzione dell’mRNA: aminoglucosidi
•Legandosi alla subunità 30S del ribosoma: tetracicline
•Legandosi alle subunità ribosomiali 50S: cloramfenicolo
•Legandosi al sito P della subunità ribosomiali 50S: ossazolidinoni
4. A livello della sintesi dell’acido tetraidrofolico:
•Inibitori dell’incorporazione del PABA nell’acido folico: sulfonamidici
•Inibitori della diidrofolicoreduttasi: trimetoprim
5. A livello della replicazione del DNA:
•Interferenza con la DNA girasi: chinoloni
•Inibizione dell’RNA polimerasi: rifamicine
Gli antibiotici possono essere quindi classificati come segue:
1. Inibitori della sintesi della parte batterica:
• Betalattamine (penicilline, cefalosporine, monobattami, carbapenemi), Glicopeptidi
(vancomicina, teicoplanina), aminoacidi (cicloserina), peptidici (bacitracina), fosfonici
(fosfomicina)
2. Alteranti le funzioni della membrana:
• Lipopeptidi (daptomicina), polimixine
3. Agenti che causano una inibizione reversibile della subunità proteica, interferendo con le
funzioni delle subunità ribosomiali 50 S:
• Macrolidi (eritromicina, azitromicina, claritromicina), cloramfenicolo, streptogramine
(dalfopristina-quinupristina), chetolidi (telitromicina), ossazolidinoni (linezolid)
4. Agenti che causano una inibizione reversibile della subunità proteica, interferendo con le
funzioni delle subunità ribosomiali 30 S:
• Tetracicline (Tetraciclina, Demeclociclina, Doxiciclina, Limeciclina, Minociclina e
Oxitetraciclina)
5. Agenti interferenti il metabolismo degli acidi nucleici batterici:
• Rifamicine, chinoloni
6. Antimetaboliti:
• Sulfonamidici, trimetoprim
5
Farmacodinamica- Nuovi antibiotici
Daptomicina
Interagisce con la
membrana
cellulare
C U C
T A C
A U G
A T G
U A C
T T G
A A C
Peptidi cationici
Interagiscono con
la membrana
cellulare
Streptogramine
Inibiscono la
sintesi proteica
A U G
T T G
T A C
C U C
A T G
U A C
A A C
Glicopeptidi
Bloccano la
formazione del
peptidoglicano
Oxazolidinoni
Inibiscono la
sintesi proteica
Figura modificata da: “Robert E W Hancock. Mechanisms of action of newer
antibiotics for Gram-positive pathogens. Lancet Infect Dis 2005; 5:209–18”
Oxazolidinoni: linezolid
Il linezolid agisce legandosi al ribosoma e inibendo la sintesi proteica batterica.
L’antibiotico blocca reversibilmente la formazione delle proteine mediante il
legame alla subunità 23S del ribosoma 50S presso l’interfaccia formata con la
subunità 30S. Il linezolid si lega vicino ai siti di legame del cloramfenicolo e
della lincomicina e compete con questi per il legame. Tuttavia, questi antibiotici
agiscono con un meccanismo d’azione differente, questo fa si che ci sia una
scarsa resistenza crociata tra linezolid e cloramfenicolo o lincomicina.
Lipopeptidi: daptomicina
La daptomicina ha mostrato di agire in vitro da battericida con un meccanismo
d’azione diverso dagli altri antibiotici in commercio. Il farmaco è in grado di
legarsi, inducendo la rapida depolarizzazione della membrana e l’inibizione
della sintesi delle proteine, del DNA e del RNA.
Streptogramine: quinupristina/dalfopristina
Le streptogramine sono state scoperte negli anni ’60 e consistono in una mistura
di due antibiotici peptidici ciclici strutturalmente differenti. La quinupristina e
la dalfopristina in combinazione sono battericidi, agiscono in sinergia sulla
subunità ribosomiale 50S inibendo la sintesi proteica.
Il sinergismo è dovuto al fatto che il legame iniziale della dalfopristina al
ribosoma aumenta il seguente legame della quinupristina e anche perché i due
antibiotici si legano a die regioni ribosomiali diverse ma sovrapponibili.
La quinupristina si lega allo stesso sito della eritromicina e degli altri macrolidi.
6
Terapia antibiotica di associazione
L’impiego di un’associazione di antiobici può essere giustificato nei
seguenti casi:
• Terapia empirica di un’infezione grave la cui causa non sia nota
• Trattamento di infezioni polimicrobiche
• Aumento dell’attività antimicrobica
• Prevenzione della comparsa di resistenza
1. La terapia empirica di un’infezione è probabilmente il motivo più comune
dell’uso di un’associazione di antibiotici. In generale, la conoscenza del tipo
di infezione, della sua microbiologia e dello spettro di attività degli
antimicrobici è essenziale per la scelta razionale del trattamento antibiotico.
Tuttavia, in presenza di una malattia grave e senza la certezza dell’agente
scatenante spesso è necessario fare ricorso a una terapia iniziale di copertura
ad ampio spettro. In questi casi può rendersi necessario impiegare più
farmaci attivi per assicurare che la terapia includa un composto attivo
contro i potenziali patogeni. È tuttavia da evitare la somministrazione
prolungata su base empirica di antibiotici ad ampio spettro o di più
antibiotici perché spesso non è necessaria e inutilmente costosa.
2. Il trattamento degli ascessi intraddominali, epatici e cerebrali e di alcune
infezioni del tratto genitale potrebbe richiedere l'impiego di un'associazione
di antibiotici per eradicare queste tipiche infezioni miste da batteri aerobi e
anaerobi. Queste e altre infezioni miste possono essere causate da due o più
microrganismi sufficientemente differenti per sensibilità antimicrobica, così
che nessun farmaco da solo può generare una copertura adeguata.
3. Quando due farmaci antimicrobici vengono somministrati insieme si può
avere un effetto sinergico. L'esempio meglio documentato dell'utilità di
un'associazione sinergica di farmaci antimicrobici è il trattamento
dell'endocardite da enterococchi.
4. L'associazione può prevenire la selezione di mutanti resistenti a un singolo
farmaco. Questa è la base teorica della chemioterapia di associazione per la
tubercolosi per cui un singolo farmaco probabilmente non è efficace a causa
dell'insorgenza di mutanti resistenti durante la terapia. L'uso concomitante
di due o più farmaci attivi aumenta di molto la percentuale di successo
prevenendone lo sviluppo di resistenza. In generale, pochi dati supportano
l'ipotesi che le associazioni producano un esito migliore della terapia
prevenendo la comparsa di resistenza.
7
Terapia antibiotica di associazione
Beta-lattamici + aminoglicosidi: Pseudomonas aeruginosa, Klebsiella,
Enterobacter, Escherichia coli e altre Enterobacteriaceae
per il trattamento delle infezioni nosocomiali, della batteriemia e della
neutropenia febbrile
La terapia di combinazione NON migliora gli esiti clinici rispetto alla
monoterapia beta-lattamica ma aumenta il tasso di reazioni avverse
Beta lattamici e glicopeptidi + aminoglicosidi: Staphylococcus aureus
per il trattamento dell'endocarditi
Non sono presenti studi prospettici che giustifichino l'uso di questa
terapia per il trattamento delle infezioni da gram+
Ceftriaxone + ampicillina: Enterococcus per il trattamento delle
endocarditi
Mical Paul et al. “Combination Antimicrobial Treatment Versus
Monotherapy: The Contribution of Meta-analyses” Infect Dis Clin
N Am 23 (2009), 277-293
8
Antifungini
1.
Antimicotici per infezioni sistemiche:
• Polienici: Amfotericina B, Flucitosina
• Derivati Azolici: Imidazoli e Triazoli
• Echinocandine: Capsofungina, Anidolafungina, Micafungina
2.
Antimicotici sistemici per le infezioni cutanee:
• Griseofulvina
• Terfinabina
3.
Agenti antimicotici per uso topico:
• Nistatina
• Azoli per uso topico
• Allilamine per uso topico
9
Numero di antifungini disponibili
Antifungini
14
12
10
8
6
Anidulafungin
Caspofungin
Micafungin
Voriconazolo
Posaconazolo
Itraconazolo
Fluconazolo
Ketoconazolo
Miconazolo
Griseofulvina
4
5-FC
2
1950
L-AmB
ABCD
ABLC
Terbinafina
Anfotericina B
Nistatina
1960
1970
1980
1990
2000
10
Antifungini: farmacodinamica
Sintesi della parete cellulare
Distruzione dell’integrità
della membrana
Echinocandine
Derivati polienici
Parete
cellulare
Membrana
cellulare
Sintesi ergosterolo
Struttura degli acidi nucleici
Azoli
5-Fluorocitosina
Allilamine
Distruzione
aggregazione dei
microtubuli
Griseofulvina
I farmaci antimicotici utilizzati in terapia hanno diversa struttura
chimica e differenti meccanismi d’azione. Per quel che riguarda la
struttura chimica i farmaci antimicotici si dividono in: antibiotici,
derivati azolici, allilamine e analoghi della pirimidina.
La maggior parte dei farmaci antimicotici agisce colpendo
selettivamente il micete all’origine dell’infezione. La selettività del
meccanismo d’azione si basa sulla differenza nella composizione lipidica
delle membrane cellulari dei miceti e delle cellule dei mammiferi. Infatti,
la membrana dei miceti contiene un’alta percentuale di ergosterolo,
mentre lo sterolo principale presente nelle membrane cellulari di batteri
e mammiferi è il colesterolo. Nonostante questa selettività d’azione nei
confronti dell’ergosterolo, alcuni antifungini sistemici sono in grado di
influenzare anche la funzione o la biosintesi degli steroli presenti nelle
cellule dei mammiferi.
Appartengono al gruppo dei farmaci interferenti con la biosintesi
dell’ergosterolo i derivati polienici (amfotericina B) e i derivati azolici
(triconazolo, fluconazolo) e le allilammine (terbinafina).
Un altro bersaglio specifico dei farmaci antifungini è rappresentato dai
componenti della parete cellulare. Per molti funghi la chitina, i glucani e
le mannoproteine sono elementi chiave della parte cellulare.
È presente una ulteriore classe di farmaci antimicotici, comprendente
farmaci quali la flucitosina, in grado di espletare la propria azione
interferendo con la sintesi proteica e del DNA.
11
Terapia antifungina di associazione
Amfotericina B + azoli: effetto antagonista
Amfotericina B + voriconazolo/posaconazolo: effetto sinergico contro
l'Aspergillus
Capsofungina + Amfotericina B/voriconazolo: effetto sinergico contro
l'Aspergillus
Flucitosina + Azoli : effetto sinergico contro la Candida
Risultati in vitro con risvolti clinici non chiari
Le poche combinazioni antifungine (amfotericina B+flucitosina vs
fluconazolo, amfotericina B+ fluconazolo vs fluconazolo, amfotericina
B liposomiale+ capsofungina vs amfotericina) valutate nell'ambito di
studi clinici randomizzati e controllati hanno migliorato gli esiti clinici
ma non la sopravvivenza
Mical Paul et al. “Combination Antimicrobial Treatment Versus
Monotherapy: The Contribution of Meta-analyses” Infect Dis Clin
N Am 23 (2009), 277-293
12
Antivirali
1.
Analoghi degli acidi nucleici che inibiscono selettivamente la
DNA polimerasi
2.
Analoghi degli acidi nucleici che inibiscono la transcrittasi
inversa del virus HIV
3.
Inibitori non nucleosidici della transcrittasi inversa del virus HIV
4.
Inibitori di enzimi (proteasi, neuroaminidasi) virali essenziali
5.
Inibitori della fusione
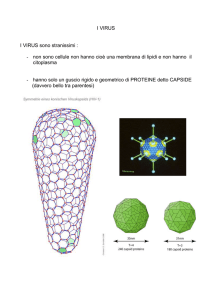
I virus sono parassiti endocellulari obbligati il cui genoma può essere costituito
da DNA a singola o doppia elica o da RNA racchiuso all’interno di un
involucro proteico chiamato capside. Alcuni virus possiedono anche un
rivestimento lipidico che come il capside può contenere antigeni glicoproteici.
La maggior parte dei virus contiene o codifica enzimi essenziali per la
replicazione virale all’interno delle cellule ospite, e quindi usurpano il sistema
metabolico delle loro cellule ospite. Gli agenti antivirali efficaci inibiscono
eventi replicativi virus-specifici o la sintesi delle proteine e degli acidi nucleici
diretta da virus piuttosto che quella diretta dalla cellule ospite. Comunque, le
molecole della cellule ospite che sono essenziali per la replicazione virale
possono anch’esse rappresentare un target per lo sviluppo di nuove terapie a
breve termine. I virus a DNA includono il poxvirus (vaiolo), gli herpesvirus
(varicella, herpes genitale e orale), gli adenovirus (congiuntivite, mal di gola) gli
hepadnavirus (epatite B), e il papillomavirus (verruche), I virus a DNA entrano
nel nucleo della cellula ospite all’interno del quale il DNA viene trascritto
nell’mRNA dalla polimerasi della cellula ospite, l’mRNA viene tradotto nelle
proteine specifiche del virus utilizzando gli stessi processi della cellula ospite,
una variante è rappresentata dal poxvirus che possiede la propria mRNA
polimerasi e di conseguenza si replica nel citoplasma della cellula ospite. Per i
virus ad RNA la strategia di replicazione prevede l’utilizzo sia degli enzimi del
virione (cellula virale completa) per sintetizzare il proprio mRNA che dello
stesso RNA virale che serve come suo proprio RNA. L’mRNA viene tradotto
nelle varie proteine virali, inclusa la RNA polimerasi, che dirige la sintesi
dell’RNA virale e dell’RNA genomico. La maggior parte dei virus a RNA
completano la loro replicazione nel citoplasma, ma alcuni come il virus
dell’influenza sono trascritti nel nucleo della cellula ospite. Esempi di virus ad
RNA sono il rubella virus (rosolial), il rabdovirus (rabbia), i picornavirus
(poliomielite, meningite, raffreddore, epatite A), arenavirus (meningite),i
flavivirus (febbre gialla, epatite C),gli
ortomixovirus (influenza), i
paramixovirus (morbillo, orecchioni) e i coronavirus (raffreddore, Sindrome
Respiratoria Acuta Severa). Un gruppo di RNA virus particolari sono i
retrovirus, questi virus contengono la transcrittasi inversa responsabile della
sintesi del DNA a partire dalla catena di RNA. La copia di DNA viene quindi
integrata nel genoma della cellula ospite che verrà definito a partire da questo
momento provirus e verrà trascritto sia nel RNA genomico che nell’mRNA per
la traduzione nelle proteine virali.
13
Farmacodinamica
Antivirali:
farmacodinamica
Liberazione della nuova
particella virale
Adesione
Gemmazione
Perdita del rivestimento
e trasferimento del DNA
virale nel nucleo della
cellula
DNA
virale
Assemblaggio
del virione
Sintesi delle
proteine da parte
dei ribosomi della
cellula ospite
Trascrizione
nell’mRNA
virale mRNA
virale
Sintesi del
DNA virale
Proteine
strutturali
Enzimi
virali
Proteine di
regolazione
Inibizione della DNA polimerasi virale
Aciclovir, vidarabina, foscarnet, ganciclovir
ACICLOVIR: inibisce la sintesi del DNA virale tramite
l’interazione con due proteine virali la timidina chinasi virale e la
DNA polimerasi. Gli enzimi cellulari convertono l’aciclovir
monofosfato ad aciclovir trifosfato che è in grado di competere
con la deossiguanosina trifosfato endogena, inibendo
competitivamente la DNA polimerasi virale e in misura minore
quella cellulare. Inoltre esso viene incorporato nel DNA virale
dove provoca l’arresto del processo di allungamento della catena a
causa della mancanza del gruppo idrossile in posizione 3’. Per
mezzo di un meccanismo definito inattivazione suicida, lo stampo
di DNA interrotto contenente aciclovir si lega alla DNA
polimerasi virale inattivandola in modo irreversibile.
FOSCARNET: inibisce la sintesi dell’acido nucleico virale
interagendo direttamente con la DNA polimerasi dell’herpesvirus
o con la transcrittasi inversa dell’HIV. Blocca reversibilmente e in
modo competitivo il sito di legame del pirofosfato presente nella
polimerasi virale, inibisce la liberazione del pirofosfato dal
deossinucleotide trifosfato.
GANCICLOVIR: analogo nucleosidico aciclico della guanina.
Subisce la trifosforilazione e nella forma trifosfato agisce come
inibitore competitivo dell’incorporazione della deossiguanosina
trifosfato del DNA, inibendo preferenzialmente la DNA
polimerasi virale.
14
Antivirali: farmacodinamica
Zanamivir
Oseltamivir
Legame alla superficie
cellulare
EMOAGGLUTININA
Liberazione della nuova
particella virale
Endocitosi
Gemmazione
Endosoma
Trasporto
intracellulare
e assemblaggio
H+
Proteina M2
Fusione
EMOGLUTININA
Perdita del
rivestimento M2
Amantadina
Rimantadina
Replicazione
dell’RNA
Ap
RN
cRNA
RNAv
A
RN
vRNA
Proteine
strutturali
p
Sintesi
delle
proteine
RNAp
Ribavirina
Proteine non
strutturali
mRNA
AMANTIDINA e RIMANTADINA: inibiscono una fase iniziale
del processo di replicazione virale, probabilmente la perdita del
rivestimento virale, forse alterando la produzione di
emoagglutinina.
OSELTAMIVIR: la neuroaminidasi del virus dell’influenza taglia i
residui terminali di acido sialico e distrugge i recettori riconosciuti
dall’ emoagglutinina virale, che sono presenti sulla superficie
cellulare, e sulla progenie dei vironi. Quest’azione è essenziale per
il rilascio del virus dalle cellule infettate, l’interazione di questi
farmaci con la neuroaminidasi causa un cambiamento
conformazionale nel sito attivo dell’enzima e di conseguenza
inibisce la sua ativitàl’inibizione dell’attività di questo enzima
porta ad aggregazione virale sulla superficie della cellula e una
diminuzione della diffusione del virus nel tratto respiratorio.
ZANAMIVIR: come l’oseltamivir inibisce la neuroaminidasi
causando l’aggregazione del virus sulla superficie cellulare e
riduce la diffusione del virus nel tratto respiratorio.
RIBAVIRINA: inibisce competitivamente l’enzima cellulare
inosina-5’-fosfato deidrogenasi e interferendo con la sintesi della
della guanosina trifosfato e più in generale con la sintesi degli
acidi nucleici.
15
Antivirali: farmacodinamica
Membrana
cellulare
Recettore per le
chemochine e CD4
Nucleo
Assemblaggio
Citoplasma
RNA genomico
del virione
RT
Virione
extracellulare
maturo
Gemmazione
e rilascio
DNA a doppia
elica non integrato
RT
RNA
virale
Inibitori
della
proteasi
Cromosoma ospite
Regolazione Proteine strutturali
gp120, p24, p18, ecc.
Rnasi H
Provirus
Nucleocapside
gp160
+
gp41
Penetrazione e
scopertura
Complesso
cDNA-RNA
Trascrizione
inversa
Proteine regolatorie
tat, rev, nef, ecc.
Integrasi
Integrazione
mRNA
virale
Trascrizione
Traduzione
Particella HIV
(virione maturo)
Attacco e fusione
Enfuvirtide
Inibitori nucleosidici della RT
Inibitori non nucleosidici della RT
INIBITORI NUCLEOSIDICI E NON NUCLEOSIDICI DELLA
TRANSCRITTASI INVERSA:
la DNA polimerasi RNAdipendente codificata dall’HIV converte l’RNA virale in DNA che
viene poi integrato in un cromosoma della cellula ospite. Come
tutti i farmaci antiretrovirali disponibili impediscono l’infezione
delle cellule ma non hanno alcun effetto sulle cellule già infettate.
Devono entrare nella cellula ed essere fosforilati per funzionare
come substrati sintetici dell’enzima. Gli analoghi fosforilati
bloccano la replicazione del genoma virale perché competono con
i nucleotidi presenti nella cellula per il legame all’enzima e, una
volta incorporati, provocano l’interruzione della catena del DNA
provirale.
ENFUVIRTIDE: blocca l’interazione alcune sequenze della
glicoproteina gp41 che previene la formazione del
raggruppamento a sei eliche, critica per la fusione delle membrane
e l’entrata del virus nella cellula ospite. Inibisce la fusione fra la
membrana dell’HIV e quella della cellula ospite.
INIBITORI DELLE PROTEASI: inibiscono in modo competitivo
l’attività della proteasi aspartica del virus, bloccando la
maturazione delle particelle virali dell’HIV alla forma infettiva.
16




![Lezione 15 Virus [modalità compatibilità]](http://s1.studylibit.com/store/data/000771737_1-84b1cca561c5813066d1b76125338a98-300x300.png)