Sensori
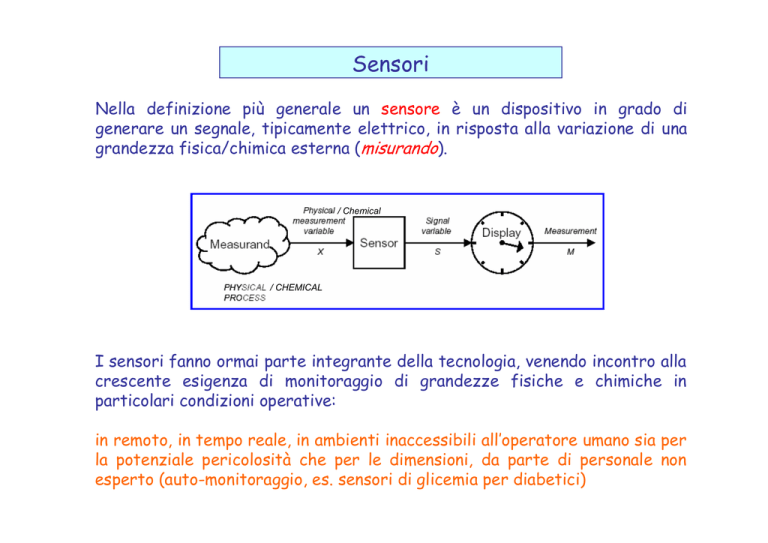
Nella definizione più generale un sensore è un dispositivo in grado di
generare un segnale, tipicamente elettrico, in risposta alla variazione di una
grandezza fisica/chimica esterna (misurando).
/ Chemical
/ CHEMICAL
I sensori fanno ormai parte integrante della tecnologia, venendo incontro alla
crescente esigenza di monitoraggio di grandezze fisiche e chimiche in
particolari condizioni operative:
in remoto, in tempo reale, in ambienti inaccessibili all’operatore umano sia per
la potenziale pericolosità che per le dimensioni, da parte di personale non
esperto (auto-monitoraggio, es. sensori di glicemia per diabetici)
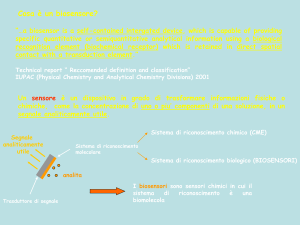
Modalità di classificazione dei sensori
I sensori possono essere classificati secondo schemi diversi:
Potenza richiesta in input: sensori passivi (es. termocoppie) o attivi
(richiedono una fonte di energia esterna o un segnale esterno per funzionare,
ad esempio i termistori)
Natura del segnale in output: sensori digitali o analogici
Modalità di misura del segnale: sensori a deflessione o di zero
Natura del misurando: sensori meccanici, termici, magnetici, (bio)chimici
Grandezza misurata: resistenza, induttanza, capacità, temperatura,
concentrazione
Caratteristiche generali di un sensore
Accuratezza (errore sistematico)
Precisione (errore random)
Discriminazione (limite di rivelabilità):
la minima quantità di misurando che
determina un segnale distinguibile dal rumore
Sensibilità
Selettività
Tempo di risposta
Intervallo di linearità
Isteresi: misura l’errore commesso nelle misurazioni successive a causa del
non perfetto ritorno del sensore alle condizioni iniziali dopo una misurazione
Esempi di sensori fisici
Sensori di spostamento resistivi (un misurando meccanico viene trasformato
in segnale elettrico)
VS
V0
Lo spostamento del contatto mobile sul resistore determina una variazione
della tensione V0; nota la tensione VS e le posizioni delle estremità del
resistore, xmin e xmax, è possibile risalire alla posizione x del contatto, e quindi
allo spostamento, dal valore di V0
Anche rotazioni intorno ad un
asse possono essere monitorate
da misure di resistenza su
resistori di forma opportuna:
Sensori di spostamento capacitivi (un misurando meccanico viene trasformato
in segnale elettrico)
La capacità di un condensatore
viene variata alterando una delle
sue caratteristiche (ad esempio
la natura del dielettrico, e
quindi la sua permittività εr, la
superficie affacciata, A, la
distanza fra le armature, d),
determinando
variazioni
di
tensione fra le armature del
condensatore.
Sensori di deformazione resistivi – strain gauges (un misurando meccanico
viene trasformato in segnale elettrico)
La resistenza di un conduttore può essere modificata dalla sua
deformazione, che ne altera la sezione e la lunghezza e può alterarne anche
la resistività ρ (piezoresistenza)
deformazione
La variazione relativa di resistenza si
può scomporre in due contributi,
quello
geometrico
e
quello
piezoresistivo:
geom.
piez.
ε rappresenta la deformazione relativo nel verso della lunghezza, ossia
dl/l, e ν, detto rapporto di Poisson, descrive la deformazione nelle
direzioni perpendicolari alla lunghezza
Rapportando dR/R a dl/l (ε) si ottiene
il cosiddetto Gauge Factor, G:
Nei resistori metallici domina il contributo geometrico ed il valore di G,
che misura la sensibilità alla deformazione, è piccolo (circa 2); nei
semiconduttori domina il contributo piezoresistivo e G può raggiungere
valori molto elevati (circa 100).
Tipicamente si usano circuiti
in cui il resistore è ripiegato
più
volte
in
modo
da
amplificare l’effetto della
deformazione
longitudinale,
mentre quella trasversale e
quella
di
spessore
sono
minoritarie.
Il circuito, deposto su un film
sottile di materiale isolante,
viene incollato all’oggetto di
cui si vuole monitorare la
deformazione.
La variazione di resistenza, molto piccola in assoluto, viene misurata dallo
sbilanciamento di un ponte di Wheatstone.
Nel caso dei resistori a semiconduttore viene di solito montato anche un
sensore di riferimento, che consenta di valutare l’effetto delle variazioni di
temperatura ma non è sottoposto a deformazione.
Sensori di temperatura: termocoppie
Effetto Seebeck: quando l’estremità della giunzione fra i due metalli A e
B si trova ad una temperatura (T1) diversa da quella delle estremità libere
(TREF) dei due metalli, fra queste si genera una tensione Vout legata alla
differenza di temperatura.
Un esempio tipico di termocoppia è la coppia Ferro/Costantana (lega
Cu/Ni 57:43)
Transizione da un sensore fisico ad un sensore chimico
Una grandezza elettrica può essere modulata anche da una grandezza
chimica, ad esempio dalla variazione di concentrazione di un analita,
purché sia introdotto nel sensore un elemento attivo, che riconosca la
presenza dell’analita.
Sensori di gas resistivi
Un materiale attivo costituisce
il contatto fra due elettrodi
metallici deposti su un blocco
riscaldato.
La resistenza del materiale
viene modulata dalla presenza
di un analita gassoso (odorant).
Esempi di materiale attivo:
ossidi
metallici
drogati,
oligomeri/polimeri conduttori
Sensori chimici
Nei sensori chimici la presenza di un analita viene percepita da un
recettore, determinando in esso variazioni chimico-fisiche che poi
vengono convertite in un segnale misurabile da un elemento detto
trasduttore, posto in intimo contatto con il recettore.
La selettività del sensore viene fortemente influenzata dalla capacità di
riconoscimento del recettore:
I sensori chimici puntano alla semplificazione di una procedura analitica
(strumentale e non) al fine di monitorare un analita in modo pratico, veloce
e con risultati affidabili, rendendo minimo il pre-trattamento del
campione.
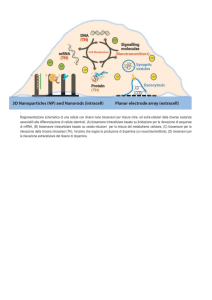
Sensori chimici ad elevatissima selettività: biosensori
La selettività del riconoscimento da parte del
recettore
può
essere
enormemente
incrementata se si impiega un biocomponente
immobilizzato:
enzima, acido nucleico, anticorpo, cellula,
tessuto
sfruttando i meccanismi di riconoscimento
chiave-serratura (lock-and-key) molto comuni
in natura
Definizione IUPAC di biosensore:
ANALYTE
IMMOBILISED
BIOCOMPONENT
TRANSDUCER
SIGNAL
Dispositivo analitico che consiste in un componente biologico immobilizzato,
responsabile del riconoscimento selettivo delle specie analizzate, in intimo
contatto con un opportuno trasduttore, dispositivo che converte la risposta
biochimica in un segnale elettrico quantificabile ed elaborabile
Breve cronistoria dei biosensori
Il primo esempio di “biosensore” fu messo a
punto nel 1962 da Clark e Lyons; era
un’evoluzione dell’elettrodo di Clark per
l’ossigeno, sviluppato nel 1956.
La membrana D, inizialmente di teflon,
permeabile all’ossigeno esterno, che veniva
monitorato sfruttando la riduzione ad H2O2
sull’elettrodo di Pt A, venne sostituita con
una membrana da dialisi in cui era
intrappolato l’enzima glucosio-ossidasi (GOD
o GOx).
L’enzima catalizzava l’ossidazione del glucosio
ad acido gluconico da parte dell’ossigeno.
Il consumo di ossigeno, misurato mediante
l’elettrodo di Clark, poteva essere correlato
alla concentrazione del glucosio, ad esempio
nel sangue.
B = elettr. Ag/AgCl
C = soluz. KCl
Il primo biosensore commerciale, che determinava il glucosio sfruttando
la rivelazione amperometrica dell’H2O2, prodotta dalla riduzione
dell’ossigeno catalizzata dalla GOD, risale ai primi anni ‘70 (Yellow
Springs Instruments, OH, USA)
Ci sono voluti quasi
vent’anni
affinché
l’impatto del mercato dei
biosensori
a
livello
mondiale
diventasse
significativo;
dopo
la
crescita è stata costante:
fonte
2.1
miliardi $
Mediamente il mercato dei biosensori
per il glucosio copre l’87% del totale
Multidisciplinarietà nello sviluppo di biosensori
Classificazioni
BIOSENSORI
BIOCOMPONENTE
ENZIMA
ENZYME
DNA
ANTICORPO
TRASDUTTORE
CELLULA
OTTICO
BIOMIMETICO
ELETTROCHIMICO
(AMPEROMETRICO)
GRAVIMETRICO
ALTRO
Biosensori amperometrici ad enzima immobilizzato
La combinazione fra recettori basati su enzimi e trasduzione elettrochimica
di tipo amperometrico rappresenta la tipologia di biosensore più studiata in
assoluto e nel contempo quella che ha riscosso maggiore successo in termini
di trasformazione in dispositivi commerciali, in ragione di alcuni vantaggi
fondamentali:
costo relativamente basso
ampia disponibilità commerciale di enzimi utilizzabili come recettori e di
informazioni di tipo fondamentale sul loro funzionamento (cinetica,
specificità, effetti di inibizione, ecc.)
relativa semplicità della realizzazione
possibilità di miniaturizzazione
L’analita
di
interesse
rappresenta il substrato per
l’enzima
immobilizzato
nel
biosensore.
Il
substrato
viene
trasformato, nel corso della
reazione
catalizzata
dall’enzima, in una specie
chimica che a sua volta può
essere rivelata direttamente,
ad
esempio
per
via
elettrochimica
(H2O2),
o
indirettamente, attraverso la
variazione di una grandezza
fisico-chimica
da
essa
provocata (ad es. variazione di
pH da parte dell’NH3).
Biosensori amperometrici ad enzima immobilizzato di
prima generazione
red
HM
2 O2
ANALYTICAL
SIGNAL
Eox
Sred
Ered
Sox
ee
MOox
2
ELECTRODE
(+0.7 V vs Ag/AgCl)
Il substrato S reagisce, mediante un processo redox, con l’enzima E, il quale
a sua volta reagisce con l’ossigeno per tornare al suo stato originario.
Tipicamente si produce H2O2 che può essere rivelata per via amperometrica
su un elettrodo metallico (Pt, glassy carbon):
presenza dell’analita
segnale elettrico
Dal punto di vista cinetico il processo può essere modellizzato, ad un primo
livello di complessità, con l’approccio di Michaelis-Menten:
Le velocità del processo è correlata
alla concentrazione della specie che
viene rivelata sul trasduttore del
sensore e quindi alla relativa
intensità di corrente, pertanto la
curva di calibrazione di un
biosensore ad enzima immobilizzato
consente
di
ottenere
utili
informazioni anche sulla cinetica
enzimatica nel dispositivo:
Diagramma di Lineweaver-Burk (o
dei doppi reciproci)
Diagramma di Eadie-Hofstee
Un esempio tipico: biosensore per il glucosio
red
HM
2 O2
ANALYTICAL
SIGNAL
Eox
Sred
Ered
Sox
ee
MOox
2
ELECTRODE
(+0.7 V vs Ag/AgCl)
Sred = GLUCOSIO
Sox = GLUCONOLATTONE
Eox = Glucosio ossidasi-FAD (GOD)
Ered = Glucosio ossidasi-FADH2
FADH2
Interferenze nella rivelazione del glucosio: acido ascorbico
ASCORBIC ACID INTERFERENCE
O2+2H+
S
G
Gl
P
2e SIGNAL
GOD
O2
AA
H 2O 2
H 2O 2
O2
AA
H 2O 2
CHEMICAL INTERFERENCE
DAA
DAA
H2O2
AA
2H2O
DAA + 2H +
dimer
xH2O
DAA + 2H2O
FARADAIC INTERFERENCE
AND
2e ELECTRODE FOULING
(XPS evidence for a hydrated
form of DAA adsorbed on the
electrode surface)
mono or
dihydrated form
AA
Anal. Chem., 65 (1993) 2690;
Anal. Chem., 69 (1997) 4113
Fresenius J. Anal. Chem., 349 (1994) 497 ;
J.Electroanal.Chem., 410 (1996) 181
dia35
AA: acido ascorbico, DAA: acido deidroascorbico
L’acido ascorbico è un interferente tipicamente presente in matrici in cui è
presente anche il glucosio (sangue, liquido cerebrale, ecc.) ed è in grado di
alterare la risposta di un biosensore al glucosio sia a causa della scarica
elettrodica diretta (interferenza faradaica) sia reagendo con l’ossigeno o
con l’acqua ossigenata (interferenza chimica)
La scarica elettrodica porta all’avvelenamento della superficie elettrodica a
causa della formazione di film superficiali contenenti carbonio e ossigeno
(XPS)
Altri analiti possono
provocare
un’interferenza
faraidica
(urato,
paracetamolo, cisteina,
ecc.)
Macromolecole
(proteine)
possono
avvelenare l’elettrodo
che
funge
da
trasduttore.
Electrode
fouling
High Molecular Weight Components
red
HM
2 O2
ANALYTICAL
SIGNAL
Sred
Ered
Sox
ee
ox
MO
2
Interfering
signal
Eox
ELECTRODE
Electroactive Interferents
Urate, ascorbate, paracetamol, .....
(+0.7 V vs Ag/AgCl)
Approccio classico all’immobilizzazione del biocomponente e
alla protezione del trasduttore dalle interferenze
(Antifouling)
(Anti-interferent)
Membrana anti-avvelenamento: una membrana di porosità opportuna
impedisce l’accesso delle macromolecole all’elettrodo
Strato enzimatico: una membrana più interna immobilizza l’enzima
Strato anti-interferenti: una membrana in acetato di cellulosa impedisce
l’accesso all’elettrodo degli analiti interferenti
Problematiche dell’approccio multi-membrana
* Limitazione bi-dimensionale nella fabbricazione del biosensore
* Difficoltà nella miniaturizzazione
* Necessità di un assemblaggio individuale dei biosensori
* Complessità nei profili diffusionali degli analiti attraverso le membrane
*Tempi di risposta elevati (anche minuti)
*Repulsione degli interferenti non sempre efficace
Approccio alternativo: immobilizzazione dell’enzima in polimeri
elettrosintetizzati con proprietà anti-interferenti e anti-avvelenamento
NON-CONDUCTING
THIN FILMS WITH
BUILT-IN SELECTIVITY
ENZYME
IMMOBILIZATION
Covalent
Covalentbinding
bindingofof
enzymes
enzymes
ELECTROPOLYMERISED
FILMS
SURFACE
FUNCTIONALIZATION
Covalent binding of
antibodies
NON
CONDUCTING
POLYMERS
MOLECULAR
IMPRINTING
Fast response,
Interference-free
biosensors
High
Highstability
stability
Biosensors
Biosensors
and/or
and/or
Enzymatic
Enzymatic
reactors
reactors
ELECTROCHEMICAL
IMUNOSENSORS
BIOMIMETIC
SENSORS
Strategia di immobilizzazione: l’enzima viene immobilizzato sull’elettrodo da
parte di un polimero ottenuto in situ per elettropolimerizzazione:
Soluzione contenente il monomero,
l’elettrolita di supporto e l’enzima
La polimerizzazione
avviene in un sistema a
tre elettrodi per
voltammetria ciclica o in
condizioni potenziostatiche
o galvanostatiche
Vantaggi principali:
) la deposizione della membrana polimerica è totalmente controllabile, in
termini di superficie e volume, per via elettrochimica ed avviene in un solo
stadio
) è possibile ottenere film polimerici con proprietà modulabili mediante un
opportuna scelta del monomero e delle condizioni della polimerizzazione
In
particolare,
i
materiali
polimerici
elettrosintetizzati
possono essere resi permselettivi,
ossia permettere la diffusione
verso l’enzima E del substrato
(analita) ma non quella verso
l’elettrodo degli interferenti e
delle macromolecole.
E
L
E
C
T
R
O
D
E
E
Electroactive
Interferents
or
high
molecular
weight
components
E
Enzyme Substrate
E
Diffusing mediator
e.g., O2
E
L’enzima può collocarsi preferenzialmente in prossimità della superficie
elettrodica se gli si consente un adeguato adsorbimento prima di dare inizio
alla polimerizzazione elettrochimica del monomero
Il prodotto della reazione redox catalizzata dall’enzima può essere più
facilmente convogliato verso l’elettrodo e quindi si riduce la sua perdita per
diffusione verso l’esterno attraverso il film polimerico
Polimeri elettrosintetizzati non conduttori
nei biosensori amperometrici: poli(orto)fenilendiammina, PPD
L’ossidazione
dell’o-fenilen
diammina (1,2-diammino-benzene)
su elettrodo di platino da
soluzioni acquose neutre porta
alla formazione di un film
polimerico sottilissimo (circa 10
nm, stimato da misure XPS) a
causa della progressiva difficoltà
nell’ulteriore
ossidazione
del
monomero all’elettrodo.
0.5
0.0
c o rr e n te / m A
-0.5
3
-1.0
pH 7
2
-1.5
-2.0
-2.5
-3.0
1
800
600
400
200
0
potenziale/ mV
Il polimero ottenuto, PPD, è in grado di “sigillare” l’elettrodo, formando una
membrana non facilmente permeabile a molecole di dimensioni medio-grandi
Indagini
XPS
sul
materiale
mostrano
la
presenza
di
funzionalità
ossidriliche
e
amminiche primarie, in grado di
interagire
con
enzimi,
facilitandone l’immobilizzazione,
ma anche di gruppi imminici e
amminici secondari:
N
NH 2
N
n
NH 22
polyphenazine-like
NH 2
NH
NH 2
NH 2
n
polyaniline-like
H
N
NH 2 O
N
NH 2
NH 2
N
OH
“defects”
Indagini ESI-MS sulla soluzione di polimerizzazione dell’oPD a vari tempi e in
varie condizioni (pH, tempo di reazione) consentono di individuare oligomeri
solubili che riflettono la struttura ipotizzata per il polimero depositato
sull’elettrodo e consentono la costruzione di un meccanismo:
Head-to-tail
coupling
Part II
La PPD usata tal quale
(Pristine)
mostra
una
capacità elevatissima di
impedire
l’accesso
all’elettrodo
a
molecole
potenzialmente interferenti
per
il
biosensore,
a
prescindere
dalla
loro
polarità.
Se tuttavia la si sottopone a
voltammetria
ciclica
prolungata
in elettrolita
(Cycled), la PPD si ossida e
perde
compattezza,
peggiorando drasticamente
la sua permselettività.
Van der
Waals molar
volume
(cm3/mol)
Aniline
Resorcinol
Acetaminophen
Hydroquinone
o-PD
Dopamine
Uric Acid
Ascorbic acid
Fe(CN)64Fe(II)
Fc-COOH
PMS
Glucose
56
57
81
57
63
84
69
78
92
102
135
110
82
Log P Pristine Cycled
+0.85
+0.80
+0.51
+0.50
+0.15
-0.98
-1.85
-2.88
hh
hh
unknown
unknown
excluded
excluded
excluded
excluded
excluded
excluded
excluded
excluded
excluded
excluded
excluded
admitted
admitted
admitted
admitted
admitted
admitted
admitted
admitted
admitted
excluded
excluded
excluded
admitted
admitted
admitted
excluded
P = n-octanol/water partition
constant
hh = highly hydrophilic
Fc-COOH = Ferrocen carbossilic
acid
PMS = Phenazine methosulphate
Icov/Ibare < 0.01
Polimeri elettrosintetizzati non conduttori
nei biosensori amperometrici: polipirrolo, PPy
Anche il pirrolo può essere
polimerizzato
per
ossidazione
elettrochimica
La polimerizzazione è innescata dai
radicali cationi del pirrolo e
prosegue per accoppiamento fra
radicali o fra radicali e neutri.
Gli oligomeri sono ancora più
facilmente ossidabili a radicali
cationi,
ciò
favorisce
la
polimerizzazione
elettrochimica,
specialmente in solvente non
acquoso.
La polimerizzazione del pirrolo può essere effettuata sia per voltammetria
ciclica sia per via potenziostatica (ad es. su Pt a + 0.7 V vs Ag/AgCl)
Il polimero così ottenuto è
conduttore/elettroattivo
grazie alla presenza lungo le
sue catene di radicali cationi
(polaroni) e di bi-cationi (bipolaroni)
formatisi
per
estrazione di elettroni dal
sistema π coniugato.
Le
cariche
positive
localizzate sulle catene sono
controbilanciate da anioni
dell’elettrolita di supporto
(ioni dopanti) presente nella
soluzione di polimerizzazione,
che vengono inglobati nella
struttura polimerica.
Xpolarone
Xbipolarone
X-
Essendo conduttore, a differenza
della PPD, il polipirrolo consente
l’ulteriore deposizione di monomero
su se stesso, in modo limitato
soltanto dalla disponibilità di
monomero in soluzione.
PPy
Si ottengono film di spessore
anche molto elevato (μm!) ed è
molto semplice inglobare in essi, e
quindi immobilizzare sull’elettrodo,
enzimi, specialmente se la carica su
questi è negativa
Sottoponendo
a
voltammetria
ciclica un film di polipirrolo in
elettrolita di supporto (ad esempio
KCl 0.1 M) si ottiene un
voltammogramma complesso per
effetto dell’ossidazione/riduzione
sulle
catene.
La
presenza
dell’enzima non influenza molto la
voltammetria (linea tratteggiata)
-0.8 V
+0.6 V
ox
red
Il polipirrolo conduttore (pristino) non è adatto alla realizzazione di un
biosensore perché risponde bene, elettrochimicamente, ai tipici
interferenti elettroattivi presenti in matrici biologiche (ascorbato, urato,
ecc.)
E’ possibile, tuttavia, modificarne completamente l’elettroattività
mediante un processo noto come overossidazione o sovra-ossidazione.
Mantenendo il film polimerico ad un
potenziale ossidativo (ad es. + 0.7 V
vs Ag/AgCl) per più ore/giorni in un
elettrolita a pH neutro/basico, se ne
modifica la struttura completamente
e l’elettroattività viene praticamente
annullata.
PPy overossidato
L’analisi XPS a bassa risoluzione
(survey scan) del PPy pristino e
ossidato mostra alcune differenze
sostanziali nella composizione del
polimero
in
superficie
dopo
l’overossidazione:
aumenta il contenuto di ossigeno
scompare il segnale del Cl, legato
all’anione Cl- presente nel PPy
compaiono piccoli segnali del P,
legati ad anioni fosfato presenti nel
tampone di overossidazione
PPy PRISTINO
PPy OVEROSSIDATO
L’analisi XPS alta risoluzione (survey
scan) sul segnale C1s, implementata
da fitting spettrale, evidenzia la
correlazione fra aumento di ossigeno
ed incremento di funzionalità
ossigenate del carbonio (C-OH, C=O
e COOH).
Le bande di shake up anomale si
riferiscono a transizioni fra i livelli
introdotti dai polaroni/bipolaroni nel
gap HOMO/LUMO del PPy.
La diminuzione di queste ultime (le
bipolaroniche
scompaiono)
e
l’incremento
di
funzionalità
imminiche (C=N) sono correlate
all’incremento
di
funzionalità
ossigenate del carbonio, attraverso
la formazione di nuovi “difetti”
strutturali
Durante l’overossidazione il PPy
perde coniugazione e spesso subisce
rottura
di
catena,
perdendo
l’elettroattività iniziale
%
L’analisi XPS alta risoluzione (survey
scan) sul segnale N1s, implementata
da fitting spettrale, evidenzia la
presenza di quattro intorni chimici
dell’azoto, due dei quali correlati alle
unità polaroniche (c) e bipolaroniche
(d).
PPy
PPyox
a
b
HO
c
d
O
NH
N
O
O
NH
NH2
OH
Dal punto di vista della permselettività, la formazione di nuovi gruppi
funzionali ossigenati rende il materiale molto efficiente nella repulsione di
numerosi interferenti, soprattutto quelli critici per l’analisi del glucosio
(ascorbato in particolare):
Andamento della corrente
dovuta
all’ossidazione
dell’ascorbato
su
un
elettrodo
Pt/PPyox-GOD
registrata in modalità FIA
a due diversi potenziali per
tempi successivi
+ 0.3 V
+ 0.7 V
L’ulteriore ossidazione del
film di PPyox, a 0.7 V (ma non
a 0.3 V) lo rende sempre più
selettivo
all’ascorbato,
impedendogli di accedere
all’elettrodo di Pt.
FIA: Flow Injection Analysis
Prestazioni di un biosensore Pt/PPyox/GOD
G, G’: glucosio 5, 10 mM
S = campione di siero
biosensore
L’applicazione del dispositivo in
misure FIA mostra un’ottima
riproducibilità nel responso, pur
alternando campioni reali e
standard.
INTERFERENTE
L’errore sistematico provocato
nella determinazione del glucosio
(glucose
bias)
da
tipici
interferenti
elettroattivi
è
molto piccolo o del tutto
assente.
GLUCOSE
BIAS
Ascorbato (0.1 mM)
14 μM
Urato (0.5 mM)
80 μM
Cisteina (0.08 mM)
40 μM
Paracetamolo (0.2
mM)
Non rivelabile
Biosensori amperometrici ad enzima immobilizzato:
seconda generazione
Una limitazione importante per i biosensori di prima generazione
realizzati con enzimi come la GOD è la dipendenza dall’ossigeno,
necessario per riossidare l’enzima.
3000
1800
N2
1600
2500
1400
2000
1200
1000
1500
800
1000
600
glucose
a'
400
500
oxygen
0
200
b'
0
G 10 mM
-500
0
20
40
60
Time / min
Pt/PPYox/GOD
80
Oxygen response / nA
Glucose response / nA
Se nel corso di una misura in
flusso
di
glucosio
su
Pt/PPyox/GOD
si
insuffla
azoto nella soluzione il segnale
diminuirà
progressivamente
perché non potrà continuare a
formarsi H2O2.
Il monitoraggio in parallelo
dell’O2 per via elettrochimica,
mostra la sua diminuzione
progressiva e con essa quella
del segnale.
Nei
biosensori
di
seconda generazione è
una
specie
redox,
introdotta
appositamente,
a
riossidare l’enzima al
posto dell’O2:
NMP.TCNQ
NMP° + TCNQ °
P
GODred
2-
TCNQ
e
GODox
G
e
+
NMP + TCNQ ELETTRODO
Eappl= + 0.2 V vs Ag/AgCl
In questo caso l’elettrodo è costituito da una
pasta del sale organico conduttore (COS)
TetraCianoChinoMetanuro di N-Metil-Fenazinio
(NMP TCNQ), inserita in un pozzetto metallico.
L’enzima GOD può essere adsorbito sulla
superficie elettrodica.
Soluzione di glucosio (G)
contatto el.
teflon
NMP TCNQ
La risposta di dispositivi di questo tipo soffre moltissimo per l’interferenza
di altri analiti elettroattivi come l’ascorbato. Un notevole miglioramento si
ottiene inglobando l’enzima in un film permselettivo, come la PPD,
depositato per via elettrochimica sull’elettrodo conduttore:
NMP.TCNQ
NMP° + TCNQ °
GODred
P
P
G
G
2-
TCNQ
e
GODox
e
AA
+
NMP + TCNQ ELETTRODO Eappl= + 0.2 V vs Ag/AgCl
ELETTRODO
Film di PPD
GLUCOSE BIAS (mM)
(Ascorbato 0.1 mM)
TTF.TCNQ (GOD adsorbito)
TTF.TCNQ/Nafion
(GOD + Ascorbato Ossidasi)
NMP.TCNQ/GOD/PPD
Soluzione di
glucosio (G)
BIBLIOGRAFIA
6.9
0.3
Anal. Chem., 1991,63,2961
J.Electroanal.Chem., 1992,334,183
0.1
J.Electroanal.Chem., 1995,381,235
Il confronto delle risposte FIA
per l’acido ascorbico (AA),
l’acido
urico
(UA),
il
paracetamolo (PA) e la cisteina
(CYS) su un elettrodo a base di
NMP TCNQ ricoperto o meno
da un film di PPD evidenzia la
permselettività introdotta nel
dispositivo
dal
polimero
elettrosintetizzato.
Elettrodo NMP.TCNQ
senza PPD
con PPD
I biosensori a NMP TCNQ di seconda generazione soffrono di uno
svantaggio fondamentale: la difficoltà di riproducibilità e di produzione
su larga scala, legate alla fase di preparazione della pasta elettrodica
(NMP TCNQ impastato con una soluzione di PVC)
Biosensori amperometrici ad enzima immobilizzato:
terza generazione
Nei dispositivi di terza generazione si impiega sempre un sale organico
conduttore ma prodotto in situ.
Un esempio è il biosensore Pt/PPYox/TTF TCNQ/GOD (BSA):
TTF.TCNQ
GOD
Pt
Il sale organico si ottiene depositando
prima uno strato di TetraTiaFulvalene
(TTF), o di NMP, e poi uno di TCNQ su
un film di PPyox.
Un elettrone passa dal sistema π del
TTF a quello del TCNQ formando una
coppia ionica.
PPYox
TTF
BSA-glut
Il sale organico TTF TCNQ cristallizza
lentamente formando strutture “ad
albero”
che
fuoriescono
dalla
superficie del PPyox.
L’enzima Glucosio Ossidasi viene
immobilizzato in questo caso per crosslinking con la proteina BSA (Albumina
di Siero Bovino) legata al PPyox
mediante ponti di glutaraldeide.
N2
glucosio
1400
800
Glucose response / nA
L’enzima GOD e il sale organico
risultano così in intimo contatto
e la risposta del dispositivo
risulta
indipendente
dalla
presenza dell’ossigeno.
1200
600
1000
800
400
100 mV vs Ag/AgCl
200
600
400
ossigeno
0
0
G 10 mM
0
20
40
Time / min
200
60
80
ELETTRODO TTF.TCNQ-GOD
Oxygen sensitive response / nA
1600
1000
PPyox
Pt
E
red
S0
Eox
P0
k’ s
S
k’
e-
P
Membrana BSA (glut)-GOD
Le ramificazioni di TTF TCNQ fanno da “connettori” fra l’enzima e la
superficie elettrodica, dunque si ipotizza che esse attraversino
completamente il film di PPYox.
glucosio
[G] = 5 mM
400
glucosio
[G] = 5 mM
350
Current / nA
300
250
200
150
100
UA
UA
AC
AC
AA
AA
50
Cys
Cys
0
0
50
100
Time / min
150
200
Nel dispositivo non si osservano interferenze significative:
☺ essendo le ramificazioni di TTF TCNQ conduttrici, si può ipotizzare
che esse siano ricoperte dall’enzima GOD, che così impedisce l’accesso
degli interferenti elettroattivi alla superficie delle ramificazioni
☺ il film di PPyox impedisce che gli stessi interferenti possano
raggiungere il substrato di Pt, generando una corrente.
Biosensori amperometrici ad enzima immobilizzato:
architetture complesse
La permselettività di un biosensore può essere ulteriormente
incrementata se si depositano, uno sull’altro, due film polimerici
permselettivi:
Lattato ossidasi
Strato di PPD
Pt
Strato di PPyox
In questo caso il PPy, prima di essere overossidato, funge da substrato
per la polimerizzazione della PPD in presenza dell’enzima lattato
ossidasi
INTERFERENTE
Ascorbato 0.1 mM (10 mM)
Cisteina 0.08 (10 mM)
Urato 0.5 mM
Paracetamolo 0.2 mM (10 mM)
LACTATE BIAS (2 mM)
n.d. (0.01%)
n.d. (0.03%)
n.d.
n.d. (0.15%)
L’enzima
può
anche
essere legato al film
polimerico
esterno
mediante
gruppi
funzionali reattivi (ad es.
OH o NH2) usando la
glutaraldeide
come
cross-linker:
Poly(tyramine)
Poly(pyrrole)
Pt
O
O
O
O
O
O
O
H
H
H2N
O
Enz
glutaraldehyde
NH2
N
N
Poly(tyramine)
O
H
Enz
N
La disponibilità di gruppi reattivi alla superficie del materiale può essere
sfruttata anche per legare molecole di biotina e, attraverso la mediazione
dell’avidina, enzimi biotinilati:
O
HN
NH
E
O
O
(CH2)4
S
HN
NH
N
E
E
H
(CH2)4
O
AVIDINA
N
BIOTINA
O
HN
ENZIMA
BIOTINILATO
OH
O
S
E
NH
POLIMERO BIOTINILATO
O
S
(CH2)4
N
H
N
O
3
ELETTRODO
I gruppi reattivi superficiali possono essere impiegati anche per legare altre
biomolecole come gli anticorpi, realizzando immunosensori.
Monitoraggio in vivo mediante biosensori amperometrici ad
enzima immobilizzato: dispositivi miniaturizzati
Il controllo elettrochimico della polimerizzazione offre la possibilità di
realizzare strati polimerici con enzimi immobilizzati anche su superfici
piccolissime, ad esempio è possibile far passare un sottilissimo filo di platino
attraverso la cavità di un ago per infusione endovenosa:
Butterfly 21 (venisystem – Abbot)
Il filo di Pt, la cui sezione ha un diametro
di 125 μm, funge da elettrodo di lavoro e
viene isolato mediante una resina (in giallo)
dal corpo metallico dell’ago (in grigio), che
funge
contemporaneamente
da
controelettrodo
ed
elettrodo
di
riferimento.
Pt
125 μm
Dal punto di vista idrodinamico il disco
elettrodico microscopico si comporta in
modo simile ad un RDE, ossia lo strato di
diffusione per la scarica di analiti è
praticamente costante.
Responso FIA per aggiunte successive di
glucosio 1 mM su elettrodo ad ago:
La curva di calibrazione mostra la
tipica
curvatura
alle
alte
concentrazioni
legata
al
raggiungimento della saturazione dei
siti attivi dell’enzima:
Monitoraggio in vivo mediante biosensori amperometrici ad
enzima immobilizzato: campionamento con fibre da microdialisi
L’impianto di un microbiosensore in vivo può presentare notevoli difficoltà
legate a biocompatibilità, stabilità, dipendenza dalla concentrazione di O2,
impossibilità di calibrare il responso.
Una possibile alternativa è rappresentata dall’uso di un sensore esterno al
quale l’analita giunge dopo essere stato campionato in vivo con una fibra da
microdialisi:
biosensore
pompa
cute
fibra
Fibra cava in
cellulosa
rigenerata,
d.i.: 150 μm
spessore
parete: 9 μm
Cut off peso
mol.: 9000 Da
tubo in nylon
L’analita di interesse passa attraverso la fibra per diffusione passiva
mentre le macromolecole vengono bloccate. Eventuali interferenti passati
attraverso i pori della fibra verranno bloccati dai film anti-interferenza del
biosensore.
Il biosensore può essere periodicamente calibrato con soluzioni standard
infuse al suo interno da un’accesso alternativo a quello collegato alla fibra.
inf. gl.
Monitoraggio sub-cutaneo del glucosio in un animale da laboratorio: a)
biosensore by-passato; b: livello di glucosio iniziale, c) andamento del
glucosio dopo infusione nell’animale di 2 g di glucosio
Monitoraggio del glucosio con biosensori usa-e-getta (disposable)
Molti biosensori usa-e-getta per il
glucosio si basano sull’uso di
microelettrodi
realizzati
per
microlitografia:
el. rif.
el. lavoro
controelettrodo
La goccia della soluzione da
analizzare (spesso sangue tal quale,
ottenuto praticandosi una micropuntura su un polpastrello con
speciali lancette sterili) viene posta
sulla zona sensibile del sensore
L’elettrodo di lavoro può essere ricoperto con film singoli o multipli di
polimero elettrosintetizzato che immobilizza l’enzima. Anche in questo caso,
date le dimensioni della superficie elettrodica, il regime idrodinamico è
quello dell’RDE, pur essendo ovviamente la soluzione quiescente.
I biosensori usa-e-getta per il
glucosio
più
comuni
in
commercio
attualmente
(si
stima che se ne consumino 10
miliardi all’anno!) si basano su
sistemi di seconda generazione,
in cui un mediatore redox
riossida la GOD:
Gli elettrodi screen-printed si ottengono stampando sul substrato gli
elettrodi con inchiostri modificati, contenenti materiale conduttore, ad
esempio grafite per elettrodo di lavoro e controelettrodo e paste Ag/AgCl
per l’elettrodo di riferimento.
I mediatori, spesso brevettati, consentono di lavorare a potenziali ossidativi
bassi (quasi 0 V vs Ag/AgCl) impedendo la scarica redox di tipici interferenti
come l’ascorbato.
Biosensori amperometrici ad enzima immobilizzato:
applicazioni in campo ambientale
Monitoraggio di composti fenolici mediante biosensori con laccasi o tirosinasi
R
HO
O2
H2O
Soluzione
1. Attività monofenolasica
Enz
2. Attività catecolasica
HO
Riciclo del prodotto e
Amplificazione enzimatica
1
2
R
R
O
O
HO
2e-
Enzima:
Tirosinasi
oi
Laccasi
Potenziale di lavoro
- 0.05 V vs. Ag/AgCl
Polimero:
PPD o PPY
Elettrodo:
Materiale
carbonioso
1 min
0.2 nA
Acqua fortificata con 0.5 ppb di fenolo
(limite UE per l’acqua potabile)
Biosensori amperometrici ad enzima immobilizzato:
analisi simultanea di più analiti su microsensori multipli
La
tecnologia
dei
microsensori consente di
realizzare
facilmente
elettrodi
multipli,
controllabili con multipotenziostati.
Pt/PPYox/LOD
ELECTRODO
PER LATTATO
Pt/PPYox/GOD
ELETTRODO PER
GLUCOSIO
I due biosensori lavorano
indipendentemente
ma
sulla stessa soluzione!
Il doppio sensore può
essere impiegato sia per
misure
su
soluzione
quiescente che
per
misure FIA se montato in
una cella in flusso.
I risultati mostrano che non c’e’ interferenza di segnale fra i due biosensori,
legata alla diffusione verso uno dei due dell’H2O2 prodotta dall’altro (crosstalk). Tale problema diventa importante quando le dimensioni e la spaziatura
fra gli elettrodi diventano sub-millimetriche.
Biosensori con recettori anticorpali, cellulari o “tissutali”
Anticorpi (ma anche filamenti di DNA/RNA) immobilizzati su una superficie
possono essere sfruttati per la rivelazione altamente specifica dei
corrispondenti antigeni (o delle catene di DNA/RNA complementari)
L’analita-antigene
può
essere
preventivamente marcato con un
fluoroforo o con un marcatore
radioattivo ed essere rivelato per
via ottica o radiometrica, dopo
aver opportunamente lavato il
substrato sensibile:
Il legame fra analita-antigene e sito recettore anticorpale o fra filamenti
di DNA/RNA complementari può essere monitorato in tempo reale, anche
in sistemi in flusso, sfruttando variazioni microgravimetriche,
meccaniche o ottiche sulla superficie dell’elemento sensibile:
Dispositivo ad onde
acustiche di bulk (Bulk
Acoustic Wave, SAW)
L’applicazione di un potenziale alternato ai due elettrodi di oro che
racchiudono una lamina di quarzo genera la vibrazione di quest’ultima
(frequenza di alcuni MHz) per effetto piezoelettrico e, di conseguenza,
un’onda acustica che si propaga dalle due superfici di oro verso l’esterno.
Se su una di queste si depositano filamenti recettori di DNA/RNA (o
anticorpi), il riconoscimento e il legame con filamenti complementari (o
con l’antigene) porterà ad una variazione misurabile della frequenza
dell’onda acustica.
Per
microlitografia
è
possibile
ottenere serie di microleve metalliche
su cui possono essere depositati
recettori oligonucleotidici:
Il legame con filamenti complementari altera la massa che insiste sulla
microleva e la fa flettere. La deflessione può essere misurata dallo
spostamento di una radiazione riflessa dalla parte inferiore della
microleva.
Anche una singola cellula può essere
depositata
su
un
substrato
biocompatibile,
diventando
l’elemento di riconoscimento.
L’interazione con l’analita determina
un segnale chimico, ossia la
liberazione da parte della cellula di
un’altra molecola che può essere poi
rivelata, o fisico (ad esempio la
produzione di impulsi elettrici da
cellule nervose).
I recettori pseudo-tissutali sono
ottenuti deponendo cellule di tipo
diverso, naturalmente presenti in un
tessuto, su strutture portanti
biocompatibili (scaffold) realizzate
per microlitografia.
Vantaggi/svantaggi di recettori cellulari/tissutali
I biosensori basati su cellule/pseudo-tessuti presentano una specificità di
risposta ad un particolare analita ed una sensibilità notevolmente più elevate
di quelle di enzimi/anticorpi/acidi nucleici
Se la cellula è vitale i recettori, canali ed enzimi che le appartengono e che
intervengono nella risposta sono nel loro stato fisiologico, laddove enzimi, o
altre biomolecole, immobilizzati in modo isolato possono cambiare la loro
conformazione
In futuro potrebbero diventare dei sistemi sostitutivi dei test sugli animali
Può essere difficilissimo mantenere cellule e tessuti in uno stato vitale
dopo averli immobilizzati su substrati xenobiotici, pur resi biocompatibili
La reperibilità delle cellule/tessuti può essere complicata
Trasduzione ottica nei biosensori
Tipo di misura
Variazioni misurate
Componenti strumentali
Assorbanza
Fluorescenza
Indice di rifrazione
Diffusione
Intensità
Frequenza
Shift di fase
Polarizzazione
Fibre ottiche
Guide d’onda
Fotodiodi
Interferometri
Trasduzione ottica basata su fibre ottiche
Una singola fibra ottica può
consentire di gestire sia la
radiazione incidente sul campione
che quella emessa, nel caso di
trasduzione per fluorescenza.
E’ possibile, tuttavia, aumentare la
sensibilità
raccogliendo
la
radiazione emessa con una o più
fibre:
Quando la fibra ottica svolge unicamente il ruolo di trasportatore della
radiazione da e verso l’elemento di riconoscimento il sensore ottico si
definisce estrinseco.
Nei sensori ottici definiti intrinseci l’elemento di riconoscimento del
biosensore è invece immobilizzato direttamente sulla fibra:
Trasduzione ottica basata sulla risonanza plasmonica di
superficie (Surface Plasmon Resonance, SPR)
Quando una radiazione luminosa
di lunghezza d’onda λ giunge alla
superficie di separazione fra
mezzi diversi, passando da quello
con indice di rifrazione maggiore
all’altro, esiste un angolo di
incidenza per cui si verifica la
riflessione totale.
In realtà il campo elettrico ad
essa
associato
riesce
a
propagarsi per uno spessore di
circa λ/4 all’interno del secondo
mezzo (onda evanescente).
Se il secondo mezzo è un metallo, la componente di tale campo diretta
lungo la superficie di separazione può mettere in risonanza gli elettroni
liberi presenti nella banda di conduzione (plasmoni) dando origine ad
un’onda elettromagnetica che può propagarsi nel mezzo esterno al metallo.
Il fenomeno dell’onda evanescente
determina
una
perdita
di
riflettività alla superficie vetrometallo, che è massima ad un angolo
di incidenza dipendente dall’indice
di rifrazione del mezzo esterno al
metallo:
Nei biosensori di tipo SPR
lo strato esterno al
metallo è modificato con
recettori biochimici.
La loro interazione con
l’analita determina una
variazione dell’angolo a
cui la riflettività è
minima.
La variazione dell’angolo di minima riflettività viene valutata monitorando
su un rivelatore bidimensionale la radiazione riflessa derivante da un
fascio di luce laser polarizzata.
L’andamento di tale variazione in funzione del tempo (sensorgramma)
consente di studiare anche la cinetica di interazione fra analita e
recettore biologico:
Il futuro dei biosensori
Biosensors