Prospettive in Pediatria
Luglio-Settembre 2016 • Vol. 46 • N. 183 • Pp. 241-249
Frontiere
Nuovi approcci
nella terapia delle
malattie mitocondriali
Massimo Zeviani
Emanuela Bottani
Carlo Viscomi
MRC Mitochondrial Biology Unit,
Cambridge, UK
Le malattie mitocondriali sono un importante gruppo di malattie genetiche caratterizzate
dal malfunzionamento della fosforilazione ossidativa (OxPhos), il processo che converte
l’energia ottenuta dalle sostanze nutritive in ATP, la molecola ad alta energia utilizzata dalle
cellule. Questi disordini sono caratterizzati da un’estrema variabilità di sintomi, coinvolgimento di organi e decorso clinico, con un notevole impatto sulla qualità e, spesso, sulla
durata della vita. Benché negli ultimi 20 anni si sia assistito a un impressionante aumento
delle nostre conoscenze sui meccanismi genetici e biochimici alla base delle malattie mitocondriali, lo sviluppo di approcci terapeutici in grado di migliorare in modo significativo il
decorso clinico non è stato altrettanto soddisfacente. Al momento, la terapia delle malattie
mitocondriali rimane basata su interventi supportivi, mirati ad affrontare le complicanze
della malattia. Tuttavia negli ultimi anni sono emerse nuove strategie terapeutiche, la cui
efficacia è stata dimostrata almeno a livello preclinico. Questo articolo riassume i risultati
principali ottenuti dalla terapia sperimentale e illustra alcuni degli sviluppi futuri in questo
campo.
Riassunto
Mitochondrial disorders are an important group of genetic conditions characterised by
impaired oxidative phosphorylation (OXPHOS). Mitochondrial disorders come with an
impressive variability of symptoms, organ involvement and clinical course, which considerably impact the quality of life and often shortens life expectancy. Although in the last
20 years there has been an exponential increase in understanding the genetic and biochemical mechanisms leading to the disease, this has not resulted in the development of
effective therapeutic approaches that have significantly improved the clinical course and
outcome of these conditions. Therapeutic options for mitochondrial diseases still remain
focused on supportive interventions aimed at relieving complications. However, new therapeutic strategies are recently emerging, some of which have shown potential efficacy at
the pre-clinical level. This review will present the state of the art on experimental therapy
for mitochondrial disorders.
Summary
Introduzione
Concetti di base di biologia e medicina
mitocondriale
I mitocondri sono organelli semiautonomi circondati
da una doppia membrana lipidica, esterna e interna;
quest’ultima si ripiega a formare numerose invaginazioni chiamate cristae mitocondriali, sulle quali sono
posizionati i complessi della catena respiratoria (CR).
I mitocondri convertono l’energia liberata dalla degradazione ossidativa completa di zuccheri e acidi
grassi, un processo noto come respirazione cellulare e i cui prodotti finali sono CO2 e H2O, in calore e
ATP, la molecola energetica della cellula. Respirazione e sintesi di ATP sono processi accoppiati che definiscono la via metabolica nota come fosforilazione
ossidativa (OXPHOS). La respirazione è svolta da
quattro complessi della CR (complessi I-IV, CI-CIV)
che trasferiscono gli elettroni, estratti dai nutrienti in
forma di atomi di idrogeno, all’ossigeno molecolare.
Gli elettroni sono convogliati alla CR in forma di due
intermedi di riduzione, il NADH che cede elettroni al
gruppo prostetico FMN, incorporato nel CI, e il FADH2
che fa parte sia del CII (il quale riceve elettroni principalmente dal ciclo di Krebs) sia di altre deidrogenasi
mitocondriali (es. la Electron-Transfer Factor dehydrogenase – ETF-DH, per quanto riguarda gli intermedi
241
M. Zeviani et al.
della beta ossidazione degli acidi grassi). Sia il NADH
sia il FADH2 donano elettroni al coenzima Q (CoQ),
un trasportatore di elettroni idrofobico mobile della
membrana mitocondriale interna. Il flusso elettronico
che determina la riduzione del CoQ avviene mediante centri ossidoriduttivi ferro-zolfo (Fe-S) contenuti sia
nel CI (8 centri Fe-S), sia nel CII (3 centri Fe-S). Il
CoQH2 (ridotto) dona elettroni al CIII, che a sua volta li
trasferisce a un’altra “navetta” ossidoriduttiva mobile,
il citocromo c, mediante l’azione di due citocromi, c1 e
b, e un centro Fe-S incorporato in una proteina catalitica, la proteina di Rieske. Il citocromo c è un elemento redox mobile che cede un elettrone per volta al CIV
(citocromo c ossidasi, COX), il quale infine opera la
riduzione di O2 molecolare a H2O. Nei complessi I, III,
e IV, ma non in CII, il flusso elettronico libera energia,
che sostiene l’attività di pompe protoniche incorporate nei complessi stessi per effettuare la traslocazione
di protoni (H+) dall’interno del mitocondrio (matrice)
allo spazio intermembrana. Si genera in questo modo
un potenziale elettrochimico di membrana (ΔP), formato da una componente elettrostatica (ΔY) e una
chimica (ΔpH), che è infine utilizzato dal complesso V
della CR (ATP sintasi) per condensare ADP e fosfato
inorganico in ATP (Wallace et al., 2010).
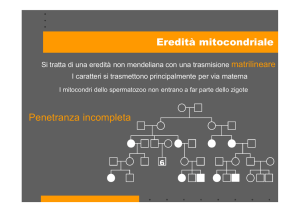
I mitocondri hanno un proprio genoma (DNA mitocondriale – mtDNA), ereditato per via matrilineare e
costituito nei mammiferi da una molecola circolare di
16,5 kb che codifica 13 subunità dei complessi I, III,
IV e V della CR (il complesso II è invece composto da
4 subunità tutte codificate dal DNA nucleare). Inoltre,
il mtDNA contiene geni codificanti 22 RNA transfer
(mt-tRNA) e 2 RNA ribosomali (mt-rRNA), necessari
per la traduzione in situ delle 13 subunità della CR codificate dal mtDNA. Il mtDNA è presente in centinaia o
migliaia di copie nei vari tipi cellulari di ogni individuo.
Negli individui sani, tutte le molecole di mtDNA sono
uguali tra loro, una condizione definita come omoplasmia. Per contro, nei pazienti con mitocondriopatia,
genomi mitocondriali mutati spesso coesistono con
genomi normali (eteroplasmia). Il resto del proteoma
mitocondriale, stimato intorno a 1500 polipeptidi, è
codificato da geni nucleari, che vengono tradotti nel
citosol e quindi trasportati nei mitocondri per mezzo
di un processo attivo che richiede energia.
Il CI (NADH-ubiquinone ossidoreduttasi) contiene sette subunità codificate dal mtDNA (ND1-ND6 e ND4L)
e almeno 37 subunità codificate nel nucleo.
Il CII (succinato-ubiquinone ossidoreduttasi) è composto da quattro subunità tutte codificate dal genoma nucleare, contenenti 3 centri Fe-S, e trasferisce
elettroni dal FADH2, prevalentemente generato dalla
beta-ossidazione degli acidi grassi, al CoQ.
Il CIII (ubiquone-ferricitocromo c ossidoreduttasi)
è composto da una singola subunità codificata dal
mtDNA (l’apocitocromo b) e 10 subunità codificate
dal genoma nucleare, di cui una contenente un centro Fe-S.
242
CIV (citocromo c ossidasi, COX), che è composto da
3 subunità codificate dal mtDNA e 11 dal genoma nucleare, contiene due molecole di eme A e due centri
catalitici contenenti rame (centri Cu++A e Cu++B).
Il complesso V (CV – ATPasi oligomicina sensibile)
utilizza l’energia potenziale del gradiente elettrochimico per sintetizzare ATP. Il CV è composto da due subunità codificate dal mtDNA (ATPasi 6 e 8) e da almeno 13 subunità codificate nel nucleo. Queste subunità
formano le due porzioni del complesso: la porzione
F0 è immersa nella membrana mitocondriale interna
e costituisce il rotore attivato dal flusso di protoni attraverso di essa, mentre la porzione F1 catalizza la
biosintesi dell’ATP (Walker, 2013).
Numerosi fattori di assemblaggio e chaperone sono
necessari per assemblare la struttura portante dei
complessi, inserire i gruppi prostetici e i centri reattivi
contenenti ioni metallici, assemblare gli olocomplessi (Fernandez-Vizarra et al., 2009) ed eventualmente
produrre strutture quaternarie costituite da più complessi interagenti fra loro, chiamati supercomplessi
(Lapuente-Brun et al, 2013).
Altre componenti del proteoma mitocondriale sono
richieste per numerosissimi processi biologici, come
la replicazione, trascrizione e traduzione del mtDNA,
la fusione e fissione della rete mitocondriale, vie di
segnalazione ed esecuzione (come la produzione
di specie reattive dell’ossigeno, ROS, e l’apoptosi),
la biosintesi di componenti lipidiche essenziali delle
membrane mitocondriali, la formazione delle cristae,
l’eliminazione di prodotti tossici ecc.
Introduzione alle malattie mitocondriali
Le malattie mitocondriali primarie possono essere
classificate in due principali categorie, a seconda che
la mutazione responsabile sia nel genoma mitocondriale o nucleare. Le mutazioni nel mtDNA comprendono mutazioni puntiformi omo- o eteroplasmiche,
e riarrangiamenti su larga scala, che sono sempre
eteroplasmici. Mutazioni puntiformi eteroplasmiche
sono state trovate in tutti i geni mitocondriali e danno
origine a diversi fenotipi clinici, incluse alcune sindromi classiche come l’encefalomiopatia mitochondriale
con acidosi lattica ed episodi di ictus (MELAS) (Goto
et al., 1990), l’epilessia mioclonica con accumulo
di fibre “rosse stracciate” ragged red fibers – RRF
(MERRF) (Shoffner et al., 1990), la sindrome da
debolezza neurogenica, atassia e retinite pigmentosa (NARP) (Holt et al., 1990), la sindrome di Leigh
(LS). La presenza di RRF è un segno di proliferazione
mitocondriale spesso osservato nelle miopatie mitocondriali, specie nel paziente adulto. Esistono anche
mutazioni omoplasmiche patogene, principalmente
quelle che causano la neuropatia ottica ereditaria di
Leber (LHON) (Wallace et al., 1988). I riarrangiamenti
singoli del mtDNA (singole delezioni o duplicazioni)
danno origine all’oftalmoplegia esterna progressiva
Nuovi approcci nella terapia delle malattie mitocondriali
(PEO) (Moraes et al., 1989), alla sindrome di KearnsSayre (KSS) (Moraes et al., 1989) e alla sindrome di
Pearson (Rotig et al., 1989). Le delezioni singole, a
differenza delle mutazioni puntiformi, sono di solito
sporadiche.
Sono state trovate mutazioni in un vastissimo numero
di geni nucleari direttamente o indirettamente legati
alla catena respiratoria e codificanti, per esempio,
proteine coinvolte nel mantenimento e/o replicazione
del mtDNA; subunità strutturali dei complessi della
catena respiratoria; fattori di assemblaggio dei complessi respiratori; proteine coinvolte nella struttura dinamica dei mitocondri, come la fissione/fusione dei
mitocondri o in processi di segnale/esecuzione come
l’apoptosi (si veda [Koopman et al., 2012] per una lista
completa).
L’estrema complessità biochimica e genetica del metabolismo mitocondriale fa sì che le malattie mitocondriali siano caratterizzate da una notevole eterogeneità clinica, che rende difficile la raccolta di gruppi
omogenei di pazienti per stabilire l’efficacia di un trattamento. Un’area nosologica esemplificativa di tale
eterogeneità sono le deficienze primarie di CoQ, che
possono presentarsi come encefalomiopatia, disordini multisistemici, atassia cerebellare, miopatia isolata o sindrome nefrosica (Lopez et al., 2014). Inoltre,
per ragioni ignote, solo il 20% dei pazienti risponde
al trattamento con CoQ, l’unica terapia al momento
disponibile (Lopez et al., 2014).
Strategie terapeutiche
Notevoli progressi sono stati fatti negli ultimi anni nella
comprensione dei processi patogenetici alla base delle
malattie mitocondriali, dei meccanismi che controllano
la biogenesi mitocondriale e delle vie di trasduzione
del segnale. Partendo da queste conoscenze, sono
state recentemente proposte alcune strategie terapeutiche per le malattie mitocondriali, e le prove sperimentali della loro efficacia si stanno accumulando in
modelli cellulari e animali. Queste terapie si possono
suddividere in strategie “generaliste” che possono, in
linea di principio, essere utilizzate in un ampio numero
di patologie, e strategie “su misura”, applicabili a una
singola malattia. Il primo gruppo include:
(i) la regolazione/attivazione della biogenesi mitocondriale;
(ii) la regolazione/attivazione dell’autofagia/mitofagia;
(iii) l’inibizione dell’apoptosi;
(iv) l’eliminazione di composti tossici, quali le specie
reattive dell’ossigeno (ROS) generati dalla disfunzione della CR;
(v) il bypass dei difetti di trasferimento elettronico sulla CR;
(vi) il trasferimento nucleare.
Il secondo gruppo include:
(i) l’eliminazione di metaboliti tossici in specifiche
condizioni;
(ii) l’integrazione di desossinucleotidi precursori del
mtDNA;
(iii) la terapia di sostituzione genica/cellulare.
Ciascuna di queste strategie può essere perseguita
attraverso diversi approcci, quali il trattamento farmacologico, il trasferimento genico (per esprimere il
gene mancante o una proteina terapeutica), il trapianto di cellule staminali o d’organo. In questo articolo ci
concentreremo sulle terapie sperimentali emergenti
(cioè in fase preclinica) per le malattie mitocondriali,
e, in questo ambito, sugli approcci più prossimi all’applicazione clinica (Fig. 1).
Interventi farmacologici
e metabolici
Aumento della biogenesi mitocondriale
Le malattie mitocondriali sono caratterizzate da difetti
bioenergetici, che causano una ridotta sintesi di ATP.
È quindi possibile che interventi terapeutici mirati ad
aumentare la quantità di ATP disponibile all’interno
delle cellule siano efficaci nell’arrestare, mitigare o
risolvere alcune mitocondriopatie. È importante considerare che le malattie mitocondriali si manifestano
quando l’attività residua di una proteina scende sotto
una soglia critica, e perciò un recupero anche parziale dell’attività può essere di beneficio dal punto di
vista clinico. Ad esempio, è stato evidenziato che i
portatori sani di mutazioni LHON hanno un contenuto
di mtDNA maggiore dei loro parenti affetti e della popolazione generale (Giordano et al., 2014).
L’aumento della biogenesi mitocondriale è una risposta omeostatica a condizioni di stress (es. freddo,
esercizio fisico, stato nutrizionale) (Scarpulla, 2008).
Le vie che controllano la biogenesi mitocondriale sono state particolarmente studiate nel muscolo
scheletrico e nel grasso bruno, dove risultano essere sotto il controllo dei coattivatori trascrizionali della
famiglia PGC (Peroxisome proliferator-activated receptor Gamma (PPARγ) Coactivators), in particolare
di PGC-1α e β. Le proteine PGC interagiscono con
numerosi fattori trascrizionali, attivandoli. Tra questi
ricordiamo i Nuclear Respiratory Factors (NRF1 and
2), e i Peroxisomal Proliferator Activator Receptors
(PPAR α, β, and γ), che stimolano la trascrizione di
geni collegati all’OXPHOS e all’ossidazione degli acidi grassi (FAO), rispettivamente.
PGC-1α è la più nota tra le proteine PGC. La sua attività è controllata dai livelli di acetilazione, che a loro volta
dipendono dall’attività dell’acetilasi GNC5 e della deacetilasi sirtuina 1 (SIRT1), e di fosforilazione, controllata da varie chinasi (Bastin et al., 2008; FernandezMarcos e Auwerx, 2011). Ridotti livelli di acetilazione e
aumentati livelli di fosforilazione stimolano l’attività di
PGC-1α e inducono la biogenesi mitocondriale.
L’attivazione della biogenesi mitocondriale è stata
sperimentalmente ottenuta utilizzando varie strategie
243
M. Zeviani et al.
Figura 1. Schema riassuntivo delle principali strategie terapeutiche per le malattie mitocondriali.
farmacologiche. Un primo approccio consiste nell’utilizzo del bezafibrato, un farmaco largamente impiegato nel trattamento delle dislipidemie. Il bezafibrato
è un agonista generico dei recettori PPAR, che a
loro volta agirebbero come attivatori trascrizionali di
PGC-1α . L’utilizzo del bezafibrato in un topo privo del
gene COX10, un enzima coinvolto nella biosintesi del
gruppo prostetico eme A presente nella citocromo c
ossidasi, e caratterizzato da una grave miopatia con
deficit di COX, ha portato a un netto miglioramento
della performance motoria e della sopravvivenza, rispetto a topi non trattati (Wenz, 2009). Questi risultati non sono però stati confermati da studi successivi
(Viscomi et al., 2011; Yatsuga e Suomalainen, 2012).
Ciononostante un trial clinico è stato recentemente
avviato su pazienti con miopatia mitocondriale (www.
clinicaltrial.gov: NCT02398201).
Vie alternative per l’attivazione della biogenesi mitocondriale dipendente da PGC-1α sono basate sulla
stimolazione della chinasi AMP-dipendente (AMPK) o
della deacetilasi nucleare Sirt1. AICAR, un agonista di
AMPK, causa una robusta induzione di geni collegati
all’OXPHOS e l’aumento delle attività dei complessi
della catena respiratoria in modelli murini di deficit di
COX (Viscomi et al., 2011). Sirt1 utilizza il NAD+ per
deacetilare i residui di lisina acetilata delle proteine.
L’aumento della concentrazione di NAD+ ne stimola
l’attività. La somministrazione del precursore di NAD+
nicotinammide riboside (NR) o l’inibizione, con siste244
mi genetici o farmacologici, della poli(ADP)-ribosil polimerasi 1 (Parp1), un enzima nucleare che compete
con Sirt1 per l’utilizzo del NAD+ come substrato, determinano l’attivazione di Sirt1 e aumentano la respirazione mitocondriale inducendo i geni dell’OXPHOS
attraverso la stimolazione di PGC1α (Cerutti et al.,
2014; Khan et al., 2014). Nonostante questi approcci siano basati su sostanze potenzialmente innocue
(NR) o già utilizzate in clinica (inibitori di PARP), non
sono al momento presenti sperimentazioni cliniche
per confermarne l’efficacia nei pazienti.
A ogni modo, questi risultati aprono la nuova ed eccitante prospettiva di una terapia in grado di correggere
un ampio spettro di malattie mitocondriali dovuto a differenti cause genetiche.
Eliminazione di metaboliti tossici
Alcuni interventi terapeutici sono stati utilizzati in
malattie mitocondriali caratterizzate dall’accumulo di
sostanze tossiche dovuto al blocco di specifiche vie
metaboliche. Un primo esempio è l’uso di N-acetilcisteina (NAC) e metronidazolo per ridurre l’accumulo
di acido solfidrico (H2S) associato all’encefalopatia
etilmalonica (EE) (Viscomi et al., 2010). EE è una malattia infantile multisistemica causata da mutazioni in
ETHE1, un gene che codifica una sulfur-diossigenasi
mitocondriale coinvolta nello smaltimento di H2S (Tiranti et al., 2009). H2S è un composto altamente tossi-
Nuovi approcci nella terapia delle malattie mitocondriali
co prodotto dal catabolismo degli aminoacidi solforati
nei tessuti e dalla flora batterica anaerobica presente
in grandi quantità nell’intestino crasso.
L’N-acetil-cisteina (NAC) è un composto permeabile
alle cellule che agisce come precursore del glutatione,
necessario per lo smaltimento di H2S. Il metronidazolo è un antibiotico specifico per i batteri anerobici, che
producono H2S. La somministrazione di NAC e metronidazolo determina un significativo prolungamento
della durata della vita e delle condizioni cliniche di un
modello murino Ethe1-/-. Gli stessi composti si sono
dimostrati efficaci nel mitigare i sintomi dei pazienti
EE (Viscomi et al., 2010).
Altri composti potenzialmente tossici sono le specie reattive dell’ossigeno (ROS), generate come prodotti secondari della respirazione mitocondriale. Nei mitocondri
l’anione superossido (O2-•), una molecola altamente reattiva, viene prodotta in diversi siti della matrice e dello
spazio intermembrana. O2-• è rapidamente convertito in
perossido di idrogeno (H2O2) dalle superossido dismutasi mitocondriale e citosolica; l’H2O2 è un composto
molto meno reattivo ed è rapidamente convertibile ad
acqua da numerosi e abbondanti enzimi presenti negli
stessi mitocondri, nei perossisomi e nel citosol (Sena
e Chandel, 2012). In presenza di ferro ridotto, Fe2+, l’anione superossido può invece generare, mediante la
reazione di Fenton, il radicale ossidrilico (•OH), un composto altamente reattivo che può danneggiare le strutture cellulari, perossidando proteine, lipidi e acidi nucleici. Un’aumentata produzione di ROS è una frequente
conseguenza di difetti di OXPHOS (Raimundo et al.,
2012), e può determinare danni importanti a proteine,
lipidi e acidi nucleici. Queste osservazioni costituiscono
la base razionale per l’utilizzo di agenti antiossidanti nella terapia delle malattie mitocondriali. Miscele di antiossidanti, quali acido lipoico, vitamine C ed E, CoQ ecc.,
sono state a lungo usate nella terapia delle malattie mitocondriali, ma di fatto la loro efficacia non è mai stata
validata da studi controllati e rigorosi in modelli animali
o nei pazienti. Alcuni trial clinici sono in corso per testare
i potenziali benefici di due nuovi antiossidanti in varie
malattie mitocondriali. Il primo composto è EPI-743, un
derivato della vitamina E, il secondo, KH176, derivato
dall’antiossidante Trolox. Entrambi sono stati sviluppati
a partire da screening di librerie di composti, e portati
alla sperimentazione clinica saltando lo stadio dei test
su modelli animali della malattia.
Sommistrazione di nucleotidi
La somministrazione di desossiribonucleotidi è stata
utilizzata per corregge la deplezione del mtDNA in fibroblasti e/o modelli murini di pazienti con mutazioni
in enzimi coinvolti nel controllo dei pool mitocondriali
di deossinucleotidi precursori del mtDNA (per esempio la deossiguanosina chinasi, dGK, e la timidina
chinasi mitocondriale, TK, codificate rispettavamente
dai geni DGUOK e TK2).
In particolare, risultati promettenti sono stati ottenuti in un modello murino che riproduce la mutazione
umana H126N nella timidina chinasi 2 (TK2) (Garone
et al., 2014), che fosforila nei mitocondri la timidina e
la deossicitidina monofosfato (dCMP). La mancanza
di TK2 causa deplezione severa del mtDNA nel muscolo e nel cervello. Il trattamento con 200 o 400 mg/
kg/die di nucleotidi determina un aumento nei livelli di
dNTP e di mtDNA, un recupero delle attività della RC
e un significativo prolungamento della sopravvivenza
da 13 a 34 giorni.
Terapie nutrizionali
Vari approcci basati sulla manipolazione della dieta
sono stati tentati con risultati controversi. Una dieta
chetogenica (KD), cioè con alto contenuto di grassi e
basso contenuto di carboidrati, è stata proposta con
lo scopo di stimolare la β-ossidazione mitocondriale e
produrre chetoni, che costituiscono una fonte alternativa di energia per cervello, cuore e muscolo scheletrico. I corpi chetonici sono metabolizzati ad acetil-CoA,
che entra nel ciclo di Krebs, e sono ossidati cedendo
elettroni alla catena respiratoria, così generando ATP
attraverso l’OXPHOS. Questa via catabolica esclude
parzialmente il complesso I, perché aumenta la sintesi
di succinato, che dona elettroni al complesso II della
catena respiratoria. Questa osservazione suggerisce
un potenziale beneficio della dieta chetogenica nei
difetti di complesso I. Inoltre, l’aumento di corpi chetonici determina una maggiore espressione di geni
OXPHOS, probabilmente per mezzo di una risposta
simile a quella del digiuno (Nunnari e Suomalainen,
2012), una condizione di stress cellulare che induce la
biogenesi mitocondriale. La KD è stata utilizzata per ridurre l’eteroplasmia associata a delezione del mtDNA
in modelli cellulari (Santra et al., 2004), e per indurre
l’espressione di proteine disaccoppianti (uncoupling
proteins, – UCP) e di geni coinvolti nella biogenesi mitocondriale nell’ippocampo di modelli animali (Jarrett et
al., 2008) e per tentare di arrestare la progressione della miopatia in un modello murino di delezioni multiple
del mtDNA (Ahola-Erkkila et al., 2010). Tuttavia, altri lavori hanno dimostrato che KD può avere effetti opposti
e peggiorare il difetto mitocondriale in vivo, ad esempio
nel modello murino Mpv17-/- (Bottani et al., 2013).
Come KD, anche una dieta high-fat, che ha un contenuto più elevato di carboidrati rispetto alla dieta KD,
ha dimostrato avere effetti protettivi in modelli di malattie mitocondriali in vivo e in vitro (Schiff et al., 2011).
Risultati simili potrebbero in linea di principio essere ottenuti con composti che rilasciano succinato nei
mitocondri. Ad esempio, la trieptaoina è un composto che induce un rapido aumento di succinil-CoA,
e migliora significativamente sia la cardiomiopatia in
pazienti con deficit di VLCAD sia i sintomi miopatici
in pazienti con deficit di CPT2 (Roe et al., 2002; Watmough et al., 1990).
245
M. Zeviani et al.
Un trial clinico è stato recentemente concluso sull’uso
di un dieta ricca di trigliceridi a media catena in pazienti con mutazione MELAS 3243A>G, ma i risultati
non sono ancora noti.
Approcci molecolari al trattamento
delle malattie mitocondriali
Terapia genica
La correzione di una mutazione attraverso la reintroduzione del gene funzionante in organi critici è stata
a lungo considerata come la cura definitiva per le malattie genetiche. In particolare, vettori virali adenoassociati (AAV) non sono patogeni per l’uomo, e il DNA da
essi veicolato rimane episomico nelle cellule dei tessuti post-mitotici (ad es. cuore, cervello, muscolo scheletrico, e in parte fegato e rene) per molto tempo, riducendo il rischio di mutagenesi inserzionale (Mingozzi e
High, 2011). Sono stati sviluppati vari serotipi AAV con
diversa specificità cellulare, che consentono di effettuare terapie mirate a singoli organi (Gao et al., 2002).
Il serotipo AAV2/8 in particolare è già stato utilizzato
con successo sull’uomo per il trattamento dell’emofilia B (Nathwani et al., 2011). Lo stesso serotipo è stato
utilizzato per riesprimere selettivamente nel fegato il
gene Ethe1, responsabile dell’encefalopatia etilmalonica, determinando un’efficace clearance di H2S dal
sangue, la normalizzazione dei biomarcatori della malattia, e un evidente miglioramento sia delle condizioni
cliniche che della sopravvivenza (Di Meo et al., 2012).
Questi risultati hanno fornito un’importante prova di
principio che la riattivazione del filtro epatico è sufficiente a migliorare decisamente le malattie mitocondriali da accumulo di sostanze tossiche, e costituiscono quindi il razionale per proporre il trapianto di fegato
nell’encefalopatia etilmalonica (Dionisi-Vici et al., 2016)
e nella MNGIE (mitochondrial neuro-gastro-intestinal
encephalomyopathy). Quest’ultima è una grave malattia autosomica recessiva causata da mutazioni nel
gene TYMP, codificante per la timidina fosforilasi (TP),
un enzima citosolico che catalizza il primo passaggio
del catabolismo della timidina (dThd) e della deossiuridina (dUrd) (Nishino et al., 1999). Nella MNGIE il malfunzionamento di TP causa un accumulo sistemico di
dThd e dUrd, che determina uno sbilanciamento dei
pool di deossinucleotidi trifosfati (dNTP), con effetti
mutageni sul mtDNA. Alterazioni deleterie del mtDNA
(deplezione, delezioni multiple e mutazioni puntiformi)
colpiscono soprattutto organi postmitotici, in particolare
la muscolatura liscia intestinale, il muscolo scheletrico
e il sistema nervoso centrale e periferico, causando un
progressivo deficit mitocondriale e disfunzione d’organo. I sintomi si manifestano in età giovanile adulta e
comprendono grave dismotilità intestinale con diarrea
cronica, dolori addominali importanti ed eventualmente
perdita di peso fino alla cachessia, oftalmoplegia esterna progressiva con miopatia, e grave neuropatia peri246
ferica sensori-motoria. I pazienti di solito muoiono per
le complicazioni dovute al loro stato nutrizionale molto
compromesso, con una vita media di 37 anni (Nishino et al., 2001). In topi TYMP-/-, la somministrazione
sistemica ad alte dosi di AAV2/8 esprimente la forma
nativa di TYMP determina la normalizzazione dei livelli
plasmatici di dCTP e dTTP fino a 8 mesi dalla somministrazione (Torres-Torronteras et al., 2014). Il trattamento correntemente usato per la MNGIE è basato sul
trapianto di midollo osseo, che ha però una mortalità
post-operatoria superiore al 50% a causa delle reazioni da rigetto, incluse quelle del trapianto contro l’ospite
(graft-versus-host disease) e la necessità di eliminare il tessuto emopoietico endogeno (haematopoietic
conditioning), che possono compromettere definitivamente le condizioni già molto critiche dei pazienti al
momento del trapianto (Hirano et al., 2006; Rahman
e Hargreaves, 2007). La somministrazione di AAV ingegnerizzati è una procedura molto meno invasiva e
quindi probabilmente più facilmente accettabile e porterebbe a un sostanziale miglioramento della prognosi
di questa malattia invariabilmente mortale.
L’epatotropismo dei ceppi AAV2/8 può anche essere
sfruttato per correggere il difetto alla base di malattie
mitocondriali che colpiscono selettivamente il fegato. Noi abbiamo applicato questo principio al modello
murino Mpv17-/-. Mpv17 è una proteina mitocondriale
a funzione ignota, mutata in pazienti affetti da forme
epato-cerebrali di sindrome da deplezione del mtDNA
(Karadimas et al., 2006; Spinazzola et al., 2006). Come
nella malattia umana, il modello murino mostra una profonda riduzione del mtDNA nel fegato ma, in contrasto
con quanto avviene nell’uomo, nessun fenotipo clinico,
almeno in condizioni standard. Tuttavia i topi Mpv17/sviluppano una steatosi con evoluzione cirrotica e disfunzione epatica rapidamente progressiva se esposti a
dieta chetogenica (Bottani et al., 2013). Un vettore virale
AAV2/8 esprimente Mpv17 umano è in grado di correggere completamente la deplezione del mtDNA e di
prevenire la cirrosi indotta da KD in topi Mpv17-/-, soprattutto quando il trattamento genico precede l’inizio della
KD, mentre la progressione della malattia è ritardata ma
non abolita, quando la terapia genica è effettuata dopo
l’inizio del regime KD. La recente introduzione di nuovi
serotipi epatotropi, come AAV5, apre la possibilità di una
seconda somministrazione di virus, sfuggendo così alla
neutralizzazione da parte del sistema immunitario (Paneda et al., 2009; Unzu et al., 2011).
Complessivamente questi risultati preclinici dimostrano il grande potenziale della terapia genica basata su
AAV per combattere specifiche malattie mitocondriali. Un
certo numero di problemi devono tuttavia essere ancora
risolti, quali lo sviluppo di strategie per colpire organi critici come cervello, cuore e muscolo scheletrico. Benché
qualche successo sia stato ottenuto su miopatie e distrofie non mitocondriali in modelli preclinici (Childers et al.,
2014; Greelish et al., 1999; Gregorevic et al., 2004), la
loro efficacia nell’uomo deve ancora essere dimostrata.
Nuovi approcci nella terapia delle malattie mitocondriali
Una strategia ripetutamente proposta per la correzione di mutazioni in geni del mtDNA è basata sull’espressione allotopica, secondo la quale il gene, ricodificato secondo il codice genetico universale, viene
fuso con una sequenza di localizzazione mitocondriale (MTS) e trasfettato nel nucleo. Il gene verrebbe
quindi trascritto nel nucleo, tradotto nel citoplasma,
e indirizzato ai mitocondri dove verrebbe traslocato all’interno della matrice/membrana mitocondriale
interna. Questo approccio è stato tentato in modelli
cellulari (Bonnet et al., 2008; Bonnet et al., 2007; Kaltimbacher et al., 2006) e animali (Ellouze et al., 2008).
Complessivamente, i risultati di questi esperimenti
sono molto controversi, poiché dati conflittuali sono
stati ottenuti da diversi gruppi sulla capacità dei geni
ricodificati e indirizzati ai mitocondri di essere effettivamente importati nell’organello e di essere correttamente integrati nei complessi della catena respiratoria
(Perales-Clemente et al., 2011). Tuttavia tre trial clinici
open label basati sull’espressione allotopica di geni
mitocondriali della LHON sono al momento in corso
(NCT02161380, NCT01267422, NCT02652767).
Modulazione dei processi di
fissione-fusione e dell’ultrastruttura
mitocondriale
I mitocondri sono organelli molto dinamici la cui forma
e massa sono finemente regolati dall’attività di proteine pro-fusione, quali mitofusina 1 (MFN1), MNF2 e la
proteina associata ad atrofia ottica 1 (OPA1), e profissione, quali la dynamin-related protein 1 (DRP1) e
la mitochondrial fission 1 FIS1 (Friedman e Nunnari,
2014; Mishra e Chan, 2014). Mutazioni in geni che
codificano per questi complessi macchinari causano
malattie nell’uomo. Ad esempio, mutazioni in OPA1
sono associate ad atrofia ottica dominante (Alexander
et al., 2000) e mutazioni in MFN2 causano la malattia di Charcot-Marie-Tooth di tipo 2A (Zuchner et al.,
2004). Alterazioni della dinamica e dell’ultrastruttura
dei mitocondri sono osservate in numerose patologie
e la loro correzione può portare a un miglioramento
della patologia. La prova genetica di questo principio
è stata ottenuta dimostrando che l’overespressione
di Opa1, una GTPasi coinvolta nella biogenesi delle cristae mitocondriali e nel promuovere la fissione
della membrana mitocondriale interna, aumenta l’efficienza respiratoria (Cogliati et al., 2013). Inoltre, la
(moderata) sovra-espressione di OPA1 migliora il fenotipo clinico di topi con deficit di complesso I e IV
e protegge da una serie di insulti, quali il danno da
ischemia-riperfusione, l’atrofia muscolare indotta da
denervazione, o il danno miopatico (Civiletto et al.,
2015; Varanita et al., 2015). Alcuni composti sperimentali, quali l’inibitore di Drp1 MDIVI-1, e l’idrazone
M1 che si ritiene promuova la fusione mitocondriale
agendo su MNF o OPA1, sono in grado di interferire
con i processi di fissione-fusione, ma il potenziale te-
rapeutico di questi composti deve comunque essere
verificato. Tuttavia, i cosiddetti peptidi di Szeto-Schiller
(SS) sono stati utilizzati per correggere i difetti dell’ultrastruttura mitocondriale in varie condizioni, quali l’atrofia muscolare, l’insufficienza cardiaca, l’ischemiariperfusione e il diabete (Szeto e Birk, 2014). I peptidi
SS sono tripeptidi in grado di penetrare in cellula e di
accumularsi nei mitocondri, dove legano la cardiolipina, un componente lipidico della membrana mitocondriale interna con attività di modulazione della catena
respiratoria e di strutturazione delle cristae. Inoltre, la
cardiolipina modula l’attività di Opa1 ed è possibile
che questo possa spiegare almeno in parte gli effetti
dei peptidi SS sulla struttura della cristae. I peptidi SS
sono stati ampiamente caratterizzati dal punto di vista
farmacologico e uno di essi (MTP131 o Bendavia) è
al momento in trial clinico per le miopatie mitocondriali (NCT02367014).
Trasferimento somatico nucleare
Data la difficoltà nella manipolazione del mtDNA e le
incertezze nella consulenza genetica per le mutazioni
nel mtDNA, al momento la migliore opzione per le donne con mutazioni patogene nel mtDNA è la diagnosi
preimpianto. Recenti progressi tecnici in primati non
umani (Tachibana et al., 2009) ed embrioni umani non
vitali (Craven et al., 2010) hanno aperto la strada alla
sostituzione del mtDNA materno mutato con quello di
un donatore sano. Questo può essere ottenuto attraverso il trasferimento del fuso cromosomico di oociti
maturi della donna affetta in un oocita sano o dei pronuclei durante la fase pre-zigotica dell’uovo fecondato
(Craven et al., 2010; Tachibana et al., 2013). Entrambe
le tecniche sono state rifinite per ridurre al minimo il
trasferimento della minor quantità possibile di mtDNA
mutato dell’ooplasma accettore. Un bambino nato da
queste procedure avrà quindi i geni nucleari della madre affetta (e del padre sano) ma i geni mitocondriali
sani del donatore (si veda (Chinnery et al., 2014) per
un sommario recente su questi argomenti).
Conclusioni
Le malattie mitocondriali sono straordinariamente
complesse e la loro biologia ha finora reso impossibile sviluppare terapie efficaci per la maggior parte
di esse. Tuttavia, negli ultimi anni si sono osservati
numerosi tentativi di modificare in modo significativo
il fenotipo di modelli cellulari o animali, utilizzando
strategie specifiche per una malattia o strategie ad
ampio spettro applicabili a vari disordini. Il patrimonio
di conoscenze accumulato in oltre 25 anni di intensi
studi sulle cause e i meccanismi delle malattie mitocondriali hanno aperto la strada all’acquisizione di
importanti “prove di principio” sperimentali in fase preclinica, che ora aspettano di essere traslate e testate
sui pazienti.
247
M. Zeviani et al.
Box di orientamento
• Cosa sapevamo prima
Le malattie mitocondriali sono al momento incurabili. La variabilità clinica , biochimica e genetica rende
estremamente difficile lo sviluppo di nuove terapie.
• Cosa sappiamo adesso
Negli ultimi anni sono stati fatti i primi passi verso la messa a punto di nuovi interventi terapeutici, alcuni
dei quali si sono mostrati efficaci in modelli animali. Questi comprendono l’uso di farmaci per aumentare
la biogenesi mitocondriale, eliminare composti tossici e correggere l’ultrastruttura dei mitocondri e l’uso
di vettori virali adenoassociati in alcune malattie specifiche.
• Quali ricadute sulla pratica clinica
Supportati dai risultati raccolti in modelli cellulari e animali, i primi trial clinici sui pazienti sono stati sviluppati
e sono attualmente in corso. L’impatto di questi approcci nella pratica clinica sarà verificato nei prossimi anni.
Bibliografia
Ahola-Erkkila S, Carroll CJ, Peltola-Mjosund
K, et al. Ketogenic diet slows down mitochondrial myopathy progression in mice. Hum Mol
Genet 2010;19:1974-84.
Alexander C, Votruba M, Pesch UE, et
al. OPA1, encoding a dynamin-related GTPase, is mutated in autosomal dominant
optic atrophy linked to chromosome 3q28.
Nat Genet 2000;26:211-5.
Bastin J, Aubey F, Rotig A, et al. Activation of peroxisome proliferator-activated
receptor pathway stimulates the mitochondrial respiratory chain and can correct deficiencies in patients’ cells lacking
its components. J Clin Endocrinol Metabol
2008;93:1433-41.
Bonnet C, Augustin S, Ellouze S, et al.
The optimized allotopic expression of ND1
or ND4 genes restores respiratory chain
complex I activity in fibroblasts harboring
mutations in these genes. Biochim Biophys
Acta 2008;1783;1707-17.
Bonnet C, Kaltimbacher V, Ellouze S,
et al. Allotopic mRNA localization to the
mitochondrial surface rescues respiratory chain defects in fibroblasts harboring
mitochondrial DNA mutations affecting
complex I or v subunits. Rejuvenation Res
2007;10:127-44.
Bottani E, Giordano C, Civiletto G, et al.
AAV-mediated liver-specific MPV17 expression restores mtDNA levels and prevents diet-induced liver failure. Mol Ther
2014;22:10-7.
Cerutti R, Pirinen E, Lamperti C, et al. NADdependent activation of Sirt1 corrects the
phenotype in a mouse model of mitochondrial disease. Cell Metab 2014;19:1042-9.
** Un importante studio sulla possibilità
di modulare la biogenesi mitocondriale attraverso la regolazione dei livelli endogeni
di NAD+.
Childers MK, Joubert R, Poulard K, et
al. Gene therapy prolongs survival and restores function in murine and canine models of myotubular myopathy. Sci Transl
Med 2014;6:220ra10.
248
* Uno dei primi esempi di terapia genica
nel muscolo di un mammifero di medie dimensioni.
Chinnery PF, Craven L, Mitalipov S, et al.
The challenges of mitochondrial replacement. PLoS Gen 2014;10:e1004315.
Civiletto G, Varanita T, Cerutti R, et al.
Opa1 overexpression ameliorates the
phenotype of two mitochondrial disease
mouse models. Cell Met 2015;21:845-54.
* La prima dimostrazione che la modulazione dell’ultrastruttura mitocondriale può essere efficace nella terapia delle
malattie mitocondriali.
Cogliati S, Frezza C, Soriano ME, et al.
Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and
respiratory efficiency. Cell 2013;155:160-71.
Craven L, Tuppen HA, Greggains GD, et
al. Pronuclear transfer in human embryos
to prevent transmission of mitochondrial
DNA disease. Nature 2010;465:82-5.
** La prima dimostrazione di fattibilità del
trasferimento dei pronuclei in embrioni umani.
Di Meo I, Auricchio A, Lamperti C, et al.
Effective AAV-mediated gene therapy in a
mouse model of ethylmalonic encephalopathy. EMBO 2012;4:1008-14.
** Il primo studio in cui la terapia genica
epatica viene utilizzata per correggere un
difetto mitocondriale dovuto all’accumulo
di sostanze tossiche.
Dionisi-Vici C, Diodato D, Torre G, et al.
Liver transplant in ethylmalonic encephalopathy: a new treatment for an otherwise
fatal disease. Brain 2016;139:1045-51.
* Il primo esempio di trapianto di fegato utilizzato per correggere l’accumulo
di sostanze tossiche dovuto a disfunzione
mitocondriale.
Ellouze S, Augustin S, Bouaita A, et al.
Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Gen 2008;83:373-87.
Fernandez-Marcos PJ, Auwerx J. Regulation of PGC-1alpha, a nodal regulator of
mitochondrial biogenesis. Am J Clin Nutr
2011;93:884S-90.
Fernandez-Vizarra E, Tiranti V, Zeviani M.
Assembly of the oxidative phosphorylation
system in humans: what we have learned
by studying its defects. Biochim Biophys
Acta 2009;1793:200-11.
Friedman JR, Nunnari J. Mitochondrial
form and function. Nature 2014;505:335-43.
Gao GP, Alvira MR, Wang L, et al.
Novel adeno-associated viruses from
rhesus monkeys as vectors for human
gene therapy. Proc Natl Acad Sci U S A
2002;99:11854-9.
Garone C, Garcia-Diaz B, Emmanuele
V, et al. Deoxypyrimidine monophosphate
bypass therapy for thymidine kinase 2 deficiency. EMBO 2014;6:1016-27.
Giordano C, Iommarini L, Giordano L, et
al. Efficient mitochondrial biogenesis drives
incomplete penetrance in Leber’s hereditary
optic neuropathy. Brain 2014;137:335-53.
Goto Y, Nonaka I, Horai S. A mutation in
the tRNA(Leu)(UUR) gene associated with
the MELAS subgroup of mitochondrial encephalomyopathies. Nature 1990;348:651-3.
Greelish JP, Su LT, Lankford EB, et al. Stable restoration of the sarcoglycan complex
in dystrophic muscle perfused with histamine and a recombinant adeno-associated
viral vector. Nature Med 1999;5:439-43.
Gregorevic P, Blankinship MJ, Allen JM,
et al. Systemic delivery of genes to striated
muscles using adeno-associated viral vectors. Nature Med 2004;10:828-34.
Hirano M, Marti R, Casali C, et al. Allogeneic stem cell transplantation corrects biochemical derangements in MNGIE. Neurology 2006;67:1458-60.
Holt IJ, Harding AE, Petty RK, et al. A
new mitochondrial disease associated with
mitochondrial DNA heteroplasmy. Am J
Hum Gen 1990;46:428-33.
Jarrett SG, Milder JB, Liang LP, et al. The ketogenic diet increases mitochondrial glutathione
levels. J Neurochemistry 2008;106:1044-51.
Kaltimbacher V, Bonnet C, Lecoeuvre G,
et al. mRNA localization to the mitochondrial surface allows the efficient transloca-
Nuovi approcci nella terapia delle malattie mitocondriali
tion inside the organelle of a nuclear recoded ATP6 protein. Rna 2006;12:1408-17.
Karadimas CL, Vu TH, Holve SA, et al.
Navajo neurohepatopathy is caused by a
mutation in the MPV17 gene. Am J Hum
Gen 2006;79:544-8.
Khan NA, Auranen M, Paetau I, et al. Effective treatment of mitochondrial myopathy by nicotinamide riboside, a vitamin B3.
EMBO Mol Med 2014;6:721-31.
Koopman WJ, Willems PH, Smeitink
JA. Monogenic mitochondrial disorders. N
Engl J Med 2012;366:1132-41.
* Un’ampia e recente revisione sulle
malattie mitocondriali.
Lapuente-Brun E, Moreno-Loshuertos
R, Acín-Pérez R, et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science 2013;340:1567-70.
Lopez LC, Luna-Sanchez M, Garcia-Corzo L, et al. Pathomechanisms in coenzyme
q10-deficient human fibroblasts. Molec
Syndromol 2014;5:163-9.
Mingozzi F, High KA. Therapeutic in vivo
gene transfer for genetic disease using
AAV: progress and challenges. Nature Rev
Genet 2011;12:341-55.
Mishra P, Chan DC. Mitochondrial dynamics and inheritance during cell division,
development and disease. Nat Rev Mol Cell
Biol 2014;15:634-46.
Moraes CT, DiMauro S, Zeviani M, et
al. Mitochondrial DNA deletions in progressive external ophthalmoplegia and
Kearns-Sayre syndrome. N Engl J Med
1989;320:1293-9.
Nathwani AC, Tuddenham EG, Rangarajan S, et al. Adenovirus-associated virus
vector-mediated gene transfer in hemophilia B. N Engl J Med 2011;365:2357-65.
** La prima applicazione all’uomo di una
terapia genica basata su AAV2/8.
Nishino I, Spinazzola A, Hirano M. Thymidine phosphorylase gene mutations in
MNGIE, a human mitochondrial disorder.
Science 1999;283:689-92.
Nishino I, Spinazzola A, Hirano M.
MNGIE: from nuclear DNA to mitochondrial
DNA. Neuromuscul Disord 2001;11:7-10.
Nunnari J, Suomalainen A. Mitochondria: in sickness and in health. Cell
2012;148:1145-59.
* Un’ampia analisi della biologia dei mitocondri.
Paneda A, Vanrell L, Mauleon I, et al. Effect of adeno-associated virus serotype and
genomic structure on liver transduction and
biodistribution in mice of both genders. Human Gene Ther 2009;20:908-17.
Perales-Clemente E, Fernandez-Silva
P, Acin-Perez R, et al. Allotopic expres-
sion of mitochondrial-encoded genes in
mammals: achieved goal, undemonstrated
mechanism or impossible task? Nucleic
Acids Res 2011;39:225-34.
Rahman S, Hargreaves IP. Allogeneic
stem cell transplantation corrects biochemical derangements in MNGIE. Neurology 2007;68:1872-3.
Raimundo N, Song L, Shutt TE, et al.
Mitochondrial stress engages E2F1 apoptotic signaling to cause deafness. Cell
2012;148:716-26.
Roe CR, Sweetman L, Roe DS, et al.
Treatment of cardiomyopathy and rhabdomyolysis in long-chain fat oxidation disorders using an anaplerotic odd-chain triglyceride. J Clin Invest 2002;110:259-69.
Rotig A, Colonna M, Bonnefont JP, et
al. Mitochondrial DNA deletion in Pearson’s marrow/pancreas syndrome. Lancet
1989;1:902-3.
Santra S, Gilkerson RW, Davidson M,
et al. Ketogenic treatment reduces deleted
mitochondrial DNAs in cultured human
cells. Annals Neurol 2004;56:662-9.
Scarpulla RC. Transcriptional paradigms in mammalian mitochondrial biogenesis and function. Physiological Rev
2008;88:611-38.
Schiff M, Benit P, El-Khoury R, et al.
Mouse studies to shape clinical trials for
mitochondrial diseases: high fat diet in
Harlequin mice. PloS One 2011;6:e28823.
Sena LA, Chandel NS. Physiological
roles of mitochondrial reactive oxygen species. Mol Cell 2012;48:158-67.
Shoffner JM, Lott MT, Lezza AMet al.
Myoclonic epilepsy and ragged-red fiber
disease (MERRF) is associated with a mitochondrial DNA tRNA(Lys) mutation. Cell
1990;61:931-7.
Spinazzola A, Viscomi C, FernandezVizarra E, et al. MPV17 encodes an inner
mitochondrial membrane protein and is
mutated in infantile hepatic mitochondrial
DNA depletion. Nat Genet 2006;38:570-5.
Szeto HH, Birk AV. Serendipity and the
discovery of novel compounds that restore
mitochondrial plasticity. Clin Pharmacol
Ther 2014;96:672-83.
Tachibana M, Amato P, Sparman M, et
al. Towards germline gene therapy of inherited mitochondrial diseases. Nature
2013;493:627-31.
Tachibana M, Sparman M, Sritanaudomchai H, et al. Mitochondrial gene replacement in primate offspring and embryonic
stem cells. Nature 2009;461:367-72.
Tiranti V, Viscomi C, Hildebrandt T, et
al. Loss of ETHE1, a mitochondrial dioxygenase, causes fatal sulfide toxicity in
ethylmalonic encephalopathy. Nature Med
2009;15:200-5.
* Uno studio sul meccanismo patogenetico dell’encefaloptia etilmalonica.
Torres-Torronteras J, Viscomi C, Cabrera-Perez R, et al. Gene therapy using
a liver-targeted AAV vector restores nucleoside and nucleotide homeostasis in a
murine model of MNGIE. Molecular Ther
2014;22:901-7.
Unzu C, Sampedro A, Mauleon I, et
al. Sustained enzymatic correction by
rAAV-mediated liver gene therapy protects against induced motor neuropathy
in acute porphyria mice. Molecular Ther
2011;19:243-50.
Varanita T, Soriano ME, Romanello V,
et al. The OPA1-dependent mitochondrial cristae remodeling pathway controls
atrophic, apoptotic, and ischemic tissue
damage. Cell Met 2015;21:834-44.
Viscomi C, Bottani E, Civiletto G, et al. In
vivo correction of COX deficiency by activation of the AMPK/PGC-1alpha axis. Cell
Met 201;14:80-90.
** La prima dimostrazione in vivo della
possibilità di utilizzare la biogenesi mitocondriale nella terapia delle malattie mitocondriali.
Viscomi C, Burlina AB, Dweikat I, et al.
Combined treatment with oral metronidazole and N-acetylcysteine is effective in
ethylmalonic encephalopathy. Nature Med
2010;16:869-71.
* Uno studio in cui si dimostra
l’efficacia di una terapia farmacologica
nell’encefaloptia etilmalonica.
Walker JE. The ATP synthase: the understood, the uncertain and the unknown.
Biochem Soc Trans 2013;41:1-16.
Wallace DC, Fan W, Procaccio V. Mitochondrial energetics and therapeutics. Annual Rev Pathol 2010;5:297-348.
Wallace DC, Singh G, Lott MT, et al. Mitochondrial DNA mutation associated with
Leber’s hereditary optic neuropathy. Science
1988;242:1427-30.
Watmough NJ, Bindoff LA, Birch-Machin
MA, et al. Impaired mitochondrial betaoxidation in a patient with an abnormality
of the respiratory chain. Studies in skeletal muscle mitochondria. J Clin Invest
1990;85:177-84.
Wenz T. PGC-1alpha activation as a therapeutic approach in mitochondrial disease.
IUBMB Life 2009;61:1051-62.
Yatsuga S, Suomalainen A. Effect of
bezafibrate treatment on late-onset mitochondrial myopathy in mice. Human Mol
Gen 2012;21:526-35.
Zuchner S, Mersiyanova IV, Muglia M,
et al. Mutations in the mitochondrial GTPase mitofusin 2 cause Charcot-MarieTooth neuropathy type 2A. Nature Gen
2004;36:449-51.
Corrispondenza
Massimo Zeviani
MRC Mitochondrial Biology Unit, Wellcome Trust/MRC, Building Hills Road, Cambridge, CB2 0XY, UK
Tel. +44 1223252704 - E-mail: [email protected]
249