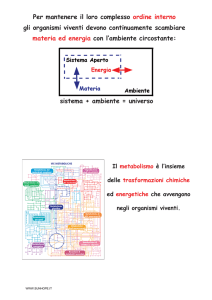
Appunti di Raffaele Vanacore
MALATTIE DEL SISTEMA NERVOSO PARTE I: CLINICA NEUROLOGICA: INTEGRAZIONI DEL CORSO DEL PROF. COTRUFO E DEI SUOI COLLABORATORI E DI “PRINCIPI DI NEUROLOGIA DI ADAMS & VICTOR” LEZIONE I: PROF. COTRUFO Preistoria e storia dello sviluppo del sistema nervoso: il tempo regola lo sviluppo spaziale,l’esperienza trasforma,attraverso l’attivazione delle reti neurali,il repertorio organizzativo potenziale in capacità funzionali del sistema nervoso. Ricadute neurobiologiche sulla fisiopatologia generale dei disturbi del sistema nervoso e dei suoi collegamenti con recettori ed effettori. Paragrafo I: Caratteristiche del SN ( funzioni nervose specifiche, complesse ed uniche) Generalità Per iniziare adeguatamente lo studio della neurologia è bene suddividere, in maniera molto schematica, il sistema nervoso(SN) in: • Porzione caudale: costituita di formazioni nervose atte alla trasmissione dell’impulso nervoso da e verso organi extranervosi ( Sistema Nervoso Periferico, SNP) • Porzione rostrale: assai più articolata ,immette in rete le informazioni in entrata dall’ambiente (afferenti; ma io aggiungerei anche dall’interno, ndr) attraverso circuiti specifici, percependole e modificandole fino a produrre un’adeguata risposta allo stimolo (efferente) ( Sistema Nervoso Centrale, SNC) Il SN è, con il suo complesso sistema di recettori ed effettori, la base dell’organizzazione anatomo‐fisiologica di tutte le funzioni del SN: vi sono dei sensori, che percepiscono le caratteristiche dell’ambiente esterno o interno e le loro eventuali modificazioni, un elaboratore, che integra questi stimoli ed elabora una risposta, e degli effettori, che attuano la risposta. Quindi, tutte le funzioni nervose (sensitive, sensoriali, mnemoniche etc.) hanno la loro base nel SN: difatti, in caso di patologia del SN si avrà la perdita di funzioni nervose, soprattutto in caso di patologie focali, con perdita di funzioni specifiche; inoltre, farmaci, droghe od altre sostanze ad azione neurotropa, inducono modificazioni delle funzioni nervose, in particolare emozionali e sensoriali. Il SN, inoltre, è la base organizzativa della mente: ad esempio, in corso di malattia di Alzheimer, a seguito di una progressiva e massiccia perdita di neuroni, si assiste ad una progressiva perdita della “mente” dell’individuo, con perdita, in particolare, delle funzioni mnestiche ed emozionali. Specificità Tutta l’organizzazione somato‐motoria, somato‐sensitiva e sensoriale è altamente specifica in ogni sua componente: si ha specificità sia nella suddivisione anatomica del SN ( ad esempio corteccia cerebrale e cervelletto hanno funzioni differenti), sia nella suddivisione topografica delle varie regioni anatomiche ( lateralizzazione degli emisferi, Homunculus di Pemfield, etc.) e quindi nella loro funzionalità. Ad esempio la visione è altamente specializzata: la macula consente, grazie all’elevata rappresentazione corticale, una rappresentazione dettagliata degli oggetti posti di fronte all’osservatore (a livello corticale vi è un’ulteriore specificità di visione: in particolare le linee e quindi i contorni degli oggetti sarebbero fondamentali nella visione, vedi Mondrian e le linee come elemento primordiale della forma e Kandel per i lavori sulla visione; rappresentazioni specifiche sarebbero poi quelle dei colori e, soprattutto, del movimento, ndr); la retina, ed in particolare quella periferica, consente un allargamento del campo visivo ad oggetti posti lateralmente all’osservatore (cosicchè se, ad esempio, una persona è in bicicletta ed un’automobile le sta tagliando la strada, è la retina periferica a percepire l’arrivo della vettura ed a consentire un pronto spostamento). Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
La macula possiede questa enorme capacità di risoluzione, cioè di analizzare i dettagli, grazie all’elevatissima capacità recettoriale che consente di percepire due punti, seppur vicinissimi tra loro, come distinti e di avere, di conseguenza, una vastissima rappresentazione corticale: quindi ciò che viene visto dalla macula, è analizzato da migliaia di recettori e milioni di neuroni, consentendo una visione dettagliata; ciò che viene visto dalla retina viene analizzato solo da decine o centinaia di neuroni, non consentendo una visione dettagliata di tutto il campo visivo. La stessa cosa avviene per la sensibilità tattile: la capacità di riconoscere gli oggetti attraverso il tatto è precipua delle dita della mano e non di quelle del piede, perché polpastrelli delle dita hanno una rappresentazione corticale decine,centinaia di volte superiore a quella della pianta del piede. Sul polpastrello delle dita il campo recettivo di un neurone nella corteccia somatosensitiva è di 1 mm2 ; questo significa che toccando qualcosa si riescono a cogliere tutte le differenze a distanza di un millimetro l'una dall'altra dell'oggetto. Invece in altre parti del corpo, ad esempio sulla pianta del piede, si riescono a distinguere due punti distanti centimetri tra loro, il campo recettivo è di cm2. Altamente specifica è poi la capacità motoria: in primis a livello cerebrale, in cui la rappresentazione corticale, a livello della corteccia piramidale di Betz o area prerolandica o area motoria primaria, è altamente specifica (homunculus di Penfield); in secundis, a livello dei nuclei motori del tronco encefalico o delle corna anteriori del midollo spinale, che consentono un coinvolgimento di fibre muscolari coordinato e selettivo. Pertanto questo stretto e specifico collegamento tra funzioni, fibre muscolari e neuroni, spinali e corticali, fa sì che per regioni corporee più innervate ( rapporto neurone motore/fibre muscolari maggiore) vi sia una rappresentazione corticale maggiore (ad esempio: mano). Altre funzioni specifiche sono quelle dell’udito, dell’olfatto (l’olfatto è un po’ meno specifico, in quanto gli odori possono raggiungere qualsiasi punto della mucosa olfattiva e, quindi, della corteccia olfattiva), del gusto, del tatto etc. Complessità Funzioni come il linguaggio, la programmazione di un movimento, la memorizzazione e la rievocazione di un evento, il riconoscimento di visi, oggetti, suoni etc., sono solo alcuni esempi di attività nervose sottese ad organizzazioni circuitali complesse; pertanto, la complessità è da considerarsi tipica, oltre che di reti circuitali complesse, delle aree associative, cioè delle aree che non hanno una funzione specifica ed univoca, ma cooperano, appunto, all’attuazione di funzioni complesse. Esempio tipico è ovviamente il linguaggio, per attuare il quale ci si avvale di un’area deputata all’ascolto, un’area deputata alla comprensione del simbolo del vocabolo, un’area deputata alla comprensione del valore semantico, un’altra deputata alla comprensione del contenuto emozionale del discorso, una deputata all’attuazione del linguaggio, ed, infine, un’area associativa, deputata all’integrazione di tutti questi dati, alla pianificazione di una risposta adeguata ed alla sua attuazione. Quindi si sottolinea, di nuovo, l’importanza di reti circuitali molto complesse, che decodificano informazioni provenienti da dati e dall’esterno e dall’interno, e di aree associative, tipicamente, ma non solo, frontali. Altro esempio tipico è quello della visione: essa, infatti, non va considerata meramente come il risultato della decodificazione, a livello della corteccia visiva primaria occipitale, dello stimolo visivo, ma come il risultato di una più complessa elaborazione di dati, a cui partecipa, oltre ovviamente allo stimolo visivo primario, una forte componente emozionale, che consente di mettere in relazione uno stimolo visivo ad una emozione, e quindi di attuare una risposta adeguata. Stesso discorso vale per il movimento, all’attuazione del quale partecipano non solo l’area motoria primaria, ma le aree associative, che, in risposta a stimoli esogeni e/o endogeni, pianificano l’attuazione del movimento stesso. In definitiva, il cervello può essere, molto sommariamente, considerato come costituito da aree primarie, deputate a funzioni specifiche (area motoria primaria, area visiva primaria, area di Wernicke etc.), e da aree associative, deputate, come detto, all’integrazione di questi dati, nonché all’elaborazione di una risposta adeguata. Unicità ed entelechia Ciascun essere umano ha un’identità psicofisica, che ritiene unica ed irripetibile e che comporta il riconoscimento dell’altro come “altro”: è per questo che la morte di una persona viene sentita come una perdita insostituibile. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Il termine entelechia è stato coniato da Aristotele per designare la sua particolare concezione filosofica di una realtà che ha iscritta in se stessa la meta finale verso cui tende ad evolversi. È infatti composto dai vocaboli en + telos, che in greco significano "dentro" e "scopo", a significare una sorta di "finalità interiore", “ ciò che ha in sé il proprio scopo” (fonte Wikipedia). Per Popper l’entelechia del SNC è l’attività mentale. Paragrafo II: sviluppo preistorico e storico del SN: come essi assicurano la specificità di funzione, la complessità del SN e l’unicità di ciascuno Il neurodarwinismo secondo Edelman (o teoria della selezione dei gruppi di neuroni) E’ un rivisitazione delle teorie biologiche darwiniane nel tentativo di fornire una spiegazione naturalistica della mente, fondata sulla saldatura concettuale fra filogenesi ed ontogenesi, fra neurobiologia e psicologia dello sviluppo delle capacità del SN, da quelle meno complesse alla cognitività. Edelman sviluppò questa teoria partendo da considerazioni sul sistema immunitario: infatti, questo è fornito di un “repertorio primario” costituito dalla struttura di base degli anticorpi, che si modifica con l’esperienza, ossia con il contatto con antigeni vari, risultando nel “repertorio secondario” diverso e caratteristico per ciascun individuo; Edelman applicò questa teoria allo sviluppo del SN. L’ipotesi epigenetica viene rinominata da Edelman teoria dei morforegolatori: i processi primari dello sviluppo (divisione,adesione,movimento,morte e differenziamento cellulare) sarebbero regolati da modulazioni locali delle superfici cellulari, cioè da cambiamenti nella quantità, nella distribuzione e nella composizione chimica delle molecole della superficie cellulare (CAM, cell adhesion molecules; SAM, substrate adhesion molecules; CJM, cell junctional molecules). La morfogenesi richiederebbe un anello di regolazione dinamica dipendente dalla sede, o contesto locale, che va dal gene (morforegolatore) al suo prodotto (molecole morforegolatrici), alle cellule, ai tessuti, e poi di nuovo indietro da queste strutture di ordine maggiore al medesimo od ad un differente gene. Meccanismi responsabili del comportamento adattivo sarebbero: aggregazione tra cellule e costituzione di gruppi di neuroni, selezione esperenziale ed organizzazione in mappe. Ricordando che le aree corticali mature differiscono per localizzazione nella corteccia, propietà molecolari, organizzazione istologica, pattern di connettività e funzioni, è bene sottolineare come i centri di controllo di tale sviluppo operano attraverso l’espressione graduata di fattori trascrizionali che controllano i programmi istogenetici per la proliferazione, la neurogenesi, la migrazione, la connettività, ed, infine, il programma di sopravvivenza o morte cellulare. Le organizzazioni nervose responsabili di specificità, unicità e complessità, si sviluppano con la neurogenesi, continuano tumultuosamente fino a 18‐20 anni e tendono, pur con la possibilità di ulteriori modifiche a cristallizzarsi; lo sviluppo del SN, comunque, termina solo con la morte dell’individuo. Al momento della fecondazione non è scritto ciò che diventeremo, ma solo la struttura di base del SN: lo sviluppo di questo “repertorio primario”, che può essere considerata la “preistoria” dell’individuo, è controllato dall’espressione genica e da eventi epigenetici e può essere modificato da patogeni (virus,droghe,tossine etc.) con disturbi anche molto gravi dello sviluppo. Quindi il repertorio primario del cervello umano è una straordinaria macchina cellulare, le cui potenzialità richiedono esperienze per essere trasformate in attualità: le esperienze scrivono la storia dell’individuo, trasformando gradualmente il repertorio primario in repertorio secondario. Preistoria Innanzitutto la preistoria: questa è la neurobiologia (geneticamente determinata) dello sviluppo prima dell’inizio della storia dell’individuo, ossia prima dell’azione dell’esperienza; su questa base neurogenetica agirà l’esperienza ( vedi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
dopo) per plasmare l’individuo nella sua unicità ed irripetibilità ( come ricorderà anche il Prof. Puoti, questo è molto a simile a quanto Platone pensava, vedi lezione sulle funzioni cognitive). Quindi, per il SN lo sviluppo è in una prima fase geneticamente determinato; poi la storia di ciascun individuo inizia a scriversi, modificando il SN in rapporto ad essa. Occorre ora capire come avviene lo sviluppo del SN. Il primo concetto fondamentale è che il tempo regola lo sviluppo spaziale del SN: lo sviluppo del SN, nella sua spazialità, dalla formazione di doccia e tubo neurale allo sviluppo ed alla differenziazione della corteccia cerebrale, procede infatti in modo continuato ed armonico, in maniera rapida ma così finemente regolata, nonchè geneticamente determinata, da assicurare a ciascun essere umano la stessa struttura anatomica, ed insieme,funzionale, di base del SN. Rilevante è l’organizzazione della corteccia che, per assicurare la maggior superficie possibile rispetto ad un volume relativamente piccolo quale quello della volta cranica, si riflette in tipici solchi cerebrali (primari,secondari,terziari). Di non minor importanza è poi il numero di neuroni (100 miliardi) e di sinapsi (500mila miliardi di sinapsi: 5mila sinapsi per neurone), nonché di cellule gliali, altrettanto numerose ed importanti nella fisiopatologia del SN. In definitiva, ne risulta uno sviluppo spaziale, e quindi funzionale, enorme, tempo‐regolato: tutte le cellule che nascono in un determinato tempo raggiungono la stessa configurazione spaziale (ora, io penso che lui si riferisca, in un primo momento, allo sviluppo embriologico del SN: tubo neurale, neuroporo anteriore e posteriore, vescicole cerebrali, corteccia cerebrale, solchi; questo sviluppo embriologico è temporalmente e finemente regolato. In un secondo momento, avviene poi lo sviluppo fetale, caratterizzato da sinaptogenesi ed orientamento assonale e conseguente inizio dell’organizzazione corticale, determinati, appunto, dal precedente sviluppo temporo‐spaziale, ndr). Il secondo concetto fondamentale riguarda le modalità di sviluppo del SN. Come avviene questo sviluppo? La prima tappa è la corretta migrazione delle cellule nervose grazie a proteine, temporalmente determinate, che regolano lo sviluppo direzionale, e quindi spaziale, del SN; una volta raggiunta la propria destinazione, queste cellule, tuttavia, non ancora una caratterizzazione né una funzione specifica, hanno solo una spazialità. La seconda tappa prevede l’intervento di fattori di crescita specifici che consentono lo sviluppo di connettività grazie alla formazione di prolungamenti caratteristici: assone, solitamente unico e lungo, e dendriti, solitamente plurimi e corti. A riguardo, è fondamentale la corretta localizzazione spaziale di tali prolungamenti, in particolare degli assoni: se ad esempio gli assoni, prolungamento di neuroni che a livello corticale, nell’Homunculus di Penfield, rappresentano la mano, andassero erroneamente a localizzarsi a livello del nervo ipoglosso che innerva i muscoli linguali, una persona, pensando di muovere la mano, muoverebbe la lingua. Anche questa tappa è temporalmente, e molto finemente, regolata, in questo caso grazie alla fondamentale azione delle Cell Adhesion Molecules (CAM) . Riguardo i dendriti, lo sviluppo, seppur per certi versi strutturalmente simile, se ne differenzia per l’intervento di un altro fattore fondamentale, l’esperienza: l’esperienza è il momento, per ritornare al concetto base di questa lezione, dell’interazione tra preistoria e storia dello sviluppo del SN; essa modifica lo sviluppo dell’arborizzazione dell’albero dendritico. Ad esempio, nel caso dello sviluppo dei neuroni motori come colinergici sarebbe proprio l’esperienza, ossia il ripetersi di contatti sinaptici, elaborati come “corretti”, tra il neurotrasmettitore acetilcolina (ACh) rilasciato dai neuroni motori ed i recettori nicotinici colinergici a valle, a consentire ed implementare lo sviluppo di questa via come “colinergica”, grazie al potenziamento della trascrizione genica (enzimi necessari per la biosintesi dell’ACH,enzimi necessari per la sintesi dei recettori colinergici, etc.) in senso, appunto, “colinergico”. Altro esempio dell’importanza dell’esperienza è l’apoptosi di neuroni in caso di mancanza di contatti sinaptici, quindi di assenza di stimoli esperenzali; ciò avviene a livello fisiologico, ma anche a livello patologico: pertanto, se, ad esempio, il collegamento sinaptico tra alcuni circuiti neuronali è interrotto, lo sviluppo del circuito stesso sarà assente, con mancanza della funzione di quel circuito. Esempi di patologie neurologiche che portano a queste alterazioni sono quelle geneticamente determinate caratterizzate da assenza delle proteine coinvolte nello sviluppo. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Storia La storia è la seconda parte dello sviluppo del SN, durante la quale l’esperienza raffina la topografia delle varie aree corticali ed i circuiti tra di esse, consentendo la maturazione e la caratterizzazione specifiche di esse. Un esempio tipico della funzione della storia, ossia dell’esperienza della nostra vita, è quello che riguarda il linguaggio: la capacità dell’essere umano di parlare, nonché di ascoltare e comprendere, sarebbe innata all’essere umano; ma la lingua parlata dal singolo individuo dipenderebbe dal luogo in cui ( o dalle persone con cui) egli si trova a fare esperienza della sua capacità ( ad esempio un italiano nato in Italia parlerà italiano, ma ad esempio un italiano nato e cresciuto in Germania con genitori tedeschi, parlerà tedesco). Lo sviluppo di una lingua madre è poi fondamentale nell’assunzione, da parte dell’individuo, di un contesto socio‐culturale con cui egli, molto probabilmente, si identificherà, facendo sue, come bagaglio esperenziale, quasi tutte le usanze e credenze di quel contesto temporo‐
spaziale. Aspetti importanti delle modalità di formazione del linguaggio sono che: in primis, un individuo, cresciuto in isolamento o tra esseri non umani, non imparerà a parlare, segnalando come l’esperienza sia necessaria per lo sviluppo del linguaggio (interessante è poi notare come individui cresciuti in isolamento presentino, non solo un’incapacità a comunicare adeguatamente, ma anche deficit cognitivi, evidenziando la strettissima associazione tra linguaggio e funzioni cognitive, in particolare intelligenza, ndr); in secundis, quanto più precoce è l’apprendimento di una seconda lingua, tanto più duraturo esso sarà. In definitiva, quest’esempio dell’uso/non‐uso del linguaggio serve ad esemplificare come una patologia possa essere dovuta non solo, ad esempio, a virus, difetti genetici o altro, ma anche a carenza di esperienza: un esempio di insufficienza di esperienza è la pseudoinsufficienza mentale, in cui un bambino, pur normalmente dotato, in assenza di adeguati stimoli cognitivi, non svilupperà delle normali competenze cognitive. Il ritardo mentale (od oligofrenia od insufficienza mentale) è un deficit di sviluppo delle funzioni cerebrali, dovuto a cause prenatali (soprattutto anomalie genetiche, disordini metabolici od ipossici), perinatali (insufficienza placentare, precocità, complicanze di gravidanza e parto) o postnatali (traumi, infezioni). Un altro esempio dell’importanza dell’esperienza nell’assicurare un corretto sviluppo del SN riguarda la corteccia visiva: ad esempio, a seguito di una cucitura sperimentale di un occhio di un ratto durante il suo sviluppo, la corteccia visiva corrispondente a quell’occhio sarà pochissimo rappresentata, mentre la controlaterale, per compenso, sarà maggiormente rappresentata (il prof non lo dice, ma probabilmente il concetto è che, a seguito di un’eventuale apertura dell’occhio precedentemente chiuso a sviluppo terminato, la corteccia visiva corrispondente non svilupperà adeguatamente, non consentendo una corretta visione con quell’occhio. Praticamente lo stesso che avviene per il linguaggio, ndr). Questo accade per deprivazione sensoriale, con conseguente perdita dei contatti sinaptici lungo la via dell’occhio forzatamente chiuso. In definitiva, l’esperienza risulta fondamentale non solo per l’attivazione, ma anche per il mantenimento dei circuiti. Un altro aspetto fondamentale è la plasticità del SN: così, ad esempio, in caso di assenza del collicolo inferiore, che normalmente conduce gli stimoli al corpo genicolato mediale e da qui alla corteccia uditiva, gli stimoli acustici provenienti dalla coclea giungeranno al collicolo superiore, che li invierà non solo al corpo genicolato laterale e quindi alla corteccia visiva, ma anche al corpo genicolato mediale ed alla corteccia uditiva. Occorre, a questo punto, considerare i tempi preistorico e storico: dato che il tempo preistorico, ossia lo sviluppo neurobiologico del SN, continua fino ai 16‐18 anni e che il tempo storico comincia già in utero (virus materni, sostanze o farmaci utilizzati dalla madre), c’è un lunghissimo periodo di overlapping, ossia di sovrapposizione, tra i due. Questa fondamentale sovrapposizione consente di considerare che molte patologie “storiche”, cioè prodotte dall’esperienza, si riflettono in una diversa espressione genica (esempio tipico, oltre alle patologie succitate, è l’ansia; vedi gli studi su Aplysia di E. Kandel) e che le nostre capacità, come la genialità o l’estrema abilità sportiva o musicale, sono il risultato di un’ integrazione tra substrato genetico preistorico ed esperienza storica, che agisce modificando la trascrizione genica (se ad esempio una persona, più o meno dotata, gioca a calcio, avrà una rappresentazione corticale dei muscoli e della sensibilità dei piedi maggiormente sviluppata rispetto ad una persona che non gioca a calcio. Tale diversità di rappresentazione è appunto dovuta ad una diversa trascrizione genica in tali aree). Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Ultima importante considerazione è quella che elimina di fatto la distinzione, un tempo di moda, tra patologie funzionali ed organiche: patologie, come alcune psichiatriche (nevrosi, ansia, depressione, schizofrenia) o le canalopatie, un tempo ritenute funzionali perché, con gli strumenti diagnostici in uso, non si riscontravano alterazioni microscopiche, funzionali o strumentali, oggi, grazie all’affinamento degli strumenti diagnostici, possono essere riconducibili ad alterazioni più o meno specifiche della neurobiologia o della neurobiochimica delle cellule nervose ( forse tale distinzione risentiva del pensiero, più filosofico‐religioso che scientifico, dominante tempo fa che distingueva psiche e cervello: le patologie funzionali erano quelle della psiche, quelle organiche del cervello; ndr). Esempi di patologie legate ad anomalie dello sviluppo del repertorio primario ‐Sindrome di Down: dovuta in genere a trisomia del cromosoma 21 (ma anche a traslocazione robertsoniana: braccio lungo del cromosoma 21 su di un altro cromosoma, spesso il 14), si manifesta con insufficienza mentale di grado variabile, carattere tranquillo, docile ed affettuoso, habitus tipico (bassa statura, brachicefalia, volte epicantali, naso appiattito, malattie cardiache congenite) e regressione mentale (tipo Alzheimer) dopo i 40 anni. ‐Microcefalia ‐Sindrome di Williams‐Bauren o della faccia da elfo: dovuta a delezione di una parte del cromosoma 7 contenente il gene dell’elastina, si caratterizza per una fisionomia tipica, per la mancanza di inibizione sociale, per i deficit visuo‐
spaziali con incapacità a costruire i puzzle anche semplici e per la stenosi aortica (vedi lezione Prof.ssa Melone). Esempi di patologie legate ad anomali dello sviluppo del repertorio secondario ‐Disturbi psicogeni del comportamento legati all’esperienza ‐Disturbi della cognitività secondari a mancata o errata educazione Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE II:PROF. COTRUFO Fisiopatologia generale dei disturbi del SN e dei suoi collegamenti tra recettori ed effettori Par. I: Meccanismi generali di patologia del SN •
•
•
•
•
•
Disordini della connettività circuitale Disordini della conduttività del potenziale d’azione Disordini della eccitabilità neuronale e muscolare Disordini della neurotrasmissione Disordini dell’accoppiamento eccitazione‐contrazione muscolare Disordini dell’integrità del sarcolemma nell’esercizio muscolare Par II: I meccanismi Alterazioni della connettività circuitale Questo meccanismo è il più frequente, dato che quasi tutte le funzioni nervose sottendono a reti circuitali. Tipico esempio di alterazione della connettività circuitale è una lesione meccanica, un trauma, del midollo spinale, con conseguente paraplegia o tetraplegia a seconda della sede di lesione, dovuta, appunto, ad una interruzione della connettività circuitale tra neuroni della corteccia motoria e motoneuroni spinali ( il primo passo successivo al trauma è la degenerazione walleriana delle strutture nervose a valle). Altri esempi sono quelli relativi a perdita neuronale per necrosi o apoptosi di neuroni, per emorragia od ischemia cerebrale, per infezione da Herpes Virus o per proteinosi di neuroni specifici, per demenza di Alzheimer o senile o per SLA con conseguente perdita di neuroni e quindi di connettività circuitale. Nonostante molte di queste alterazioni portino ad una perdita di funzionalità (come appunto in caso di tetraplegia o paraplegia), non tutte la alterazioni portano ad essa, in virtù, in primis, della ridondanza di alcune aree, specie associative, del SN. Importante è, inoltre, il tipo di neurone, o di gruppi di neuroni, con connettività alterata: eccitatori od inibitori. Difatti, in caso di perdita di neuroni inibitori, ne risulterà una disinibizione e quindi un’eccitazione dei neuroni a valle: se questi sono eccitatori, ne conseguirà, ancor più a valle, un’ulteriore eccitazione; ma se questi sono inibitori, ne risulterà, ancor più a valle, una iperinibizione. Di conseguenza, in questi casi, l’alterazione della connettività può portare non ad una perdita della funzione, ma ad un aumento di essa: esempio tipico è il morbo di Parkinson, in cui a fronte di una perdita di connettività tra substantia nigra e nucleo striato, si assiste ad un’iperattività motoria (tremore a riposo, ipertono muscolare), dovuta appunto ad una iperattivazione da disinibizione del nucleo striato. Riguardo lo stroke, infine, esso non va considerato primariamente come un disturbo delle connettività: infatti, vi è una prima fase, definita penombra ischemica, in cui, a fronte di una assenza di alterazioni neurodegenerative e quindi di connettività circuitale, vi è una perdita solo di funzione, e quindi di eccitabilità, dovuta ad una riduzione del flusso sanguigno e, quindi, di ATP; nella seconda fase, invece, può esserci un’alterazione neurodegenerativa e di connettività circuitale. Disordini della conduzione del potenziale d’azione(PDA) Fondamentale risulta poi, oltre ad una integra rete neurale, anche una sua corretta funzionalità ed, in particolare, una corretta conduzione del PDA: a tal fine, di primaria importanza è la corretta mielinizzazione degli assoni (fattore determinante la velocità di propagazione del PDA, insieme al diametro delle fibre, determinato dal calibro proprio dell’assone e dal numero di avvolgimenti mielinici); difatti, in caso di un’alterazione della mielinizzazione, a seguito ad esempio dell’azione di autoanticorpi, risulterà, nonostante l’integrità della rete neurale a monte, una perdita di conduttività e quindi di connettività neurale(l'assone è rivestito di mielina tranne che a livello dei nodi di Ranvier e lo Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
spazio tra due nodi di Ranvier è detto internodo: basta una demielinizzazione tra due internodi contigui per l’arresto del PDA). Esempio tipico è la sclerosi multipla (SM). Disordini della eccitabilità neuronale e muscolare Tutte le cellule possiedono una carica elettrica, ma ciò che caratterizza le cellule nervose e muscolari (striate, lisce e miocardiche) è la capacità di depolarizzarsi, cioè di modificare il proprio potenziale di membrana (PDM): responsabili di questa capacità sono specifici canali, regolati dal voltaggio elettrico della membrana o da sostanze chimiche, come neurotrasmettitori e farmaci, e capaci di modificare molto rapidamente il passaggio di ioni attraverso le membrane e, quindi, il PDM. I principale ioni coinvolti sono: sodio, che ha un PDM positivo, in virtù di una sua maggior concentrazione all’esterno, e, pertanto, tende, a seguito dell’apertura dei propri canali, ad entrare, depolarizzando la cellula; potassio, che ha un PDM negativo, a causa della sua maggiore concentrazione all’interno, e, pertanto, tende, a seguito dell’apertura dei propri canali, ad uscire, iperpolarizzando la cellula; cloro, che ha un PDM negativo, a causa della maggior concentrazione esterna, e, pertanto, tende ad entrare; calcio, che ha anch’esso, come il sodio, un PDM positivo. Il PDM a riposo è negativo (‐80 mV), in virtù della maggior permeabilità agli ioni potassio ( quindi è più vicino al PDM del potassio, negativo appunto, per la maggior fuoriuscita di ioni positivi rispetto al loro ingresso): a seguito di uno stimolo si assiste all’apertura dei canali del sodio, con conseguente depolarizzazione del PDM ed eccitazione cellulare; la cellula ritornerà poi al potenziale di riposo grazie all’apertura dei canali al potassio; questo meccanismo avviene, pressappoco nel medesimo modo, a livello degli assoni (PDA) e delle fibrocellule muscolari. I potenziali graduati sono, invece, quelli delle sinapsi (neurone pre‐sinaptico e neurone o fibra muscolare post‐
sinaptici): essi consentono di graduare, tramite stimoli sottosoglia, il PDM di queste cellule e, quindi, la loro eccitabilità; a seconda della prevalenza dei segnali inibitori od eccitatori in arrivo alla cellula nervosa, ne conseguirà una maggiore o minore iperpolarizzazione, e, di conseguenza, una minore o maggiore eccitabilità. Tra le patologie legate ad alterazioni dell’eccitabilità neuronale, vanno sicuramente annoverate le canalopatie, tra cui le epilessie e le miotonie (oltre alle canalopatie cardiache), le patologie neurotrasmettitoriali, come in caso di carenza di GABA, genetica od autoimmunitaria, da carenza della glutammico‐decarbossilasi (possono essere considerate come canalopatie secondarie: un deficit di GABA porterà ad un deficit di attivazione dei canali al cloro e, quindi, ad un’ipereccitabilità con possibili crisi epilettiche), le paralisi da non eccitabilità neuronale e l’amnesia globale transitoria (queste ultime due patologie sono non da ipereccitabilità come le prima, ma da ipoeccitabilità, probabilmente dovuta ad ischemia temporanea di specifiche zone corticali). Disordini della trasmissione sinaptica e della neurotrasmissione La trasmissione sinaptica avviene grazie all’arrivo, a livello presinaptico del PDA: ciò induce una depolarizzazione con conseguenti apertura dei canali del calcio ed attivazione del sistema proteico di esocitosi calcio‐dipendente, che consente, appunto, la fusione delle vescicole contenti il neurotrasmettitore con la membrana presinaptica; il neurotrasmettitore si lega, poi, ai recettori postsinaptici, Quindi, tra i disordini della trasmissione sinaptica, oltre a disturbi da deficit neurotrasmettitoriali presinaptici, come il deficit di gluttammico‐decarbossilasi, e conseguentemente di GABA ( in questo caso, il deficit è primariamente della neurotrasmissione e, secondariamente, dell’eccitabiltà), vi sono disturbi postsinaptici: i più frequenti sono da esotossine (botulismo, tetano) o da autoanticorpi diretti contro i recettori post‐sinaptici, come nella miastenia gravis. I deficit neurodegenerativi, come la malattia di Parkinson, invece, non vanno annoverati tra i deficit della neurotrasmissione: l’alterazione è neurodegenerativa e, secondariamente, neurotrasmettitoriale. Disordini dell'accoppiamento eccitazione contrazione muscolare L’ACh rilasciata da neuroni presinaptici in quelli postsinaptici induce in questi ultimi una depolarizzazione che innesca il PDA: il PDA viaggia lungo il sarcolemma e penetra all’interno delle fibre muscolari tramite i tubuli T: questi sono accoppiati al reticolo sarcoplasmatico (triade), in cui inducono rilascio di Ca2+. Questo processo avviene grazie all’apertura, lungo i tubuli T, di canali per il Ca2+ voltaggio‐dipendenti diidropiridina‐sensibili: l’ingresso di Ca2+ induce il rilascio di ulteriore Ca2+ dal reticolo sarcoplasmatico tramite il suo legame ai recettori sarcoplasmatici Ca2+‐
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
dipendenti rianodina‐sensibili; ne deriva un massiccio ingresso di Ca2+ all’interno della fibrocellula muscolare e conseguente contrazione tramite accoppiamento actina‐miosina. Infine, il Ca2+ viene riportato all’interno del reticolo sarcoplasmatico tramite un meccanismo ATP‐dipendente. Tra le patologie legate ad alterazioni di questo meccanismo si ricordano: paralisi periodica ipocaliemica, dovuta ad alterazione dei canali diidropiridina‐sensibili e conseguente paralisi per incapacità di contrazione, ed ipertermia maligna, dovuta ad alterazione dei canali rianodina‐sensibili e conseguente rilascio prolungato di Ca2+ nella cellula, contrazione paralizzante ed iperproduzione di calore (lo sviluppo della patologia portava inevitabilmente alla morte per eccessivo consumo di ATP; oggi, per fortuna, la prognosi è migliorata grazie al dantrolene) Disordini dell’integrita’ del sarcolemma Il sarcolemma è una struttura alquanto fragile, costituita solo da un esile doppio strato lipidico, costituzione che, da sola, non gli consentirebbe di resistere agli stress in trazione conseguenti alla contrazione (diminuzione della lunghezza con aumento della larghezza e conseguente iperpressione tangenziale su di esso): pertanto, la resistenza e la stabilità delle fibre muscolari sono dovute al citoscheletro ed al robusto sistema di ancoraggio posto tra esso e tra la matrice extracellulare: alla base di questo sistema di ancoraggio vi sono la distrofina, proteina intracellulare, la laminina ed il collageno extracellularmente, il destroglicani ed il sarcoglicano all’interno della membrana. Di conseguenza, le patologie da alterata integrità del sarcolemma dipendono da alterazioni del sistema di ancoraggio, e soprattutto della distrofina (distrofia muscolare), ma anche di destroglicani e sarcoglicani e della laminina. Per la diagnosi di patologia muscolare è fondamentale il dosaggio del CPK sierico, rilasciato dalle cellule alterate (è bene ricordare che anche una persona sana può andare incontro ad una distrofia muscolare “fisiologica”, come a seguito di sforzi muscolare particolarmente intensi, come dopo una maratona: la differenza è che, ovviamente, lo sforzo muscolare per esplicitare una distrofia ed un aumento del CPK per una persona sana è notevole, per un distrofico modesto). Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE III: PROF COTRUFO Meccanismi eziopatogenetici delle malattie del SN Par I: Classificazione I meccanismi eziopatogenetici delle malattie del Sistema Nervoso e dell’apparato neuro‐muscolare sono riconducibili a: • Tumori e sindromi paraneoplastiche • Infezioni virali, non virali, da prioni, sarcoidosi • Malattie cerebro‐vascolari • Traumi cranio‐cerebrali, spinali e dei nervi periferici • Malattie immuno‐mediate del SNC, periferico e neuro‐muscolare. • Malattie ereditarie • Malattie dismetaboliche, carenziali, tossiche e iatrogene • Malattie cromosomiche • Anomalie dello sviluppo del Sistema Nervoso: – Malattie da anomalie del foglietto germinale – Malattie da tossici esogeni – Malattie ereditarie poligeniche • Il problema delle malattie “degenerative” e dei disturbi “funzionali” Par II. Eziopatogenesi specifiche Tumori intracranici ed intraspinali e sindromi paraneoplastiche Innanzitutto, è bene considerare alcune aspetti epidemiologici dei tumori intracranici: quelli primitivi sono abbastanza frequenti, ma le metastasi cerebrali sono ancor più frequenti (4,5% di morti da cancro vs 25% di morti per cancro); sono la seconda causa di morte per patologia intracranica, dopo gli ictus; nei bambini, sono ì più comuni tumori solidi ed i secondi più comuni tra tutti, dopo le leucemie; l’incidenza annuale è di 15/105 per i tumori primitivi e di 46/105 per tutti i tumori cerebrali. E’ bene ricordare come le metastasi cerebrali spesso siano, data la pronta evidenza di una sintomatologia clinica, la prima manifestazione clinica di altri tumori primitivi con scarsa o assente evidenza clinica, specie per la presenza di una elevata riserva funzionale, come i tumori polmonari, mammari o delle ovaie: la diagnosi cerebrale si fa tramite TC, per passare poi alla ricerca del tumore primitivo; la prognosi di questi tumori con metastasi cerebrali è molto negativa; il 25% di questi pazienti muore per la metastasi piuttosto che per il tumore primitivo. Alcuni principi importanti nella clinica neurologica dei tumori sono: • Diversi tipo di tumore, primitivi o secondari, possono svilupparsi nella cavità cranica e nel midollo spinale; alcuni sono più frequenti di altri (quelli della fossa cranica posteriore nel bambino, quelli sovratentoriali, specie gliomi, nell’adulto). I tumori primitivi sono soprattutto neuroepiteliali, cioè di derivazione dalla placca neurale, cioè sia da neuroni che da cellule della glia come astrociti ed oligodendrociti; i tumori secondari sono metastasi di altri tumori • Alcuni di questi tumori, come il craniofaringioma, il meningioma e lo schwannoma, hanno propensione a crescere in aree particolare della cavità cranica, dando origine a sindromi specifiche: il craniofaringioma, infatti, sviluppandosi nella regione sovrasellare, comprime il chiasma ottico, il peduncolo ipofisario, l’ipotalamo, la regione infundibolare ed il terzo ventricolo; lo schwannoma, invece, colpisce prevalentemente il nervo acustico all’interno del canale acustico Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Alcuni tumori possono avere una presentazione acuta simil‐ictale, a causa di un’emorragia intratumorale per rapido ed improvviso accrescimento o di una stenosi arteriosa per compressione ab estrinseco Malattie come AIDS, neurofibromatosi, cancerosi sistemiche, predispongono allo sviluppo di tumori del SN La velocità di crescita e l’invasività dei tumori sono variabili: alcuni, come il glioblastoma (4° di malignità), sono altamente maligni, invasivi e rapidamente progressivi; altri, come il meningioma, sono benigni, ad evoluzione lenta e compressivi (tranne in rarissimi casi di evoluzione in meningiosarcomi, i meningiomi sono asintomatici o con sintomi più o meno gravi in relazione alla sede colpita); i gliomi, invece, hanno un’evoluzione molto variabile e, talora, molto rapida, da qui la necessità di un follow‐up anche ogni 6 mesi. La prognosi dipende anche dalla possibile escissione chirurgica: vi sono, infatti, sedi a maggior rischio di morte o rischio di avere un deficit neurologico peggiore con l’escissione piuttosto che con la permanenza del tumore; un esempio è dato dall’oligodendrocitoma a localizzazione nel terzo ventricolo o nell’emisfero sinistro deputato al linguaggio: in entrambi i casi, un’escissione porterebbe ad un peggioramento della sintomatologia (importante, in questi casi, è la valutazione, tramite TC o RMN del grado di malignità biologico: nei casi suddetti, si ha un grado di malignità biologico basso, ma un grado di malignità in sede elevato). Le metastasi cerebrali sono, invece, solitamente meno compressive e più infiltranti dei tumori primitivi; inoltre, sono abbondantemente vascolarizzate, tramite la vascolarizzazione primitiva e con un endotelio fenestrato, e quindi molto emorragiche: ne risulta uno stravaso emorragico che provoca un’ulteriore disturbo della conduzione del SN. In questi casi, di elevatissima malignità, non c’è altro da fare se non una radioterapia di tutto il cervello ed una chemioterapia mirata contro il tumore primitivo (che sarà attiva anche contro le metastasi, poiché hanno la medesima derivazione cellulare) Neoplasie sistemiche possono, tramite meccanismi poco conosciuti, avere un effetto remoto sul SN, del tutto indipendente, dall’effetto compressivo, infiltrante e metastatico: tali effetti paraneoplastici possono rappresentare la manifestazione clinica iniziale o unica della neoplasia di base (risulta, pertanto, fondamentale una loro precoce identificazione, al fine di una pronta diagnosi del tumore primitivo); tra le più frequenti si ricordano le sindromi miasteniche, come complicanze di timomi o microcitomi, o neuropatie varie, come conseguenza di tumori endocrino‐metabolici, dell’ovaio o della mammella Alterazioni della circolazione liquorale e sindrome da ipertensione endocranica (IEC) Tra i meccanismi si ricordano: • Massa intra od extra‐cerebrale [tumori (meningiomi), infarti massivi con edema, contusioni, emorragie od ematomi parenchimali, subdurali od epidurali, ascessi]: determina alterazione della circolazione liquorale al raggiungimento di uno dei siti critici per la circolazione (forame di Monroe, acquedotto di Silvio, forami di Majendie e di Luschka) o per impedimento del riassorbimento del liquor (tramite ostruzione delle granulazioni del Pacchioni) • Rigonfiamento cerebrale generalizzato [stati anossici (che determinano un edema citotossico diffuso), insufficienza epatica acuta, encefalopatia ipertensiva, sindrome di Reye (squilibrio mitocondriale diffuso)]: determina aumento della pressione intracranica e disturbo della circolazione liquorale • Ipertensione venosa (insufficienza cardiaca, ostruzione delle vene mediastiniche superiori e giugulari, trombosi venosa cerebrale): il riassorbimento di liquor avviene nei seni venosi della volta cranica tramite le granulazioni del Pacchioni: se la pressione in questi è maggiore di quella del liquor, il riassorbimento non avviene • Ostacoli al flusso e al rigonfiamento del LCS [idrocefalo da meningite infettiva, come quella tubercolare, carcinomatosa (metastasi leptomeningea di tumore primitivo in altra sede), granulomatosa, fibromatosa o post‐emorragica; dilatazione prevalente degli spazi sub‐aracnoidei]: in questi casi è la formazione di aderenze cicatriziali ad impedire la circolazione liquorale negli spazi sub aracnoidei, e quindi il riassorbimento di liquor • Processo patologico che espande il volume del LCS (meningiti; emorragie subaracnoidee oppure aumento del liquor come nei rari tumori dei plessi corioidei) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Infezioni non virali del SN • Infezioni piogeniche o batteriche – Tromboflebite settica – Meningite batterica – Ascesso cerebrale – Ascesso epidurale – Empiema sottodurale • Infezioni granulomatose del SN – Tubercolosi – Sifilide – Sarcoidosi – Lebbra (propria del SNP, ed in particolare dei nervi sensitivi) • Infezioni da rickettsie, protozoi, vermi, zecche e parassiti (echinococcosi, cisticercosi, trichinosi etc.) • Toxoplasmosi Malattie da esotossine batteriche • Tetano: è una patologia, causata da Clostridium Tetani, da ipereccitabilità neuronale, dovuta a blocco degli interneuroni inibitori di Renshaw, che inibiscono, appunto, i motoneuroni spinali. o Patogenesi: quando i motoneuroni spinali vengono eccitati parte, non solo un potenziale d’azione diretto alla giunzione neuromuscolare, ma anche un potenziale d’azione diretto, tramite assoni collaterali, ai neuroni di Renshaw; questi neuroni, attivati, rilasciano glicina sui motoneuroni spinali, inibendoli e preservandoli da una ulteriore eccitazione. Ne risulta, in caso di blocco di questi interneuroni da tossina tetanica (o tetanospasmina), una contrattura muscolare persistente, sia degli agonisti che degli antagonisti, con prevalenza di quelli più potenti: o Quadro clinico: trisma per contrattura dei muscoli della mandibola (masseteri), risus sardonicus , addome a barca,opistotono per contrattura degli estensori del rachide, blocco dei muscoli respiratori fino all’asfissia ed alla morte, fenomeno Tien (ossia aumento della temperatura corporea per spasmo muscolare intenso e protratto). Possono anche verificarsi attacchi tetanici, parossismi di contrazioni toniche o spasmi muscolari • Difterite: l’esotossina difterica, rilasciata sa Corynebacterium dyptheriae, che ha colonizzato la regione orofaringea, agisce sui canali del sodio, bloccando la depolarizzazione e, quindi, l’eccitabilità dei neuroni ed inducendo demielinizzazione secondaria nelle parti prossimali dei nervi: si ha, dapprima una blocco dei nervi cranici glossofaringeo, ipoglosso e vago; poi, diventa sempre più generalizzata o Paralisi palatale: voce natale, rigurgito, disfagia o Paralisi clilare: perdita dell’accomodazione e l’annebbiamento della vista o Polineuropatia sensitivo‐motoria periferica o Arresto cardio‐respiratorio • Botulismo: la tossina botulinica agisce a livello presinaptico sui motoneuroni, inibendo il rilasco di acetilcolina e, quindi, l’eccitazione muscolare; ne deriva una paralisi flaccida (in opposizione alla paralisi spastica tetanica). In condizioni normali, l’arrivo del PDA a livello presinaptico induce l’apertura di canali al Ca2+, che inducono, a loro volta, l’esocitosi; l’esocitosi di ACh risulta interrotta, oltre che a livello neuromuscolare, anche a livello pre‐ e post‐gangliare del sistema parasimpatico: o Sintomi prodromici: anoressia, nausea, vomito o Sintomi iniziali: offuscamento della vista, diplopia, ptosi, strabismo, pupille non reagenti o Altri sintomi da coinvolgimento bulbare: sordità, voce nasale e rauca, disartria, disfagia, difficoltà di fonazione, stipsi o Coinvolgimento di muscoli mimici, muscoli del collo, del tronco e degli arti o Arresto cardiorespiratori Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Infezioni virali • Poliovirus e motoneuroni spinali: determina paralisi flaccide • Virus Varicella‐Zoster e gangli sensitivi (neuroni sensitivi di prim’ordine): determina nevralgie insopportabili (fuoco di Sant’Antonio) • Virus rabbico e cellule di Purkinje del cervelletto: determina disturbi atassici, tra cui blocco della deglutizione, anche solo dell’acqua (“idrofobia”) • Herpes Simplex e necrosi del lobo temporale: determina encefalite focale temporale • HIV1 e HIV2 e focolai multipli di necrosi a livello cerebrale (per la maggior suscettibilità ad infezioni virali) • Citomegalovirus • Epstein‐Barr virus: come il precedente, non ha particolare tropismo verso alcun neurone Infezioni virali subacute e croniche che simulano una malattia degenerativa I virus responsabili di queste infezioni avrebbero infettato l’individuo molti anni prima dell’infezione ed andrebbero incontro a modifiche genomiche a seguito della permanenza nel SN, con conseguente rallentamento del proprio sviluppo e danni cerebrali, che diventano rapidamente gravissimi e mortali. • Panencefalite sclerosante subacuta: causata dal virus del morbillo • Encefalite sub‐acuta da morbillo con immunosoppressione • Panencefalite progressiva rubeolica: causata dal virus della rosolia, • Leucoencefalite multifocale progressiva e immunodeficienza : è dovuta ad un virus opportunista (JC virus), che la maggior parte delle persone incontra durante la vita, con produzione di anticorpi e blocco dell’infezione; nei pazienti immunodeficienti, il virus si riattiva • Encefalite letargica di Von Economo o malattia del sonno: conseguenza della pandemia influenzale della seconda metà del ‘900 ed oggi molto rara, è stata descritta de O. Sacks nel libro “Risvegli” ed interpretata nel film da Robert De Niro; i pazienti furono curati con L‐dopa Encefalopatie spongiformi trasmissibili (malattie da prioni) • Encefalopatie degli animali: degli ovini (Scrapie), dei bovini (“mucca pazza”) • Encefalopatia spongiforme sub‐acuta (malattia di Creutzfeld‐Jacob,CJD) : più frequentemente sporadica, può anche essere genetica o iatrogena • Sindrome atassica familiare (GSSD): è solo geneticamente determinata • Insonnia familiare fatale: anch’essa è determinata solo geneticamente • Kuru: era trasmessa tramite cannibalismo, soprattutto in popolazioni africane che mangiavano il cervello della matriarca nella speranza di appropriarsi della sua saggezza, e anche geneticamente L’importanza di queste patologie deriva, più che dalla loro limitata incidenza, dal particolare meccanismo eziopatogenetico, dovuto ad una proteina contagiosa: essa riesce a modificare la conformazione di proteine normali presenti nel SN. Malattie cerebro‐vascolari Innanzitutto, alcuni dati epidemiologici: rappresentano circa il 50% delle patologie del SN; sono la 3° causa di morte dopo le cardiopatie ed il cancro ; sono la 1°causa di invalidità permanente; i 4/5 degli ictus sono ischemici, il restante quinto è emorragico (intraparenchimale o subaracnoideo) . La malattia cerebro‐vascolare (MCV) è definibile come qualsiasi alterazione encefalo‐midollare derivante da un processo patologico dei vasi sanguigni, ossia da qualsiasi alterazione di cuore, vasi sanguigni e crasi ematica che comporta ischemia od emorragia cerebrale: da non trascurare sono le alterazioni cardiache, costituite da emboli, dovuti soprattutto a valvulopatie o fibrillazione atriale; gli ictus ischemici, comunque, sono solitamente legati ad una patologia dei tronchi sovraaortici (TSA). Manifestazione tipica delle MCA (ma non patognomonica, in quanto, come visto, anche i tumori possono dare ictus) è la sindrome ictale: l’ictus è un deficit neurologico focale improvviso non convulsivo (anche se l’infarto cerebro‐
vascolare può condurre ad epilessia post‐ictale). Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Esempi di sindromi ictali sono: l’aneurisma congenito del poligono di Willis (la dilatazione può rompersi, con conseguente emorragia subaracnoidea o intraparenchimale in caso in cui la pressione del sangue sia tale da rompere il parenchima e penetrarvi dentro); infarto rosso (è un infarto ischemico con successiva riperfusione del territorio: l’endotelio, tuttavia, è andato in necrosi e, pertanto, il sangue passa proprio nel territorio infartuato); macroglobulinemia di Waldenstrom (che aumenta la viscosità ematica). Traumi craniocerebrali e spinali I traumi sono la principale causa di morte delle persone giovani di età inferiore ai 44 anni: circa la metà di questi morti ha avuto un trauma cranico. La fisiopatologia è abbastanza complessa: difatti, si va dalle contusioni, con danno del parenchima evidente, soprattutto per emorragia, alle commozioni cerebrali, alle condizioni senza neanche commozione cerebrale, chiamate danno assonale tardivo. Malattie immuno‐mediate del SNC, del SNP e del muscolo scheletrico Definire l’eziopatogenesi, in questi casi, è molto importante perché consente una terapia adeguata (di tipo patogenetico, e non eziologico, perché non si conosce ancora l’agente causale): • Sclerosi Multipla: molto rilevante, oltre che per la frequenza, per la giovane età dei malati, è una malattia del SNC; è legata ad autoanticorpi diretti contro la mielina, ma anche contro gli oligodendrociti che la producono e, talvolta, contro gli assoni con conseguente degenerazione assonale • Poliradicolonevrite sub‐acuta benigna di Guillian‐Barret: interessa il SNP; si producono anticorpi contro le radici nervose dei nervi periferici con fagocitosi della mielina • Nevrite motoria multipla: è legata alla produzione di autoanticorpi contro glicolipidi dei nodi di Ranvier: ne consegue un blocco della conduzione assonale saltatoria • Poliradicolonevrite cronica : come la precedente, è a carico del SNP; ha un meccanismo eziopatogenetico simile a quello della sindrome GB • Miastenia gravis: interessa la giunzione neuromuscolare; è dovuta nel 75% dei casi ad autoanticorpi contro il recettore per l’ACh, nel 15% ad autoanticorpi contro la proteina MUSK (kinasi muscolo specifica) • Polimiosite e dermatomiosite: interessano le fibre muscolari, cioè gli autoanticorpi sono rivolti contro le fibre muscolari Malattie genetiche del Sistema Nervoso, del DNA nucleare e mitocondriale Questo capitolo delle patologie è molto importante, data l’assenza di terapie efficacie e l’elevatissimo coinvolgimento di SN, muscoli ed organi di senso nelle malattie genetiche (fino al 90%). Con l’avvento della neurochimica e della genetica molecolare si è proceduto alla identificazione di così tante malattie metaboliche ed ereditarie(circa 6000 catalogate da Mc Kusick) che è divenuto difficile tenere a mente i loro nomi, il gene mutato,il cromosoma mutato,il cromosoma imputato ,il nome dell’enzima o della proteina alterata o non espressa,la sindrome clinica del genotipo, anche perché la relazione genotipo‐fenotipo non è assolutamente costante. Compito del neurologo è identificare il fenotipo clinico, mirare le analisi biochimiche e genetiche alla ricerca delle possibili mutazioni, estendere le analisi ai genitori, definire il trattamento, se possibile, e la prognosi ed, infine, offrire una consulenza genetica –clinica alla famiglia (mirata soprattutto ad informare sulla probabilità, con future gravidanze, di avere figli affetti dalla medesima patologia). Si riconoscono diversi tipi di patologie genetiche: • Patologie monogeniche a trasmissione mendeliana: ad esempio, la distrofia di Duchenne • Patologie multifattoriali • Aberrazioni cromosomiche: ad esempio, la sindrome di Down • Malattie mitocondriali a trasmissione materna quasi esclusiva 21: la sindrome di Luft, ad esempio, induceva un ipermetabolismo dovuto ad un disaccoppiamento tra elevato consumo di O2 e scarsa resa energetica, dovuto ad un deficit della fosforilazione ossidativa. Le patologie mitocondriali coinvolgono i tessuti a più elevato consumo di ATP, come cervello, cuore, muscolo; inoltre, possono essere dovute ad alterazioni del DNA mitocondriale o del DNA nucleare Uno dei meccanismi responsabile dell’altissima frequenza con cui una mutazione danneggia il sistema nervoso può essere il fatto che 1/3 del genoma umano è espresso specificamente nello sviluppo del SN; altro meccanismo può Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
essere il fatto che le cellule nervose sono perenni: ad esempio, il gene mutato nelle corea di Huntington, huntingtina, si esprime, pur presente dall’inizio dello sviluppo, solo a 30‐40 anni: quindi, a differenza di cellule ad elevato ricambio, le cui le cellule danneggiate vengono rimpiazzate da cellule sane, nei neuroni, a bassissimo ricambio, ciò non avviene e le mutazioni possono accumularsi producendo il danno e l’espressione fenotipica della malattia. Affezioni metaboliche acquisite che alterano il SNC, il SNP e il muscolo scheletrico • Da alterato metabolismo intermedio: per esempio del glucosio • Disendocrine: per esempio tiroidee • Tossiche: per esempio alcoliche • Carenziali: per esempio da deficit di vitamina E o B12 • Iatrogene: da farmaci, soprattutto antitumorali ed immunosoppressori Malattie dello sviluppo del SN Possono essere: • Malformative: in genere, dovute a disturbi endogeni della citogenesi e della istogenesi nella prima metà della gestazione • Non malformative: in genere, dovute ad agenti esogeni nella seconda metà della gestazione Principi generali di queste malattie sono: • L’anomalie del SN è spesso accompagnata da anomalie di altre strutture (specie organi di senso) • L’anomali presente alla nascita, solitamente, non è evolutiva • Dovrebbero evitarsi alterazioni durante gravidanza e parto • Se l’anomalia è familiare, l’eziologia è probabilmente, ma non necessariamente, genetica • Molte condizioni teratogene provocano aborti spontanei e, pertanto, non sono riconosciute • Il neonato sottopeso è maggiormente esposto ad alterazioni post‐natali dello sviluppo del SN Tra i principali agenti eziologi si ricordano: • Mutazioni genetiche • Aberrazione cromosomiche • Fattori esogeni: virus, radiazioni, tossine, farmaci • Alterazioni circolatorie • Fattori idiopatici nel 60% dei casi Malattie prive di una eziopatogenesi definita Tra esse rientrano, in particolar modo, le malattie degenerative sporadiche, come: • Morbo di Parkinson • Morbo di Alzheiimer • Demenze Fronto‐Temporale • Sclerosi Laterale Amiotrofica (SLA) Queste hanno, solitamente, un correlato genetico, che può aiutare nella comprensione della patogenesi: nella SLA, ad esempio, vi è una mutazione del gene per la superossido‐dismutasi, con conseguente aumento dei ROS e, di conseguenza, della neurotossicità dei motoneuroni; della sinucleina nel Parkinson; dei precursori della beta‐amiloide nell’Alzheimer (la patogenesi potrebbe riconoscere un meccanismo simile alle malattie prioniche, in cui una proteina alterata “contagia” proteine normali, inducendone modifiche conformazionale). Aspetti importanti di queste patologie sono: • Apoptosi: morte cellulare programmata, non lascia traccia e può dar conto dell’atrofia; non sempre è alla base della degenerazione • Degenerazione: consiste in un processo patologico, che porta a distruzione elementi di tessuto con accumulo di prodotti di degradazione non fisiologici e conseguente gliosi (SNC) o fibrosi ( SNP e muscolo); ad esempio, in corso di distrofia muscolare di Duchenne si ha fibrosi e reazione adiposa muscolare, assenti in caso di atrofia da denervazione. Meccanismi alla base di molte malattie degenerative sono stati individuati in: mutazioni, dismetabolismi, tossici, carenze nutrizionali, virus lenti, prioni (tali patologie, quindi, non rientrano Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
in questa sezione); per altre patologie degenerative, i meccanismi eziopatogenetici non sono stati individuati (queste sono quelle che rientrano in questa sezione) Caratteristiche generali delle malattie degenerative sono: esordio insidioso tardivo (un certo periodo di tempo è necessario per l’accumulo del danno: ad esempio, per il manifestarsi del Parkinson, c’è bisogno di una degenerazione dell’80% dei neuroni), decorso progressivo e prolungato, manifestazioni bilaterali, ma in genere asimmetriche , dei deficit funzionali ed anatomici, con coinvolgimento selettivo di sistemi neuronali anatomicamente e fisiologicamente correlati (da ciò derivano le sindromi tipiche; la diagnosi di certezza sarà solo bioptica: caso di Ronald Reagan). Disordini neurologici privi di alterazioni anatomiche Bisogna ricordare come, fino a poco tempo fa, in medicina era presente una distinzione tra patologie organiche e patologie funzionali: le prime, in realtà, non sono altro che patologie con correlati diagnostici definibili (istologici, strumentali, microscopici); le seconde, un tempo, appunto, prive di correlati diagnostici, oggi sono spesso definibili in termini di biologia molecolare (epilessia, emicrania, amnesia globale transitoria, nevrosi, psicosi): molte di queste sono oggi interpretabili come canalopatie (tipiche anche a livello cardiaco), che spesso determinano un’alterazione dell’equilibrio eccitazione‐inibizione. Appendice: le sindromi paraneoplastiche Costituiscono un gruppo di disturbi neurologici in pazienti affetti da neoplasia, anche se il SN non è sede di metastasi e non è interessato direttamente da invasione o compressione da parte del tumore. Il microcitoma polmonare, l’adenocarcinoma della mammella e quello dell’ovaio e la malattia di Hodgkin sono i tumori che più frequentemente si associano a questi distrubi. • Sindrome miastenica di Lambert‐Eaton: è una forma di miastenia spesso associata a microcitoma, ad insorgenza in età adulta. o Quadro clinico: a differenza della miastenia gravis, sono i muscoli del tronco, del cingolo pelvico e scapolare e delle estremità inferiori ad essere colpiti più frequentemente dai deficit di forza e da affaticabilità. In seguito possono svilupparsi ptosi, diplopia, disartria e disfagia. Altri disturbi sono rappresentati da dolori acuti e da alterazioni vegetative (secchezza delle fauci, stipsi, difficoltà della minzione, impotenza). Infine, al contrario della miastenia gravis, la risposta a neostigmina o a piridostigmina, è scarsa o Patogenesi: compromissione del rilascio calcio‐mediato di ACh a genesi autoimmune (autoanticorpi contro i canali del calcio presinaptici): contrariamente alla miastenia gravis l’estensione della superficie recettoriale è aumentata e non sono presenti anticorpi anti‐recettore o Terapia: 3,4 diaminopiridina: blocca i canali del potassio presinaptici, ritardando la ripolarizzazione ed aumentando il tempo di rilascio delle vescicoli di ACh • Polimiosite (vedi lezione Luss) • Degenerazione cerebellare: o Tumori associati: microcitoma, carcinoma mammario od ovarico, linfoma di Hodgkin o Quadro clinico: sintomi cerebellari, talvolta anche sintmi non cerebellari (diplopia, vertigini, segno di Babinski, alterazioni cognitive) o Autoanticorpo (aab) predominante: anti‐cellule di Purkinje (anti‐Yo) • Sindrome opsoclono‐mioclono‐atassia o Tumori associati: generalmente rappresenta una manifestazione del neuroblastoma del bambino, di cancro della mammella o microcitoma nell’adulto. Una caratteristica importante è la sua risposta positiva ad ACTH e corticosteroidi o Aab predominante: anti‐Ri (ab antineuronale 2) È diretto contro un antigene legante l’RNA Si associa a carcinoma mammario, molto raramente a microcitoma, mai a neuroblastoma dell’infanzia • Encefalomieliti Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Tumori associati: microcitoma polmonare, neuroblastoma, carcinoma di prostata, mammella o testicolo (aab anti‐Ma), linfoma di Hodgkin o Quadro clinico: encefalite limbica, encefalite del tronco cerebrale, neuronopatia e neuropatia sensitiva, amiotrofia o Aab predominanti Anti‐Hu (ab antineuronali 1) Anti‐Ma: nel carcinoma prostatico Neuronopatia e neuropatia sensitive subacute Degenerazione retinica Sindrome dell’uomo rigido Corea Neuropatia ottica o
•
•
•
•
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE IV: PROF COTRUFO Metodo Clinico Par I: Introduzione I sintomi ed i segni sono essenziali come spie di patologia del SN e per definire nel loro insieme la diagnosi sindromica: le sindromi neurologiche sono, poi, importanti per definire la sede di disfunzione (in tal senso, il SN è peculiare perché quasi tutte le proprie funzioni, ad eccezioni di quelle associative, sono peculiari di sedi specifiche, a differenza quindi degli altri organi) e del probabile danno anatomico (probabile perché spesso il danno anatomico non è individuabile, come ad esempio in caso di TIA, in cui si assiste solo ad una perdita di funzione, senza alterazioni anatomiche, in caso di CJD, in cui il danno è rilevabile non con le comuni indagini diagnostiche, ma solo microscopicamente, in caso di emicrania o di epilessia): diagnosi di sede (o anatomica o topografica), a cui possono contribuire le analisi per immagini, che integrano la valutazione clinica (fondamentale risulta, pertanto, un corretto esame clinico, a cui successivamente possono essere di supporto le varie analisi, evitando spese superflue ed ingenti al paziente ed alla comunità: ad esempio, in caso di cefalea non è bene ricorrere subito a TC e RM in sospetto di un tumore cerebrale, presente in realtà solo in un numero limitato di casi di cefalea. Inoltre occorre prestare particolare attenzione all’età: difatti, reperti tipici dell’invecchiamento, quali artrosi cervicale, aterosclerosi diffusa o demenza senile, possono erroneamente indirizzare la diagnosi: solo un attento esame clinico può condurre ad una diagnosi esatta, come ad esempio in caso di CJD. Inoltre, in casi come la corea di Huntington o la sclerosi multipla sarebbe più corretto procedere ad un attento esame clinico e, solo in un secondo momento, ad indagini diagnostiche, quali, rispettivamente, indagini genetiche e RM ed esame del liquor). La rivalutazione, poi, di dati anamnestici, quali modalità di esordio e di decorso, l’evidenziazione di disturbi precedenti, concomitanti o successivi, l’insieme dei dati di laboratorio e d’immagini, consentono di definire la diagnosi patologica o di natura (neoplastica, vascolare, infiammatoria, traumatica, degenerativa etc.); l’identificazione della causa di quella patologia conduce, se possibile, alla diagnosi eziologica (un esempio è stato l’AIDS all’inizio della sua diffusione: i medici, ed in particolare i neurologi coinvolti per le connesse problematiche neurologiche, non sapendo di cosa si trattasse, perché appunto l’AIDS non era ancora diffusa, erano tenuti ad un’ attentissima anamnesi, che, condotta più profondamente, poteva evidenziare costumi sessuali particolarmente promiscui, trapianti o trasfusioni non sicure) . La diagnosi funzionale, infine, consente di stabilire il grado di disabilità (parametro oggettivo correlato a deficit specifici, come in caso di difficoltà od incapacità nella deambulazione) e di invalidità conseguente al danno (parametro soggettivo, fortemente influenzato dal lavoro svolto: ad esempio, in caso di afasia, un professore sarà invalido, mentre un muratore può continuare nel proprio lavoro). Quindi, si operano le seguenti e successive diagnosi; • Diagnosi sindromica: si avvale di o Anamnesi raccolta dal paziente, ma anche dai familiare, per inquadrare il problema di cui occuparsi (più produttiva sembra un anamnesi “problem oriented”, che parte, non da una generica anamnesi, familiare, remota etc., ma direttamente, al fine di ottenere un rapporto più diretto e proficuo col paziente, dal motivo che ha indotto il paziente a consultare il medico) o Esame neurologico (è opportuna un’esecuzione dell’esame più generica, che si fa particolare al riscontro di alterazioni di specifiche funzioni, come della motricità o della sensibilità), neuropsicologico (indaga le funzioni cognitive: linguaggio, comportamento, gestualità etc.) e del fondo oculare (con particolare riguardo alla papilla ottica, implicato soprattutto in caso di papilledema), per il rilievo di tutti i segni di disfunzione, in eccesso o in difetto, di SN, sensori ed apparato neuromuscolare • Diagnosi anatomica: solitamente contemporanea alla diagnosi sindromica, si avvale, appunto, della definizione dei principali quadri sindromici, cui consegue una probabile diagnosi di sede: o Sindromi comportamentali: lobo frontale (in questo caso la diagnosi di sede non è molto precisa, ma alquanto generica; il contrario avviene per le sindromi alterne) o Sindromi da deficit cognitivo: corteccia cerebrale o Sindrome da alterata vigilanza: sostanza reticolare ascendente o Sindrome epilettica: sede ben definita, solitamente, in caso di crisi focali Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
o Sindrome da ipertensione endocranica: solitamente diffusa o Sindrome piramidale: dalla corteccia motoria al cono midollare o Sindrome extrapiramidale: gangli della base e substantia nigra o Sindromi somestetiche: dai recettori alla corteccia somatosensoriale o Sindromi sensoriali: dai sensori alle aree sensoriali primarie o Sindromi disendocrine e disturbi del bioritmo: nuclei ipotalamici e loro assoni o Sindromi alterne: tronco encefalico o Sindromi atassiche e dissinergiche: vestibolocerebellum, midollo spinale o Sindromi vertiginose: dall’orecchio interno ai nuclei vestibolari o Sindromi sensitivo‐motorie non craniche: midollo spinale o Sindromi sensitivo‐motorie‐vegetative (smv) del sellino ed arti inferiori: cauda equina o Sindromi smv in dermatomeri e miomeri: radici o plessi nervosi periferici o Sindrome ipostenica, ipotrofica, ipotonica, iporiflessica: unità motoria o Sindrome cefalgica,con rigidità nucale e rachidea: meningi o Sindrome vaso‐vagale, ileo paraltico etc. : SN autonoma o Sindrome nevralgica con dolore senza stimolo: dal nervo periferico al talamo Diagnosi di natura ed eziopatogenetica: non sempre raggiunta la diagnosi eziopatogenetica per mancanza di strumenti diagnosti adeguati e per incompleta conoscenza dei meccanismi eziopatogenetici, riconosce, comunque, come elementi clinici importanti (ad esempio, può farsi una diagnosi di sindrome meningea dovuta a meningite, ma non riscontrarsi l’agente batterico responsabile): o Anamnesi: esordio [iperacuto, acuto (malattie cerebrovascolari, amnesia globale transitoria), subacuto, cronico (tumori)], eventi correlati (fattori contestuali, precedenti, successivi: ad esempio, se un paziente lamenta, accanto alla cefalea, disturbi visivi, quali emianopsia o quadrantopsia, la diagnosi sarà indirizzata verso masse, come adenomi sovrasellari o craniofaringiomi, che comprimono il chiasma ottico o il tratto ottico o la parte immediatamente prechiasmatica del nervo ottico. Inoltre, in caso di paralisi di un arto superiore preceduta da una crisi epilettica focale motoria, la diagnosi sarà indirizzata alla paralisi di Todd, dovuta ad una perdita di energia , cioè di ATP, successiva ad un eccessivo consumo durante la crisi motoria ), decorso [favorevole con remissione completa o parziale, recidivante‐remittente (malattie infiammatorie), ingravescente in modo progressivo (malattie neurodegenerative: malattia di Parkinson o di Alzheimer) o per attacchi] o Analisi di laboratorio su sangue e liquor o biopsie: indici di flogosi (diverse manifestazioni neurologiche sono secondarie a malattie autoimmunitarie, quali LES, sindrome di Sjorgen e vasculiti), analisi ematologiche (un’anemia macrocitica può correlarsi ad una sindrome mielopatia, una leucemia ad alterazioni neurologiche), ematochimiche (funzione renale, epatica, glicemia), immunologiche (alcune manifestazioni neurologiche possono essere correlate a manifestazioni neurologiche quali la gammapatia monoclonale), genetiche, citomorfologiche (analisi delle cellule del liquor, ma anche, in caso di metastasi cerebrale, di altre sedi, alla ricerca del tumore primitivo), marcatori tumorali (anche paraneoplastici,) batteriologiche, virologiche, neuropatologiche (soprattutto post‐mortem per conferma e per ricerca, o diagnostiche per patologie muscolari) o Diagnostica per immagini: TC,RM, angiografia cerebrale e spinale, SPECT,PET o Esami ultrasonorografici (utili soprattutto pe patologie cerebrovascolari): doppler, ecodoppler TSA, doppler transcranico, ecocardiografia, altre ecografie o Indagini neurofisiologiche: EEG (il suo ruolo, pur rimanendo importante in patologie quali epilessia, encefalopatie dismetaboliche e CJD, si è alquanto ridimensionato) , ENMG (esame elettroneuromiografico: serve per esplorare il SNP ed il muscolo scheletrico, quindi le unità periferiche sensitive e l’unità motoria; può discriminare una patologia periferica assonale o mielinica ed evidenziare un ritardo nella trasmissione neuromuscolare, come in caso di miastenia gravis , PESS, PEV, PEM E PEA (potenziali evocativi: somestetici, visivi, motori ed acustici: possono servire a discriminare la sede della lesione, come in caso di patologia piramidale, o a fare diagnosi precoci, come in caso di clinically isolated syndrome, sindrome solitamente evocativa di sclerosi multipla e Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
caratterizzata da un alterazione clinica monospaziale, che però, ad un’analisi con PE, può risultare, come nella SM, multi spaziale), test di stimolazione ripetitiva Diagnosi funzionale Terapia: sintomatica (come in caso di dolore o di cefalee), patogenetica (specie in caso di patologie autoimmunitarie, come SM e poliradicolonevrite di Guillain‐Barrè, dermato‐ o poli‐miositi), eziologica (soprattutto antibiotici), di supporto Prognosi: spontaneamente favorevole, favorevole con terapia, riservata con terapia, sfavorevole quoad valetitudinem o quoad vitam (CJD, traumi al SNC), non ben definibile (SM) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE V PROF COTRUFO Fisiopatologia della vigilanza, della coscienza e del sonno Par I: Vigilanza Definizione La vigilanza corrisponde alla veglia, ossia a quello stato di allerta che sottende alla coscienza: pertanto, la vigilanza è necessaria per la coscienza; tuttavia, non è sufficiente per la coscienza: difatti, si può essere vigili ma non coscienti, come in caso di morbo di Alzheimer avanzato. Disturbi della vigilanza Sono legati ad un’alterazione della sostanza reticolare ascendente (SRA) con conseguente alterazione anche della coscienza (vedi anche dopo). • Obnubilamneto del sensorio: condizione più frequente, è caratterizzato da risposte verbali rare ed imprecise, dovute ad un deficit percettivo ed a distraibilità con disattenzione e disorientamento. Questa condizione è caratteristica di processi che influenzano globalmente il cervello, come in caso di disturbi tossico‐metabolici o di demenza. Comunque, può verificarsi anche in caso di disturbi focali: nelle aree associative destre, nelle aree funzionali sinistre deputate al linguaggio, nelle aree deputate alla memoria o in quelle deputate all’orientamento visuo‐spaziale (vedi dopo). È importante il tipico aumento del grado di confusione durante il giorno con il passare del tempo (“al calar del sole”). • Stato soporoso: denota un’incapacità a mantenere uno stato di vigilanza in assenza di stimolazioni esterne: tuttavia, il paziente è risvegliabile con stimolazioni anche lievi. • Stupor (o stato stuporoso): caratterizza i pazienti risvegliabili solo con stimoli vigorosi e ripetuti: la risposta ai comandi verbali è assente, rallentata o inadeguata; quella ai comandi motori è conservata. In assenza di una stimolazione continua o ripetuta, ricadono rapidamente in questo stato. • Coma: è caratterizzato dall’assenza di risposta a comandi sia verbali che motori (vedi dopo). Per definire il livello di vigilanza ci si può avvalere della scala di Glasgow, che valuta, assegnando un punteggio: • apertura degli occhi o assente: 1 o dopo stimolazione dolorosa: 2 o dopo stimolazione verbale: 3 o spontanea: 4 • risposta motoria: può avvenire a seguito di stimoli verbali o dolorifici [con risposta finalizzata o non finalizzata (decerebrata)] o assente: 1 o estensione (rigidità decerebrata): 2 o flessione anormale (rigidità decorticata): 3 o allontanamento dallo stimolo con movimento di flessione: 4 o localizza lo stimolo doloroso: 5 o esegue ordini: 6 • risposta verbale o assente: 1 o suoni incomprensibili: 2 o parole inappropriate: 3 o conversa, ma è disorientato: 4 o conversa ed è orientato: 5 Dalla somma dei punteggi derivano: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
punteggio 3‐7: lesione grave punteggio 8‐12: lesione di media entità punteggio 13‐15: lesione lieve Par II: Coscienza Definizione La coscienza, invece, ha conosciuto un lungo e non ancora terminato tentativo di definizione. Una prima definizione è quella dello psicologo americano Williams James, secondo il quale “ogni persona sa cos’è la coscienza sino a quando cerca di definirla”: la coscienza, quindi, sarebbe uno stato di consapevolezza di sé e del proprio ambiente; la coscienza di sé comprenderebbe tutti “i sentimenti, le attitudini, le emozioni, gli impulsi, le volontà e gli aspetti attivi del comportamento”, ovvero la pressoché continua consapevolezza di tutte le attività mentali, particolarmente dei processi cognitivi e della loro relazione con ricordi ed esperienze passate. Le successive definizioni hanno avuto il compito di evidenziare l’importanza, oltre che della consapevolezza di sé e del proprio ambiente, della sua reattività (intesa come capacità di elaborare ed attuare una risposta adeguata ) nei confronti dell’ambiente esterno ed interno. Alcuni autori, inoltre, operano una distinzione tra il livello di coscienza, che indica lo stato di vigilanza o il grado di variazione del normale stato di allerta, stimato in base alla mimica, alla fissità dello sguardo ed alla postura corporea (di maggior interesse neurologico, vedi anche sopra) ed il contenuto della coscienza, cioè la qualità e la coerenza del pensiero e del comportamento (di interesse prevalentemente psichiatrico). In definitiva, il normale stato di coscienza è la condizione della persona normale in stato di veglia: il soggetto risponde pienamente al pensiero od alla percezione e manifesta, mediante il proprio comportamento e l’eloquio, la stessa consapevolezza di sé e dell’ambiente dell’esaminatore. Da questa interpretazione ne risulta che numerose funzioni sottendono alla coscienza, in primis la percezione: le vie anatomiche a ciò preposte sono quelle che arrivano al talamo (coscienza protopatica, indifferenziata) e da qui diffondono alla corteccia (coscienza epicritica); in aggiunta vi sono vie cortico‐corticali di associazione (collegano i diversi lobi fra loro: pertanto, pur avendo l’interessamento di un lobo, si può avere un deficit funzionale di altri lobi ad esso collegati) e le vie in arrivo ed in partenza dalla sostanza reticolare ( vedi dopo). In secundis, altre funzioni importanti sono: la memoria della percezione, l’orientamento temporo‐spaziale (da valutare attraverso domande precise, è compromesso già nel primo stadio del coma, ma anche in alcune epilessie temporali: difatti, le vie afferenti al lobo temporale sono fondamentali per l’orientamento), l’attenzione etc. Tali funzioni possono essere valutate tramite EEG: necessario per una corretta esecuzione dell’EEG è che il paziente sia a riposo ed ad occhi chiusi, cioè libero da qualsiasi stimolo esterno; in questo modo, si ottiene una sincronizzazione di corteccia e sostanza reticolare che consente di rilevare il potenziale alfa (l’apertura degli occhi, ad esempio, desincronizza il segnale: ciò, nonostante le modifiche all’EEG, non è ovviamente patologico, ma bisogna prestare attenzione ed evitarlo; inoltre, persone molto ansiose non riescono a raggiungere uno stato di riposo psico‐sensoriale e, quindi, ad esplicitare il potenziale alfa; infine, persone con insufficienza mentale possono avere un EEG normale). In definitiva, l’EEG è l’esame che può più finemente rilevare le modifiche qualitative e quantitative dello stato di coscienza. Disordini della coscienza Vi sono, in primis, disordini della coscienza da alterata percezione, con compromissione della consapevolezza; conseguono a danni delle reti neurali che sottendono alle funzioni cognitive (focali,di aree associative): • rete perisilviana per il linguaggio: una persona affetta da afasia di Wenicke, ad esempio, non comprende il significato delle affermazioni e, pertanto, ha una ridotta coscienza dell’ambiente • rete parieto‐frontale per l’orientamento temporo‐spaziale • rete occipito‐temporale (soprattutto destra) per il riconoscimento di facce ed oggetti: una persona affetta da proposagnosia, ad esempio, ha una ridotta consapevolezza dell’ambiente esterno (“l’uomo che scambiò sua moglie per un cappello”) • rete limbica per la conservazione dei ricordi • rete prefrontale per l’attenzione ed il comportamento. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Questi disturbi possono essere globali, con compromissione di tutte o quasi queste aree, come in caso di morbo di Alzheimer, o focali, con compromissione solo di una o alcune aree, come in caso di infarti, emorragie, tumori o infezioni. In secundis, vi sono alcuni quadri clinici specifici da considerare nella diagnosi dei disturbi della vigilanza e della coscienza. • Coma psicogeno nell’isteria‐ipocondria o nelle psicosi catatoniche: in questo caso, il soggetto è totalmente estraneo all’ambiente e non comunica più, ma è risvegliabile ed, al risveglio, a differenza di persone in coma, affermerà che sentiva e percepiva gli oggetti e le situazioni attorno a lui, ma non riusciva a comunicare e si sentiva male. • Locked‐in syndrome: stato clinico in cui sono scarsi o assenti i disturbi della coscienza, ma vi è solo un’incapacità del paziente di rispondere adeguatamente, dovuto generalmente ad una lesione della porzione basale del ponte per occlusione dell’arteria basilare; questa lesione risparmia sia le vie della sensibilità somatica sia il sistema neuronale ascendente responsabile della vigilanza, così come alcuni raggruppamenti neuronali mesencefalici che consentono il sollevamento delle palpebre (III oculomotore e vie cortico‐mesencefaliche), ma interrompe le vie cortico‐bulbari e cortico‐spinale, privando il paziente della capacità di parlare e di rispondere in qualsiasi modo, eccetto che con lo sguardo di verticalità e con l’ammiccamento; queste persone, infine, data l’incapacità di deglutizione, necessitano di sondino naso‐
gastrico o percutaneo. • Mutismo acinetico: caratterizza un gruppo di pazienti taciturni ed inerti a causa di lesioni bilaterali del lobo frontale (in particolare nelle regioni ventro‐mediali o a livello delle connessioni fronto‐diencefaliche; in modo simile alla lobotomia,ndr) malgrado l’integrità delle vie motorie e sensitive; ciò che manca in questi pazienti è la motivazione psichica o l’impulso verso l’azione (abulia). • Stato vegetativo persistente: di risalto mediatico per il caso Englaro, ed anche noto come coma apallico per l’interessamento corticale (per certi aspetti, è l’inverso della locked‐in syndrome: il paziente può compiere movimenti vari ed incoerenti, pur nella totale incoscienza, cioè nella totale incapacità di relazionarsi con l’ambiente), è solitamente dovuto a traumi cerebrali che risparmiano tronco encefalico e midollo spinale. Ne deriva un quadro caratterizzato da mantenimento, e talvolta esaltazione, dei riflessi spinali e tronco encefalici (chiusura delle palpebre in risposta a stimoli corneali, deglutizione in risposta all’ingestione, iperventilazione in risposta all’aumento di CO2: in realtà nel caso Englaro questi riflesse erano assenti per la concomitante distruzione del tronco encefalico), da una reattività limitata a movimenti posturali primitivi ed a movimenti riflessi degli arti, da alterazioni all’EEG (mancata attività di fondo in seguito a stimolazione). Le più comuni basi anatomopatologiche di questa condizione sono una diffusa lesione cerebrale provocata da trauma cranico chiuso, la necrosi laminare diffusa della corteccia dopo arresto cardiaco e la necrosi talamica dovuta ad una varietà di cause. Più spesso, come accennato sopra, le lesioni sono a carico anche di talamo e nuclei subtalamici (talvolta, il danno talamico rappresenta l’unica causa di “coma vigile”); nei casi traumatici le alterazioni patologiche corrispondono ad una degenerazione diffusa della sostanza bianca sottocorticale (danno assonale diffuso), a prevalente degenerazione talamica ed a danno ischemico corticale. In definitiva, lo stato vegetativo persistente sarebbe una condizione nella quale la corteccia è diffusamente danneggiata o disconnessa ed isolata dal talamo: la disfunzione marcata e diffusa del cervello si riflette nella riduzione estrema del flusso e del metabolismo cerebrali, valutati con RMf e PET. Infine, può rappresentare una fase estrema di malattie degenerative corticali, come la malattia di Alzheimer e quella di Creutzfeld‐Jakob. • Morte cerebrale: può essere definito come: stato di coma nel quale l’encefalo è irreversibilmente danneggiato e non più funzionante, mentre le funzioni polmonari e cardiache possono essere mantenute con mezzi artificiali; completa incapacità di risposta a tutte le modalità di stimolazione, con arresto respiratorio ed assenza di tutte le attività EEG per 24 ore; perdita di qualunque attività del SN. Le considerazioni centrali nella diagnosi di morte cerebrale sono: assenza di funzioni cerebrali, assenza delle funzioni del tronco cerebrale, compresa la respirazione spontanea, ed irreversibilità della condizione Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
(quindi, per l’ultimo criterio, è necessario dimostrare una causa di danno cerebrale irreversibile, come trauma, arresto cardiaco ed emorragia cerebrale, ed escludere una causa reversibile, come l’overdose farmacologica). L’assenza di funzionalità cerebrale viene stabilita in base alla presenza di coma profondo e totale mancanza di movimenti spontanei e di risposte motorie o vocali a stimoli visivi, uditivi e cutanei (i riflessi spinali possono, talvolta, persistere); l’assenza di funzioni del tronco cerebrale può essere accertata sulla base della perdita dei movimenti oculari spontanei, della posizione intermedia degli occhi, della mancanza di risposte alla stimolazione oculo‐cefalica ed oculo‐vestibolare; in definitiva, si ha, solitamente, una totale perdita di risposta agli stimoli, anche ai più violenti. Altre caratteristiche sono: midriasi, paralisi della muscolatura bulbare (nessun movimento facciale o faringeo, corneale o di suzione), assenza di risposte motorie e vegetative agli stimoli dolorosi, mancata capacità di risposta dei centri bulbari ad un’elevata pressione di CO2 (valutabile tramite test di apnea: al raggiungimento di gravi livelli ipossici, inoltre, possono manifestarsi movimenti spontanei drammatici, come il segno di Lazzaro, ossia il brusco sollevamento delle braccia ed il loro incrociarsi su torace e collo), assenza di modificazione del polso all’infusione di atropina. L’EEG fornisce una conferma della morte cerebrale: si avrà un EEG piatto o isoelettrico (silenzio cerebrale), in assenza di potenziali di ampiezza superiore a 2 microV durante una registrazione di 30 minuti. Inoltre, è importante un’accurata diagnosi differenziale, soprattutto per condizioni reversibili come: profonda ipotermia (che porta a perdita di qualsiasi attività del SN: in questo caso, è bene riportare la temperatura corporea oltre i 36,5° C), intossicazione con farmaci sedativo‐ipnotici ed immediatamente dopo un arresto cardiaco. Coma Il coma è la perdita della vigilanza, e quindi della coscienza, per alterazioni della sostanza reticolare ascendente; può essere distinto in più stadi: • Stadio I: paziente obnubilato, in stato soporoso o stuporoso, con alterazioni vegetative, del diametro pupillare, della motilità oculare, della motilità involontaria; quindi, è un paziente con occhi chiusi, che, se stimolato, risponde a tono, non è confuso nel tempo e nello spazio, è solo intorpidito, cioè lento nelle risposte. • Stadio II: totale perdita dello stato di coscienza, compromissione delle funzioni vegetative, miosi, risposta coordinata a stimoli dolorosi, decerebrazione in caso di stimoli molto intensi; quindi, il paziente non apre gli occhi, spesso non risponde a stimoli esterni, risponde a stimoli dolorosi molto intensi (come la spremitura del capezzolo o la forte pressione all’apice del muscolo cucullare), spesso in maniera decerebrata e decorticata (ad esempio, con movimenti in intrarotazione finalistici ed incoerenti: indica che il coma ha coinvolto il mesencefalo, quindi le aree mediali del tronco encefalico) • Stadio III: decerebrazione, cioè deafferentazione corteccia‐subcorteccia, nessuna risposta a stimoli dolorosi molto intensi, compromissione delle funzioni vegetative, come iperpiressia e sudorazione per alterazione dei centri della termoregolazione • Stadio IV: coma depassé (oltre la vita): è caratterizzato da irreversibilità (attenzione a non confonderlo con coma profondo: l’aggettivo indica solo la profondità del coma e non la sua irreversibilità: il coma depassé è un coma profondo, ma un coma profondo può essere reversibile, e quindi non depassé) e da: ariflessia pupillare, apnea, fenomeni di automatismo midollari, assenza bilaterale persistente del riflesso fonomotore, ipertermia maligna Il coma profondo è una condizione paradossa: si ha la sindrome apallica, con funzionalità del solo tronco encefalo, con mantenimento delle funzioni vegetative, e perdita della cosciena; il paziente ha gli occhi aperti e li muove, con possibile lacrimazione, ma queste sono non espressioni emotive, ma vegetative. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Tra i meccanismi eziopatogenetici principali del coma, si ricordano: • Lesioni focali sottotentoriali: la lesione (emorragia o infarto del tegmento ponto‐mesencefalico per occlusione dell’arteria basilare o del cervelletto) è localizzata nel talamo o nel mesencefalo con distruzione o compressione diretta dei neuroni della SRA • Lesioni focali sopratentoriali di tipo espansivo [infarto massivo corticale, edema ischemico, ematoma intracerebrale, tumore intracerebrale (oligodendrocitoma)]: queste lesioni coinvolgono solamente una parte della corteccia e della sostanza bianca, ma provocano una distorsione delle strutture più profonde e comprimono il TE per erniazione centrale od uncale (in senso temporale, con danno prima del III oculomotore e poi della SRA). Quindi, si ha uno spostamento controlaterale e verso il basso delle strutture subtalamiche e della parte superiore del tronco cerebrale, con (sindrome da erniazione uncale‐
paraippocampale) o senza (sindrome da erniazione centrale) erniazione della parte mediale del lobo temporale (uncus, ippocampo) attraverso l’apertura del tentorio. • Sofferenza cerebrale diffusa per: traumi, anossia, intossicazione da CO, ipoglicemia, iperglicemia chetogena (acido acetacetico, acido, beta‐idrossibutirrico, acetone), emorragia subaracnoidea (ESA), infezioni, intossicazioni (coma etilico, farmaci, droghe), ipo‐ od iper‐termia (congelamento o colpo di calore), dismetabolismi (coma epatico, dovuto all’iperazotemia; coma uremico, dovuto probabilmente ad accumulo di tossine dializzabili, costituite forse da derivati fenolici degli aminoacidi aromatici), alterazioni dell’equlibrio idro‐elettrolitico. In questi casi il coma è il risultato di un’interruzione degli impulsi afferenti alla corteccia o di una distruzione estesa e bilaterale dei neuroni corticali; comunque, un ruolo, in molti casi, sembra avere anche il danno talamico. Il coma può essere, pertanto, distinto in: • Coma senza segni neurologici focali o di irritazione meningea, con TC e liquor normali: o Intossicazione alcolica: ipotermia, ipotensione, arrossamento cutaneo, alito “che sa di alcol” o Intossicazione da sedativi (barbiturici, BDZ, antidepressivi): ipotermia, ipotensione o Intossicazione da anestetici generali o Intossicazione da oppioidi: respiro rallentato, cianosi, costrizione pupillare o Intossicazione da CO: cute rosso ciliegia o Ischemia globale‐anossia: rigiidità, postura decerebrata, febbre, crisi epilettiche, mioclonie o Ipoglicemia: come sopra o Iponatriemia o Coma diabetico: segni di deficit del LEC, iperventilazione con respiro di Kussmaul, alito “che sa di frutta” o Uremia: ipertensione, cute asciutta e di colorito olivastro, alito “che sa di urina”, sindrome mio clonico‐convulsiva o Coma epatico: ittero, ascite ed altri segni di ipertensione portale, asterixis o Ipercapnia: papilledema, mioclono diffuso, asterixis o Infezioni gravi (shock settico): ipertermia estrema, respiro frequente o Colpo di calore: come sopra o Crisi epilettiche, stati post‐critici e stati di male epilettico: la scarica neuronale improvvisa ed intensa, ma focale, ha scarsi effetti sulla coscienza sin quando non diffonde da un emisfero all’altro. A questo punto subentra, infatti, il coma perché la diffusione della scarica epilettica alle strutture centrali ne abolisce la funzionalità. Nelle crisi che iniziano con perdita di coscienza, il focus sarebbe, secondo alcuni Autori, diencefalico o Commozione cerebrale: l’improvvisa torsione del cervello, indotta dal colpo alla testa, producendo una rotazione degli emisferi cerebrali sul tronco encefalico, sarebbe la causa dell’immediata perdita di coscienza • Coma senza segni neurologici di lato, con segni di irritazione meningea o Meningite ed encefalite o Emorragia subaracnoidea: respiro stertoso, ipertensione, rigidità nucale, segno di Kernig Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Coma con segni focali o di lato o Emorragia cerebrale: emiplegia, ipertensione, respiro periodico, segni oculari o Occlusione dell’arteria basilare (trombotica od embolica): atteggiamento di estensione e segno di Babinski, assenza precoce delle reazioni oculocefaliche, “ocular bobbing” o Infarto esteso ed edema nel territorio carotideo: emiplegia, pupilla non reattiva o dilatata da un lato o Ematoma sottodurale: respiro lento e ciclico, pressione arteriosa in aumento, emiparesi, pupilla dilatata unilateralmente o Trauma cranico o Ascesso cerebrale o Encefalopatia ipertensiva ed eclampsia o Porpora trombotica trombocitopenia: petecchie, convulsioni, segni focali di spostamento La terapia è, in primis, eziopatogenetica (glucosio per coma ipoglicemico, insulina per coma iperglicemico, ossigeno per coma anossico); tuttavia, non sempre una causa specifica è identificabile e, pertanto, risulta fondamentale la terapia di mantenimento delle funzioni vitali (soprattutto respiratorie e cardiocircolatorie), se necessario e finchè vi siano possibilità di remissione; infine, la terapia sintomatica e delle complicanze (infezioni, tumori) va praticata, ma senza accanimento terapeutico. Par II: Sonno Generalità Il sonno rappresenta una fase di attività cerebrale che si alterna ritmicamente alla veglia, differenziandosi da essa: indispensabile per salute dell’individuo, esso è relativamente indipendente da stimoli esterni, essendo stimoli ambientali intensi capaci di interrompere il sonno, ma non di influire su di esso (cioè di modificare le varie fasi del sonno; comunque, secondo Freud, variazioni di stimoli ambientali, come quelli termici, avrebbero un ruolo nella formazione degli incubi, vedi L’interpretazione dei sogni, ndr). Veglia (vigilanza) e sonno sono regolati da organizzazioni neuronali site nel tronco encefalico (la coscienza, invece, è una funzione corticale): la vigilanza è una funzione di competenza della sostanza reticolare ascendente a sede ponto‐
mesencefalica attivante la corteccia cerebrale ( serve, appunto, a tener sveglio, vigile, il soggetto: una sua distruzione o disfunzione provoca il coma); il sonno, riconducile a due tipi, NREM (non REM) e REM ( rapid eyes movement o paradosso), ha sede, rispettivamente, nei nuclei serotoninergici del rafe mediano e nei nuclei catecolaminergici ponto‐bulbari (vedi basi neuroanatomiche). Il controllo nervoso dei ritmi circadiani risiede nella regione ventrale anteriore dell’ipotalamo, più precisamente nei nuclei sovrachiasmatici: lesioni di questi nuclei provocano una disorganizzazione totale dei ritmi di riposo e di attività, nonché della temperatura e dell’alimentazione. La principale differenza tra sonno e veglia è l’assenza, nel primo, di consapevolezza di sé e dell’ambiente esterno (come detto, il paziente è risvegliabile in base all’intensità dello stimolo ambientale ed alla profondità del sonno; la differenza tra sonno e coma è, appunto, che nel primo si è risvegliabili). Stadi del sonno Il ciclo sonno‐vegli è influenzato dall’età con modifiche sia qualitative (durata del sonno inversamente proporzionale, di solito all’età) che qualitative (soprattutto nella durata delle fasi,vedi dopo) e, soprattutto, dal singolo individuo (buoni dormitori: buon riposo con poche ore di sonno vs scarsi dormitori: buon riposo con molte ore di sonno; comunque, il sonno è molto individuale e non va trascuratala possibili “siesta” pomeridiana). Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Sono stati definiti cinque distinti stadi del sonno, riconducibili a due meccanismi fisiologici di base che si alternano: 1. Fase 1: l’EEG assume un voltaggio progressivamente più basso, con frequenze miste e perdita dell’attività alfa; ciò è associato a movimenti lenti degli occhi; le palpebre si abbassano ed i muscoli si rilassano 2. Fase 2: l’EEG risulta caratterizzato da fusi del sonno (salve di onde di grande ampiezza) e da onde al vertice (onde intermittenti e ripide,lente ed a voltaggio elevato) 3. Fase 3: l’EEG risulta caratterizzato da onde delta di grande ampiezza ed alto voltaggio (onde lente) 4. Fase 4: come la fase 3 5. Sonno REM: si associa ad un’ulteriore riduzione del tono muscolare, ad eccezione della muscolatura extraoculare, con salve di movimenti oculari rapidi a palpebre chiuse; l’EEG si desincronizza, ossia assume un quadro caratterizzato da basso voltaggio ed alta frequenza, simile a quello della veglia (aspetto piatto) Nella prima parte di una tipica notte di sonno, le persone normali passano successivamente attraverso le fasi 1,2,3, e 4 del sonno NREM; dopo circa 90 minuti (70‐100 minuti), passati soprattutto nelle fasi 3 e 4, si verifica il primo episodio REM, in genere annunciato da un aumento transitorio dei movimenti corporei; questo ciclo si ripete da quattro a sei volte durante ogni notte. I cicli successivi al primo presentano una graduale riduzione della fase 4: nell’ultima parte di un normale sonno notturno, il ciclo consiste essenzialmente nell’alternarsi di fase 2 e sonno REM (quindi la durata del sonno REM aumenta col ripetersi dei cicli). Neurofisiologia del sonno I neuroni corticali tendono a scaricare in salve sincronizzate durante il sonno NREM e desincronizzate durante la veglia; nel sonno REM il quadro EEG è anch’esso, generalmente, di tipo asincrono. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Inoltre, la maggior parte dell’attività onirica complessa con componenti visive si svolge nel periodo REM ed i sogni sono generalmente ricordati se il soggetto viene risvegliato in questa fase; comunque, dato che il tempo trascorso in fase NREM è molto più lungo di quello trascorso nella fase REM, una parte importante dell’attività onirica complessiva avviene al di fuori dei periodi REM. Riguardo le funzioni del sonno, la prima e più evidente è quella di riposo, cioè di recupero fisico e psichico; il sonno, tuttavia, non va inteso come un mero recupero funzionale, ma, benché non esistano teorie definitive, assume altre funzioni altrettanto importanti, come la facilitazione della funzione motoria ed il consolidamento dell’apprendimento e della memoria (conservando ciò che è utile e dimenticando ciò che è inutile) al fine, probabilmente, di preparare l’organismo ad accadimenti futuri sulla base delle esperienze passate [ricordando che la maggior parte della funzione onirica avviene nel sonno REM, come testimoniato dall’attivazione selettiva delle aree visive corticali extra‐striatali e delle regioni limbiche‐paralimbiche, con contemporanea riduzione dell’attività nella corteccia visiva primaria e nelle aree associative frontali (che potrebbe spiegare l’accettazione acritica del contenuto visivo bizzarro, dell’alterata relazione temporale e dell’aumento dell’emotività,AV), e che durante il sonno NREM si ha una riduzione del metabolismo del glucosio cerebrale, è ipotizzabile che l’apprendimento mnemonico‐
comportamentale avvenga durante la fase REM ed il riposo durante la fase NREM, ndr]. Riguardo le funzioni dei sogni, invece, si è molto discusso: la teoria attualmente più accreditata riconosce nei sogni una scarica emotiva finalizzata a gratificare, quantomeno parzialmente, istinti e desideri subconsci o repressi, oltre che la funzione, come detto, di apprendimento mnemonico‐comportamentale. Comunque, durante i sogni, che risultano prevalentemente angosciosi (forse nel tentativo di liberare scariche emotive troppo intense per la vita quotidiana, vedi anche dopo) e che sono rapidamente dimenticati al risveglio, prevalgono le allucinazioni visive su quelle uditive (questo perché prevalgono le allucinazioni riferibili ai sensi maggiormente sollecitati nella vita quotidiana: ad esempio, una persona non vedente dalla nascita, non farà sogni visivi), si è atonici e si hanno erezioni indipendenti dai contenuti erotici del sogno (questo è importante nei disturbi dell’erezione: una persona con disturbi che presenta erezioni notturne avrà probabilmente problemi psicogeni, mentre una che non le presenta potrà soffrire di neuropatia autonomica diabetica o di sclerosi multipla); inoltre, impedire di sognare, comporta un incremento di frequenza e durata delle fasi REM al successivo sonno. La deprivazione del sonno comporta la morte negli animali da esperimento, sintomi sgradevoli (non si è ovviamente testato fino alla morte) distinti dagli effetti legati all’insonnia nell’uomo: sonnolenza, fatica ed irritabilità progressivamente più intense , insieme a difficoltà di concentrazione ed a peggioramento dell’attività manuale, fino a disturbi percettivi e difficoltà di orientamento (illusioni ed allucinazioni, specie visive e tattili, fino, in rari casi, ad episodi psicotici). La fase 4 è la più importante per il compenso funzionale del SN e la deprivazione selettiva di essa ( o comunque di sonno NREM) conduce a diminuzione delle reattività ed eccessiva sonnolenza, come in caso di utilizzo di alcuni IMAO (fenelzina) ed a testimonianza del suo ruolo nel recupero fisico e psichico dl SN. Lla deprivazione selettiva di sonno REM conduce, invece, ad iperattività, labilità emotiva e minor capacità di controllo degli impulsi, a testimonianza del suo ruolo nella preparazione e nella elaborazione di risposte emotive e motorie adeguate. Basi neuroanatomiche Alla base della fisiologia del sonno e delle diverse funzioni delle fasi NREM e REM, vi sarebbe una specifica base neuroanatomica e, di conseguenza funzionale, del SNC: • nuclei serotoninergici, situati vicino alla linea mediana del ponte, a livello del rafe • nuclei noradrenergici, concentrati nel locus coeruleus e nei nuclei ad esso correlati nel tegmento centrale del mesencefalo caudale e nelle altre regioni tegmentale ventro‐laterali • nuclei colinergici, siti nel gruppo dei nuclei peduncolo‐pontini e nel gruppo del tegmento dorsale‐laterale. Durante la veglia, sarebbe elevata l’attività dei neuroni aminergici inibitori (NA e ST) con basso livello di attività dei neuroni colinergici; durante il sonno NREM, invece, vi sarebbe un progressivo declino dell’attività inibitoria aminergica con conseguente aumento di quella colinergica; il sonno REM si verificherebbe al termine di questa transizione, cioè con la netta prevalenza di meccanismi colinergici. I circuiti aminergici sarebbero, inoltre, regolati, da nuclei ipotalamici secernenti ipocretina. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Infine, un ruolo importante avrebbero anche nuclei dopaminergici, come testimoniato dalla diminuzione dell’attività onirica e dalla possibili insonnia in pazienti parkinsoniani o in trattamento con dopamino‐bloccanti e dall’aumento di questa attività in pazienti trattati con L‐dopa. Disordini del sonno L’insonnia, intesa letteralmente come l’impossibilità di prendere sonno, è più comunemente intesa come ogni alterazione della durata e della profondità del sonno o della capacità di apportare ristoro tipica del sonno: quindi, l’insonnia può consistere in una difficoltà di addormentarsi o di rimanere addormentati, in un risveglio precoce, o in una combinazione di questi. Si possono riconoscere due tipi di insonnia: primaria, dovuta ad un’alterazione primaria dei normali meccanismi del sonno, e secondaria ad alterazioni psicologiche o mediche; a queste va aggiunta la “pseudoinsonnia”, in cui il paziente dorme bene, ma percepisce come accorciato il proprio periodo di sonno. • insonnia primaria: è una condizione in cui il sonno notturno è disturbato per periodi prolungati e non causata da malattie mediche o psichiatriche: nonostante molti medici abbiano ritenuto questo disturbo più che altro un percezione anomala del sonno, fino a ritenere questi pazienti “ipnoipocondriaci”, nella maggior parte dei casi essi dormono davvero male; l’elevata incidenza di difetti psicologici, in questi casi, potrebbe essere l’effetto, e non la causa, dei disturbi del sonno • L’insonnia secondaria può essere dovuta a o disturbi psichiatrici: nevrosi, ansia, depressione, tossicodipendenze o disturbi medici aspecifici: dolori addominali o vertebrali, ulcera peptica, carcinoma, insufficienza polmonare o cardiovascolare, prostatismo o disturbi medici specifici: insonnia familiare fatale: è una malattia da prioni,vedi lezione specifica sindrome delle gambe senza riposo: il paziente si lamenta di una dolenzia sgradevole e di una sensazione di stiramento a polpacci e cosce: i sintomi sono indotti dal riposo e si ottiene una remissione rapida, ma temporanea, muovendo le gambe; quindi, il paziente non riesce a dormire perché appena si mette a letto cominciano i sintomi altri disturbi neurologici: cefalee a grappolo, morbo di Parkinson, epilessia notturna, tumori e traumi cerebrali alterazioni del ritmo circadiano: jet lag syndrome, lavoratori notturni: possono essere accompagnate da sonnolenza diurna Le ipersonnie sono, invece, caratterizzate da un aumento della durata del sonno e, tra le principali, si ricordano: • Sindrome da sonnolenza diurna eccessiva: spesso è compensatoria ad una insonnia notturna, come in caso di pazienti depressi, o secondaria a: o farmaci (sedativi, tranquillanti, anticonvulsivanti, antidepressivi, beta‐bloccanti, atropinici, L‐dopa, agonisti DA), sostanze stupefacenti, alcol o malattie mononucleosiche e simil‐mononucleosiche, incluse tutte le infezioni respiratorie e gastro‐
intestinali o stati post‐chirurgici e post‐anestetici o malattie neurologiche croniche (SM, demenze) o alterazioni metaboliche (ipotiroidismo, malattia di Addison, diabete grave) o malattie encefaliche (encefaliti virali, tripanosomiasi, encefalite letargiche) o malattie ipotalamiche (sindrome di Kleine‐Levin, tumore o granuloma ipotalamico) • Sindrome delle apnee nel sonno (sono considerate patologiche apnee di durata maggiore di 10 secondi): o Centrale: è dovuta a disregolazione bulbare del respiro [poliomielite bulbare, infarto bulbare laterale, encefalite del tronco cerebrale, esiti di interventi chirurgici, MCJ, sindrome da ipoventilazione bulbare (o “maledizione di Onida”)] e caratterizzata da un aumento della superficialità del sonno con concomitante sonnolenza diurna o Periferica o di tipo ostruttivo: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Obesità: tipica dei grandi russatori, che spesso dormono supini e sono obesi protrusione della lingua sull’epiglottide malattie neuromuscolari che determinano un indebolimento della muscolatura faringea posteriore: malattie del motoneurone ipertrofia adeno‐tonsillare nei bambini Sindrome di Pickwick: molto simile alla precedente e tipica dei grandi obesi, è caratterizzata da continui addormentamenti diurni, cefalee mattutine, deficit dell’attenzione e dell’impegno scolastico o lavorativo, e, nei casi gravi, ipertensione arteriosa polmonare o sistemica fino al cuore polmonare cronico, policitemia (faccia rossa: come nel ragazzo descritto da Dickens nel “Circolo Pickwick”, da cui il nome, ndr) Narcolessia con o senza cataplessia (s. di Gelinau): questa sindrome è dovuta ad una disfunzione della sostanza reticolare ascendente, con perdita della vigilanza ed ipersonnia, con o senza alterazione di quella discendente: nel primo caso si avrà perdita del tono muscolare con continue cadute. Sembra dovuta a deficit del neurotrasmettitore ipotalamico ipocretina. Ipersonnia idiopatica: i pazienti hanno bisogno, per motivi non ancora chiariti, di continui cicli di sonno nelle 24 ore Sindrome di Kleine‐Levin: è una patologia ipotalamica, caratterizzata, oltre che da ipersonnia (fino a 18 ore al giorno), da disturbi dell’alimentazione (iperfagia), del comportamento (rifiuto sociale, negativismo, rallentamento ideativo, disattenzione e disturbi della memoria) e sessuali (ipersessualità), con tendenza alla regressione spontanea Le parasonnie, infine, sono condizioni caratterizzate dall’esclusiva manifestazione durante il sonno: • Terrore notturno ed incubi: il terrore notturno è più frequente nei bambini e spesso accompagnato da sonnambulismo, non è ricordato al mattina né associato a disturbi psicologici e solitamente regredisce durante l’adolescenza; la sua persistenza durante la vita adulte è, invece, associata a disturbi psicologici. Gli incubi, più frequenti del terrore notturno, sono di eguale frequenza tra bambini ed adulti e tipici del sonno REM (ancor più frequento durante periodi di sonno REM rebound, come in seguito alla sospensione di alcool o farmaci sedativo‐ipnotici cha abbiano cronicamente soppresso la componente REM; sono solitamente ricordati al mattino e possono essere secondari a farmaci (prima assunzione di beta‐bloccanti o L‐dopa), cefalea o disturbi psichiatrici • Sonnambulismo: più frequente nel bambino ed associato spesso a fenomeni di enuresi notturna e terrore notturno, è caratterizzato da comportamento motorio del paziente e dalla sua capacità di entrare in contatto con l’ambiente esterno durante il sonno; frequentemente il paziente non fa altro che sedersi sul letto, ma spesso cammina per casa, compie gesti abituali od anche aggressivi ( rari nei bambini, più frequenti negli adulti). I sonnambuli hanno gli occhi aperti, ma non rispondono alle domande e compiono atti stravaganti o borbottano in maniera incomprensibile; al mattino il paziente, generalmente, non ricorda l’episodio. Il sonnambulismo si verifica quasi esclusivamente durante la fase 4 del sonno NREM e, quindi, durante il primo terzo della notte, quando tale fase è più frequente. Nel bambino, non compromette una buona qualità del sonno e regredisce con l’adolescenza; nell’adulto è, invece, spesso associato ad intossicazioni farmacologiche (farmaci psicotropi e sedativi assunti prima di coricarsi) od a disturbi psichiatrici. • Disturbo comportamentale durante il sonno REM: più frequente in maschi anziani, privi di anamnesi positiva per sonnambulismo, è caratterizzato da violenti e spesso pericolosi attacchi di attività motoria, accompagnati da sogni molto vividi, solitamente angosciosi e ben ricordati al mattino, ed eloquio alterato con grida, che si verificano esclusivamente durante la fase REM • Clonie dell’addormentamento (mioclonie ipniche): al sopraggiungere del sonno, alcuni centri motori possono eccitarsi e generare una scarica di attività incontrollata: il risultato è una clonia del corpo che sveglia il paziente. Sono tipiche di pazienti in condizioni di ansia e tensione • Parossismi sensitivi: i centri sensitivi possono essere analogamente interessati, in maniera isolata o associata all’interessamento mototio; il paziente, comunque, avverte di essere svegliato da “una strana sensazione che gli attraversa il corpo”, da un improvviso lampo di luce o da un fragore dirompente. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Distonia parossistica notturna: è caratterizzata da salve parossistiche di movimenti coreoatetosici, balistici o distonici durante il sonno NREM; in una certa percentuale di casi, può essere espressione di crisi epilettiche frontali. Paralisi ipnica: è caratterizzata da paralisi nel momento tra sonno e veglia, reversibile anche con il più piccolo stimolo e legata a varie ipersonnie (apnee,sindrome di Pickwick, narcolessia) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ VI PROF COTRUFO Encefaloneuromiopatie tossiche e dismetaboliche Par I: Introduzione Generalità Una parte importante e di frequente osservazione della neurologia è rappresentata da numerose affezioni, nelle quali l’alterazione della funzione cerebrale (encefalopatia), del SNP (neuropatie) o dei muscoli (miopatie), è dovuta allo scompenso di un altro organo: il cuore (o il sistema cardiovascolare), i polmoni (o il sistema respiratorio), i reni, il fegato, il pancreas e le ghiandole endocrine. Concetti importanti sono: • Causano disturbi aspecifici (cioè non patognomonici) del comportamento in relazione alla vita precedente del paziente • Inducono disfunzione di varia gravità della sostanza reticolare ascendente attivante, quindi con alterazione della vigilanza e dello stato di coscienza: il ritmo sonno‐veglia si modifica, con tendenza all’addormentamento o incapacità a raggiungere il sonno profondo • Si hanno alterazioni di vario grado della corteccia cerebrale, quindi con alterazione dei contenuti della coscienza, solitamente con stato demenziale remittente‐recidivante o disturbo della coscienza instabile: questo quadro è dovuto ad alterazioni diffuse, non focali, della corteccia (differenza con Alzheimer: in cui questi disturbi non si accompagnano ad alterazioni dello stato di veglia) • Inoltre, causano altri disturbi del SN, spesso sia inibitori che eccitatori: ad esempio, possono aversi diminuzione dei riflessi e crisi epilettiche insieme • Le disfunzioni causate sono generalmente reversibili ed entro certi limiti di gravità: solitamente il disturbo non è acuto, ma di lunga durata, e la presentazione più tipica è quella di un paziente che rimane per giorni o settimane in uno stato confusionale • È importante una diagnosi precoce per una pronta terapia dello squilibrio metabolico o per l’eliminazione del tossico, con prevenzione dei danni nervosi. • Sono instabili, potendo recidivare e rimettere in relazione a fattori precipitanti: un concetto molto importante è l’indipendenza della recidiva dalla patologia di base. Cioè si possono avere recidive, ricadute o peggioramenti della patologia di base, con condizione clinica di base stabile: ad esempio, in caso di encefalopatia epatica, può aversi un peggioramento della sintomatologia cerebrale, dovuto all’aumento delle tossine cerebrali, in assenza di un corrispondente peggioramento clinico o laboratoristico (transaminasi) dell’epatopatia • Esiste un fattore soglia che varia con le ricadute dell’encefalopatia: anche questo concetto è molto importante: concentrazioni di tossine, in particolare di ammoniaca, all’inizio non tossiche per il cervello, col protrarsi della patologia di base, pur rimanendo stabili, possono risultare tossiche per un meccanismo di sensibilizzazione cerebrale. Inoltre, più passa il tempo, più il danno sarà meno facilmente irreversibile. Pertanto, il consiglio è occuparsi al più presto dell’eventuale encefalopatia associata alla malattia di base Aspetti clinici e diagnostici I dati clinici, come detto, non sono patognomonici, ma utili per sospettare la malattia: • Neurologici o Alterazioni del ritmo sonno‐veglia o Disturbi del comportamento o Deficit cognitivi un po’ più specifici: nelle encefalopatie minime, cioè in quelle da diagnosticare precocemente, è importante l’esame delle funzioni cognitive specifiche. Questi pazienti, infatti, tendono ad avere disturbi della memoria selettivi e disturbi dell’abilità di processare le informazioni: ad esempio, nell’alcolista vi è un’incapacità di memorizzazione di una sequenza e di svolgere dei calcoli o Disturbi della coscienza: dal delirio al coma, cioè alla perdita di coscienza e di funzioni relazionali del SN Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Neuro‐oftalmologici: il riflesso fotomotore ed oculovestibolare sono conservati anche in caso di compromissione della coscienza fino al coma. Questo accade in tutte le encefalopatie tossico‐
dismetaboliche, eccetto quella ipossiemica: infatti, questa, similmente ad un’ipossiemia, diminuisce la capacità di produzione di ATP L’esame neurologico, in questi casi: • È indicativo di patologia diffusa: segni focali sono generalmente assenti e, se presenti, indicano altra patologia. Ad esempio, nell’epatopatico, disturbi focali sono imputabili ad un’emorragia focale cerebri, imputabile ad un deficit dei fattori della coagulazione. È l’insieme delle alterazioni aspecifiche a far sorgere il sospetto di encefalopatia tossico‐metabolica • È utile per la valutazione della gravità, e di conseguenza della prognosi: valuta soprattutto lo stato di coscienza, dalla confusione, meno grave, al coma, più grave • Può rilevare o Disturbi del tono muscolare o Stato di prostrazione o Cefalea o Tremori o Flapping: il flapping tremor della dita è detto anche asterixis: ha alla base un disturbo del tono muscolare, per cui le persone tendono a cadere, risultando incapaci di mantenere la postura o Crampi o Mioclonie • Rileva frequentemente crisi epilettiche (non come episodio singolo, ma associate alle suddette alterazioni neurologiche aspecifiche): o Generalizzate Intossicazione da acqua Ipossia Uremia Ipoglicemia o Parziali continue: iperglicemia o Miocloniche multifocali: Ipossia Uremia Importante è poi lo studio EEG, non specifico, ma utile per la diagnosi e, soprattutto, per la prognosi: l’EEG dà una misura semiquantitativa del danno: • Alterazioni EEG si osservano regolarmente e consentono di differenziare queste encefalopatie dai disturbi psicogeni della coscienza e del comportamento • Si va dal rallentamento del ritmo alfa, al theta, al delta di basso voltaggio, alla inattivazione elettrica • Caratteristici sono i gruppi di onde delta lente generalizzate, più ampie nelle regioni frontali, di aspetto trifasico • È molto utile in caso di crisi epilettiche Altri strumenti diagnostici sono: • Test neuropsicologici: molto utili, specie nelle encefalopatie minime, mostrando deficit dell’attenzione, della concentrazione e della percezione visuo‐spaziale • PEV e PEA nelle encefalopatie minime • Imaging: utile soprattutto per escludere altre patologie, come emorragie per disturbi della coagulazione nel cirrotico, ma anche per documentare l’eventuale edema cerebrale, come negli squilibri idro‐elettrolitici (iponatremia) o nelle encefalopatie ipossiche ed ipercapniche (in questi casi l’edema è citotossico: in caso dell’iponatremia per l’ipo‐osmolarità del sangue, con passaggio osmotico di liquidi dal sangue alle cellule. In caso di ipossia o ipercapnia, le cellule nervose perdono la capacità di utilizzare la pompa Na/K, alterando Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
l’osmolarità intracellulare, che risulta aumentata per l’aumento di Na: ne consegue un passaggio di acqua all’interno della cellula per osmosi), e per documentare la mielinolisi centrale del ponte nella correzione troppo rapida delle iponatremie (in questi casi, il brusco aumento ematico di sodio causa una brusca uscita di acqua dai neuroni, portandoli appunto alla demielinizzazione, in particolare nella zona del ponte, e quindi dei fasci piramidale, spinotalamico, blubotalamico etc.). Principali encefalopatie tossiche e dismetaboliche • Tossiche o Epatica: la diagnosi, oltre che sulla clinica, si basa sulla valutazione delle transaminasi sieriche: queste, da un lato, informano soprattutto sulla natura della patologia, cirrotica o da shunt porto‐
sistemico; dall’altro, come visto, possono comunque non correlare con la clinica o Renale (anche chiamata uremica, ma questo termine è incorretto poiché non è dimostrato che sia l’urea a causare il danno. Infatti, infondendo urea e creatinina ad un animale da esperimento, questo non si ammala di encefalopatia): è importante notare come le sostanze nefrotossiche, e sospette tossiche anche per il cervello, quali creatinina, azoto uremico ed altre sostanze a basso PM (acidi organici, fosfati), sono dializzabili. Quindi, la dialisi dovrebbe migliorare anche l’encefalopatia. Comunque, ogni malattia renale grave, acuta o cronica, può essere accompagnata da stato confusionale episodico, stadio stuporoso ed altri sintomi neurologici, sempre associati ad ipertensione arteriosa. I sintomi iniziali sono solitamente costituiti da apatia, affaticamento, mancanza di attenzione ed irritabilità; successivamente si osservano stato confusionale, turbe della percezione sensitiva, allucinazioni, disartria, tremore, asterixis. In caso di IRA l’ottundimento del sensorio è sempre associato a vari fenomeni motori (scosse, mioclonie, crisi epilettiche: sindrome mioclono‐convulsiva uremica). Negli stadi finali il paziente cade in un leggero stato di coma: se permane l’acidosi metabolica, compare respiro di Kussmaul, sostituito poi dal respiro di Cheyne‐
Stokes o Ipercapnica: la CO2, oltre a diminuire il pH e quindi a causare danni da acidosi, determina aumento del flusso cerebrale, con vasodilatazione e conseguente edema • Dismetaboliche o Da alterato metabolismo glucidico Ipoglicemica: si ha soprattutto in caso di errore nella valutazione comparativa della terapia insulinica rispetto alla dieta. La patogenesi è riconducibile ad un’alterazione del metabolismo, da carenza di glucosio, con riduzione della produzione di ATP ed edema citotossico (vedi sopra). Il fattore più importante nel danno da ipoglicemia è il tempo, ma anche la suscettibilità individuale gioca un ruolo (ad esempio, nella distrofia miotonica, la spiccata insulino‐resistenza consente al paziente di svolgere le normali attività quotidiane con una glicemia di 20 mg/dL!) Iperglicemia: per l’osmosi, tende a disidratare le cellule nervose o Da alterato euilibrio idro‐elettrolitico: iponatremia (soprattutto da diabete insipido, per la patogenesi vedi sopra). La terapia è con ADH, con lenta infusione di Na o Da ipossiemia: l’ipossiemia determina una riduzione della sintesi di neurotrasmettitore indipendente dalla sintesi di ATP. Ad esempio l’ACh è sintetizzata a partire dalla colina e dall’acetil‐
CoA, intermedio della glicolisi anerobia precedente il ciclo di Krebs: un aumentato catabolismo di questo intermedio, finalizzato a compensare attraverso la via anaerobica la diminuita capacità di sintetizzare, per la carenza di ossigeno, ATP tramite la via ossidativa aerobica, determina inizialmente una diminuzione di ACh con livelli di ATP compensati, e quindi normali. Considerazioni simili possono farsi per la sintesi delle monoamine, che richiede ossigeno. In definitiva, l’encefalopatia ipossiemica risulta correlata, non solo al deficit di ATP, ma anche, e più precocemente, ad un deficit di neurotrasmettitori. • Carenziali Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Deficit di tiamina (B1): causa la sindrome di Wernicke‐Korsakoff, frequente negli alcolisti (vedi dopo). La terapia prevede oltre alla tiamina, anche l’infusione di glucosio, per compensare l’ipoglicemia dovuta alla riduzione dell’alfa‐chetoglutarato (la tiamina, infatti, è un cofattore della reazione di produzione dell’alfa‐chetoglutarato), e di potassio o Deficit di piridossina (B6): la vitamina B6 è importante per il metabolismo del piridossalfosfato o Deficit di cobalamina (B12): causa patologia dei nervi periferici più che demenza o Deficit di tocoferolo (vitamina E): la sua carenza, specie nelle forme genetiche, causa atassia cerebellare Da tossici esogeni e medicamenti o Tossici esogeni non voluttuari: Metalli pesanti: piombo, mercurio, arsenico, tallio, manganese Composti organici: idrocarburi, derivati alogenati, organo fosfati, alcoli CO o Tossici esogeni voluttuari: alcol etilico, cocaina o Medicamenti: acido valproico, anticolinesterasici, anticolinergici, antidepressivi, barbiturici, baclofen, BDZ, carbamazepina, L‐DOPA e dopamino‐agonisti, neurolettici, fenitoina, morfinici, disulfiram, amfetamine, corticosteroidi, betabloccanti, digossina, teofillina, cimetidina, litio, metotrexato. In realtà tutti i farmaci sono potenzialmente encefalotossici o
•
Par II: Encefalopatia epatica Generalità Rappresenta la causa maggiore di morbilità e di mortalità nei pazienti epatopatici: pertanto, per un netto miglioramento della prognosi, occorre un pronto ed adeguato intervento per correggere l’encefalopatia. Riconosce due meccanismi, isolati o associati: • l’insufficienza epato‐cellulare: è caratteristica dell’epatite fulminante acuta, che si manifesta con aumento drammatico ed improvviso delle transaminasi • lo shunt porto‐cavale: anastomosi chirurgica o malformativa • associazione: cirrosi epatica Tipico è il decorso con recrudescenze e remissioni: si sviluppa poi una ipersensibilità alle neurotossine, con recrudescenze sempre più frequenti ed indipendenti dall’epatopatia. Fattori precipitanti, molto importanti nel causare encefalopatia, sono: • Iatrogeni (per lo più sedativi, 25%): le BDZ hanno un meccanismo d’azione sinergico sui recettori GABAergici e quindi possono peggiorare il quadro, aumentando la confusione, la sonnolenza, lo stato crepuscolare. È importante sottolineare che le BDZ provocano questi effetti non solo se somministrate come farmaci, ma anche se assunte con una dieta regolare (ad esempio tramite le patate) per un ridotto metabolismo epatico. In aggiunta, vi sono dei composti BDZ‐simili endogeni, con un ruolo di ansiosi fisiologica: un loro ridotto catabolismo per insufficienza epatica aumenta, come detto, gli effetti encefalici. • Emorragie gastro‐intestinali (20%): il cirrotico è normalmente predisposto a queste emorragie, sia per l’aumento della pressione portale, con conseguenti varici esofagee, sia per la ridotta sintesi dei fattori coagulativi (con diminuzione del tempo di protrombina). Il meccanismo alla base dell’encefalopatia è simile,in questo caso, all’assunzione di un pasto iperproteico: infatti, il sangue riversato nell’esofago e digerito è ricco di ammonio. • Iperazotemie (15%): non infrequentemente i cirrotici diventano anche insufficienti renali • Eccessi proteici nella dieta (10%) • Altro: costipazione, infezioni, riduzione di vitamina K, etc (30%) Diagnosi • Dati di laboratorio: aumento di bilirubina, transaminasi, ammoniaca (è l’analisi più importante. Bisogna prestare particolare attenzione durante un prelievo, data la volatilità dell’ammoniaca), tempo di protrombina Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
EEG: per la diagnosi, ma anche per la prognosi, determinando il grado dell’encefalopatia RM: iperintensità in T1 del pallido. Serve piuttosto ad escludere altri meccanismi alla base Test neuropsicologici: soprattutto per le encefalopatie minime, caratterizzate da riduzione dell’attenzione, concentrazione e percezione visuo‐spaziale, anche in assenza di chiari segni di encefalopatia, specie nell’alcolista (che può andare incontro a demenza alcolica di tipo Wernicke‐Korsakoff, irreversibile). Sono remissibili con la terapia PEV e PEA alterati: la componente P300 dei PEV e dei PEA è particolarmente importante nelle encefalopatie minime, in assenza di evidenze cliniche Patogenesi L’ipotesi più probabile mette il coma epatico in rapporto con un’alterazione del metabolismo dell’azoto, in cui l’ammoniaca (NH3), che si forma nell’intestino per azione di alcuni microrganismi, dotati di ureasi, dalle proteine della dieta e viene trasportata al fegato per mezzo della circolazione portale, non verrebbe convertita in urea a causa della malattia epatocellulare, della formazione di uno shunt porto‐sistemico o di entrambi. Di conseguenza, quantità eccessive di ammoniaca raggiungono il cervello, determinando ipertrofia degli astrociti, proliferazione di mitocondri e reticolo endoplasmatico ed aumento dell’attività glutammico‐deidrogenasico: queste alterazioni rifletterebbero l’elevata attività metabolica associata alla detossificazione dell’ammoniaca (la rimozione dell’ammoniaca dipende, infatti, dalla formazione di glutammina attraverso una reazione catalizzata dall’enzima ATP‐
dipendente glutammina‐sintetasi, localizzato negli astrociti). Correlati fisiopatologici dell’aumento di ammoniaca cerebrale sono. • Diminuzione del FEC e del metabolismo intracellulare di glucosio, soprattutto in caso di encefalopatia grave • La riduzione di flusso nel giro cingolato è responsabile della riduzione dell’attenzione • Il flusso nella corteccia visiva associativa, invece, aumenta nei casi con minima compromissione neuropsicologica • L’iperammonemia, come detto, provoca un’ipertrofia‐iperplasia degli astrociti protoplasmatici, dato fondamentale del cirrotico encefalopatico: ne consegue un’alterazione della BEE, con rottura ed ulteriore ingresso di ammoniaca. Quindi, il dato neuropatologico fondamentale è l’ipertrofia prima e l’iperplasia poi degli atrociti protoplasmatici (tipo II di Alzheimer); presumibilmente le modificazioni astrocitarie influenzano l’attività sinaptica dei neuroni. Quindi, il quadro neuropatologico risulta caratterizzato da proliferazione delle cellule di Alzheimer II associata a gliosi nella corteccia, necrosi laminare neuronale, atrofia dei nuclei lenticolari e micro cavitazioni della giunzione corteccia‐sostanza bianca, dei nuclei della base e della sostanza bianca cerebellare • Aumento del pH • Aumento della trasmissione GABAergica (anche per potenziamento delle BDZ esogene ed endogene per ridotto catabolismo, vedi dietro) • Aumento degli acidi grassi a catena corta: dei mercaptani o alcoli solfonati (metanethiol, cioè metilmercaptano, prodotto solfonato del metabolismo della metionina), nel sangue e nell’aria espirata Terapia • Obiettivi: è solitamente efficace o Identificare e trattare i pazienti con encefalopatia minima o Prevenire la progressione, identificando precocemente e curando o evitando fattori precipitanti (vedi sopra): in questo modo si tenta di evitare l’ipersensibilizzazione delle cellule cerebrali alle neurotossine • Metodi o Restrizione del contenuto proteico della dieta o Riduzione della flora enterica mediante somministrazione orale di neomicina o kanamicina, che sopprimono i batteri produttori di ureasi a livello intestinale o Utilizzo di clisteri Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Lattulosio, zucchero inerte che acidifica il contenuto del colon e riduce notevolmente l’attività batterica o Trapianto in caso di insufficienza epatica non trattabile o Chetoanaloghi degli acidi essenziali (valina,leucina, isoleucina): fonte di amminoacidi essenziali privi di azoto, di cui l’epatopatico è spesso carente per ridotta produzione o Bromocriptina: aumenta la trasmissione dopaminergica Complicanze o Degenerazione epato‐cerebrale non wilsoniana (quella wilsoniana è correlata alla carenza o assenza della ceruloplasmina, con conseguente ridotto catabolismo del rame e suo accumulo soprattutto nel fegato e nel cervello. In caso di trapianto epatico la patologia cerebrale, per il miglioramento del metabolismo epatico del rame, reverte) o Mielopatia epatica: degenerazione del midollo spinale nel cirrotico Prognosi: o mortalità dell’80‐85% in pazienti in coma profondo o migliora in caso di prevenzione dell’ipersensibilizzazione o
•
•
Par III: Alcol ed alcolismo Generalità L’alcol, in moderata quantità, può avere effetti positivi sulla salute, riducendo il rischio di infarti del miocardio e cerebrali, di calcolosi biliare, di demenza vascolare e forse di malattia di Alzheimer. L’alcolismo è,invece, il risultato di abuso e dipendenza, che riducono l’aspettativa di vita di 10 anni per gli effetti nocivi su SN, fegato, pancreas, apparato cardio‐circolatorio e gastro‐enterico. L’abuso di alcol in gravidanza, inoltre, può causare gravi danni al fegato. L’etanolo ha diversi effetti nutrizionali: • ha un elevato potere calorico (7kcal/g), ma è privo di sostanza nutritive quali proteine, vitamine, sali minerali • riduce l’assorbimento e l’immagazzinamento di vitamine quali acido folico, piridossina (B6), tiamina (B1), niacina (B3), vitamina A Possono aversi: • tolleranza farmacocinetica: aumento del metabolismo epatico dell’etanolo • tolleranza farmacodinamica: modificazioni neurochimiche • tolleranza comportamentale: ridotti effetti quantitativi sulle funzioni cerebrali • dipendenza: bisogno di etanolo per il miglior funzionamento del cervello Il metabolismo dell’alcol avviene: • attraverso il MEOS (sistema di ossidazione etanolica microsomiale): 20% • attraverso l’alcol deidrogenasi con formazione di acetaldeide: 80%. L’acetaldeide, più tossica dell’etanolo, è metabolizzata in: o acetil‐CoA: partecipa alla formazione di acidi grassi o acetato: entra nel ciclo dell’acido citrico, producendo alla fine anidride carbonica ed acqua Effetti dell’etanolo Possono variare in base alla concentrazione ematica (in mg/dL): • 20: disinibizione, leggera sensazione di intossicazione • 80: riduzione delle funzioni cognitive complesse e della motricità • 200: eloquio nettamente confuso, incoordinazione motoria, irritabilità e scarsa capacità di giudizio • 300: coma lieve e segni vitali depressi • 400: morte Conseguenze cliniche sono: • Intossicazione da alcol Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Ubriachezza: consiste in gradi variabili di allegria ed eccitazione, perdita di controllo, irregolarità del comportamento, loquacità e parola disartria, incoordinazione dei movimenti e dell’andatura, irritabilità, sonnolenza, fino allo stupor ed al coma negli stadi più avanzati o Black‐out mnestico: consiste in episodi circoscritti e transitori che sopraggiungono in una fase di intossicazione grave e di cui il paziente, una volta ritornato sobria, non ha più memoria o Intossicazione patologica: l’alcol ha un effetto prevalentemente eccitatorio, risultando in un comportamento caratterizzato da una furia cieca con comportamento aggressivo e distruttivo, che spesso esita in una sonnolenza profonda Disturbi del sonno Malattie nutrizionali o Sindrome di Wernicke‐Korsakoff o Polineuropatia o Neuropatia ottica (ambliopia “alcol‐tabagica”) o pellagra Malattie a patogenesi incerta o Degenerazione cerebellare o Mielinolisi pontina centrale o Demenza alcolica o Atrofia cerebrale Psicosi alcolica Sindrome da astinenza: o Tremori: la manifestazione più comune è quella caratterizzata da tremore generalizzato, associato ad irritabilità generale, tachicardia, anoressia, nausea e vomito o Allucinazioni: soprattutto visive ed uditive o Convulsioni da astinenza (“rum fits”) o Iperattività vegetativa e psicomotoria o Delirium tremens: è caratterizzato da un profondo stato confusionale, deliri, allucinazioni, tremore, agitazione ed insonnia, con associati segni di iperattività vegetativa, cioè pupille midriatiche, febbre, tachicardia e sudorazione profusa. È in sostanza la sindrome da astinenza completa Disturbi neurologici conseguenti a cirrosi o Stato stuporoso e coma epatico o Degenerazione cronica epato‐cellulare o
•
•
•
•
•
•
Trattamento • Intossicazione acuta: cura dei parametri vitali (soprattutto cardiorespiratori e del coma) e dismetabolici + neurolettici (diazepam, aloperidolo) • Sindrome da astinenza: o Cura delle disfunzioni di organi e dei dismetabolismi o Vitamine B o Neurolettici (lorazepam, fenobarbital) ed antiepilettici • Riabilitazione presso strutture idonee Sindrome di Wernicke‐Korsakoff È un disturbo neuropsichiatrico causata da un deficit di tiamina, che si sviluppa spesso in età adulta, in soggetti alcolisti. Si presenta come triade sintomatologica caratterizzata da: alterazione dello stato di coscienza, atassia ed oftalmoplegia, con evoluzione verso una psicosi amnesica confabulatoria. Giunta nei neuroni e nelle cellule gliali, la tiamina agisce da coenzima nel metabolismo glucidico, lipidico e proteico, nella regolazione della trasmissione colinergica e serotoninergica e nella formazione di alcuni trasmettitori. • Fattori che causano il deficit o Congeniti: predispongono allo sviluppo della sindrome Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Acquisiti Malnutrizione associata ad alcolismo cronico Procedure chirurgiche che determinano scarso assorbimento intestinale dell’aminoacido: gastrectomia,gastrodigiunostomia Disturbi GI che provocano diarrea e vomito cronico: ulcera peptica Tumori in trattamento chemioterapico Malattie sistemiche: AIDS, tireotossicosi Patogenesi: il deficit di tiamina porta a lesioni cerebrali dapprima a livello delle cellule gliali e poi dei neuroni, a causa di un’alterazione del ciclo dell’acido tricarbossilico, con diminuita produzione di ATP ed edema citotossico. In seguito, a livello delle cellule endoteliali, per l’alterazione della transchetolasi, si iperproduce NO con alterazione della BEE con edema vaso genico. Il persistere del deficit provoca lesioni necrotiche irreversibili a carico di corpi mammillari, talamo mediale, sostanza reticolare, collicoli superiori ed altre strutture tronco encefaliche Quadro clinico o Alterazioni dello stato mentale: stato confusionale, apatia, fino al coma o Anomalie della motilità oculare, nistagmo ed oftalmoplegia (lesioni dei collicoli superiori e dei nuclei mesencefalici) o Disturbi motori, incoordinazione motoria ed atassia (lesioni vermiane e dei nuclei vestibolari) o Evoluzione, in assenza di trattamento, in una severa amnesia anterograda (lesioni dei corpi mammillari con interruzione del circuito di Papez) o
•
•
Par IV: Altre patologie Malattia di Wilson Anche nota come degenerazione epatolenticolare, è causata da un difetto congenito del metabolismo del rame, che porta ad accumulo del metallo nel fegato ed in altri organi, in particolare nell’encefalo. È una patologia congenita a trasmissione autosomica recessiva provocata da un difetto del legame del rame alla ceruloplasmina, con ridotta escrezione del rame attraverso le vie biliari e suo accumulo negli epatociti ed in altre cellule extraepatiche. A livello cerebrale, il rame attraversa la BEE e si accumula soprattutto nei gangli della base, dove innesca un processo degenerativo con demielinizzazione progressiva, danno vascolare e formazione di lesioni necrotiche. In fase acuta si manifestano sintomi epatici acuti ed anelli di Kayer‐Fleischer a livello della cornea: in fase tardivasi manifestano i sintomi neurologici: tremore asimmetrico, atassia, discinesia, disartria, distonia, incoordinazione motoria ed alterazioni comportamentali (comportamento ipercinetico, labilità emotiva, depressione, psicosi). Malattia mitocondriale (MELAS) Indica una sindrome ereditaria caratterizzata da miopatia, encefalopatia, acidosi lattica ed episodi stroke‐like. È provocata da mutazioni genetiche del DNA mitocondriale, che compromettono la produzione di energia cellulare sotto forma di ATP. Ha un decorso clinico progressivo, caratterizzato da periodiche riacutizzazioni della sintomatologia. La diagnosi si basa sul riscontro bioptico di mitocondri rigonfi nelle cellule della muscolatura liscia e nell’endotelio delle arteriole muscolari, in associazione ad alterazioni strutturali delle fibre muscolari rosse. La patologia esordisce durante l’adolescenza con cefalea diffusa associata ad emianopsia, psicosi ed afasia; altri possibili segni sono ipotonia, ipoacusia, crisi comiziali. Nelle fasi avanzate si manifestano i deficit neurologici permanenti e la demenza. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE VII PROF. COTRUO Sindromi cerebrali, tronco‐encefaliche e dei nervi cranici Par I: Generalità Principali quadri sindromici Tra i principali quadri sindromici si ricordano: • Sindrome piramidale: paralisi spastica caratterizzata da: o Diminuzione di forza dei movimenti volontari con perdita dei movimenti fini o Aumento del tono muscolare di tipo spastico (ipertonia) o Riflessi propiocettivi esagerati con o senza clono o Diminuzione od abolizione dei riflessi esterocettivi (addominali, cremasterici, plantari) o Comparsa di riflessi patologici (segno di Babinski, segno di Oppenheim, segno di Gordon, segno di Mendel‐Bechterew etc.) o Assenza di atrofia muscolare degenerativa o Sede: in questi casi, può aversi una precisa definizione della sede. In primis, occorre valutare l’emisoma colpito, che sarà controlaterale alla lesione. In secundis, occorre valutare le regioni corporee colpite: ad esempio, in caso di coinvolgimento facio‐brachio‐crurale, la regione sarà al di sopra del ponte (ad esempio, a livello della capsula interna); in caso di coinvolgimento brachio‐
crurale, il coinvolgimento sarà pontino o più a valle, dato che il fascio faciale (o i fasci per altri nuclei cranici più a valle) è già emerso. In questo secondo caso, se la lesione è sovrabulbare sarà interessato anche il fascio cortico‐bulbare con conseguente interessamento dei muscoli della lingua (protrusione della lingua verso il lato colpito); se la lesione è sottobulbare, i muscoli della lingua non saranno interessati. In caso di lesioni midollari sottocervicali (e fino a livello lombare), poi, la paralisi sarà solo crurale, dato che i nervi del complesso brachiale sono già emersi. Questo in caso di lesione del fascio piramidale. In caso di lesione di specifiche aree corticali, può aversi l’interessamento di specifiche aree corticali a livello dell’homunculus di Pemfield. Infine, possono aversi sindromi associate che consentono un miglioramento della specificità diagnostica: ad esempio, in caso di lesione della capsula interna, si avrà interessamento del fascio talamo‐corticale, con alterazione della sensibilità epicritica discriminativa, e delle radiazioni ottiche con emianopsia. • Sindromi somestetiche: possono derivare da una lesione delle vie della sensibilità in qualunque punto. La sensibilità somatica, comunque, si distingue in esterocettiva e propiocettiva e le loro vie sono in parte distinte, in parte unite: la sensibilità propiocettiva, insieme a quella tattile superficiale, arriva al cordone posteriore omolaterale; quella termo‐dolorifica arriva al cordone laterale controlaterale per poi ascendere nel fascio spino‐talamico (dissociazione della sensibilità). Di conseguenza, in caso di lesioni emimidollari, conseguiranno una paralisi motoria omolaterale, un’anestesia propiocettiva e tattile superficiale omolaterale, ed un’anestesia termo‐dolorifica controlaterale. A livello tronco encefalico, la via propiocettiva e tattile superficiale arriva al secondo neurone sensitivo del bulbo e questo decusserà: da questo punto in poi, l’alterazione sarà sempre dallo stesso lato, cioè quello controlaterale. Il neurone di second’ordine bulbare proietta al neurone di terz’ordine talamico e questo al neurone di quart’ordine corticale: nella corteccia vi è poi una precisa rappresentazione somatotopica a livello postrolandico e lesioni corticali daranno alterazioni della sensibilità in sedi corporee specifiche. Infine, come regola generale e valida anche per i disturbi motori, man mano che si sale verso la corteccia, data l’apertura a ventaglio degli assoni, è sempre meno probabile che lesioni focali, come tumori od infarti, possano determinare una lesione completa • Sindromi sensoriali: o Ipo‐ od an‐acusia: le fibre acustiche a partenza dalla coclea arrivano al ponte sia omo‐ che contro‐
lateralmente (quindi le sindromi saranno rare) e vanno al collicolo inferiore e, da qui, al corpo genicolato mediale per arrivare alla corteccia uditiva. Le sindromi, quindi, potranno essere diverse a seconda della sede: per lesioni a livello del ponte, cioè per lesioni a carico del nervo acustico, vi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
sarà un disturbo dell’udito monolaterale ed omolaterale alla lesione; per disturbi sovra‐pontini vi sarà un disturbo del campo dell’udito, dato che le fibre di un lato si uniranno a quelle del lato controlaterale. Le sindromi uditive sono più rare e meno precise di quelle campimetriche, in virtù del fatto che le onde sonore si muovono nello spazio, colpendo consecutivamente più recettori anche controlaterali, e che i nuclei cocleari proiettano sia omo‐ che contro‐lateralmente o Aura acustica di epilessia temporale o Allucinazioni uditive o Agnosia uditiva o Ageusia o disturbo del gusto: è molto rara perché per poter essere avvertita deve essere bilaterale: infatti anche per un deficit del nucleo del tratto solitario, deputato appunto al gusto e che fornisce fibre a glosso‐faringeo, vago e faciale, il lato sano avvertirà correttamente il gusto. Un altro disturbo del gusto è la cacosmia, cioè la percezione di un odore estremamente sgradevole: in questi casi, la causa può essere una condizione patologica rinofaringea, come l’empiema dei seni nasali, o, se il disturbo si ripete, una condizione epilettica o psichiatrica. Sindromi cerebellari: anche nel cervelletto vi è una rappresentazione somatotopica: gli arti vengono rappresentati sugli emisferi cerebellari ed il tronco sul verme, in maniera però omolaterale. Pertanto, in caso di lesioni che coinvolgono, ad esempio, l’angolo ponto‐cerebellare, come neurinomi o meningiomi, si avrà una lesione pontina del fascio piramidale, con paralisi spastica controlaterale, ed un’atassia omolaterale alla lesione. Segni di lesione cerebellare sono: o Atassia: perdita della coordinazione dei movimenti (alterazione del segno naso‐punta) per asinergia del movimento. Si ricorda che la funzione principale del cervelletto è di controllo dei movimenti tramite fini efferenze inibitorie alla corteccia (ruolo di “freno” sulla corteccia, che di per sé sarebbe sempre “accelerata”): le efferenze cerebellari vanno al talamo e poi alla corteccia controlaterale per poter così controllare l’emisoma appropriato. Esistono poi delle vie cerebello‐troncoencefalo (al nucleo rosso ed alla sostanza reticolare)‐spinali che controllano i movimenti corporei senza l’intervento della corteccia, e quindi in maniera più rapida (ciò è molto importante per evitare ostacoli etc.): anche in questo caso il fascio efferente decussa per compensare la successiva decussatio dei fasci rubro‐spinali e reticolo‐spinali o Adiadococinesia: perdita della coordinazione dei movimenti di un arto rispetto all’altro (ad esempio della prono‐supinazione) o Tremore intenzionale: compare durante l’esecuzione di un movimento o Assenza del fenomeno del rimbalzo: opponendo una resistenza, ad esempio, alla flessione dell’avambraccio, fisiologicamente, al cessare della resistenza, l’avambraccio, grazie alla contrazione degli estensori, compie un movimento di estensione “ di rimbalzo”; il paziente cerebellare, invece, non compie questo movimento e persiste nella flessione o Disturbi del linguaggio: parola scandita, disartria Sindromi vestibolari: strettamente connesso con il cervelletto per il mantenimento dell’equilibrio è il sistema vestibolare, cioè il labirinto: i canali semicircolari sono dei sensori dell’accelerazione in tutte le possibili direzioni di movimento; l’attivazione di questi canali in assenza di movimento determina la vertigine, ossia l’allucinazione del movimento. Dai canali semicircolare parte il nervo vestibolare, che compone con il nervo acustico, l’VIII nervo cranico: il nervo vestibolare si connette con nuclei vestibolari pontini che hanno una connessione coi nuclei del fastigio e flocculo‐nodulari del cervelletto, deputati proprio al mantenimento dell’equilibrio; l’equilibrio è mantenuto attraverso efferenze cerebello‐vestibolari e vestibolo‐spinali (questo sistema è omolaterale). Quindi, in caso di danno nelle vie vestibolari o nel cervelletto, si avrà difficoltà a mantenere l’equilibrio, con sbilanciamento verso il lato lesionato e caduta a terra (astasia); la marcia sarà alterata e tendente verso il lato sano (una sorta di compenso per non cadere; abasia; marcia a stella: il paziente, ad occhi chiusi, va verso il lato sano in avanti e verso quello malato indietro) Sindromi uditive: la membrana timpanica e la catena degli ossicini trasmettono le onde sonore dall’orecchio medio alla coclea, alloggiata nell’orecchio interno, la quale trasmette le informazioni alla corteccia temporale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
del telencefalo attraverso vie polisinaptiche. Infatti, la depolarizzazione delle cellule ciliate stimola le terminazioni nervose del nervo cocleare, disposte in maniera tonotopica (localizzazione tonotopica della frequenza): le informazioni uditive provenienti dalla base delle cellule ciliate sono trasportate dai neuroni a T posti nel ganglio spirale di Corti, da cui partono gli assoni del nervo cocleare.. il nervo cocleare attraversa il meato acustico interno, decorre insieme al nervo vestibolare nella cisterna dell’angolo ponto‐cerebellare e penetra nel tronco a livello della fossetta sovra olivare, terminando nei nuclei dorsale e ventrale cocleari del bulbo. Da qui, la maggior parte dei neuroni passa contro lateralmente nel nucleo olivare superiore per poi risalire nel lemnisco laterale: alcune fibre terminano nel nucleo del lemnisco laterale, mentra altre continuano a risalire sino al tubercolo quadrigemino inferiore. Da qui le fibre raggiungono il corpo genicolato mediale, da cui parte la radiazione acustica che si proietta alla corteccia acustica primaria del piano sovratemporale del giro temporale superiore (area uditiva I o area 41 di Brodman) e sulla corteccia uditiva di associazione della porzione posteriore del giro temporale superiore (area uditiva II o area 42 di Brodmann). Il più importante disturbo acustico è l’ipoacusia: o Di trasmissione alla coclea o Neurosensoriale (o percettiva) o Centrale Sindromi tronco‐encefaliche: nel tronco encefalo, oltre ai nuclei troncoencefalici ed alle vie di comunicazione, vi sono i nuclei dei nervi cranici dal III al XII (il I, il nervo olfattorio, entra direttamente nel cervello con il tratto olfattorio verso la corteccia temporale; il II, il nervo ottico, entra nel cervello con il tratto ottico dopo il chiasma): questi sono molto importanti per la diagnosi di sede, in quanto un disturbo da alterazione di questi nuclei può associarsi a patologie delle vie nervose. Ne deriveranno caratteristiche sindromi alterne (vedi avanti per le principali sindromi alterne), ossia sindromi con disturbi periferici da un lato e disturbi da deficit dei nervi cranici nel lato opposto. Un primo esempio è una lesione mesencefalica, ad esempio da tumore od infarto, che coinvolga il fascio piramidale e quello spino‐talamico, ma anche il nucleo del III nervo cranico, ossia dell’oculomotore: ne deriva una paralisi spastica controlaterale, un’anestesia controlaterale ed una paralisi dell’oculomotore omolaterale. Quindi, per comprendere le sindromi alterne e per una diagnosi precisa della sede di lesione, occorre una buona conoscenza neuroanatomica della localizzazione dei nuclei dei nervi cranici (si ricorda che i nuclei motori sono localizzati medialmente e quelli sensitivi lateralmente): o III: oculomotore comune: origina dal mesencefalo anteriore ed innerva tutti i muscoli estrinseci dell’occhio (cioè ad esclusione di quelli dell’iride), cioè il retto mediale, il retto superiore, il retto inferiore e l’obliquo inferiore, l’elevatore superiore della palpebra o IV: trocleare: origina dal mesencefalo posteriore ed innerva l’obliquo superiore o V: trigemino: è formato da una porzione sensitiva (sono neuroni di second’ordine, quelli di prim’ordine si trovano nel ganglio di Gasse), costituita dal nucleo mesencefalico, dal nucleo pontino e dal nucleo spinale (quindi la sensibilità di quasi tutta la faccia, fino alla regione auricolare, è di pertinenza trigeminale) e divisa in 3 branche (oftalmica, mascellare e mandibolare), e da una porzione motoria, che innerva i muscoli masticatori (temporale, massetere, pterigoidei) o VI: abducente: origina dal ponte ed innerva il retto laterale, che serve appunto ad abdurre l’occhio o VII: faciale: origina dal ponte, innerva i muscoli mimici del volto, dando le tipiche manifestazioni facciali come corrugare la fronte, muovere le labbra, alzare l’angolo della bocca; si costituisce anche di fibre che provengono dal nucleo solitario, che partecipano al senso del gusto ed alla lacrimazione, e dal nucleo salivare inferiore, che partecipano alla salivazione. Di conseguenza, se la lesione è a livello del nucleo faciale, si avrà solo un deficit di moto dei muscoli mimici; se la lesione è a livello del nervo faciale, dopo aver ricevuto le altre fibre, vi saranno anche altri segni come perdita del gusto, riduzione della salivazione e lacrimazione o VIII: vestibolo‐cocleare: origina nell’angolo ponto‐cerebellare (vedi sindromi vestibolari) o IX: glossofaringeo: origina nel midollo allungato ed innerva la parte motoria del faringe (quindi la sua paralisi provoca disturbi della deglutizione: disfagia con possibile fuoriuscita del cibo dal naso o Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
passaggio nelle vie respiratorie con polmonite ab ingestis), la parte gustativa del terzo posteriore della lingua, e la parte secretiva della parotide. Si costituisce di fibre che partono dal nucleo ambiguo, dal nucleo solitario e dal nucleo salivare inferiore X: vago: origina dal solco posterolaterale del midollo allungato e si forma di fibre provenienti dal nucleo ambiguo, dal nucleo solitario e dal nucleo dorsale motorio del nervo vago; contribuisce all’innervazione della parte inferiore della muscolatura faringea, partecipando alla deglutizione, all’innervazione delle corde vocali (ad esempio, in caso di interventi sull’aorta, il nervo ricorrente, ramo del vago, può ledersi con conseguente afonia). Quanto detto è la componente motoria, poi vi è la componente sensitiva, ma soprattutto la componente autonomica, che innerva praticamente tutti gli organi. Di conseguenza, per paralisi del vago, si avranno disturbi della fonazione e della deglutizione, e disturbi della frequenza cardiaca (che non saranno nel senso di una bradi‐ o tachicardia, ma nel senso di una incapacità nell’adattare la frequenza cardiaca alle richieste del corpo) XI: accessorio: origina dalle radici craniali e spinali ed innerva sternocleidomastoideo e trapezio; una sua paralisi consegue, quindi, in una perdita della forza nella rotazione della testa e nel sollevamento della spalle XII: ipoglosso: origina dal midollo allungato ed innerva i muscoli della lingua; serve non solo alla deglutizione, ma anche alla fonazione (è opportuno ricordare l’estesa rappresentazione corticale della lingua). Pertanto, una sua paralisi determinerà spostamenti della lingua verso il lato colpito e disturbi della fonazione Tra i disturbi più frequenti delle sindromi alterne vi è la diplopia: il concetto fondamentale per capire la diplopia è che ciascun occhio divide il proprio campo visivo in una zona temporale laterale ed una nasale mediale (ora, la zona temporale sinistra e la zona nasale destra sono deputate al campo visivo destro, mentre la zona nasale sinistra e la zona temporale destra al campo visivo sinistro: in seguito, infatti le zone nasali decussano per rappresentare il campo visivo sinistro a destra ed il campo visivo destro a sinistra). Pertanto, in caso di strabismo dovuto ad esempio a paralisi del III oculomotore, ed in particolare del muscolo retto interno, ossia dell’adducente, l’occhio in questione, ad esempio il destro sarà abdotto. Ora, ricordando che è la macula la zona della retina che mette a fuoco, l’occhio sano vedrà normalmente un oggetto come, ad esempio, destro, mettendolo a fuoco sulla macula in posizione corretta; l’occhio patologicamente abdotto, invece, non metterà a fuoco correttamente l’oggetto sulla macula, ma lo vedrà in un altro punto, ad esempio a sinistra. Ne deriva che la corteccia riceverà due informazioni, una correttamente come destra (in questo caso dalla zona temporale sinistra) e l’altra, non corretta, come sinistra (dalla zona temporale destra, e non da quella nasale destra). Questa è la diplopia crociata. In questi casi di lesioni mesencefaliche, l’occhio paralizzato in abduzione sarà omolaterale alla lesione, mentre le possibili alterazioni delle vie motorie o sensitive sono controlaterali. Possono anche aversi lesioni periferiche dell’oculomotore, cioè lungo il suo decorso, o a livello giunzionale, come per la miastenia gravis: in questi casi non vi saranno alterazioni motorie o sensitive associate. Un caso simile si ha per paralisi del muscolo abduttore per lesione del VI abducente: in questo caso l’occhio strabico sarà addotto (quindi lesioni dell’adducente daranno diplopie spostate in senso controlaterale alla lesione, quelle dell’abducente in senso omolaterale). Questa è la diplopia omonima. Oltre che in crociata ed omonima, la diplopia può essere distinta in monoculare, dovuta ad irregolarità della superficie corneale, a patologie del cristallino o ad alterazioni della retina (e quindi di interesse prevalentemente oculistic), e binoculare, dovuta a patologie dei muscoli extraoculari innervati dai nervi cranici, come MCV, ictus, miastenia gravis, SM, etc. Qualsiasi tipo di strabismo per deficit dei muscoli oculari può condurre a diplopia, assente però in caso di strabismo concomitante, in cui l’occhio strabico va fuori al campo visivo e quindi viene completamente escluso dalla visione. In caso di paralisi del retto superiore, l’occhio non riesce ad andare verso l’alto, con diplopia con immagini una sopra l’altra: un occhio codificherà correttamente l’immagine come alta, l’altro incorrettamente come bassa. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Altre sindromi correlate sono: o Sindrome del chiasma ottico: dovuta a fenomeni compressivi, come gliomi, craniofaringiomi o tumori ipofisari, o a malattie demielinizzanti come la SM, si manifesta con deficit delle fibre nasali chiasmatiche, quindi con emianopsia temporale bilaterale o Emianopsia altitudinale: indica la perdita bilaterale di una metà, superiore od inferiore, del campo visivo, dovuta a lesioni bilaterali delle radiazioni ottiche o della corteccia visiva (lesioni monolaterali determinano, invece, quadrantopsia, superiore od inferiore) o Sindrome del seno cavernoso: dovuta principalmente a trombosi venosa, si manifesta con paralisi dei nervi oculomotori (III, IV e VI) ed ipoestesia nella regione della I branca trigeminale, con chemosi e proptosi Possono poi aversi sindromi trigeminali, caratterizzate da deficit sensitivi a carico dei territori innervati dal nervo trigemino e da paralisi dei muscoli masticatori, con mandibola aperta in maniera asimmetrica e verso il lato non colpito e non contrazione di massetere e temporali omolaterali durante la masticazione; in questi casi, che si hanno per lesioni bulbari, il deficit sensitivo del resto del corpo sarà controlaterale. Si ricorda che la componente motoria del trigemino origina dalla branca mandibolare ed innerva i muscoli masticatori suddetti. In caso di sindromi faciali, invece, il quadrò sarà caratterizzato dal fatto che alcuni muscoli innervati dal faciale, come gli orbicolari delle palpebre ed i frontali (muscoli superiori), hanno una rappresentazione corticale doppia e quindi saranno meno colpiti, mentre altri, come i muscoli buccali e mentonieri (muscoli inferiori), hanno una rappresentazione quasi esclusivamente controlaterale e quindi saranno colpiti più frequentemente. Di conseguenza, per paralisi periferiche, saranno colpiti sia i muscoli superiori che i muscoli inferiori; per paralisi sovranucleari (o centrali), invece, i muscoli superiori, ricevendo anche fibre dall’altro emisfero, saranno poco o niente colpiti, mentre quelli inferiori, ricevendo fibre solo dall’emisfero controlaterale, saranno colpiti. Quindi, in entrambi i casi vi saranno difficoltà ed incongruenze nella chiusura della bocca, ma solo nella paralisi periferica l’occhio non si chiude e la fronte non si corruga. Infine, si ricorda che anche molti muscoli come quelli della deglutizione e della suzione hanno una rappresentazione bicorticale. Infine, una sindrome alterna particolare, non troncoencefalica, è quella da ischemia della carotide interna, con deficit visivo omolaterale da ischemia della regione dell’arteria oftalmica ed emianestesia ed emiplegia, e talvolta emianopsia, controlaterali. Sindrome meningea: il cervello è privo di recettori, mentre le meningi ne sono ricche: pertanto, le sindromi meningee sono particolarmente dolorose. Una sindrome meningea può aversi per meningite, ma anche per sindromi emorragiche subaracnoidee, ed è caratterizzata da o Cefalea o Rigidità nucale, positività della manovra di Kernig e del segno di Brudzinski o Atteggiamento a cane di fucile Sindrome da ipertensione endocranica: un progressivo ingrandimento della massa intracranica porterà ad un incremento della pressione intracranica (anche per ostruzione della circolazione liquorale); la curva pressione‐volume consente, per piccoli aumenti del volume intracranico, attraverso l’assorbimento di liquido cerebrospinale e di sangue, di compensare l’aumento della massa fino ad una soglia di tolleranza, superata la quale si avrà un brusco aumento di pressione con la sintomatologia caratteristica (vedi lezione sull’idrocefalo) o Cefalea o Nausea o Deterioramento dello stato di coscienza o Disturbi visivi: allargamento dello scotoma paracentrale fisiologico con o senza riduzione dell’acuità visiva Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
o Decesso Sindrome midollare: bisogna determinare la sede: o Cervicale o inferiore: nel primo caso si avrà una paralisi brachio‐crurale, nel secondo caso solo crurale con possibile coinvolgimento degli sfinteri se a livello lombo‐sacrale, a livello del cono e dell’epicono o Primo o secondo motoneurone o Anteriore, laterale o posteriore Principali sindromi alterne • Sindrome di Weber: è dovuta ad occlusioni vascolari, tumori od aneurismi, della base del mesencefalo, con coinvolgimento del III nervo cranico e del tratto corticospinale. Ne deriva un quadro caratterizzato da paralisi oculomotoria con emiplegia crociata • Sindrome di Claude: è dovuta alla stesse cause, ma a livello del tegmento mesencefalico, con interessamento, oltre che del III nervo cranico, del nucleo rosso e del braccio quadrigemino. Il quadro risultante è caratterizzato da paralisi oculomotoria con atassia cerebellare controlaterale e tremore • Sindrome di Benedikt: è simile alla precedente, ma dovuta ad infarti, emorragie, tubercolomi o tumori e con interessamento anche del fascio corticospinale • Sindrome di Nothangel: dovuta solitamente a tumori, si localizza a livello del tetto del mesencefalo e coinvolge peduncoli cerebellari e III nervo cranico. Il quadro esita in paralisi oculari, paralisi dello sguardo ed atassia cerebellare • Sindrome di Millard‐Gubler: dovuta ad infarti o tumori, interessa la base del ponte, coinvolgendo il tratto corticospinale, il VIII e, spesso, il VI nervo cranico. Il quadro risulta in un paralisi omolaterale di faciale ed abducente ed emiplegia controlaterale • Sindrome di Avellis: dovuta alle stesse cause, ma localizzata a livello del tegmento del bulbo, coinvolge il tratto spinotalamico, il X nervo cranico e, talvolta, le fibre pupillari discendenti, con sindrome di Bernard‐
Horner. Il quadro risulta in una paralisi del palato molle e delle corde vocali con emianestesia contro laterale • Sindrome di Jackson: è simile alla precedente, ma con interessamento anche del XII nervo cranico, quindi con paralisi ipsilaterale della linhua • Sindrome di Wallenberg: è dovuta ad occlusione dell’arteria vertebrale o della cerebellare postero‐inferiore e coinvolge il tegmento laterale del bulbo, interessando i nervi cranici V, IX, X, XI, i tratti spinotalamico laterale, spinocerebellare ed olivo cerebellare, le fibre dilatatrici pupillari. Il quadro risulta in paralisi ipsilaterale dei nervi cranici coinvolti, sindrome di Horner, atassia cerebellare e perdita contro laterale delle sensazioni termo dolorifiche Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE VII PROF: COTRUFO Epilessia Par I: Generalità Definizione L’epilessia (dal greco “epilambanein”: esser colti all’improvviso) è una sindrome caratterizzata dalla ricorrenza delle crisi (la ricorrenza è un aspetto molto importante: ognuno può avere una crisi, ciò non giustifica, in assenza del carattere ricorrente, la diagnosi di epilessia), dal loro esordio improvviso e dalla loro breve durata (da secondi a pochi minuti: ciò perché il cervello ha dei meccanismi endogeni di limitazione delle crisi, che, se continuassero, provocherebbero danni gravi e permanenti al cervello, come in caso di stato di male epilettico): durante la crisi il malato ha un’anomalia dell’attività motoria, della funzione vegetativa, della coscienza, della memoria o delle percezioni. Altri aspetti fondamentali sono la possibile insorgenza in qualunque età (duplice picco e quindi duplice eziologia: 0‐20 anni e 60‐80 anni: eziologia da trauma da parto, da malformazioni congenite o dello sviluppo od anossica/ischemica nel primo caso, da malattia cerebrovascolare nel secondo caso, da tumori nel periodo intermedio) ed i sinonimi un tempo utilizzati, che possono fornire utili ed attuali informazioni: “mal caduco”, che indica la brevità e l’immediata reversibilità della crisi, “morbus sacer”, che indicava qualcosa di “sacro”, ossia difficilmente spiegabile su basi conosciute, e quindi organiche, “crisi comiziale” “a deo immisso”, comiziale per indicare che avvenivano durante i comizi, ossia in maniera improvvisa. Di grande importanza fisiopatologica e diagnostica è che ogni crisi ha un correlato elettrico registrabile in EEG, caratterizzata da attività sincrona e ritmica di popolazioni di neuroni: la crisi clinica è l’effetto di tale disordine dell’attività elettrica e si correla con la sede del firing neuronale. La crisi epilettica è dovuta ad una scarica eccessiva e disordinata del tessuto nervoso cerebrale, che può esitare in un’improvvisa perdita di coscienza, un’alterazione della percezione od una disfunzione delle funzioni psichiche, in movimenti convulsivi, alterazioni della sensibilità o in una diversa combinazione di questi fenomeni: tale scarica origina da un abbassamento della soglia di eccitabilità dei neuroni cerebrali (teoricamente chiunque può avere una scarica epilettica, ma un individuo normale ha una soglia di eccitabilità normale e quindi difficilmente andrà incontro ad una crisi, al contrario di individui predisposti: ad esempio, un individui sano, se stimolato con elettroshock, che supera la soglia di eccitabilità normale ha una crisi epilettica). Già secondo Tissot, nel 1770, la crisi epilettica dipendeva da due fattori: una predisposizione cerebrale (la soglia di eccitabilità più bassa, come poi si è visto) ed una causa scatenante; secondo Huglings Jackson, ne 1850, l’epilessia è una “scarica improvvisa, temporanea ed eccessiva di cellule instabili di una parte della sostanza grigia del cervello”. Secondo dati più recenti, l’induzione chimica (attraverso l’acido kainico o la pilocarpina è possibile indurre anche una forma particolarmente grave di epilessia farmaco‐resistente, ossia la sclerosi mesiale del lobo temporale) od elettrica di crisi epilettiche può indurre una condizione stabile di epilessia: da ciò deriva l’importanza di una terapia antiepilettica preventiva (ad esempio, un bambino che soffre di crisi convulsive può andare incontro, se non trattata, ad una sindrome epilettica). Inoltre, le crisi un emisfero possono indurre alterazioni dell’eccitabilità, tramite le numerose connessioni interemisferiche, nell’emisfero opposto (mirror focus). Altro concetto correlato è quello del kindling, ossia stimolazioni ripetute sottosoglia che possono indurre un’ipereccitabilità cellulare. Infine, altre caratteristiche importanti sono: la necessità di diagnosi differenziale con le crisi isteriche, con la sincope e con i TIA, la possibile epilettogenesi di alcuni farmaci quali antidepressivi ed antipsicotici e, viceversa, la tendenza dei farmaci antiepilettici a dare manifestazioni psichiatriche, l’elevato costo sociale dell’epilessia. Epilettogenesi Elementi chiave dei neuroni alla base dell’epilettogenesi sono: pompe al Na+ ed al K+, neuromodulatori (in particolare il GABA ed il glutammato) e ioni Cl‐ e Ca2+; una patologia in uno di questi tre elementi costituirà la base per una predisposizione alle crisi epilettiche. A fondamento del firing neuronale epilettico vi è il PDS (Paroxismal Depolarization Shifts), che consiste in brusche e ricorrenti depolarizzazioni della membrana che determinano scariche ad alta frequenza di potenziali d’azione Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
(bursts): in tal caso, infatti, a seguito di una depolarizzazione, il potenziale di membrana non riesce a tornare a riposo, ma risulta in una depolarizzazione, quindi nella scarica e, clinicamente, nella crisi. Meccanismi responsabili dei PDS sono: deficit di inibizione GABA‐mediata, potenziamento della trasmissione glutammatergica, presenza di gruppi di neuroni intrinsecamente più eccitabili. EEG L’EEG fornisce la conferma del concetto che la crisi epilettica consista in una scarica ricorrente, improvvisa ed eccessiva dei neuroni corticali: tutti i tipi di crisi epilettica generalizzata si associano ad anomalie del tracciato, spesso anche in crisi focali si riscontrano anomalie (tipico è poi il caso di crisi focali che si fanno generalizzate); comunque, l’EEG è importantissimo nel diagnosticare il focus epilettogeno, in quanto la regione in cui si manifestano più precocemente le punte è quella che più probabilmente corrisponde al focolaio epilettogeno. Comunque, è alquanto improbabile, se non in ambito ospedaliero, fare un tracciato EEG durante una crisi: tuttavia, nel periodo intercritico è frequente il riscontro di mancanza di anomalie EEG. Durante una crisi l’attività neuronale si sincronizza e ne risulta un quadro assai specifico, caratterizzato da fasi EEG correlabili a quelle cliniche (vedi dopo) : • Fase 0: paroxysmal depolarizing shift (PDS): ampie depolarizzazioni che preludono la crisi • Periodo silente • Fase I: complessi punta onda seguiti da un periodo di onde di minor ampiezza • Fase II: punte ad onde lente • Fase III: tracciato quasi piatto Classificazione Una sola crisi epilettica non è diagnostica per sindrome epilettica (si può fare una distinzione tra sindrome epilettica, in cui le crisi epilettiche rientrano in un quadro clinico riconducibile ad una determinata patologia, come ad esempio in caso di tumori o di malattia cerebrovascolare, e malattia epilettica, in cui le crisi epilettiche sono l’unica manifestazione di malattia, come nelle canalopatie ereditarie), ma occorre il ripetersi di più crisi. Comunque, vi è innanzitutto una classificazione eziologica, che distingue: • Epilessie idiopatiche: dovute a cause familiari o genetiche, un tempo erano denominate “idiopatiche” perché non si conosceva l’eziopatogenesi (“derivano da se stesse”: riconoscono in se stesse la causa). Ora, si conoscono alcune cause, come canalopatie e malformazioni dello sviluppo corticale • Epilessie sintomatiche: sono dovute a causa nota, come traumi, interventi di neurochirurgia, infezioni, intossicazioni da farmaci, alcol o sostanze d’abuso etc. • Epilessie criptogenetiche: sono dovute a cause non dimostrabili: questo gruppo sta diminuendo grazie al continuo riconoscimento delle cause, come in caso di displasie corticali, di sclerosi o tumori ippocampali in molte epilessie del bambino. In questi casi l’ippocampo tende ad incunearsi su di una volta cranica non ancora formata e quindi subisce un trauma di trazione, come durante un parto travagliato,con conseguente sclerosi dell’ippocampo, evidenziabile solo con RM e quindi solo da poco. Seconda questa concezione, molte epilessie sarebbero dovute a malattie passate inosservate durante la vita intrauterina, alla nascita o nella prima infanzia per la loro scarsa o nulla evidenza clinica e per l’assenza di lesioni rintracciabili con le attuali metodiche diagnostiche (la sclerosi ippocampale, un tempo misconosciuta, è oggi individuabile tramite RM). Le crisi sono manifestazioni accessuali, secondarie alla repentina alterazione dell’equilibrio del potenziale di membrana, che provoca una depolarizzazione rapida, prolungata ed intensa della membrana neuronale: sono il risultato di una scarica ipersincrona di una popolazione neuronale ipereccitabile (vedi sopra). Si distinguono in: • Generalizzate o Toniche, cloniche o, più frequentemente, tonico‐cloniche (grande male) o Assenze (piccolo male) Con solo perdita di coscienza Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Complesse, con brevi movimenti tonici, clonici od automatici o Sindrome di Lennox‐Gastaut o Epilessia mioclonica giovanile o Spasmi infantili (sindrome di West) o Crisi atoniche (astatiche, acinetiche), talvolta con scosse mio cloniche Crisi parziali, o focali o Semplici: senza perdita di coscienza od alterazione della funzione psichica Motorie con origine nel lobo frontale: toniche, cloniche, tonico‐cloniche, jacksoniane Somato‐sensitive o sensoriali: visive, uditive, olfattorie, gustative, vertiginose Vegetative‐autonomiche Psichiche pure o Complesse: con disturbi della coscienza Inizio come crisi parziale semplice e successivo disturbo della coscienza Con compromissione della coscienza fin dall’inizio Par II: Le crisi Crisi generalizzate È importante distinguere, innanzitutto, tra crisi generalizzate primarie e crisi generalizzate secondarie a crisi focali. Nel primo caso, la prima modificazione clinica indica un coinvolgimento di entrambi gli emisferi e del ponte, in particolare della sostanza reticolare: ne risulta la perdita di coscienza. Inoltre, quelle primariamente generalizzate sono rappresentate da un gruppo di fenotipi peculiari, età‐correlati, caratterizzati da punte generalizzate a 2,5‐4 Hz, predominanti sulle regioni frontali, o da scariche di polipunte‐onde, che originano in assenza di anomalie strutturali sottostanti ed in presenza, solitamente, di una forte componente genetica. Al contrario, le crisi secondariamente generalizzate, generalmente, non presentano tale componente genetica e dipendono da una malattia cerebrale sottostante, acquisita (traumi, ictus etc. Pertanto, questo gruppo di crisi aumenta con l’età) o malformativa congenita (più raramente), o da un difetto metabolico; la crisi focale iniziale è spesso misconosciuta. Si distinguono in: • Crisi toniche o cloniche: poco frequenti • Tonico‐cloniche (o grande male): si succede in tre fasi: o Fase 0 o prodromica: sono talvolta presenti sintomi prodromici, come: disturbi affettivi (apatia, depressione, irritabilità), alcuni scatti mioclonici durante il giorno, movimenti di rotazione della testa e degli occhi o movimenti di un arto poco prima della crisi; comunque, più frequentemente l’esordio è improvviso. Più spesso, comunque, tali prodromi non si verificano e la perdita di coscienza è immediata o Fase I o tonica: il paziente perde improvvisamente la coscienza (ciò indica il coinvolgimento di entrambi gli emisferi) e cade a terra, con possibile emissione di un grido; è presente un’ipertonia muscolare generalizzata: ne risulta un quadro di irrigidimento in estensione dei 4 . Questa fase dura circa 20‐60 secondi. o Fase II o clonica: i muscoli sono interessati da movimenti clonici, ossia da bruschi movimenti ritmici in flesso‐estensione degli arti; il volto diventa violaceo ed è deformato da una serie di smorfie e spesso il paziente si morde la lingua. Sono evidenti segni neurovegetatitivi: polso rapido, pressione arteriosa elevata, pupille dilatate, sudorazione e salivazione abbondanti, apnea respiratoria. Questa fase dura circa 30 secondi o Fase III o coma ascessuale: può essere o di ripresa immediata (il paziente termina questa 3 fase e si riprende subito) oppure può essere seguita da un sonno, con EEG in cui scompare tutta l’attività parossistica. Comunque, il paziente giace immobile ed inerte in uno stato di coma profondo per molti minuti o per molte ora in caso di sonno; al risveglio dal coma non ricorda l’accaduto. Circa il 5‐
8% dei pazienti sviluppa uno stato di crisi prolungate ripetute senza ripresa di coscienza (stato epilettico convulsivo). Si ricorda, infine, che queste crisi si risolvono da sole e nulla si può fare se non evitare che il paziente si morda la lingua o che cada bruscamente a terra con traumi o fratture patologiche. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
Assenza tipica (o piccolo male): si distingue dalle precedenti per la brevità (talvolta son così brevi che il soggetto ne rimane all’oscuro) e per la scarsità di manifestazioni di tipo motorio (spesso si osservano fini movimenti mioclonici a carico di muscolatura delle palpebre, muscolatura facciale o delle dita); l’attacco, improvviso, consiste in un’interruzione improvvisa della coscienza, evidente solo con la fissità dello sguardo e l’eventuale interruzione del dialogo (il resto delle funzioni, come camminare o guidare una bicicletta od anche una macchina è conservato), per circa 15‐20 secondi. Inoltre, sono tipici automatismi motori semplici (schioccare le labbra, masticare, movimenti annaspanti delle dita) e complessi (il paziente può camminare). Sono tipiche dell’infanzia (spesso infatti è l’insegnante ad accorgersene) e frequenti quando compaiono (fino anche a centinaia al giorno). Il meccanismo patogenetico che rende clinicamente differenti le crisi di grande e di piccolo male va ricercato nel diverso coinvolgimento della sostanza reticolate: reticolo‐talamo‐corticale (interessamento della SR ascendente, che provoca la perdita di coscienza) e reticolo‐talamo‐midollare (interessamento anche della componente discendente, che provoca disinibizione ed alterazione delle componenti motorie) nel primo caso, esclusivamente reticolo‐talamo‐corticale nel secondo. Assenza mioclonica: si ha in caso di coinvolgimento parziale di fibre reticolo‐talamo‐midollari concomitante all’assenza (un bambino, ad esempio, lascia cadere il giocattolo che ha in mano) Sindrome di Lennox‐Gestaut o piccolo male acinetico od assenza atonica: il bambino perde improvvisamente il tono muscolare e rovina bruscamente a terra, per poi rialzarsi. Può manifestarsi come evoluzione di una sindrome del neonato, la sindrome di West o ipsaritmia, caratterizzata dalla triade: ritardo motorio, crisi epilettiche “a colpo d’ala di piccione” (il bambino abbassa la testa ed alza la parte prossimale degli arti superiori) e quadro EEG tipico (ipsiaritmico). Crisi focali (o parziali) • Focali semplici: la crisi focale è il prodotto di una lesione dimostrabile o di un’alterazione EEG in un’area della corteccia cerebrale; possono essere distinte in: semplici, senza perdita di coscienza e solitamente dovute a focolai motori o sensitivi, o complesse, con perdita di coscienza e solitamente dovute a focolai temporali o frontali (vedi dopo). Generalmente la manifestazione sarà controlaterale; data l’ipereccitabilità come base patogenetica della crisi epilettica, la manifestazione sarà un eccesso od una distorsione della funzione svolta da un particolare lobo (allucinazioni visive per crisi occipitali, crisi motorie per crisi frontali, etc.). Tra le principali si ricordano: o Crisi del lobo frontale: A partenza dall’area supplementare motoria (aree 6 ed 8): crisi focali motorie: dovute ad una lesione del lobo frontale controlaterale nella suddetta area, si manifestano tipicamente come un movimento di rotazione della testa e degli occhi verso il lato opposto al focolaio irritativo (controversive); ma talvolta sono ipsiversive, (cioè verso il lato colpito). Sono spesso associate a contrazione tonica di tronco ed arti di quel lato e, talvolta, seguite da movimenti clonici generalizzati o da generalizzazione. A partenza dell’area motoria primaria (area 4): crisi motorie jacksoniane: la clinica tipica di una crisi jacksoniana è rappresentata da un prima fase di contrazione tonica, seguita da una seconda fase di movimenti clonici; la durata è solitamente inferiore al minuto. Quelle a partenza dalla faccia sono abbastanza frequenti data l’elevata rappresentazione corticale dei muscoli della faccia nell’homunculus di Pemfield; molto frequenti sono, comunque, altre crisi dovute a foci in regioni specifiche dell’homunculus di Pemfield, e soprattutto in quelle più estese, come quelle rappresentative delle dita della mano: caratteristico è poi l’interessamento espansivo a neuroni contigui e quindi ad altre regioni corporee (marcia jacksoniana). In seguito a convulsioni con marcati segni focali si può osservare una paralisi transitoria degli arti colpiti (paralisi di Todd). A partenza dall’area di Broca: crisi di arresto afasico (TEA: transient epileptc amnesia): la crisi epilettica può originare dall’area del linguaggio; in questo caso ci si pone il problema di fare diagnosi differenziale con TIA a carico delle stesse aree corticali: la breve durata (può raggiungere al massimo i 2 minuti), la ripetitività (il fenomeno epilettico può riverificarsi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
nell’arco della giornata) e la presentazione sotto forma di crisi (cioè la possibile e frequente associazione con altre crisi, soprattutto motorie o sensitivo‐sensoriali o l’eventuale generalizzazione) sono le caratteristiche dell’epilessia. o Crisi somato‐sensitive o sensoriali Crisi somato‐sensoriali: sia focali, sia con fenomeni di marcia verso altre parti dello stesso emisoma, indicano quasi sempre un focus a livello della circonvoluzione post‐rolandica o nelle sue vicinanze, nell’emisfero contro laterale. Le sedi più frequentemente colpite sono quelle a più elevate rappresentazione corticale: labbra e dita di mani e piedi. Il disturbo sensitivo è descritto come intorpidimento o sensazione di puntura, talvolta come formicolio o scossa elettrica. Crisi uditive: si caratterizzano per la percezione, generalmente, di brusii o rumori fragorosi e si differenziano da altre patologie dell’orecchio per la brevità, la ripetibilità e le alterazioni dell’EEG (vedi lezione 1 prof. Puoti) Crisi visive • A partenza dalla corteccia visiva primaria (area 17 o corteccia striata): sensazioni visive elementari, come oscuramenti, punti e lampi, colorati o meno (il rosso ed il giallo sono i colori che si manifestano più frequentemente. È interessante sottolineare, sebbene non si tratti di crisi propriamente visive, come Vincent Van Gogh soffrisse di crisi epilettiche, curate con la digitale. L’intossicazione digitalica determinò una xantopsia, che gli faceva vedere tutto giallo: a ciò dobbiamo i capolavori del suo “periodo giallo”, ndr) • A partenza delle cortecce visive associative (aree 18 e 19): sensazioni di luci pulsanti o scintillanti. Possono frequentemente associarsi a crisi uditive Crisi di tipo vertiginoso: la lesione è a livello della regione temporale supero‐posteriore Crisi olfattorie: sono dovute a lesioni della parte infero‐mediale del lobo temporale, in genere nella regione della circonvoluzione paraippocampale o dell’uncus (crisi uncinate), e solitamente descritte come sensazioni sgradevoli o disgustose Crisi gustative Sensazioni viscerali anomale: ad origine prevalentemente nel lobo temporale e riferite soprattutto nel torace, nell’epigastrio e nell’addome, sono tra i più frequenti tipi di aura. Palpitazioni e tachicardia sono anch’esse correlate a foci temporali. Crisi cognitive Crisi focali complesse: si differenziano dalla crisi generalizzate per la presenza di un’aura, che spesso indica un’origine temporale, e di un periodo di alterazione del comportamento e della coscienza, piuttosto che di una improvvisa perdita di coscienza. Quindi, l’aura può intendersi come una manifestazione critica che prelude ad una perdita di coscienza: è quasi sempre rappresentata da crisi focali semplici o da illusioni/allucinazioni percettive, indicando un’origine solitamente temporale (però non possono propriamente definirsi “crisi temporali”, in quanto hanno origini, talvolta, anche dalla parte mediale‐orbitaria del lobo frontale). Possono esitare in crisi generalizzate. Queste crisi sono caratterizzate da: o Alterazioni dalla percezione Illusioni sensoriali: sono tra i fenomeni più comuni, rappresentati solitamente da micropsie, macropsie, palinopsie Allucinazioni sensoriali: sono generalmente visive o uditive o Alterazioni dello stato cognitivo : déjà vu (sensazioni di aumentata realtà o familiarità), jamais vu (sensazioni di estranietà e non familiarità), esperienze emotive drammatiche, senso di depersonalizzazione, atti di violenza ed aggressività, stati paranoidi‐deliranti, alterazioni del comportamento. È bene sottolineare come alcuni pazienti affetti da crisi temporali presentino tipiche alterazioni del comportamento anche durante il periodo inter‐critico, fino ad una sindrome caratterizzata da iposessualità, iperreligiosità ed ipergrafia (sindrome di Waxwan‐Geschwind: ne avrebbero sofferto Giovanna d’Arco e lo stesso Van Gogh) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
Automatismi motori: se si manifestano, compaiono durante l’ultima fase della crisi e si manifestano come schiocco delle labbra, movimenti di masticazione o deglutizione, etc. Terapia Esistono farmaci di prima scelta per un determinato tipo di crisi: ad esempio la crisi di grande male ha come farmaco di prima scelta il valproato. Comunque, vi sono diversi farmaci antiepilettici, di vecchia e nuova generazione, che agiscono sui meccanismi dell'epilettogenesi. Il protocollo terapeutico prevede quindi: dare il farmaco giusto per quel tipo di crisi alla quantità giusta per il peso del soggetto e la sua età, in seguito accertarsi che ci sia una buona compliance (l'assunzione del farmaco, infatti, deve essere continua). Lo steady state è abbastanza variabile: nei farmaci di vecchia generazione, si raggiungeva anche in 20 giorni, in quelli di nuova generazione in maniera più rapida; questo significa che, prima di un eventuale cambiamento del farmaco, occorre attendere un certo periodo per valutare i risultati. Benchè n tempo ritenuta una patologia per lo più femminile, l’epilessia ha in realtà un’egual frequenza nei due sessi: tuttavia, dato il ruolo degli ormoni sull’epilettogenesi (il progesterone la riduce, gli estrogeni la aumentano), l’andamento nelle donne è caratteristico. In particolare, durante il periodo mestruale e nella fase ovulatoria può esserci un picco di incidenza delle crisi. Inoltre, durante la gravidanza, benché quasi tutti i farmaci antiepilettici siano teratogeni, non è consigliabile sospendere la terapia poiché in realtà il rischio teratogeno è solo del 2‐3 % maggiore rispetto a donne sane. Infine, le crisi epilettiche stesse possono modificare il ciclo mestruale: in particolare, quelle del lobo temporale, dato il suo stretto collegamento con l’asse ipotalamo‐ipofisario. Nell’anziano, invece, nell’uso dei farmaci, va prestata particolare attenzione: difatti, egli probabilmente assume già altri farmaci, data soprattutto l’eziologia nell’anziano, più frequentemente cerebrovascolare, con rischio di interazioni negative o soffre di patologie epatiche o renali con rischio di accumulo (infatti, spesso richiede una dose minore). In caso di stato di male epilettico, il paziente va intubato per evitare la morte per arresto respiratorio, non si aspettano i 20 giorni per il raggiungimento dello steady state e l’eventuale cambiamento del farmaco, il farmaco di prima scelta, per via endovenosa, è il diazepam, che ha un effetto pronto ma non duraturo (inoltre, in questi casi si somministrano cortisonici per evitare l’edema cerebrale e, talvolta, barbiturici per indurre uno stato di coma farmacologico finalizzato ad evitare un eccessivo consumo di O2. Tra i farmaci utilizzati nella terapia dell’epilessia si ricordano: • Farmaci GABAergici (cioè che potenziano l’azione del GABA): valproato (diminuisce la degradazione presinaptica del GABA in semialdeide succinica tramite l’inibizione della GABA‐transaminasi), vigabatrin (ha lo stesso meccanismo), tiagabina (diminuisce il reuptake di GABA), benzodiazepine (clonazepam, importante antimioclonico; diazepam, importante nello stato di male epilettico), barbiturici • Farmaci che regolano le correnti del Na+ voltaggio‐dipendenti: carbamazepina, fenitoina, valproato, topiramato, lamotrigina, zonisamide (non in uso in Italia) • Farmaci che regolano le correndi del Ca2+ voltaggio‐dipendenti talamo‐corticali: valproato, etosuccimide Gli utilizzi sono: • Crisi tonico‐clonica: in prima scelta, fenitoina, carbamazepina, valproato; in seconda scelta, lamotrigina, oxcarbamazepina • Assenza: in prima scelta, valproato; in seconda scelta, etosuccimide, lamotrigina • Crisi parziali: in prima scelta, carbamazepina, fenitoina; in seconda scelta, valproato, lamotrigina, oxcarbamazepina Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ IX PROF COTRUFO Eventi critici Par I: Sincope Generalità La sincope è una transitoria perdita di coscienza e del tono posturale, con incapacità a restare in piedi, dovuta a riduzione del flusso ematico cerebrale. Altri caratteri distintivi sono l’inizio relativamente improvviso, la breve durata ed un recupero spontaneo e senza alcun bisogno di misure di rianimazione. Può essere determinata da tre cause principali: • Perdita riflessa del tono simpatico vascolare (effetto vasodepressivo), scatenata dall’inibizione, mediata a livello centrale, delle normali influenze simpatiche toniche, spesso associata ad eccessivo tono vagale e bradicardia (sincope neurogena). Il tipo più comune è la classica sincope vasovagale, comunque possono essere: o Innescate da segnali estrinseci diretti al bulbo a partire dai barocettori Vasovagale (svenimento comune, spesso dovuto a stress fisici o psichici) Neurocardiogena Da ipersensibilità del seno carotideo Vago‐glossofaringea Da dolore intenso, specialmente se viscerale o Associate a diminuito ritorno venoso al cuore Minzionale Da tosse Da manovra di Valsalva, sforzo, apnea, sollevamento di pesi Post‐prandiale o Stimoli psicogeni intrinseci: Paura, ansia, isteria Vista del sangue • Deficit dell’innervazione simpatica dei vasi sanguigni e delle risposte compensatorie autonomiche (tachicardia e vasocostrizione riflesse), che si verifica con l’assunzione della stazione eretta e determina una stasi di sangue nelle parti declivi del corpo, causando ipotensione ortostatica e sincope. Può essere dovuto a: o Insufficienza autonomica periferica Invecchiamento Malattie dei nervi periferici: neuropatia diabetica, tabe dorsale, neuropatia amiloidea, sindrome di Guillain‐Barrè Malattia prolungate che costringono il paziente, spesso anziano, a letto per molto tempo Farmaci antipertensivi ed altri farmaci ad azione bloccante sul sistema vascolare (L‐dopa, antidepressivi, sedativi) Simpaticectomia chirurgica o Insufficienza autonomica centrale Deficit autonomico primario (ipotensione ortostatica primaria) • Forma I: degenerazione selettiva dei neuroni dei gangli simpatici, con denervazione dei vasi della muscolatura e delle ghiandole surrenali • Forma II: sindrome di Shy‐Drager: si osserva degenerazione dei neuroni pregangliari delle colonne laterali della sostanza grigia del midollo spinale, associata a degenerazione di altri sistemi neuronali (atrofia multisistemica) o Degenerazione della sub stantia nigra e del locus coeruleus (sindrome parkinsoniana o Degenerazione strio‐nigrica o Degenerazione olivo‐ponto‐cerebellare Traumi, infarti e necrosi del midollo spinale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Farmaci antipertensivi ed altre sostanze ad azione centrale Riduzione della gittata cardiaca o Aritmie: bradiaritmie, blocco AV di Adam‐Stokes, tachicardie o Infarto o grave insufficienza cardiaca congestizia o Ostruzione all’efflusso ventricolare sinistro od aortico, come in caso di stenosi aortica o Ostruzione del flusso polmonare: stenosi polmonare, tetralogia di Fallot o Tamponamento pericardico Volume intravascolare inadeguato: emorragie, disidratazione Quindi, tra le principali sincopi si riconoscono: • Sincope neurogena: questo termine si riferisce a tutte le forme di sincope dovute all’azione diretta sul sistema vascolare di segnali provenienti dal SNC, principalmente dal nucleo del tratto solitario. Un certo numero di stimoli, la maggior parte proveniente dai visceri, ma alcuni di origine psichica, è in grado di determinare questa risposta, che consiste in una riduzione o perdita del tono vascolare simpatico associata ad una aumento dell’attività vagale. Fisiologicamente, il nucleo del tratto solitario, localizzato nel bulbo, integra questi stimoli afferenti ed i normali segnali provenienti dai barocettori con i meccanismi simpatici efferenti, che mantengono il tono vascolare. Patologicamente, invece, risulta compromessa la capacità del SN simpatico di compensare la caduta della pressione arteriosa (sebbene il meccanismo vasodepressivo non sia del tutto chiarito: ad esempio, l’iniziale vasodepressione sarebbe dovuta ad un eccesso di efferenze adrenergiche, che causerebbe una vasodilatazione beta2‐mediata). Per i meccanismi capaci di indurre queste alterazioni, vedi la classificazione sopra. • Ipotensione ortostatica: interessa prevalentemente persone con alterazioni del sistema vasoregolatore periferico. Le due circostanze, che più frequentemente causano la sincope, sono il prolungato mantenimento della posizione eretta ed il passaggio dal clino‐ all’orto‐statismo. All’assunzione della pozione ortostatica, ad esempio, si verifica un’evidente caduta della pressione arteriosa, a livelli incapaci di sostenere la circolazione cerebrale. A differenza della sincope neurogena, non vi sono manifestazioni di tipo vegetativo, quali pallore, sudorazione, nausea o tachicardia compensatoria. Per le cause di ipotensione ortostatica, vedi la classificazione sopra, per la diagnosi vedi sotto. Diagnosi differenziale sincope‐epilessia Una delle patologie che più comunemente può confondersi con l’epilessia è la sincope, che può anch’essa manifestarsi con convulsioni; tuttavia vi sono numerosi aspetti peculiari, che ne consentono una distinzione: • Meccanismo fisiopatologico: o Sincope: insufficienza graduale del circolo cerebrale , nella sostanza reticolare attivante e nel talamo o Epilessia: rapida diffusione di un’anomalia elettrica • Relazione con le posture o Sincope: comune. Soprattutto di notte, con l’assunzione della posizione ortostatica, per l’ipotensione ortostatica conseguente al ridotto rilascio notturno di catecolamine, e durante la minzione, per lo sforzo in inspirazione, con aumento del sangue nei capillari polmonari, ridotto ritorno di sangue polmonare al cuore e diminuita gittata cardiaca, un paziente anziano può frequentemente andare incontro ad un attacco sincopale. La sincope in clinostatismo è rara. o Epilessia: no • Ora del giorno o S: diurna, cioè da svegli. Infatti, non si ha mai una sincope durante il sonno o E: diurna o notturna. Ci sono anche persone che hanno crisi epilettiche solo durante il sonno (sindrome di Morfeo): il sonno sembra, infatti, predisporre in generale alle crisi epilettiche. • Colorito della cute o S: pallore nelle fasi iniziali per l’ipoperfusione, talvolta cianosi nelle fasi tardive o E: non alterato, talvolta cianosi nelle fasi tardive • Periodo di aura o sintomi premonitori Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
S: lungo. Il paziente solitamente avverte che sta per svenire: la testa gira, il mondo ruota, la vista si offusca etc. o E: breve o brevissima Convulsioni: o S: rare (sincope convulsiva) o E: comuni Lesioni conseguenti alla crisi o S: rare o E: comuni con crisi convulsive, per l’immediata sospensione dei riflessi protettivi Incontinenza urinaria o S: rara o E: comune Confusione post‐ictale o S: rara. Il ripristino della coscienza è rapido o E: comune. Il ripristino della coscienza è più lento Cefalea post‐ictale o S: no o E: comune Segni neurologici focali o S: no o E: occasionali. Dopo una crisi motoria può verificarsi, ad esempio, una paralisi post‐critica (o di Todd), dovuta all’esaurimento dei motoneuroni corticali a seguito della crisi Segni cardiovascolari o S: comuni, specie nella sincope cardiaca o E: no EEG anomalo o S: raro. Può aversi un tardivo rallentamento diffuso con onde delta o E: comune o
•
•
•
•
•
•
•
•
Indicatori di disautonomia sono importanti nella diagnosi differenziale, soprattutto quando i parametri suddetti non sono risolutivi per distinguere tra sincope ed epilessia. La sincope neurologica è, infatti, principalmente una sincope vagale neuromediata: • Sintomi di intolleranza ortostatica: testa vuota, malessere con stanchezza e scarsa concentrazione, visione offuscata, tremore, vertigini, pallore, ansia, palpitazioni, ipersudorazione, nausea • Disfunzione erettile e sfinterica • Stipsi per ipomobilità dell’intestino • Bocca secca per iposalivazione • Irritazione oculare per iposalivazione • Anidrosi • Miosi o midriasi In caso di sospetta sincope un corretto iter diagnostico prevede: • In caso di storia clinica ed esame fisico normali, occorre prendere in considerazione una sincope riflessa. In questo caso si esegue il tilt testing o HUTT (head up tilt test): posto il paziente su di un tavolo basculante, cioè che si alza, con l’elevazione del corpo, la pressione arteriosa, e soprattutto quella diastolica, piuttosto che aumentare, diminuisce, accompagnandosi, inoltre, a bradicardia, confermando la disautonomia. Una pressocchè immediata caduta della pressione arteriosa è indicativa di ipotensione ortostatica, una caduta ritardata o provocata dall’isoproteneroloe di sincope neurogena. • In caso invece di evidenza all’anamnesi, all’esame clinico ed all’ECG, di una patologia cardiaca, la diagnosi sarà indirizzata verso una sincope cardiaca Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
In caso invece di frequenti casi di ipotensione ortostatica, basta porre il paziente in clinostatismo (al massimo con la testa inclinata di 5‐10°), misurargli la pressione e farlo scendere dal letto dopo 5‐10 minuti. Se la pressione, in particolare quella diastolica, si abbassa più del normale, la presenza di ipotensione ortostatica è confermata. Inoltre, occorre valutare la frequenza cardiaca: fisiologicamente, alla lieve caduta di pressione conseguente all’assunzione della posizione eretta, si accompagna tachicardia; se invece, in aggiunta all’eccessiva ipotensione, vi è bradicardia, la natura neurogena vagale, e quindi parasimpatica, è confermata In caso di copresenza di sintomi neurologici, bisogna sospettare delle malattie che causano i suddetti segni, ad esempio: neuropatia amiloiditica, neuropatia diabetica, atrofie multisistemiche (paralisi sovranucleare progressiva), etc Quindi, un corretto approccio diagnostico prevede: • Misurazione della PA in clino e poi in ortostatismo: l’ipotensione ortostatica è avvalorata da diminuzioni di quella sistolica >20mmHg o di quella diastolica >10mmHg • Misurazione della FC, in clino ed ortostatismo: un aumento della FC >15 indica una sincope non neurogena • Anamnesi o Farmaci: antipertensivi, triciclici, fenotiazine, insulina, barbiturici o Tossici: etanolo o Patologie associate: DM, PD, scompenso cardiaco, ipovolemia o Relazione temporale con pasti, risveglio mattutini, caldo, esercizio fisico La sincope neuromediata, in definitiva, può definirsi come una sindrome dominata dalla vasodilatazione, associata a bradicardia relativa o assoluta. La sua terapia prevede l’uso di amine simpatico‐mimetiche: etilefrina, medodrina. Altre diagnosi differenziali Occorre distinguere la sincope dal drop‐attack. Quest’ultimo è un disturbo che colpisce prevalentemente la popolazione anziana, viene spesso considerato, erroneamente, un TIA del territorio vertebro‐basilare, ed è caratterizzato dall’improvvisa perdita di tono muscolare con afflosciamento al suolo (“drop” significa goccia e si riferisce pertanto proprio alla caduta come una “goccia”) non accompagnata da perdita di coscienza. L’assenza di perdita di coscienza può essere l’elemento dirimente nella diagnosi differenziale con la sincope. Comunque, va differenziato, patogeneticamente, dal TIA, in quanto la causa del drop‐attack risiede in un’alterazione della sostanza reticolare discendente: infatti, un’ipoperfusione di questo territorio così selettiva, in assenza di altri segni, è improbabile. Più probabile è invece la patogenesi irritativa a carico del sistema simpatico, tipicamente causata nell’anziano dalla spondiloartrosi: ne deriverebbe un aumento del tono simpatico, con vasocostrizione di questo territorio. Il drop‐attack sarebbe più simile patogeneticamente alla sincope, con la differenza che, in questa, vi sarebbe un’alterazione anche della sostanza reticolare ascendente, con perdita di coscienza. L’emicrania basilare è un’altra condizione spesso difficile da distinguere dalla sincope. Colpisce prevalentemente bambini o giovani donne, che presentano: perdita di coscienza, , sintomi prodromici quali parestesie cheiro‐orali e disturbi campimetrici con scotomi, simili a quelli dell’emicrania con aura, ma bilaterali; altri possibili segni neurologici (instabilità ed incoordinazione degli arti, disartria); cefalea occipito‐nucale, seguita da perdita di coscienza o da stato confusionale o stuporoso. Questo quadro è molto simile a quello dovuto a lesioni nel territorio dell’arteria basilare. La presenza di dolore e dei sintomi prodromici, in assenza di altri disturbi autonomici, può essere l’elemento dirimente. Par II: Cefalee Emicrania L’emicrania è una malattia familiare caratterizzata da episodi cefalgici periodi, generalmente monolaterali e pulsanti, che iniziano nell’infanzia, nell’adolescenza o nei giovani adulti e ricorrono in maniera decrescente nell’età più avanzata. Colpisce il 15% delle donne ed il 6% degli uomini. Può essere distinta in emicranica senz’aura (emicrania comune), che si accompagna a nausea e vomito, ed emicrania con aura (emicrania classica o neurologica). Il tipo con aura è preannunciato da un chiaro disturbo neurologico, più spesso visivo (fotofobia, fotopsia, scotomi, scotoma scintillante, visione confusa od offuscata; sensazione di testa Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
vuota, dolorabilità del cuoio capelluto, parestesie a livello della faccia e della mano, vertigini, alterazioni dello stato di coscienza; questi sintomi durano da 1 a 15 minuti), seguito da una cefalea emicranica con nausea e vomito. Il dolore di carattere emicranico e pulsante, che evolve in un dolore sordo e diffuso, è la caratteristica più tipica rispetto ad altre forme di cefalea. Inoltre, si manifesta ad intervalli regolari, di settimane o mesi. È un evento critico, ma non un’emergenza: infatti, è autolimitante, ma a ricorrenza molto variabile. • Fattori scatenanti (spesso, comunque, fattori scatenanti non sono evidenti): o Luce, rumori, movimenti od urti della testa, profumi intensi o Periodo di tensione premestruale, mestruazioni, menopausa, contraccettivi orali (quindi i fattori ormonali sembrano avere un ruolo notevole: gli estrogeni riducono la frequenza degli attacchi, mentre il progesterone l’aumenta) o Alcuni alimenti (soprattutto cibi ricchi in tiramina come formaggio e cibi grassi), alcol (soprattutto il vino bianco), caffeina o Stress psico‐fisici, modificazioni dell’appetito (fame od anoressia) o del ciclo sonno‐veglia (soprattutto mancanza di sonno) • Fattori allevianti: sonno (è un grande “tranquillante”: persone con forte emicrania, riescono, se in condizioni adeguate, ad addormentarsi, senza ripresentare l’emicrania al risveglio), gravidanza, euforia, triptani • Sede: fronto‐temporale • Forme cliniche: o Comune: è quella senza aura o Classica: è quella con aura, cioè preceduta dai suddetti sintomi neurologici o Basilare (vedi sopra) o Carotidodinia: si ha un dolore che parte dalla carotide: il dolore, infatti, parte dal nucleo trigeminale inferiore o Sine dolore: si ha l’aura, ma non il dolore: quindi è solitamente benigna • Diagnosi differenziale o TIA: età, ricorrenza con segni d’aura diversi o Altri disturbi ischemici: età, ricorrenza senza lasciare segni • Profilassi: in caso di frequenza abbastanza elevata o Beta‐bloccanti: propanololo, atenololo o Antiepilettici: valproato, topiramato o Tricicilici: amitriptilina, nortriptilina o Calciantagonisti: flunarizina. Solitamente è il primo farmaco somministrato, che fa venire un po’ di sonnolenza e pertanto p consigliabile prendere prima di coricarsi • Terapia: triptani (agonisti recettoriali della serotonina) per os, per via nasale o sottocute Cefalea a grappolo Questo tipo di cefalea, che si manifesta prevalentemente in giovani adulti maschi (tra i 20 ed i 50 anni) è caratterizzato da una localizzazione orbitaria, costantemente monolaterale. Il dolore viene avvertito in profondità dentro ed attorno all’occhio, è di norma intenso e non pulsante e spesso si irradia alla fronte, alla tempia ed alla guancia. Un’altra caratteristica è la ricorrenza, in circa la metà dei casi, nelle ore notturne, con risveglio del malato; inoltre, si presenta senza aura né vomito. La cefalea tende a ripresentarsi, con sorprendente regolarità, alla stessa ora, tutti i giorni, per un periodo di 6‐12 settimane, dopo il quale si osserva una completa assenza di attacchi per diversi mesi (risultando,quindi, spesso stagionale). La ricorrenza del dolore è periodica in circa l’85% dei malati; invece, nel 10% circa dei casi diventa cronica. La cefalea è quindi intensa e profonda, raggiunge il picco di massima gravità del dolore in 5 minuti, dura 30‐120 minuti e tende a ripresentarsi a cluster, anche nello stesso giorno (“a grappolo”). Nel 70% circa dei casi è scatenata dall’alcol. I fenomeni, vasomotori e non, associati sono: lacrimazione, arrossamento e congestione congiuntivale, chiusura della narice, rinorrea, ptosi palpebrale, tutto dallo stesso lato del dolore. In circa il 50% dei casi il dolore insorge di notte e sveglia il malato. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
La profilassi si avvale di ergotamina o indometacina, del carbonato di litio o del prednisone, la terapia degli attacchi di triptani sottocute o dell’inalazione di 9L di ossigeno. Cefalea tensiva È la forma più comune di mal di testa: è generalmente bilaterale, spesso a prevalenza occipito‐nucale, temporale o frontale; in alternativa, ha una diffusione diffusa al vertice del cranio. Il dolore viene descritto come sordo e continuo, non pulsante, costrittivo, pungente o gravativo. L’esordio dell’attacco è graduale: la cefalea si continua però, in maniera fluttuante, per settimane, mesi od anni (cefalea cronica). Colpisce gli adulti, in prevalenza donne ed è scatenata da stress psico‐fisici. Si accompagna quasi sempre a sintomatologie ansioso‐depressive e si cura con analgesici, ansiolitici od antidepressivi. Par III: Altri disturbi acuti Amnesia globale transitoria È una sindrome acuta, ma non una vera e propria emergenza, con perdita della memoria, che rimette spontaneamente in ore e, nel 90% dei casi, non recidiva. Si tratta di un disturbo esclusivo della memorizzazione con preservazione, in genere, dell’identità personale e della rievocazione, riconducibile a spreading depression della corteccia del lobo temporale, in particolare infero‐mediale. La persona in crisi, in genere di età medio‐avanzata ed affetta da aterosclerosi o sottoposta ad intervento cardiochirurgico, appare molto agitata o preoccupata e chiede continuamente cosa stia accadendo e quali siano le coordinate spazio‐temporali. La diagnosi è clinica, quella differenziale va posta con le altre amnesie acute: traumatiche, ipossiche, ischemiche, alcoliche, psicogene. Delirium o stato confusionale acuto È un grave disturbo della coscienza: coinvolge anche la vigilanza, ma soprattutto la coscienza con alterazione dei contenuti. Il malato appare disorientato, disattento e soporoso (per l’alterazione della vigilanza) e spesso anche agitato (perché non si rende conto della sua condizione e di quella dell’ambiente). Risponde in modo finalizzato ad alcuni stimoli semplici e quindi non è in coma. La diagnosi sindromica è clinica, quella eziopatogenetica più complessa (cardiovascolare, respiratoria, metabolica, da tossici, infezioni, traumi, epilessia, demenza, abuso di farmaci e droghe, psicosi, tumori, AIDS‐demenza complex). Richiede un trattamento d’emergenza. Crisi isterica È la manifestazione eclatante di un grande malessere psichico, dominato dall’ansia, che può mimare diverse sindromi neurologiche, sempre apparentemente gravi: paralisi, convulsioni, cecità, visione “a cannocchiale” afasia etc. C’è restringimento, ma non perdita della coscienza: il paziente è consapevole di star male, ma non riesce a rispondere alle domande, né a muoversi, a seconda del tipo di paralisi. Il malessere è vero ed il quadro clinico grave, non una simulazione. Il neurologo deve saperla differenziare dall’apparente patologia neurologica mimata ed essere rassicurante. Comprensione, rassicurazione e suggestione possono risolvere la crisi, ma non la psicopatologia che la sottende. Nevralgia trigeminale ( o tic douloureux) È caratterizzata da parossismi di dolore lancinante (tic douloureux: il dolore può essere così intenso che il paziente arriva a sussultare) nella II o III branca del trigemino, raramente nella I branca, di brevissima durata (secondi), ricorrente(i parossismi ricorrono frequentemente, sia di giorno che di notte, per diverse settimane), precipitabile per stimolazione di zone grilletto (o trigger zone: anche una carezza od un soffio di vento sulla regione coinvolta o il semplice poggiare la guancia sul cuscino, oppure stimoli interni alla cavità orali, come il parlare od il mangiare). Solitamente si presenta in una sola branca, monolaterale. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Può essere idiopatica (tipicamente senile) o sintomatica (tipica del giovane: SM, patologie odontostomatologiche od otorinolaringoiatriche, anomali vascolari, tumori del trigemino): se idiopatica, l’esame neurologico non deve dimostrare alcun deficit della sensibilità nel territorio interessato dal dolore, si può solo avere allodinia, oltre al dolore vero e proprio. La terapia si avvale di: • Antiepilettici: pregabalin, carbamazepina (solitamente usata per prima) • Diatermocoagulazione della branca trigeminale coinvolta: un elettrodo riscaldante viene infilato fino al ganglio di Gasser. Ne deriva una coagulazione delle proteine, ad una certe temperatura, delle sole fibre A‐
delta e C, cioè di quelle dolorifiche, ma non delle altre sensibilità • Alcolizzazione con glicerolo • Decompressione chirurgica microvascolare della radice: in caso di evidenza di compressione vascolare sulla radice trigeminale Emergenze neurologiche Le più comuni emergenze neurologiche sono: • Cefalea intensa, come nessuna sofferta in precedenza. Infatti, se è ricorrente, è probabilmente un’emicrania o una cefalea a grappolo, non è un’emergenza o Gravativa: tipica dell’ipertensione endocranica, come in caso di tumori, ma anche dell’emorragia subaracnoidea o Pulsante: tipica delle malformazioni vascolari o Trafittiva • Disturbi acuti, non ricorrenti, dello stato di coscienza, transitori e non: se infatti sono ricorrenti, sono probabilmente dovuti ad epilessia o sincope e non sono un’emergenza. Se invece è alla prima manifestazione, il disturbo acuto dello stato di coscienza può essere dovuto a patologie vascolari, raccolte di sangue all’interno del cranio, tumori, prima crisi epilettica. • Amaurosi acuta completa: perdita di visus acuta completa monolaterale. Può essere un attacco ischemico in territorio carotideo • Amnesia acuta: può essere un’amnesia globale transitoria (vedi sopra), ma anche ad altre patologie. Infatti è possibile un’amnesia acuta in caso di intossicazione acuta alcolica; può essere anche dovuta ad un secondo infarto nel territorio dell’arteria cerebrale posteriore (dopo un primo infarto nella superficie infero‐mediale del lobo temporale di un lato, si ha un secondo infarto controlaterale). • Sindromi dolorose gravi: richiedono un trattamento analgesico d’emergenza (NB l’emergenza non è necessariamente da curare in una struttura sanitaria, ma può essere curata dal medico in loco). • Prima crisi epilettica o stato di male: in caso di prima crisi epilettica, è importante fare una corretta diagnosi, per evidenziare eventuali patologie scatenanti la crisi. In caso di male epilettico, l’intervento in emergenza è terapeutico (il male epilettico riflette sempre una condizione di epilessia) • Deficit neurologici focali ad esordio acuto: indicano un’emergenza vascolare (vedi MCV) • Deficit di forza degli arti ad esordio acuto/subacuto: in caso di disturbi che procedano dal basso verso l’alto, occorre pensare ad una patologia infiammatoria dei nervi periferici o delle radici nervose, che, proseguendo verso l’alto, può arrivare ad interessare la respirazione. Frequente è anche l’insorgenza di disfagia, con possibile polmonite ab ingestis • Insufficienza ventilatoria di grado moderato/marcato: si evidenzia con dispnea e cianosi • Contratture muscolari persistenti con o senza rabdomiolisi: un esempio è l’ipertermia maligna • Disfagia grave: è l’incapacità di deglutire cibi solidi e liquidi, anche la propria saliva. È abbastanza frequente in varie patologie del SN e della giunzione neuromuscolare e può condurre alla polmonite ab ingestis ed al soffocamento • Grave e persistenti disturbi del sonno: l’insonnia persistente può essere la manifestazione di una encefalopatia prionica, la sonnolenza persistente di un’encefalite virale o di un’intossicazione da farmaci sedativi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Patologie più frequentemente diagnosticate in emergenza sono: • Ictus cerebri ischemico od emorragico: poiché non è possibile conoscere già all’esordio l’evoluzione di un evento ischemico od emorragico, tutti i pazienti nella fase iperacuta di un ictus vanno considerati emergenze neurologiche in prognosi riservata. L’ictus emorragico, pur meno frequente, presenta un tasso di mortalità più elevato. o Tassi di mortalità dopo un primo attacco di ictus Ad una settimana: 12% : prevalentemente per danno cerebrale Ad un mese: 19% Ad un anno: 31%: prevalentemente per complicanze legate all’immobilità o Terapia dell’ictus in fase iperacuta Assistenza intensiva delle funzioni vitali • Mantenere pervie le vie aeree • Monitorare l’attività cardiaca e trattare precocemente eventuali infarti del miocardio od aritmie • Ottimizzare la pressione arteriosa • Provvedere ad eventuali disturbi della deglutizione • Trattare un’eventuale ipertermia • Fornire un corretto apporto idrosalino e calorico • Valutare la funzionalità renale • Controllare la glicemia • Assistere le funzioni sfinteriche Trattamento farmacologica dell’ictus ischemico • Trombolitico • Antiedemigeno: mannitolo, glicerolo • Altri: antiaggreganti, anticoagulanti, nifedipina, neuroprotettori Trattamento dell’ictus emorragico • Correggere le anomalie della coagulazione • Antifibrinolitici • Eventuale terapia chirurgica • Emorragia subaracnoidea o Principali cause Aneurismi cerebrali Traumi MAV Neoplasie cranio‐vertebrali Coagulopatie Vasculiti o Diagnosi Clinica: • Cefalea improvvisa, grave ed inspiegata, seguita da dolore che si irradia alle regioni occipitale e cervicale • Rigidità nucale • Vomito, fotofobia, letargia • Perdita di coscienza, di breve durata o permanente con coma apallico, stato vegetativo o morte cerebrale • Possibile sindrome locked‐in • Possibili sintomi neurologici focali da ischemia a valle per vasospasmo da irritazione o da emorragia meningo‐cerebrale • Possibili convulsioni Valutazione pressione arteriosa: un suo aumento accresce le probabilità di risanguinamento Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
TC: da effettuare non appena si sospetti questa diagnosi Puntura lombare: se la TC è positiva, non va effettuata per il rischio di sanguinamento dell’aneurisma; se negativa, va effettuata e dimostra il sangue nel liquor Angiografia digitale o angio‐RM: per evidenziare l’aneurisma o le altre malformazioni vascolari Terapia Farmacologica preoperatoria: anticonvulsivanti, nimodipina ev (serve per prevenire il vasospasmo e quindi l’ischemia a valle), antipertensivi, corticosteroidi Chirurgica Paralisi respiratoria acuta neurogena: molte malattie (vascolari, infettive, infiammatorie, neoplastiche etc) del SNC possono provocare insufficienza respiratoria attraverso il danneggiamento del centro respiratorio bulbare o delle sue connessioni col midollo spinale cervicale o toracico. Anche traumi, intossicazioni, dismetabolismi, abuso di farmaci sedativi, possono condurre a paralisi respiratoria. Questa condizione richiede la ventilazione assistita. Insufficienza ventilatoria da patologia neuromuscolare (neuropatie, malattie della giunzione, miopatie): il paziente lamenta debolezza e fatica, gli viene affanno quando parla ed usa i muscoli accessori della respirazione (pettorali, intercostali, scaleni, sternocleidomastoidei, etc). La debolezza del diaframma può essere rilevata dalla rientranza della parete addominale durante l’inspirazione. Particolarmente rischiosa è la concomitante disfagia. Vi sono condizioni a prognosi favorevole quale la sindrome di Guillaine‐Barrè (che determina, nelle fasi finali, deinnervazione dei muscoli respiratori), in cui la ventilazione assistita è necessaria, e condizioni a prognosi sfavorevole, come la fase finale di una neuropatia progressiva, come la SLA, o di una distrofia muscolare, in cui la ventilazione assistita andrebbe effettuata secondo la volontà del malato (può essere non invasiva con maschere o invasiva con tracheotomia). Stato di male epilettico di tipo tonico‐clonico: rappresenta un’emergenza. All’inizio gli attacchi assumono tipicamente la forma di crisi subentranti, ma distinte, di grande male. Col passare del tempo, tuttavia, l’attività motoria convulsiva si modifica, divenendo dapprima continua; poi, le clonie divengono meno marcate fino a cessare del tutto. Da questo momento, il paziente cadrà in uno stato di profonda incoscienza e la prognosi è sfavorevole. Questi stadi non si verificano in tutti i pazienti, possono essere modificati dalla terapia farmacologica ed il periodo di tempo fra uno stadio e l’altro è variabile. Può riconoscere diverse o Complicanze: Cerebrali • Danno cerebrale ipossico‐metabolico • Danno cerebrale indotto dalle convulsioni • Edema cerebrale con ipertensione endocranica • Emorragie ed infarti cerebrali • Trombosi dei seni venosi Cardiovascolari, respiratorie ed autonomiche • Ipotensione o ipertensione • Insufficienza cardiaca • Bradi‐ o tachi‐cardia • Arresto cardiaco • Shock cardiogeno Metaboliche • Disidratazione • Insufficienza renale acuta • Insufficienza epatica acuta Altre • CID • Insufficienza multiorgano o
•
•
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
• Rabdomiolisi Misure terapeutiche I stadio • Valutare la funzione cardiorespiratoria • Liberare le vie respiratorie • Somministrare ossigeno II stadio • Istituire un regolare monitoraggio • Terapia antiepilettica d’emergenza o Stato di male iniziale: diazepam o lorazepam ev, se necessario si passa as una somministrazione continua per fleboclisi di quantità variabili a seconda del risultato o Stato di male conclamato: fenitoina ev e/o fenobarbital o Stato di male refrattario: anestesia generale con fenobarbital (continuare l’anestetico per 12‐24 ore dalle ultime convulsioni cliniche o EEGgrafiche). Se ancora refrattario, una causa può essere l’ipocalcemia • Indagini di emergenza • Somministrare glucosio e/o tiamina • Trattare l’acidosi III stadio • Stabilire l’eziologia • Identificare e trattare le eventuali comolicanze IV stadio • Monitoraggio EEG • Terapia antiepilettica di mantenimento a lungo termine Ipertensione endocranica o Cause: Traumi cranici (ematomi extradurali, subdurali etc.) Cerebrovascolari (emorragia, infarto etc.) Idrocefalo Tumori Infezioni del SNC Encefalopatie metaboliche Stato di male epilettico o Diagnosi Storia sospetta (recenti cefalee, nausea, vomito, visione offuscata o confusa, diplopia) con o senza papilledema TC cranio Non eseguire mai una puntura lombare o Trattamento: dipende dalla diagnosi Tumori: desametasone ev, chirurgia Ascessi: aspirazione, escissione Idrocefalo: derivazione del liquor In caso di condizioni gravi e/o incoscienza • Intubazione e ventilazione assistita • Mannitolo ev Ipertermia maligna: si osserva, in individui suscettibili, durante l’anestesia generale (soprattutto con alotano e succinilcolina; per la patogenesi vedi la lezione sui meccanismi eziopatogenetici). È caratterizzata da rapida elevazione della temperatura corporea, irrigidimento muscolare, particolarmente evidente a livello o
•
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
mascellare, ed elevata mortalità, dovuta a collasso cardiocircolatorio, conseguente a tachipnea e tachicardia (per l’aumento del consumo di ossigeno). La terapia si basa sull’utilizzo del dantrolene • Paralisi periodiche diskaliemiche: possono essere responsabile di una paralisi acuta degli arti, ma a differenza delle policardicolonevriti non portano ad insufficienza respiratoria. Tuttavia, possono portare ad alterazioni del ritmo cardiaco • Traumi encefalo‐midollari: possono dare deficit neurologici focali, disturbi della memoria, disturbi della coscienza • Encefalopatie dismetaboliche e tossiche • Poliradicolonevriti subacute: causano soprattutto disturbi di forza • Miastenia gravis: può dare anche disfagia ed insufficienza respiratoria • Tumori del SN ed altre cause di ipertensione endocranica: possono causare crisi epilettiche, cefalea intensa come nessuna delle precedenti o deficit neurologici focali per sindromi ictali • Delirium tremens ed altre sindromi d’astinenza • Neuropatie associate a dolori nevralgici: nevralgia trigeminale, rizopatia da compressione • Infezioni del SN e dei suoi involucri ad esordio acuto/subacuto L’iter diagnostico‐terapeutico prevede: • Inquadramento sindromico del tipo d’emergenza: la valutazione neurologica si avvale dei seguenti quesiti (spesso, tuttavia, il paziente è incosciente o confuso, non riuscendo a fornire adeguate informazioni) o Sintomi neurologici focali o non focali? o Deficitari (ad esempio perdita di una funzione) o di tipo irritativo (parestesie, crisi epilettiche, dolore)? o Comparsa improvvisa? o Sintomi focali massimi all’esordio o a carattere progressivo? o Quali sono le parti del SN interessate? o Danno anatomico, funzionale o entrambi? o Fattori predisponenti o scatenanti l’attacco acuto? o Precedenti eventi analoghi? o Da quali patologie note è affetto il paziente? o Fattori di accompagnamento dell’evento acuto? • Supporto delle funzioni vitali se necessario e terapia sintomatica (ad esempio analgesici, sedativi etc) • Ricerca del meccanismo eziopatogenetico • Terapia eziopatogenetica e supporto riabilitativo Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ I PROF. PUOTI Fisiopatologia delle funzioni cognitive Par I: Generalità Le funzioni cognitive Le principali funzioni cognitive sono: • Orientamento: è la capacità di esprimere correttamente le proprie coordinate essenziali in relazione al tempo, allo spazio ed alla nostra identità personale, come risultato di tutta l’esperienza fatta in passato fino a quel momento e proiettata nel futuro e nel presente. Tipicamente nelle malattie dementigene (come nella demenza di Alzheimer) una delle prime funzioni persa è proprio l’orientamento temporo‐spaziale, poi viene perso anche l’orientamento personale. Non è possibile stabilire con esattezza la regione anatomica che se lesionata può portare a disturbi dell’orientamento: diverse regioni cerebrali cooperano per questa funzione • Percezione: non è semplicemente il processo di arrivo degli stimoli al SN, ma è un processo attivo di elaborazione e di integrazione di questi: pertanto, sarebbe più opportuno parlare di appercezione. In tal senso, la percezione è intesa semplicemente come l’insieme degli input in entrata nel cervello tramite le vie sensoriali, l’appercezione è invece intesa come l’elaborazione e l’integrazione di quegli input. A tal fine sono fondamentali le aree di associazioni multimodali: esse ci consentono l’integrazione e l’associazione non solo delle informazioni sensoriali di un preciso momento, ma anche di quelle passate e future, allo scopo di meglio dirigere le attività. Comunque, si distinguono componenti principali di percezione uditiva, tattile e visiva, ed ulteriori sottocomponenti più specializzate (es. percezione per i volti, colori, rapporti spaziali, ecc.). • Abilità costruttive: capacità di pianificare e realizzare azioni dotate di rapporti spaziali complessi, per esempio assemblare oggetti, disegnare, costruire modelli tridimensionali • Ragionamento: è l’insieme delle operazioni mentali che mettono in relazione due o più unità elementari (ad esempio: sommare numeri). Sono prevalentemente frontali, e soprattutto dell’emisfero dominante, quindi solitamente il sinistro, la capacità di ragionamento, di astrazione, di pianificazione, di critica e di giudizio • Funzioni esecutive: abilità di livello gerarchico più elevato (nel cervello infatti c’è una gerarchia: cioè esistono aree specializzate la cui integrazione conduce ad aree ancora più specializzate: aree primarie, secondarie, terziarie), che comprendono la capacità di decidere se e come impegnarsi in una certa azione, la capacità di stabilire obiettivi e scopi, la capacità di pianificare, controllare e correggere l’azione in corso, ecc. • Intelligenza generale: è il risultato dell’utilizzo efficace delle diverse funzioni cognitive specializzate, che di solito si riflette in un vantaggio adattativo • Attenzione: capacità di assegnare, distribuire e mantenere le risorse cognitive disponibili in funzione del compito da svolgere; risente di interferenze di altri sistemi, è regolata soprattutto dalla sostanza reticolare ascendente (che provvede con la sua distribuzione ad ventaglio ad attivare la corteccia)e dai nuclei talamici. L’aspetto motivazionale, regolato da strutture cerebrali più profonde ed emozionali, quali amigdala ed ippocampo risulta fondamentale per l’attenzione, a sua volta fondamentale per l’apprendimento, senza il quale non si memorizza. Si distinguono solitamente : o Attenzione divisa: è la capacità di prestare attenzione ed elaborare diverse informazioni che si presentano contemporaneamente. Sedi di lesione, in caso di sua perdita, sono prevalentemente diffuse, con una maggiore estensione a carico dell’emisfero destro, ma anche a carico del corpo calloso, del lobo frontale e parietale. Il paziente affetto da Alzheimer od anche una persona normale ma molto anziana non riesce a seguire un discorso di più persone nella stessa stanza, perché la sua attenzione divisa si è indebolita o Attenzione selettiva: permette di concentrarci su uno o più stimoli target (visuo‐spaziali e uditivo‐
verbali selezionandoli tra altri stimoli distrattori o tra informazioni in competizione tra loro). Sedi di lesione sono lobo frontale sinistro ed asse troncoencefalo‐talamo‐corteccia frontale, a livello parietale in caso di sindrome da negligenza spaziale o Attenzione sostenuta: è la capacità di mantenere l’attenzione su stimoli target per un protratto periodo di tempo. Sedi di lesione sono soprattutto nell’emisfero destro, coinvolto maggiormente nel mantenimento dell’attenzione, a livello prefrontale, parietale posteriore e temporale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Apprendimento: consente di acquisire nuove informazioni prelevandole dalla realtà Memoria: si distingue in: o Memoria a breve termine: capacità di ritenere fedelmente gli stimoli percepiti per brevi periodi di tempo (fino a circa 30‐60 secondi). È un deposito temporaneo a capacità limitata (nei pazienti con demenza di Alzheimer, ma in parte anche con l’anzianità, è questa a perdersi, e non quella a lungo termine: per una sorta di legge di “proporzionalità inversa”, quanto meno è vicino il ricordo, tanto più si conserva). o Memoria a lungo termine: capacità di ritenere in modo stabile gli aspetti salienti degli stimoli percepiti. È un deposito permanente a capacità virtualmente illimitata. Si compone di: Memoria esplicita o dichiarativa che usiamo continuamente in maniera ricercata e ragionata, riguarda l’apprendimento di nuove informazione basate su nuovi dati e si divide a sua volta in: • Memoria episodica: che riguarda gli episodi della nostra vita ed ha una grossa componente autobiografica; denota un sistema di memoria utilizzato per datare le esperienza personali e le loro relazioni temporali (si ricorda che questa distinzione tra i vari tipi di memoria non è puramente didattica, ma basata su dati clinici che riguardano la perdita di uno dei sottotipi di memoria in determinate patologie: ad esempio la memoria episodica è persa nella sindrome amnesica transitoria, mentre quella semantica è conservata) • Memoria semantica: che riguarda il significato delle parole, costituisce il bagaglio individuale di conoscenza percettiva e fattuale, che rende possibile comprendere il linguaggio e compiere differenze (in realtà riguarderebbe il significato del contesto sociale dell’individuo). Memoria implicita o non dichiarativa: è la memoria procedurale (ad esempio guidare la bicicletta, la macchina),a lungo termine, automatica, riguarda l’apprendimento di capacità manuali. Vi è anche una memoria implicita visiva, con la funzione di rievocazione di rappresentazioni visive. Meccanismi di memorizzazione e circuiti preposti Alla base dei processi di memorizzazione vi è il sistema limbico, costituito da: • Giro paraippocampale • Giro del cingolo: a sua volta costituito da: ippocampo, che ha il compito di filtrare le informazioni in arrivo attraverso una continua comunicazione con la corteccia, e corpo calloso • Amigdala: considerata il “cervello emozionale”, ha stretti rapporti con l’ipotalamo: da questa interazione ipotalamo‐amigdala‐ippocampo scaturisce la connotazione emozionale dello stimolo e del ricordo • Circonvoluzione del cingolo e fornice Le informazioni provenienti da un’ampia rete di neuroni corticali sono convogliate al giro dentato e, successivamente, alle cellule piramidali del corno di Ammone (CA); le efferenze ippocampali provengono prevalentemente dalle cellule piramidali di CA1 e del subiculum. Tra i circuiti più importanti del lobo limbico si ricorda il circuito di Papez: gli assoni originati dal subiculum, attraverso il fronice, fanno sinapsi a livello dei corpi mammillari ipotalamici; da qui parte fascio di Vicq d’Azir che proietta dai corpi mammillari ai nuclei talamici anteriori, che a loro volta proiettano al giro del cingolo ed all’ippocampo. Questo circuito, per la lesione dei corpi mammillari ipotalamici, è alterato nella sindrome amnesica di Korsakoff. Secondo la teoria di consolidamento dei sistemi, l’ippocampo non è sede di deposito dei ricordi, ma svolge un ruolo cruciale nella creazione di nuovi ricordi: l’ippocampo sarebbe un sistema a capacità limitata che acquisisce rapidamente ed automaticamente le informazioni, senza però mantenerle a lungo; col tempo, poi, l’informazione originariamente disponibile nell’ippocampo diviene permanente in altre strutture del cervello, in particolare, corticali: il meccanismo responsabile di questo trasferimento è la riattivazione delle configurazioni di attività neurali, forse in particolare durante il sonno. La corteccia non memorizza i dati in maniera seriale, ma in maniera associativa, quasi come fosse un ologramma, tramite appunto un complesso sistema di associazioni, integrazioni ed elaborazioni. Gli elementi visivi, uditivi, olfattivi, verbali registrati su aree corticali diverse (cortecce sensitive primarie), ma simultaneamente, sono convogliati verso un unico gruppo neuronale (ippocampo) in cui risultano associati in un'unica situazione contestuale: tale insieme di informazioni soggiornerà, in questa sorta di buffer di memorie episodiche, Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
per settimane o mesi, finché non verrà trasferito ad aree corticali con alta densità cellulare ed eventualmente classificato ed inquadrato temporalmente Questa stimolazione all'indietro (ippocampo ‐‐> corteccia sensitiva primaria) comincia circa 100millisecondi dopo l'inizio e trova quindi le sinapsi, da cui il processo è partito, ancora attive e quindi in quello stato di modificabilità sinaptica che dura circa 1 secondo: lungo tutto il percorso si verificheranno dunque delle modificazioni sinaptiche che determinano il formarsi di sinapsi forti o, nei termini di Edelmenn, di selezionare un circuito secondo un processo di darwinismo neuronale, cioè privilegiando un circuito e, quindi, un tipo di informazioni rispetto ad altre. Ne deriva, comunque, un continuo e proficuo scambio tra strutture limbiche e corticali: la corteccia fornisce le informazioni su ciò che sta accadendo al sistema limbico; questo le riveste di una componente emozionale e le reinvia alla corteccia per l’ulteriore elaborazione. La neuroplasticità, a questo livello, svolge un ruolo preponderante nella memorizzazione: infatti, essa consente, attraverso la modifica dei rapporti sinaptici, l’elaborazione e l’eventuale memorizzazione dei dati in arrivo; ciò avviene grazie a modifiche strutturali, cioè all’attivazione, tramite segnali elettrici o chimici, di geni che codificano per proteine coinvolte nella modulazione sinaptica. Alla base di questa neuroplasticità, vi è il fenomeno della long term potentiation (LTP), aumento a lungo termine nella trasmissione del segnale tra due neuroni che si ottiene stimolandoli in maniera sincrona, su basi glutammatergiche: per indurre potenziamento a lungo termine è necessario che la membrana post‐sinaptica sia depolarizzata nell'intervallo di tempo in cui il terminale pre‐sinaptico libera glutammato. Il legame con il glutammato apre i canali dei recettori AMPA (in cui passano ioni sodio e potassio), mentre la depolarizzazione che ne consegue fa staccare gli ioni magnesio per repulsione elettrostatica dai recettori NMDA consentendo il passaggio (oltre al sodio e al potassio) anche agli ioni calcio: il calcio è l'elemento centrale del processo perché, una volta raggiunta una certa concentrazione nella cellula, è in grado di attivare la CaMKII, una chinasi calcio e calmodulina‐dipendente, in grado a sua volta di apportare modifiche nella citoarchitettura. I recettori AMPA presenti nella cellula vengono trasferiti sulla membrana e i recettori già presenti lasciano passare una maggiore quantità di ioni; inoltre, il calcio è in grado di attivare un secondo processo che porta alla creazione di nuovi recettori AMPA che, una volta inseriti nella membrana, modificano permanentemente la forza di connessione. Un evento del tutto fisiologico di breve durata è quindi in grado di causare una modifica sinaptica duratura: il neurone bersaglio rafforzato dalla LTP è molto più responsivo e produce EPSP più ampi per molto tempo. È inoltre chiaro che, a discrezione della corteccia cerebrale, neuroni modificati con LTP, devono poter essere "resettati" e riportati alle "condizioni di partenza". Tra i correlati neuropatologici caratterizzati da alterazioni delle strutture limbiche, con alterazione dei processi di memorizzazione, vi sono l’ischemia ippocampale e la demenza di Alzheimer. Linguaggio Il linguaggio può essere definito come la comprensione, la formulazione e la trasmissione di idee e sentimenti tramite l’uso di segni, simboli, suoni e gesti della loro sequenzializzazione secondo regole grammaticali: il particolare tipo di linguaggio utilizzato dall’uomo, insieme alla destrezza nell’uso delle mani (in particolare della destra: quindi l’emisfero sinistro, sede delle aree per il linguaggio e delle aree per la mano destra, risulta decisamente importante nella filogenesi dell’uomo) risulta caratterizzante l’uomo rispetto agli altri animali. Infatti, il linguaggio umano è simbolico, caratterizzato dalla capacità di produrre ed utilizzare simboli verbali, sia come base per la nostra ideazione sia come mezzo di trasmissione orale e scritta dei nostri pensieri, mentre il linguaggio degli altri animali (ed anche degli uomini primitivi) è di tipo emozionale, caratterizzato quindi dalla comunicazione paralinguistica (intonazione, espressione del volto, movimenti degli occhi, gesti del corpo: anche le aree del linguaggio preposte a tale scopo sono diverse: nel linguaggio emozionale le aree coinvolte sono diencefaliche ed ipotalamiche; ciò è caratteristico in quanto, nell’uomo, a seguito di afasie di Broca può accadere che un paziente, pur incapace di linguaggio compiuto, emetta parolacce, bestemmie od altre frasi esclamative). Il linguaggio simbolico si è andato sviluppando tramite una complessa serie di aree focali e specializzate: in primis, ricordando la grossolana distinzione del cervello in aree anteriore, parte esecutiva del cervello, come il lobo frontale per le funzioni motorie, e posteriore, parte percettiva del cervello, come le aree sensitivo‐sensoriali, si può fare una distinzione tra aree deputate alla decodificazione del linguaggio ed aree deputate alla produzione del linguaggio. Le aree del linguaggio possono considerarsi tutte perisilviane, ossia intorno alla scissura silviana, nell’emisfero sinistro, e distinte in 4 aree principali, le prime due decodificative e le seconde due produttive: • Area di Wernicke: principale area recettiva, responsabile della percezione del linguaggio (e della sua decodificazione, ossia della sua trasformazione in simboli), occupa la regione temporale posteriore/postero‐superiore (parte posteriore dell’area 22) ed il giro di Heschl (aree 41 e 42) • Area del giro angolato, nel lobo parietale inferiore (area 39), anteriormente alle aree visivi: è preposta alla percezione del linguaggio scritto. A queste due aree percettive principale va Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
sicuramente aggiunta la corteccia uditiva primaria, in cui arriva lo stimalo uditivo, che sarà inviato alla corteccia di Wernicke e lì interpretato come simbolo Area di Broca: situata a livello della parte terminale posteriore della circonvoluzione frontale (area 44), è in rapporto con gli aspetti motori ed espressivi del linguaggio Area di scrittura di Exner: sarebbe preposta alla produzione del linguaggio scritto, ossia della scrittura Queste aree sensoriali e motorie sono connesse tra loro tramite una ricca rete di fibre nervose: un voluminoso fascio di queste fibre, il fascicolo arcuato, passa attraverso l’istmo del lobo temporale ed attorno alla parte più posteriore della scissura silviana (una lesione in questa sede causerebbe un’afasia transcorticale o di conduzione). Da questa definizione anatomica deriva una classificazione focale dei disturbi del linguaggio: • Afasia motoria o di Broca: è un disturbo primitivo della produzione del linguaggio, con relativo risparmio della comprensione, localizzato nell’area sovrasilviana frontale; l’eloquio è non fluente, difficoltoso, agrammaticale fino ad essere completamente assente nelle forme più gravi. In alcuni casi possono essere ripetute continuamente frasi semplici o stereotipate od esclamazioni impulsive; vi può essere, talvolta, come segno associato, una debolezza dei muscoli del braccio destro e della parte posteriore della faccia. Quasi sempre sono associati disordini della scrittura; talvolta anche la comprensione è alterata. Le cause più frequenti di questa lesione sono: infarto embolico nel territorio del ramo superiore dell’arteria cerebrale media, trombosi aterosclerotica, tumori, emorragie, crisi epilettiche • Afasia di Wernicke: è caratterizzata da perdita della comprensione della parola, determinata dall’incapacità di differenziare tra loro gli elementi della parola o fonemi, sia scritti che parlati, e da eloquio fluente ma parafasico (cioè pronuncia parole diverse dai sostantivi da utilizzare od inappropriate): l’eloquio pur se corretto grammaticalmente, è completamente privo di significato informativo; la lesione è localizzata nel lobo temporale superiore laterale sinistro. Il paziente gesticola molto, è agitato, ma, al contrario dell’afasia di Broca, è inconsapevole del deficit: comunque, data la difficoltà nella comprensione, l’integrazione sociale è notevolmente difficoltosa. Possono essere associate: dislessia (difficoltà nella percezione visiva di lettere e parole), emi‐ o quadrant‐anopsia • Afasia totale o globale: è dovuta alla distruzione di gran parte dell’area del linguaggio con coinvolgimento dell’area di Broca, di Wernicke e di gran parte del terriotorio compreso tra queste due regioni. Tutti gli aspetti del linguaggio sono colpiti ed è quasi sempre accompagnata da emiplegia, emianestesia ed emianopsia omonina destre di grado variabile • Afasia di conduzione: dovuta ad un’alterazione a livello del fascicolo arcuato, risulta caratterizzata da grave compromissione della ripetizione, relativo risparmio della comprensione (fatto che la differenzia dall’afasia di Wernicke a cui, peraltro, è molto simile), linguaggio fluente con parafasie • Afasia anomica (o amnesica o nominale): l’anomia, ossia l’incapacità di trovare le parole (spesso può consistere solo nell’incapacità di nominare un oggetto), è caratteristica di quasi tutte le afasie, nonché di alcune demenze, compresa quella di Alzheimer; tuttavia, si impiega il termine afasia anomica quando l’anomia è l’aspetto di più evidente rilievo nel disturbo. E’ solitamente dovuta a lesioni nel lobo temporale posteriore o medio, con interruzione delle connessioni tra aree sensoriali del linguaggio ed aree ippocampali legate all’apprendimento ed alla memoria. • Afasia transcorticale: la caratteristica distintiva di questi disturbi del linguaggio è il risparmio della capacità di ripetizione; si riconoscono afasie transcorticali: o Sensoriali: è simile all’afasia di Wernicke, ma con la capacità di ripetizione ben conservata, e localizzata nell’area parieto‐occipitale posteriore o Motoria: il paziente non riesce ad iniziare una conversazione ed emette solo qualche sillaba; la comprensione e la ripetizione sono conservate; sarebbe dovuta ad un’interruzione tra l’area di Broca e l’area motoria supplementare • Afasia sottocorticale: può essere o Anteriore: la lesione è a livello di nuclei della base o della capsula interna o Posteriore: la lesione è a livello dei nuclei talamici Altre sindromi • Aprassia: è una condizione in cui, in assenza di disordini neurologici elementari motori o sensoriali, si manifesta difficoltà od incapacità nell’eseguire movimenti volontari finalistici o meno; risulta quindi un disordine di pianificazione delle strategie di movimento e di programmazione ed organizzazione degli stessi. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
E’ contraddistinta da una dissociazione automato‐volontaria: lo stesso gesto, prontamente eseguito quando richiesto da esigenze contestuali od interiori, fallisce se richiesto dall’esaminatore, senza quindi motivazioni interne od esterne (vedi anche lezione Melone) • Agrafia: disordine della scrittura della parole o Centrale: lessicale (il soggetto utilizza solo le procedure fonologiche e non quelle lessicali: scrittura di “faiv” al posto di “five”), fonologica (difficoltà fonologiche, il soggetto non riesce a scrivere parole senza senso), profonda (il soggetto commette errori semantici: tempo al posto di orologio, sedia al posto di tavolo) o Periferica: da neglet (mancata scrittura di parte di una parola o di una lettera), aprassica (incapacità di compiere i movimente gestuali), ideatoria, spaziale • Sindrome da negligenza spaziale: il paziente si comporta come se non fosse più in grado di concepire e percepire l’esistenza del lato corporeo ed extracorporeo controlaterale. Caratteristiche principali sono: mancata risposta agli stimoli controlaterali, significativa diminuzione dei movimenti esplorativi verso il lato controlaterale, presenza della sintomatologia anche in assenza di deficit sensoriali o motori. Nei casi più gravi i pazienti possono evidenziare una numerosa serie di sintomi, quali la deviazione ipsilesionale di occhi e capo, la tendenza a non usare, anche in assenza di emiparesi, l'arto contro lesionale (neglect motorio), la mancata interazione con persone presenti nello spazio negletto o l'omissione nell'uso o nella 'percezione' (pur in assenza di deficit percettivi) di oggetti posti nello spazio negletto. Qualora la lesione sia meno grave oppure nella fase subacuta di neglect conclamato, il soggetto può essere capace di interagire con gli oggetti presenti nello spazio contro‐lesionale, ma solo in alcune circostanze; più precisamente, il paziente si dimostra consapevole di tali oggetti solo in assenza di stimoli distrattori collocati ipsilesionalmente. Se, viceversa, due stimoli sono presentati contemporaneamente, uno nell'emicampo sano •
e l'altro in quello contro‐lesionale, quest'ultimo verrà negletto. Questo fenomeno è noto in letteratura come estinzione. Le aree corticali più frequentemente coinvolte sono la parietale ed in misura minore la frontale.
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE II PROF PUOTI Disturbi neurologici conseguente a lesioni di zone cerebrali specifiche Par I: Basi neuroanatomiche Generalità La corteccia cerebrale è organizzata in maniera molto peculiare, per cui vi sono aree primarie, ossia aree specifiche destinate a funzioni specifiche, come motricità e sensibilità (10%), ed aree associative non destinate a funzioni specifiche, ma a funzioni di grado più elevato, quali attenzione, vigilanza, pensiero, intelligenza, etc (90%); ciò risulta, date l’elevata ridondanza delle aree associative e la localizzazione diffusa delle funzioni associative, in una prevalenza nettamente maggiore dei disturbi specifici focali. Partendo da considerazioni strettamente anatomiche e tramite l’utilizzo dell’elettrostimolazione, Brodman ha distinto le aree associative da quelle frontali e quest’ultime in 47 aree: ad ogni corrisponderebbe una funzione specifica: ad esempio, l’area 17 è la corteccia visiva primaria, le aree 41‐42 la corteccia uditiva primaria, l’area 44 l’area di Broca e così via. Comunque, si può considerare la corteccia come un insieme eterogeneo di vari sistemi anatomici, ciascuno con un proprio dispositivo complesso di collegamento intracorticale e connessioni diencefaliche. Una prima distinzione è quella tra emisfero sinistro ed emisfero destro: il cervello sinistro, che lavora in maniera sequenziale ed analitica, è deputato ai processi cognitivi ed all’organizzazione razionale della progettazione e dell’attuazione degli enti, nonché al linguaggio; il cervello destro, che lavora in parallelo, cioè in maniera simultanea ed olistica, è deputato ai processi creativi, alla socializzazione, alla musicalità, all’arte, le tonalità paralinguistiche del linguaggio. Par II: Sindromi da lesioni di zone cerebrali specifiche Lesioni dei lobi frontali I lobi frontali si trovano davanti al solco centrale o rolandico e sopra la scissura silviana: sono più estesi negli esseri umani (un terzo dell’intero cervello) che negli altri animali. Vi si trovano: • Area 4: corteccia motoria primaria • Area 6: corteccia motoria supplementare • Area 8: corteccia oculomotoria e corteccia premotoria • Area 44: area di Broca (solo nell’emisfero dominante) • Giri orbitali mediali e le porzioni anteriori dei giri del cingolo: sono parte del sistema limbico e partecipano al controllo di funzioni vegetative • Aree prefrontali (aree da 9 a 12 e da 45 a 47): particolarmente sviluppate negli esseri umani, rivestono un ruolo preponderante nell’iniziare movimenti pianificati e nel controllo esecutivo di tutte le operazioni mentali Può, dunque, suddividersi la patologia frontale (oltre che in patologie corticali e della sostanza bianca) in: • Sindromi lobari eccitatorie o Area motoria primaria: crisi focali motorie: si hanno contrazioni toniche e poi cloniche che esordiscono al livello dell’emivolto o di una porzione limitata di un arto, per poi espandersi a tutto l’emisoma colpito controlaterale (marcia jacksoniana) o Area motoria supplementare: crisi posturali: assunzione di posture anomale per manifestazioni toniche o Area oculomotoria: crisi versive: deviazione occhi e testa, solitamente con abduzione ed elevazione dell’arto superiore omolaterale o Giro del cingolo anteriore: crisi son automatismi motorie: ipermotricità, scalciamento, agitazione frenetica con possibili manifestazioni affettive, ansia o terrore, e/o vegetative, rossore o pallore (pseudocrisi psicogene) o Circonvoluzione frontale inferiore dell’emisfero dominante: crisi fonatorie con impossibilità di parlare Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Sindromi deficitarie o Deficit motori: sindrome piramidale (vedi lezione Melone) per lesioni nell’area motoria primaria e premotoria mutismo, emiinattenzione motoria controlaterale ed incoordinazione bilaterale per deficit nell’area motoria supplementare paralisi del movimento di rotazione controlaterale degli occhi per lesioni nell’area oculomotoria o Afasia di Broca (vedi lezione precedente) o Sindrome prefrontale: si verificano compromissione delle capacità motorie (risposte di prensione forzata, di suzione e di appoggio, tendenza ad imitare i gesti dell’esaminatore ed a manipolare in maniera compulsiva gli oggetti situati di fronte al paziente, riduzione dell’attività motoria, perseverazione od insistenza motoria e rigidità paratonica alla manipolazione passiva degli arti) ed alterazioni della sfera cognitiva e della personalità (perdita di iniziativa, inattività, perdita dell’attività intellettiva e della memoria, perdita della capacità di pensiero astratto, rallentamento psicomotorio associato a facile distraibilità, diminuzuione delle capacità di problem‐solving, inerzia nel pensiero e nel linguaggio fino al mutismo acinetico). Si distinguono sindromi apatiche (corteccia prefrontale mediale) sindromi diseducative con deficit cognitivi ed intellettivi (corteccia prefrontale dorsolaterale) sindrome disinibita con alterazioni di personalità e comportamento (corteccia orbitofrontale): in questi casi, comunque, il deficit deve essere esteso e bilaterale per dare segni evidenti (vedi sopra) o Alterazioni del giro cingolato anteriore del giro frontale superiore: perdita del controllo di minzione e defecazione Lesioni dei lobi parietali Situati dietro il solco rolandica e sopra la scissura silviana, ma senza confini ben definiti col lobo occipitale, e temporale, è al suo interno delimitata dal solco post‐centrale, che segna il confine dell’area somestetica, e dal solco intraparietale, che divide i lobi parietali posteriori in superiore (importante area associativa) ed inferiore (costituito da giro sopramarginale e giro angolato, implicate nella comprensione del linguaggio scritto). Si può grossolanamente dividere la corteccia parietale in un’area postcentrale recettiva somato‐sensitiva, ed in una restante area, molto più sviluppata nell’uomo che negli altri animali, associativa. In definitiva, la funzione principale del lobo parietale è quella di rappresentare il centro integratore delle sensazioni somatiche con le informazioni visive ed uditive per fornire la consapevolezza del corpo (schema corporeo) e dei suoi rapporti con lo spazio extrapersonale; altre funzioni fondamentali sono quelle di comprensione del linguaggio scritto e di fornire l’input motorio al lobo frontale (non presente nell’aprassia ideomotoria). Anche per lesioni del lobo parietale possono aversi: • Sindromi eccitatorie: crisi parestetiche con formicolii, dolore, sensazioni di scariche elettriche (con possibile marcia jacksoniana) • Sindromi deficitarie: o Sindrome corticale sensitiva: caratterizzata da deficit controlaterale della sensibilità discriminativa, con diminuzione o perdita del senso di posizione, della percezione del movimento passivo, della capacità di localizzare gli stimoli tattili, pressori, vibratori, termici e dolorifici, di distinguere gli oggetti dalle loro dimensioni, ma con integrità della percezione dolorifica, tattile, etc, è dovuta a lesioni nella corteccia parietale post‐centrale ed è spesso associata ad una lieve emiparesi (alcune fibre piramidali partono da quest’area) o Somatoagnosia: incapacità di riconoscere parte del proprio corpo, può manifestarsi come anosognosia, in cui il paziente è indifferente al suo deficit o le nega (è quindi un deficit della sensibilità somatica con perdita dello schema corporeo, negazione concettuale della paralisi, non Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
coscienza di metà del corpo e disturbo della percezione visiva: tale sindrome deriva da lesioni del lobulo parietale superiore, in particolare destro, cioè quello non dominante), o come emiinattenzione spaziale, in cui il paziente ignora completamente il mondo controlaterale alla lesione, con aprassia costruttiva (il paziente non disegna metà degli oggetti, come case od orologi) o dell’abbigliamento (il paziente non rade o non veste metà del corpo: anche tali disturbi derivano da alterazioni dell’emisfero non dominante) Stereoagnosia (od agnosia tattile): il paziente, per lesioni nel lobo parietale sinistro nel giro post‐
ventrale, è incapace di riconoscere, con entrambe le mani, gli oggetti con il solo senso tattile (se la lesione è nel lobo destro, l’agnosia tattile potrebbe riguardare solo la mano controlateral). Cause più frequenti sono ictus, malattie neurodegenerative e neoplasie Disorientamento spaziale e disturbi della localizzazione spaziale topografica Sindromi da lesioni dell’emisfero dominante (solitamente il sinisto) Sindrome di Gerstmann: deriva da una lesione nel lobulo parietale inferiore sinistro e risulta caratterizzata da agnosia digitale (incapacità a denominare le dita della mano), incapacità a discriminare destra e sinista, discalculia, agrafia Aprassia ideativa ed ideomotoria: i pazienti perdono la capacità di eseguire particolari ma anche semplici compiti motori (vedi lezione Melone) Disturbi del linguaggio: alessia Sindromi da lesioni dei lobi temporali La scissura silviana separa la parte superiore di ciascun lobo temporale dal lobo frontale e dalla parte anteriore del lobo parietale, non vi è invece un confine distinto con il lobo occipitale e con la parte posteriore del lobo parietale. Nel lobo temporale si trovano le circonvoluzioni temporali superiore, media ed inferiore, l’occipito‐temporale laterale, la fusiforme, la linguale, la paraippocampale, l’ippocampale, i giri trasversali di Heschl (area uditiva primaria) ed il plenum temporale, parte integrante della corteccia uditiva, una regione che riceve afferenza labirintiche, un’area olfattiva e gustativa, una visiva, l’area di Wernicke. Quindi, funzioni principali delle strutture temporali sono: • Area di Wernicke: recezione del linguaggio • Area uditiva primaria: udito • Aree visive associative: orientamento spaziale, stima della profondità e della distanza, visione stereoscopica, percezione dei toni dei colori • Ippocampo ed aree paraippocampali: memoria ed apprendimento Ne risulta un ruolo, per il lobo temporale, di integrazione di sensazioni, emozioni e comportamento: il lobo temporale sembra la sede dove tutte le modalità sensitive vengono integrate fino alla consapevolezza di sé. Si ricordano: • Sindromi eccitatorie o Allucinazioni uditive elementari o complesse o Allucinazioni visive o Disturbi dell’olfatto e del gusto: sono causati soprattutto da foci epilettogeni nella regione uncale (crisi uncinata: può essere anche l’aura di una crisi complessa). Come il precedente disturbo, possono essere accompagnati da alterazioni affettive, come ansia e paura, dovute a coinvolgimento di strutture limbiche o Illusioni vestibolari: dovute a coinvolgimento dell’area deputata al controllo dell’equilibrio, possono dare alterazioni del rapporto con l’ambiente circostante o Disturbi della percezione del tempo: in crisi focale epilettiche • Sindromi deficitarie o Ipoacusia: sordità corticale da lesioni bilaterali dei giri di Heschl, agnosia uditiva per lesione delle aree uditive associative secondarie (mancato riconoscimento di suoni complessi, come note musicali) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
Afasia di Wernicke (vedi lezione precedente) Disturbi visivi: le lesioni della sostanza bianca della parte posteriore e centrale del lobo temporale coinvolgono le fibre arcifori inferiori del fascio genicolo‐calcarino. Ne deriva una quadrantopsia omonima Anosmia ed ageusia: questi disturbi, come l’acusia, sono rari in quanto per la loro manifestazione occorrono lesioni bilaterali Disturbi della memoria: soprattutto della memoria a breve e brevissimo termine (anomia amnesica) o
Sindromi da lesioni dei lobi occipitali I lobi occipitali costituiscono il punto terminale delle vie genicolo‐calcarine e quindi sono essenziali per la percezione ed il riconoscimento visivo: l’area visiva primaria (area 17) è solcata dalla linea o banda di Gennari, costituita da una banda molto spessa di fibre mieliniche, e pertanto chiamata anche area striata; le aree 18 e 19 costituiscono, invece, la struttura parastriata, area associativa visiva secondaria. Si riconoscono: • Sindromi eccitatorie o Illusioni visive (metamorfopsie): deformazione dell’immagine, alterazione delle dimensioni o del colore, illusione di movimento o combinazioni varie o Allucinazioni visive: elementari (lampi di luce, punti luminosi, forme geometriche semplici) o complesse (oggetti, persone, animali): indicano alterazioni nelle aree associative o nelle loro connessioni coi lobi temporali. Sono tipiche di emicrania e di crisi epilettiche, di cui possono costituire l’aura, nonché di stati confusionali o deliranti • Sindromi deficitarie o Deficit del campo visivo: quadrantopsia, emianopsia omonima: da lesioni focali o Cecità corticale: da lesioni bilaterali dei lobi occipitali o Anosognosia visiva (o sindrome di Anton): il paziente non vede, ma non ammette la propria cecità: in questi casi, la lesione si estende oltre la corteccia striata, interessando le aree visive associative o Agnosie Per oggetti: il paziente non riconosce gli oggetti con la sola vista, ma solo con l’ausilio, ad esmpio, di tatto od udito Proposagnosia: il paziente non riconosce i volti, anche di persone care (“l’uomo che scambiò sua moglie per un cappello”), fino all’autoproposagnosia (mancato riconoscimento del proprio volto) Per l’ambiente Per i colori Simultaneoagnosia: il paziente ha perso la capacità di riconoscere ed interpretare adeguatamente tutti gli oggetti di una scena visiva Sindrome di Balint: il paziente percepisce solo parti individuali di una scena. La sindrome è caratterizzata da: deficit dell’attenzione visiva, difficoltà nell’afferrare e toccare un oggetto sotto la guida degli occhi (atassia ottica), incapacità a dirigere volontariamente lo sguardo verso la periferia (paralisi psichica della fissazione dello sguardo); è dovuta a lesioni bilaterali, specie delle aree visive associative Sindromi ipotalamiche ed infundibolo‐tuberiane L’ipotalamo svolge varie funzioni nell’attività del sistema nervoso: • controllo del sistema endocrino, in collaborazione con l’ipofisi: sindromi endocrine • regolazione e coordinazione delle funzione autonome, in collaborazione col SNA: sindromi vegetative • ruolo di “orologio” circadiano e stagionale per il comportamento e le funzioni sonno‐veglia: alterazioni di questo ciclo, spesso con associazione di sintomi psichiatrici Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
ruolo nella regolazione delle emozioni, in collaborazione con il sistema limbico: queste funzioni interagiscono tra loro e consentono il mantenimento dell’omeostasi e la regolazione delle funzioni emotive. Ruolo nella memoria (corpi mammillari: componenti del circuito di Papez): sindrome amnesica di Korsakoff da deficit di tiamina Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE I PROF.SSA MELONE FISIOPATOLOGIA DEI DISTURBI DEL MOVIMENTO E DELL’EQUILIBRIO Par I: Basi neuro anatomiche generali Il sistema motorio è organizzato in modo gerarchico, con tre livelli, in cui ciascun livello motorio superiore controlla quello sottostante: fu Hughlings Jackson ad ipotizzare che i neuroni spinali e del tronco cerebrale rappresentassero il livello più basso, più semplice e più rigidamente organizzato dei centri motori, che i motoneuroni della regione frontale posteriore fossero il secondo centro motorio, più complesso e meno organizzato, e che la corteccia prefrontale rappresentasse il terzo e più alto centro motorio; in seguito, come vedremo, fu stabilita l’importanza del lobo parietale, del cervelletto e dei gangli della base nel controllo motorio. Inoltre, i sistemi motorio e sensitivo, benché separati per praticità clinica, sono entità, non separate, ma intimamente connesse ed integrate: infatti, a livello corticale più elevato, la motivazione, la programmazione ed altre attività del lobo frontale, che sottendono al controllo motorio, sono sempre precedute e modulate dall’attività della corteccia sensitiva parietale. Le attività motorie, comunque, non includono solo quelle che modificano la posizione di un arto o di una parte del corpo (contrazione isotonica), ma anche quelle che stabilizzano la postura (contrazione isometrica): a questi diversi tipi di contrazione sottendono, come vedremo, diversi tipi di attività nervosa; i movimenti, poi, possono essere distinti in riflessi, i più automatici, e volontari, i meno automatici (in questo caso, è ovviamente fondamentale la coscienza, che consente un’attuazione adeguata alla finalità), ed in lenti (movimenti “ramp”) e rapidi (come quelle balistici). Le seguenti parti del corpo sono coinvolte in maniera preponderante nel controllo del movimento ed una loro alterazione risulta in specifici fenotipi patologici: • a‐motoneuroni cranici e spinali i cui assoni sono destinati ai muscoli scheletrici. essi costituiscono la via finale comune attraverso la quale tutti gli impulsi vengono trasmessi ai muscoli (unita’ motoria) • motoneuroni piramidali di betz situati nella corteccia frontale pre‐rolandica • fascio piramidale e rubro‐spinale • fascio vestibolo‐spinale • neuroni del tronco encefalico: formazione reticolare discendente, nuclei vestibolari, nuclei rossi • sistemi sottocorticali: gangli della base e cervelletto • corteccia pre‐motoria e supplementare motoria • corteccia pre‐frontale • corteccia associativa parietale posteriore • corteccia parietale sensitiva primaria Ne conseguono diversi tipi di patologie • Paralisi da patologia delle unità motorie • Paralisi da patologia dei motoneuroni superiori • Disturbi aprassici dovuti all’interessamento delle vie associative cerebrali • Riduzione dell’iniziativa motoria e disinibizione di automatismi arcaici da patologia prefrontale • Movimenti involontari e anomalie posturali da patologia dei gangli della base: malattia di Parkinson, corea di Huntington • Anomalie della coordinazione (atassia) da lesioni cerebellari o da deficit di informazione Par II: Motoneuroni inferiori Basi neuroanatomiche Sono rappresentati dai grandi motoneuroni delle corna anteriori del midollo spinale e dai nuclei motori del tronco cerebrale, i cui assoni si prolungano nelle radici anteriori, nei nervi spinali e nei nervi cranici, destinati ai muscoli scheletrici: costituiscono i neuronI motori inferiori, la cui lesione provoca perdita di tutti i movimenti, volontari, automatici, posturali e riflessi; i motoneuroni inferiori costituiscono la via finale comune attraverso la quale tutti gli impulsi motori vengono trasmessi ai muscoli: ogni motoneurone spinale o cranico, attraverso l’estesa arborizzazione della parte terminale dell’assone, è in contatto con un numero variabile (da poche a più di 100: in genere, ciò dipende dalla finalità del muscolo: muscoli che compiono ampi movimenti, come il trapezio, hanno 100‐200 fibre muscolari per Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
unità motoria; muscoli che compiono movimenti più fini, come i muscoli estrinseci dell’occhio, hanno 10‐12 fibre muscolari per unità motoria) fibre muscolari; l’insieme costituito da neurone, assone e fibre muscolari costituisce l’unità motoria. Tutti i movimenti sono realizzati mediante attivazione dei motoneuroni inferiori: i più grandi governano le grandi unità motorie, i più piccoli le minori. Le unità motorie piccole sono attivate con maggiore efficacia da vie afferenti sensitive provenienti dai fusi neuromuscolari, hanno attività tonica e sono reclutate nelle attività riflesse ed in quelle coinvolte nel mantenimento della postura, nella deambulazione e nella corsa; le unità motorie grandi prendono parte principalmente ai movimenti fasici, caratterizzati da una scarica iniziale di attività nei muscoli agonisti, seguita da una a livello degli antagonisti ed, infine, da una terza a livello degli agonisti (organizzazione trifasica agonisti‐antagonisti‐
agonisti). Nel mantenimento della stazione eretta, invece, agonisti ed antagonisti si contraggono simultaneamente; la deambulazione, poi, richiede che l’organizzazione riflessa estensoria della postura eretta venga inibita e sostituita con uno schema coordinato alternante di movimenti tipici del passo. Un peculiare recettore contenuto nella maggior parte dei muscoli scheletrici è il fuso neuromuscolare la cui caratteristica è quella di presentare fibre muscolari proprie, specificamente innervate e disposte in parallelo rispetto alle fibre muscolari extrafusali: fa parte di un circuito a feedback alla base del riflesso monosinaptico da stiramento in cui le fibre afferenti fusali (Ia) rispondono allo stiramento passivo del muscolo, attivando gli alfa‐motoneuroni del muscolo agonista e, tramite un’interneurone, inibendo gli alfa‐motoneuroni del muscolo antagonista. Inoltre, la stimolazione delle fibre efferenti gamma che innervano esclusivamente i fusi neuromuscolari, provoca contrazione delle estremità contrattili delle fibre intrafusali e quindi ne stira la porzione centrale dando l’avvio ad impulsi lungo le fibre afferenti fusali (Ia) che portano alla contrazione riflessa del muscolo. Quando la scarica efferente gamma è aumentata, le fibre intrafusali sono più corte di quelle extrafusali esaltando la sensibilità dei fusi allo stiramento, con la conseguenza che la soglia del riflesso da stiramento risulta più bassa; la frequenza di scarica dei motoneuroni gamma è regolata, attraverso fasci discendenti, da varie strutture encefaliche tra cui, area facilitatoria reticolare del tronco encefalico e nuclei vestibolari, che la incrementano, aumentando la sensibilità del fuso, ed area inibitoria reticolare del tronco encefalico attivata da corteccia cerebrale, cervelletto, gangli della base, che la riduce, abbassando la sensibilità del fuso. Un altro fattore che condiziona la soglia dei riflessi spinali da stiramento è l’eccitabilità dei motoneuroni alfa. Quindi, la sensibilità dei fusi e la soglia dei riflessi da stiramento vengono modulati secondo le necessità del controllo posturale: pertanto, il fuso neuromuscolare, attraverso l’integrazione di segnali, garantisce equilibrio tra muscolatura agonista ed antagonista e quindi una corretta postura per il mantenimento di una certa funzione finalizzata all’esecuzione di un movimento; ciò consente anche la sinergia che accompagna un movimento di dorsiflessione della testa e del tronco (sinergia intersegmentaria). Riguardo i neurotrasmettitori coinvolti, i grandi neuroni delle corna anteriori del midollo utilizzano l’ACh come neurotrasmettitore; i principali neurotrasmettitori del fascio cortico‐spinale sono aspartato e glutammato; il neurotrasmettitore dei neuroni che mediano l’inibizione reciproca (inibizione dei muscoli antagonisti ) durante l’attività riflessa è la glicina, neurotrasmettitore anche delle cellule di Renshaw responsabili dell’inibizione ricorrente (inibizione a feedback negativo: i motoneuroni alfa attivati attivano, tramite fasci collaterali, anche le cellule di Renshaw che, appunto, li inibiscono per prevenire contrazioni eccessive e spasmi); aspartato ed glutammato sono, invece, liberati dalle terminazioni sinaptiche degli interneuroni eccitatorii; il GABA, infine, è il neurotrasmettitore degli interneuroni inibitori delle corna posteriori. Paralisi da lesione dei motoneuroni inferiori In caso di interruzione di tutte o quasi le fibre nervose motorie periferiche che innervano un muscolo, risultano aboliti tutti i movimenti volontari, posturali e riflessi: il muscolo diviene molle e lasso e non oppone resistenza allo stiramento passivo (flaccidità); il tono muscolare, ossia la lieve resistenza che un muscolo normale in stato di rilassamento oppone al movimento passivo, è ridotto (ipotonia); il muscolo denervato va incontro ad atrofia; la reazione del muscolo allo stiramento improvviso, quale si osserva percuotendo il tendine, è perduta (ariflessia). Inoltre, le singole fibre muscolari cominciano a contrarsi spontaneamente (fibrillazione, ossia l’incapacità della fibra muscolare di mantenere un potenziale stabile): quest’attività, non visibile sulla cute integra, è rintracciabile tramite EMG. Ancora, in caso di sofferenza del motoneurone, possono presentarsi fenomeni di irritabilità (ad esempio, impulsi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
ectopici da parte dell’assone) e le fibre muscolari possono dare origine a scariche sporadiche, indipendenti dalle altre unità (fascicolazione, visibile sulla cute). La paralisi del motoneurone inferiore è il risultato diretto della perdita di funzione o della distruzione delle cellule delle corna anteriori o dei rispettivi assoni nelle radici anteriori (che partecipano alla formazione di più nervi) o nei nervi periferici: pertanto, segni e sintomi variano a seconda della sede di lesione; ad esempio, in caso di lesione della radice motoria di L5 si determina caduta del piede e paralisi degli estensori del piede, mentre una lesione del nervo peroneo determina caduta del piede, ma non paralisi degli estensori, controllati dal nervo tibiale, e quindi da L5. Inoltre, l’associazione di paralisi flaccida e disturbi sensitivi indica compromissione di nervi misti o delle radici anteriori e posteriori; l’assenza di disturbi sensitivi indica l’interessamento della sostanza grigia midollare anteriore, delle radici anteriori o di una branca esclusivamente motoria del nervo periferico. Per quadri parziali o meno gravi, si usa il termine paresi. Par III: Motoneuroni superiori Basi neuroanatomiche Sono rappresentati dai motoneuroni situati nella corteccia frontale adiacente alla scissura rolandica: sono connessi ai motoneuroni spinali mediante un sistema di fibre denominato, per l’aspetto d’insieme del suo fascicolo nel bulbo (midollo allungato), fascio piramidale (o cortico‐spinale); tali neuroni sono indicati come motoneuroni superiori. Il fascio piramidale discende dalla corteccia cerebrale, attraversa la sostanza bianca sottocorticale (corona radiata), la capsula interna, il peduncolo cerebrale, il ponte ventrale e la piramide della parte superiore del bulbo; incrocia poi la linea mediana (decussa l’80%: fascio crociato; il 20 % non decussa: fascio diretto ventrale) nella parte inferiore del midollo allungato e prosegue il suo decorso nella colonna laterale del midollo spinale. Questo è il solo sistema di connessione diretta fra corteccia cerebrale e midollo spinale; vie indirette, attraverso le quali la corteccia è in grado di influenzare il midollo spinale sono: via rubro‐spinale, reticolo‐spinale, vestibolo‐spinale e tetto‐spinale. E’ causa di confusione la convinzione che il fascio piramidale origini unicamente nella corteccia motoria primaria (area 4 di Brodmann), dalle cellule piramidali giganti di Betz: infatti, il fascio piramidale è costituito da fibre che prendono origine anche da altre aree cerebrali: area motoria supplementare (area 6 di Brodman), area somatosensoriale primaria ( aree 1,2 e 3 di Brodmann) e lobulo parietale superiore (aree 5 e 7). Al fascio cortico‐spinale, nel tronco cerebrale, si accompagna il fascio cortico‐ bulbare, che si distribuisce ai nuclei motori dei nervi cranici omo‐ e contro‐laterali: data l’analoga origine delle fibre cortico‐spinali e cortico‐bulbari, i nuclei motori del tronco cerebrale sono assimilabili ai nuclei motori del midollo spinale e considerabili entrambi come motoneurone inferiori. Importante, nella pratica clinica, è poi l’organizzazione somatotopica del sistema cortico‐
spinale: una volta emersi dalla corteccia motoria, gli assoni discendente motori mantengono la specificità anatomica della corteccia stessa. Più distalmente, le fibre motorie discendenti convergono e si raccolgono nel braccio posteriore della capsula interna, cosicchè anche una piccola lesione in questa sede può dare origine ad una emiplegia motoria pura; ancor più caudalmente, nel peduncolo cerebrale e nella base del ponte si può ancora riconoscere una distribuzione topografica; il pattern topografico è mantenuto anche a livello della piramide bulbare e nelle colonne laterali del midollo spinale. Da ricordare, infine, che dal fascio cortico‐bulbare, dopo la decussatio a livello del ponte superiore, si distacca, e risale, un fascio destinato al nucleo faciale controlaterale. A livello spinale, poi, i fasci cortico‐spinali e gli altri motoneuroni superiori terminano principalmente in rapporto con le cellule nervose della zona intermedia della sostanza grigia del midollo spinale (neuroni internunciali), da cui gli impulsi motori vengono trasmessi alle cellule delle corna anteriori; solo il 10‐20 % delle fibre cortico‐spinali (presumibilmente i grossi assoni a rapida conduzione che provengono dalle cellule di Betz) stabilisce connessioni dirette con i grandi motoneuroni delle corna anteriori. Paralisi da lesione dei motoneuroni superiori Le vie cortico‐spinali possono essere interrotte a più livelli: corteccia cerebrale, sostanza bianca sottocorticale, capsula interna, tronco cerebrale e midollo spinale. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
E’ bene notare, come premessa, che nella corona radiata e nelle capsula interna le fibre cortico‐spinali sono frammiste, oltre che a fibre cortico‐tronco encefaliche, a fibre talamo‐corticali, importante sistema di collegamento tra cervelletto e gangli della base e corteccia: di conseguenza, le lesioni in questa regione colpiscono simultaneamente, sia il sistema cortico‐spinale che quello extrapiramidale. Altre considerazioni preliminari sono che: la sola area dove le fibre cortico‐spinali si trovano isolate è il fascio piramidale in corrispondenza del bulbo; viene sempre interessato un gruppo di muscoli piuttosto che singoli muscoli; i movimenti bilaterali (oculari, mandibolari, faringei, addominali) sono poco o per nulla interessati, data l’innervazione bilaterale; l’atrofia che ne risulta è modesta e per lo più dovuta a disuso. Il quadro sarà caratterizzato da spasticità con riflessi tendinei iperattivi e risposta plantare in estensione (segno di Babinski), fascicolazioni assenti e velocità di conduzione normale (nessun potenziale di denervazione all’EMG). I meccanismi alla base della spasticità e dell’iperriflessia sono alquanto complessi e non ancora chiariti: un tempo attribuiti alla “liberazione” dalle vie cortico‐spinale inibitorie discendenti, oggi si sottolinea l’importanza di altre vie (fascio reticolo spinale dorsale, che ha effetti inibitori sui riflessi di stiramento; fasci reticolo spinale mediale e vestibolo spinale, che facilitano il tono degli estensori). La malattia che unisce segni di patologia del motoneurone superiore e di patologia del motoneurone inferiore, ha carattere degenerativo e prende il nome di Sclerosi laterale amiotrofica (SLA). Può avere due sedi lesionali: bulbare e midollare. In caso di lesione bulbare si ha una paralisi labio‐glosso‐faringea perché coinvolge sia il primo che il secondo motoneurone dei nervi cranici: quindi, ad essere compromessa, è la via che dalla corteccia va al bulbo, dove termina nei nuclei motori dei nervi cranici e quella che, partendo da questi stessi nuclei motori (contenenti i secondi neuroni di moto) costituisce i nervi cranici; la prognosi è infausta perché questi sono pazienti gravemente disfasici, distonici e con paralisi della muscolatura respiratoria. Se lesione è midollare, invece, si ha una patologia a livello cervicale, toracico e lombo‐sacrale che può dar luogo a sindromi da coinvolgimento (denervazione) degli arti superiori, della muscolatura toracica e di quella lombo‐sacrale. Nell’ambito della SLA, inoltre, esistono tre forme: una forma classica anche nota come malattia di Charcot o di Lou Gehrig, in cui si associano segni di interessamento del primo e del secondo neurone di moto; una forma bulbare in cui sono predominanti i segni di patologia del primo neurone di moto; una forma pseudopolinevritica o malattia di Patrikios, in cui prevalgono i segni di coinvolgimento del secondo neurone di moto. La forma bulbare va posta in diagnosi differenziale con la sclerosi laterale primaria, considerata una malattia motoneuronale, in cui c’è l’esclusivo interessamento del primo neurone di moto. La forma pseudopolinevritica va, invece, differenziata dall’atrofia muscolare spinale, malattia su base genetica che colpisce esclusivamente il secondo neurone di moto: mentre l’atrofia muscolare spinale è tipica dell’età infantile e giovanile, la forma pseudopolinevritica della SLA è tipica dell’età adulta. Ricapitolando, nella forma classica della SLA i segni di patologia del secondo motoneurone sono: atrofia, ipostenia, fascicolazioni, areflessia osteo‐tendinea, ipotonia; mentre i segni di patologia del primo motoneurone sono: spasticità, ROT vivaci, segno di Babinski, ipostenia, segni pseudo‐bulbari e cioè paralisi labio‐glosso‐faringea (paralisi molto grave, principale manifestazione della forma bulbare, forma più rapidamente infausta della SLA). Un esempio, invcece, di differenze semeiologiche tra paralisi centrali e periferiche è la paralisi del nervo facciale, centrale o periferica. In caso di paralisi periferica, una serie di elementi consente di giungere immediatamente alla diagnosi, perché riflettono l’interessamento delle tre strutture muscolari innervate dal nervo facciale (la paralisi periferica, infatti, è legata ad una lesione del tronco nervoso nel suo percorso, dopo l’uscita dal nucleo, con conseguente coinvolgimento di tutti i territori a valle e cioè di tutti i muscoli omolaterali al nervo faciale colpito): muscolo corrugatore della fronte, muscolo orbicolare dell’occhio, muscolo orbicolare della bocca; quindi, oltre allo stiramento del solco naso‐genieno presente anche nella paralisi centrale, si presenta il lagoftalmo, ossia l’incapacità di chiudere l’occhio (la rima palpebrale) per paralisi del muscolo orbicolare, con conseguente deficit di ammiccamento. La paralisi centrale, invece, rientra nella sindrome piramidale: la patologia dipende dalla lesione del fascio piramidale controlaterale (nel fascio piramidale, infatti, vi sono fibre dirette a quella porzione del nucleo controlaterale che dà origine alla componente inferiore del nervo faciale; la porzione del nucleo che genera la componente superiore del nervo faciale, riceve, invece, fibre cortico‐pontine omolaterali e controlaterali). Pertanto, in un soggetto con paralisi facio‐brachio‐crurale (emiplegico) da lesione del fascio piramidale vi sarà una paralisi limitata ai muscoli innervati Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
dalla componente inferiore del nervo faciale, controlaterale al fascio piramidale leso (l’integrità dei muscoli facciali superiori dipende dal fatto che la porzione del nucleo da cui ha origine la componente superiore del nervo faciale riceve fibre cortico‐pontine sia omolaterali che contro laterali). Comunque, la paralisi periferica del nervo faciale, la cosiddetta paralisi “a frigore” (in quanto la causa principale è il freddo), è molto più comune di quella centrale. Tipi di paralisi • Monoplegia: si riferisce alla perdita della forza o paralisi di tutti i muscoli di un arto. Possono distinguersi: monoplegia senza atrofia muscolare, solitamente dovuta a lesione della corteccia cerebrale (cause più frequenti: lesione cerebrale vascolare, tumore circoscritto, ascesso) o ad una fase iniziale di lesione dei motoneuroni inferiori; monoplegia con atrofia muscolare, più frequente e solitamente dovuta a lesione dei motoneuroni inferiori o a disuso conseguente a lesione dei motoneuroni superiori (in questo caso, si ricorda, i riflessi osteo‐tendini sono conservati e la velocità di conduzione dei motoneuroni periferici è normale), cause più frequenti sono: nel lattante, trauma da parto di un plesso; nel bambino, poliomielito o altra infezione; nell’adulto, poliomielite, siringomielia, SLA, lesione di un plesso, SM, tumori (per compressione di un plesso) • Emiplegia: forma più frequente, interessa entrambi gli arti e l’emifaccia di un lato; solitamente è attribuibile ad una lesione del sistema cortico‐spinale del lato opposto alla paralisi, con possibile interessamento del fascio cortico‐ bulbare e, quindi, dei nuclei dei nervi cranici. Di solito, la sede della lesione (corteccia cerebrale, corona radiata, capsula, tronco cerebrale o midollo spinale), può essere dedotta da reperti neurologici associati: le patologie localizzate a livello di corteccia, corona radiata e capsula, si manifestano con ipostenia e paralisi dell’emicorpo controlaterale; la lesione a livello del tronco encefalico superiore provoca un quadro simile, con possibile interessamento del III nervo cranico (oculomotore) omolaterale alla lesione (sindromi alterne); le lesioni pontine basse causano, invece, oltre alla paralisi contro laterale di braccio e gamba, una paralisi omolaterale di abducente o del facciale (sindrome alterna di Millard‐Gubler); a livello bulbare si avranno quadri simili (vedi lezione sulle sindromi alterne); raramente, infine, una paralisi emiplegica può essere causata da una lesione omolaterale del midollo spinale cervicale (sindrome di Brown‐
Sequard), più frequentemente, in questi casi, si ha coinvolgimento bilaterale con tetraplegia. Tra le cause più frequenti si ricordano, in ordine di frequenza: malattie cerebrovascolari di encefalo e tronco encefalico, traumi (contusione cerebrale, ematoma epidurale e subdurale), tumori cerebrali, ascessi cerbrali, malattie demielinizzanti, complicanze vascolari di meningite od encefalite. • Paraplegia: indica ipostenia o paralisi di entrambi gli arti inferiori e può verificarsi a causa di malattie del midollo spinale, delle radici nervose o, più raramente, dei nervi periferici; può essere distinta in: acuta (causa più comune è un trauma spinale,di solito associato a frattura o lussazione della colonna; cause meno comuni sono l’ematomielia dovuta ad una malformazione vascolare con conseguente ischemia, l’infarto midollare causato dall’occlusione dell’arteria spinale anterioreo di rami segmentatnti dell’aorta, l’emorragia epidurale o subdurale da malattie emorragiche o da terapia anticoagulante con farfari, mielopatia acuta demielinizzante o necrotizzante), croniche dell’adulto (SM, tumori, protrusione del disco intervertebrale cervicale, ascesso epidurale, processi infettivi come tubercolosi ed altre malattie granulomatose, degenerazione da deficit di B12, patologie degenerative delle colonne laterali e posteriori ad eziologia sconosciuta), croniche del bambino [rachitismi, leucomalacia periventricolare, traumi del parto, malformazioni congenite del midollo spinale, atassia di Friedrich, distrofia muscolare progressiva, paraplegia familiare, paraparesi spatica familiare adrenoleucodistrofia (neuropatia metabolica legata all’X che colpisce esclusivamente i maschi, caratterizzata da una paresi crurale spastica per lesione del primo motoneurone di moto in corrispondenza dell’assone nel tratto dorso‐laterale del midollo spinale)] • Tetraplegia: indica una perdita di forza di tutti e 4 gli arti; può essere conseguente a lesioni che interessano nervi periferici, muscoli o giunzioni neuromuscolari, sostanza grigia del midollo spinale o motoneuroni superiori (le cause sono praticamente le stesse della paraplegia con la differenza che la lesione si trova a livello cervicale piuttosto ch toracico o lombare, come in caso di tumori od altre lesioni compressive della regione del forame magno e dei segmenti rostrali del midollo cervicale; nei bambini, inoltre, sono frequentemente dovute a malattie metaboliche cerebrali, come la leucoencefalopatia metacromatica). La Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
diplegia è una forma particolare di tetraplegia in cui le gambe sono colpite più delle braccia; la triplegia, invece, si verifica più spesso come condizione transitoria nel corso dello sviluppo o del recupero della tetraplegia Paralisi di gruppi muscolari isolati: è legata solitamente ad una lesione di uno o più nervi periferici o di più radici spinali adiacenti; l’interruzione completa od estesa di un nervo periferico è seguita da atrofia dei muscoli da questo innervati e da perdita dei riflessi tendinei degli stessi muscoli; possono anche verificarsi anomalie vasomotorie o della sudorazione o trofiche (cutanee, sottocutanee od ungueali) Paralisi isterica: può interessare un braccio, una gamba, entrambe le gambe o tutto un lato del corpo; i riflessi tendinei sono conservati e non vi è grave atrofia muscolare (ciò che la distinguono da una lesione del motoneurone inferiore); può essere, caratteristicamente, osservata una perdita della sensibilità o della sensorialità del lato interessato, non osservabile in corso di paralisi organica. Paralisi muscolari e spasmi in assenza di alterazioni visibili del nervo o del muscolo: miastenia gravis, miopatie infiammatorie, distrofie muscolari e congenite, miotonia congenita di Thompson, paralisi periodica familiare, disturbi metabolici (di sodio, potassio, calcio o magnesio), botulismo, tetano, miopatie tiroidee ed altre endocrine Par IV: Corteccia motoria, premotoria, supplementare motoria e controllo cerebrale del movimento Basi neuro anatomiche Le aree corticali implicate nel movimento sono: • Area motoria: è intesa come la regione cerebrale dalla quale possono essere evocati movimenti isolati con stimoli di intensità minimale: nell’area 4 sono rappresentati i gruppi muscolari dell’emifaccia, del braccio, del tronco e della gamba contro laterali; le parti del corpo in grado di eseguire i movimenti più delicati hanno la rappresentazione corticale più ampi (homunculus di Pemfield). Altre parti della corteccia cerebrale, in particolare quella premotoria e la corteccia supplementare motoria sono coinvolte nella programmazione dei movimenti volontari, cioè controllano l’ordine sequenziale e la modulazione di ogni movimento volontario: i livelli gerarchici del controllo motorio sono in parallelo ; infatti, ai fini dell’integrazione tutto deve avvenire in maniera sincrona, altrimenti il movimento si “spezzetterebbe” nelle diverse parti, divenendo non corretto sul piano funzionale. Ogni rete,inoltre, secondo l’approccio connessionista, è costituita da tres trati neuronali: uno d’entrata, uno di uscita ed una intermedio: le sinapsi dello strato intermedio sono modificabili con l’apprendimento. • Area premotoria (area 6): richiede stimoli più intensi per evocare i movimenti: la stimolazione della parte più caudale provoca risposte simili a quelle dell’area 4, probabilmente grazie ad impulsi trasmessi direttamente all’area 4; la parte più rostrale, invece, induce schemi di movimento più generali, in genere a carico della muscolatura prossimale degli arti. Si può affermare che la corteccia motoria‐premotoria è in grado di elaborare l’azione di muscoli agonisti in un’infinita varietà di schemi motori finemente graduati ed altamente differenziati, guidati anche dalle informazioni provenienti dalle aree sensoriali visive (area7) e tattili (area 5), nonché emotivo‐motivazionali • Area supplementare motoria: anteriore all’area 6 premotoria, regolata da input primariamente somato‐
sensoriali, sembra funzionale all’apprendimento di nuove sequenze motorie ed all’attuazione di movimenti autogenerati. Una caratteristica fondamentale dell’area premotoria e dell’area motoria supplementare è la loro connessione al lobo parietale: questi circuiti parieto‐frontali rappresentano dei moduli di trattamento dell’informazione all’interno dei quali si elaborano gli schemi motori fondamentali o rappresentazioni centrali dell’attività gestuale (coordinazione visumotoria, prensione, manipolazione, pianificazione sequenziale). Peraltro l’attività di queste aree corticali premotorie è modulata da altre aree associative prefrontali situate più a monte nei processi decisionali, con presa in carico degli aspetti motivazionali (corteccia orbito frontale e cingolare) e operativi del comportamento (corteccia prefrontale dorso‐laterale). • Corteccia associativa dorso‐laterale prefrontale: è anch’essa coinvolta nella pianificazione (soprattutto grazie alla modulazione emotivo‐emozionale) e nell’avvio dei movimenti volontari: fibre a partenza dalla corteccia prefrontale proiettano alla corteccia supplementare e premotoria (ed all’area frontale di controllo dei movimenti oculari: area oculocefalogira, cioè area 8), fornendo loro segnali motori Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Corteccia associativa parietale posteriore: analogamente, alcune regioni corticali parietali, dopo aver ricevuto ed integrato input da sistemi sensitivi e sensoriali, forniscono l’informazione sensitiva somatica e sensoriale che attiva la corteccia prefrontale, l’area frontale di controllo dei movimenti oculari, la corteccia premotoria e supplementare motoria e consente l’esecuzione di movimenti precisi; un ruolo in questi processi ha anche la corteccia parietale associativa posteriore. In definitiva, la corteccia parietale posteriore è una delle grandi cortecce associative del cervello dei mammiferi, dei primati e dell’uomo (contiene le aree 5, 7 allargate a 39 e 40). In questa zona, membro del carrefour parieto‐temporo‐occipitale, sono contenuti due settori chiave nel destrimane: a sinistra,vi è l’area delle prassie la cui lesione in un soggetto, con forza conservata, non atassica, senza disturbi extra‐piramidali né difetti delle sensibilità primarie, determina un’incapacità ad eseguire un compito fino a quel momento perfettamente svolto (aprassia, vedi dopo); a destra, questa zona è la sede della costruzione dello schema corporeo, il suo coinvolgimento provoca un quadro con negligenza tanto dell’emicorpo sinistro che dello spazio extracorporeo corrispondente (emiasomatognosia o anosodiaforia di Anton‐Babinski). Porzioni del SN implicate nella sensibilità tattile (corteccia parietale sensitiva primaria), vestibolare, propiocettiva, visiva ed uditiva: sono connesse anche direttamente alla corteccia motoria: queste vie associative realizzano un propria regolazione sensitiva della funzione motoria. Pertanto, il sistema motorio può essere riconsiderato come un sistema sensori‐motorio, poiché l’output motorio è guidato da un input sensitivo‐sensoriale (fanno eccezione i movimenti balistici, movimenti rapidi ed esplosivi, privi di controllo esecutivo e già pianificati, come mordere o scalciare); tale sistema è molto modificato dall’esperienza e dall’apprendimento, così ad esempio i calciatori avranno una rappresentazione corticale sensitivo‐motoria del piede maggiore di una persona che non gioca a calcio. Disturbi da lesioni di aree della corteccia • Lesione prefrontale: la corteccia prefrontale programma attività complesse, concettualizza lo scopo finale e modifica continuamente le singole componenti di una sequenza motoria finalizzata al raggiungimento dello scopo prefissato (con un importante ruolo dei neuroni specchio); inoltre, inibisce attività motorie primordiali come suzione e prensione involontaria. Pertanto, le lesioni frontali, hanno l’effetto di ridurre l’impulso a pensare, a parlare e ad agire (ridotto tono corticale o abulia): un’attività complessa, inoltre, non può essere iniziata o proseguita abbastanza a lungo da essere completata; altri possibili disturbi sono l’ecolalia, in cui il paziente ripete, a mo’ di pappagallo, parole o frasi pronunciate da altri, e l’ecoprassia, in cui il paziente ripete le azione compiute da altri • Lesione della corteccia associativa parietale posteriore: o Aprassia: è la condizione di una persona lucida, con forza conservata, non atassica, senza disturbi extra‐piramidali né difetti delle sensibilità primarie, che perde la capacità di eseguire gesti ed azioni complesse appresi in precedenza (ogni azione, pianificata o comandata, prende, infatti, avvio non nel lobo frontale, dove avviene l’impulso all’azione, ma nel lobo parietale dell’emisfero dominante, dove trovano integrazione le informazioni visive, uditive e della sensibilità somatica). Responsabile di aprassia di entrambi gli arti è una lesione nel lobo parietale sinistro (cioè in quello solitamente dominante), dato che esso controlla anche quello destro: più precisamente, una lesione del tratto sottocorticale (probabilmente il fascicolo arcuato) disgiunge la corteccia parietale da quella frontale, determinando l’aprassia degli arti di destra; l’aprassia degli arti di sinistra è, invece, dovuta ad una disconnessione, nel corpo calloso, della corteccia premotoria sinistra da quella di destra. Fin poco tempo fa (ora i confini si ritengono molto confusi) si distinguevano: Aprassia ideativa: incapacità a concepire o formulare un’azione, spontanea o dietro comando, dovuta a lesione del lobo parietale dell’ emisfero sinistro Aprassia ideomotoria: incapacità, nonostante il ricordo dell’azione pianificata o comandata, di eseguirla, dovuta a da lesioni del lobo parietale che si connette con la corteccia pre‐motoria e supplementare motoria dove viene iniziata la fase esecutiva del movimento Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Aprassia motoria (o cinetica degli arti): impaccio o perdita di destrezza di un arto, di solito la mano dominante, durante l’esecuzione di un movimento complessa, non attribuibile a paresi, atassia o deficit sensitivo Aprassia bucco‐linguale: incapacità di eseguire su comando movimenti facciali come leccarsi le labbra o soffiare su un fiammifero: questi pazienti, tuttavia, possono imitare questi gesti mimati dall’ esaminatore. Dipende da lesione del giro sopra‐marginale sinistro o della corteccia motoria associativa di sinistra e può essere accompagnata o meno da aprassia degli arti Aprassia dell’abbigliamento e costruttiva: indica estinzione controlaterale o neglect dello schema corporeo e dei rapporti visuo‐spaziali (gnosie) o Neglect Contralaterale: inabilità a rispondere a stimoli visivi, uditivi, o somatosensoriali provenienti da un lato del corpo per severo danno parietale dell’emisfero controlaterale Lesioni della corteccia somato‐sensitiva primaria o Sindrome della mano aliena: indipendentemente dalla volontà, la mano ed il braccio intraprendono movimenti complessi ed apparentemente finalizzaati, come infilarsi la mano in tasca od in borsa; il paziente ha la sensazione che questi movimenti avvengano fuori dal proprio controllo, come se la mano fosse controllata da un agente esterno. Nella maggior parte dei casi, è conseguenza di una lesione dell’arteria cerebrale anteriore controlaterale, che irrora il territorio del corpo calloso o Sublimazione: incapacità di tenere un arto in un determinata posizione nello spazio, con tendenza a muovere l’arto nello spazio, come se non si sapesse dove metterlo. o Impersistenza di contrazione o Sindrome della mano inutile: compromissione dei movimenti di esplorazione e manipolazione degli oggetti, per cui un paziente con lesione del lobo parietale, oltre a presentare sublimazione degli arti, esplicitata con la manovra di Mingazzini, ha difficoltà a riconoscere, ad occhi chiusi, un oggetto messogli in una mano Par V: Nuclei del tronco encefalico che proiettano verso il midollo spinale, in particolare i nuclei del ponte e della formazione reticolare bulbare, i nuclei vestibolari ed i nuclei rossi, e vie discendenti Basi neuro anatomiche Questi nuclei e le loro fibre discendenti sottendono i meccanismi neurali della postura e del movimento, in particolare nel caso dei movimento altamente automatizzati e ripetitivi; alcuni di questi nuclei vengono influenzati da vie cortico‐reticolo‐spinali. L’organizzazione funzionale delle vie discendenti corticali e sottocorticali è determinata più dalle modalità di terminazione e dalle capacità motorie dei neuroni internunciali, su cui le fibre hanno terminazione, che dalla sede delle cellule di origine: pertanto alla base della distribuzione terminale sono state distinte 3 vie motorie: • Via ventro‐mediale: origina dal tetto (fascio tetto‐spinale), nei nuclei vestibolari (fascio vestibolo‐spinale) e nelle cellule reticolari pontine e bulbari (fascio reticolo‐spinale); termina sulle cellule internunciali sulla parte ventro‐mediale del grigio spinale controllando la postura, movimenti integrati tra tronco e arti, movimenti globali degli arti • Via laterale: origina dalla porzione magnocellulare del nucleo rosso (tratto cortico‐rubro‐spinale dorso‐
laterla); termina nella regione internunciale dorsale e laterale e aggiunge capacità di movimento indipendente delle estremità, soprattutto delle mani • Via cortico‐spinale e cortico‐bulbare: proiettano a tutti i livelli di midollo spinale e tronco cerebrale, terminando, in modo diffuso, nel nucleo proprio del corno dorsale e della zona intermedia (tratto cortico‐
spinale dorso‐laterale). In parte termina direttamente sugli a‐motoneuroni spinali che innervano dita faccia e lingua permettendo movimenti fini e frazionati come quelli indipendenti delle dita delle mani; un’importante componente delle fibre ha, invece, origine a livello della corteccia somatosensoriale e sembra rivestire un ruolo nella modulazione del movimento tramite il controllo delle afferenze sensitive Ne risultano: • tratti motori dorsolaterali Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
tratto corticospinale dorsolaterale: decussa nelle piramidi midollari e controlla i motoneuroni dei muscoli distali (movimenti fini delle singole dita, nei primati controllo dei grossi muscoli di sostegno degli arti inferiore da parte delle cellule di Betz) o tratto corticorubrospinale dorsolaterale: decussa a valle del nucleo rosso e controlla i muscoli del viso (attraverso fasci ai nuclei cranici) ed i muscoli distali degli arti tratti ventromediali: molto più diffuse dei tratti dorso‐laterali, innervano i muscoli prossimali di tronco ed arti, controllando i movimenti dell’intero corpo e la postura o tratto corticospinale ventromediale: discende omolateralmente alla corda spinale ventro‐mediale o tratto cortico‐troncoencefalo‐spinale ventromediale: innerva le strutture del tronco encefalo per poi discendere bilateralmente o
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE II: PROF.SSA MELONE ALTERAZIONI DEL MOVIMENTO E DELLA POSTURA DA MALATTIE DEI GANGLI DELLA BASE E CEREBELLARI Par I: I gangli della base Generalità Le attività dei gangli della base e del cervelletto sono associate e modulano il sistema cortico‐spinale ed il sistema cortico‐tronco‐spinale: le attività statico‐posturali svolte dai primi sono indispensabili per l’esecuzione dei movimenti volontari e finalistici mediate da questi due sistemi; viceversa, alterazioni del sistema cortico‐(tronco‐)spinale si riflettono in alterazioni anche posturali [lesioni cortico‐spinali provocano, generalmente, non solo paralisi della metà controlaterale del corpo, ma anche un atteggiamento posturale tipico con braccio in flessione e gamba in estensione (distonia empiplegica); invece, l’interruzione delle vie di proiezione motoria causate da lesioni nella parte superiore del ponte o nel mesencefalo può dar luogo ad una postura tipica, in cui i quattro arti sono in estensione ed i segmenti toraco‐lombari iperestesi (rigidità da decerebrazione)]. Pertanto, una reale differenza anatomico‐funzionale tra i due sistemi non è reale, ma una distinzione clinica rimane indispensabile su un piano didattico per differenziare due grandi sindromi motorie: quella piramidale (cortico‐
spinale), caratterizzata da spasticità, paralisi dei movimenti volontari, aumento dei riflessi tendinei, segno di Babinski, fenomeno del coltello a serramanico, ipertonia a carico di flessori delle braccia ed estensori delle gambe, assenza di fenomeni involontari; quella extrapiramidale, caratterizzata da plasticità uguale durante tutto il movimento passivo (rigidità) o intermittente (ruota dentata), ipertonia generalizzata ma prevalente a carico dei flessori di arti e tronco, movimenti involontari (tremore, corea, atetosi, distonia), riflessi tendinei generalmente normali, assenza di segno di Babinski e di paralisi dei movimenti volontari. Comunque, il sistema extra‐piramidale, assume maggior caratterizzazione se diviso in gangli della base e cervelletto. Considerazioni anatomiche I gangli della base sono nuclei motori deputati al controllo motorio controlaterale: infatti, fanno parte di un loop che riceve informazioni dalla corteccia e li ritrasmette indietro via talamo, risultando deputati alla selezione ed all’inizio di sequenze motorie (“priming motorio” deputato all’esecuzione rapida di atti motori non premeditati), all’apprendimento di compiti motori e di compiti cognitivi non‐motori (“programmazione motoria”: modalità di avvio e di modulazione dell’attività motoria), all’inibizione di movimenti non voluti ed alla facilitazione di movimenti desiderati tramite selezione di pattern motor specifici. Da un punto di vista più strettamente anatomico, possono essere considerati suddivisi in due nuclei principali, il nucleo caudato ed il nucleo lenticolare, composto da putamen e globus palidus: poiche, in realtà, caudato e putamen costituiscono una struttura singola, separata solo in modo incompleto dalle fibre della capsula interna, mitologicamente e funzionalmente distinta dal pallido, una suddivisione più significativa di questi nuclei distingue striato, costituito da caudato e putamen, e pallido, con le sue porzioni interna ed esterna (GPI e GPE). In virtù delle loro strette connessioni con i nuclei caudato e lenticolare, si includono nell’ambito dei gangli della base anche il nucleo subtalamico (corpo di Luys, STN) e la substantia nigra, distinta in pars compacta (SNC) e pars reticolare (SNR). In definitiva, vi è un circuito non piramidale principale, costituito da striato, pallido, talamo, corteccia premotoria e corteccia supplementare motoria (definibile anche come prepiramidale), che proietta finalmente alla corteccia motoria: fondamentali, in tale circuito, risultano i nuclei ventrolaterale e ventrale anteriore del talamo, collegamento essenziali all’interno di un sistema di fibre ascendenti, non solo dai gangli della base, ma anche dal cervelletto, verso la corteccia premotoria e motoria; pertanto, gangli della base e cervelletto eserciterebbero, tramite appunto queste connessioni talamo‐corticali, un’influenza sul sistema cortico‐spinale e su altre vie discendenti della corteccia (difatti, oltre al suddetto sistema prepiramidali, le proiezioni tra gangli della base‐talamo e corteccia sarebbero funzionali ad altri circuiti: oculomotore, con proiezione sui campi oculari frontali; prefrontali, con proiezioni sulla corteccia prefrontale dorso laterale ed orbito frontale laterale; limbico, con proiezioni sulla corteccia del cingolo anteriore ed orbito frontale mediale). Inoltre, le connessioni dei gangli della base presentano una organizzazione assai complessa e solo in parte chiarita: la maggior parte delle afferenze a questi nuclei proviene da quasi tutte le aree della corteccia cerebrale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
(gluttamatergiche) e dalla sub stantia nigra pars compacta (dopaminergiche) e raggiungono quasi esclusivamente i neuroni del corpo striato, cioè del nucleo caudato e del putamen; i nuclei effererenti, invece, sono costituiti dal pallido interno e dalla sub stantia nigra pars reticolata e sono GABAergici. In particolare, sono state descritte due distinte sottopopolazioni di neuroni GABAergici striatali, che danno origine alle due principali vie neuronali, attraverso cui lo striato regola gli input eccitatori talamo‐corticali: la via diretta e la via indiretta. I neuroni della via diretta proiettano direttamente al globo pallido interno ed alla substantia nigra pars reticolata, che, a loro volta, inviano afferenze GABAergiche al talamo (tramite l’ansa lenticolare ed il fascicolo lenticolare): l’attivazione di questa via, attraverso la doppia stazione inibitoria GABAergica (i neuroni GABAergici striatali inibitori inibiscono l’inibizione del pallido interno e della substantia nigra pars reticolata al talamo) determina disinibizione della proiezione glutammatergica talamo‐corticale con conseguente facilitazione motoria. I neurono GABAergici striatali proiettano, invece, nella via indiretta, al globo pallido ed alla sub stantia nigra pars reticolata tramite un circuito trisinaptico: neuroni GABAergici striato‐globo pallido esterno, neuroni GABAergici globo pallido esterno‐nucleo subtalamico, neuroni glutammatergici STN‐GPI/SNR; l’attivazione della via indiretta induce un aumento del controllo inibitorio esercitato dal GPI/SNR sul talamo, con conseguente riduzione degli input eccitatori talamo‐corticali e riduzione dell’attività motoria. La modulazione di queste vie è esercitato dai neuroni dopaminergici della SNC che proiettano allo striato, dove i neuroni GABAergici, rispettivamente della via diretta ed indiretta, sono modulati da recettori attivatori D1 ed inibitori D2: ne consegue, a seguito della proiezione SNC‐striato con rilascio di dopamina, un’attivazione della via diretta ed una inibizione della via indiretta, con risultato netto di facilitazione del movimento; in caso di degenerazione dei nuclei dopaminergici della SNC, come in caso di malattia di Parkinson, si avrà una compromissione della via SNC‐striato, con conseguente diminuita attività della via diretta ed aumento dell’attività di quella indirette, con risultato netto di perdita dell’attivazione delle aree corticali coinvolte nella programmazione e nella regolazione del movimento e conseguente difficoltà motorie. Questo sistema, distinto in via diretta ed indiretta, pur non chiarendo tutti gli aspetti della sintomatologia parkinsoniana, sarebbe fisiologicamente responsabile del favoreggiamento, durante un movimento intenzionale, di una serie di attività e della contemporanea inibizione di altre attività motorie non necessari. Comunque, altro sistema neurotrasmettitoriale fondamentale nella malattia di Parkinson è quello dell’ACh (equilibrio DA/ACh) In caso di corea di Huntington, invece, la lesione sarebbe solo a carico della via indiretta, in particolare con ridotta inibizione da parte dei nuclei dopaminergici striatali D2 sul GPL (quindi, deriva da una lesione a carica dei neuroni D2 della via indiretta; nella forma acinetico‐rigida la lesione è, invece, a carico dei neuroni D1 della via diretta), con conseguente iperattivazione dei neuroni GABAergici del GPL ed iperinibizione del STN: ne deriva una ridotta attivazione del GPI con ridotta inibizione del talamo ed aumento della via talamo‐corticale; ne conseguono scariche di attività coreoide irregolare. Nell’emiballismo, la lesione, vascolare, neoplastica o degenerativa, è a carico del STN: ne deriva, comunque, una ridotta attivazione del GPI con ridotta inibizione del talamo ed aumento della via talamo‐corticale. Infine, altre patologie dovute ad alterazione dei gangli della base sono: distonie (con sede solitamente nel putamen), tic (con sede sconosciuta) e mioclonie (con sedi varie). Quadro clinico In generale, tutti i disturbi motori possono essere considerati dipendenti da disturbi primari funzionali (o sintomi negativi) ed effetti secondari (o sintomi positivi), legati alla liberazione e disinibizione di porzioni del sistema nervoso rimaste intatte: in tal senso, la bradicinesia, l’ipo‐ e l’a‐cinesia e la perdita dei normali riflessi posturali emergono come deficit primari, mentre tremore, rigidità e movimenti involontari (corea, atetosi, ballismo e distonia) costituiscono i sintomi positivi. Dai disturbi posturali e dalla rigidità derivano, inoltre disturbi della deambulazione, del linguaggio e della fonazione. Comunque, è definibile come sindrome extrapiramidale l’insieme eterogeneo di patologie dei nuclei della base, caratterizzate da alterazioni della motilità non riconducibili a deficit di forza, atassia o aprassia; si distinguono, inoltre, due grandi gruppi di sindromi extrapiramidali: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Sindome ipertonica‐ipocinetica, tipica della malattia di Parkinson (degenerazione della substantia nigra, pars compacta) e caratterizzata da acinesia, rigidità e tremore Sindrome ipotonica‐ipercinetica, tipica della corea di Huntington (degenerazione del nucleo striato) e caratterizzata da atetosi, corea, torcicollo spasmodico, distonia di torsione e ballismo: è, a sua volta, distinguibile in: o Sindromi coreiche (caudato e putamen): caratterizzate da movimenti irregolari, repentini, di breve durata, aritmici, a variabile localizzazione, afinalistici (κορεια=danza) o Sindromi atetosiche (putamen e pallido): caratterizzate da lenti e continui movimenti tentacolari di flesso‐estensione dell’articolazione degli arti soprattutto superiori e a livello distale (danzatrici giavesi) I sintomi più importanti, tipici delle sindromi extrapiramidali sono: • Ipocinesia o acinesia: si riferiscono alla mancata o assente tendenza del paziente ad utilizzare la parte colpita in tutti i movimenti naturali del corpo: a differenza delle paralisi piramidali, la forza del segmento colpito non è significativamente ridotta; è tipica dei pazienti parkinsoniani, nei quali assume la forma di un’estrema ipoattività, fino al punto che le braccia vengono quasi dimenticate (neglected arm). Altri segni tipici possono essere: riduzione delle sincinesie pendolari; movimento degli occhi, ma non della testa nel guardare da un lato; riduzione dell’ammiccamento; scialorrea per deglutizione rallentata; volto privo di movimenti espressivi (ipomimia); linguaggio monotono • Bradicinesia: definisce la lentezza nell’avviare (malato di Parkinson “lento d’avvio”: aumento del tempo tra il comando e l’inizio della contrazione muscolare; la formulazione mentale del piano d’azione è normale: bradifrenia assente) e nell’eseguire un movimento. Ciò sarebbe dovuto ad una mancata energia (intesa come numero di unità motorie) sufficiente per completare il movimento: ne derivano un aumento delle sequenze trifasiche (agonisti‐antagonisti‐agonisti) necessarie per attuare il movimento e conseguente rallentamento dello stesso. La bradicinesia può essere causata da qualsiasi processo o sostanza in grado di alterare il circuito cortico‐
striato‐pallido‐talamico‐corticale: riduzione delle afferenze DA dalla sub stantia nigra allo striato, come in caso di malattia di Parkinson; il blocco dei recettori DA da parte dei neurolettici; la degenerazione estesa dei neuroni striatali (degenerazione strio‐nigrica, forma rigida della corea di Huntingtn); distruzione del pallido mediale nella malattia di Wilson • Disturbi associati: innervazione tonica (contrazione muscolare persistente che impedisce l’esecuzione di movimenti: ad esempio, una contrazione tonica della mano impedisce di stringere una penna), spasmo intenzionale (contrazione contemporanea di agonisti ed antagonisti nell’esecuzione di un movimento, con impedimento dello stesso) blocco in un punto nell’esecuzione sequenziale di un movimento, maggior affaticabilità dei muscoli volontari • Disturbi dei meccanismi di fissazione posturale, equilibrio e raddrizzamento: tipici del paziente parkinsoniano (e della malattia di Wilson), la postura prevalente è una flessione involontaria di tronco, arti e collo, accompagnata dall’incapacità a compiere i normali aggiustamenti posturali nel passare dalla posizione supina o quella eretta o nell’abbassarsi‐alzarsi. Inoltre, spingendo lievemente il paziente a livello dello sterno o del dorso, egli può iniziare a compiere una serie di piccoli passettini di compensazione, che non è in grado di controllare (festinazione) • Rigidità ed alterazioni del tono muscolare: nella forma di ipertonia definita rigidità, i muscoli si trovano continuamente o in modo intermittente in uno stato di tensione e di irrigidimento, a causa di un abbassamento della soglia di contrazione muscolare (rigidità a tubo di piombo o a coltello a serramanico: indicano le caratteristiche di uniformità e persistenza della rigidità). Tende ad interessare tutti i muscoli del corpo, ma prevalentemente quelli che mantengono una postura flessa, come i flessori del tronco e degli arti. Differenze con la spasticità sono che non vi è un intervallo libero dalla contrazione eccessiva all’inizio del movimento e che i riflessi tendinei sono conservati. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Un tipo particolare di rigidità è il fenomeno della ruota dentata: quando il muscolo ipertonico viene allungato passivamente, come nella dorsiflessione della mano, si avverte una resistenza che si interrompe ritmicamente, come in una ruota dentata. Comunque, la rigidità è tipica delle malattie dei gangli della base, come malattia di Parkinson (fasi avanzate), malattia di Wilson, degenerazione strio‐nigrica,intossicazione da neurolettici, calcinosi dei gangli della base: infatti, la deaerazione delle cellule pigmentate della substantia nigra priva i neuroni striatali della loro innervazione dopaminergica, con conseguente inibizione della via talamo‐corticale e comparsa di rigidità, ipo‐ od acinesia e bradicinesia. Movimenti involontari: si caratterizzano per tipo (afinalistici vs imitazione di movimenti finalistici), sede, ampiezza, velocità, frequenza (misurata in Hz), ritmo, costanza, fattori modificanti, interferenza coi movimenti volontari (e conseguente grado di disabilità). Si distinguono: o Corea: il termine, derivato dalla parola greca che significa danza, si riferisce a movimenti involontari, aritmici, abbastanza violenti, rapidi ed a scatto; possono essere semplici o piuttosto elaborati, con distribuzione variabile; anche se finalistici, il malato può incorporarli in movimenti finalizzati per renderli meno visibili. Altre espressioni di questi movimenti sono le smorfie della faccia o le emissioni di suoni respiratori; gli arti tendono ad essere rilassati ed ipotonici, i riflessi rotulei pendolari (a seguito di percussione del tendine rotuleo, la gamba oscilla avanti e indietro 4‐5 volte). La corea è caratteristica di: Disturbi ereditari: malattia di Huntington (i movimenti sono solitamente coreoatetosici), corea benigna ereditaria, corea senile,neuroacantosi, atrofia dento‐rubro‐pallido‐luysiana Corea reumatica: corea di Sydenham e corea gravidica (correlata ad un’infezione post‐
streptococcica: autoanticorpi diretti contro i nuclei della base) Corea iatrogena: neurolettici (fenotiazine, aloperidolo), contraccettivi orali, fenitoina, L‐
dopa e DA‐agonisti, cocaina Corea secondaria: LES, tireotossicosi, policitemia vera, AIDS, iperglicemia iperosmolare non chetosica, sindromi paraneoplastiche Emicorea: raramente associata a ictus, tumori, malformazioni vascolari o Atetosi: il termine, derivato da una parola greca che significa “non fisso, mutevole”, indica una condizione caratterizzata dall’incapacità di mantenere in una data posizione le dita delle mani o dei piedi, la lingua, o qualsiasi altra parte del corpo: l’atteggiamento posturale viene interrotto da movimenti lenti, sinuosi, finalistici, tentacolari; schemi di base dei movimenti sono: alternanza prono‐supinazione e flesso‐estensione di braccio o dita, intra‐extrarotazione del piede, retrazione‐
protusione delle labbra, apertura‐chiusura delle palpebre. Sono più lenti dei movimenti coreici: il termine coreoatetosi indica le possibili gradazioni di velocità fra corea ed atetosi. L’atetosi può colpire tutti e 4 gli arti od essere emiplegica: l’associazione di corea ed atetosi in tutti e 4 gli arti è tipica della corea di Huntington e di un’altra malattia ad esordio precoce (atetosi doppia); le cause più frequenti sono: Nel bambino: ipossia (status marmoratus dello striato), ittero nucleare (status dismielinatus) Nell’adulto: malattie degenerative (corea di Huntington, malattia di Wilson), patologie mitocondriali, encefalopatia epatica, intossicazione cronica da fenotiazine od aloperidolo, uso prolungato di L‐dopa, lesioni vascolari di nucleo lenticolare o talamo o Ballismo: indica un movimento a scatto di un arto, poco strutturato ed incontrollabile: vi è una stretta relazione con corea ed atetosi, indicata dalla coesistenza di questi disturbi del movimento e dalla tendenza del ballismo ad evolvere in una coreo atetosi meno disabilitante a carico della parte distale dell’arto affetto. I movimenti ballistici sono generalmente unilaterali (emiballismo) e causati da una lesione acuta del STN controlaterale o delle strutture ad esso adiacenti (per infarto o emorragia, raramente per lesioni demielinizzanti); il ballismo bilaterale è molto raro e dovuto a disturbi metabolici, come il coma iperosmolare non chetosico. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
Distonia: consiste in una postura persistente in una posizione finale di un movimento atetotoide, legata alla contrazione simultanea dei muscoli agonisti ed antagonisti, che fissano l’arto in una posizione non naturale; è strettamente correlata all’atetosi, da cui differisce per la fissità della posizione assunta (spasmo di torsione). Scompare con il sonno, si intensifica in condizioni di stress o durante il movimento volontario (distonie d’azione). Possono aversi due tipi di classificazione: eziologica, che distingue distonie • idiopatiche: familiari o sporadiche (distonia primaria generalizzata come la distonia muscolorum deformans di Oppenheim o distonia torsionale idiopatica, distonia idiopatica sensibile alla L‐dopa), e • sintomatiche: atetosi doppia da ipossia cerebrale, ittero nucleare, corea di Huntington, malattia di Parkinson, malattie da accumulo lisosomiale, intossicazione da farmaci (neurolettici, L‐dopa, anticonvulsivanti, ansiolitici), altre patologie eredodegenerative (cecità neurale, necrosi dello striato con coinvolgimento del nervo ottico, amiotrofia paraplegica) clinica, che distingue distonie • focali: blefarospasmo (contrazione forzata degli orbicolari delle palpebre che può portare a cecità funzionale), distonia oro‐mandibolare (apertura forzata della mandibola, retrazione delle labbra, spasmo del platisma, protrusione della lingua), tic e spasmi d’abitutidine (da manierismi idiosincrasici semplici altamente personalizzati, come della lingua o delle labbra, ad azioni ripetitive come annusare, schiarirsi la gola, sporgere il mento in avanti. Caratteristiche principali sono la stereotipia e l’ irresistibilità. Frequente nei bambini tra 5‐10 anni) distonia distonica, disfagia distonica, torcicollo spasmodico (spasmi o contrazioni intermittenti aritmici, brevi o prolungati, di un muscolo o di un gruppo di muscoli adiacenti del collo), crampo professionale (del musicista o dello scrivano) • segmentale (sindrome di Meige, assiale, crurale, brachiale) • Multifocale • Emilaterale • generalizzata. La distonia più tipica è quella conseguente a malattia di Oppenheim: caratterizzata da eredità autosomica dominante con penetranza ridotta e da assenza di evidenze neurodegenerative, causata da perdita del gene DYT1 (perdita di residuo di acido glutammico nella proteina TorsinA), il tipico onset è precoce (<28 anni, con esordio ad un arto e successiva generalizzazione) con assenza di terapie adeguate. Tremore Si tratta di oscillazioni ritmiche, involontarie, di una parte del corpo con movimento modesto e con distribuzione e frequenza più o meno costante, che risultano dall’azione alternata o sincrona di un gruppo di muscoli e dei loro antagonisti; si accentuano con l’emozione e lo sforzo; si riducono con il riposo; scompaiono con il sonno, si associano in genere ad ipertonia. Si distinguono: • Tremore a riposo: parkinsoniano: tremore grossolano, ritmico, caratterizzato da scariche di attività alternate in muscoli contrapposti. Si verifica quando l’arto è in condizione di riposo ed è, almeno momentaneamente, soppresso o diminuito dai movimenti volontari; in realtà, il termine “a riposo” andrebbe rivisto, dato che una certa contrazione muscolare è sempre presente e che, nel sonno, il tremore scompare. Comunque, si manifesta con estensione‐flessione o adduzione‐abduzione delle dita o della mano (la flesso‐
estensione delle dita in combinazione con l’adduzione‐abduzione del pollice dà luogo al classico tremore del tipo “contar moneta”) o con prono‐supinazione di avambraccio o mano, che si mantengono durante la marcia. Altri reperti tipici sono: blefaroclono (la palpebra socchiusa tende a tremolare in modo ritmico), la lingua protrusa si muove avanti ed indietro. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Agenti scatenanti sono soprattutto stress emotivi, attenuanti L‐dopa ed anticolinergici Tremore intenzionale: cerebellare (vedi dopo) Tremore posturale o Essenziale (senile, familiare): si manifesta a carico di mani, capo e corde vocali; è scatenato da ansia, paura, affaticamento, beta‐agonisti, e ridotto da alcol, propanololo, pirimidone o Da patologie neurologiche: o Aumento del tremore fisiologico (posizione, febbre, freddo, alcool, farmaci, ipertiroidismo, ipoglicemia) Tremori di tipo misto Tremori isolati: del palato, della scrittura, della voce Quadro clinico generale della malattia di Parkinson Dovuta danno della sub stantia nigra pars compacta, i segni cardine sono: • Motori: tremore a riposo, rigidità muscolare, ipo‐ od acinesia e bradicinesia, instabilità posturale • Psichici: bradifrenia, depressione, demenza, disturbi cognitivo‐comportamentali, ansia, attacchi di panico, disturbi psicotici (sindrome non motoria) • Sensitivi: iposmia • Disautonomici: disturbi urologici e gastrointestinali, ipotensione ortostatica • Disturbi del sonno: insonnia notturna, sonnolenza diurna, nicturia, acinesia notturna, incubi, disturbi della fase REM • Altro: disturbi respiratori, cadute, dolori e disestesie, interventi chirurgici Recentemente, si è sottolineata l’importanza di questa sindrome non motoria, come elemento precose di diagnosi: infatti, sintomi quali anosmia, stipsi, depressione e disturbi del sonno, compaiono spesso precocemente, prima dei segni motori; pertanto, anche la definizione patogenetica della malattia è andata mutando, intendo la degenerazione dei nuclei della SNC solo come la punta dell’iceberg di una più ampia degenerazione che coinvolgerebbe anche, e prima, la corteccia olfattiva e temporale, il locus coeruleus, l’amigdala e l’ipotalamo, i nuclei del rafe, il midollo spinale ed il sistema nervoso autonomo. Par II: Il cervelletto Basi neuroanatomiche Il cervelletto, organo principalmente motorio, è responsabile della regolazione e del controllo del tono muscolare, della coordinazione del movimento, in particolare delle abilità motorie specializzate, nonché del controllo della postura e della deambulazione e dell’apprendimento (e quindi dell’automaticità) di nuovi movimenti tramite la pratica. Il cervelletto può essere, neuroanatomicamente (divisione funzionale basata sulle afferenza) e filogeneticamente, distinto in 3 porzioni: • Lobo flocculo‐nodulare: filogeneticamente più antico (e pertanto denominato anche archeocerebellum) e simile in tutti gli animali, situato inferiormente, è separato dalla massa principale del cervelletto, detta corpo cerebellare, dalla fessura postero‐laterale; riceve impulsi propiocettivi speciali dai nuclei vestibolari (quindi è definito anche vestibolocerebellum) ed è deputato essenzialmente all’equilibrio • Lobo anteriore (o paleocerebellum): porzione del corpo cerebellare rostrale alla fessura primaria, massima parte del cervelletto negli altri animali, nell’uomo è relativamente piccolo, essendo formato dal verme antero‐superiore e dalla regione paravermiana contigua, le fibre afferenti derivano in gran parte dei propiocettori degli arti tramite il fascio spino‐cerebellare dorsale, per gli arti inferiori, e ventrale, per gli arti superiori (quindi è definito anche spinocerebellum): influenza principalmente la postura ed il tono muscolare • Lobo posteriore (o neocerebellum): costituito dalle parti mediane del verme e dalle loro vaste espansioni laterali, nell’uomo comprende la maggior parte degli emisferi cerebellari; riceve le fibre afferenti dalla Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
corteccia tramite i nuclei pontini ed il brachium pontis (quindi è definito anche pontocerebellum): è coinvolto soprattutto nella coordinazione dei movimenti intenzionali avviati a livello corticale cerebrale Si possono, quindi, iniziare a delineare tre grandi sindromi cliniche corrispondenti alle suddette divisioni principali: • Lesioni nodulo‐flocculari: causano disturbi dell’equilibrio e, spesso, un nistagmo di posizione, con movimenti degli arti inalterati • Lesioni del lobo anteriore: determinano un aumento delle reazioni di accorciamento e di allungamento, con esagerazione dei riflessi posturali (riflesso positivo di sostegno: estensione dell’arto in risposta ad una leggera pressione sulla pianta del piede) • Lesioni degli emisferi cerebellari: provocano ipotonia ed impaccio degli arti controlaterali, con possibile tremore intenzionale; il coinvolgimento degli emisferi neocerebellari, genera un’atassia o incordinazione spazio/temporale dell’attività cinetica volontaria con ipermetria, adiadococinesia, discronometria e asinergia (vedi avanti) Quanto visto finora è la suddivisione trasversale del cervelletto: tuttavia,le proiezioni afferenti ed efferenti cerebellari sono più propriamente organizzate in suddivisioni longitudinali (e, anche in questo caso, vi saranno quadri clinici specifici a seconda della sede di lesione : • Zona vermiana: coordina i movimenti oculari e del corpo in relazione alla forza di gravità ed i movimenti della testa nello spazio; invia le fibre efferenti al nucleo fastigiale ed al nucleo vestibolare laterale: il nucleo fastigiate controlla i muscoli antigravitari e le altre sinergie muscolari nella stazione eretta e nella marcia. Pertanto, per lesioni in questa sede si avranno disturbi motori che coinvolgono la testa ed il tronco con alterazioni delle funzioni suddette • Zona intermedia: riceve afferenze dalla corteccia motoria , influenzando poi il tono posturale ed i singoli movimenti degli arti omolaterali; invia le efferenze ai nuclei globoso ed emboliforme (nucleo interpositus negli animali). Quindi, il nucleuo interpositus riceve afferenze, oltre che spino‐cerebellari (provenienti dagli organi tendinei del Golgi, dai fusi neuromuscolari, dai recettori cutanei e dagli interneuroni midollari coinvolti nel movimento), cortico‐cerebellari. Per lesioni di questa zona, si avranno, di conseguenza, ipotonia e disturbi posturali • Zona laterale: è deputata soprattutto alla coordinazione dei movimenti degli arti omolaterali, ma anche ad altre funzioni; invia efferenze al nucleo dentato. Il nucleo dentato riceve afferenze dalla corteccia premotoria e supplementare motoria e concorre nel dare avvio ai movimenti intenzionali tramite efferenze al talamo ventrolaterale ed alla corteccia motoria. Lesioni in questa sede saranno, quindi, specialmente atassiche con rallentamento dell’inizio del movimento. In conclusione, si distinguono lesioni più mediane, che coinvolgono l‘equilibrio, la marcia e il tono (sindrome vermiana o statica), e le alterazioni più laterali, che si esprimono soprattutto con atassia (sindrome emisferica o cinetica). Quindi, le fibre efferenti della corteccia cerebellare, rappresentate principalmente dagli assoni delle cellule di Purkinje, proiettano ai nuclei cerebellari profondi (fastigiale, interposittus e dentato), i quali proiettano alla corteccia cerebrale e ad alcuni nuclei tronco encefalici tramite: • Le fibre provenienti dai nuclei dentato, globoso ed emboliforme, che formano il peduncolo cerebellare superiore ed entrano nel tegmento pontino superiore come brachium conjunctivum, decussano a livello del collicolo inferiore e salgono al nucleo ventrolaterale del talamo ed, in misura minore, ai nuclei intralaminari. Alcune fibre ascendenti contraggono sinapsi nel nucleo rosso subito dopo la decussazione, mentre la maggior parte lo attraversa senza interruzione: comunque, i gruppi ventrali talamici che ricevono afferenze dal cervelletto, proiettano alla corteccia supplementare motoria ipsilaterale. Ora, data la decussazione delle fibre cerebello‐talamo‐corticali e la decussazione delle fibre cortico‐spinale, gli effetti di una lesione in un emisfero cerebellare si manifestano omolateralmente. Un piccolo gruppo di fibre del peduncolo cerebellare superiore, inoltre, discende nel tegmento ventro‐
mediale del tronco cerebrale dopo la decussazione e termina nei nuclei reticolo‐tegmentale e paramediano del ponte e nel nucleo olivare inferiore del bulbo: questi nuclei proiettano, attraverso il peduncolo Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
cerebellare inferiore, al cervelletto, soprattutto anteriore, completando così un meccanismo di controllo a feedback cerebello‐reticolo‐cerebellare (triangolo di Mollaret) Il nucleo del fastigio proietta verso i nuclei vestibolari di entrambi i lati ed, in misura minore, verso altri nuclei della formazione reticolare del ponte e del bulbo: i nuclei olivari inferiori proiettano poi, attraverso il peduncolo cerebellare inferiore, alla corteccia cerebellare controlaterale ed alle parti corrispondenti dei nuclei centrali. In definitiva, la corteccia cerebellare influenza l’attività motoria attraverso le sue connessioni con la corteccia motoria, i nuclei del tronco e le loro vie discendenti. In aggiunta, la corteccia cerebellare è organizzata in maniera somatotopica: vi è una doppia rappresentazione a livello sia del lobo anteriore che del lobo posteriore. La struttura corticale uniforme del cervelletto induce a ritenere che l’organo abbia effetti simili (controllo fine ed anticipatoria della funzione) su ogni parte del cervello verso cui proietta (corteccia cerebrale, nuclei della base,talamo) e che, di conseguenza, l’attività delle strutture cerebrali (cognitiva e sensoriale, oltre che motoria), potrebbe essere modulata in modo simile. Quadro clinico Secondo Babinski, dato il ruolo fondamentale del cervelletto nella sinergizzazione dei movimenti, una lesione cerebellare si manifesta soprattutto con dissinergia, ossia disarmonizzazione e scomposizione delle normali sequenze motorie coinvolte in ogni gesto, ma soprattutto in quelli rapidi alternati (disdiaconocinesia); inoltre, tale lesione si accompagna ad aggiustamenti inadeguati della stazione eretta ed a catalessia (mantenimento prolungato di una postura). Holmes, invece, impiegò il termine scomposizione dei movimenti per descrivere la frammentazione di un movimento fluido in una serie irregolare di movimenti a scatti e sottolineò l’importanza del tremore intenzionale come espressione di questo fenomeno. Come giustamente osservato dai due grandi neurologi, quindi, le principali anomalie successive ad una lesione cerebellare sono: incoordinazione dei movimenti volontari (atassia), tremore intenzionale (od atassico), disturbi dell’equilibrio e della deambulazione, riduzione del tono muscolare (soprattutto nelle lesioni acute), disartria (interpretabile come un’incoordinazione dei movimenti fonici), nistagmo. In caso di lesioni limitate, vi è una grande capacità di mantenimento della fusione con solo lieve perdita funzionale E’ ora opportuna analizzare singolarmente i segni: • Atassia (o incoordinazione dei movimenti volontari): si distinguono, in primis, un’atassia statica, quando il malato non può mantenere in una data posizione il corpo o un arto, che ondeggia con ampie e lente oscillazioni, ed atassia dinamica, quando gli arti sono incapaci di movimenti coordinati. In secundis, si distinguono atassia periferiche, quali quelle sensitive, vestibolari o visive, e centrali, quali quelle cerebrali o cerebellari. In caso di atassia cerebellare, vi sarebbero anomalie della rapidità di inizio, della velocità, dell’ampiezza e delle forza del movimento, con conseguenti irregolarità e rallentamento del movimento stesso. Conseguenze dell’atassia sono: o Incoordinazione motoria di: arti superiori (atassia del gesto), arti inferiori (atassia della marcia), tronco (atassia posturale) o Andatura atassica cerebellare (vedi dopo) o Tremore intenzionale: innanzitutto, il termine “intenzionale” è fuorviante poiché il tremore si manifesta solo durante le fasi più intense di un movimento attivo e nell’esecuzione di un movimento preciso e programmato (quindi, il tremore è solitamente assente durante le prime fasi di un movimento volontario, ma compare allorquando vengano richiesti aggiustamenti più precisi, come nel toccare la punta del naso). Contrariamente al tremore parkinsoniano, le oscillazioni avvengono su più di un piano. Questo tipo di tremore indica, invariabilmente, lesioni del cervelletto, ed in particolare del peduncolo cerebellare superiore o Tremore a battito d’ali: tremore grossolano, irregolare, ad ampio raggio, che può compare ogni volta che il paziente attiva i muscoli degli arti, sia per mantenere un atteggiamento posturale, sia per Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
effettuare un movimento; viene evidenziato facendo mantenere al paziente le braccia distese di lato con i gomiti inclinati o Titubazione: movimento ritmico avanti‐dietro di testa e collo superiore o Nistagmo da paralisi di sguardo: i pazienti non sono in grado di mantenere una posizione di sguardo eccentrica, con saccadi ipo‐ od iper‐metriche ed incursioni di saccasi nei movimenti di inseguimento lento (nel tentativo di mantenere la fissazione, gli occhi possono superare il bersaglio e quindi oscillare più volte prima di raggiungere una fissazione precisa) o Dismetria: la velocità e la forza del movimento non vengono controllate in modo normale: l’escursione dell’arto può essere arrestata prematuramente ed il bersaglio viene allora raggiunto con una serie di movimenti a scatto; in altri casi l’arto supera la mira (ipermetria) a causa dell’attivazione ritardata e della ridotta contrazione dei muscoli antagonisti (l’errore viene corretto mediante una serie di movimenti secondari in cui l’indice oscilla attorno al bersaglio prima di arrestarsi o si muove due o tre volte da un lato all’altro del bersaglio) o Adiadococinesia: i suddetti deficit sono più evidenti nelle azioni che richiedono un’alternanza od un rapido cambiamento di direzione del movimento, come prono‐supinazione dell’avambraccio o il toccare in successione le dita con la punta del pollice o Disartria: disturbo del linguaggio (pronuncia indistinta o parola scandita, cioè con sillabe ben scandite; eloquio rallentato; volume rallentato, talora con parola esplosiva) o Disgrafia Tra le cause di atassia cerebellare si ricordano: o Malattie degenerative (Atassia di Friedreich, atrofie multisistemiche, SCA) o Malattie prioniche (CJD, GSS) o Infiammatoria (Sclerosi multipla) o Infettive (Cerebellite virale postinfettiva) o Neoplasie (Medulloblastoma, astrocitoma, emangioblastoma...) o Paraneoplastiche (associate a opsoclono in carcinoma ovarico e mammario, autoimmuni ) o Associate ad alcolismo e carenze nutrizionali (B12) o Intossicazioni (litio, barbiturici, fenitoina, inalazione di solventi, mercurio...) o Malformative (es. malformazione di Arnold‐Chiari) Disturbi dell’equilibrio e della deambulazione: restare eretti a piedi uniti può essere impossibile o tale posizione può essere mantenuta solo per un brevissimo periodo di tempo (astasia); chiudendo gli occhi, nonstante l’assenza del segno di Romberg, può esserci un peggioramento. Nella deambulazione i passi sono irregolari ed i piedi poggiati male a terra (deambulazione a gambe allargate, con deviazione dalla linea retta), con barcollamenti improvvisi (abasia: impossibilità o grave difficoltà nel camminare). Se questi sintomi sono isolati od associati, come frequentemente avviene a vertigini, la lesione è solamente a livello del verme o dei nuclei vestibolari (con danno soprattutto delle loro connessioni con la formazione reticolare pontina e mesencefalica) ; se associata ai sintomi descritti sopra, la lesione è probabilmente estesa agli emisferi cerebellari Ipotonia: diminuzione di resistenza dei muscoli alla mobilizzazione passiva con compromissione del riflesso di arresto (per deficit degli antagonisti: in caso di flessione forzata dell’avambraccio, ad esempio, quando la resistenza dell’esaminatore viene a mancare, per deficit degli estensori, non si verifica l’arresto, col fenomeno del rimbalzo, ma l’arto procede nella flessione per inerzia) Altri sintomi: lieve perdita di forza muscolare, eccessiva affaticabilità, miocloni (contrazioni casuali di muscoli o gruppi muscolari), deficit della memoria e cognitivi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE III PROF.SSA MELONE Malattie dementigine con disordini del movimento, prevalentemente carico dell’organizzazione e della coordinazione Par I: Introduzione alle malattie degenerative Definizioni Le malattie degenerative del SN possono considerarsi patologie, sporadiche o geneticamente determinate, caratterizzate da perdita di neuroni con conseguente alterazione e perdita della connettività circuitale e della funzione gliale di nutrimento e sostegno e sviluppo della sindrome corrispondente. La maggior parte di esse, comunque, va intesa come il risultato di un’interazione tra genotipo, ambiente, stili di vita e fattori contestuali casuali, in cui uno o più di questi assumono, a seconda della sindrome, carattere preponderante. La neuodegenerazione va intesa come morte cellulare nel SN, incapacità a rigenerare e danno permanente; fattori coinvolti sono: stress ossidativo, aggregazione di proteine, infiammazione, apoptosi, eccitotossicità, alterazioni mitocondriali. Questione importante è, quindi, l’accumulo proteico, che in linea di massima può essere dovuto a: • Eccessiva produzione della proteina da triplicazione od iperattività del gene, come nella MP • Scissione enzimatica anomala con formazione di prodotti che causano la formazione di alterati, come nella MA • Insufficiente rimozione con conseguente accumulo Alcuni esempi di patologie neurologiche caratterizzate dal misfolding progressivo e dal conseguente accumulo proteico sono: • Malattia di Alzheimer (MA): beta‐amiloide (placche extracellulari), tau (grovigli intracellulari) • Demenza frontotemporale associata al Parkinson: tau • Malattia di Parkinson (MP, demenza con corpi di Lewy): alfa‐sinucleina (accumulo intracitoplasmatico) • CJD: proteina prionica (placche extracellulari, oligomeri intra‐ ed eztra‐neuronali) • Sindrome da espansione poliglutamminica (malattia di Huntington, atassia spinocerebellare etc.): lunghe fibre glutaminiche (nei nuclei e nel citoplasma neuronali) • Sclerosi laterale amiotrofica (SLA): superossido‐dismutasi (citoplasma neuronale) Caratteristiche cliniche comuni sono: • Inizio insidioso, talvolta asimmetrico, non correlato ad alcun evento antecedente (la sindrome si manifesta solitamente al superamento di un limite soglia, spesso molto elevato, al di sotto del quale non vi è alcuna sintomatologia e superato il quale la reversibilità è pressocchè nulla, come nel caso della MP) • Decorso gradualmente ed inesorabilmente progressivo, quasi mai influenzato dalla terapia, fino all’interessamento bilaterale e simmetrico • Tendenza a colpire, il più delle volte, parti o sistemi funzionali specifici del SN: la maggior parte di esse è caratterizzata da un coinvolgimento selettivo di sistemi di neuroni anatomicamente o funzionalmente correlati (motoneuroni nella SLA, cellule di Purkinje del cervelletto in alcune forme di atassia progressiva). In questi casi si potrebbe usare il termine “atrofie neuronali sistemiche”, in contrapposizione al termine “atrofie neuronali multisistemiche”, in cui si assiste, al contrario, al coinvolgimento di più sistemi funzionali. • Ricorrenza familiare: implica non solo l’ereditarietà, monogenica o poligenica, ma anche l’esposizione comune ad eventuali fattori di rischio Manifestazioni cliniche caratteristiche per una o più sindromi, in ordine di frequenza, sono: spasticità, distonia, atetosi, corea, tics, rigidità, atassia, tremore, mioclono, ballismo. Classificazione • Sindromi caratterizzate da demenza progressiva, con assenza o presenza minima di altri segni neurologici o Atrofia cerebrale diffusa: MA, atrofia cerebrale diffusa di tipo non Alzheimer, alcuni casi di demenza a corpi di Lewy o Atrofia cerebrale circoscritta: malattia di Pick (sclerosi lobare), demenza frontotemporale( DFT), degenerazione talamica Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
•
Sindromi caratterizzate da demenza progressiva in associazione con altre anomali neurologiche o Corea di Huntington (CH) o Malattia a corpi di Lewy (MCL) o Alcuni casi di MP o Degenerazione gangliare corticobasale o Degenerazione cortico‐striato‐spinale di Jakob e complesso demenza‐MP‐SLA o Degenerazione cerebro‐cerebellare o Demenza familiare con paraparesi spastica, amiotrofica o mioclono o Malattia dei poliglucosani o DFT con MP o SLA o Afasia progressiva primaria Sindromi caratterizzate da alterazioni della postura e dei movimenti o MP o Degenerazione strio‐nigrica associata o meno ad insufficienza autonomica (sindrome di Shy‐Drager) ed atrofia olivo‐ponto‐cerebellare (atrofia multisistemica) o Paralisi sovranucleare progressiva (di Steele‐Richardson‐Olszewski) o Distonia muscolorum deformans o Malattia di Hallervorden‐Spatz o CH ed altre forme ereditarie di corea o Degenerazione gangliare corticobasale o MCL o Degenerazione dentato‐rubro‐pallido‐luysiana o Distonie limitate, compresi torcicollo spasmodico e la sindrome di Meige o Tremori familiari ed essenziali o Malattia dei tic multipli (sindrome di Gilles de la Tourette) o Corea acantocitotica Sindromi caratterizzate da atassia progressiva o Atassie spinocerebellari: atassia di Friedreich (AF), atassia di tipo non Friedreich ad esordio precoce o Atassie corticocerebellari: atrofia cerebello‐olivare pura familiare, atrofia cerebellare ad esordio tardvo o Atrofie cerebellari comlicate: degenerazioni olivo‐ponto‐cerebellari, degenerazione dentato‐rubrica, atrofia dentato‐rubro‐pallido‐luysiana Sindromi caratterizzate da debolezza muscolare e da atrofia a lenta evoluzione o Disturbi motori con atrofia: SLA, atrofia muscolare progressiva, paralisi bulbare progressiva, forme ereditarie di atrofia muscolare progressiva e paraplegia spastica, SLA‐DFT o Disturbi motori senza atrofia: sclerosi laterale primaria, paraplegia spastica ereditaria Disturbi sensitivi e sensitivo‐motori (neuropatie): neuropatie ereditarie motorie Sindromi caratterizzate da cecità progressiva ed oftalmoplegia associate o meno ad altre alterazioni neurologiche: degenerazione pigmentosa della retina Sindromi caratterizzate da sordità neurosensoriale: sordità neurosensoriale pura Paraparesi spastiche ereditarie Rappresentano un largo gruppo di disordini geneticamente determinati, in cui il sintomo predominante è la debolezza degli arti inferiori: hanno una prevalenza simile a quella della SLA. Sono riconducibili ad una degenerazione assonale a carico delle porzioni distali del motoneurone superiore (tratto corticospinale) e delle fibre sensitive (fascio gracile); in caso di forme complicate si ha una neurodegenerazione sito‐
specifica addizionale. Sono notevolmente eterogenee, in primis da un punto di vista genetico: • Forme autosomiche dominanti legate alle mutazioni di geni che codificano per la spastina (una proteina di membrana) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Forme autosomiche recessive legate a mutazioni di geni che codificano per la paraplegina (situata sulla membrana mitocondriale: ne deriverebbe un deficit della fosforilazione ossidativa) Forme legate a mutazioni sul cromosoma X in geni che codificano per L1CAM o per PLP •
Comunque, numerosi processi molecolari, a livello del traffico assonale, sottendono alle alterazioni delle PSP: disturbi nella dinamica dei microtubuli e del trasporto assonale e dei mitocondri, alterazioni nello sviluppo e nella mielinizzazione del fascio corticospinale e gracile. In secundis, si ha una eterogeneità sul piano clinico, che consente una classificazione in base alle manifestazioni cliniche: • Forma pura: presenta spasticità e deficit motori degli arti inferiori, ROT vivaci, segno di Babinski; in caso di esordio durante l’infanzia, possono associarsi: piede cavo, dismetria degli arti inferiori, contrazione dei muscoli del polpaccio che costringe il bambino a camminare sulle punte; ipopallestesia, disturbi sfinterici e deterioramento cognitivo dopo i 50 anni • Forma complicata: a questi segni associa: nistagmo, paralisi oculare, atrofia ottica, degenerazione pigmentosa maculare, atassia cerebellare e sensitiva, cataratta, ritardo od insufficienza mentale, polineuropatia sensitivo‐motoria, ittiosi, sordità, pigmentazione cutanea a chiazze, epilessia, atrofia muscolare e demenza Ulteriore classificazione clinica può essere quella basata sull’esordio e sul decorso: • Tipo I: caratterizzato da: o Esordio prima dei 35 anni o Decorso lento o Debolezza, disturbi urinari e sensitivi meno marcati o Solitamente deambulazione fino alla morte, che sopraggiunge per altre cause • Tipo II: è caratterizzato da: o Esordio dopo i 35 anni o Decorso più rapido o Debolezza, disturbi urinari e sensitivi più marcati, tremore d’azione o Perdita della deambulazione intorno ai 60‐70 anni Par II: Sindromi caratterizzate da alterazioni della postura e dei movimenti: taupatie Generalità sulle proteinosi Come detto, molte delle patologie in questione risultano dovute all’accumulo di aggregati proteici (proteinosi cerebrali): le proteine, a causa di mutazioni e di altri meccanismi non ancora chiariti, si riuniscono in aggregati indigeribili e precipitano nello spazio intra‐ (intracitoplasmatico od intranucleare) od extra‐cellulare. In questa classe di patologie rientrano: • Patologie dovute ad alterazione delle poliglutamine: caratterizzate da disordini del movimento • Alfa‐sinucleinopatie: come la MP • Disordini del sistema ubiquitina‐proteasoma: il disturbo del proteasoma, comunque, può essere anche secondario all’eccessivo accumulo di proteine anomale ed al conseguente superamento della capacità degradativa del sistema ubiquitina‐proteasoma • Taupatie: caratterizzate da precipitazione intracitoplasmatica ed intranucleare Taupatie Il termine taupatie si applica ad un gruppo eterogeneo di disordini neurodegenerativi, clinicamente caratterizzati da demenza e/o sintomi motori, in cui l’elemento patologico prevalente è l’accumulo intracellulare di filamenti Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
anomali derivati da proteine tau iperfosforilate associate ai microtubuli; tra le taupatie si ricordano: AD, malattia di Pick, SLA, sindrome di Down, paralisi sovranucleare progressiva (PSP), sindrome frontotemporale associata a parkinsonismo, degenerazione corticobasale. La proteina tau, infatti, normalmente si assembla, fosforilata, ai microtubuli (è quindi una MAP: microtubul associated protein), presente in grosse quantità sia nel SNC che nel SNP: è coinvolta nell’assemblaggio e nella stabilizzazione dei microtubuli e, quindi, insieme ad altre MAP, gioca un ruolo cruciale nel trasporto assoplasmatico. Il gene tau si trova sul cromosoma 17q21 e contiene un totale di 15 esoni per la codifica di 11 isoforme della proteina tau: ciascuna isoforma sembra tessuto‐specifica e ciò potrebbe spiegare l’interessamento di zone cerebrali specifiche in corso di alterazioni specifiche. Tra le mutazioni principali, responsabili tutte di iperfosforilazione della proteina tau (ne deriva, da un lato, il mancato aggancio ai microtubuli con perdita di funzione, e ,dall’altro, l’eccessiva precipitazione con accumulo), vi sono: • N279K: demenza frontale + PSP • P301L: demenza frontotemporale + parkinsonimo • P301S: demenza frontale + degenerazione cortico‐basale Demenza frontotemporale e parkinsonismo legati al cromosoma 17 (DFTP17): Rappresenta un gruppo di patologie neurodegenerative ereditarie, caratterizzate da iniziali alterazioni comportamentali e da successivi disturbi cognitivi e motori. Da un punto di vista anatomopatologico, è caratterizzata da atrofia dei lobi frontali e temporali con perdita di cellule nervose, gliosi astrocitaria e microvacuolizzazioni del neuropilo, più pronunciate nei livelli corticali più superficiali, ma presenti anche nei gangli della base e nella substantia nigra (il quadro istologico, comunque, risulta diverso da quello della MA o della malattia di Pick). Depositi di proteina tau, simili a quelli della MA e abbastanza simili a quelli riscontrati nella degenerazione corticobasale, possono essere riscontrati sia nei neuroni che nelle cellule gliali. Le diverse manifestazioni patologiche riscontrate dipendono probabilmente dalla localizzazione di diverse mutazioni sui geni per la proteina tau. Il quadro clinico sarà caratterizzato da anomalie della personalità e del comportamento tipiche di disfunzioni dei lobi frontali e temporali anteriori (apatia, scarsa capacità di giudizio e di astrazione, alterata emotività, comportamento sociopatico o disinibito), da sindrome afasica per alterazioni del lobo temporale laterale, da segni parkisnoniani. La sindrome di Guam o del Pacifico occidentale rappresenta DFTP17 + patologia del motoneurone Degenerazione corticobasale (DCB): E’ una rigidità extrapiramidale asimmetrica progressiva, associata a segni corticali, prevalentemente parietali, e corticospinali, è caratterizzata da • Esordio dopo i 60 anni e decorso progressivo inesorabile, inizialmente all’arto superiore, poi all’altro e poi a quelli inferiori , non influenzato da alcuna terapia farmacologica • Segni extrapiramidali: bradicinesia, rigidità asimmetrica, acinesia, tremore posturale o d’azione, incapacità a svolgere movimenti semplici con aumento della rigidità ed assunzione di posture bizzarre e distoniche, incoordinazione • Segni corticali: aprassia ideomotoria unilaterale, emiparesi, deficit sensitivi corticali, mano aliena; il paziente risulta totalmente dipendente ed incapace anche alle più semplici azioni quotidiane • Altri segni: distonia o mioclono degli arti, disfagia, disartria precoce, demenza tardiva La diagnosi si avvale di • Quadro anatomopatologico: atrofia corticale, soprattutto fronto‐parietale, con degenerazione della substantia nigra e/o dello striato, asimmetrica • Studio elettroneurofisiologico: mioclono corticale • RM: atrofia frontotemporale asimmetrica + atrofia dei nucleid della base e della SNpc asimmetrica • PET e SPETC: ridotto metabolismo nelle aree coinvolte Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Paralisi sovranucleare progressiva (o sindrome di Steel‐Richardson‐Olszewski) E’ una patologia neurodegenerativa, estremamente grave, lentamente progressiva, che coinvolge il SNC a livello dei gangli della base, del mesencefalo, del tegmento pontino, del cervelletto e della corteccia cerebrale; esordisce dopo i 40 anni e nel giro di 6‐10 anni costringe il paziente sulla sedia a rotelle o a letto; non esiste terapia realmente efficace (è infatti resistente alla L‐dopa). La sintomatologia è caratterizzata da: • Disturbi oculari: difficoltà nei movimenti oculari verticali (oftalmoplegia sovranucleare o paralisi dello sguardo verticale), successiva compromissione delle saccadi volontarie, retrazione delle palpebre superiore, deterioramento e perdita dei movimenti di inseguimento e di rifissazione, riduzione del riflesso di ammiccamento, miosi. Un certo numero di pazienti, comunque, non presenta questi disturbi oculari. • Deterioramento cognitivo, perdita della memoria, anomalie comportamentali (soprattutto per disfunzioni frontali, come apatia), rallentamento ideativo, crisi improvvisa di riso o di pianto, perdita di memoria, fino alla demenza corticale • Disturbi extrapiramidali o Disturbo della deambulazione con cadute ripetute (tipicamente all’indietro) o Irrigidimento in estensione del collo (retrocollis) o Espressione fissa, attonita, del volto (volto “a maschera”) o Rigidità e bradicinesia, soprattutto prossimale: queste alterazioni, insieme all’ipomimia del volto fanno pensare ad una MP; tuttavia, se ne distingue per l’assenza del tremore, la postura eretta o iperestesa anziché flessa (retrocollis piuttosto che antecollis, tipico della MP), caduta all’indietro piuttosto che in avanti, importanti anomalie oculomotorie • Altro: disartria, disfagia, distonia focale degli arti, disturbi del sonno, incontinenza sfinterica • RM: atrofia mesencefalica dorsale (collicoli superiori, nuclei rossi: aspetto ad “orecchie di topo”) • Quadro anatomopatologico: degenerazione neurofibrillare dovuta ad accumulo di proteina tau bilaterale di neuroni e gliosi nella sostanza grigia periacqueduttale, nel collicolo superiore, nel nucleo subtalamico di Luys, nel nucleo rosso, nel pallido, nel nucleo dentato, nei nuclei pretettale, vestibolare e dell’oculomotore. La differenza con la MA è che le fibrille sono rettilinee piuttosto che aggrovigliate • Criteri o Criteri clinici Obbligatori • Esordio oltre i 40 anni con decorso progressivo • Instabilità posturale con frequenti cadute • Lentezza dei movimenti saccadici volontari (PSP possibile) • Paralisi dello sguardo verticale (PSP probabile) Di supporto • Disfunzione cognitiva frontale o sottocorticale • Rigidità assiale • Disfagia e disartria preudobulbare • Blefarospasmo o aprassia nell’apertura degli occhi Di esclusione: encefalite recente, sindrome dell’arto alieno, difetti della corteccia sensitiva o atrofia temporoparietale, psicosi non dovute a trattamento dopaminergico, importanti sgni cerebellari, importanti disturbi disautonomici, segni di parkinsonimo asimmetrici o tremore Par III: Sinucleinopatie Malattia a corpi di Lewy (MCL) E’ caratterizzata da un quadro di parkinsonismo, demenza e frequente tendenza a presentare episodi di delirium, e definita dall’interessamento diffuso dei neuroni corticali da parte di inclusioni tipo corpi di Lewy e da assenza o presenza minima di ammassi neurofibrillari e di placche senili. I corpi di Lewy (CL) sono inclusioni citoplasmatiche ialine, polimeri di alfa‐sinucleina, di forma arrotondata, con parte centrale fortemente acidofila, tipici, ma non patognomonici, della MP e della MCL. Per la diagnosi sono fondamentali: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
Deterioramento cognitivo: di entità sufficiente da interferire con le normali attività della vita quotidiana, vede con particolare frequenza i disturbi dell’attenzione, della memoria, delle attività frontali e sottocorticali e visuospaziali; esordisce solitamente in maniera prima dei disturbi motori Uno (malattia possibile) o due (malattia probabile) di: o Fluttuazioni della cognitività con importanti variazioni di attenzione e coscienza, fino alla demenza franca o Allucinazioni visive ricorrenti, tipicamente strutturate e dettagliate, anche in fase precoce o Caratteristiche motorie parkinsoniane: bradicinesia, rigidità, tremore raro Caratteristiche di supporto o Ipotensione ortostatica, sincopi e/o cadute ripetute (da alterazioni a livello della colonna cellulare intermedio‐laterale del midollo spinale o nei gangli simpatici) o Episodi di perdita della coscienza o Esagerata sensibilità ai neurolettici: sviluppo di parkinsonismo con dosi minime o Deliri strutturati e/o allucinazioni non visive (tipico sarebbe uno stato ansioso cronico con comportamento intermittente psicotico o delirante) o Decorso della demenza più rapido che nella MA o Ottima risposta alla terapia con anticolinesterasici Criteri di esclusione o Malattia cerebrovascolare: come in presenza di alterazioni focali o evidenza alla neuroimaging o Altra malattia somatica o cerebrale Criteri di imaging o RMN: atrofia ippocampale meno pronunciata che nella MA, atrofia più diffusa o DAT‐SCAN: ipointensità di putamen e caudato, atrofia corticale minore che nella MA Diagnosi differenziale o MP con demenza Storia tipica di MP con buona risposta alla L‐dopa Demenza anni dopo l’esordio della malattia Demenza sottocorticale, caratterizzata da: severa sindrome disesecutiva, cue recall normale, instrumental activities normali (linguaggio, prassie e gnosie normali) o MCL Parkinsonismo atipico e scarsa risposta alla L‐dopa Precoce comparsa dei disturbi cognitivi Precoci e ricorrenti allucinazioni visive Fluttuazione dei deficit cognitivi (“stato confusionale cronico”) Malattia di Parkinson Descritta in parte già dalla medicina indiana e cinese migliaia di anni fa, una trattazione sistematica, seppur incompleta, fu fatta, per la prima volta in Europa da un chirurgo londinese, James Parkinson, a cui si deve l’intuizione e la sistematizzazione di una sindrome caratterizzata da “tremori involontari, con forza muscolare diminuita e tendenza a piegare il tronco in avanti, mentre sensibilità ed intelligenza risultano integre”. A Parkinson, ma non, negli anni successivi, ad Althaus e Charcot, sfuggì l’importanza della rigidità e della bradicinesia. La malattia è risultata dovuta ad una distruzione, di almeno l’80% dei neuroni pigmentati della SNpc con conseguente interruzione delle sue connessioni con lo striato (vedi lezione Melone 1): sebbene la perdita di neuroni pigmentati nella SNpc, e di tirosina beta‐idrossilasi con riduzione della sintesi di dopamina (DA), sia correlata ad un fisiologico invecchiamento, una perdita così netta, come nella MP, risulta decisamente correlata alla sindrome parkinsoniana. Tra i fattori da rischio vanno ricordati, come suggerito dal modello sperimentale con MPTP ed in aggiunta all’invecchiamento ed alla familiarità: tossine ambientali (con maggior prevalenza, infatti, in aree agricole), tossine industriali ed inquinanti (con maggior prevalenza nei paesi industrializzati e nelle città), metalli pesanti. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
La MPTP, un analogo della meperidina, che veniva assunta dai tossicodipendenti, diviene tossica in seguito ad ossidazione da parte delle MAO‐B in MPP+ (metil‐4‐fenilperidina): questo derivato, da un lato, compete con la DA per il reuptake, diminuendone la quantità intracellulare ed aumentandone di conseguenza la degradazione extracellulare, dall’altro sembra avere un effetto tossico sui mitocondri, con conseguente stress ossidativo, e sulle vescicole secretorie, con loro diminuzione ed aumento della degradazione intracitoplasmatica di DA; ne consegue, da questi meccanismi, una morte neuronale soprattutto, ma non solo, nella SNpc. La distruzione, infatti, non inizia né avviene solamente nella SNpc, ma in altre regioni cerebrali, dando luogo ad un preciso pattern migratorio e sintomatologico, una cui attenta conoscenza e valutazione può consentire al clinico esperto una pronta diagnosi con una terapia precoce ed un rallentamento della neurodegenerazione: secondo questo pattern, i primi nuclei interessati sono quelli motori del nervo vago e quelli del locus coeruleus, seguiti dai nuclei adiacenti, secondo un percorso caudo‐rostrale. In seguito, si ha l’interessamento dei neuroni della SNpc e dell’amigdala, nonché quelli della regione olfattoria, con passaggio dalla fase presintomatica a quella sintomatica. Succede poi l’interessamento di talamo e mesocortex, quello della neocorteccia associativa e di quella primaria. Ora, prima di analizzare il quadro clinico, occorre indagare gli aspetti genetici della malattia: difatti, sebbene le forme genetiche siano un’infima percentuale di quelle sporadiche ( <1%), i meccanismi patogenetici responsabili potrebbero servire un valido appoggio alla comprensione dei meccanismi patogenetici delle forme sporadiche. Quindi, anticipando che numerosi sono i geni e le proteine coinvolte nell’insorgenza delle forme familiari del MP, preponderante, soprattutto nella formazione dei corpi di Lewy, sembra l’alterazione dell’alfa‐sinucleina: comunque, geni e proteine coinvolti sono: • Park 1: alfa‐sinucleina: questa proteina, presente normalmente in forma solubile a conformazione aperta nei terminali assonici presinaptici, forma, a concentrazioni più elevate, aggregati di filamenti intraneuronali, principali costituenti dei corpi di Lewy. La funzione dell’alfa‐sinucleina sarebbe quella di collegamento, meccanico e funzionale, della membrana assonale con la membrana vescicolare, con un ruolo anche nella plasticità sinaptica. Una sua alterazione comporterebbe, quindi, da un lato una perdita di funzionalità delle vescicole contenenti DA, dall’altro un suo accumulo con formazione dei CL. Una sua alterazione può essere dovuta a: duplicazione di una copia del gene, mutazioni puntiformi, mutazioni dei geni preposti al suo catabolismo (vedi avanti). L’accumulo intracellulare di CL porta, poi, ad apoptosi e degenerazione neuronale • Park 2: parkina: mutata in una forma sindromica autosomica recessiva (detta anche malattia da parkina, ad esordio molto precoce, a differenza della sindrome da mutazione del gene per l’alfa‐sinucleina, autosomica dominante e ad esordio un po’ più tardivo), codifica per l’E3 ubiquitina‐legasi: ne deriva un deficit di degradazione delle proteine intracellulari con loro accumulo, in particolare di alfa‐sinucleina, ma assenza di corpi di Lewy. In questa forma, inoltre, è caratteristica una riduzione diffusa, alla PET, della captazione di DA, diversamente dalla malattia sporadica • Park 5: UCH‐L1 (ubiquitina‐carbossiterminale‐idrolasi L1): la sindrome conseguente ad un’ alterazione di questo gene, autosomica dominante e ad insorgenza intorno ai 50 anni, è dovuta ad un’incorretta attività dei monomeri di ubiquitina, con accumulo, non solo di alfa‐sinucleina, che non viene degradata e forma i CL, ma anche degli stessi monomeri • Park 6 e Park 7: PINK1 e DJ1: sono geni mitocondriali, la cui alterazione causa alterazioni della funzionalità mitocondriale con stress ossidativo e conseguente sindrome parkinsoniana • Park 8: dardarina: codifica per una chinasi, probabilmente responsabile di stress ossidativo • NR4A2: NURR1: codifica per una proteina coinvolta nella formazione ed identità dei neuroni DA Considerate le forme genetiche, è ipotizzabile un meccanismo patogenetico per le forme sporadiche, che si fonda sull’alterazione del complesso mitocondriale, con conseguente aumento dello stress ossidativo, alterazioni della struttura dell’alfa‐sinucleina per perossidazione, mancata degradazione e suo accumulo, a cui parteciperebbe, in un circolo vizioso, un’alterazione del complesso ubiquitina‐proteasoma; inoltre, la disfunzione mitocondriale causerebbe una diminuzione dell’ATP, con aumento della depolarizzazione e dell’eccitabilità neuronale, mediata dai recettori NMDA del glutammato. Passando ora all’analisi del quadro clinico è opportuno distinguere: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
Sintomi extramotori precoci (vedi anche lezione Melone 1): anosmia, disordini del sonno, depressione, disfunzione autonomica (sindrome parkinsoniana non motoria) Sintomi motori precoci: rarità dell’ammiccamento, lieve ampliamento della rima palpebrale (occhi sgranati: segno di Stellwag), riduzione dei movimenti dei muscoli facciali (ipomimia o volto “a maschera”), numero ridotto di aggiustamenti e piccoli spostamenti Sintomi motori tipici o Tremore: classicamente a riposo, può comunque manifestarsi come lievissimo tremore d’azione, a livello delle dita o delle mani o Rigidità ed ipertonia: l’ipertonia posturale è prevalente nei muscoli del tronco, a livello dei flessori, con conseguente postura curva del paziente o Bradicinesia ed ipo‐ od a‐cinesia: la povertà di movimento si traduce anche in deficit di deglutizione con aumento della salivazione, masticazione lenta ed incapace, assenza di oscillazioni delle braccia durante la marcia o Alterazioni della deambulazione: il paziente perde spesso l’equilibrio, e camminando in avanti o indietro, sembra “rincorrere il centro di gravità del corpo” con una serie di piccoli passi, per evitare di cadere (festinazione) o Altri: micrografia, disturbi del linguaggio (disartria ipocinetica), difficoltà a girarsi nel letto, alterazione dei movimenti oculari, demenza Il reperto anatomopatologico più costante e tipico è una perdita delle cellule pigmentate della substantia nigra e di altri nuclei pigmentati (locus coeruleus, nucleo motore dorsale del vago): i nuclei pigmentati presentano marcata deplezione di cellule ed una gliosi sostitutiva. Inoltre, molte delle cellule rimaste nei nuclei pigmentati contengono inclusioni citoplasmatiche eosinofile circondate da un alone chiaro, i cosiddetti corpi di Lewy. Altre regioni coinvolte nella perdita neuronale sono la formazione reticolare mesencefalica, i gangli del simpatico, altri nuclei tronco encefalici. La diagnosi strumentale si avvale di: • RM: riduzione dello spessore medio della sub stantia nigra pars compacta • Spettroscopia: riduzione del NAA, indicativa di perdita neuronale, associata a progressivo aumento dei lattati • DAT‐SCAN: studio PET o SPECT del trasportatore della dopamina La terapia, infine, si basa su: • L‐dopa + inibitori della dopa‐decarbossilasi (carbidopa, benserazide) • Inibitori delle COMT: tolcapone, entacapone • Agonisti dopaminergici: bromocriptina, pergolide, cabergolina, pramipexolo, ropinirolo, • Anticolinergici: biperidene, prociclidina, metixene • I‐MAOB: selegilina, rasagilina • Agonisti del glutammato: amantadina Atrofia multisistemica (AMS) Può essere definita come una malattia sporadica, talora geneticamente determinata, neurodegenerativa, progressiva, ad eziopatogenesi non definita, caratterizzata dalla variabile combinazione di disturbi a carico dei sistemi autonomici, extrapiramidali, cerebellari e piramidali. Nell’ambito delle AMS, si annoverano e si associano tra loro: • Degenerazione striato‐nigrale: è correlata clinicamente alla MP, ma se ne distingue, pur con una simile alterazione della sostanza nera pars compacta (SNpc), da un punto di vista anatomo‐patologico: infatti, da un lato, sono assenti i corpi di Lewy; dall’altro, vi è anche una notevole degenerazione a carico dello striato (soprattutto del putamen) e, secondariamente, del pallido. Clinicamente si caratterizza per una sindrome parkinsoniana, pur in assenza del caratteristico tremore (per le differenze vedi dopo) • Degenerazione striato‐nigrale associata ad insufficienza autonomica: sindrome di Shy‐Drager (SSD): associa alla degenerazione striato‐nigrale, una perdita delle cellule delle corna intermedio‐laterali del midollo spinale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
e dei nuclei pigmentati del troncoencefalo, che causano le alterazioni autonomi che: ipotensione ortostatica, sincope, impotenza, perdita della sudorazione, secchezza delle fauci, disturbi minzionali, disfonia o stridore laringeo • Degenerazione olivo‐ponto‐cerebellare: è la manifestazione di un processo degenerativo, che origina nei nuclei pontini e, con andamento anterogrado, si estende alle fibre trasverse del ponte, sino a raggiungere gli emisferi cerebellari, risparmiando il verme Quindi, queste forme possono presentarsi isolate o combinarsi tra loro, o con disturbi autonomici o piramidali, a dare le AMS (la SSD è già una AMS). A loro volta, le AMS posso classificarsi in base alla predominanza di sintomi extrapiramidali parkinsoniani (AMS‐P) o di sintomi cerebellari (AMS‐C), secondo i criteri di Quinn: • AMS‐P o Possibile: esordio sporadico in età adulta (>30 anni), scarsa o nulla risposta alla L‐dopa, segni parkinsoniani o Probabile: segni di possibilità + severa disfunzione autonomica, associazione di disturbi piramidali o cerebellari, alterazioni EMG o Certa: conferma autoptica post‐mortem • AMS‐C o Possibile: esordio sporadico oltre i 30 anni, sindrome cerebellare con segni di parkinsonimo o di sindrome piramidale o Probabile: segni di possibilità + severa disfunzione autonomica, alterazioni EMG o Certa: conferma autoptica post‐mortem Quindi, la sintomatologia sarà, in vario modo ed in eterogenea associazione, caratterizzata da: • Segni extrapiramidali: rigidità e bradicinesia, con tremore caratteristicamente assente o molto lieve ed incostante • Segni cerebellari: atassia cerebellare, disartria, nistagmo • Segni piramidali: segno di Babinski, iperriflessia • Segni autonomici: ipotensione ortostatica (talvolta fino alla sincope con frequenti cadute), stipsi od incontinenza fecale, impotenza,disfunzione erettile, perdita della sudorazione con secchezza cutanea, secchezza delle fauci e congiuntivale, miosi, incontinenza o ritenzione urinaria; paralisi delle corde vocali con stridore, disfonia ed ostruzione delle vie aeree Nonostante la notevole similitudine di molte di queste forme, e soprattutto della SSD, con la MP, vi sono alcune importanti differenze: • Assenza, il più delle volte, di tremore • Maggior incidenza e gravità dei disturbi vegetativi • Coinvolgimento più simmetrico • Scarsa risposta alla terapia con L‐dopa • Rapidità del decorso • Anomalie dei movimenti oculari scarsamente evidenti • Differenze strumentali o RMN encefalo: nella MP si ha ipointensità del pallido e della substantia nigra da deposizione di ferro con normale segnale dal putamen; nella AMS si associa ipointensità del putamen ed iperintensità della zona periputaminale da fenomeni gliotici, più evidenti nella forma parkinsoniana. Inoltre, nella MP il troncoencefalo è poco o nulla interessato, mentre nella AMS, in visione laterale, si ha un restringimento (fenomeno del colibrì). Peraltro, nella AMS, a causa della degenerazione ponto‐
cerebellare, le fibre pontine laterali e longitudinali risultano, per fenomeni gliotici, più evidenti (iperintensità cruciforme in T2 o “hot‐cross‐bun” o fenomeno del panino di Pasqua). Infine, si ha atrofia cerebellare, con iperintensità in T2 da fenomeni gliotici, più evidente nella forma cerebellare o TC: rivela alterazioni, oltre che nella substantia nigra, come nella MP, anche a livello del putamen o SPECT: ridotta captazione nelle aree coinvolte Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Schemi diagnostici parkinsonismi In caso di rigidità e bradicinesia il quadro può essere: • Simmetrico e prevalentemente assiale e nucale, con cadute all’indietro, limitazione nello sguardo verticale, apatia: PSP • Asimmetrico, tremore a riposo, miglioramento con terapia: MP • Asimmetrico, disturbi autonomici, scarsa risposta terapeutica: AMS, SSN Parkinsonismi plus possono essere considerate tutte quelle condizioni che associano altri disturbi alla MP; una classificazione dei parkinsonismi plus (P+) è: • Disturbi sporadici o PSP o AMS o SSN, degenerazione corticobasale, atrofia pontocerebellare o Malattia a corpi di Lewy diffusa o Degenerazione pallidale diffusa o Calcinosi diffusa striato‐pallidale o MP con neuroacantocitosi • Disturbi familiari o Associati con demenza: DFTP17, DCB, malattia a corpi di Lewy diffusa familiare o Associati con disturbi psichiatrici e respiratori o Associati con altri disturbi del movimento: distonia, mioclonia etc. o Associati con anomalie dei movimenti oculari: PSP familiare Possibile è anche una diagnosi differenziale alla RM tra: • AMS o Ipointensità putaminale o Iperintensità periputaminale o Dilatazione del IV ventricoloatrofia del nucleo dentato o Aumento del segnale nei peduncoli cerebellari e nel ponte (hot‐cross bun) • PSP o Diametro troncoencefalico <17 mm (segno del colibrì): è praticamente patognomonico o Aumento di segnale troncoencefalico o Dilatazione del III ventricolo o Atrofia frontotemporale o Atrofia o aumento del segnale dal nucleo rosso • DCB: o Atrofia corticale frontoparietale asimmetrica o Atrofia putaminale dilatazione dei ventricoli laterali o Dilatazione del terzo ventricolo o Atrofia pontina • MP o Atrofia della substantia nigra o Atrofia putaminale Par IV: sindromi caratterizzate da demenza progressiva in associazione con altre anomali neurologiche Corea di Huntington La CH rientra tra le patologie da triplette, caratterizzate da una ripetizione abnorme di triplette nucleotidiche, con formazione di proteine anomale; le prime ad essere descritte furono la sindrome dell’X fragile e la sindrome di Kennedy. La ripetizione delle triplette può avvenire sia in regioni codificanti che in regioni non codificanti: comunque, Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
il difetto genico non consiste sempre nella perdita di funzione della proteina tradotta, ma anche, talvolta, nell’aumento di funzioni della proteina. Nel caso della CH, l’accumulo di huntingtina, determinato da un numero abnorme di triplette e quindi da una sua alterata conformazione, causa una degenerazione dei neuroni GABAergici dello striato, in particolare di quelli della via indiretta (nella forma acinetico‐rigida, è coinvolta la via diretta,vedi lezione 1 Melone). L’accumulo di triplette può considerarsi: • Normale: fino a 34 • Sospetto: 35‐39 • Diagnostico: oltre le 40: l’aumento delle triplette si correla, non solo ad un quadro clinicamente peggiore, ma anche ad un esordio precoce. Tipico è anche il fenomeno dell’anticipazione, imputabile all’allungamento della sequenza delle triplette e, di conseguenza, alla trasmissione di un numero maggiore di triplette Possono distinguersi, in base all’età d’esordio, due varianti: • Forma classica o Prevalenza maggiore, trasmissione autosomica dominante, esordio a 35‐40 anni o Segni clinici iniziali Disturbo della personalità: inizia con forme subdole di alterazioni del carattere, come sospettosità, aggressività, irritabilità, impulsività, eccentricità, ipersessualià, depressione, declino cognitivo (“demenza sottocorticale”), disturbi del sonno, e può sfociare in forme francamente deliranti o allucinate. Segni motori: si ha inizialmente un quadro premonitore con lentezza di movimento di mani e dita, ridotta velocità nel tamburellare le dita e difficoltà nell’eseguire movimenti con le mani; si hanno, inoltre, aumento della frequenza dell’ammiccamento (al contrario della MP) ed alterazioni dei movimenti della lingua. Il quadro poi viene sconvolto dall’irruzione dei movimenti coreici o Segni clinici tardivi Demenza progressiva: fino ad uno stato vegetativo con invalidità totale (con forte rischio di suicidio) Segni motori: disartria, coreoatetosi, disturbi dei movimenti oculari, distonia, rigidità (nella variante acinetico‐rigida) • Forma giovanile o rigida o variante di Westphal o Prevalenza minore, trasmissione autosomica dominante (nell’80% dei casi dal padre), esordio prima dei 15 anni o Segni clinici iniziali: disturbi della personalità, rigidità, distonia o Segni clinici tardivi: demenza progressiva, disartria, anomalia dei movimenti oculari, tremore, atassia, crisi epilettiche, bradicinesia Segno anatomopatologico e strumentale caratteristico è l’atrofia bilaterale della testa del caudato e del putamen, di solito accompagnata da atrofia moderata a livello delle regioni frontali e temporali; alla PET, si riscontra un diminuito metabolismo del glucosio in queste aree. Infine, un trattamento utile è quello con aloperidolo (altri farmaci che riducono la quantità di effetti collaterali o bloccano i recettori dopaminergici, come reserpina, clozapina e tetrabenazina, possono essere di una certa utilità, ma con effetti collaterali gravi: sonnolenza, acatisia, discinesia tardiva). Par V: Sindromi caratterizzate da atassia progressiva Classificazione • Atassie autosomiche recessive o Atassia di Friedreich o Atassie cerebellari ad esordio precoce con ROT conservati o Atassia con deficit di vitamina E Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Atassia con: ipogonadismo (atassia ereditaria di Holmes), mioclono (sindrome di Ramsay‐Hunt), retinopatia pigmentosa, atrofia ottica con o senza ritardo mentale (sindrome di Behr), cataratta e ritardo mentale (sindrome di Marinesco‐Sjorgen), sordità infantile, sindrome extrapiramidale Atassia cerebellare ad esordio tardivo Atassie cerebellari autosomiche dominanti Atassia spino‐cerebellare X‐linked Atassie cerebellari autosomiche dominanti • I: atassia cerebellare, oftalmoplegia, atrofia ottica, demenza e/o segni extrapiramidali • II: atassia cerebellare, retinopatia pigmentata, oftalmoplegia e/o segni extrapiramidali • III: atassia cerebellare pura ad esordio tardivo • IV: atassia cerebellare, ipoacusia e neuropatia • Atassie periodiche o episodiche Atassia di Friedreich E’ il prototipo di tutte le forme di atassia progressiva e rende conto di circa la metà di tutti casi di atassia ereditaria: Friedreich dimostrò, circa un secolo e mezzo fa, che esisteva una forma di atassia della deambulazione non sifilitica. In circa la metà dei casi, l’esordio è prima dei 10 anni di età e, comunque, quasi mai dopo i 25 anni: la malattia è poi invariabilmente progressiva, ed incurabile, nei 5 anni successivi. Il quadro clinico è caratterizzato da: • Atassia della deambulazione: sintomi precoci sono la difficoltà a mantenere la stazione eretta e l’incapacità di correre; segue poi l’atassia della marcia di tipo sensitivo‐cerebellare (tabeto‐cerebellare): il paziente mantiene la stazione eretta con i piedi molto distanziati, cambiando continuamente posizione per mantenere l’equilibrio (atassia statica). La chiusura degli occhi causa caduta a terra (segno di Romberg), a testimoniare l’interessamento della componente spinale. Disturbi correlato sono l’impaccio ad utilizzare le manie la disartria (fino all’incomprensione della parola) • Incoordinazione di respirazione, deglutizione e riso fin quasi al soffocamento • Piede cavo: arco plantare elevato con retrazione delle dita a livello delle articolazioni MTF e flessione a livello delle IF (dita a martello) • Cifoscoliosi: dovuta ad uno squilibrio dei muscoli paravertebrali, può causare un’insufficienza respiratoria • Miocardiopatia: le fibre miocardiche sono ipertrofiche con degenerazione e fibrosi sostitutiva: ne conseguono aritmie e scompenso cardiaco, che possono condurre all’exitus • Intolleranza al glucosio e DM: per deposizione di ferro nelle cellule‐beta pancreatiche • Senso di posizione e pallestesia deficitari, perdita della sensibilità vibratoria e, talvolta, anche di quella tattile, dolorifica e termica • Segno di Babinski positivo, con ROT ridotti od assenti • Instabilità emotiva • Quadro RM: riduzione di spessore del midollo spinale, prevalentemente nella sostanza grigia, atrofia nel cervelletto Esistono delle varianti: • Ad esordio precoce con conservazione dei ROT: è caratterizzata da possibile associazione ad ipogonadismo, possibile spasticità, assenza di cardiopatia e di cifoscoliosi, prognosi migliore • Ad esordio tardivo Da un punto di vista patogenetico, la malattia è dovuta ad un’amplificazione di triplette GAA, in un introne del gene FRDA (sul locus 9q13) per la fratassina, proteina della matrice mitocondriale con la funzione di evitare il sovraccarico di ferro: si riconoscono i tipi allelici: • Normali: fino a 35 ripetizioni • Portatori di premutazioni: da 36 a 100 ripetizioni Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Portatori di malattia: oltre le 100 ripetizioni: l’espansione della tripletta GAA interferisce con la trascrizione del gene, con conseguente alterazione del processo di elongazione del trascritto (la riduzione della trascrizione è proporzionale alla lunghezza dell’espansione della tripletta), ne consegue una notevole riduzione dei livelli di fratassina E’ possibile una mutazione a carico del gene FRDA2 ed anche una forma che non riconosce mutazioni su questi geni. Comunque, alterazioni biochimiche e cellulari conseguenti sono: • Alterazioni mitocondriali: la fratassina, infatti, codifica per una proteina mitocondriale coinvolta nel metabolismo del ferro o Diminuzione attività dell’aconitasi e degli enzimi del complesso I‐III della catena respiratoria (enzimi che contengono gruppi Fe‐S): ne deriva un danno ossidativo, soprattutto a livello di SNC, cuore e pancreas, ma anche a livello di SNP e muscoli o Accumulo di ferro mitocondriale soprattutto nei tessuti cardiaci o Perdita di DNA mitocondriale • Diminuzione di fosfolipidi nella corteccia cerebellare ed occipitale • Perdita neuronale nel midollo spinale, nella corteccia e nel cervelletto: le colonne posteriori, i fasci corticospinali e quelli spinocerebellari risultano impoveriti di fibre mieliniche, con una gliosi fibrosa; possono essere interessati anche i nuclei dei nervi cranici (VIII, X, XII) Possibili, ma scarsamente efficaci, opzioni terapeutiche sono: supplemento di fratassina, supplemento di antiossidanti, impiego di chelanti per il ferro, supplemento di L‐cartina, terapia genica, ehnancers esogeni. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ III PROF. PUOTI Demenze neurodegenerative Par I: Generalità Classificazioni La demenza, secondo Hughling Jackson, è la depersonalizzazione dell’uomo, cioè la perdita del concetto di persona, del sé, di ciò che rende ognuno unico ed irripetibile. Si hanno diverse classificazioni: • In base all’età d’esordio o Demenze presenili o Demenze senili (oltre i 65 anni) • In base alla sede di lesione o Corticale: generalmente quelle corticali sono degenerative, mentre quelle sottocorticali possono non esserlo e possono essere dovute a cause vascolari o da idrocefalo normoteso Demenza di Alzheimer (DA) Demenza con corpi di Lewy (DCL) Demenza frontotemporale (DFT o malattia di Pick) o Sottocorticale: in questi casi, in associazione coi frequenti disturbi dei movimenti extrapiramidali, si osservano smemoratezza, rallentamento dei processi del pensiero, apatia e depressione, mentre risultano relativamente integri il lessico, la capacità di denominazione e le prassie. Al contrario, le demenza corticali si distinguono per i gravi disturbi della memoria, del linguaggio e della capacità di calcolo, per gli evidenti segni di aprassia ed agnosia, nonché per l’alterata capacità di produrre un pensiero astratto Demenze vascolari Demenze da idrocefalo normoteso Demenze con disturbi del movimento: corea di Huntington (CH), morbo di Parkinson (MP), paralisi sovranucleare progressiva (PSP), degenerazione cortico‐basale (DCB) • In base all’eziologia o Demenze primitive: non si conosce la causa specifica e sono irreversibili: MA MCL Altre malattie degenerative: MP, CH, PSP, epilessia mioclonico progressiva Malattie da prioni o Demenze secondarie: si conosce la causa specifica e sono reversibili Vascolari: • Multi‐infartuale • Da singoli infarti • Da coinvolgimento di piccoli vasi • Da ipoperfusione • Da emorragia Endocrino‐metaboliche Carenziali • Demenza alcolica • Sindrome di Wernicke‐Korsakoff • Pellagra • Deficit di B12 o folati Da agenti tossici: metalli pesanti (piombo, arsenico, manganese, alluminio), CO, farmaci Da neoplasie intracraniche Da idrocefalo normoteso: l’idrocefalo normoteso può provocare una demenza sottocorticale progressiva potenzialmente reversibile Da traumi cranici: ematomi, emorragie, ipossia, encefalopatia cronica dei pugili Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Da infezioni: HIV, meningiti croniche, encefaliti Da patologie autoimmunitarie e demielinizzanti: SM In base alla prognosi o Demenze degenerative o irreversibili: non esiste terapia contro la neurodegenerazione: DA, MCL, DFT, MP e sindromi parkinsoniane atipiche, CH, DCB, PSP o Non degenerative o reversibili: demenza secondarie e psichiatriche (pseudodemenza) Cenni epidemiologici Nel mondo occidentale la DA è quella più frequente (60‐70%), in quello orientale prevale invece la demenza vascolare: comunque, in particolare nel mondo occidentale, la reale prevalenza delle diverse forme di demenza è inficiata dalla teoria predominante (un tempo vascolare, poi DA, ora si iniziano ad evidenziare anche demenze neurodegenerative non Alzheimer). La prevalenza della demenza aumenta con l’età ed è quindi correlata all’invecchiamento: di conseguenza, dato l’invecchiamento della popolazione, anche l’incidenza è in aumento. Demenze vascolari Costituiscono il 10‐15% di tutte le demenze. • Elementi che le distinguono dalle demenze neurodegenerative o Evidenze cliniche e di neuroimaging di MCV o Esordio spesso prima dei 65 anni o Relazione tra demenza e MCV: esordio sincrono, fluttuazioni, deterioramento “a scalini” dei deficit cognitivi (per l’aumento del carico lesionale o per l’insorgenza di un nuovo infarto in posizione strategica) • Sottotipi o Multinfartuale: è' la risultante di infarti multipli e completi, generalmente nel territorio di distribuzione, corticale o sottocorticale, dei grossi vasi. Questo provoca la perdita di sostanza cerebrale e la conseguente interruzione della continuità tra i circuiti neuronali: maggiore è la compromissione vascolare, cioè il numero degli infarti, maggiore sarà il grado di demenza o Da singoli infarti strategici: è data dai singoli infarti in aree cerebrali funzionalmente importanti per le prestazioni cognitive (es. area mediale del lobo temporale dove risiedono le strutture coinvolte nella memoria; giro angolare; prosencefalo basale; talamo; silviana di sinistra, etc) o Da coinvolgimento di piccoli vasi che irrorano soprattutto le strutture sottocorticali o Da ipoperfusione: è il risulatato di un danno ipossico acuto, cronico o ripetuto o Emorragica: è la sequela di lesioni emorragiche intraparenchimali (fra le più frequenti l'emorragia intracerebrale a sede capsulare) o extraparenchimali (ematoma subdurale cronico, emorragia sub aracnoidea) o Mista: demenza vascolare con componente degenerativa, spesso da invecchiamento Par II: Demenza di Alzheimer Dati epidemiologici E’ la più comune ed importante patologia degenerativa del cervello: l’incidenza ha un aumento costante ed esponenziale correlato all’età, specie dopo i 65 anni, anche se è possibile un esordio nel presenio (secondo il professore l’incidenza della DA diminuirebbe al superamento di una certa età: in realtà la confusione è dovuta al fatto che sono i numeri di casi e non l’incidenza a ridursi, per l’ovvio aumento generale della mortalità. La prevalenza, infatti, risulta in aumento costante con l’età. Comunque, a testimonianza dell’incidenza progressivamente crescente con l’età si cita lo studio di Bemejo‐Pareja et al. , secondo il quale nella popolazione generale l’incidenza è di 2,5 casi ogni 1.000 persone per la fascia di età tra i 65 e i 69 anni; sale a 9 casi su 1.000 persone tra i 75 e i 79 anni, e a 40,2 casi su 1.000 persone tra gli 85 e gli 89 anni). La sopravvivenza dei pazienti con DA è ridotta, principalmente a causa di malattie respiratorie e cardiovascolari e dell’inanizione, ma anche per altre ragioni non del tutto chiarite. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Si presenta in circa il 90% dei casi come forma sporadica, nel restante numero dei casi si presenta in forma familiare, per lo più legata a mutazioni di geni differenti, solitamente con iperproduzione di beta‐amiloide, ed ad esordio precoce. Una certa correlazione esiste, infine, con l’Apo‐E, proteina che contribuisce al trasporto di colesterolo nei tessuti, ed in particolare nel SNC, dove il colesterolo svolge l’importante ruolo di costituente delle membrane neuronali e della mielina. Il rischio aumenta con la presenza di un allele per l’isoforma Apo‐E4, ed ancor di più con la presenza di due alleli Apo‐E4. Clinica L’inizio delle alterazioni mentali è di solito talmente insidioso che né la famiglia né il paziente sono in grado di precisarne il momento: comunque, il sintomo principale è lo sviluppo graduale di un deficit di memoria (pattern ipomnestico). Difatti, l’alterazione neuropatologica inizia nelle strutture mediali del lobo temporale, ed in particolare nell’ippocampo, deputato appunto alla memoria: da qui diffonde alla corteccia entorinale, alla restante corteccia temporale, alla corteccia parietale (disturbi del linguaggio), a quella occipitale (disturbi visuospaziali) ed a quella frontale (disturbi del comportamento: esasperazione di tratti caratteriali che possono sfociare nel delirio, ad esempio nel delirio di gelosia). Il paziente si rende conto del deterioramento cognitivo e ciò può innescare disturbi depressivi od ideazioni suicidarie fino all’attuazione del suicidio. Si distinguono diverse fasi dello sviluppo della patologia. • Prima fase o Lieve perdita di memoria per gli eventi recenti e per gli impegni: quelli remoti sono conservati (legge della memoria di Ribot). Vi sarebbe un lungo periodo preclinico (7 anni) con solamente lieve perdita della memoria, seguito dal decorso sintomatico, che dura mediamente 5 anni. Comunque, questa primissima fase sarebbe caratterizzata da uno stadio amnesico di Korsakoff, con un deficit spropositato della memoria di fissazione, con integrità delle altre capacità cognitive. o Alterazioni del linguaggio: linguaggio esitante per la difficoltà a richiamare le parole necessarie (la disnomia, ossia il dimenticare le parole, specialmente i nomi propri, è spesso la causa della visita neurologica), vocabolario stereotipato e ripetitivo, concomitanti alterazioni della scrittura, mancata comprensione del linguaggio o Impoverimento del pensiero astratto, con ridotta capacità di ragionamento logico e di giudizio o Progressiva incapacità a svolgere compiti semplici o Esagerazione dei tratti caratteriali premorbosi o Discalculia o Alterazione dell’orientamento visuo‐spaziale (demenza corticale posteriore: il paziente tende a perdersi, soprattutto in ambienti nuovi, e non riesce a svolgere attività semplici come inserire il braccio nella manica della giacca. Altri segni sono: proposagnosia, agnosia per gli oggetti, incapacità di distinguere destra e sinistra, eminegligenza visiva) e temporale • Fase intermedia o Peggioramento dei disturbi del linguaggio: pensiero interciso (il paziente, mentre parla, si interrompe perché dimentica ciò che stava dicendo), afasia nominum (il paziente non sa nominare gli oggetti o le persone: per nominarli usa delle interlocuzioni), ecolalia, fino all’incapacità di esprimersi o Incapacità di apprendimento di nuove informazioni o Compromissione della memoria remota o Completo disorientamento temporo‐spaziale: perdita della giusta sequenza temporale del proprio sé: trasposizione diacronica, ossia il paziente sovrappone diversi momenti della propria vita o Incapacità a copiare forme o modelli geometrici semplici o Ulteriore compromissione del comportamento e della personalità: tipici i deliri paranoidi e l’incuria o Necessità di assistenza per la vita quotidiana • Fase avanzata o Memoria a breve e lungo termine compromessa Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
o
o
o
o
Incapacità a riconoscere anche i propri familiari Incapacità a svolgere qualsiasi attività quotidiana Aprassia ideativa ed ideomotoria Evoluzione verso il mutismo acinetico Disturbi motori: il paziente risulta incapace sia di stare in piedi che di camminare: arti inferiori in flessione paraplegica (tipica dello stato vegetativo persistente) Incontinenza sfinterica: per mancato riconoscimento del significato dello stimolo Disfagia: per compromissione delle strutture sottocorticali Diagnosi • Anamnesi e clinica • Analisi di laboratorio: escludono la presenza di altre patologie, solitamente curabili (demenze metaboliche, luetiche, da idrocefalo normoteso) • Valutazione neuropsicologica: valuta il deterioramento mnestico e cognitivo • Imaging o RM (studio morfologico e volumetrico): consente innanzitutto la ricerca di eventuali tumori o MCV, che potrebbero aver provocato la demenza, e poi la diagnosi differenziale con demenze non‐
Alzheimer tramite: Misurazione dei ventricoli laterali e del terzo ventricolo, che nella DA si dilatano in seguito all’atrofia del parenchima Valutazione dell’atrofia ippocampale, sempre notevole nella DA Valutazione spettroscopica: diminuzione NAA fRM: riduzione della connettività tra le aree della corteccia coinvolte ed il centro del default (un sistema corticale molto complesso ed articolato che consentirebbe, tramite il suo “switch‐off”, l’esecuzione di azioni complesse, ndr) Voxel based morphometry: consente, nelle fasi precoci, in cui l’alterazione RM è aspecifica (potrebbe essere dovuta anche al semplice invecchiamento), di rilevare, grazie alla valutazione della connettività funzionale, una diminuzione di questa nelle aree coinvolte, quindi nell’ippocampo e nel cingolo posteriore o TC o SPECT e PET (indagini funzionale): evidenziano un’ipoperfusione soprattutto temporale e parietale • Rachicentesi (dosaggio tau e beta‐amiloide nel liquor): importante è la valutazione del “movimento” relativo di una rispetto all’altra, indice di DA. Comunque, nella DA il rapporto beta‐amiloide/tau nel liquor è insolitamente basso • Biopsia: è l’unica esame che consente una diagnosi di certezza, solitamente effettuato post‐mortem e solo in casi eccezionali in vivo (come nel caso dell’ex presidente americano Ronald Reagan). L’atrofia diffusa consente una prima distinzione con altre demenze caratterizzate da atrofia focale; per il resto vedi dopo. Anatomia patologica Negli stadi avanzati di malattia il cervello presenta un aspetto diffusamente atrofico ed il suo peso è di solito ridotto del 20% o più: le circonvoluzioni cerebrali sono ristrette, i solchi ampliati, i ventricoli allargati. L’estrema atrofia dell’ippocampo è caratteristica e può diffondersi secondo il pattern suddetto. Da un punto di vista microscopico si osserva una perdita diffusa di cellule nervose nelle zone corticali coinvolte, ma anche in strutture sottocorticali (in particolare nel nucleo basale de Meynert e nel locus coeruleus): alla perdita neuronale fa seguito una proliferazione astrocitaria compensatoria. Markers diagnostici tipici di DA sono: • Placche senili: sono depositi sferici extraxellulari di materiale amorfo sparsi in tutta la corteccia cerebrale, il cui nucleo è costituito da agglomerati di fibrille di beta‐amiloide, peptide derivante dall’APP (amyloid Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
precursor protein). L’esterno delle placche è costituito da processi gliali, cellule microgliali e terminazione nervose in via di degenerazione. L’amiloide si trova anche sparsa in tutta la corteccia cerebrale in una forma priva di organizzazione strutturale ed anche nelle pareti dei piccoli vasi sanguigni vicini alle placche (angiopatia congofila). L’APP, fisiologicamente, viene scisso prima dall’ alfa‐ e poi dalla gamma‐secretasi, risultando in prodotti non tossici per i neuroni e funzionale ad una riduzione dell’eccitotossicità. Il clivaggio da parte prima della beta‐ e poi della gamma‐secretasi dà luogo a due prodotti, la beta‐amiloide 40 e 42, quest’ultima particolarmente tossica per i neuroni: l’accumulo di beta‐amiloide42 sarebbe alla base della formazione delle placche (difatti questo secondo clivaggio avviene normalmente ma solo per il 5% della frazione di APP: un aumento di questa frazione, come nel caso di famiglie con rare mutazione genetiche che inducono una diminuzione della sensibilità all’alfa‐secretasi, determina la formazione delle placche). Un’altra prova a favore di questa ipotesi è stata ricavata dalla pressoché costante DA in pazienti con sindrome di Down: il gene per l’APP si trova, infatti, proprio sul cromosoma 21; pertanto, un suo aumento, come appunto nella trisomia 21, causerebbe un accumulo di placche e la DA. Un ruolo importante, inoltre, è svolto dalle preseniline 1 e 2 che interagiscono con la gamma‐secretasi: se aumentate, come per rare mutazioni, inducono un aumento dell’attività della gamma‐secretasi. Simile effetto ha una mutazione nel gene per la nicastrina, che controlla l’attività della beta‐secretasi. Si ricorda che una quarta mutazione genica responsabile di MA genetica (oltre quindi a quelle a carico del gene per l’APP sul cromosoma 21, a cui può associarsi la trisomia di questo cromosoma nella sindrome di Down, del gene per la presenilina 1 e di quello per la presenilina 2) è a carico del gene per l’Apo‐E (vedi sopra) Degenerazione neurofibrillare: presenza all’interno del citoplasma delle cellule nervose di filamenti spessi, simili a fibre, appaiati ad elica, costituiti da una forma iperfosforilata delle proteina microtubulare tau. Quindi, la proteina tau da un lato perde la sua funzione MAP (microtubulo associated protein: le MAP assicurano mantenimento, assemblaggio e corretto stanziamento dei microtubuli perché, grazie ad un’attività di fosfo‐ e de fosforilazione, consentono ai microtubuli di variare al bisogno la loro lunghezza, al fine non solo di un corretto funzionamento e della sopravvivenza dei neuroni, ma anche di un adeguato trasporto assoplasmatico e di una corretta plasticità sinaptica. La proteina tau assembla la microtubulina in microtubuli e stabilizza i microtubuli nella struttura portante del citoscheletro), dall’altro si accumula dando luogo non solo alla degenerazione neurofibrillare, ma anche alla formazione di corpi di Pick, corpi di Lewy e degenerazione granulovacuolare. La proteina tau è infatti alterata in una serie di patologie, per lo più focali (taupatie: PSP, DFT, vedi lezione Melone). Quindi la formazione di questi agglomerati di proteina tau risulta tossica per le cellule nervose. Sembrerebbe, infine, che la formazione di beta‐amiloide extracellulare dia l’innesco per la formazione di agglomerati neurofibrilalri intracellulari. Terapia Non esiste una terapia valida, ma sulla scorta di evidenze di anomalie neurotrasmettitori ali vi sono alcuni farmaci sintomatici: tra questi vi sono quelli anticolinesterasici (donepezil, rivastagmina, galantamina), che aumentano il tono colinergico, soprattutto in virtù della degenerazione del nucleo basale colinergico di Meynert e di altri nuclei colinergici. Altri farmaci neurotrasmettitori ali sono quelli glutammatergici, tra cui la memantina, che inibisce i recettori metabotropici del glutammato, con riduzione dell’eccitotossicità. Par III: Altre taupatie Generalità La proteina Tau, da sola, può essere causa di altre malattie degenerative complessivamente definite come taupatie: sono tutte a distribuzione lobare e il loro elemento patogenetico è la degenerazione neurofibrillare. Si ricordano: • Degenerazione fronto‐temporale • Afasia primaria progressiva • Degenerazione corticobasale • Paralisi sovra nucleare progressiva Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
• Malattia di Pick • Gliosi sottocorticale progressiva • Agnosia visiva progressiva • Aprassia progressiva • Astereognosia progressiva • Compromissione progressiva dell’esplorazione spaziale Possibili segni e sintomi sono: • Deterioramento cognitivo • Disturbi del comportamento: disinibizione, apatia, disturbo ossessivo‐convulsivo • Mioclonie • Epilessia • Sindromi extrapiramidali • Alterazioni della postura Demenza fronto‐temporale propiamente detta È responsabile di circa il 20% dei casi di demenza degenerative e prevale nell’età media (45‐65 anni). È anatomopatologicamente caratterizzata da atrofia fronto‐temporale con perdita neuronale e gliosi reattiva che coinvolge la sostanza bianca. Coinvolge le strutture prefrontali e temporali. Vi sono soggetti con un predominante disturbo prefrontale, quindi con marcati disturbi del comportamento: questi soggetti sono, a seconda della porzione di corteccia prefrontale coinvolta, apatici, abulici, inerti e disinteressati anche dei parenti più stretti o disinibiti e moriatici. I soggetti con prevalente interessamento temporale sono, invece, prevalentemente afasici. Comunque, si possono distinguere le principali regioni coinvolte con la sintomatologia associata: • Corteccia prefrontale dorsolaterale: perseverazione, difficoltà di giudizio , disturbi nella pianificazione, ridotta fluenza verbale, diminuità capacità di astrazione • Corteccia orbitofrontale: disinibizione, impulsività, euforia • Corteccia temporale anteriore: ipersessualità, iperoralità, ipereligiosità, disturbi del linguaggio, anomia semantica • Corteccia del gingolo: apatia, perdita di interesse, ridotta motivazione La diagnosi, oltre che dei dati amnestico‐clinici, si avvale di: • Imaging: riscontrano aree di atrofia corticale, con coinvolgimento della sostanza bianca, nelle aree compromesse • Anatomia patologica: riscontra la neurodegenerazione nelle aree coinvolte Malattia di Pick È una forma di degenerazione cerebrale, nella quale l’atrofia è circoscritta (quindi a differenza della MA, in cui è più diffuda), solitamente ai lobi frontali e/o temporali, con coinvolgimento sia della sostanza bianca che di quella grigia. La caratteristica istologica saliente è rappresentata da una perdita di neuroni più marcata a livello dei primi 3 strati corticali. Inoltre, i neuroni risparmiati sono ricchi di corpi argentofili intracitoplasmatici, i corpi di Pick, composti da fibrille rettilinee, piuttosto che elicoidali come nella MA. Infine, vi sono anche una gliosi astrocitaria reattiva ed una perdita di fibre mieliniche nelle aree coinvolte. Il quadro clinico è simile a quello della demenza frontotemporale. Afasia primaria progressiva Può essere considerata una forma di demenza frontotemporale, con spiccato coinvolgimento temporale, e quindi delle aree del linguaggio. I disturbi del linguaggio possono, in questi casi, essere divisi in afasia primaria progressiva e demenza semantica (vedi dopo). Nel primo caso l’alterazione del linguaggio è dovuta ad un’incapacità di organizzare la parola (disartria, deterioramento dello spelling), di trovare le parole (anomia) e di scrivere correttamente (disgrafia). Quindi, il Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
disturbo è prevalentemente fonemico (e grafico), piuttosto che semantico: ne deriva “un miscuglio di parole e di frasi sconnesse”. Il paziente, per circa 2 anni, risulta comunque in grado di lavorare e svolgere le azioni quotidiane: non è demente. Infine, tuttavia, il paziente è muto, apparentemente privo di impulso a parlare, con perdita completa della capacità di formare le parole. La diagnosi può esser posta: • Quando le altre facoltà mentali (memoria, abilità visuo‐spaziali, comportamento) sono relativamente conservate • Quando il linguaggio è la sola, o la prevalente, area del linguaggio compromessa per i primi 2 anni • Quando l’imaging mostra atrofia solo nelle aree del liguaggio • Quando l’esame neuropsicologico è confermativo Nell’afasia semantica, invece, il disturbo sta nella comprensione del linguaggio: i soggetti parlano, anche in maniera fluente, ma non capiscono quel che gli viene detto né quel che dicono. Il soggetto, pur capace di discriminare grandi categorie semantiche, ad esempio oggetti e verdure, è incapace di distinguere diversi componenti di una categoria, ad esempio carote e finocchi. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Lez X PROF. COTRUFO Malattie degenerative, sporadiche ed ereditarie, con disordini prevalenti dell’esecuzione dei movimenti Par I: Generalità Malattie del motoneurone Le malattie del motoneurone indicano un gruppo di patologie degenerative progressive dei motoneuroni del midollo spinale, del tronco cerebrale e della corteccia motoria, che si manifestano clinicamente in varie combinazioni con deficit di forza, atrofia muscolare e segni del tratto corticospinale, e suddivise in diversi tipi sulla base del diverso raggruppamento di segni e sintomi: • Sclerosi laterale amiotrofica (SLA o malattia di Charcot): è la forma più frequente, con associazione di amiotrofia ed iperriflessia (il termine “amiotrofia” si riferisce all’atrofia da denervazione ed alla perdita di forza dei muscoli) • Atrofie muscolari spinali: il deficit di forza e l’atrofia si verificano isolatamente, senza evidenza di disfunzione del tratto corticospinale • Paralisi bulbare progressiva: il deficit di forza e l’atrofia colpiscono prevalentemente i muscoli innervati dai nuclei motori della porzione inferiore del tronco cerebrale, cioè i muscoli di mascella, volto, lingua, faringe e laringe • Sclerosi laterale primaria: il quadro clinico è dominato da debolezza spastica, iperreflessia e segni di Babinski, mentre la patologia del motoneurone inferiore diviene evidente solo in stadi molto avanzati di malattia. • Neuropatie periferiche • Distrofie muscolari In maniera preliminare, è opportuno distinguere: • Forme geneticamente determinate o SLA familiare autosomica dominante: è il 5‐10% di tutte le forme di SLA, il 20 % di queste forme presenta una mutazione del gene SOD1 o Paraplegia spastica ereditaria: AD o AR, si riconoscono diversi loci responsabili o Atrofia muscolare spinale: AR, associata a mutazioni del gene SMN (survival motoneuron) o Altre forme minori: amiotrofia spinobulbare legata al cromosoma X, associata ad espansione della tripletta CAG del gene per il recettore degli androgeni, malattia di Tay‐Sachs dell’adulto, da deficit dell’esoaminidasi • Forme sporadiche o Paralisi bulbare progressiva o SLA ad esordio distale degli arti o Atrofia muscolare spinale progressiva o Sclerosi laterale primaria • Forme complesse di associazione o Atrofia multisistemica con degenerazione dei motoneuroni (MN) spinali o Paralisi sovranucleare progressiva con degenerazione dei MN spinali o Degenerazione corticobasale con degenerazione dei MN spinali o Forma amiotrofica di CJD • Forma acquisite da considerare nella diagnosi differenziale o SLA associata ad AIDS: può essere dovuta ad un effetto diretto del virus, ad un’azione di agenti opportunisti o a tumori secondari o Neuropatia motoria Multifocale con blocchi di conduzione ed anticorpi anti GM1 (ganglioside monosialico) Associata a paraproteinemia o cancro o Poliomielite anteriore acuta o Intossicazione da mercurio, piombo o alluminio o Mielopatia attinica: soprattutto come conseguenza dell’esposizione a raggi X Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
Sindrome posti‐polio: dopo anni dal’esposizione al virus od al vaccino antipolio Mielopatie associate a malattie autoimmunitarie (LES, sindrome di Sjorgen) Mielopatie associate a disendocrinopatie (ipertiroidismo, iperparatiroidismo) Par II: Patologie specifiche SLA La SLA, è una patologia in costante aumento di incidenza, nel 10% dei casi familiare e nel restante numero di casi sporadica: • SLA familiare o Forma AD associata a mutazione del gene SOD1, che codifica per la superossido dismutasi: è simile alla SLA sporadica. La proteina è molto abbondante sia nei motoneuroni che nelle cellule non neurali circostanti: una sua mutazione causerebbe la formazione di aggregati intracellulari, che promuoverebbero un’attività glutaminergica eccitotossica e causerebbero disfunzione mitocondriale. o Forma AR associata a mutazione del gene ALS2, che codifica per l’alsina, proteina appartenente alle vie di segnalazione delle cellule neuronali: questa forma colpisce i bambini, interessando i neuroni corticospinali più che quelli spinali o Forma AD associata a mutazione del gene DCTN, che codifica per la dinactina: è lentamente progressiva, ad esordio in età adulta, con segni bulbari prevalenti o Forma AD associata a mutazione del gene SETX che codifica per la sentaxina, una DNA‐elicasi coinvolta nei processi di ripiegamento e dispiegamento della cromatina: la forma è giovanile a progressione molto lenta o Forma mitocondriale associata a mutazioni del gene CytoC, che codifica per la citocromo c ossidasi: la forma è con esordio in età adulta e con spasticità prevalente o Forma AD associata a mutazione del gene VAPB, che codifica per una proteina di membrana associata alle vescicole: la forma esordisce in età adulta ed simile alla forma sporadica • SLA sporadica: l’esordio è tipicamente, ma non esclusivamente, intorno ai 45 anni di età, con incidenza in aumento per ogni decade successiva. La malattia è dovuta ad un interessamento variabile dei motoneuroni sia superiori che inferiori: ne deriva un quadro clinico molto eterogeneo. Comunque, l’esordio è classicamente con debolezza alle parti distali di un arto ed un certo impaccio nei movimenti fini delle dita, seguiti da rigidità delle dita e lievi deficit di forza od ipotrofia dei muscoli della mano. Si presentano poi crampi intensi e fascicolazioni, soprattutto a livello dell’arto inferiore. In poco tempo la triade composta da deficit di forza ed atrofia di mani ed avambracci, lieve spasticità delle braccia e delle gambe ed iperreflessia generalizzata, senza alterazioni sensitive, lascia poco spazio ai dubbi. Gli adduttori, gli abduttori e gli estensori di dita e pollice tendono ad essere colpiti dal deficit di forza prima dei flessore: gli spazi dorsali interossei divengono infossati (mano scheletrica o cadaverica). In un secondo momento sono colpiti i muscoli di avambraccio, braccio e cingolo scapolare; successivamente, il deficit di forza con amiotrofia si diffonde ai muscoli di collo, lingua, faringe ed, infine, a quelli di tronco ed estremità inferiori, fino alla fase più devastante di malattia. Il decorso è inesorabilmente progressivo, con morte in 3 anni del 50% dei pazienti ed in 6 anni del 90%. Criteri diagnostici per SLA sono: • Definita: segni di MN1 (segno di Babinski, clono, assenza dei RAS, perdita di destrezza motoria) e MN2 (atrofia, debolezza, fascicolazioni) in 3 regioni (bulbare, cervicale, dorsale, lombosacrale) • Probabile: segni di MN1 e 2 in 2 regioni, con segni di MN1 rostrali a quelli di MN2 • Probabile con ausilio dell’EMG: segni di MN1 e segni EMG di MN2 in 2 regioni • Possibile: segni di MN1 e 2 in 2 regioni; segni di MN1 in 2 regioni; segni di MN1 e 2 in 2 regioni, con segni di MN1 caudali a quelli di MN2 Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Alterazioni anatomopatologiche (e conseguenti reperti diagnostici strumentali) in corso di SLA sono: perdita di cellule nervose nelle corna anteriori del midollo spinale e nei nuclei motori della parte inferiore del tronco cerebrale, gliosi e proliferazione delle cellule microgliali, assottigliamento delle radici anteriori, perdita di fibre mieliniche nei nervi motori, degenerazione del tratto corticospinale soprattutto nelle parti inferiori del midollo spinale, perdita di cellule di Betz nella corteccia motoria. Unica terapia utile, ma efficace solo nell’aggiungere non più di 3 mesi di vita, è il riluzolo, agente antiglutammato; farmaci sintomatici sono il baclofen e la tizadina, agenti antispastici. Infine, va ricordata l’importanza di un’adeguata terapia per fronteggiare la disfagia: dopo una prima fase in cui è sufficiente un’alimentazione con cibi tagliati minuziosamente o frullati, è consigliabile, in una fase più avanzata, il posizionamento di un sondino gastrico. Atrofie muscolari spinali Si distinguono: • Forme eredofamiliari: sono atrofie muscolari spinali (SMA) di tipo ereditario, tutte legate ad alterazioni (95‐
98% dei casi delezioni, 2‐5% mutazioni puntiformi; solitamente AR, raramente AD) del gene SMN (survival motoneuron), localizzato sul cromosoma 5: la proteina SMN prende parte alla formazione di complessi proteina‐RNA essenziali per lo splicing genetico, una sua sua assenza o mutazione porta all’atrofia muscolare. Tutte le forme possono considerarsi espressioni cliniche di gravità variabile della stessa malattia legata al gene SMN o SMA I o di Werdnig‐Hoffman: può esordire già in utero, alla nascita o entro i primi 6 mesi. E’ comune (2° causa di morte per malattia ereditaria recessiva, dopo la fibrosi cistica). Il quadro clinico è caratterizzato da: Ipotonia neonatale (“floppy baby”) Debolezza muscolare con deficit di suzione e deglutizione, della respirazione Possibile artrogriposi delle caviglie e dei polsi o lussazione dell’anca Incapacità a stare seduto ed a mantenere il capo eretto: se eliminati gli effetti della forza di gravità, i muscoli tendono a contrarsi, testimoniando che l’alterazione è di tipo paraparetica piuttosto che paralitica Decorso progressivo e costante Alterazioni bioptiche: atrofia muscolare da denervazione, alterazioni nelle corna anteriori del midollo spinale e nei nuclei motori dei nervi cranici, gliosi sostitutiva e degenerazione secondaria di radici e nervi o SMA II o di tipo intermedio: l’esordio è tra i 6 ed i 15 mesi, con quadro clinico intermedio tra le forme I e III e caratterizzato da: Deficit di forza prossimale Fascicolazioni e tremore fine delle mani Impossibilità a stare in piedi Prognosi variabile: decesso dovuto a complicanze respiratorie o SMA III o di Wohlfart‐Kugelberg‐Welander o SMA prossimale cronica infantile e giovanile: è una forma che coinvolge prevalentemente i muscoli prossimali degli arti ed è caratterizzata da una progressione lenta. L’esordio si verifica nel 50% dei casi entro i 2 anni, nell’altro 50% entro i 18 anni. Inizio insidioso con deficit di forza ed atrofia del cingolo pelvico e dei muscoli prossimali delle gambe, a cui fa seguito un interessamento del cingolo scapolare e dei muscoli della parte superiore del braccio Ritardo dello sviluppo motorio Simmetrica sin dall’inizio Fascicolazioni solo nella metà dei casi Coinvolgimento, alla fine, dei muscoli distali degli arti e perdita dei riflessi tendinei Evoluzione più lenta Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
SMA IV o malattia di Fazio‐Londe o paralisi bulbare progressiva della fanciullezza: è una paralisi progressiva dei muscoli innervati dai motoneuroni dei nuclei motori di ipoglosso, vago, facciale e trigemino, cioè dei muscoli facciali, linguali, faringei e laringei. Ne consegue un quadro clinico, che può esordire dall’infanzia alla prima adolescenza, caratterizzato da: Stridore e sintomi respiratori fino all’insufficienza respiratoria ed all’asfissia Diplegia facciale, disartria, disfagia, disfonia Sindrome di Kennedy od atrofia bulbo‐spinale: è una forma di atrofia distale con prevalenti segni bulbari legata al cromosoma X (raramente AD). Il periodo d’insorgenza è variabile dall’infanzia all’età adulta, ma più tipicamente nella terza decade. La malattia è dovuta ad un’espansione di triplette CAG nel gene che codifica per il recettore degli androgeni sul braccio corto del cromosoma X (recettori per gli androgeni sono presenti anche nei motoneuroni bulbari e spinali). Il quadro clinico sarà caratterizzato da: o Atrofia dapprima distale, poi prossimale e cingolare o Debolezza orofaringea con disartria e disfonia o Ginecomastia, oligospermia o Decorso lentamente progressivo Paralisi bulbare progressiva: è una condizione nella quale i sintomi iniziali e predominanti sono in rapporto con un deficit di forza e lassità (debolezza spastica) dei muscoli innervati dai muscoli motori della parte inferiore del troncoencefalo, cioè i muscoli di mascella, volto, lingua, faringe e laringe; ne consegue un quadro clinico caratterizzato da: o Difetto di articolazione della parola, fino all’esprimersi con un linguaggio incomprensibile o Spasticità dei muscoli della lingua: alla fine la lingua diviene raggrinzita e giace inutilizzabile nel pavimento buccale o Spasticità dei muscoli laringei: stridore laringeo, alterazione del tono di voce o Alterazione dei movimenti di deglutizione e masticazione: il bolo non viene masticato e, per l’incapacità dei muscoli faringei, non passa in esofago, ma può fuoriuscire dal naso o entrare nelle vie respiratorie, con conseguente polmonite ab ingestis o Perdita del tono dei muscoli facciali: ipomimia o Fascicolazioni in questi muscoli o Decorso inesorabilmente progressivo con exitus entro 2‐3 anni o Esordio, praticamente in tutti i casi, di manifestazioni di SLA (quindi, la PBP sarebbe una forma di SLA ad esordio bulbare) Atrofia muscolare progressiva: è dovuta ad un’alterazione dei motoneuroni inferiori, riportabili sempre a mutazioni del gene SOD1: quindi, differisce dalla SLA per il mancato interessamento del motoneurone superiore, con assenza dei riflessi osteo‐tendinei. Il quadro clinico sarà caratterizzato da: atrofia muscolare progressiva con ipotrofia solitamente simmetrica a partenza dai muscoli della mano fino ai muscoli più prossimali, crampi e fascicolazioni Sclerosi laterale primaria: è dovuta ad alterazioni dei soli motoneuroni superiori, ma il più delle volte conosce l’interessamento anche di quelli inferiori, con esito in SLA. Comunque, il quadro tipico è caratterizzato da: disturbo degenerativo lentamente progressivo del fascio corticospinale, che esordisce con una paraparesi spastica pura delle gambe, successivo coinvolgimento di braccia e muscoli orofaringei, spasticità vescicale. Caratteristiche distintive con le paraparesi spastiche ereditarie (PSE) sono l’esordio in età adulta (tra i 40 ed i 60 anni) ed il coinvolgimento di braccia e muscoli orofaringei, tipicamente risparmiati nelle PSE. Caratteristica distinta dalla SLA sarebbe la progressione per 3 anni senza evidenza di disfunzione del motoneurone inferiore. Paraparesi spastiche ereditarie (vedi lezione Melone) o
•
•
•
•
•
Neuropatie periferiche Si distinguono per: • Numero di nervi colpiti: mono‐, multi‐ o poli‐neuropatie Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Componente del nervo compromessa: neuropatie demielinizzanti o da degenerazione assonale Eziopatogenesi Meccanismo genetico (in caso di neuropatie genetiche): AD, AR, X‐linked Nervi coinvolti: sensitivi, motori od autonomini in varie combinazioni Quindi, si riconoscono: • Forme ereditarie o Di tipo misto sensitivo‐motorie Atrofia muscolare peroneale dominante o malattia di Charcot‐Marie‐Tooth: per l’atrofia del tibiale anteriore, il piede risulta cavo, equino, varo, con andatura steppante (il paziente atterra con la punta del piede per poi cadere sul tallone con un rumore deciso) • Tipo I: mielinopatia ereditaria dominante: la velocià di conduzione, per la mielinopatia, è rallentata, con riduzione in ampiezza dei potenziali d’azione. In questo caso, inoltre, le cellule di Schwann sono ammassate intorno alle fibre assonali rendendo la conduzione rallentata e risultando anche palpabili come ingrossamento del nervo • Tipo II: assonopatia ereditaria dominante: la velocità di conduzione è praticamente normale, con riduzione in ampiezza dei potenziali d’azione e riscontro di denervazione • Tipo III: mielinopatia ereditaria recessiva • Tipo IV o foma di Refsum: associato ad altre patologie quali la retinite pigmentosa, la neuropatia periferica, l’atassia o le malformazioni periferiche Polineuropaita ipertrofica di Déjerine‐Sottas, sia dell’ adulto che del bambino Polineuropatia ipomielinizzante congenita Neuropatie ereditarie con paralisi da compressione: la paralisi avviene solo in seguito alla compressione del nervo o Di tipo sensitivo o motorio o Con interessamento autonomico • Neuropatie acquisite o Associate a malattie sistemiche come il DM o Associate ad ipovitaminosi: soprattutto gli alcolisti, per ipovitaminosi B12 (ma c’è anche un effetto tossico diretto dell’alcol sulle fibre nervose) o Associate a malattia critica come la sepsi o Associate a carcinoma: da alterazioni dirette, legate alla terapia o paraneoplastiche o Associate a crioglobulinemie: soprattutto nei casi con epatite C o Associate a lebbra (un tempo era la neuropatia più frequente), HZV, borrelia burgdoferi o Associate ad immunopatie Merita delle note aggiuntive l’andatura steppante, che si osserva nelle malattie dei nervi periferici degli arti inferiori o dei motoneuroni spinali: neuropatie assonali croniche acquisite (diabetica, infiammatoria, tossica, carenziale, etc.), la malattia di Charcot‐Marie‐Tooth, l’atrofia muscolare spinale progressiva. È causata da paralisi dei muscoli tibiale anteriore e peronieri, con impossibilità di flettere dorsalmente e di ruotare verso l’esterno il piede: i passi sono regolari ed uniformi, ma il piede che avanza pende con la punta verso il terreno (piede cadente). Il cammino è reso possibile da un’accentuata flessione all’anca, con elevazione anormale della gamba per impedire al piede di strisciare sul terreno. Si apprezza il rumore del piede che batte contro il pavimento (punta‐
tacco). Miopatie Sono patologie legate ad interessamento primario delle fibre muscolari, ereditarie od acquisite: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
•
•
•
Distrofie muscolari progressive: la distrofia muscolare di Duchenne‐Becker ne è l’espressione più tipica (per la patogenesi della DDB e delle altre distrofie muscolari vedi la lezione sui meccanismi eziopatogenetici) o Distrofia muscolare di Duchenne‐Becker: da assenza o riduzione del gene per la distrofina localizzato sul locus Xp21 Patogenesi: l’assenza della distrofina comporta, in presenza di stress contrazionale, lesioni nella membrana sarcoplasmatica: ciò determina da un lato la fuoriuscita di enzimi quali CPK, LDH ed aldolasi utili per la diagnosi, dall’altro l’ingresso di Ca2+. L’ingresso del catione determina un’eccitotossicità che esita nella morte cellulare e nella conseguente necrosi tissutale. Queste alterazioni possono essere determinate anche da alterazioni in altre componenti di questo sistema di ancoraggio citoscheletro‐membrana sarcoplasmatica‐
ECM, come destro‐ e sarco‐glicani e laminina (vedi anche dopo). Esordio a 3 anni, con progressione inesorabile ed incapacità a camminare intorno ai 10 anni e morte intorno ai 20 Quadro clinico: manovra di arrampicamento (il paziente, caduto a terra, si arrampica sul proprio corpo per rialzarsi), scapola alata, iperlordosi lombare, ipertrofia dei polpacci da reazione fibrotica, scoliosi Quadro anatomopatologico: necrosi delle fibre muscolari o Distrofia muscolare di cingoli: da alterazioni dei sarcoglicani o Distrofie muscolari congenite: da alterazioni dei geni per la laminina o Distrofia miotonica o di Steinert: è una patologa multisistemica, dovuta ad espansione della tripletta TCG intronica nella miotonina chinasi, ad esordio nella prima o seconda decade. Quadro clinico: debolezza muscolare distale, miotonia, cataratta, atrofia testicolare, calvizie, aritmie cardiache, possibile ritardo mentale, facies lugubre (atrofia dei muscoli temporali, atrofia dei masseteri) Quadro anatomopatologico: atrofia prevalentemente a carico delle fibre ossidative, che consentono esercizi aerobici e prolungati (di resistenza) Paralisi periodiche Miopatie metaboliche (glicogenosi, lipidosi): sono sempre legate ad alterazioni genetiche Miopatie infiammatorie o autoimmuni (polimiosite, dermatomiosite) Miopatie tossiche e dismetaboliche Miopatie mitocondriali: riconoscono un coinvolgimenti dei tessuti ad elevato consumo di ATP, cioè i muscoli scheletrici e cardiaco ed il cervello Miopatie da malattia cronica (sepsi) Miotonie: in questi casi non è presente una distrofia, ma solo una miotonia, ossia una persistente contrazione indotta da un movimento (“rimanere attaccato al tram”) Miopatie iatrogene (statine, che determinano rabdomiolisi, ossia necrosi focale delle fibre muscolari, dosabile tramite CPK; glucocorticoidi, che causano una debolezza ed un’atrofia muscolare) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ. IV PROF. PUOTI Encefalopatie spongiformi trasmissibili: malattie da prioni Par. I: Generalità Sono malattie rare, con un’incidenza di circa 1/800mila soggetti: sono sempre esistite, ma sono state dolo da poco inquadrate nell’uomo. Non sono esclusive dell’uomo e pertanto si distinguono: • Malattie dell’animale o Scrapie: colpisce pecore e capre. “Scrapie” significa “grattarsi”: infatti, gli animali affetti tendono a strusciarsi ovunque possono (rami, alberi etc) o Encefalopatia trasmissibile del visone o Malattia cachettica del daino e dell’alce o Encefalopatia spongiforme bovina (ESB): nel 1996 in Inghilterra si sono avuti i primi casi di “mucca pazza”. Tramite ingestione di carne di bovini affetti da “mucca pazza” anche l’uomo viene infettato. Esistono due forme: ESB simile alla forma sporadica di MCJ ESB simile alla nuova variante di MCJ o Encefalopatia spongiforme felina: è comparsa negli zoo • Malattie dell’uomo: sono inesorabilmente progressive e non si conoscono cure adeguate o Kuru (ormai scomparso) o Malattia di Creutzfeldt‐Jacob (MCJ) sporadica (85%): la trasmissione interumana non iatrogena è probabilmente aerea, quella iatrogena, invece, può essere dovuta a: Trapianto di dura madre Strumenti non adeguatamente sterilizzati Elettrodi stereotassici (cioè elettroencefalografici profondi) Trapianti di cornea GH e gonadotropine umane estrattive Contatto con qualsiasi oggetto o sostanza contaminati o MCJ familiare o Malattia di Gerstmann‐Strauser‐Sheinker (MGSS) o Insonnia familiare fatale (IFF): queste ultime tre condizioni sono ereditarie e rappresentano circa il 15% dei casi) o Nuova variante della MCJ: origina dalla contaminazione con materiale bovino infetto In definitiva, la trasmissione può avvenire tramite cannibalismo (kuru), trasmissione animale‐uomo (ingestione di carne contaminata, contaminazione di sostanza poi trasmesse all’uomo) e trasmissione interumana (iatrogena o espositiva). Par II: Forme cliniche Malattia di Creutzfeldt‐Jacob E’ una malattia cerebrale, in cui una profonda demenza rapidamente progressiva è associata a scosse miocloniche e ad una varietà di alterazioni neurologiche, principalmente visive e cerebellari. Le principale alterazioni neuropatologiche si trovano nella corteccia cerebrale e cerebellare: le caratteristiche della lesione sono la diffusa perdita neuronale con gliosi, accompagnate da una singolare vacuolizzazione o stato spongioso delle zone colpite (pertanto è stata anche definita encefalopatia spongiforme subacuta). L’età d’esordio della forma sporadica è di circa 65 anni, con un picco d’incidenza intorno ai 75 anni, senza distinzione di sesso, di etnia o di area geografica, benché siano possibili anche casi nei giovani. Il quadro clinico è caratterizzato da: • Sintomi prodromici (33%): affaticamento, depressione, perdita di peso, disturbi del sonno e dell’appetito, di durata di parecchi settimane Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
•
•
•
•
Disturbo cognitivo rapidamente evolutivo: alterazioni del comportamento, della risposta emotiva e delle funzioni intellettive. In molte circostanze la fase precoce della malattia è caratterizzata da sintomi di confusione mentale, con allucinazioni, deliri ed agitazione. Comunque, i paziente iniziano a comportarsi in maniera bizzarra, non riescono a fare quello che facevano prima, sono distraibili, hanno difficoltà mnesiche e si sentono “la testa vuota”. Questo quadro, a differenza della DA, è rapidamente evolutivo, anche in una settimana Mioclonie degli arti: possono iniziare alle dita delle mani, per poi coinvolgere altri gruppi muscolari e tutti e 4 gli arti. Il mioclono si associa a stimoli sensitivi improvvisi (rumore, luce intensa, tocco), ma può anche verificarsi spontaneamente. Comunque, le mioclonie lasciano gradualmente il posto ad uno stato di mutismo, stupor e coma Coma: i pazienti vanno incontro inizialmente ad un coma vigile, talvolta con atteggiamento distonico in caso di prevalenza della componente extrapiramidale o con atteggiamento spastico in caso di prevalenza piramidale; lo sguardo è tipicamente “attonito”. Nel giro di settimane, il coma si fa sempre più profondo, fino alla morte per complicanze infettive od internistiche (blocco cardiorespiratorio o insufficienza renale) Segni cerebellari: l’atassia è molto frequente, generalmente in seguito ai disturbi cognitivi, ma talvolta come sintomatologia d’esordio Crisi epilettiche: talvolta, rappresentano l’esordio della malattia Deficit sensitivi, cefalea e vertigini: sono frequenti, ma rapidamente mascherati dal mutismo Deficit visivi corticali: talvolta, rappresentano l’esordio della malattia. I soggetti hanno un’alterazione della capacità di riconoscimento tridimensionale degli oggetti, della profondità e dell’organizzazione spaziale: in sostanza, hanno alterazioni a livello della corteccia associativa visiva, responsabile dell’integrazione e dell’elaborazione degli stimoli visivi Disfunzione vestibolare Segni disautonomici Segni tardivi: segni piramidali, del motoneurone inferiore ed extrapiramidali, paralisi della convergenza e dello sguardo verso l’alto La diagnosi, che può essere solo di probabilità, in quanto quella di certezza è solo bioptica o, più spesso, autoptica, si avvale di: • EEG: è caratteristico, passando da un diffuso e non specifico rallentamento ad un quadro contraddistinto da complessi strereotipati ad alto voltaggio di onde lente (1‐2 Hz) ed aguzze, su uno sfondo sempre più lento ed a basso voltaggio. Queste onde aguzze ad alto voltaggio, apparentemente periodiche (onde lente trifasiche pseudoperiodiche), sono sincrone con il mioclono, ma possono persistere anche in sua assenza • RM: mostra un’iperintensità in T2 dei nuclei della base, in particolare di caudato e putamen, nella forma classica e del pulvinar talamico nella nuova variante • Esame del liquor: è stato introdotto un esame ad alta sensibilità nel liquor, cioè il riscontro mediante test immunologico di un particolare frammento peptidico appartenente a normali proteine cerebrali, denominato 14.3.3. Questo frammento peptidico non è molto specifico, in quanto è rilasciato dai neuroni distrutti, ossia è indice di citolisi neuronale: è rilasciato, oltre che nei casi di rapida degenerazione cerebrale, nei casi di ischemia cerebrale, di meningite e di encefalite. Anche le concentrazioni liquorali di enolasi e neopterina sono aumentate, ma, per i medesimi motivi, poco specifiche • Esame anatomopatologico o Macroscopico: la patologia interessa soprattutto corteccia cerebrale e cerebellare. Il quadro è quello di una degenerazione e perdita neuronale, associata ad astrogliosi, con aspetto spongioso. I vacuoli microscopici, responsabili dell’aspetto spongiotico, sono localizzati all’interno dei processi citoplasmatici delle cellule gliali e dei dendriti dei neuroni. La perdita di neuroni inibitori a livello talamico corrisponderebbe alla presenza di mioclonie e di onde appuntite all’EEG. Comunque vi sono particolari pattern anatomopatologici, che si riflettono in particolari pattern clinici: Diffuso Perivascolare Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
Perineurale A placche, come nella DA Immunoistochimico: anticorpi monoclonali diretti contro la proteina malata (che appare scura, marrone) Immunoblotting: evidenzia una resistenza della proteina modificata alla proteinasi K, enzima degradativo delle proteine. Difatti, la proteina, per l’aumento di PM, “shifta” Malattia di Gerstmann‐Straussler‐Scheinker E’ una forma sempre familiare, autosomica dominante, dovuta ad alterazioni differenti dello stesso gene, di atassia lentamente evolutiva (fino a 10‐11 anni): spesso i pazienti vengono impropriamente classificati come atassici cerebellari o spino‐cerebellari. Diagnosi differenziale è anche con la sclerosi multipla, malattia ad andamento cronico‐
progressivo con coinvolgimento dei sistemi piramidale ed extra‐piramidale. Comunque, clinicamente è caratterizzata da atassia cerebellare progressiva, segni piramidali, disartria e nistagmo, con demenza all’inizio lieve. Tardivamente compare l’encefalopatia diffusa, con demenza, coma e morte. Istologicamente si riscontrano le tipiche alterazioni spongiformi, specie a livello cerebellare, con le conseguenti alterazioni alla RM. Insonnia familiare fatale Si tratta di una rarissima malattia familiare, caratterizzata da insonnia intrattabile (all’ipnogramma si riscontra al massimo la fase 1 del sonno), iperattività simpatica, segni disendocrini (probabilmente dovuti ad alterazioni ipotalamiche) e demenza, che porta al decesso nell’arco di 7‐15 mesi. Le alterazioni anatomopatologiche, costituite da perdita neuronale e gliosi, sono state rilevate soprattutto a livello del talamo e dell’ipotalamo. Kuru Prima infezione lenta da agenti trasmissibili non convenzionali documentata negli esseri umani, si manifesta solo nelle popolazioni di lingua Fore delle regioni montuose della Nuova Guinea. E’ dovuta ad atti di cannibalismo: il tessuto infetto viene ingerito e sfregato sul corpo dei parenti della vittima (solitamente è il tessuto della nonna ad essere trasmesso ai nipoti, nella speranza di infondere le virtù della nonna, quali saggezza, bontà, bellezza, intelligenza, e l’aura. Queste sono infatti tribù matriarcali, in cui quindi la nonna è praticamente all’apice della società), consentendo l’ingestione dell’agente infetto, ma anche l’assorbimento tramite congiuntiva, mucose ed abrasioni cutanee (in definitiva, è importante sottolineare come l’eziopatogenesi delle malattie abbia aperto la strada a nuove prospettive diagnostico‐terapeutiche in numerosissime patologie ad eziopatogenesi sconosciuta, tra cui anche il cancro. La trasmissione di agenti proteici, in particolare ingeriti con un’alimentazione carnivora, potrebbe portare ad alcune di queste patologie ad eziologia ancora sconosciuta, ndr) . Clinicamente la malattia si manifesta senza febbre, con atassia cerebellare progressiva, demenza (“dementi felici”), alterazioni dei movimenti extraoculari, paresi progressiva fino all’immobilità, incontinenza nelle ultime fasi, coma e morte 3‐6 mesi dopo l’esordio. Dal punto di vista istologico si riscontra una perdita neuronale non infiammatoria con alterazioni spongiformi in tutto il cervello, ma prevalentemente nella corteccia cerebellare (il cervello si presenta come una spugna piena di buchi), associata a proliferazione astrogliale e placche stellate PAS‐positive di materiale simil‐amiloideo. Nuova variante della MCJ Differisce dalla forma classica per esordio precoce (intorno ai 28 anni), durata della malattia maggiore (3 anni) con decorso più lento e sintomatologia diversa, caratterizzata da esordio psichiatrico associato a parestesie degli arti inferiori. Si riscontra, inoltre, assenza di alterazioni all’EEG ed alla RM. A livello genetico, la caratteristica è un’omozigosi Met‐Met a livello del codone 129 in assenza di altre mutazioni. Si riscontrano poi le tipiche alterazioni anatomopatologiche. In questo caso la proteina prende due strade: • Nervosa: attraverso le terminazioni del plesso mioenterico raggiunge direttamente il midollo spinale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Reticolo‐istiocitaria: attraverso le cellule del sangue staziona ai linfonodi o ad altri organi linfatici. In questi casi la diagnosi può essere effettuata tramite la ricerca della proteina a livello delle tonsille palatine Aspetti biomolecolari Le malattie da prioni sono malattie rare e trasmissibili: a differenza delle malattie infettive, responsabile della malattia non sono gli acidi nucleici, ma una proteina (particella infettiva proteinacea). Evidenze sperimentali a supporto di quest’ipotesi sono che: • Preso il cervello di un topolino affetto da encefalopatia, omogenato ed inoculato ad un topolino sano, quest’ultimo risulta affetto dalla stessa encefalopatia • Preso l’omogenato infetto, sottoposto in laboratorio a procedure inattivanti qualsiasi acido nucleico (come i RUV) ed inoculato ad un topolino sano, quest’ultimo si ammala • Preso l’omogenato infetto, sottoposto in laboratorio a metodiche di denaturazione delle proteine ed inoculato ad un topolino sano, quest’ultimo non si ammala • Topi transgenici privi della proteina sono resistenti alla malattia • La reintroduzione della proteina ristabilisce la capacità di ammalarsi La proteina prionica PrP è la proteina responsabile delle encefalopatie spongiformi trasmissibili: è normalmente codificata da un gene situato sul braccio corto del cromosoma 20, è una sialoglicoproteina di membrana altamente conservata nei mammiferi e costitutivamente espressa in tutti i tessuti, ma soprattutto nel cervello. La sua funzione non è ancora chiara, ma la proteina è implicata: • nella trasmissione GABAergica a livello sinaptico • nella sopravvivenza a lungo termine delle cellule del Purkinje • nella regolazione del ritmo sonno‐veglia • nella cleareance dei ROS (una sua parte è infatti simile alla superossido‐dismutasi). La PrPc (costitutiva, normale) del cervello è simile a quella PrPsc (di un soggetto affetto da encefalopatia spongiforme trasmissibile) per: PM, ancora GPI, lunghezza, catene glicigiche legate ai residui 181 e 197. Le differenze stanno: nella resistenza della PrPsc alla proteinasi K con produzione di un frammento di 27‐30 kDa con medesima capacità infettiva, nella diversa conformazione (prevalenza di alfa‐eliche nella PrPc, di foglietti‐beta nella PrPsc), nella tendenza della PrPsc ad assemblarsi in strutture ROD‐like quando esposte a detergenti (ossia in strutture ordinate che si impacchettano l’una sull’altra a formare strutture sferiche di tipo amiloideo: placche che, al congo rosso, presentano una caratteristica birifrangenza). Dunque, la differenza principale starebbe nella diversa struttura secondaria, con conseguente diversità nella struttura tridimensionale e nella funzione: alla base di queste alterazione vi sarebbero delle mutazioni puntiformi. Nella forma sporadica la mutazione della proteina sarebbe indotta dal contatto con la PrPsc o legata a mutazioni somatiche, probabilmente a seguito di un errore cellulare, come l’errata attività delle chaperonine del reticolo endocellulare con alterato impacchettamento delle proteine. Nelle forme familiari, invece, le mutazioni sarebbero nelle regioni geniche che codificano per la struttura secondaria delle proteine, con switch patologico alfa‐elica/ foglietti‐beta. Altro concetto fondamentale è il polimorfismo metionina/ valina al codone 129 del gene per la PrP, che condiziona il fenotipo clinico: • Mutazione 178 associata a Met sul codone 129: insonnia familiare fatale • Mutazione 178 associata a Val sul codone 129: MCJ • Mutazione 102 associata a Met sul codone 129: MGSS con atassia e demenza • Mutazione 102 associata a Val sul codone 129: MGSS con paraparesi spastica Quindi, il codone 129 è un punto chiave nella trasformazione della proteina: esisterebbero più conformazioni patologiche della proteina prionica, ciascuna responsabile di un particolare fenotipo. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Riguardo la trasmissione è fondamentale l’evidenza che la PrPsc ha la capacità di legare e modificare la PrPc. Ciò spiega anche perché la scrapie non è trasmissibile all’uomo: infatti, la proteina prionica della pecora è diversa da quella dell’uomo e non riesce quindi a modificare la PrPc (barriera di specie: in questo caso, la differenza è di 22aa). La proteina prionica della mucca, diversa solo per pochi aa, invece, è simile a quella dell’uomo e, pertanto, la trasmissione è possibile. La formazione dell’eterodimero PrPsc/PrPc è il primo step nella formazione di PrPsc nell’ospite. Per il continuo del processo è fondamentale la proteina X, fattore cellulare che riconosce alcuni residui della PrPc dell’ospite. In definitiva, l’evento molecolare chiave della malattia da prioni è la conversione PrPc in PrPsc, che può essere: • Casuale o dovuto a mutazione somatica nella forma sporadica • Indotto da PrPsc esogena nella forma iatrogena o trasmessa • Conseguenza dell’instabilità della PrP mutata nella forma familiare La PrPsc, per la conformazione anomala, tenderebbe ad accumularsi ed a precipitare, formando le placche patologiche. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZIONE IV PROF.SSA MELONE Sviluppo del SN e patologie collegate Par I: Sviluppo del SN Embriogenesi Una noxa patogena può avere conseguenze in base al periodo dello sviluppo in cui agisce: durante la fase di sviluppo dello zigote è abortiva (cioè durante le prime 2 settimane), durante gli altri periodi provoca malformazioni del SN irreversibili e di gravità generalmente correlata alla precocità di azione o anomali funzionali. Comunque, esistono periodi critici, periodi di rapida trasformazione nello sviluppo dell’organismo, in cui un teratogeno può essere particolarmente dannoso: ad esempio, per cuore ed arti il periodo maggiormente sensibile ai teratogeni è quello embrionale, cioè da 2 a 9 settimane; per denti e genitali quello fetale, ossia dalla 9° settimana alla nascita; per il SN, invece, il periodo critico corrisponde praticamente a tutto il periodo di sviluppo, dalla 2° settimana alla nascita, anche se il periodo embrionario è più suscettibile. L’embriogenesi del SN è alquanto complessa: l’interazione fra mesoderma dorsale ed il sovrastante ectoderma è una delle fasi più importanti di tutto lo sviluppo, poiché dà inizio all’organogenesi; durante questa fase, il cordomesoderma induce nell’ectoderma la formazione del tubo neurale, che secerne molecole prodotte dai geni noggin, chordin e follistatin, che inattivano la BMP1 (proteina morfogenetica dell’osso); altri geni che svolgono un ruolo importanti nelle regioni caudali del SN sono WNT3a , che media l’espressione di molecole segnale essenziali per i somiti, e FGF; quindi, il SN si sviluppo dall’ectoderma, come la cute, e pertanto malattia del SN e cutanee, come vedremo, risultano spesso associate. Il SNC compare alla 3° settimana di gestazione nello stadio presomitico tardivo, come ispessimento ectodermico allargato: la placca neurale, localizzata nella regione dorsale mediana dell’embrione al davanti del nodo di Hersen e della linea primitiva. Al termine di tale periodo, il SNC, di forma tubulare, risultata costituito da una porzione più rostrale allargata, l’encefalo, ed una più caudale ristretta ed allungata, il midollo spinale. L’estremità cefalica, al 29° giorno, presenta tre dilatazioni, le vescicole encefaliche primarie: il prosencefalo od encefalo anteriore, il mesencefalo o encefalo medio, il rombencefalo od encefalo posteriore. Contemporaneamente il tubo spinale forma due flessure: la flessura cervicale, alla giunzione del midollo spinale con l’encefalo posteriore, e la flessura cefalica, localizzata nella regione del mesencefalo. Alla 5° settimana il prosencefalo risulta costituito da due parti: il telencefalo, formato da una porzione mediana e due estroflessioni laterali, gli emisferi cerebrali primitivi, ed il diencefalo, caratterizzato dall’evaginazione delle due vescicole ottiche. Il mesencefalo risulta separato dal rombencefalo da un profondo solco, l’istmo del mesencefalo. Il midollo spinale si forma subito dopo la chiusura del tubo neurale: la cavità del midollo spinale, il canale centrale, comunica con quella del rombencefalo (IV ventricolo), del diencefalo (III ventricolo) e degli esmisferi cerebrali (I e II ventricoli); III e IV ventricoli sono collegati tra loro tramite il canale del mesencefalo, questo canale si restringe notevolmente fino a costituire l’acquedotto di Silvio; i ventricoli laterali comunicano col III ventricolo tramite il forame di Monro. Il rombencefalo è costituito da 8 segmenti, i rombomeri, la cui formazione è determinata da geni HOX, organizzati in 4 gruppi su 4 cromosomi differenti: questa notevole ridondanza assicura una più alto grado di funzionalità in caso di mutazioni e quindi una minor probabilità di alterazioni patologiche. Anomalie di sviluppo del SN A livello cellulare possono distinguersi 8 fasi dello sviluppo fetale ed embrionale: mitosi/proliferaione, migrazione, differenziazione, aggregazione in nuclei, sinaptogenesi, morte neurale (riguardo le cellule nervose, quelle che fanno sinapsi permarranno, quelle che non contraggono sinapsi andranno in apoptosi) , riorganizzazione sinaptica, mielinizzazione. Su ciascuna di esse possono agire i vari teratogeni (fisici, chimici, biologici ,metabolici), ma soprattutto su proliferazione, migrazione ed apoptosi. Tra le anomalie di sviluppo del SN, che generalmente provocano alterazioni cognitive ed epilessia farmaco‐resistente, si ricordano: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Sindrome alcolica fetale: presente in figli di madri fortemente alcolizzate durante la gravidanza, è caratterizzata da: o Segni facciali tipici: rima palpebrale corta, epicanto, ipoplasia mascellare, micrognatia o Deficit di crescita: con riduzione del rapporto lunghezza‐peso e della circonferenza cranica o Deficit cerebrali: dovuti ad alterazioni cerebrali, soprattutto della sinaptogenesi, ma anche della proliferazione e della crescita (dendriti piccoli), si manifestano con distraibilità ,sindrome da deficit dell’attenzione, compromissione della coordinazione motoria, ritardo mentale, anomalie del comportamento o Altro: anomali dei genitali esterni, labiopalatoschisi, sordità, anomalie visive (una simile sindrome si verifica anche a seguito di assunzione di antiepilettici come l’acido valproico: sindrome fetale da antiepilettici) Malformazioni dello sviluppo corticale o Disturbi della proliferazione neuronale o gliale o dell’apoptosi: sono precoci e migratori Forme diffuse: microencefalia Forme emisferiche: emimegalencefalia, isolata od associata a sindromi neurocutanee (ipertrofia di un emisfero, con spostamento della linea mediana, ispessimento corticale, cattiva differenziazione tra sostanza grigia e bianca) Forme focali bilaterali o multifocali: megalencefalia, sclerosi tuberosa di Bourneville Forme focali unilaterali: non tumorali (displasie focali corticali tipo Taylor: hanno aspetto istologico caratterizzato da degenerazione corticale conperdita della laminazione e citomegalia, presenza di neuroni giganti dismorfici e di voluminose cellule gliali a citoplasma balloniforme) o tumorali (disembrioplasiche neuroepiteliali, gangliogliomi) o Disturbi della migrazione neuronale: sono intermedi e migratori Forme diffuse: lissencefalia isolata (agiria‐pachigiria), sindrome di Miller‐Dicker, complesso di Cobblestone, eterotopia in bande sottocorticali (doppia corteccia) Forme focali bilaterali o multifocali: pachigiria, eterotopie nodulari periventricolari o sottocorticali, eterotopie glio‐neurali, eterotopie neurali isolate nella sostanza bianca Forme focali unilaterali: come sopra ma unifocali o Disturbi della organizzazione corticale: sono tardivi e post‐migratori Forme focali bilaterali o multifocali: polimicrogiria (silviana), schizencefalia, associazione di queste 2, displasie corticali, disgenesia dell’ippocampo Forme focali unilaterali: come sopra ma unifocali Par II: Facomatosi Generalità Le facomatosi (dal greco “fakos”: macchia, lentiggine, nevo) sono sindromi neurocutanee caratterizzate da: • Trasmissione ereditaria • Compromissione di organi di origine ectodermica (SN, bulbi oculari, retina e cute) • Lento sviluppo delle lesioni durante infanzia ed adolescenza • Tendenza alla formazione di amartomi (formazioni benigne simili ai tumori dovute a turbe dello sviluppo) • Predisposizione a sviluppare neoplasie maligne fatali Si possono distinguere due gruppi di facomatosi: • Facomatosi propiamente dette o Sclerosi tuberosa o Neurofibromatosi • Angiomatosi cutanee con anomalie del SNC o Atassia teleangectasia o Malattia di von Hippel‐Lindau Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
o
o
Malattia di Fabry Amangiomi dermatomici e malformazioni vascolari spinali Sindrome di Sturge‐Weber Malattia di Osler‐Weber‐Rendu Sindrome del nevo epidermico (nevo sebaceo linerare) Neurofibromatosi I o malattia di von Recklinghausen L NF1 è una malattia ereditaria relativamente comune, nella quale cute, SN, ossa e, a volte, altri organi, sono sede di anomalie congenite, che spesso si manifestano sotto forma di tumori benigni: il quadro clinico, solitamente riconoscibile a prima vista, è caratterizzato da numerose aree circoscritte di intensa pigmentazione cutanea, accompagnata da tumori dermici e neurali di vario tipo. Circa la metà dei pazienti ha una storia familiare di NF1 documentata e la distribuzione dei casi all’interno di una famiglia è sempre in accordo con un’ereditarietà di tipo dominante ed una penetranza elevatissima (sembra la malattia genetica col più alto grado di penetranza: arriva infatti al 100%. La penetranza, comunque, è età‐dipendente: cresce all’aumentare dell’età, fino a raggiungere la penetranza completa intorno ai 6 anni); tuttavia, la metà dei casi è dovuta a nuove mutazioni (fatto molto tipico: in realtà la genesi, visti gli alberi genealogici, sarebbe più complessa: è ipotizzabile un meccanismo di alterazione proteica proteina‐ indotto, sulla scorta di quanto avviene per le malattie prioniche? Ndr). Riguardo alcuni dati epidemiologici, l’incidenza di attesta su di un caso ogni 3000 nuovi nati e la prevalenza su di uno ogni 30000 persone. Riguardo invece la biologia molecolare, la neurofibromina, proteina alterata responsabile della NF1, è una GTPasi: il suo ruolo, pertanto, è quello di spegnere la cascata proliferativa e differenziativa indotta da Ras attivata da GTP: la GTPasi idrolizza il GTP in GDP spegnendo la cascata proliferativa. Pertanto, una alterazione della neurofibromina causerebbe una mancata idrolizzazione di GTP in GDP e quindi un mancato spegnimento della cascata proliferativa: ne deriva, quindi, una proliferazione incontrollata col conseguente sviluppo di iperplasie e neoplasie; la conseguenza è che gli elementi cellulari derivati dalla cresta neurale (cellule di Scwann, melanociti, fibroblasti endoneurali, componenti naturali di cute e nervi) vanno incontro ad una proliferazione eccessiva in focolai multipli. Inoltre, ormoni e fattori di crescita hanno un ruolo importante, essendo direttamente coinvolti, in quanto attivatori, nella cascata Ras‐dipendente: pertanto, i periodi più a rischio di complicanze (aumento di numero e dimensioni di lesioni già presenti, comparsa di nuove lesioni) sono pubertà e gravidanza. Riguardo il quadro clinico, reperti fondamentali (criteri primari) ed implicati nella diagnosi [presente secondo il National Institute of Health (NIH) in caso di presenza di 2 di questi] sono: • Chiazze di pigmentazione cutanea: espressione clinica più evidente, compaiono subito dopo la nascita e si osservano in qualsiasi parte del corpo; sono di forma ovale e di colore dal marrone chiaro al marrone scuro (“a caffellatte”), dovuto all’aumento del numero di melanosomi all’inteno dei melanociti. Le dimensioni aumentano durante la pubertà (diagnostiche 6 o più macchie di dimensioni maggiori a 0,5 mm in fase prepuberale, a 1,5 mm in fase post‐puberale) • Lentigginosi in sede ascellare o acrale (intertriginosa): pigmentazione di tipo lentigginosa o diffusa in sede intertriginosa • Tumori neurofibromatosi cutanei o sottocutanei (presenza di 2 o più neurofinromi di qualsiasi tipo o di un neurofibroma plessiforme): o Tumori cutanei: si sviluppano nel derma, formando papule distinte, molli o dure, di dimensioni variabili (fino al “mollusco fibroso”); di colore carneo o violaceo e spesso ricoperti da un comedone, se schiacciati, tendono ad invaginarsi lasciando un’apertura sulla cute (“occhiellatura”: utile per distinguerli da altri tumori cutanei) o Tumori neurali sottocutanei: possono assumere due forme Noduli duri e ben distinti, ben aderenti al nervo Neuromi plessiformi: formazioni dovute a crescita di tessuto sottocutaneo, talvolta enormi, compaiono spesso su viso, cuoio capelluto, collo o guance, provocando orribili deturpazioni Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
(non tuttavia quanto quelle della sindrome di Promoteo, caratterizzata, appunto, da deturpazioni devastanti, come nel film di David Lynch “the elephant man”, ndr) • Glioma ottico: possono anche essere presenti cefalee, idrocefalo, altri tumori delle vie ottiche (schwannomi), meningiomi, astrocitomi (astrocitoma pilocitico, astrocitoma diffuso), ependimoma del IV ventricolo (può causare idrocefalo ostruttivo) o tumori dei nervi periferici. Comunque, la cecità progressiva durante l’infanzia rappresenta un problema clinico di primaria importanza • Noduli di Lisch: piccola macula biancastra (amartoma) a livello dell’iride • Lesioni ossee: cisti ossee, fratture patologiche (pseudoartrosi) da assottigliamento della corticale ossea, difetti delle ossa craniche con esoftalmo pulsante (disgenesia dello sfenoide), ipertrofia ossea, scoliosi, macrocefalia (circonferenza cranica intorno al 90° percentile), bassa statura (altezza intorno al 20‐25° percentile), malformazioni del torace (pectus excavatus o carenatus), ipertelorismo (macrocefalia, bassa statura, malformazioni toraciche ed ipertelorismo rappresentano criteri dei secondo grado) • Parente di I grado affetto Altri reperti caratteristici (presenti nel 30‐40% dei casi ed importanti fattori di morbilità e mortalità), invece, sono: • Disabilità cognitive e disturbi del comportamento (iperattività) • Malattie cerebrovascolari: stroke, emorragia subaracnoidea • Altri tumori del SNC (astrocitoma cerebellare, gliomi troncoencefalici o spinali) e del SNP (schwannomi maligni, neurofibrosarcomi, angiosarcomi) • Tumori maligni non neurali: leucemie, feocromocitomi. Adenocarcinoma dell’ampolla di Vater • Alterazioni cardiovascolari: ipertensione nefrovascolare, coartazione dell’aorta • Aumento di incidenza di crisi epilettiche • Altro: albinismo, sordità congenita, atrofia muscolare congenita Neurofibromatosi II Meno frequente della precedente, è dovuta ad alterazione del gene che codifica per la merlina (o schwannomina: ha la funzione di ancorare la membrana plasmatica al citoscheletro) e caratterizzata da neuromi bilaterali (meningiomi e gliomi) dei nervi acustici. E’ diagnosticata in caso di presenza di un familiare affetto e due tra: • Neurinomi (schwannomi) della branca vestibolare del nervo acustico (tipicamente bilaterali) presenti nella maggioranza dei casi entro i 30 anni • Neurofibromi / schwannomi di altri nervi cranici o periferici (più spesso a carico delle radici spinali o della cauda equina) • Glioma • Meningioma (della falce, della convessità) • Opacità lenticolare (a livello del cristallino) subcapsulare posteriore Sclerosi tubolare (o malattia di Bourneville) E’ una malattia congenita di tipo ereditario caratterizzata da una serie di lesioni delle cellule dell’ectoderma e del mesoderma, dovute ad iperplasia circoscritta, che insorgono su cute, SN, reni, cuore ed altri organi; il quadro clinico tipico è caratterizzato da epilessia, ritardo mentale ed adenoma sebaceo, nonché dalla “chiazza zigrinata” (macula cutanea ipomelanotica). L’eredità, di tipo autosomico dominante, è meno evidente che nella NF e l’ espressione è molto variabile (da forme “fruste” più lievi a quadri molto gravi); nel 75% dei casi il sospetto è indotto da crisi convulsive focali o generalizzate (talvolta presenti sin dalla nascita) e da ritardo mentale più o meno grave (spesso visibile intorno ai 3‐4 anni, in assenza dei normali progressi psicomotori), mentre l’adenoma sebaceo si sviluppa nella tarda infanzia per avere poi un decorso progressivo. Riguardo alcuni dati epidemiologici, a fronte di una prevalenza attestata intorno ad un caso su 6000/9000 casi clinici, la reale prevalenza sembra sottostimata in virtù dell’espressione variabile, e quindi di casi più lievi non diagnoticati. Riguardo la biologia molecolare, il gene anomalo è localizzato in due possibili siti: braccio lungo del cromosoma 9, nel gene codificante per la amartina, o nel braccio corto del cromosoma 16, nel gene codificante per la tuberina. Queste Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
due proteina interagiscono tra loro per inibire la crescita cellulare, operando quindi come oncosoppressori: una loro mutazione con perdita di funzione può spiegare la propensione a sviluppare amartomi e neoplasie; le anomali possono interessare cellule di diverso tipo (fibroblasti, mioblasti, angioblasti cardiaci, glioblasti, neuroblasti). Riguardo il quadro clinico, possono aversi: • Lesioni neurologiche: o Crisi epilettiche o Ritardo psicomotorio o Noduli subependimali: localizzati lungo le superfici dei ventricoli laterali e, talvolta, del IV ventricolo, se localizzati nelle adiacenze del forame di Monro (o dell’acquedetto o del pavimento del IV ventricolo) possono causare idrocefalo od evolvere in astrocitomi subependimali a cellule giganti. Ben visualizzabili alla RM, al microscopio l’architettura tissutale risulta sconvolta dalla presenza di cellule abnormi: cellule gliali e neuroni enormi, mostruosi od “a pallone”, configurando i caratteristici tuberi (quindi, i tuberi sono aree discrete di perdita della normale architettura cerebrale). Possibile, infine, la formazione di calcoli cerebrali calcifici. • Lesioni cutanee o Adenoma sebaceo (o di Pringle): lesioni facciali ben sviluppate, patognomoniche, hanno l’aspetto di noduli di colore rosso o rosato, a superficie liscia e presenti su pliche naso‐labiali, guance, mento, fronte o cuoio capelluto. In realtà sono angiofibromi, essendo le ghiandole sebacee interessate solo passivamente. Si manifestano solitamente in età scolare, crescendo poi di dimensioni e numero o Lesioni “a foglia di frassino”: macule ipomelanocitiche congenite, sono le prime lesioni cutanee a comparire, disponendosi in maniera lineare su tronco od arti con configurazione caratteristica, cioè con un’estremità arrotondata e l’altra appuntita, appunto a forma di foglia di frassino o Chiazza zigrinata: placca di fibrosi sottoepidermica presente sul tronco, specie in zona lombo‐
sacrale, si manifesta come area cutanea piatta, legegrmente sovraelevata o Adenomi sub‐ o peri‐ungueali o Altro: appendici fibroepiteliali (fibromi molli), macchie caffèlatte, nevi angiomatosi di colore vinoso • Lesioni da interessamento viscerale o Facomi: placche grigie o giallastre (tumori gliomatosi) su retina, disco ottico, od un po’ distanti da questo o Cuore: rabdomiomi : se localizzati nella parete atriale, possono dar luogo a disturbi di conduzione o Reni: angiomiolipomi, cisti, carcinomi, o Polmoni: linfangioleiomatosi, tumori o Ossa: cisti (frequenti al metacarpo) Pertanto, per la diagnosi, si riconoscono: • Criteri maggiori: angiofibromi facciali o macchia sulla fronte, fibromi ungueali o periungueali non traumatici, macule ipomelanotiche ( >3), chiazza zigrinata, amartomi nodulari retinici multipli, tubero corticale, nodulo sottoependimale, astrocitoma sottoependimale a cellule giganti, rabdomioma cardiaco, linfoangiomatosi, angiolipoma renale • Criteri minori: cavità multiple nello smalto dentario, polipi rettali amartomatosi, cisti ossee, linee di demarcazione nella sostanza bianca cerebrale, fibromi gengivali, amartomi non renali, macchia acromica retinica, lesione cutanea a coriandoli, cisti renale multipla La diagnosi potrà essere definita (2 maggiori o 1 maggiore+ 2 minori), probabile (1 maggiore + 1 minore), possibile (1 maggiore o almeno 2 minori). Sindrome di Sturge‐Weber o angiomatosi meningo‐facciale (encefalo‐facciale) con calcificazione cerebrali In questa malattia, un nevo vascolare diffuso, presente alla nascita, copre gran parte di un lato del viso e del cranio in corrispondenza della branca oftalmica del nervo trigemino (entrambi i lati nel 25% dei casi): la lesione può avere estensione variabile, interessando solo la palpebra superiore nei casi più circoscritti e tutta la testa, od anche altre Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
parti del corpo, nei casi più diffusi; il nevo è di colore rosso scuro (nevo vinoso), con superficie resa irregolare da papule molle d dure formate da vasi. Complicanze sono il glaucoma fino alla cecità ed un’iperplasia di tessuto connettivo ed osseo sottostante, esitante in una deformazione ben apprezzabile. L’affezione cerebrale compare, invece, nel primo anno di vita o più tardi: le manifestazioni più caratteristiche sono: convulsioni monolaterali, emiparesi spastica con atrofia di braccio e gamba, difetto emisensitivo, emianopsia, controlaterali al nervo trigemino interessato; all’RX si evidenzia il tipico reperto di calcificazioni “a binario”, che traccia il contorno delle circonvoluzioni della corteccia parieto‐occipitale (vi sarebbe una lesione corticale primitiva, che residua in tessuto gliale che va incontro a calcificazione). Si ricorda, quindi, la strettissima associazione tra interessamento della palpebra superiore e lesioni cerebrali. Malattia di von Hippel‐Lindau Malattia genetica caratterizzata da neoplasie multiple, a livello soprattutto di: SNC, occhi, reni, pancreas, ghiandole surrenali. E’ individuabile specialmente per la presenza di un emangioblastoma, talora multiplo, localizzato solitamente al cervelletto, ma anche nel troncoencefalo o nel midollo spinale (il tumore è caratterizzato dalla presenza di un nodulo all’interno di una cisti); in oltre la metà dei casi, è poi presente un emangioblastoma retinico, in un numero inferiore di casi un tumore renale a cellule chiare (speso multiplo e bilaterale) o cisti renali bilaterali (come nella malattia renale policistica congenita), in un numero ancora minore di casi feocromocitoma (a livello di ghiandole surrenali o di altre strutture pregangliari, accompagnato da ipertensione arteriosa), tumori (tumori delle insule non secernenti, adenomi microcistici sierosi, adenocarcinomi) o cisti pancreatiche, cistoadenomi epididimali, , policitemia vera. Comunque, elemento caratteristico di questa malattia è l’emangioblastoma, tumore vascolare benigno a lenta crescita, costituito istologicamente da canali vascolari endoteliali circondati da cellule stromali e periciti (producono eritropoitetina: da qui la policitemia), che danno sintomi in base alla sede colpita: sede preferenziale è il SNC, ed in particolare il cervelletto, dove colpiscono solitamente gli emisferi e si esplicitano come cefalea, atassia, nausea e vomito, ma anche troncoencefalo, midollo spinale (tipici quelli midollari multipli) o corteccia; l’emangioma cerebellare si sviluppa tipicamente nella quarta decade di vita, risultando mortale in poco tempo (la mortalità, intorno ai 40 anni, è dovuta nei due terzi dei casi all’emangioma cerebellare, in un terzo dei casi al tumore renale). Frequenti sono poi gli emangioblastomi retinici, spesso localizzati in periferia e quindi asintomatici, possono comunque provocare perdita del visus per grosse lesioni maculari centrali ed altre complicanze, quali emorragie, distacco retinico, uveite, glaucoma, edema maculare. L’ereditarietà è di tipo autosomico dominante, con penetranza variabile ma più alta in età avanzata: la mutazione responsabile si trova nel cosiddetto gene VHL, soppressore tumorale inattivato dalla mutazione (posto sul cromosoma 3 vicino al gene dell’oncogene Raf1): ne deriva un aumento dell’oncogenesi tramite incrementata espressioni di fattori di crescita quali VEGF; sono state identificate varie mutazioni (incluse aberrazioni cromosomiche acquisite) che spiegherebbero la grande variabilità di forme tumorali. Atassia‐teleangectasia o sindrome di Louis‐Bar E’ una sindrome multisistemica autosomica recessiva, dovuta ad una mutazione del gene ATM (atassia teleangectasia mutated), che codifica per una chinasi coinvolta nel processo di riparazione del DNA, bloccando il ciclo cellulare in seguito ad un danneggiamento dello stesso DNA, soprattutto per rotture a doppio filamento: pertanto, in seguito ad una sua mutazione, si verificano riparazione incorrette, con aumento del rischio di linfomi, leucemie ed altri tumori, ed alterazioni a carico di cellule di Purkinje del cervelletto, altre cellule cerebrali (in particolare a livello di substantia nigra e locus coeruleus), cellule endoteliali di congiuntiva ed epiteliali di cute. Ne deriva un quadro clinico caratterizzato da: • Lesioni del SNC: il disturbo si presenta inizialmente come una sindrome atassica‐discinetica, ad esordio quando il bambino inizia a camminare; verso i 4‐5 anni, poi, all’atassia si associano coreoatetosi, smorfie, disartria, alterazioni dei movimenti oculari, aprassia dello sguardo; intorno ai 10 anni compaiono, infine, segni di deterioramento cognitivo e di neuropatia periferica. Quindi, si può affermare che segno caratteristico è una progressiva ed invalidante neurodegenerazione Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
Teleangectasie: sono plessi venosi subpapillari trasversale, a comparsa intorno ai 3‐4 anni ed a sede a livello della parte esterna della congiuntiva bulbare, sopra le orecchie, nelle parti più esposte del collo e sul dorso del naso, diramandosi alle guance con disposizione “a farfalla”, nonché nelle pieghe flessorie degli avambracci Alterazioni cutanee o Alterazioni progeriche: poichilodermia, capelli grigi, perdita del pannicolo adiposo sottocutaneo, sclerosi o Ipertricosi agli avambracci o Altro: granulomi cutanei, macchie caffèlatte, dermatite seborroica, vitiligine, eczema, acanthosis nigricans, carcinomi a cellule basali Alterazioni endocrine: assenza di sviluppo sessuale secondario, intolleranza glucidica, sterilità per difettosa ricombinazione meiotica Infezioni broncopolmonari ricorrenti: sono causate da una diminuzione od assenza di varie classi di Ig per una loro ridotta sintesi e possono residuare in bronchiectasie; si associano ipoplasia del timo, perdita di follicoli linfonodali, mancanza di reazioni da ipersensibilità ritardata, rallentamento della sintesi di Ab circolanti Suscettibilità neoplastica: linfomi, leucemie, carcinoma mammario Aumentata radiosensibilità Par III: Altri disturbi dello sviluppo del SN Difetti del tubo neurale (DTN) (o disrafia cerebrale, spinale o cerebrospinale) Derivano da mancata chiusura del tubo neurale durante la neurulazione primaria (18°‐ 27° giorno del concepimento), si suddividono in: • Difetti di chiusura del tubo neurale: anencefalia, craniorachischisi, mielomeningocele (possono essere distinti in aperti o chiusi a seconda del coinvolgimento o meno della volta cranica) • Difetti assiali mesodermici: o Con erniazione del tubo neurale: encefalocele, meningocele o Difetti di chiusura: split cord (livello alto) • Difetti del bottone germinale terminale: spina bifida occulta, split cord (livello basso), idromelia In alcuni casi, i DTN non si presentano come disturbi isolati, ma come parte di sindromi malformative, riconducibili ad alterazioni genetiche, come nella sindrome di Meckel, ad alterazioni cromosomiche, come nella sindrome di Edwards o di Patau, od a teratogeni ambientali, come nella sindrome da aminopterina. Anormalità cromosomiche ed altre patologie Tra esse si ricordano: • Sindrome di Williams: è caratterizzata da ritardo mentale di grado lieve, ma con sorprendenti capacità di ritenzione delle informazione ed addirittura precocità o superiorità nelle attitudini musicali e nell’amabilità sociale (“everybody in the world is my friend”; queste capacità sarebbero forse dovute ad un deficit corticale prevalentemente sinistro, con disinibizione del controllo su quello destro, con amplificazione di queste qualità, derivate prevalentemente proprio dall’emisfero destro normalmente frenate dall’emisfero sinistro, ndr). Al contempo, possono essere presenti notevoli capacità grafiche con produzione di lunghe descrizioni scritte, che si contrappone però ad una forte deficit visuospaziale con incapacità a disegnare anche oggetti semplici. Il bambino è lievemente ritardato e presenta anomalie somatiche (bocca ampio, naso all’insù, occhi a mandorla, orecchie piccole ed appuntite), che lo rendono simile ad un elfo. Questa patologia è dovuta ad una microdelezione sul cromosoma 7, nella regione del gene che controlla la produzione di elastina: il deficit di elastina comporta, infatti, anche una stenosi aortica sopravalvolare. • Sindrome del cri‐du‐chat: sindrome caratterizzata da emissione di suoni simili ad un miagolio dovuti a d anomali laringee, grave deficit mentale, ipertelorismo, pliche epicantiche, brachicefalia, facies lunare, Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
inclinazione antimongoloiede della rima palpebrale, micrognatie, ipotonia e strabismo, è dovuta a delezione del braccio corto del cromosoma 5 Sinrome di Down: da trisomia 21 Sindrome di Patau: da trisomia 13 Sindrome di Edwards: da trisomia 18 Sindrome di Smith‐Lemli‐Optiz: sindrome ereditaria trasmessa come tratto autosomico recessivo, caratterizzata da microcefalia, dismorfismi facciali (punta del naso allargata e narici piegate in avanti, occhi eccesivamente distanti tra loro, pliche epicantiche, ptosi, mento piccolo, orecchie a bassa inserzione, margine alveolare mascellare allargato), brachidattlia o sindattilia cutanea delle dita del piedi, ipospadia, criptorchidismo, ritardo psicomotorio. L’alterazione biochimica diagnostica consiste nella riduzione dell’attività della 7‐deidrocolesterolo reduttasi, con conseguente bassi livelli di colesterolo ed elevati livelli di 7‐deidrocolesterolo Sindrome da deficit di folati: l’acido folico (vitamina B9) è coinvolto nella sintesi delle purine e nella introduzione di un gruppo metilico nell’anello delle pirimidine essenziali per la produzione di DNA ed RNA; quindi, i tessuti in fase proliferativa e di differenziazione, come i tessuti embrionali, sono particolarmente sensibilii al deficit ed alle alterazioni metaboliche dell’acido folico: pertanto, risulta fondamentale un supplemento di acido folico durante la gravidanza per prevenire lo sviluppo di DTN ed altre anomalie dello sviluppo del SN Screening diagnostico prenatale Si avvale di • Tritest: valutazione computerizzata della probabilità di anomalie cromosomiche (Down) e di difetti del tubo neurale calcolato mediante i dosaggi sierici di alfafetroproteina, beta HCG ed estriolo libero. L'esame prende in considerazione anche l'età materna ed i parametri biometrici. • Esame ultrasonorografico: eseguito tra il primo ed il terzo mese di gravidanza, rappresenta la principale tecnica di diagnosi di DTN, in quanto i difetti occulti spesso sfuggono all’analisi biochimica • Valutazione dell’alfaproteina (AFP): elevati valori di AFP sono associati a DTN, ma anche a gravidanza gemellare, morte fetale intrauterina, triploidia, gravidanza addominale, teratoma, nefrosi congenita (falsi positivi) • Valutazione generale (key points): una noxa patogena che intervenga durante embriogenesi o fetogenesi, può provocare aborto, manifestazioni congenite od alterazioni funzionali. Le malattie da deficit cerebrale (MDC) costituiscono un ampio spettro di malformazioni cerebrali costituite durante l’embriogenesi: sono la conseguenza di alterazioni di proliferazione, migrazione od organizzazione corticale. La maggior parte di esse può essere riconosciuta tramite RM. Ad un certo numero di esse (STB, lissencefalia, eteropatie in bande) è stata riconosciuto un difetto genetico. Il quadro clinico è solitamente dominato da epilessia, che può essere associata a deficit neurologici ed insufficienza mentale di vario tipo; l’espressione clinica è tanto più grave quanto più precoce è l’esordio durante l’embriogenesi e quanto più diffusa è la malformazione. Studi neurofisiologici (EEg, MEG) e di imaging funzionale (fMRI, PET), sono utilizzati per studiare l’epilettogenesi ed i fenomeni di riorganizzazione funzionale specifica per ogni tipo di MDC. Un certo di numero di pazienti con epilessia farmaco‐resistente può beneficiare del trattamento chirurgico, in particolare quelli con displasie focali corticali o con tumori neuroepiteliali disembrioplasici. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ I PROF LUSS Principali malattie immunomediate del SN e della giunzione neuromuscolare ParI: Sclerosi Multipla (SM) Generalità La SM è una malattia infiammatoria cronica demielinizzante del SNC, caratterizzata da placche sclerotiche disseminate nella sostanza bianca dell’encefalo e del midollo spinale (MS), con sintomatologia variabile. Le malattie demielinizzanti possono considerarsi un gruppo di malattie del SN caratterizzate, come manifestazione predominante, da perdita della guaina mielinica (demielinizzazione). I criteri anatomo‐patologici comunemente accettati per una malattia demielinizzante consistono in: • Distruzione delle guaine mieliniche che rivestono le fibre nervose con risparmio relativo degli altri elementi del tessuto nervoso, come evidenziato dalla relativa assenza di degenerazione walleriana o secondaria di tratti di fibre nervose. Comunque, può essere, talvolta, presente un grave danneggiamento dei cilindrassi e delle strutture vascolari, oltre che della mielina • Infiltrazione di cellule infiammatorie con distribuzione perivascolare e, in particolare, paravenosa • Localizzazione delle lesioni principalmente nella sostanza bianca, in piccoli focolai multipli disseminati o in focolai più ampi che si espandono a partire da uno o più nuclei centrali Una classificazione delle malattie demielinizzanti distingue: • SM o Forme encefalomielopatiche croniche recidivanti (forma classica) o Sclerosi multipla acuta (o malattia di Marburg) o Neuromielite ottica (o malattia di Devic) o Sclerosi cerebrale diffusa (o malattia di Schilder) • Neuromielite ottica • Encefalomielite acuta disseminata o Post‐infettiva: morbillo, varicella, vaiolo, parotite, influenza, mycolplasma, rickettsiae o Post‐vaccinica: vaccino anti‐rabbico, anti‐vaiolo • Encefaliti emorragiche necrotizzanti acute e subacute o Forme encefalopatiche acute: leucoencefalite emorragica di Hurst o Mielopatia necrotizzante subacuta La SM è una delle più importanti malattie neurologiche a causa della frequenza e della cronicità, nonché per la tendenza a colpire giovani adulti: è caratterizzata clinicamente da disturbi focali a carico di nervo ottico, midollo spinale ed encefalo, che possono regredire in vario grado per poi ripresentarsi (forma recidivante‐remittente, vedi dopo). Le manifestazioni cliniche sono assai variabili in rapporto alla localizzazione ed all’estensione dei focolai di demielinizzazione: solitamente, comunque, le sedi sono abbastanza tipiche, tali da determinare un quadro abbastanza tipico. Tale quadro è caratterizzato, in vario modo, da ipostenia, paraparesi, parestesie, compromissione della vista, diplopia, nistagmo, disartria, tremore intenzionale, atassia, disturbi della sensibilità profonda e disfunzioni vescicali. Il decorso può essere: • Recidivante‐remittente: nella maggior parte dei casi, le manifestazioni cliniche regrediscono parzialmente, od anche totalmente, per ricomparire, dopo un intervallo di tempo variabile, secondo le stesse modalità o con comparsa di nuove anomalie riferibili all’interessamento di altre parti del SN • Progressivo primario: è costantemente evolutivo, specie nei soggetti di età superiore ai 40 anni al momento dell’esordio • Progressivo secondario: una forma recidivante remittente si fa progressiva • Recidivante‐progressivo Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Eziopatogenesi Le tappe della patogenesi della SM sarebbero: • Adesione di cellule T autoreattive (per la loro genesi vedi dopo) alla barriera ematoencefalica (BEE): ciò causerebbe la penetrazione di metalloproteasi di matrice (MMP) con: • Rottura della BEE: causerebbe la penetrazione di autoanticorpi (AAB) demielinizzanti e del linfociti T autoreattivi • Infiammazione: produzione di mediatori infiammatori e demielinizzanti, indotta dalla penetrazione, attraverso la BEE danneggiata, dei linfociti T autoreattivi e degli AAB, con attivazione dei linfociti B • Demielinizzazione: sarebbe dovuta agli AAB che provocano danni: o Complemento‐mediati o Cellulo‐mediati (soprattutto macrofagi): nelle forme più gravi e prolungate, l’intero processo porterebbe alla distruzione degli assoni e degli oligodendrociti • Rimielinizzazione inefficace delle placche di SM: il tentativo di rimielinizzazione di assoni denudati comporta la produzione delle caratteristiche “placche d’ombra” (vedi dopo) Tra i fattori eziologici vi sarebbero: • Fattori ambientali: un antigene ambientale, simile ad un autoantigene, eliciterebbe una risposta sia immunitaria che autoimmunitaria (mimetismo molecolare). I superantigeni sono in grado di legarsi ai MHC, sensibilizzandoli agli autoantigeni. L’esposizione ai fattori ambientali è importantissime nei primi anni di vita, fino ai 15 anni. I fattori ambientali possono essere di origine: o Infettiva: morbillo, parotite, rosolia, mononucleosi (EBV: è stato riscontrato in vari casi di autopsie di soggetti con SM. Tuttavia, data l’elevatissima positività della popolazione per EBV, l’associazione è molto dubbia) o Virus particolari: retrovirus associato alle infezioni da SM, HHV‐6 o Traumatica: traumi elettrici, artrosi cervicale, parto • Fattori genetici: o Rischio assoluto maggiore in pazienti di primo grado o Concordanza maggiore nei gemelli omozigoti o Rischio aumento per presenza dell’allele HLA‐DR2 (gene coinvolto nei meccanismi di risposta immunitaria) • Fattori autoimmunitari: perdita del meccanismo di auto tolleranza. Tuttavia, il reale ruolo dell’autoimmunità è messo in dubbio dalla scarsa evidenza di malattie autoimmuni e dalla scarsa risposta alle terapie immunosoppressive Quindi, una teoria eziopatogenetica integrante prevede il contatto con un agente ambientale (pur su di un substrato genetico predisponente) nell’infanzia, che provocherebbe l’autoimmunità, ed una successiva esplicitazione di questa autoimmunità, tramite meccanismi e cause ancora non ben chiariti (secondo un’ipotesi sarebbero le riesposizioni alle stesse infezioni virali a riattivare la malattia). Tale autoimmunità, secondo i meccanismi suddetti, si manifesterebbe contro i componenti della mielina, fin, nelle forme più gravi, al coinvolgimento di tutti gli elementi tissutali, compresi gli stessi assoni. Questa possibilità è avvalorata dal riscontro di AAB diretti contro specifiche proteina mieliniche, quali la proteina basica della mielina (MBP) e la glicoproteina oligodendrocitaria (MOG), nel liquor e nel siero. Il principale effetto fisiologico della demielinizzazione è di impedire la conduzione elettrica saltatoria degli impulsi nervosi da un nodo di Ranvier al successivo: il conseguente deficit di trasmissione elettrica sarebbe alla base di gran parte delle disfunzioni delle fibre centrali e periferiche della malattia demielinizzante. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Epidemiologia È molto caratteristico il fatto che il rischio è correlato all’incremento di latitudine: pertanto USA e paesi dell’Europa mediterranea presentano una discreta prevalenza, Canada e paesi dell’Europa centro‐settentrionale presentano una prevalenza ancora più alta. Le popolazioni di etnia africana o dell’America del Sud presentano un rischio più basso, ma, se emigrate in zone a prevalenza più elevata prima dai 15 anni, presentano un rischio pari a quello delle popolazioni native. Queste considerazioni riflettono l’importanza dei fattori ambientali (vedi sopra; anche smog, fumo, alimentazione?). La prevalenza, inoltre, è maggiore (2:1) nelle donne: ciò rifletterebbe il ruolo di fattori ormonali nella regolazione immunitaria (le donne sono più soggette, infatti, a malattie autoimmunitarie). L’età di comparsa è intorno ai 20‐40 anni: dopo l’infanzia (in cui comunque è possibile riscontrare rari casi), il rischio aumenta rapidamente, fino a raggiungere un picco a circa 30 anni e rimanendo elevato fino ai 40 anni, per poi diminuire nettamente e diventare basso nella sesta decade (la malattia dell’età adulta è solitamente più benigna) Quadro clinico In alcuni pazienti possono essere presenti sintomi prodromici, quali affaticamento, astenia, perdita di peso ed indistinti dolori osteoarticolari, settimane o mesi prima dell’insorgenza della sintomatologia neurologica. La sintomatologia neurologica può esordire in maniera variabile: da un esordio brusco, addirittura in minuti od ore, ad un esordio graduale ed insidioso, in mesi od anni, passando per le forme più comuni di esordio in giorni o settimane. In circa la metà dei pazienti, la perdita di forza e l’intorpidimento di uno o più arti sono i sintomi iniziali caratteristici: si associano formicolii localizzati alle estremità e senso di costrizione “a fascia” od “a cintura” al tronco ed agli arti, dovuti probabilmente al coinvolgimento dei cordoni posteriori del MS. Si riconoscono: • Sintomi o Debolezza ed affaticamento intenso o Neurite ottica: tipicamente si verifica una perdita parziale o totale della vista da un occhio, preceduta, talvolta, da dolore all’interno dell’orbita. Spesso sono presenti anche altri disturbi visivi, specie del campo visivo, fino all’emianopsia. Nei pazienti esenti da disturbi visivi, è possibile comunque rilevare lievi manifestazioni di interessamento del nervo ottico, come un difetto dell’afferenza pupillare, l’atrofia delle fibre nervose della retina o lo slaminamento delle vene della retina, ed anomalie dei potenziali evocati visivi. È bene, infine, notare che oltre la metà dei pazienti con neurite ottica sviluppa, in seguito, altri segni di SM. • Segni o Piramidali Paraparesi spastica ad evoluzione rapida Iperattività ROT Segno di Babinski o Sensitivi Perdita della sensibilità profonda e superficiale di vario grado Segno di Lhermitte: la flessione del collo provoca una scossa simile a quella elettrica lungo le spalle e la schiena e, meno frequentemente, lungo la parte anteriore della coscia. È una conseguenza dell’aumentata suscettibilità degli assoni demielinizzati allo stiramento ed alla compressione del midollo spinale, conseguente alla flessione del capo Disestesie e parestesie o Cerebellari Atassia, incoordinazione della marcia, instabilità della deambulazione, perdita dell’equilibrio Disdiadococinesia, nistagmo, parola scandita, tremore intenzionale o Troncoencefalici: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
o
Diplopia: è solitamente dovuta ad una oftamoplegia internucleare, caratterizzata da paresi del muscolo retto mediale. Se l’oftalmoplegia è bilaterale, il distrubo è pressocchè patognomonico di SM Altri: vertigini, vomito, dolore facciale, paralisi dei muscoli facciali, nevralgia del trigemino, sordità ronzio auricolare Deficit neurologici a comparsa improvvisa: disartria ed atassia, dolore parossistico e disestesia in un arto, bagliori intermittenti, prurito parossistico, crisi distoniche Urogenitali: ritardo o incapacità ad iniziare la minzione, urgenza e frequenza dello stimolo urinario, incontinenza urinaria, svuotamento incompleto, impotenza Cognitivo‐comportamentali: deterioramento cognitivo con riduzione dell’attenzione, della velocità di elaborazione e di esecuzione, della memoria (demenza sottocorticale, con mantenimento del linguaggio e delle altre funzioni intellettive), demenza globale o stato confusionale psicotico nelle forme più avanzate, depressione o disturbo bipolare Pertanto, possono riconoscersi diverse sindromi cliniche: • Miste: coinvolgono nervi ottici, tronco encefalo, cervelletto e midollo spinale (fasci piramidali e cordoni posteriori) • Spinale: è presente un’atassia spastica con alterazioni della sensibilità profonda a livello delle estremità • Cerebellare o cerebello‐ponto‐bulbare • amaurotica Ne deriva un particolare decorso della malattia: • Disabilità minima • Aumento della limitazione della capacità di camminare • Necessità di assistenza durante il cammino • Paziente costretto sulla sedia a rotelle • Paziente a letto, completamente dipendente • Morte Tra le altre forme si ricordano: • Sclerosi cerebrale diffusa di Scilder: colpisce soprattutto bambini (sarebbe una sorta di “SM” dei bambini). Clinicamente simile alla forma classica, presenta tipiche lesioni demielizzanti encefaliche molto grandi • Neuromielite ottica di Devic: è una malattia demielinizzante a decorso monofasico o recidivante caratterizzato da attacchi di neurite ottica e mielite trasversa, che risparmiano, negli stadi precoci, l’encefalo. • Sclerosi multipla acuta di Marburg: colpisce soprattutto giovani con decorso clinico monobasico fino all’exitus • Sclerosi concentrica di Balò: colpisce soprattutto giovani e si distingue dalla SM per il pattern neuro radiologico delle lesioni “a bulbo di cipolla” Diagnosi • Anatomopatologica: ad un esame esterno il cervello non presenta alcuna alterazione riconducibile alla malattia, ma la superficie del midollo spinale può apparire irregolare. La dissezione del cervello e del midollo evidenzia lesioni disseminate lievemente depresse rispetto alla superficie e di colore rosa‐grigio, dovuto alla perdita di mielina. È interessata principalmente la sostanza bianca del cervello e del midollo spinale, le lesioni non si estendono oltre la zona d’ingresso delle radici dei nervi spinali e cranici. Caratteristica è la localizzazione periventricolare delle lesioni; altre strutture frequentemente interessate sono nervi ottici, chiasma, tronco encefalo e peduncoli cerebellari. Possono didatticamente distinguersi più fase di alterazioni neuropatologiche: o Prima fase: le lesioni sono caratterizzate dalla distruzione parziale o completa e dalla perdita della mielina lungo tutta un’area formata dal confluire di molti piccoli focolai, prevalentemente Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
perivenosi, con relativo risparmio degli assoni, degenerazione oligodendocitica ed astrocitaria lieve e reazione infiammatoria periva scolare o Seconda fase: numerosi macrofagi ed astrociti infiltrano la lesione; può iniziare l’apoptosi oligodendrocitaria o Terza fase: le lesioni risultano costituire da un tessuto di granulazione relativamente acellulare, con degenerazione di fibre discendenti ed ascendenti. È possibile anche un tentativo di rimielinizzazione con formazione delle “zone d’ombra”. Infine, può aversi una cavitazione, indice di interessamento anche del tessuto di sostegno e dei vasi. • RM: è l’esame più utile per individuare placche anche asintomatiche nel cervello, nel tronco encefalico, nei nervi ottici e nel midollo spinale. Le placche croniche sono iperintense nelle immagini in T2 ed ancor più evidenti nelle immagini FLAIR. Può essere presente un certo grado di cavitazione, risultando in immagini ipointense in T1. Comunque, il reperto in T2 di numerose lesioni asimmetriche e ben delimitate, immediatamente adiacenti alla superficie ventricolare, di solito segnala la presenza della SM. Di particolare valore diagnostico è la presenza di zone di demielinizzazione ovali o lineari, orientate perpendicolarmente alla superficie ventricolare: corrispondono ai fasci di fibre della sostanza bianca ed alle vene periventricolari. Nelle prime fasi evolutive di una lesione da SM si verifica un’interruzione della BEE: ne risulta un’immagine di iperintensità dopo somministrazione di gadolino. Infine, altri aspetti rilevabili alla RM, sono: processi di rimielinizzazione delle placche, degenerazione assonale ed atrofia cerebrale • Esame del liquor o Moderato aumento delle proteine: 50‐70 mg/ml o Moderata pleiocitosi mononucleare: 6‐20/mm3 o Livelli aumentati di IgG: poiché le gamma‐globuline all’elettroforesi migrano come distinte popolazioni patologiche, danno luogo alle bande oligoclonali di IgG. Inoltre l’indice delle IgG è aumentato (IgG liquorali/ IgG sieriche : albumina liquorale/ albumina sierica) o Livelli elevati MBP • Potenziali evocati visivi, uditivi e somatosensoriali alterati • Diagnosi differenziale o Disturbi metabolici: disturbi del metabolismo della B12, leucodistrofie o Malattie autoimmuni: sindrome di Sjorgen, sindrome di Behcet, condizioni degenerative spino cerebellari o Infezioni: mielopatie associate ad HIV ed HTLV1, malattia di Lyme o Malattie psichiatriche: reazione di conversione, simulazione o Vasculopatie: fistola arterovenosa durale vertebrale, emangiomi cavernosi o Sindromi genetiche: atassie e paraplegie ereditarie, atrofia ottica di Leber o Lesioni della fossa cranica posteriore e del midollo spinale: malformazione di Arnold‐Chiari, mielopatia spondilosica o Malattie neoplastiche: tumori del midollo spinale, linfoma del SNC o Varianti della SM: neurite ottica, malattia di Malburg Sono stati recentemente elaborati dei criteri diagnostici per la SM: Recidive
risp. clinica
Lesioni clinicamente
verificate
Requisiti supplementari per la diagnosi
Due o più
Due o più
nessuno; sono sufficienti i segni clinici
Due o più
Una
Lesioni disseminate nello spazio dimostrate
alla RMI:
≥ 1 lesione/i in almeno 2/4 localizzazioni
tipiche della SM (periventricolare,
juxtacorticale, infratentoriale, spinale)
Una recidiva
due o più
Lesioni disseminate nel tempo dimostrate
alla RMI:
Presenza contemporanea di lesioni
asintomatiche che si impregnano di liquido
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Recidive
risp. clinica
Lesioni clinicamente
verificate
Requisiti supplementari per la diagnosi
di contrasto e lesioni che non si
impregnano;
oppure
≥1 nuova lesione T2 o che si impregna di
liquido di contrasto in una RMI susseguente
Una recidiva
monosintomatica
Una
Lesioni disseminate nello spazio alla RMT:
≥ 1 lesione/i in almeno 2/4 localizzazioni
tipiche della SM (periventricolare,
juxtacorticale, infratentoriale, spinale)
così come
Lesioni disseminate nel tempo dimostrate
alla RMI:
Presenza contemporanea di lesioni
asintomatiche che si impregnano di liquido
di contrasto e lesioni che non si
impregnano
oppure
≥1 nuova lesione T2 o che si impregna di
liquido di contrasto in una RMI susseguente
Sin dall’insorgenza,
decorso progressivo con
sospetto di SM
Lento peggioramento
neu-rologico
compatibile con la SM
Progressione della malattia per un anno
con due dei criteri seguenti:
a) RMT cerebrale positiva (≥ 1 lesione/i in
almeno 2/4 localizzazioni tipiche della SM:
periventricolare, juxtacorticale,
infratentoriale, spinale)
b) RMT del midollo spinale positiva
(due o più lesioni T2 focali)
c) Esame liquorale positivo
Terapia • Della fase acuta: corticosteroidi • Di fondo: beta‐interferoni, copolimero, immunosppressori (ciclofosfamide, mitoxantrone, natalizumab): prevengono le ricadute, ritardano la progressione della malattia Par II: Miastenia gravis Introduzione La miastenia gravis (MG) è una malattia disimmune caratterizzata dalla formazione di anticorpi contro il recettore nicotinico post‐sinaptico della giunzione neuromuscolare. Una riduzione nel numero dei recettori dell’acetilcolina porta ad un quadro clinico caratterizzato da una progressiva riduzione di forza muscolare durante l’esercizio con ripresa dopo il riposo e da un’abnorme affaticabilità muscolare. La muscolatura bulbare è spesso coinvolta in maniera anche grave, ma nella maggior parte dei casi l’ipostenia è generalizzata. La caratteristica principale è l’ipostenia fluttuante di alcuni muscoli volontari, in particolare di quelli innervati dai nuclei motori del tronco encefalico, cioè gli oculomotori, i masticatori, i facciali, i muscoli della deglutizione e quelli linguali. Altre caratteristiche importanti sono: il deficit di forza durante l’attività prolungata, il rapido recupero della forza con il riposo ed il notevole miglioramento in seguito alla somministrazione di farmaci anticolinesterasici come la neostigmina. È una malattia ubiquitaria, più frequente nel sesso femminile, in cui insorge anche più precocemente (28 anni vs 43 anni). Patogenesi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
La debolezza miastenica e la fatica sono dovute ad una trasmissione neuromuscolare inefficace a livello del versante post‐sinaptico: a causa della notevole riduzione del numero dei recettori e dell’azione competitiva degli anticorpi anti AChR, l’ampiezza del potenziale di placca è insufficiente per generare un potenziale d’azione in alcune fibre nervose. Il blocco cumulativo della trasmissione in numerose placche terminale comporta una riduzione del potere contrattile dell’intero muscolo. La trasmissione neuromuscolare può essere compromessa in diversi modi: • L’anticorpo può bloccare il legame dell’ACh al suo recettore • Le IgG sieriche dei pazienti miastenici sono in grado di indurre un incremento del tasso di degradazione dei recettori: questo può essere il risultato della capacità degli anticorpi di formare legami crociati con i recettori, raggruppati così sulla membrana muscolare, endocitati e degradati • Gli anticorpi possono causare una distruzione complemento‐mediata delle superfici post‐sinaptiche La formazione di tali AAB sarebbe dovuta ad un fenomeno di mimetismo molecolare successivo ad un’infezione virale, prevalentemente a carico del timo. Questi AAB sono presenti nel siero dell’85% dei pazienti affetti da MG: nel restante numero di casi la patologia è dovuta alla formazione di AAB diretti contro epitopi insoliti localizzati sull’AChR o nelle sue vicinanze. Tra questi si ricordano le IgG contro la chinasi muscolo specifica (MuSK), che ha un ruolo di supporto della normale struttura della membrana post‐sinaptica e nella stabilità del recettore. Anatomia patologica • Alterazioni tardive della giunzione neuromuscolare o Notevole riduzione numerica ed appiattimento delle pieghe giunzionali o Allargamento dello spazio sinaptico o Depauperamento recettoriale della membrana post‐sinaptica, dove sono evidenti IgG • Alterazioni del timo o Timoma (10‐15%) o Iperplasia linfofollicolare non neoplastica (70%) Quadro clinico La MG è caratterizzata da un deficit di forza muscolare: l’attività persistente o ripetuta di un gruppo muscolare ne esaurisce la forza contrattile, conducendo ad una paresi progressiva, mentre il riposo ne ripristina, almeno parzialmente, la forza. La vulnerabilità selettiva di alcuni muscoli rappresenta una caratteristica distintiva: le palpebre ed i muscoli oculari, più raramente quelli facciali, mandibolari, della lingua o del collo, sono i primi ad essere colpiti. L’ipostenia dell’elevatore della palpebra o dei muscoli extraoculari è il più delle volte il primo segno: la paralisi oculare e la ptosi (debolezza nell’apertura degli occhi) sono solitamente accompagnare dalla debolezza anche della chiusura degli occhi. La diplopia è la conseguenza di un’ipostenia asimmetrica di molti muscoli in entrambi gli occhi. L’ipostenia combinata dei muscoli extraoculari, dell’elevatore della palpebra e dell’orbicolare, accompagnata da una risposta pupillare alla luce e da un’accomodazione normali, è diagnostica di MG, specie se queste funzioni sono recuperate col riposo. I muscoli dell’espressione facciale, della masticazione, della deglutizione e della parola sono, in seguito, colpiti: l’espressione e la motilità facciale sono alterate, il sorriso naturale distorto, la mandibola cadente, la masticazione difficile con sospensione del pasto, la conversazione faticosa, la voce nasale. Sono colpiti, in seguito, anche i muscoli del collo (con difficoltà a sostenere la testa), del torace (in particolare gli estensori paravertebrali), del cingolo scapolare e delle anche. Nei casi più avanzati tutti i muscoli risultano indeboliti, compresi diaframma, muscoli addominali ed intercostali (con compromissione della respirazione: tachipnea, respiro superficiale e cianosi), gli sfinteri vescicali e rettali. Sono frequenti delle crisi: • Miastenica: favorita da traumi, stress, gravidanza, mestruazioni, pasti abbondanti, infezioni, medicamenti causanti blocco neuromuscolare (streptomicina, neuromicina, curaro, BDZ etc.), presenta una risposta positiva al test all’edrofonio Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Colinergica: dovuta ad iperdosaggio di anticolinesterasici o ad ipersensibilità agli stessi, si manifesta con sintomi muscarinici (anoressia, lacrimazione, sudorazione, diarrea, nausea) e nicotinici (fascicolazioni, disfagia, trisma, crampi muscolari) e peggiora con l’edrofonio È possibile classificare, sulla base del decorso, diverse forme: • Miastenia oculare • Miastenia generalizzata o Lieve a lenta progressione: buona risposta ai farmaci o Moderata a lenta progressione: grave interessamento bulbare e scheletrico, scarsa risposta ai farmaci • Miastenia acuta fulminante: rapida progressione di sintomi gravi con crisi respiratorie e scarsa risposta ai farmaci, elevato tasso di mortalità • Miastenia tardivamente grave: progressione grave ma lenta Diagnosi • Anamnesi o Familiarità negativa o Esordio subacuto‐cronico (raramente acuto) o Fluttuazione del deficit variabile durante la giornata (più spesso più grave di sera) • Esame obiettivo o Esauribilità muscolare o ROT normali o Assenza di disturbi sensitivi • Test farmacologico all’edrofonio (Tensilo) o alla neostigmina: questi inibitori dell’acetilcolinesterasi inducono un incremento della potenza muscolare nel paziente miastenico della durata di 4‐5 minuti • Esami elettrofisiologici: la rapida riduzione dell’ampiezza dei potenziali d’azione muscolari composti evocati dalla stimolazione ripetitiva di un nervo periferico (tipicamente a livello dei muscoli facciali, della mano e da quelli prossimali degli arti), e la normalità di questa risposta dopo somministrazione di efrofonio o di neostigmina, è diagnostica di MG • Indagini di laboratorio o CPK e VES nei limiti o AAB anti‐AChR nell’85% dei casi, nel restante numero di casi possibili (nel 70%) AAB ant‐MuSK o anti‐muscolo striato o altri (FR, anti‐tireoglobulina etc.) • Imaging: Rx torace, TC mediastino, scintigrafia timica: per evidenziare le alterazioni timiche Terapia • Anticolinesterasici: piridostigmina, neostigmina • Immunosoppressori: aziatropina • Cortisonici: prednisone • Plasmaferesi • Ig ev • Timectomia nei pazienti con timoma Par III: Sindrome di Guillain‐Barrè o poliradicolonevrite subacuta benigna Generalità È la causa più comune di paralisi generalizzata acuta o subacuta. Si osserva in tutto il mondo, in tutte le età (praticamente dalla nascita alla morte, comunque con un picco tra i 50 ed i 75 anni) ed in egual modo in entrambi i sessi. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
È una malattia post‐infettiva: infatti, nella maggior parte dei casi è preceduta da un infezione (virale: esantemi virale, CMV, EBV, HIV; batterica: Campylobacter jejuni, Mycoplasma pneumoniae, malattia di Lyme. Comunque nel 70% dei casi è preceduta da un’infezione respiratoria o gastrointestinale). In altri casi può essere preceduta da: vaccinazione, terapia trombolitica, linfomi. È, quindi, su base infiammatoria, autoimmune, demielinizzante, tipicamente associata alla rottura della BEE (vedi dopo): la lesione essenziale è un’infiltrazione infiammatoria mononucleare perivascolare delle radici e dei nervi. Patogenesi La maggior parte delle evidenze è a favore di una reazione cellulo‐mediata diretta contro il nervo periferico, in particolare contro una proteina basica, denominata P2, che si ritrova solo nella mielina del nervo periferico. In realtà, non esiste alcuna reazione antigene‐anticorpo dominante: qualsiasi elemento dell’assone o della mielina può essere coinvolto nello scatenamento della reazione immune. La patogenesi segue diverse e caratteristiche tappe: • Primo stadio: i linfociti si attaccano alla parete dei vasi endoneurali e migrano attraverso la parete vasale, ingrandendosi e trasformandosi. Non sono ancora presenti le lesioni nervose • Secondo stadio: il numero dei linfociti migrati aumenta. Il primo effetto è la frammentazione della mielina con risparmio dell’assone (demielinizzazione segmentaria) • Terzo stadio: la lesione è ancora più intensa e sono presenti, oltre ai linfociti, anche i leucociti PMN. In aggiunta alla degenerazione della guaina mielinica, anche gli assoni vengono interrotti: di conseguenza, il muscolo va incontro ad atrofia da denervazione ed il corpo cellulare presenta una cromatolisi centrale. o In caso di lesione assonica distale: il corpo cellulare può sopravvivere, con possibile rigenerazione e guarigione clinica o In caso di lesione assonica prossimale, per una lesione radicolare o del tronco nervoso prossimale particolarmente intensa: il corpo cellulare può andare incontro a degenerazione e dissoluzione. In questo caso, non è possibile la rigenerazione, ma solo la reinnervazione collaterale del muscolo da parte delle fibre motorie rimaste in vita Un ruolo, infine, sembrano avere anche gli anticorpi anti‐mielina, come quelli diretti contro i gangliosidi. Clinica Il caso tipico di GBS si identifica facilmente, ed è caratterizzato, oltre che da esordio precoce, da: • Perdita di forza (ipostenia) con atrofia muscolare precoce ed areflessia: in genere, inizia agli arti inferiori, per poi estendersi a quelli superiori, alla muscolatura respiratoria e bulbare (paralisi ascendente di Landry). Questi sintomi sono accompagnati da dolore ed algie fastidiose ai muscoli colpiti e, talvolta, da bruciore alle dita di mani e piedi • Deficit sensitivo: parestesie ed ipoestesie sono in genere precoci, con coinvolgimento, in ordine di frequenza, di propriocezione, sensibilità discriminativa e profonda (pressoria e di vibrazione) e superficiale (dolore e temperatura) • Disturbi vegetativi: tachicardia o bradicardia sinusale, ipertensione ed ipotensione fluttuanti, arrossamento del viso, deficit della sudorazione o diaforesi profusa • Altro: ritenzione urinaria, complicanze secondarie all’immobilizzazione ed al deficit respiratorio Il decorso vede: • Nel 70‐80% dei casi: remissione completa • Nel 10% deficit residui lievi, soprattutto motori • Nel 3‐5%: morte per: arresto cardiaco, distress respiratorio, pneumo‐ od‐ emotorace, embolia polmonare, complicanze batteriche dell’insufficienza respiratoria Diagnosi • Analisi del liquor: dissociazione albumino‐citologica (aumento della proteinorrachia,ma non delle cellule) • Anomalie della conduzione nervosa all’EMG o all’ENG: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Riduzione d’ampiezza del potenziale d’azione muscolare, rallentamento della velocità di conduzione o blocco di conduzione o Segni di denervazione delle fibre muscolari RM: iperintensità a livello delle radici della cauda equina Antomia patologica o Infiltrati linfocitari perivascolari, specie perivenosi, cui si associa, in seguito, demielinizzazione segmentaria, con possibile degnerazione walleriana, a livello dei nervi periferici, dei gangli spinale e dei nervi cranici o Rigonfiamento delle radici nervose all’uscita dalla dura Esami di laboratorio di routine o
•
•
•
Terapia • Ig ev • Plasmaferesi • Terapia dell’eventuale insufficienza respiratoria e cardiovascolare Varianti • Sindrome di Miller‐Fischer: è caratterizzata dall’associazione di oftalmoplegia completa, atassia ed areflessia tendinea, con assenza di rilevanti disturbi di forza agli arti. È costantemente associata alla presenza di Anticorpi‐anti ganglioside GQ1B nel siero. La terapia è come per la GBS e la prognosi favorevole • Forma assonale acuta Altre neuropatie • Poliradicolonevrite cronica: è una polineuropatia sensitivo‐motoria, simmetrica, a decorso cronico‐
progressivo o recidivante‐progressivo, a patogenesi disimmune. È caratterizzata da: iporeflessia, ipostenia (soprattutto a i muscoli prossimali degli arti), lieve ipotrofia muscolare, talora atassia sensitiva. La prognosi è incerta con la terapia per la GBS, migliore con Anticorpi monoclonali‐anti linfociti (rituximab) • Neurite motoria multifocale: è una neuropatia motoria caratterizzata da elevata tendenza alla cronicizzazione, caratterizzata da: o Esordio asimmetrico distale, di solito agli arti superiori o ROT normo‐ od iper‐ecctabili o Presenza di fascicolazioni o Presenza, nell’80% dei casi, di Anticorpi anti‐GM1 o Prognosi favorevole con la terapia della GBS Par IV: Polimiosite (PM) e dermatomiosite (DM) Generalità Sono malattie infiammatorie, a patogenesi autoimmune, limitate al muscolo scheletrico (PM) o con interessamento anche della cute (DM). La PM colpisce prevalentemente intorno ai 30‐40 anni, la DM in tutte le età: entrambe colpiscono maggiormente il sesso femminile. Sono entrambe malattie autoimmuni: • PM: risposta cellulo‐mediata: alla biopsia infiltrati infiammatori endomisiali contenenti linfociti T CD8+ • DM: risposta anticorpo mediata con attivazione del complemento: alla biopsia muscolare infiltrati infiammatori perivascolari costituiti prevalentemente da linfociti B nel derma e nel perimisio Clinica La PM è un’affezione idiopatica caratterizzata da debolezza simmetrica subacuta o cronica dei muscoli prossimali degli arti e del tronco senza dermatite: l’esordio è di solito insidioso ed il decorso progressivo. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
L’esordio classico è caratterizzato da debolezza senza dolore dei muscoli prossimale degli arti, specialmente dell’anca e delle coscia, in misura minore del cingolo scapolare e del collo: attività come alzarsi da una sedia, scendere le scale, pettinarsi, diventano sempre più difficili. Soltanto una piccola percentuale di pazienti avverte dolori. Nei casi più gravi possono essere colpite la muscolatura faringea (disfagia) e quella laringea (disfonia, dispnea). Si ha, infine, atrofia dei muscoli interessati e riduzione dei riflessi. In un elevato numero di casi sono state riscontrate anomalie cardiache, che portano allo sviluppo di aritmie e di MCI, dovute ad una necrosi delle fibre miocardiche. La DM è caratterizzata, oltre che dalle alterazioni muscolari, da alterazioni cutanee: eritema localizzato o diffuso (eritema eliotropo del volto), eruzione maculo‐papulare (papule di Gottron), dermatite eczematosa desquamativa, dermatite esfoliativa. Altri segni importanti sono: calcificazioni periarticolari e sottocutanee, segni di connetticopatia, fenomeni di Raynaud. Diagnosi • Anamnesi: familiarità negativa, esordio subacuto • Clinica: deficit esclusivamente di forza muscolare • Indagini di laboratorio o Aumento di CPK e di altri enzimi muscolari (aldolasi, LDH, GOT, GTP) o Aumento della VES e linfocitosi o AAB Aspecifici: FR, ANA, anti‐RNA, anti‐Ro/SSA, anti‐La/SSB Specifici: anti‐Jo1, anti‐tRNA, anti‐SRP, anti‐Mi2 o Mioglobinuria: in caso di miosite acuta necrotizzante • EMG o Potenziali d’azione piccoli e di breve durata o Potenziali di fibrillazione: sono entrambi indice di denervazione • ECG: alterato nei casi con concomitanti alterazioni cardiache • Biopsia muscolare Terapia • Corticosteroidi: prednisone per os • Immunosoppressori: azatioprina Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Lez I: PROF.SSA COPPOLA Elementi clinici essenziali sulle malattie infettive del SN e delle meningi Par I: Generalità Tutte le infezioni si verificano quando il microrganismo capace di generare la malattia incontra un ospite adeguato ed è in grado di eludere con successo i meccanismi di difesa dell’ospite, rappresentati tipicamente da barriere anatomiche e sistema immunitario: in particolare, nel SNC, ruolo preponderante è svolta dalla barriera ematoencefalica (BEE). Generalmente, le infezioni neurologiche possono svilupparsi per: • Infezione diretta neuronale o gliale • Formazione di massa lesionale • Infiammazione con conseguente edema, blocco del deflusso del liquor, danno neuronale e vasculopatia • Secrezione di neurotossine Un approccio diagnostico corretto è volto a valutare: • Sintomatologia: segni tipici di infezione del SN sono febbre, cefalea o algie della colonna, alterazioni neurologiche focali o generalizzate • Esordio e decorso: solitamente esordio subacuto con decorso rapidamente ingravescente • Localizzazione neuroanatomica • Micorganismo responsabile: è sospettato in base a viaggi eventualmente svolti, occupazione, attività ricreative, contatto con animali • Fattori di rischio: o Traumi precedenti o Procedure neurochirurgiche (PNC): è molto importante considerare il crescente numero di casi attribuibile a procedure PNC o Infezioni recenti: soprattutto orecchie, seni paranasali, focolai osteomielitici del cranio, denti) o Assetto immunitario o Uso di antibiotici, di steroridi o di chemioterapici In definitiva, le infezioni piogeniche possono raggiungere le strutture endocraniche attraverso due vie: • Diffusione ematogena (emboli batterici o trombi infetti): in caso di meningiti è importante considerare l’elevata carica necessaria al loro sviluppo; in caso di ascessi cerebrali è importante considerare la naturale resistenza del tessuto cerebrale alle infezione (sarebbe forse necessario un infarto del tessuto cerebrale come premessa allo sviluppo dell’ascesso) • Estensione dalle strutture pericraniche (orecchie, seni paranasali, focolai osteomielitici del cranio, denti) o Formazione di trombi infetti nelle vene dipoloiche, trasporto nei seni della dura madre e da qui nel tessuto cerebrale per via retrograda lungo le vene meningee o Formazione di un focolaio osteomielitico con erosione del tavolato interno dell’osso ed invasione della dura madre, dello spazio sotto durale, della pia aracnoide e, talvolta, della sostanza cerebrale Micorganismi patogeni più comuni sono: • In caso di infezione ematogena in corso di batteriemia: microrganismo unico: o Nel lattante: E.Coli, streptoccocco di gruppo B o Nel bambino e nel ragazzo: H. Influenzae o Nell’adulto: H. Influenzae, S. Pneumoniae, N. Meningitidis, L. Monocytogenes, stafilococchi • In cado di infezioni da materiale embolico di origine polmonare, da fistole arterovenose polmonari o da malattie cardiache congenite, o per estensione da strutture contigue: infezioni miste • In seguito a PNC: stafilococchi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Par II: Meningiti Generalità L’effetto immediato dei microrganismi a livello dello spazio subaracnoideo consiste nel causare una reazione infiammatoria nella pia e nell’aracnoide, come pure nel liquor: dato che lo spazio subaracnoideo circonda cervello, midollo spinale e nervi ottici, un agente infettivo penetrato nella subaracnoide infetta tutti questi spazi (meningite sempre cerebro‐spinale). Meningiti batteriche acute Soggetti più a rischio sono bambini ed anziani; le meningiti possono svilupparsi come conseguenza di: • Infezioni da zone contigue (vedi dietro) • Alterazioni delle barriere anatomiche: traumi od interventi neurochirurgici • Rottura di ascessi cerebrali nel sistema ventricolare o nello spazio subaracnoideo Comunque, più frequentemente, le meningiti si sviluppano a seguito di colonizzazione del nasofaringe, che determina batteriemia ed alterazione della BEE. Tra i microrganismi più frequenti (potenzialmente qualsiasi microrganismo può causare meningite) vi sono: • S. Pneumoniae e N. Meningitidis (insieme ad H. Influenzae rendono conto del 75% dei casi): negli adulti con difese immunitarie intatte (caserme) sono i patogeni più frequenti per la capacità di colonizzare il nasofaringe. La meningite meningococcica è particolarmente frequente nei soggetti molto giovani, quella pneumococcia in adolescenti ed anziani • H. Influenzae B: prima dell’avvento del vaccino era molto frequente nei neonati e nei bambini, ora è più frequente negli adulti, oltre che ancora frequente nei paesi meno sviluppati. Insieme ai due microrganismi precedenti è un normale commensale delle vie nasofaringee, che in particolari condizioni, a seguito di batteriemia ed alterazione della BEE (i microrganismi diffonderebbero al liquor anche tramite i plessi corioidei), diffonde alle meningi, dove, sempre a causa di condizioni predisponenti, causa infiammazione • L. Monocytogenes: soprattutto in neonati, anziani, immunodepressi ed alcolisti • S. Aureus ed Epidermidis: sono tipici agenti di meningite in pazienti con shunt ventricolare, PNC, traumi o ascessi cranici • Bacilli Gram – (E. Coli, Klebsiella, Proteus, Pseudomonas): possono causare meningiti in pazienti ospedalizzati, anche a seguito di punture lombari, anestesie spinali o shunt ventricolari, e neutropenici. Quindi insieme alle meningiti stafilococciche, quelle da bacilli Gram‐ riflettono, nel loro aumento di prevalenza, il forte aumento di prevalenza delle forme di meningite nosocomiali. La sintomatologia è caratterizzata da: • Segni e sintomi infettivi aspecifici: o Tipici: febbre, artromialgie, astenia o Atipici: Sovrainfezione erpetica labiale Petecchie cutanee generalizzate: la presenza di eruzione petecchiali, purpuriche od ecchimotiche, indica solitamente una meningite meningococcica CID Sindrome di Waterhouse‐Fridericksen: grave sindrome cardiorespiratoria e renale da shock settico • Segni di irritazione meningea (pio‐aracnoidite pura) o Rigidità in estensione di nuca e tronco (opistotono): questi segni, come i successivi, dipendono dall’attuazione di riflessi propiocettivi che accorciano ed immobilizzano la spina dorsale, riducendo lo stiramento delle strutture meningee infiammate o Posizione a cane di fucile: con decubito laterale e gambe e cosce flesse o Segno di Kernig: incapacità di estendere completamente le gambe: la manovra viene considerata positiva se l’estensione della gamba, a coscia flessa sul bacino, determina dolore e resistenza all’estensione della gamba. E’ positiva se il dolore compare prima di raggiungere un angolo di Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
145°fra coscia e gamba. Inoltre deve essere positiva bilateralmente altrimenti è indice di una radicolopatia L5‐S1 o Segno di Brudzinski: flessione di gambe e cosce alla flessione della testa o Segno di Binda: sollevamento della spalla controlaterale alla rotazione passiva della testa o Segno di Flatau: midriasi, come reazione simpatica al dolore, alla flessione del capo o Segno di Lasegue o Manovra mento‐torace o Iperestesia cutanea • Segni di ipertensione endocranica o Cefalea: oppressiva, pulsante, con fase di esacerbazione parossistica o Vomito cerebrale: a getto, improvviso, non accompagnato da nausea o dolori addominali ed indipendente dall’assunzione di alimenti o Tensione alla fontanella bregmatica nei lattanti o Papilla da stasi: solo nei casi di ipertensione marcata e che dura da giorni o Bradicardia • Segni neurologici o Encefalopatia subpiale con compromissione dello stato di coscienza: torpore, crisi di agitazione psicomotoria ed epilettiche, coma. Il tessuto sottostante alla pia non viene attaccato dai batteri: pertanto, le alterazioni sono probabilmente di natura tossica o da citochine. o Interessamento delle radici dei nervi cranici: paralisi oculare, paresi faciale, ipoacusia/sordità, fotofobia o Trombosi delle vene meningee: possono causare i suddetti sintomi generali o sintomi focali, quali crisi epilettiche focali, emiparesi, afasia lieve o RAS ridotti od assenti o ROT spesso vivaci ed accentuati • Segni neurovegetativi o Turbe del respiro e della frequenza cardiaca o Dermografismo rosso con persistenza di una striatura rossa quando si sfiora la cute (segno di Trousseau) • Complicanze o Fibrosi meningea attorno a nervi ottici o a midollo e radici spinali: cecità ed atrofia ottica, paraparesi spastica con perdita della sensibilità ai livelli inferiori del midollo o Meningoencefalite cronica con idrocefalo: demenza, stato confusionale o coma, paralisi o Idrocefalo persistente, soprattutto nel bambino: cecità arresto delle capacità mentali, tetraplegia spastica L’esame del liquor è caratterizzato da: • Pressione elevata • Proteinorrachia aumentata: 100‐500 mg/dl (vn 15‐45) • Glicorrachia ridotta <40% del glucosio sierico: importante è la DD con la meningite carcinomatosa • Pleiocitosi marcata: 100‐10000/mm3 (vn fino a 5) con predominanza di PMN • Aumento LDH • Colorazione di Gram positiva nel 60% dei casi • Colture positive nel 75% dei casi (colture su sangue positive nel 50% dei casi) Studi di neuroimaging possono essere negativi od evidenziare complicanze quali edema cerebrale, idrocefalo comunicante od ostruttivo, infarto cerebrale o trombosi dei seni venosi. La terapia, per tutti i tipi di meningite batterica, include la somministrazione di antibiotici: il trattamento è urgente, al fine di evitare complicanze neurologiche e sistemiche. Quindi, la terapia deve essere iniziata il prima possibile, anche se in maniera empirica: • Giovani adulti od adulti di mezza età: cefalosporina di terza generazione e vancomicina Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
Pazienti con più di 50 anni o a rischio di infezione da L. Monocytogenes (immunodepressi, alcolisti, soggetti affetti da IRC): aggiunta di penicillina od ampicillina In caso di meningite nosocomiale: ceftazidime per eradicare Pseudomonas Per le meningiti acquisite in comunità: aggiunta di desametasone Meningite asettica Rappresenta un complesso sintomatologico indotto da diversi agenti infettivi, la maggior parte dei quali, ma non solo, virali, sospettabile quando: • Un paziente sviluppa nel corso di ore o giorni segni e sintomi di meningismo, ma senza evidenza di patogeni batteri o fungini, né di infezioni parameningee • Non sono presenti alterazioni cerebrali parenchimali, alterazioni dello stato di coscienza, crisi epilettiche o segni neurologici focali • Il decorso è benigno ed autolimitante Le cause sono: • Infettive o Virali Enterovirus (80%): echovirus, Coxsackievirus, enterovirus71. Sono a trasmissione orofecale, quindi più frequenti in ambienti sottosviluppati; si accompagnano a manifestazioni esantematiche Virus della parotite HSV2 e, meno frequentemente, HSV1 Virus della coriomeningite linfocitaria (CML) Adenovirus EBV, CMV, VZV, arbovirus (solitamente meningoencefalite) HIV o Spirochete: sifilide, malattia di Lyme, leptospirosi o Altri: micoplasmi, clamidie, rickettsie, brucelle, bartonelle, • Parainfettive: meningiti batteriche parzialmente trattate, infezioni perimeningee (focolai di infezioni batteriche situati in zone adiacenti alle meningi), endocarditi, batteriemie, sindromi post‐vacciniche • Non infettive o Farmaci: FANS, trimetoprim, sulfametossazolo, azatioprina, gammaglobuline, OKT3 (ab monoclonale diretto contro TCR/CD3 usato nel rigetto acuto), chemioterapia intratecale: generalmente in seguito ad instillazione durante puntura lombare, anestesia spinale o PNC o Tumori: craniofaringiomi, cisti epidermoidi: la loro rottura causa un perdita di liquido nello spazio su aracnoideo. Nei bambini frequenti sono le meningiti secondarie a leucemie o linfomi (meningite carcinomatosa o linfomatosa: disseminazione di cellule tumorali lungo le meningi ed i ventricoli. Le manifestazioni principali consistono in cefalea, poliradiculopatie sensitivo‐motorie, paralisi multiple dei nervi cranici e stato confusionale. La diagnosi si basa sul riscontro di cellule neoplastiche e markers tumorali nel liquor) o Granulomatose e vasculitiche: sarcoidosi, granulomatosi di Wegener, Malattia di Behcet, vasculiti o Malattia di Vogt‐Kanyanagi‐Harada: caratterizzata da combinazioni variabili di iridociclite, depigmentazione di una ciocca di capelli e della cute attorno agli occhi, perdita delle ciglia, disacusia, sordità o Emicrania, crisi epilettiche Da un punto di vista clinico, la meningite asettica è caratterizzata da febbre alta, cefalea intensa e segni di irritazione meningea. Altri segni neurologici sono poco frequenti, più tipici sono gli esantemi infantili, associati al virus responsabile. Il liquor, caratteristico, è caratterizzato da: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
•
Pleiocitosi 10‐1000/mm3, in prevalenza linfociti e monociti Lieve e variabile aumento delle proteine: 50‐80 mg/dl Glicorracchia pressocchè normale: se ridotta, con il liquor peraltro asettico, è indice di tubercolosi, meningite micotica, carcinomatosa o linfomatosa Colorazioni e colture negative PCR per l’identificazione del materiale genomico virale VDRL (Veneral Disease Research Laboratories per la sifilide) Ricerca Ag streptococcici e fungini Meningite cronica E’ sospettata in caso di: • Persistenza di cefalea, rigidià nucale, febbre e fotofobia, per più di 4 settimane • Dopo la terapia empirica, peggioramento del quadro clinico con disturbi dello stato di coscienza, deficit dei nervi cranici od altri disturbi neurologici • Decorso progressivo (piuttosto che autolimitante o recidivante) Le più frequenti cause di meningite cronica sono: • In pazienti sani: tubercolosi, criptococcosi, sifilide • In pazienti che hanno frequentato zone endemiche: malattia di Lyme, istoplasmosi, coccidiomicosi, cisticercosi • Non infettive: farmaci, diffusione meningea di un carcinoma o di un linfoma (meningite carcinomatosa o linfomatosa), emorragia subaracnoidea, neurosarcoidosi, vasculite sistemica o primaria del SNC, sindromi uveo‐meningitiche Importante per la diagnosi è l’anamnesi: • Calo ponderale e lunga storia di BPCO in paziente fumatore: meningite carcinomatosa • Lavoro in macelleria: brucellosi • Viaggi o lavoro in zone endemiche (vedi sopra) Ulteriore ausilio diagnostico fondamentale è l’esame obiettivo: • Rash cutanei palmari: sifilide secondaria • Uveite: sarcoidosi, malattia di Bechet, malattia di VKH Leptomeningiti granulomatose: meningite tubercolare L’incidenza della meningite tubercolare ha conosciuto un periodo di aumento di incidenza, dovuto alla diffusione dell’HIV. La meningite tubercolare è causata sia dal micobatterio tipico M. Tubercolosis, che dai micobatteri atipici M. Bovis e M. Fortuitum, e può insorgere sia come evento terminale nei casi di tubercolosi miliare sia come singolo focolaio di tubercolosi generalizzata. La patogenesi sarebbe correlata ad una disseminazione nelle meningi e nelle regioni subpiali del cervello del micobatterio, con formazione di tubercoli: successivamente, la rottura di uno o più di questi tubercoli causerebbe la liberazione di batteri nello spazio subaracnoideo. Diversamente dalle meningiti piogene, inoltre, il processo patologico non è confinato allo spazio subaracnoideo, ma frequentemente penetra nella pia e nell’ependima ed invade il tessuto cerebrale sottostante: la malattia è quindi una meningoencefalite. Comunque, a livello anatomopatologico si ha un essudato infiammatorio cronico granulomatoso soprattutto alla base del cervello (cisterne della base, fessure silviane, troncoencefalo, cisterna magna), ed in misura minore sulle convessità: l’essudato circonda anche il midollo spinale. In aggiunta, i nervi cranici vengono spesso avvolti dall’essudato infiammatorio, le arterie vanno incontro ad un processo infiammatorio con occlusione ed infarto cerebrale, il blocco delle cisterne basali provoca un idrocefalo iperteso da ostruzione meningea. Pertanto, la sintomatologia è strettamente correlata al quadro anatomo‐patologico: • Esordio con febbricola, malessere, cefalea, letargia, confusione mentale, rigidità nucale, segni di Kernig e Brudzinski Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
Decorso cronico progressivo con peggioramento dello stato mentale fino al coma ed al decesso Segni di meningite basilare cronica Segni di interessamento dei nervi cranici Papilledema ed altri sintomi da ipertensione endocranica Sintomi da coinvolgimento del midollo spinale o delle radici Deficit neurologico focale dovuto ad infarti emorragici Caratteristico è il liquor: • Limpido, talvolta giallino, raramente smerigliato (reticolo di Mya: solo in fase molto iniziale) • Pressione nettamente aumentata • Pleiocitosi linfomonocitaria: 50‐500/mm3 • Aumento della proteinorrachia >100 mg/dl • Glicorrachia diminuita <30% del glucosio ematico (ma solitamente più elevata rispetto alle forme di meningite piogenica) • Cloro liquorale ridotto per sindrome da inappropriata secrezione di ADH o per sindrome addisoniana da tubercolosi surrenalica • Coltura positiva dopo 3‐4 settimane: esiste una tecnica di coltura accelerata che dà risultati in 1 settimana • PCR Par III: Ascessi Ascesso cerebrale L’ascesso cerebrale si sviluppa: • Dall’esterno (10%): fratture composte del cranio, operazioni intracraniche, ferite d’arma da fuoco • Dall’interno (90%): l’ascesso è secondario ad un processo di suppurazione o Per contiguità: Siti infetti nel distretto intracranico: osteomieliti cranio‐facciali: l’osso diventa la sede di un processo osteomielitico con conseguente infiammazione e penetrazione di materiale infetto nella dura madre e nella leptomeninge e formazione di un tragitto suppurativo all’interno del tessuto cerebrale Orecchio: ascesso cerebellare o del lobo temporale Seni nasali e paranasali: ascesso del lobo frontale o temporale Denti, in particolare i molari o Per via ematogena Diffusione lungo le vene da sedi contigue: è favorita da microinfarti cerebrali Diffusione metastatica da sedi lontane: gli ascessi metastatici si localizzano solitamente nel territorio distale delle arterie cerebrali medie e sono frequentemente multipli, al contrario di quelli oto‐ e rino‐genici • Endocarditi batteriche • Malattie cardiache congenite (tetralogia di Fallot) e fistole artero‐venose • Fonti polmonari: infezioni ed ascessi polmonari, bronchiectasie • Fonti pleuriche • Fonti più rare: infezioni degli organi pelvici, delle tonsille, cutanee o da osteomieliti di osso non craniche Tra gli agenti eziologici più frequenti si ricordano: • Streptococchi anaerobi o microaerofili, spesso associati ad altri anaerobi quali Bacteroides e Propionibacterium o ad enterobatteri quali E.Coli e Proteus: gli streptococchi anaerobi giungono solitamente dai polmoni o dai seni nasali o paranasali, i microrganismi enterici sono quasi sempre secondari ad otiti • Pneumococco: con origine dai seni nasali o paranasali • Stafilococchi: sono solitamente secondari a traumi accidentali o chirurgici Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
• Nocardia: soprattutto in pazienti immunodepressi, successivamente ad infezioni polmonari • Miceti: Candida, Aspergillus, Mucor, tipici di pazienti immunocompromessi La reazione precoce all’invasione batterica del cervello è rappresentata da essudato infiammatorio localizzato, trombosi settica dei vasi ed aggregati di leucociti in disfacimento: la lesione tende ad espandersi (cerebrite). In seguito la lesione centrale diviene purulenta e quella periferica fibrosa con tessuto prima di granulazione e poi collagenasico. Il quadro clinico risulta caratterizzato da: • Cefalea progressivamente ingravescente • Disturbi generalizzati: sonnolenza, confusione, crisi epilettiche generalizzate, alterazione della coscienza (per idrocefalo o per compressione del tronco encefalo) • Disturbi focali: crisi epilettiche focali, disturbi motorio o sensitivi, alterazioni del linguaggio, quadrantopsia od emianopsia • Disturbi cerebellari: cefalea retro auricolare o sub occipitale, nistagmo, atassia degli arti e della marcia • Segni di ipertensione endocranica • Altro: malessere generalizzato, nausea, vomito Il liquor è caratterizzato da: • VES aumentata • Pressione moderatamente aumentata • Conta cellulare di 20‐300/mm3 con prevalenza di neutrofili • Piccolo aumento della proteinorrachia con glicorrachia normale Ausili strumentali sono: • TC: la capsula dell’ascesso assume il contrasto, mentre il centro dell’ascesso e la sostanza bianca edematosa circostante appaiono ipodensi. E’ possibile il riscontro di piccolo ascessi multipli, spesso indicativi di diffusione ematogena • RM o T1: la capsula assume il contrasto e l’interno è ipodensi o T2: la capsula risulta ipodensa e l’edema circostante assume il contrasto La terapia è: • Antibiotica: vancomicina, metronidazolo, cefalosporine di III generazione (cefotaxime, ceftriazone, ceftazidime) • Chirurgica: in casi selezionati • Dell’edema cerebrale con desametasone e mannitolo Ascesso cranico epidurale E’ un’infezione che coinvolge lo spazio tra dura e la teca cranica, dovuta ad un’estensione di un’osteomielite contigua, solitamente secondaria ad infezioni auricolari o de seni o a PNC. Può essere dovuto, specie nei casi spinali, a diffusione di infezioni distanti. I sintomi sono per lo più focali. Ascesso cranico subdurale: empiema E’ una raccolta di pus tra dura ed aracnoide, spesso secondario ad infezioni dell’orecchio o dei seni paranasali: può risultare in tromboflebite. Si manifesta con: cefalea, febbre, rigidità nucale, crisi epilettiche, segni focali, ad esordio acuto. Par IV: Encefaliti Generalità sui virus neurotropici Alcuni virus sono neurotropici, evidenziando una particolare affinità per alcuni tipi di neuroni: virus della poliomielite e motoneuroni, VZV e neuroni sensitivi periferici, virus della rabbia e neuroni troncoencefalici. Molti dei rimanenti virus neurotropici hanno un tipo di affinità meno selettivo, coinvolgendo tutti gli elementi del sistema nervoso, ma in particolari regioni, sono cioè neuroistopatici: l’HSV, ad esempio, è in grado di devastare le parti mediali dei lobi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
temporali, distruggendo neuroni, cellule gliali, fibre nervose e vasi sanguigni; l’HIV può indurre focolai multipli di necrosi in tutto il cervello. In moltissimi casi gli effetti sistemici sono limitati: sono gli effetti neurologici a determinare il quadro clinico. Le più comuni vie di penetrazione dei virus nel SNC sono: • Via ematogena: il virus entra nell’organismo, si moltiplica ed invade, tramite i plessi corioidei ed i capillari cerebrali, il SNC. I virus attraversano la BEE all’interno di linfociti migranti e direttamente in aree delle zone gliali e vascolari permeabili nei loro confronti. Questo può avvenire a seguito di ingresso del virus nell’organismo tramite: o Via respiratoria: virus della parotite, del morbillo e della varicella o Via oro intestinale: poliovirus e gli altri enterovirus o Via mucosale: HSV1 e 2 o Via cutanea: arbovirus (tramite la puntura di insetti), virus della rabbia (tramite il morso degli animali) • Via nervosa o Nervi periferici: il movimento centripeto del virus viene promosso dal sistema di trasporto assoplasmatico retrogrado. L’HSV, il VZV ed il virus della rabbia utilizzano questa via. o Neuroni olfattori della mucosa nasale: HSV: i prolungamenti di queste cellule attraversano i fori della lamina cribrosa dell’etmoide e fanno sinapsi nel bulbo olfattorio, all’interno del SNC o Nervo trigemino e ganglio di Gasser Comunque, una volta penetrato nel SNC, il virus esplica la sua azione, e il suo eventuale neurotropismo, tramite l’interazione con siti recettoriali specifici: così alcuni virus, come gli enterovirus, legheranno le cellule meningee, esitando in meningiti asettiche; altri legheranno tipi neuronali encefalici o midollari, esitando in disturbi encefalitici e poliomielitici. Nella poliomielite, quindi, vi sarà un neurotropismo per i motoneuroni dei nervi cranici e spinali, nella rabbia per i neuroni dei gangli del trigemino, del cervelletto e dei lobi inferiori. Nell’encefalite acuta i neuroni suscettibili vengono aggrediti direttamente dal virus e le cellule vanno incontro a lisi con relativa reazione gliale ed infiammatoria e neuronofagia, ossia la fagocitosi dei neuroni colpiti e dei loro prodotti degenerativi. Nella leucoencefalite multifocale progressiva (LMP) vi è una lisi progressiva degli oligodendrociti con focolai di demielinizzazione; in altre infezioni virali vi sono aree di necrosi tissutale in aree specifiche, come nella regione infero‐mediale del lobo temporale in caso di encefalite da HSV. Le cellule del cervello fetale in fase di differenziazione sono particolarmente vulnerabili: l’incorporazione virale può dar luogo a malformazioni ed idrocefalo (virus della parotite: disfunzione ependimale e stenosi dell’acquedotto). In altre condizioni, il virus può persistere a lungo nel SNC prima di dar luogo a reazioni infiammatorie, come nel caso della LMP e della panencefalite sclerosante subacuta. Sperimentalmente, infine, l’incorporazione del genoma virale in cellule neuronali può dar luogo a neoplasie cerebrali, con un meccanismo simile a quello successivo all’incoraporazione dell’EBV nei linfociti B e conseguente sviluppo di linfoma cerebrale a cellule B. Tra le più importanti sindromi dovute ad ingresso di virus nel SNC si ricordano: • Meningite asettica acuta (vedi dietro) • Meningite cronica (vedi dietro) • Encefalite o meningoencefalite acuta, focale o generalizzata • Ganglionite da herpes zoster • Invasione cronica del SN da retrovirus: neuroAIDS, paraparesi spastica tropicale • Poliomielite anteriore acuta • Infezioni virali croniche (o infezioni lente) Encefalite virale acuta I virus più comunemente responsabili sono: • HSV: è la causa più frequente • Virus della rabbia, VZV, CMV, CMLV Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
Arbovirus: in pazienti anziani ed immunocompromessi Enterovirus: soprattutto poliovirus Paramixovirus: virus della parotite e del morbillo Enterovirus71: ha un neurotropismo simile a quello dei poli virus, è diventato una causa imporatante di encefaliti e mieliti epidemiche Echovirus e Coxsackievirus‐B: danno più frequentemente encefaliti, ma talvolta anche encefaliti o meningoencefaliti Il quadro clinico tipico di un’encefalite virale acuta, è caratterizzato da: febbre, cefalea, convulsioni, delirium, confusione mentale, stupor o coma; segni focali quali afasia, emiparesi, segno di Babinski; segni cerebellari quali movimenti involontari, atassia, nistagmo. Tra i quadri tipici più frequenti si ricordano: • Encefalite da HSV: è la forma più comune e più grave di encefalite acuta, caratterizzata da elevata mortalità e gravi sequele neurologiche permanenti. E’ causata quasi sempre dall’HSV1, soprattutto in individui con più di 40 anni, ma l’HSV2 ha una certa prevalenza nei neonati, in rapporto ad infezioni erpetiche genitali della mamma, e causa più frequentemente meningite. L’encefalite da HSV si sviluppa in seguito ad un’infezione primaria (stomatite HSV di tipo 1 o infezione genitale HSV di tipo 2) che si diffonde lungo il tratto olfattorio o in seguito alla riattivazione di un’infezione nel ganglio trigeminale e ciò spiega la sua predilezione per le cortecce orbito‐frontale e temporale. o Quadro clinico Eventuali segni di infezione se in fase attiva Sintomi generali da encefalite: febbre, cefalea, crisi epilettiche, stato confusionale, stuporoso o comatoso Segni di interessamento del lobo temporale: allucinazioni olfattorie o gustative, anosmia, crisi epilettiche temporali, afasia Segni di interessamento del lobo frontale: alterazioni della personalità, comportamento bizzarro o psicotico o delirante, emiparesi, disturbi della memoria Possibili edema ed erniazione di uno od entrambi i lobi temporali attraverso il tentorio, con conseguente coma profondo ed arresto respiratorio Eventuali sintomi concomitanti di meningismo Decorso rapidamente ingravescente fino all’exitus in un numero elevato di casi Sequele: disturbi irreversibili del comportamento e della memoria o Esame del liquor Liquor limpido, ma talvolta xantocromico, cioè ricco di eritrociti, a sottolineare la natura emorragica delle lesioni. Spesso, comunque, gli eritrociti sono assenti Pressione aumentata Pleiocitosi di 50‐100/mm3: generalmente linfociti e PMN Lieve aumento della proteinorrachia, con glicorrachia non patologica Evidenza del virus tramite PCR o Quadro anatomopatologico Intensa necrosi emorragica delle porzioni infero‐mediali dei lobi temporali e di quelle medio‐orbitarie dei lobi frontale: le lesioni sono generalmente bilaterali, anche se non simmetriche Inclusioni eosinofile intranucleari nei neuroni e nelle cellule gliali o Altri strumenti diagnostici EEG: rileva grafo‐elementi epilettiformi lateralizzati Studio con anticorpi fluorescenti e la coltura virale di materiale bioptico cerebrale MRI: può evidenziare alterazioni del segnale nelle regioni coinvolte TC: ipodensità delle zone interessate o Terapia: aciclovir ev ad alte dosi (effetti collaterali: insufficienza renale) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Herpes zoster: è dovuto ad una riattivazione del VZV latente nei gangli delle radici dorsali, soprattutto nelle cellule gangliari del trigemino e dei gangli toracici, tipicamente in soggetti affetti in passato da infezione primitiva da varicella ed in soggetti anziani. In seguito a riattivazione, imputabile ad un calo delle difese immunitarie come nell’anziano e negli immunodepressi, il virus percorre in senso anterogrado l’assone ed invade la cute: la moltiplicazione del virus a livello della cute determina rigonfiamento, vacuolizzazione e lisi delle giunzioni cellulari, portando alla formazione delle vescicole e dei cosiddetti corpi di Lipschutz. Raramente il virus può viaggiare in maniera centripeta, raggiungendo il SNC e causando un’encefalomielite. o Quadro anatomopatologico Reazione infiammatoria unilaterale in diversi gangli sensitivi adiacenti a nervi cranici o spinali, frequentemente di intensità tale da causare la necrosi di tutto il ganglio o di parte di esso, con o senza emorragia Reazione infiammatoria nelle radici e nei nervi spinali contigui al ganglio interessato Poliomielite: meno frequente Leptomeningite relativamente lieve, limitata ai segmenti cranici o spinali interessati ed alle radici nervose Vasculite cerebrale tardiva o Quadro clinico Sintomi prodromici: prurito, formicolio, sensazione di bruciore nei dermatomeri interessati, talvolta febbre e malessere generale Intenso dolore localizzato o radicolare nei dermatomeri interessati Eruzione cutanea: gruppi di vescicole tese e chiare su base eritematosa, il cui contenuto diventa torbido, poi secco, squamoso e crostoso Herpes oftalmico: in caso di localizzazione nell’area di distribuzione della prima branca del trigemino con interessamento del ganglio di Gasser Herpes del ganglio genicolato: paralisi faciale con eruzioni erpetiche nel meato uditivo esterno, sordità e vertigini Encefalite da herpes zoster: patologia grave verificatasi, in un paziente immunodepresso, a distanza di tempo da un attacco di herpes zoster Cerebellite da varicella Vasculite cerebrale Nevralgia post‐erpetica: è una complicanza abbastanza frequente, caratterizzata da dolore neuropatico persistente nella zona interessata o Terapia: con aciclovir ev, da iniziare entro 72 dalla comparsa della sintomatologia Poliomielite: in passato causata da uno dei tre tipi di poliovirus, oggi può essere dovuta anche a Coxsackievirus A e B ed arbovirus, più frequenti nei paesi con programmi di vaccinazione antipolio. Comunque, i poliovirus sono enterovirus: il principale serbatoio di infezione è il tratto intestinale umano e a principale via di infezione quella orofecale; pertanto, la malattia è appannaggio dei paesi a basso standard socio‐economico. La poliomielite è ad andamento stagionale (prevalente in estate) e può essere sporadica od epidemica. o Quadri clinici Infezione inapparente: infezioni intestinali senza alcuna sintomatologia Malattie minori o poliomieliti abortive: solo lievi sintomi sistemici con faringite o gastroenterite o una sindrome similinfluenzale Poliomielite non paralitica e preparalitica • Sintomi da malattia minore • Altri sintomi generali: apatia, cefalea, febbre alta, rigidità e dolenzia muscolare, faringodinia, vomito, nausea, anoressia • Sintomi muscolari: tensione dei tendini della zampa d’oca, dolore a collo e schiena, irrequietezza accompagnata da irritabilità, rigidità nucale Poliomielite paralitica: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
o
Paralisi muscolare (acuta o “a singhiozzo”) flaccida Fascicolazioni grossolane Diminuzione ROT Parestesie a livello degli arti colpiti Atrofia muscolare Possibile paralisi bulbare: disturbi della deglutizione e della respirazione e circolatori Sindrome post‐polio Quadro anatomopatologico Distruzione e neuronofagia dei neuroni delle corna anteriori ed intermedie della sostanza grigia del midollo spinale Irritazione meningea Lesioni nelle vie del SNA nella sostanza reticolare Lesioni in molte altre zone del SNC, soprattutto nei nuclei del tronco encefalo e nella corteccia prerolandica Par V: Infezioni virali subacute e croniche che simulano una malattia degenerativa Leucoencefalite multifocale progressiva E’ una malattia demielinizzante acquisita, diffusa, del SNC, ad esordio subacuto e decorso rapidamente ingravescente, associata alla riattivazione del Poliomavirus JC (dal nome del primo paziente). Il virus JC è ubiquitario, a giudicare dalla presenza di anticorpi nel 70% circa della popolazione adulta normale: rimarrebbe latente fino all’instaurarsi di uno stato di immunodepressione. E’ una virus a DNA bicatenario circolare, con capside icosaedrico e privo di envelope, responsabile, come altri membri della famiglia Poliomaviridae, di infezioni inapparenti in soggetti immunocompetenti. Quindi, il virus JC causa infezioni inapparenti in un elevatissimo numero di individui e latita a livello di rene, urotelio, tonsille e midollo osseo, per riattivarsi in seguito a deficit dell’immunità cellulomediata. La patologia è caratterizzata da diffuse lesioni demielinizzanti, soprattutto a livello degli emisferi cerebrali, ma anche a livello di troncoencefalo e cervelletto, e raramente del midollo spinale. Le lesioni variano molto sia per grandezza che per gravità, da focolai microscopici di demielinizzazione a grosse lesioni distruttive della mielina e dei cilindrassi, che interessano la maggior parte di un emisfero cerebrale. Le alterazioni delle cellule gliali sono caratteristiche: astrociti giganti con nuclei di forma bizzarra, oligodendrociti con nuclei ingrossati ed inclusioni anomale: molte di queste cellule vengono distrutte con conseguente demielinizzazione; tipica è la scarsa reazione infiammatoria. Possibile è anche l’infezione delle cellule granulari del cervelletto. Tra i fattori di rischio si ricordano: • Sieropositività all’HIV o AIDS conclamata (80%) • Uso di immunosoppressori (rituximab, natalizumab) • Immunosoppressione in pazienti trapiantati • Malattie disimmuni: artrite reumatoide, LES, anemia emolitica autoimmune • Malattie infiammatorie croniche: sarcoidosi, tubercolosi • Neoplasie: leucemie linfociti che croniche, linfoma di Hodgkin, linfosarcomi, malattie mieloproliferative Il quadro clinico è caratterizzato da: • Esordio subacuto • Deficit visivi campimetrici fino alla cecità cerebrale • Emiparesi in progressione verso la tetraparesi • Afasia, disartria, atassia, deficit della sensibilità • Demenza, stato confusionale, coma, disturbi comportamentali • Morte entro 3‐6 mesi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
La diagnosi si avvale di: • RM: tipica è la sindrome da immunoricostruzione al termine della terapia con natalizumab • Ricerca del virus JC tramite PCR o Nelle urine: non significativo o Nel sangue: predittivo, ma non diagnostico o Nel liquor: diagnosi di conferma • Biopsia cerebrale Importante è la diagnosi differenziale: • In pazienti HIV‐ : sclerosi multipla, encefalopatia acuta disseminata, malattie disimmuni, leucodistrofie dell’aulto, • In pazienti HIV+ : demenza HIV associata, altre encefaliti da agenti opportunisti, linfoma primitivo del SNC, toxoplasmosi cerebrale Non vi è nessuna terapia efficace: un modesta effetto può avere la terapia antiretrovirale ad alta efficacia in pazienti HIV+ . Panencefalite sclerosante subacuta Rappresenta l’esito di un’infezione morbillosa cronica, colpisce soprattutto bambini ed adolescenti ed evolve in maniera tipica. Il virus è stato dimostrato nel tessuto cerebrale con il microscopio elettronico ed è stato isolato da biopsie cerebrali; è stata dimostrata la presenza dell'antigene del morbillo nel tessuto cerebrale mediante tecniche che impiegano anticorpi fluorescenti. L’incidenza si è ridotta con la vaccinazione antimorbillo. Si riconoscono fasi caratteristiche: • Prima fase: calo del rendimento scolastico, disturbi caratteriali e di linguaggio • Seconda fase: progressivo deterioramento cognitivo associato a crisi epilettiche, mioclonie diffuse, disturbi visivi da corioretinite progressiva, segni di disfunzione del SNA • Terza fase: segni piramidali ed extra‐piramidali • Fase terminale: il paziente giace immobile, decorticato, con mutismo acinetico, coma o stato vegetativo fino alla morte in 2‐3 anni (possibile anche un decorso fulminante). Non è infatti disponibile alcun trattamento efficace. Criteri diagnostici sono: • Maggiori o Alto titolo di Ab‐antimorbillo nel liquor o Storia clinica Tipica: esordio subacuto e decorso rapidamente ingravescente, esordio insidioso e decorso ingravescente, esordio insidioso e decorso recidivante‐remittente Atipica: crisi epilettiche, primo stadio prolungato, età insolita (oltre i 20 anni) • Minori o EEG tipico con complessi periodici caratterizzati da onde‐punta ogni 2 secondi o IgG aumentate nel liquor o Biopsia cerebrale: le lesioni interessano la corteccia cerebrale e la sostanza bianca di entrambi gli emisferi e del tronco cerebrale. La distruzione dei neuroni, la neuronofagia ed i manicotti perivasali di linfociti e di cellule mononucleate denunciano la natura virale dell’infezione. Altri markers di malattia sono: degenerazione delle fibre mieliniche nella sostanza bianca, inclusioni eosinofile intranucleari ed intracitoplasmatiche nei neuroni e nelle cellule gliali. Le lesioni macroscopiche sono evidenziabili anche alla RM o Test non convenzionali: test diagnostico molecolare per identificare il genoma mutato del virus del morbillo. Questi ultimi due criteri sono richiesti se la presentazione è atipica, altrimenti sono richiesti 2 criteri maggiori ed 1 minore Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Altre forme: • Encefalite subacuta da morbillo con immunosoppressione: a differenza della precedente, che si manifesta in bambini normali, questa si manifesta in bambini ed adulti immunodepressi. E’ caratterizzata da: crisi epilettiche, segni neurologici focali, stupor, coma • Panencefalite progressiva da rosolia: la sintomatologia si caratterizza per: deterioramento del comportamento e delle capacità cognitive, crisi epilettiche, demenza, impaccio dell’andatura seguito da atassia franca, segni piramidali, disartria, disfagia, disturbi visivi • Encefalite letargica (malattia di von Encomo o malattia del sonno): è caratterizzata da oftalmoplegia, spiccata sonnolenza, disturbi del movimento extrapiramidali Par VI: Infezioni del SN da spirochete Neurosifilide L’incidenza della neurosifilide, dopo essersi straordinariamente ridotta nei decenni successivi alla seconda guerra mondiale con l’avvento della penicillina, è negli ultimi anni aumentata, sia negli individui immunocompetenti che in quelli immunocompromessi, come quelli HIV+. La sifilide è causata dal Treponema Pallidum: • Stadi dell’infezione: o Sifilide primaria: asintomatica, senza alcun segno neurologico: la diffusione al SNC si verifica nel 30% dei casi o Sifilide latente: è asintomatica, con positività solo della sierologia e del liquor o Sifilide secondaria: il microrganismo diffonde in tutto l’organismo, dando luogo alla malattia disseminata Forma sistemica: malattia simil‐influenzale e rash cutanei Forma neurologica: meningite, neuropatia dei nervi cranici (ipoacusia), sifilide meningovascolare (infarto cerebrale o spinale) o Sifilide terziarie: anni e talvolta decadi dopo l’infezione primaria Forma cardiaca: miocardite, pericardite, disturbi di conduzione Forma neurologica: demenza (paralisi progressiva), tabe dorsale, mielo‐neuropatia • Concetti generali o Il treponema invade il SNC entro 18 mesi dalla penetrazione nell’organismo o L’esordio dell’infezione neurosifilitica è una meningite, generalmente asintomatica ed evidenziabile tramite esame del liquor. Più raramente può manifestarsi in maniera più drastica, con paralisi dei nervi cranici, crisi epilettiche, fenomeni apoplettici, idrocefalo e segni di ipertensione endocranica o Questa meningite può essere asintomatica e causare, dopo anni, un danno parenchimale o Tutte le forme di neurosifilide esordiscono come meningite e un’infiammazione meningea più o meno attiva è il corollario invariabile di tutte le forme di neurosifilide o In genere si osserva la combinazione di più delle suddette sindromi o Le sindromi cliniche e le reazioni patologiche della sifilide congenita sono analoghe a quelle delle forme tardive acquisite, differendone solo per l’età d’esordio o Il liquor è un indicatore sensibile della presenza di un’infezione sifilitica attiva: Pleiocitosi fino a 100/mm3 , costituita soprattutto da linfociti Aumento delle proteine totali fino a 200 mg/dl Aumento delle gammaglobuline, soprattutto di IgG Positività dei test sierologici o La diagnosi sierologica si avvale di Anticorpi non specifici (reagine): se positivi sul liquor, consentono di porre la diagnosi, ma spesso sono negativi nel siero (sifilide sieronegativa) • Test di Kolmer: fissazione del complemento • VDRL (veneral disease research laboratori): test di flocculazione Anticorpi specifici Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
• Test di adsorbimento anticorpale treponemico a fluorescenza (FTA‐ABS) • Test di immobilizzazione del TP (TPI): molto costoso e di difficile impiego Sindromi cliniche di neuro sifilide o Neurosifilide asintomatica: la diagnosi si basa solo su reperti liquorali. L’unico reperto clinico può essere la pupilla di Argyll‐Robertson: miosi bilaterale (pupille a forma di spillo), pupille di forma disuguale ed irregolare (aneucicliche ed anisocoriche), che non si dilatano correttamente con i farmaci midriatici e non reagiscono correttamente alla luce, anche se tendono a contrarsi per riflesso di accomodazione. Sede della lesione è a livello dei nuclei pretettali: vengono così ad essere bloccate le connessioni tra le pupille bilaterali ed i nuclei di Edinger‐Westphal; quindi, sono interrotte le vie afferenti del riflesso fotomotore, ma rimangono integre le vie dell’accomodazione o Sifilide meningea: compaiono entro 2 anni dall’infezione sintomi aspecifici di interessamento meningeo: cefalea, rigidità nucale, paralisi dei nervi cranici, convulsioni, confusione mentale, sintomi da ipertensione endocranica (papilledema, nausea, vomito), alterazioni del liquor, assenza di febbre (a differenza dalla meningite tubercolare) o Sifilide meningovascolare: forma più comune di neurosifilide, si manifesta, dopo 6‐12 anni dall’infezione, come insorgenza di uno o più attacchi cerebrovascolari, con emiplegia, afasia, perdita della sensibilità, disturbi visivi, confusione mentale a rapida insorgenza. Sintomi più aspecifici sono: cefalea, vertigini, diminuzione della capacità di concentrazione, stanchezza, insonnia, visione offuscata. Paralisi dei nervi cranici ed anomalie della pupilla indicano, invece, una meningite basilare. Una forma particolare è l’arterite di Huebner, caratterizzata, oltre che da infiltrati meningei, da infiammazione e fibrosi delle piccole arterie, con stenosi ed occlusione o Interessamento del midollo: si manifesta con: sintomi bulbari, debolezza ed atrofia dei muscoli dei cingoli e degli arti, paraparesi spastica a lenta progressione e, in rari casi, mielite trasversa con paraplegia flaccida improvvisa e perdita di controllo degli sfinteri o Neurosifilide paretica (o meningoencefalite sifilitica o demenza paraltica o paralisi progressiva): si manifesta, dopo 15‐20 anni dall’infezione, come: demenza, disartria, scosse miocloniche, tremore intenzionale, crisi epilettiche, iperreflessia, segno di Babinski e pupille di Argyll‐Robertson, deliri sistemattizati megalomani o altre manifestazioni psichiatriche. Comunque, il quadro più caratteristico è caratterizzato da una demenza con indebolimento delle capacità intellettive, mnestiche, linguistiche e grafiche. Con il progredire del deterioramento verso lo stadio paralitico, le funzioni intellettive subiscono un graduale declino e si manifestano forme di afasia, agnosia ed aprassia, con eventuali disturbi psichiatrici e netta diminuzione della cura personale. Progredisce anche il decadimento fisico: portamento ed andatura alterati, debilitazione, instabilità, disartria, tremore a lingua e mani, fino all’allettamento. Altri sintomi sono: emiplegia, emianopsia, afasia, paralisi dei nervi cranici e crisi epilettiche focali (sclerosi cerebrale di Lissauer), idrocefalo, psicosi. o Tabe dorsale (o neurosifilide tabetica): si manifesta 15‐20 anni dopo l’infezione con: Dolori lancinanti: improvvisi (“a pungnalata”), in qualsiasi zona del corpo, ma soprattutto alle gambe Atassia sensitiva: sia statica che dinamica Incontinenza urinaria (vescica insensibile ed ipotonica), stipsi e megacolon: espressione delle alterazione delle radici e del midollo spinale Assenza dei riflessi rotulei ed achillei Ipotonia ed ipotrofia muscolare Alterazione della sensibilità vibratoria e di posizione nei piedi e nelle gambe Compromissione della sensibilità tattile, dolorifica e termica con parestesie: in alternativa può aversi la dissociazione tabetica, in cui diminuisce o scompare la sensibilità profonda o tattile, m è conservata quella termico‐dolorifica Segno di Romberg Pupille di Argyll‐Robertson associate a ptosi ed oftalmoplegia, con possibile atrofia ottica Atropatia di Charcot Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Crisi viscerali: dolore epigastrco diffuso, crisi intestinali o Altre manifestazioni: atrofia ottica, sordità nervosa, meningomielite sifilitica Terapia: penicillina G ev o benzatin penicillina im + probenecid per os, eritromicina e tetraciclina nei paziente allergici Neuroborreliosi (malattia di Lyme) La Borrelia Burgdoferi, trasmessa dal morso di una zecca (Ixodidae), dà luogo ad un’infezione che progredisce con iniziale spirochetemia, danno vascolare in molti organi ed alto grado di neurotropismo, con interessamento anche di nervi cranici e periferici. La manifestazione iniziale consiste in una lesione cutanea che si sviluppa nella sede del morso della zecca , tende ad allargarsi e a diffondersi (eritema cronico migrante), accompagnata da affaticamento e sintomi similinfluenzali. Settimane più tardi compaiono le manifestazione cardiache, neurologiche ed articolari. Stadi della malattia sono: • I: eritema cronico migrante • II: infezione sistemica con interessamento del SN • III: infezione persistente con frequente interessamento del SN. In questo stadio, come nel precedente, la compromissione neurologica può essere isolata Il quadro neurologico tipico assume la forma di una meningite asettica o di una meningoencefalite fluttuante con nevrite cranica e periferica: si distingue in: • Sindromi precoci o Sindrome meningea aspecifica: cefalea, lieve rigidità nucale, nausea e vomito, malessere, affaticamento cronico o Sindrome encefalitica aspecifica: sonnolenza, irritabilità, scarsa memoria, depressione dell’umore, alterazioni comportamentali o Neuropatia dei nervi cranici: paralisi di Bell uni‐ o bi‐laterali o Radicolonevriti dolorose o Meningoradiculite della cauda equina o Forma mielitica con tetraparesi • Sindromi tardive o Encefalomieliti o Neuropatie post‐Lyme La diagnosi, anamnestico‐clinica, è confermata dalla positività dei test sierologici specifici (IgM e poi IgG anti‐borrelia nel sangue e nel liquor). La terapia prevede: • In fase precoce: ceftriaxone o cefotaxime ev per 2 settimane • In fase tardiva: ceftriaxone ev per 2‐4 settimane Par VII: Infezioni varie Neurocisticercosi Frequente in Africa, Medio Oriente ed Africa, dove è una delle maggiori cause di epilessia ed altri disturbi neurologici, si sta diffondendo, per la notevole emigrazione e l’aumento dei viaggi in queste zone, anche nel mono occidentale. E’ dovuta all’ingestione della Taenia solium. • Forme cliniche (molto frequente la coesistenza) o Parenchimale: crisi epilettiche, sintomi focali o Meningea: talvolta le cisti si localizzano nello spazio subaracnoideo della base cranica, dove provocano un’intensa reazione infiammatoria che porta ad idrocefalo, vasculite ed ictus, con possibile paralisi dei nervi cranici (forma racemosa poco influenzata dalla somministrazione di praziquantel) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Intraventricolare: spesso un’ampia cisti intraventricolare può ostruire il passaggio del liquor provocando idrocefalo Diagnosi: generalmente può essere posta per la presenza di lesioni multiple calcificate a livello dei muscoli delle cosce, delle gambe e delle spalle, oltre che nel cervello. A livello cerebrale le manifestazioni sono variabili, da poche e grandi cisti a molte e piccole cisti. Di aiuto può essere la titolazione sierica. Il liquor presenta le caratteristiche di una meningite asettica con titolo positivo per cisticerco. Comunque, alla RM possono riscontrarsi: o Cisti inattive: appaiono come piccole calcificazioni o Cisti attive: appaiono come formazioni cistiche che non prendono contrasto e senza edema o Cisti in fase di degenerazione: hanno una presa di contrasto ad anello e sono generalmente circondate da edema Terapia o Antiepilettica ed antiedemigena o Praziquantel o albendazolo + corticosteroidi o
•
•
Complicanze neurologiche dell’AIDS Una classificazione in base alla sede colpita riconosce: • Cervello o Non focali AIDS‐demenza complex Encefalite acuta da HIV Encefalite da CMV, VZV o HSV Encefalopatie metaboliche o Focali Toxoplasmosi cerebrale Linfoma primitivo del SNC Leucoencefalopatia multifocale progressiva Criptococcoma Ascesso cerebrale/tubercoloma Neurosifilide (soprattutto meningovascolare) o Vasculopatie cerebrali: endocardite batterica ed emorragie cerebrali associate a trombocitopenia • Midollo spinale o Mielopatia vacuolare o Mielite da herpes zoster o simplex • Meningi o Meningite asettica o Meningite criptococcica o Meningite tubercolare o Meningite luetica o Meningite linfoma tosa metastatica • Nervi periferici e radici spinali o Infezioni o Herpes zoster o Poliradiculopatia lombare da CMV, correlata al virus o si base immunitaria o Polineuropatia infiammatoria da HIV acuta o cronica o Multi neuropatia o Polineuropatia demielinizzante sensitivo‐motoria o Polineuropatia simmetrica distale sensitivo dolorosa: può essere dovuta al virus a farmaci retro virali (stavudina) o Sindrome linfocitica infiltrativa diffusa Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
o Sindrome infiammatoria da ricostituzione immunitaria: disordini autoimmuni Muscoli: polimiosite ed altre miopatie, comprese quelle da farmaci (zinovudina) Il complesso AIDS‐demenza si manifesta nelle fasi tardive (è molto comune nei bambini), come encefalopatia indotta dall’infezione da HIV e potenziata dall’attivazione del sistema immunitario (soprattutto macrofagi e microglia) nell’encefalo: queste cellule, infettate dall’HIV, secernono prodotti neurotossici di origine sia endogena che virale. L’aspetto neuropatologico principale risulta quindi costituito da aggregati di macrofagi e cellule multinucleate nella sostanza bianca: ne consegue una rarefazione della sostanza bianca; l’atrofia encefalica con perdita neuronale si realizza solo nelle fasi terminali. Questa patologia assume la forma di una demenza lentamente o rapidamente progressiva con: perdita della capacità di memorizzare, deficit dell’attenzione, disturbi del linguaggio, apatia, anomalie della funzione motoria, paralisi spastica. Altri disturbi sono: deficit motilità oculare volontaria, atassia della marcia, incoordinazione motoria, aprassia, iperriflessia, ipertonia, segni di liberazione frontale, coma apallico e morte in 2‐6 mesi. Tutto ciò si manifesta anni dopo l’esordio della malattia e si associa a bassi linfociti CD4+ e ad elevata carica virale plasmatica. Toxoplasmosi cerebrale Può manifestarsi come: • Forma congenita: ha effetti gravissimi sul cervello del neonato: crisi epilettiche, idrocefalo, microcefalia, calcificazioni cerebrali, ritardo psicomotorio, morte • Riattivazione in età adulta di una forma pregressa, specie in soggetti HIV+ : febbre, cefalea, alterazioni dello stato di coscienza, deficit neurologici focali, segni di encefalopatia metabolica (mioclono ed asterixis), segni di meningoencefalite (crisi epilettiche, confusione mentale, irritazione meningea e coma) o RM: lesioni multiple con presa di contrasto ad anello e predilezione per i gangli della base e per la giunzione tra sostanza grigia e sostanza bianca o Aumento titoli sierici di IgG o Terapia: pirimetamine e sulfadiazine (+ acido folcia per prevenire la soppressione midollare da pirimetamina) + corticosteroidi (per contrastare l’edema perilesionale che può causare ipertensione endocranica) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ XI PROF. COTRUFO Malattia cerebrovascolare (MCV) ischemica Par I: Generalità Introduzione Fra tutte le malattie neurologiche dell’età adulta, quelle cerebrovascolari si collocano certamente al primo posto per frequenza ed importanza, rappresentando il 50% dei disturbi neurologici osservati in clinica. Negli ultimi anni, sono state introdotte nuove e straordinarie tecniche neuroradiologiche che consentono al medici di effettuare distinzioni fisiologiche fra tessuto cerebrale normale, ischemico ed infartuato: l’identificazione del tessuto ischemico, ma non ancora infartuato, definisce l’obiettivo del moderno trattamento dell’ictus. Infine, tutti i medici rivestono un ruolo nella prevenzione dell’ictus, favorendo la riduzione dei fattori di rischio, come l’ipertensione, e l’identificazione dei segni di un potenziale ictus,come attacchi ischemici transitori (TIA), fibrillazione atriale e stenosi della carotide. Terminologia e classificazione Il termine “ictus” si applica ad una sindrome neurologica improvvisa focale non convulsiva, dovuta in particolare ad una MCV. La MCV definisce qualsiasi alterazione cerebrale derivante da un processo patologico dei vasi sanguigni. “Processo patologico” è inteso come termine generico, comprendendo l’occlusione del lume da parte di un embolo o di un trombo, la rottura di un vaso, un’alterazione della permeabilità della parete vasale, oppure l’aumento della viscosità od altre alterazioni qualitative del sangue cerebrale. Il profilo temporale riveste particolare importanza: è il modo improvviso, secondi o minuti, in cui si verifica, che lo identifica come vascolare. Gli ictus possono classificarsi come: Embolici: ad esordio improvviso Trombotici: l’esordio può essere più graduale, in un periodo di minuti od ore con un andamento progressivo (talvolta, può durare giorni, con andamento “a gradini”, vedi dopo” Emorragici o Ipertensivo (od intracerebrale): esordio improvviso o Subaracnoideo L’altro aspetto importante della temporalità, oltre quindi al suo carattere immediato, è l’arresto della progressione e quindi la regressione del deficit neurologico in quasi tutti gli ictus, tranne quelli fatali. Riguardo la rapidità d’involuzione, a un estremo vi è una sindrome focale che migliora velocemente e rapidamente nell’arco di alcuni minuti fino ad un ora (TIA); all’altro vi sono gli infarti embolici, che regrediscono in ore o giorni, e trombotici, che regrediscono lentamente, anche in settimane o mesi. Grande importanza rivestono le alterazioni parenchimali cerebrali secondarie , che possono essere ischemiche (con o senza infarto) ed emorragiche (vedi dopo). Cause di lesioni cerebrali da alterazioni della circolazione cerebrale sono: Trombosi aterosclerotica TIA Embolia Emorragia ipertensiva Aneurismi sacciformi e malformazioni AV e loro rottura Arteriti o Sifilide meningo‐vascolare, arterite secondaria a meningite piogena e tbc o Malattie del tessuto connettivo: PAN, LES, arterite necrotizzante, arterite di Wegener, malattia di Takayasu, arterite temporale, arterite o angiote a cellule giganti Tromboflebite cerebrale Malattie ematologiche: da anticoagulanti e trombo litici, alterazione dei fattori della coagulazione, policitemia, anemia a cellule falciformi, trombocitosi Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Traumatismi e dissecazioni a carico delle arterie carotidee e basilari Angiopatia amiloide Aneurisma dissecante dell’aorta Complicanze dell’arteriografia Emicrania complicata con deficit persistenti Associate ad ernie tentoriali, del forame magno e sottofalciali Miscellanea: contraccettivi orali, raggi X, moyamoya (in ragazzi e giovani adulti) Ictus ischemico Può essere definito come un ictus dovuto a cause ischemiche. In base alla prognosi gli ictus ischemici, inoltre, possono venir classificati come: TIA: breve episodio di deficit neurologico causato da ischemia cerebrale focale o retinica. Il deficit neurologico rimette in meno di un’ora e non è associata a segni di ischemia alla TC, né precoci né tardivi. Possono essere tardivamente evidenti segni di alterazione alla RMI‐T2 RIND (deficit neurologico ischemico reversibile): il deficit neurologico rimette quasi completamente in circa 3 giorni e non è associato a segni di infarto alla TC Minor stroke: i deficit durano più di 3 giorni, con esiti minimi a 3 settimane e microinfarto visibile in TC Ictus ischemico completato: il deficit neurologico raggiunge all’inizio la massima gravità, che generalmente rimette, lasciando esiti stabili; è associato ad infarto evidente in TC Ictus ischemico progressivo: il deficit neurologico, dopo l’esordio, si aggrava in ore o giorni, associandosi ad ampliamento dell’area infartuata alla TC Ictus silente: dovuto ad ictus in aree associative, con assenza di sintomatologia evidente In base alla patogenesi, gli ictus ischemici, che costituiscono il 70‐80% degli ictus, possono essere classificati (la frequenza varia molto a seconda dei campioni utilizzati) come dovuti a: AS di arterie maggiori (trombotici) Cardioembolia (embolici) Lipoialinosi di piccoli vasi Altre cause: patologie ematologiche, dell’emostasi ed emodinamiche Epidemiologia • Incidenza: si è ridotta negli ultimi anni grazie ad efficaci terapie antipertensive preventive o Nel mondo: 100‐300/100mila abitanti/anno o In italia: 400/100mila abitanti/anno: ne derivano 200mila nuovi casi all’anno su tutto il territorio e circa 20mila in Campania (notevole è l’assenza in Campania di strutture sanitarie adeguate) • Mortalità: l’ictus, fino a poco tempo fa la terza causa di morte dopo le cardiopatie ed il cancro, è oggi diventata la seconda causa di morte dopo il cancro. Infatti, la terapia dell’infarto miocardico acuto ha conosciuto un notevole miglioramento dell’organizzazione e dei presidi sanitari, che ne ha consentito una riduzione della mortalità. La terapia acuta dell’ictus, invece, non ha conosciuto un miglioramento così netto, consentendo solo una scarsa riduzione della mortalità. Inoltre, la terapia trombolitica, pietra angolare del trattamento dell’IMA, si rileva spesso controindicata in caso di ictus. Circa un quarto degli ictus sono fatali, i tre quarti non sono invece fatali: un terzo degli ictus non fatali determina disabilità permanente (l’ictus risulta la patologia che causa il maggior numero di disabili nel mondo) ed una gran parte di essi rimane così grave da non poter tornare ad una vita quotidiana normale, rimanendo talvolta nelle strutture ospedaliere. I restanti due terzi dei casi non fatali recupera la condizione primitiva. Inoltre, frequente è l’incidenza di recidive nei pazienti sopravvissuti al primo attacco. In definitiva, è bene sottolineare come, a fronte di una riduzione modesta dell’incidenza e moderata della mortalità dell’ictus, l’incidenza di invalidità permanente a seguito di un ictus è aumentata, segnalando come il Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
reale obiettivo delle terapie, ossia un miglioramento delle condizioni di vita a seguito di un ictus, non sia stato realmente raggiunto. Fattori di rischio per l’ictus aterosclerotico • Non modificabili o Età: il rischio di ictus cresce in maniera esponenziale con l’età, raddoppiando per ogni decade dopo i 55 anni. Di conseguenza, dato l’aumento della popolazione, a fronte di una diminuzione, legata all’uso cronico di terapie antipertensive, dell’incidenza, vi è un certo aumento di essa legato, appunto, all’aumento dell’età media della popolazione. È bene notare come il flusso ematico cerebrale (FEC) si riduce con l’età, soprattutto dopo i 70 anni, rendendo questi soggetti anziani particolarmente esposti all’ictus. o Sesso: quello maschile è più colpito fino ai70‐75 anni, poi, risulta equivalente. La mortalità, invece, è maggiore nelle donne, specie tra i 50 ed i 55 anni. o Etnia: quella africana presenta un rischio maggiore, seguita da quella latino‐americana. Le popolazioni americane e caucasiche presentano, invece, un rischio maggiore di aterosclerosi (AS) intracranica, probabilmente per una maggior prevalenza di fattori di rischio modificabili. o Familiarità: aumenta il rischio di 1,5 volte o Presenza di altre condizioni geneticamente determinate: la demenza vascolare sottocorticale (CADASIL: cerebral autosomal dominant arteriophaty with subcortical infarcts and leukoencephalophaty), ad esempio, determina un aumento dell’incidenza di infarti sottocorticali per un’angiopatia, non AS né amiloidea, delle arteriole cerebrali accompagnata da leucoencefalopatia. Questa patologia è legata ad una mutazione del gene Notch, localizzato sul cromosoma 19. • Modificabili o Ipertensione arteriosa: dopo l’età è il principale fattore di rischio per ictus sia AS che emorragico, predisponendo all’AS dei grandi e piccoli vasi. Lo studio Framingham ha diviso la popolazione in: Pazienti normotesi: pressione sistolica fino a 130 mmHg, rischio relativo pari ad 1 Borderline: pressione sistolica tra 130 e 139 mmHg, rischio relativo lievemente aumentato. È molto importante considerare il “conflitto” tra cardiologi e neurologi: per i primi, infatti, sarebbe necessario, per un’ottimale performance cardiaca, una pressione sistolica di 110‐
115 mmHg (e quindi eccedono nella terapia antipertensiva), pressione tuttavia insufficiente nell’anziano ad assicurare un adeguato FEC I stadio: pressione sistolica tra 140 e 159 mmHg, rischio relativo pari ad 1,5 II stadio: pressione sistolica fra 160 e 180 mmHg, rischio relativo pari a 3 III stadio: pressione sistolica oltre i 180 mmHg, rischio relativo pari a 3 In realtà, il rischio sembra determinato sia dall’aumento della pressione sistolica che da quello della pressione diastolica. Comunque, il controllo a lungo termine dell’ipertensione riduce l’incidenza di infarto AS e di emorragia intracerebrale. o Diabete mellito: aumenta il rischio di 1,5‐3 volte in base alla severità. Fino all’80 % dei diabetici va incontro ad AS delle grandi arterie o Iperlipemia (aumento di colesterolo totale, LDL e/o trigliceridi): aumentano il rischio di ictus AS. Il colesterolo HDL lo riduce o Obesità: occorre valutare la circonferenza dell’addome o Sedentarietà o Abitudine prolungata al fumo di sigaretta: in particolare, riduce sia le HDL sia il FEC o Uso di contraccettivi orali o Terapia ormonale sostitutiva post‐menopausale o Emicrania con aura o Iperomocisteinemia o Processi infiammatori cronici o Scarso consumo di K+ Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o Patologie ematiche: policitemia, piastrinosi, iperfibrinogenemia, ematocrito elevato, leucocitosi o Cardiopatie: insufficienza cardiaca congestizia, AS coronarica Criptogenetiche
Cause di ictus embolico • Di origine cardiaca o Fibrillazione atriale ed altre aritmie (conseguenti a miocardiopatia reumatica, AS, ipertensiva, congenita o sifilitica) o Infarto miocardico con trombo murale o Endocardite batterica acuta e subacuta o Shunt destra‐sinistra o Miocardiopatia senza aritmia né trombo murale (stenosi mitralica, miocardite, etc.) o Complicanze della cardiochirurgia o Protesi valvolari o Vegetazioni endocardiche trombotiche non batteriche (marantiche) o Prolasso della mitrale o Embolia paradossa nelle miocardiopatie congenite o Mixoma • Di origine non cardiaca o AS dell’aorta e delle arterie carotidi (trombo murale, materiale ateromatoso) o Da sedi di dissecazione e/o displasia fibromuscolare delle arterie carotidi e vertebro‐basilari o Trombo nelle vene polmonari o Grasso, tumore od aria o Complicanza di interventi chirurgici cervicali o toracici o Trombosi pelvica e degli arti inferiori in presenza di shunt cardiaco destra‐sinistra o Di origine non determinata Par II: Fisiologia del circolo cerebrale Circolazione encefalica Dall’arco aortico a sinistra e dal tronco anonimo a destra si distacca l’arteria carotide comune, che si divide in esterna ed interna. Dall’arteria carotide interna, a livello intracranico, nascono le arterie oftalmica, cerebrale anteriore e cerebrale media. Dalle succlavie nascono, invece, le arterie vertebrali, che, a seguito del loro ingresso nel cranio ed a livello della giunzione ponto‐bulbare, si uniscono a formare l’arteria basilare, che alla sua estremità darà origine all’arteria cerebrale posteriore. La circolazione encefalica, data la sua ovvia e straordinaria importanza, è protetta da un efficiente circolo anastomotico, il poligono di Willis: dalle cerebrali posteriori originano le due comunicanti posteriori, che consentono la comunicazione tra il circolo vertebro‐basilare e quello carotideo (le due cerebrali anteriori, inoltre, danno origine alla comunicante anteriore); ne consegue, come detto, una comunicazione tra circolo vertebro‐basilare e circolo carotideo, ma anche una comunicazione tra circolo destro e sinistro, consentendo una notevole riserva ematica. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Altro circolo anastomotico di minore, ma non trascurabile importanza, è quello tra arteria oftalmica ed arteria nasale, e quindi tra carotide interna e carotide esterna. Pertanto, in caso di occlusione della carotide interna prima dell’emergenza dell’oftalmica e di pervietà della carotide esterna, l’inversione del flusso, dall’esterna all’interna, consente un adeguato rifornimento di sangue al sifone carotideo. Comunque, un ruolo riveste anche la temporalità: in caso di occlusione acuta il circolo anastomotico, meno sviluppato rispetto ai cadi di occlusione più graduale, sarà meno efficace. Inoltre, il livello della pressione arteriosa può esercitare un ruolo: difatti, in caso di ipoperfusione cerebrale da ipotensione i circoli collaterali possono risultare insufficienti. Un altro circolo collaterale è quello a livello piale, che, grazie alle anastomosi interarteriolari subaracnoidee, mette in comunicazione le arterie cerebrali media, anteriore e posteriore. Quindi, riepilogando, gli effetti di un’occlusione arteriosa focale sul tessuto cerebrale dipendono dalla localizzazione dell’occlusione, in relazione alla disponibilità di circoli collaterali ed anastomotici. In caso di ostruzione prossimale al circolo di Willis, le arterie comunicanti posteriori ed anteriore sono spesso in grado di prevenire l’infarto. In caso di ostruzione dell’arteria carotide interna nel tratto cervicale, vi può essere un flusso retrogrado dalla carotide esterna attraverso l’arteria oftalmica o attraverso rami di collegamento minori tra carotide esterna ed interna. Il flusso anastomotico, in caso di occlusione dell’arteria vertebrale, può avvenire tramite l’arteria cervicale profonda, la tireo‐cervicale o l’occipitale, oppure per via retrograda dall’altra vertebrale. In caso di ostruzione a livello prossimale delle arterie cerebellari o cerebrali distali al circolo di Willis, il danno ischemico può essere ridotto dalle anastomosi meningee. Le placche ateromatose La maggior parte delle MCV può essere attribuita all’AS ed all’ipertensione cronica, aggravate dai fattori di rischio visti in precedenza: queste determinano lo sviluppo delle placche ateromatose, che originano e si sviluppano nell’arco di 20‐30 anni, per divenire sintomatiche in caso di complicanze trombotiche. Sebbene le placche possano restringere il lume di un’arteria causando una stenosi, l’occlusione completa è quasi sempre dovuta ad una trombosi. Il processo trombotico si forma solitamente su di una placca ateromatosa: infatti, la placca stessa determina una condizione che favorisce la coagulazione e l’aggregazione piastrinica, con progressivo ingrandimento del trombo parietale che può portare in aggiunta, da un lato, al distacco di frammenti embolici che vanno ad ostruire vasi più a valle (embolo artero‐arterioso fino alla sindrome dell’embolo viaggiante), dall’altro, all’occlusione completa del vaso (trombosi di stagnazione) con coinvolgimento di tutti i vasi a valle. Ad esempio, per una trombosi di stagnazione della carotide interna alla sua biforcazione vi sarà un coinvolgimento dell’oftalmica od anche della cerebrale media: l’estensione del trombo di stagnazione sarà inversamente proporzionale all’estensione dei circoli anastomotici. Inoltre, il trombo, che, diversamente da un embolo, non ostruisce da subito in maniera completa il circolo, dando la sintomatologia in maniera meno immediata dell’embolo, può propagarsi sino a punti critici distali o prossimali. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Le sedi più frequenti di placche ateromatose, con conseguenti stenosi e trombosi, sono i siti di biforcazione e di incurvamento, quindi: • l’emergenza della vertebrale dalla succlavia • l’emergenza della carotide comune dal tronco anonimo • l’emergenza della carotide interna dalla carotide comune ed in corrispondenza del seno carotideo • il tratto in cui le vertebrali si congiungono per formare il tronco basilare • l’origine e la biforcazione delle arterie cerebrali medie • le arterie cerebrali posteriori nel punto in cui decorrono attorno al mesencefalo • le arterie cerebrali anteriori nel punto in cui si incurvano sul corpo calloso. L’evoluzione di un trombo, come visto, può essere variabile: TIA isolati (14%): un TIA è un disturbo neurologico focale, improvviso, non convulsivo, che dura meno di 24 ore e regredisce spontaneamente senza lasciare segni TIA che evolvono in ictus (42%) Evoluzione a gradini di un ictus, preceduto o meno da TIA (18%) Ictus come evento singolo o Improvviso (11%) o Progressivo e graduale (6%): ictus “lento” Ictus seguito da TIA (9%) Territori di distribuzione Una precisa conoscenza dei territori di distribuzione delle arterie cerebrali consente al clinico attento una pronta diagnosi della sede dell’ictus. Grossolanamente possono distinguersi: Superfici laterali degli emisferi cerebrali: irrorata da o Arteria cerebrale media: anteriormente e centralmente o Arteria cerebrale posteriore: posteriormente Superfici mediali o Arteria cerebrale anteriore: anteriormente e centralmente. Il territorio d’irrorazione della cerebrale anteriore diminuisce in senso antero‐posteriore, risultando, quindi, maggiore a livello frontale e minore a livello parietale (pertanto, una sindrome frontale sarà più probabilmente dovuta ad ictus della cerebrale anteriore) o Arteria cerebrale posteriore: posteriormente. In questo caso il territorio d’irrorazione aumenta in senso antero‐posteriore, lasciando, alla fine, solo un piccolo spazio irrorato dalla cerebrale media. Inoltre, gran parte delle strutture profonde, quali l’ippocampo e la restante superficie infero‐mediale del lobo temporale, è irrorata dalla cerebrale profonda I territori di confine fra due arterie sono molto importanti, data la maggior probabilità di ipoperfusione in questi territori. Infine, è bene ricordare l’irrorazione del midollo spinale, nonostante la scarsa frequenza di ictus midollari: vi è una rete anastomotica che consente la formazione dell’arteria spinale anteriore e dell’arteria spinale posteriore. Possono, comunque, differenziarsi 3 livelli di irrorazione: Livello alto: di pertinenza dell’arteria vertebrale Livello medio: di pertinenza dell’arteria succlavia e dell’ascellare Livello basso: di pertinenza delle arterie radicolari dorsali Livello ultimo: di pertinenza dell’arteria di Adamkievicz, che origina direttamente dall’aorta addominale. Pertanto, l’infarto dell’arteria di Adamkievicz è piuttosto frequente, dato il coinvolgimento in casi di dissecazione dell’aorta addominale. Il quadro sarà molto tipico con coinvolgimento che inizia a livello D6 e termina a livello del cono midollare Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Come detto, possono distinguersi, in sezione trasversale: Arteria spinale anteriore: irrora i 2/3 anteriori. Pertanto, ictus anteriori causano una sindrome sensitiva, per lesione del fascio spino‐talamico, e piramidale, per lesione del fascio cortico‐spinale, con risparmio della sensibilità propiocettiva e tattile superficiale (epicritica) grazie al risparmio dei cordoni posteriori Arteria spinale posteriore: irrora il 1/3 posteriore, cioè una parte del corno grigio posteriore ed i cordoni posteriori . Pertanto, ictus posteriori causano perdita della sensibilità propiocettiva e tattile superficiale nel territorio sottostante, con risparmio della sensibilità termo‐dolorifica e della motilità. Flusso ematico cerebrale Il cervello, in virtù della sua straordinaria richiesta di sangue, ossigeno e nutrienti, derivante dalla sua ininterrotta e necessaria attività, gode di un grande privilegio, ossia di un flusso ematico particolarmente elevato. Infatti, pur rappresentano il cervello il 2% del peso corporeo (1,5 kg in una persona di 70 kg), riceve il 15% del flusso ematico al minuto (FE totale 5L/min, FEC 750 mL/min, ossia 50 mL/min/100g) e consuma il 20% dell’ossigeno circolante al minuto (consumo totale O2 250cc/min, consumo cerebrale O2 50cc/min. Praticamente un qualsiasi punto cerebrale consuma 20 volte più ossigeno di un qualsiasi altro punto corporeo medio ): tutto questo con un volume ematico relativamente basso (volume ematico totale 5L, volume ematico cerebrale 60 mL, quindi il volume ematico cerebrale è solo l’1,2 % del volume ematico totale, consentendo, da un lato, una rapida perfusione cerebrale, dall’altro, una ridotta pressione cerebrale). Questa straordinaria velocità è consentita dalla mancanza di resistenze nei vasi cerebrali, rispetto agli altri tessuti: ne deriva un sistema di estrazione estremamente capace nonostante l’assenza di resistenze, dovuta al fatto che il cervello “galleggia” nel liquor, quasi in assenza di gravità. In realtà il flusso cerebrale, 50 mL/min/100g di tessuto è una media: alcune regioni hanno un flusso maggiore delle altre, come rilevabile tramite la PET, in dipendenza sia da fattori basali, ma anche da fattori dipendenti dall’attività svolta. Questa autoregolazione è molto importante e dipende, non solo dall’attività, ma anche dalla pressione arteriosa sistemica: infatti, se il cervello subisse tutte le variazione pressorie che subisce l’organismo, in particolare dalla posizione supina a quella eretta, data la sua posizione nell’estremo superiore del corpo, sarebbe il primo organo a risentire degli effetti dell’ipotensione e della conseguente ipoperfusione (cosa che in effetti avviene in pazienti affetti da disautonomia familiare, quindi privi di questo sistema di autoregolazione). Il sistema di autoregolazione funziona in un range di valori: al di sotto dei 75mmHg ed al di sopra dei 145 mmHg di pressione arteriosa media [(pressione sitolica + diastolica)/2] è incapace di assicurare un FEC fisiologico, risultando, rispettivamente in un’ischemia da ipoperfusione ed in un’encefalopatia ipertensiva con eventuale emorragia intracranica ipertensiva. Comunque, questi valori, compresi tra 75 e 145 mmHg di pressione arteriosa media, risultano in un amplio range, nel quale il FEC rimane costante. Questo meccanismo conosce un certo logoramento con l’avanzare dell’età e ciò spiega la relativa diminuzione del FEC nell’anziano. Altro parametro importante è la pressione parziale di CO2: al contrario della stabilità relativa alle variazioni di pressione, vi è una notevole variabilità del FEC in relazione alle variazione della PCO2 , con un aumento del flusso direttamente proporzionale all’aumento della PCO2. Ciò è molto importante nella regolazione del FEC in base all’attività: i territori attivi sono quelli che consumano più ossigeno, rilasciano più anidride carbonica e, quindi, ricevono un flusso maggiore. L’anziano preserva la capacità di differenziare il flusso in base alle aree cerebrali attive, ma, in virtù di una riduzione generale del FEC, porta comunque meno sangue alle aree attive. Ad esempio, sembra che proprio un ridotto FE in aree con elevata richiesta ematica, come quelle deputate alla memoria, causerebbe il logoramento di queste funzioni. Questo sembra imputabile all’incapacità di assicurare un’adeguata sintesi proteica per FEC <65 ml/100g: l’inadeguata sintesi proteica risulterebbe in una scarsa capacità di memorizzazione, che richiederebbe appunto un elevato flusso per la continua sintesi proteica finalizzata alla memorizzazione. In aggiunta, un parametro molto importante nel determinare il FEC è l’eventuale patologia sottostante, ed in particolare l’AS: l’AS determina la perdita dell’autoregolazione, con l’incapacità di assicurare un flusso adeguato già con una pressione arteriosa media di circa 100 mmHg e conseguente ipoperfusione cerebrale. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Segno premonitore della perdita dell’autoregolazione, e quindi della riduzione del FEC, è l’ipotensione ortostatica, tipica dell’anziano e dovuta all’abbassamento della diastolica all’assunzione della pressione eretta, con possibile sincope. Inoltre, in soggetti AS anche la capacità di variare il flusso in base alle variazioni di anidride carbonica è persa. Altre considerazioni fisiopatologiche È importante,da un punto di visto anche clinico‐terapeutico, considerare il danno che l’ipoperfusione comporta, non solo alle cellule neuronali, ma anche a quelle delle barriere emato‐encefalica ed emato‐liquorale, soprattutto a seguito di periodi ischemici prolungati. Infatti, la riperfusione successiva ad un’ischemia e ad un danno di queste barriere causa un passaggio di metaboliti tossici ematici nel cervello e nel liquor, con conseguenze peggiori a quelle dell’ischemia stessa. Inoltre, una sindrome ischemica può aversi, oltre che per ridotto apporto, per una diminuita capacità metabolizzante, come avviene in caso di mitocondropatie: in questo caso, a fronte di un’integrità del sistema circolatoria cerebrale e, quindi, di un adeguato apporto do ossigeno, vi è un’inadeguata capacità di utilizzare l’ossigeno, per un’alterazione del ciclo di Krebs, della catena respiratoria o della fosforilazione ossidativa, con una conseguente insufficiente quantità di ATP prodotta. La penombra ischemica Importantissimo è poi considerare il periodo di “penombra ischemica”, durante il quale vi è ischemia senza infarto, perdita di funzione senza perdita di vitalità. Questo periodo, come detto all’inizio, costituisce la vera finestra terapeutica, durante la quale un pronto intervento può ristabilire un recupero funzionale completo. Secondo Astrup, che la descrisse per primo, la penombra ischemica è “quel flusso che causa perdita di funzione, ma non di vitalità”. Secondo il professore, è però necessario aggiungere a questa definizione una dimensione temporale: questo concetto è stato inteso nelle suddette considerazioni. Ne risulta un concetto dinamico di penombra ischemica, per cui un certo flusso può provocare in un certo intervallo di tempo ischemia; ma, ad esempio, un flusso ridotto in maniera minore per intervalli di tempo prolungati può comunque provocare ischemia. Comunque, vi sarebbe, in caso di riduzione del FEC al di sotto di una determinata soglia, un immediata necrosi solo nel centro ischemico, contornato da una zona di penombra ischemica indenne che, in caso di prolungamento del danno, può essa stessa andare incontro a necrosi. Importante è considerare, poi, la reversibilità della penombra ischemica: fondamentale risulta, per evitare l’instaurarsi o l’estensione della lesione necrotica, un pronto intervento. Possono, tramite PET, distinguersi flussi di 50 mL/min/100g: fisiologico 22‐30 mL/min/100g: perdita di funzione, ma non di vitalità; prognosi buona 12‐22 mL/min/100g: perdita di funzione con perdita di vitalità in caso di prolungamento dell’ischemia; prognosi incerta <12 mL/min/100g: perdita di vitalità, oltre che di funzione, con necrosi ischemica ed impossibilità di recupero; prognosi cattiva Diversi studi sperimentali hanno consentito, negli ultimi anni, di chiarire una serie di aspettI: Il deficit clinico neurologico compare per flusso <30 mL/min/100g, per poi farsi sempre più marcato Esaminando con elettrodi la corteccia, è possibile rilevare, ancor prima della perdita di funzione, un’alterazione dei parametri elettrofisiologici, in particolare dei potenziali evocati La concentrazione di ATP intracellulare si riduce in maniera direttamente proporzionale alla riduzione del flusso In territorio di penombra, al di sotto dei 22 mL/min/100g, il rapporto intracellulare Na/K si riduce fIno ad invertirsi: ciò è dovuto al difetto della pompa Na/K per carenza di ATP, a sua volta secondaria a carenza di ossigeno L’aumento di sodio intracellulare determina, per inversione della pompa Na/Ca, un ingresso di calcio all’interno della cellula. Il calcio è particolarmente neurotossico. Il cloro esce dalla cellula. Ne deriva un quadro caratterizzata da aumento intracellulare di sodio e calcio ed aumento extracellulare di potassio e cloro Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Il consumo di glucosio, all’inizio della diminuzione del flusso, aumenta, per poi diminuire progressivamente: l’iniziale aumento del consumo è dovuto all’aumento della glicolisi anaerobica, nel tentativo di compensare la ridotta produzione aerobica di ATP. Questo ipermetabolismo anaerobico determina un’acidosi lattica tossica per il tessuto cerebrale. Infatti, si è dimostrato come l’infusione di una soluzione glucosata durante il periodo di penombra determina un peggioramento della prognosi (questo spiegherebbe in parte la prognosi peggiore in pazienti diabetici). La sintesi proteica è particolarmente sensibile alla riduzione del flusso, diminuendo, in aree caratterizzate da un’elevata sintesi proteica, come quelle deputate alla memorizzazione, già a valori di FEC più elevati di quelli medi (cioè a 70‐80 mL/min/100g). E’ bene considerare come sia la sintesi proteica media a diminuire, a fronte di un aumento della sintesi di proteine coinvolte nel danno ischemico e nella sua riparazione Tutti i neurotrasmettitori, sia inibitori che eccitatori, vengono liberati in caso di ischemia: in particolare, la depolarizzazione ischemica conseguente al deficit delle pompe e dei canali ionici, da riduzione dell’ATP induce ulteriore rilascio di neurotrasmettitori, in particolare eccitatori, quali glutammato ed aspartato, con amplificazione del danno, mediato soprattutto dai recettori NMDA I neurotrasmettitori eccitatori sono intermedi glicolitici del ciclo di Krebs e, probabilmente, la loro produzione aumenta durante le fasi di aumento di glicolisi anaerobica Effetti dell’edema e tipi di infarto L’emisfero infartuato aumenta di volume in conseguenza della citotossicità dell’ischemia: l’aumento di sodio intracellulare determina, per osmosi, un aumento dell’ingresso di acqua nella cellula con rigonfiamento cellulare; è questo l’edema citotossico. Questo tipo di edema si combatte terapeuticamente con agenti iperosmolari, cioè con soluzioni iperosmolari, per consentire una fuoriuscita, sempre per osmosi, di acqua dalle cellule. L’edema citotossico può condurre ad ipertensione focale che, se supera la pressione di perfusione, riduce ulteriormente il flusso sanguigno, instaurando un circolo vizioso che, in casi estremamente gravi, può condurre all’edema di un intero emisfero. Inoltre, l’edema citotossico può determinare il “fenomeno del non riflusso”, ossia il blocco della riperfusione a seguito dell’edema cellulare degli endoteliociti. Un altro tipo di edema è quello vasogenico, dovuto alle alterazioni delle barriere emato‐ encefalica ed emato‐
liquorale e contrastato dagli steroidi. Gli infarti, infine, possono essere: Pallidi: le aree infartuali sono prive di sangue Rossi od emorragici: le aree infartuali presentano uno stravaso ematico massivo. Gli infarti trombotici possono essere di entrambi i tipi, mentre quelli embolici sono solitamente rossi. Ovviamente anche gli infarti emorragici sono rossi. Misti Par III: Diagnosi Generalità In caso di sospetto di ictus, cioè in caso di deficit neurologico improvviso (perdita della vista, emiparesi, parestesia, perdita dell’equilibrio, afasia etc.), bisogna comportarsi con la stessa preoccupazione ed urgenza del sospetto di IMA . Solitamente, infatti, l’atteggiamento in cado di sospetto ictus è errato: il paziente, da parte sua ed a differenza della grande apprensione indotta dall’IMA e dall’angina sternale, concede poca importanza a sintomi quali afasia, parestesia etc, ritardando, e talvolta mancando, il ricovero. Il clinico, da parte sua, assume spesso un atteggiamento fatalistico, indotto dalla relativa assenza ed inefficacia dei trattamenti per l’ictus. Il primo esame da eseguire, comunque, è la TC, soprattutto in caso di disturbo neurologico ancora in corso e non rimesso. La TC va eseguita anche in caso di TIA: difatti, questi, seppur liberi da lesioni infartuali nei territori coinvolti, possono essere un campanello d’allarme per altri trombi che potrebbero esitare in ictus. In questi casi, ma generalmente in ogni caso, vanno ricercate le eventuali fonti trombigene od emboligene: la ricerca partirà dal cuore e dall’arco aortico per arrivare ai territori intracerebrali. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Quindi, la TC va eseguita in urgenza in primis per distinguere tra ictus ischemico od emorragico: l’ischemia può essere non visibile anche fino ad un’ora dopo l’esordio, mentre l’emorragia dà praticamente subito segno di sé. Inoltre, la TC può talvolta rivelare che è stato un tumore, soprattutto tumori metastatici, a dare una sindrome ictale. Discernere un ictus ischemico da uno emorragico è fondamentale sul piano terapeutico: una terapia antiaggregante od anticoagulante, somministrata per un sospetto di ischemia, sarebbe fatale in caso di emorragia. In caso di mancanza di segni alla TC, ma persistenza della sintomatologia per più di un’ora (fatto che esclude la diagnosi di un TIA), bisogna sempre procedere alla terapia antischemica. Diagnosi differenziale va posta con: • Emicrania con aura: in questo caso, che può portare deficit neurologici focali, più che il dolore, elemento discriminante è la ricorrenza degli episodi emicranici. Inoltre, l’emicrania è tipicamente giovanile • Epilessia focale: soprattutto nei casi con perdita di funzione (perdita del tono muscolare, assenze). Anche in questo caso discriminante è l’anamnesi • Lesioni cerebrali espansive: tumori, ematoma subdurale cronico, malformazioni vascolari • Cause non vascolari: coma ipoglicemico, malattia di Meniere, SM (amaurosi ad esordio acuto per la neurite ottica), isteria (in questo caso i segni neurologici sono assenti) • Nei pazienti con disturbi oculari: arterite gigantocellulare, ipertensione arteriosa maligna, glaucoma, edema papillare, altre affezioni non vascolari Territori di distribuzione e sindromi correlate • Arteria cerebrale media o Rami Branca superiore • Arteria prerolandica • Arteria rolandica • Arteria parietale anteriore Branca inferiore • Arteria parietale posteriore • Arteria temporale anteriore • Arteria temporale posteriore • Arteria angolare o Territori di distribuzione e sindromi correlate Area motoria somatica per la faccia e l’arto superiore e fibre discendenti dall’area per l’arto inferiore che entrano nella corona radiata: paralisi contro laterale di faccia, arto superiore ed inferiore Area sensitivo‐somatica per faccia, arto superiore e proiezioni talamo parietali per l’arto inferiore: deficit sensitivo contro laterale di faccia, arto superiore ed inferiore Area di Broca ed aree motrici circostanti dell’emisfero dominante: disturbi del linguaggio di tipo motorio Area di Broca e corteccia parieto‐occipitale dell’emisfero dominante: afasia centrale, sordità verbale, anomia, sindrome di Gerstmann (agrafia, acalculia, agnosia digitale, confusione destra‐sinistra) Lobo parietale non dominante: aprassie ed agnosie Radiazioni ottiche nella zone interessata della seconda circonvoluzione temporale: quadrantopsia od emianopsia omonima Area oculomotoria: paralisi dello sguardo dal lato opposto • Arteria cerebrale anteriore: si continua, nella porzione mediale del cervello, come arteria pericallosa, distaccando rami corticali che irrorano: o Area motoria per l’arto inferiore: paralisi del piede e della gamba contro laterali; paraplegia se bilaterale Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Area corticale per l’arto superiore o fibre discendenti verso la corona radiata: paresi di grado minore dell’arto superiore contro laterale o Area sensitiva per piede ed arto inferiore: anestesia corticale, di alluce, piede ed arto inferiore o Porzione postero‐mediale della circonvoluzione frontale superiore per la vescica (bilateralmente): incontinenza urinaria o Superficie mediale della parte posteriore del lobo frontale: riflesso di prensione controlaterale, riflesso di suzione, rigidità paratonica o Area prefrontale mediale: abulia, mutismo acinetico, apatia Arteria corioidea anteriore: nasce dalla carotide interna appena sopra l’origine della comunicante posteriore o Braccio posteriore della capsula interna: emiplegia contro laterale o Tratti talamo‐corticali: emiipostesia o Tratto genicolo‐calcarino: emianopsia omonima. Quindi, questa sindrome è ben caratterizzata in presenza di estese alterazioni motorie, sensitive e visive, con linguaggio e funzioni cognitive ben conservate Arteria cerebrale posteriore o Rami Segmento circolare o prossimale: irrora gran parte delle strutture cerebrali profonde Segmento corticale o distale • Arteria occipitale laterale: porzioni latero‐basali del lobo temporale ed occipitale • Arteria occipitale mediale: splenio, cuneo, precuneo, circonvoluzione calcarina, polo occipitale, lobo occipitale latero‐basale o Territori di distribuzione e sindromi Territorio centrale • Nucleo postero‐laterale del talamo, nucleo subtalamico o delle sue connessioni con il pallido: sindrome talamica (anestesia per tutte le modalità, dolore spontaneo e disestesie), coreoatetosi, emiballismo • Tratto dentato‐talamico e radice del III nervo cranico: sindrome talamo‐perforata: o Atassia cerebellare superiore crociata o Sindrome di Claude: atassia cerebellare inferiore crociata con paralisi del III nervo cranico • Peduncolo cerebrale: emiplegia controlaterale • Radice del III nervo cranico e peduncolo cerebrale: sindrome di Weber: paralisi del III nervo cranico ed emiplegia contro laterale Territorio periferico • Corteccia calcarina o radiazione ottica: emianopsia omonima • Lobo occipitale bilaterale con possibile interessamento delle aree parieto‐
occipitali: emianopsia omonima bilaterale, cecità corticale, sindrome di Anton • Lobo temporale, bilaterali o dal lato dominante: deficit di memoria • Aree visive associative: proposagnosia, disorientamento topografico, simultaneoagnosia o
•
•
Tecniche d’imaging Le tecniche d’imaging consentono uno studio clinico sempre più accurato delle vittime di un ictus, identificando sia la lesione cerebrale, sia il vaso sanguigno colpito: • TC: identifica anche fenomeni di scarsa entità come emorragie, infarti emorragici, raccolte ematiche subaracnoidee, aree di necrosi infartuate e malformazioni AV • RM: mette in evidenza queste lesioni ed, in aggiunta, consente di visualizzare carenze di flusso nei vasi, alterazioni conseguenti a necrosi ischemica e gliosi. Si è dimostrata, inoltre, vantaggiosa nell’evidenziare piccole lesioni lacunari emisferiche a sede profonda e nel dimostrare anomalie nel tronco encefalico, regione poco visibile alla TC Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Tecnica pesata in diffusione: consente di individuare una lesioni infartuale entro pochi minuti dall’ictus Ecografia Doppler: consente di dimostrare placche ateromasiche e stenosi dei grossi vasi. il Doppler intracranico dimostra in modo accurato le stenosi e le occlusioni dei grossi vasi intracranici, così come la presenza di aneurismi, MAV ed altre patologie Angio‐RM e veno‐RM Puntura lombare: indica il passaggio di sangue nel liquor Par IV: Terapia Protocollo terapeutico • Assistenza intensiva delle funzioni vitali e dei principali metabolismi, da iniziare immediatamente dopo l’ictus (nell’ambulanza) • Correzione dell’ipertermia e dell’iperglicemia, che predispongono all’ictus progressivo, con prognosi negativa: l’uso di soluzioni glicemiche è quindi controindicato. In caso di febbre, occorre una pronta terapia antipiretica con eventuale individuazione del focolaio infettivo seguita da un’efficace terapia antibiotica. In pazienti immunocompetenti non è indicata una profilassi antibiotica • Terapia trombolitica endovenosa (più diffusa) od intrarteriosa (più efficace perché va direttamente nell’arteria coinvolta) con r‐tPA (attivatore del plasminogeno tissutale ricombinante), dopo la TC, entro 3 ore dall’esordio (ma l’alteplase migliora l’outcome anche tra 3 e 4,5 ore), il 10% in bolo ed il 90% in infusione o Razionale terapeutico: in caso di trombo, l’occlusione determina una necrosi immediata nel centro ischemico irreversibile. Tuttavia, i deficit neurologici funzionali possono considerarsi dovuti piuttosto all’ipoperfusione delle zone adiacenti di penombra ischemica, che, in caso di ostruzione prolungata, vanno anch’esse incontro a necrosi, nel giro più o meno di 3 ore, con irreversibilità del danno neuologico. Se, tuttavia, si procede ad una pronta, cioè in meno di 3 ore, terapia trombolitica, si potranno evitare la necrosi delle zone di penombra ischemica ed il conseguente danno neurologico permanente. In realtà il territorio di penombra ischemica può andare incontro a necrosi in un lasso di tempo maggiore, anche di giorni: tuttavia, entro 3 ore si manifesta, nel centro ischemico, un’alterazione della BEE. Conseguentemente, una riperfusione dopo 3 ore, e cioè dopo l’instaurarsi del danno della BEE, comporterà uno stravaso di sangue dai vasi al tessuto cerebrale, con edema cerebrale e peggioramento della prognosi o Criteri d’inclusione Età maggiore di 18 anni Deficit neurologici misurati con scala NINDS compresi tra 6 e 30: in caso di deficit più lievi il rapporto rischi/benefici è maggiore; in caso di deficit più gravi la probabile alterazione della BEE indurrebbe un peggioramento della prognosi a seguito della rivascolarizzazione con infarto rosso Esordio < 3 ore o Criteri d’esclusione Evidenza di emorragia intracranica alla TC Sintomi minori o in rapido miglioramento Presentazione clinica suggestiva di emorragia subaracnoidea Emorragia interna in atto Diatesi emorragica con: • Conta piastrinica <100mila/mm3 • Somministrazione di eparina entro 48 ore con aumento dell’aPTT • Trattamento in corso o recente con anticoagulanti orali con aumento del PT (>15 secondi) Interventi chirurgici maggiori o gravi traumi nei 14 giorni precedenti Storia di emorragia del tratto gastro‐intestinale od urinario nei 21 giorni precedenti Recente puntura arteriosa in siti non comprimibili o puntura lombare Ipertensione non controllata (sistolica >185 mmHg o diastolica >110 mmHg) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
Storia di emorragia intracranica Alterazione dei livelli glicemici (<50 o >400 mg/dL) Post‐infarto miocardico Crisi epilettiche all’esordio Malformazioni artero‐venose o aneurismi noti o Nuove proposte con finestra temporale maggiore IST‐3: r‐tPA entro 6 ore dall’esordio dei sintomi, in pazienti selezionati con MRI. Desmoteplase (nuovo attivatore del plasminogeno): entro 9 ore dall’esordio dei sintomi, in pazienti selezionati con MRI Terapia antiaggregante e/o anticoagulante in caso di controindicazione alla terapia trombolitica, è controindicata in caso di ictus emorragico o ASA: 300 mg per os/ev pro die per 2 settimane, seguita da 100 mg pro die o ASA + dipiridamolo, clopidogrel, ticlopidina o Eparina ev: In pazienti con dissecazione dei grossi tronchi arteriosi Nei casi di stenosi subocclusiva in attesa di trattamento chirurgico In pazienti con eziologia cardioembolica ad elevato rischio di recidiva precoce (aPTT 1,5‐2,5 il valore basale) Terapia anticoagulante orale: pazienti con ictus cardioembolico a basso rischio di recidiva precoce Terapia antiedema iperosmolare, se necessaria, da iniziare immediatamente dopo la TC: mannitolo o glicerolo. I corticosteroidi, invece, sono controindicati in quanto non sono attivi sull’edema da ictus (citotossico) ed aumentano il rischio di infezioni; inoltre, aumentano la pressione arteriosa e la glicemia. Anche l’uso di soluzioni ipotoniche è controindicato per l’evidente peggioramento dell’edema citotossico. Eventuale terapia citoprotettiva per aumentare la probabilità di successo del protocollo Prevenzione delle trombosi venose profonde in pazienti a rischio elevato (pazienti plegici, con alterazione dello stato di coscienza, obesi, con pregressa patologia venosa agli arti inferiori): eparina a basso PM Neuroprotezione: statine (atorvastatina; agirebbero riducendo l’infiammazione nei tessuti ischemici), ipotermia (di difficile applicazione clinica), antiepilettici (topiramato; riducono l’attività neuronale e, quindi, la richiesta di ATP) Protocollo per la prevenzione • Controllo della pressione arteriosa • Statine, anche in pazienti non iperlipemici • Eventuale terapia del DM • Endoarteriectomia carotidea o In caso di stenosi sintomatica (cioè con episodi ischemici cerebrali od oculari negli ultimi 3 mesi) maggiore o uguale al 70% del lume o In caso di stenosi sintomatica tra il 50 ed il 69% del lume per un miglior out come, rispetto alla terapia medica, nel medio‐lungo termine, specie in pazienti a più alto rischio, cioè con: Ischemia recente Sintomi cerebrali piuttosto che oculari Placca ulcerata Età avanzata Maschi o Non indicata in caso di stenosi inferiori al 50% del lume • Endoarteriectomia carotidea precoce, cioè entro 2 settimane, in caso di TIA o di stenosi maggiori al 50% del lume • Terapia antiaggregante o ASA Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
ASA+dipiridamolo: in caso di scarsa efficacia della sola aspirina, più efficace nella prevenzione secondaria in caso di patologie dei piccoli vasi o Clopidogrel: in caso di patologie dei grandi vasi o Ticlopidina o ASA+clopidogrel od ASA+ticlopidina: non è indicata perché comporta un aumento dei rischi emorragici Terapia anticoagulante: warfarin sodico nei pazienti affetti da fibrillazione atriale o da patologie ad alto rischio emboligeno o
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
PARTE 2: NEUROCHIRURGIA: APPUNTI DELLE LEZIONI DEI PROFF. MORACI E ROTONDO, INTEGRATI CON L’ “ADAMS & VICTOR” E CON IL “MORACI E PARLATO” LEZ I PROF. ROTONDO Emorragia cerebrale Par I: Generalità Introduzione L’emorragia cerebrale, definibile come la formazione di una raccolta ematica localizzata nel parenchima cerebrale, può essere di due tipi: • Intracerebrale: il sangue filtra dal vaso (generalmente una piccola arteria) direttamente nel parenchima cerebrale, formando un ematoma e propagandosi, talvolta, ai ventricoli e di qui allo spazio subaracnoideo (SSA). Al termine dell’emorragia, il sangue si decompone lentamente e viene riassorbito nell’arco di settimane o mesi. Comunque, la massa di sangue coagulato provoca distruzione fisica del tessuto ed esercita una pressione sul circostante parenchima cerebrale • Subaracnoidea: ha origine da una dilatazione aneurismatica nei punti di biforcazione delle grandi arterie del poligono di Willis: l’emorragia è quasi del tutto confinata agli SSA e causa scarsi effetti focali immediati sul cervello, differendo quindi dalle altre sindromi ictali. Tuttavia, il sangue presente nello SSA, se abbondante, può causare ischemia cerebrale tardiva attraverso un meccanismo di costrizione dei vasi del circolo di Willis e dei loro rami principali (vasospasmo) Le cause di emorragia cerebrale sono: • Ipertensione ed AS (emorragia intracerebrale primaria od ipertensiva) • Rottura di un aneurisma sacciforme • Rottura di una MAV • Angioma cavernoso • Trauma, compresa l’apoplessia post‐traumatica ritardata • Malattie emorragiche: leucemia, anemia aplastica, porpora trombocitopenia, epatopatie, complicanze della terapia anticoagulante o trombolitica, ipofibrinogenemia, emofilia • Tumore primario o secondario cerebrale • Embolia settica, aneurisma micotico • Amiloidosi cerebrovascolare • Miscellanea: farmaci vasopressori, cocaina, patologie infiammatorie o infettive dei vasi Le cause più comuni possono essere riconducibili o all’ipertensione o a malformazioni vascolari (aneurisma, MAV, angioma cavernoso). Par II: Emoraggia intracerebrale primaria o ipertensiva Generalità Si tratta della comune e ben nota emorragia cerebrale “spontanea”, dovuta principalmente all’ipertensione cronica con degenerazione delle arterie cerebrali. Le sedi più comunemente interessate sono: • Putamen e l’adiacente capsula interna (50%, “tipiche”) • Talamo • Caudato (rientra sempre nelle emorragie tipiche, le seguenti si considerano atipiche) • Sostanza bianca centrale dei lobi occipitali, temporali, parietali e frontali (emorragie lobari) • Ponte • Emisfero cerebellare Se nei quadri tipici la lesione è generalmente su base ipertensiva, in quelli atipici la lesione riconosce diverse cause: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
• Giovani: anomalie vascolari • Età media: anomalie vascolari, neoplasie • Anziani: ipertensione arteriosa, neoplasie, coagulopatie, anomalie vascolari Il vaso interessato è generalmente un’arteria perforante. Circa il 2% delle emorragie primarie è multiplo. La lesione sembra riconoscere spesso una predisposizione genetica: gli aneurismi miliari di Charcot‐Bouchard, piccoli aneurismi dovuti all’alterazione della parete arteriosa indotta dall’ipertensione e dall’AS. Alcuni dati epidemiologici riportano: • Un’incidenza maggiore nelle donne (1,6:1) • Incidenza in aumento con l’età, in particolare dopo i 45 anni, con un ulteriore incremento dopo gli 80 anni • Elevata incidenza di mortalità e morbilità Anatomia patologica Lo stravaso forma una massa grossolanamente circolare od ovale che disgrega il tessuto e si accresce man mano che l’emorragia aumenta: il tessuto cerebrale circostante viene spostato e compresso. In caso di emorragia cospicua, le strutture della linea mediana vengono spostate verso il lato e vengono danneggiati i centri reticolari di attivazione ed il centro respiratorio, portando a coma, arresto respiratorio e morte. L’emorragia può spesso coinvolgere il sistema ventricolare, esitando in un liquor ematico. In seguito all’emorragia, intorno al coagulo, si determina un edema che accentua l’effetto massa; può verificarsi idrocefalo come conseguenza del sanguinamento nel sistema ventricolare o nelle cisterne basali o per compressione del terzo ventricolo. Quadro clinico Si hanno, in generale: • Segni di ipertensione endocranica: o Ipertensione arteriosa acuta reattiva all’emorragia o Vomito: è molto più frequente che negli infarti o Cefalea grave: questi primi 3 sintomi, specie se accompagnati da sintomi focali, sono i più importanti nell’indirizzare al sospetto di emorragia intracranica o Rigidità nucale o Altri meno frequenti: papilledema, stupor, coma (nei casi gravi) • Segni focali: emiplegia, disturbi del linguaggio, crisi epilettiche focali Comunque, fra tutte le MCV l’emorragia cerebrale (“apoplessia”) è la più drammatica: il prototipo è rappresentato da un individuo di sesso maschile, pletorico ed iperteso che, in piena salute, cade a terra privo di sensi, ha un respiro stertoroso e muore in poche ore. Nei casi meno drammatici il quadro evolve più gradualmente, in maniera più simile ad un ictus ischemico. Possono aversi quadri specifici: • Emorragia del putamen: è la più frequente e solitamente coinvolge l’adiacente capsula interna. Si presenta con: o Emiplegia controlaterale da lesione della capsula o Occhi deviati dal lato opposto a quello degli arti paretici o Segni generici: vomito, cefalea, confusione, stupor o Negli stadi più avanzati: coma per coinvolgimento del tronco encefalico, segno di Babinski bilaterale, respiro profondo ed irregolare per coinvolgimento dei centri del respiro, pupille fisse e dilatate, rigidità decerebrata • Emorragia talamica: spesso può associarsi ad emorragia del putamen, è caratterizzata da: o Grave deficit sensitivo di tutta la metà controlaterale del corpo o Emiplegia contro laterale per coinvolgimento della capsula interna o Afasia di Wernicke in caso di coinvolgimento dell’emisfero dominante o Amorfosintesi e neglect contro laterale in caso di coinvolgimento dell’emisfero non dominante Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Deficit del campo visivo Disturbi oculari per coinvolgimento del mesencefalo: Pseudo‐paralisi degli abducenti con rotazione asimmetrica degli occhi verso l’interno Paralisi verticale e laterale dello sguardo Anisocoria con assenza di reazione alla luce Occhi deviati dal lato opposto agli arti paretici Ptosi ipsilaterale Miosi Assenza di convergenza o Idrocefalo da compressione del terzo ventricolo Emorragia pontina o Coma profondo in pochi minuti o Plegia diffusa o Pupille miotiche o Rigidità decerebrata Emorragia cerebellare o Vomito ripetuto o Cefalea occipitale o Vertigine o Incapacità a mantenere la posizione eretta ed a deambulare o Nistagmo ed atassia cerebellare più raramente o Altro: ipostenia facciale omolaterale, ridotto riflesso corneale, disartria, disfagia, alterazioni dei movimenti oculari o Segni gravi: stupor, coma, alterazioni del respiro Emorragia lobare: non è generalmente dovuta ad ipertensione, ma, più frequentemente, a terapia anticoagulante o tromb litica, MAV, traumi e, nell’anziano, amiloidosi dei vasi cerebrali o Lobo occipitale: dolore attorno all’occhio ed emianopsia omonima o Lobo temporale: dolore in sede mastoidea, emianopsia parziale ed afasia fluente o Lobo frontale: emiplegia controlaterale e cefalea frontale o Lobo parietale: deficit sensitivo controlaterale e cefalea o
o
•
•
•
Diagnosi Si avvale di: • Indagini di base o Monitoraggio della pressione intracranica o Monitoraggio della pressione arteriosa o Stadiazione clinica secondo Glasgow Coma Scale o Esami laboratoristici di base o Screening urine e sangue per evidenziare l’eventuale utilizzo di droghe • TC cranio‐encefalica: è essenziale nelle prime 24 ore ed utile nel follow‐up o Stadio iperacuto (0‐4 ore): iperdensità eterogenea da ematoma in formazione o Stadio acuto (5‐72 ore): iperdensità omogenea o Stadio subacuto (4‐21 giorni): isodensità progressiva dalla periferia al centro o Stadio cronico (dopo 22 giorni): ipodensità con tendenza alla formazione di cisti malaciche • RM: è essenziale per piccoli ematomi del tronco encefalo ed utile per le fasi subacute e croniche o Stadio iperacuto: isointenso al parenchima cerebrale (sangue saturato d’ossigeno) o Stadio acuto: ipointenso al parenchima cerebrale (desossiemoglobina) o Stadio subacuto: Metaemoglobina intracellulare: iper in T1, ipo in T2 Metaemoglobina extracellulare: iper in T1 e T2 Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Stadio cronico: Cisti malacica: ipo in T1, iper in T2 Cercine ipointensi in T2 per effetto paramagnetico dell’emosiderina Angiografia: convenzionale, angio‐TC, amgio‐RM o
•
Terapia • Adeguata ventilazione • Controllo dell’edema (mannitolo) • Tecniche chirurgiche mininvasive: consentono una minima esposizione cerebrale, un approccio attraverso aree non elquenti ed una minima retrazione cerebrale o Indicazioni alla chirurgia: severità e progressione dell’alterazione dei livelli di coscienza e dei deficit neurologici Emorragia intracranica medio grande esterna ai nuclei basali Evoluzione clinica progressiva ma non fulminante Ipertensione arteriosa controllabile farmacologicamente Età <75 anni o Fattori che influenzano la scelta chirurgica Condizioni cliniche ed età del paziente Sito e dimensione dell’ematoma Qualità di vita post‐operatoria o Tecniche Microscopio: chirurgia “open” con lembi epicentrati Endoscopio Neuronavigatore Stereotassi Par III: Malformazioni AV cerebrali Generalità Consistono in un groviglio di vasi dilatati, formato da diversi peduncoli arteriosi e diverse vene di scarico riunite da una serie inestricabile di vasi anomali, che crea un’anomalia di comunicazione tra il sistema arterioso e quello venoso, cioè una vera fistola AV. Quindi, risulta formato da: • Arterie: terminali, passanti con partecipazione, passanti senza partecipazione • Vene: proprie, accessorie, funzionali • Nido Si tratta di un’anomalia di sviluppo legata alla persistenza di un modello vascolare embrionale, non di una neoplasia, sebbene i vasi che la costituiscono proliferino e si ingrandiscano col passare degli anni. Le dimensioni delle malformazioni vascolari sono variabili, da una piccola imperfezione di pochi mm di diametro localizzata nella corteccia o nella sostanza bianca, fino ad un’enorme ammasso di canali tortuosi. In prossimità della lesione principale possono individuarsi arterie afferenti ipertrofiche e dilatate, che si suddividono in una rete di vasi sanguigni a parete sottile, che vanno direttamente a collegarsi con le vene drenanti. Il groviglio vascolare interposto è formato da vasi eccessivamente sottili. Le MAV possono essere localizzate in tutte le parti del cervello, del tronco encefalico, del cervelletto e del midollo spinale, ma le più ampie si osservano in corrispondenza della parte centrale di un emisfero cerebrale e formano di solito una lesione a forma di cuneo, che si estende dalla corteccia al ventricolo. Pertanto, il sanguinamento è più frequentemente intracerebrale che subaracnoideo. Inoltre, morbilità e mortalità sono correlate al rischio di sanguinamento, quindi peggiori in fossa cranica posteriore. Quadro clinico • Esordio solitamente intorno ai 10‐30 anni Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
Sanguinamento Crisi epilettiche Cefalea Deficit neurologici progressivi per compressione e per “furto intracerebrale” Idrocefalo per aumentato afflusso alla vena di Galeno Diagnosi come sopra Terapia • Chirurgia: trattamento di scelta, l’obiettivo è l’exeresi totale, che elimina immediatamente il rischio di emorragia. La tecnica prevede: o Ampia esposizione o Dissezione circumferenziale del nido o Riconoscimento degli elementi arteriosi: Chiusura arterie terminali ed a pettine Identificazione e risparmio arterie passanti o Chiusura collettore venoso in uscita dal nido • Radiochirurgia stereotassica: trattamento accettato per MAV piccole e/o rotonde (nido 2‐3 cm). Il rischio persiste per 1‐3 anni • Embolizzazione: facilita come procedura iniziale quelle chirurgiche (MAV ad alto flusso) e radiochirurgiche. Inadeguata da sola per l’obliterazione permanente della MAV, che può ricanalizzarsi. Richiede procedure multiple e può indurre effetti emodinamici acuti Par IV: Angioma cavernoso È un alveare di spazi vascolari contenenti sangue in circolazione molto lenta: l’arteria afferente e la vena di drenaggio sono molto piccole, non dimostrabili agli esami neuroradiologici. La diagnosi è basata sulle manifestazioni cliniche, simili ma più lievi di quelle delle MAV, e sulla RM, che nelle immagini pesate in T1 evidenzia un groviglio di vasi circondato da un’ampia zona di ferritina ipodensa. Circa la metà degli angiomi cavernosi si trova nel tronco cerebrale ed in passato molti dei sintomi venivano erroneamente interpretati come segni di SM, per l’evoluzione “a gradini” dei defici neurologici. Anche in questo caso, le lesioni sono solitamente intracerebrali. La grandezza è variabile: comunque, la maggior parte delle lesioni, al momento del riconoscimento clinico, è del diametro di 1,5‐3 cm. Inoltre, il tessuto nervoso circostante può andare incontro a gliosi ed è di colorito giallo, per le piccole e ripetute emorragie. La clinica è caratterizzata da: • Possibile silenzio clinico • Cefalea • Epilessia: irritazione chimica dei neuroni da parte di pigmenti ematici contenenti ferro • Emorragia L’angiografia cerebrale è: • Indicata: pazienti con ematomi a sede atipica; pazienti giovani • Controindicata: pazienti anziani ed ipertesi con ematomi a sede tipica La terapia può essere: • Medica: nei cavernomi diagnosticati casualmente, quindi in assenza di sintomatologia, basta il monitoraggio clinico e strumentale tramite RM • Chirurgica: le lesioni sottotentoriali hanno un più alto rischio di sanguinamento ed un comportamento clinicamente più aggressivo. È richiesta, pertanto, una terapia microchirurgica. Nelle lesioni profonde e troncoencefaliche sarebbe indicata la radiochirurgia stereotassica. L’asportazione in blocco del cavernoma e Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
della lesione satellite è indicata in pazienti con presentazione clinica di emorragia o di crisi convulsive intrattabili. Importante comunque è l’identificazione della sede: o Sedi accessibili: AC sanguinanti, con deficit focali o diagnosticati occasionalmente o Sedi non accessibili: AC risanguinanti, AC fortemente sintomatico del ponte Prevenzione secondaria: o Monitoraggio intensivo o Prevenzione del vasospasmo sintomatico o Controllo angiografico Par V: Emorragia subaracnoidea (rottura di un aneurisma sacciforme) Generalità Un aneurisma è una dilatazione circoscritta di un tratto di parete arteriosa, dotata o meno di un colletto (sacciformi o fusiformi). Gli aneurismi sacciformi hanno la forma di piccole bolle dalla parete sottile che protrudono dalle arterie del circolo di Willis o dai sui maggiori rami: la loro rottura determina il passaggio di sangue circolante ad alta pressione nello spazio subaracnoideo. Di regola, gli aneurismi si localizzano a livello delle biforcazioni e delle diramazioni e derivano da disturbi di sviluppo della media e della lamina elastica. Il processo aneurismatico inizierebbe con la distruzione focale della membrana elastica interna, provocata da forze emodinamiche agli apici della biforcazione: come risultato della debolezza locale, l’intima protrude, coperta solo dall’avventizia, la sacca gradualmente si espande e, infine, si verifica la rottura. Nel 20% dei casi gli aneurismi sono multipli, l’incidenza aumenta gradualmente fino a raggiungere un picco tra i 35 ed i 65 anni (quindi, non andrebbero considerati come un difetto interamente genetico, ma come il risultato di diversi fattori lesivi su di un substrato fortemente compromesso). Le localizzazioni più comuni sono a livello del poligono di Willis: • In prossimità dell’arteria comunicante anteriore • All’origine dell’arteria comunicante posteriore a partire dalla radici della carotide interna • Alla prima importante biforcazione dell’arteria cerebrale media • Alla biforcazione della carotide interna con le arterie cerebrali media ed anteriore • Altro: carotide interna nel seno cavernoso, origine dell’arteria oftalmica, giunzione dell’arteria comunicante posteriore con la cerebrale posteriore, biforcazione dell’arteria basilare, le origini delle 3 arterie cerebellari Quindi un aneurisma intracranico può definirsi come una dilatazione localizzata, solitamente sacciforme, della parete di un’arteria cerebrale del poligono di Willis. Oltre all’aneurisma sacciforme si conoscono diversi tipi di aneurismi: micotici (dovuti ad un embolo settico che indebolisce la parete vasale), fusiformi, diffusi o globosi (questi ultimi 3 prendono il nome dalla forma e sono solitamente di origine AS). Tra le cause di emorragia subaracnoidea si ricordano: • Aneurismi (vedi sopra) • MAV, discrasie ematiche, malattie del collageno, tumori • Sine causa: microaneurismi (o aneurismi criptici) Quadro clinico • Esordio spesso correlato all’attività fisica o sforzi che aumentino la pressione ematica • Cefalea improvvisa nucale a “colpo di pugnale” seguita talvolta da incoscienza ed accompagnata da confusione e sonnolenza • Coma, talvolta fino alla morte, accompagnato da alterazioni del respiro e della cricolazione • Aumento della pressione intracranica fino alla diminuzione della FEC con sindrome ischemica • Meningismo • Fotofobia • Vomito Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
•
•
•
•
Crisi convulsive Deficit dell’oculomotore per lesioni della comunicante posteriore (nel punto d’unione tra questa arteria ed il tronco della carotide interna) Deficit dell’abducente e del faciale per lesioni a livello della fossa posteriore, solitamente da compressione Paralisi transitoria di uno o entrambi gli arti inferiori: aneurisma della comunicante anteriore, che ostacola la circolazione nelle cerebrali anteriori Emiparesi o afasia: aneurisma a livello della biforcazione principale della cerebrale media Emorragia subialoidea Sindrome pseudo tumorale Sindrome del seno cavernoso con idrocefalo e compressione dei suddetti nervi cranici Storia naturale: o Risanguinamento: 30% dei casi nei primi giorni o Ischemia da vasospasmo: il picco d’incidenza è intorno al 14° giorno Patogenesi: un’emiplegia ritardata od altri deficit focali compaiono generalmente da 3 a 12 giorni dopo la rottura. Questi deterioramenti tardivi, insieme con il restringimento focale visibile tramite angiografia di una o più arterie di grandi dimensioni, sono riuniti sotto il termine “vasospasmo”. Questo sembra essere un effetto diretto del sangue o di qualche prodotto di degradazione sull’avventizia delle arterie: in tali casi, il reperto autoptico consiste in aree d’infarto ischemico nel territorio del vaso sede dell’aneurisma, senza trombosi od altre alterazioni del vaso stesso Clinica: dipende dal vaso arterioso lesionato; frequenti sono uno stato confusionale ingravescente accompagnato da emiparesi o afasia Diagnosi • Valutazione angiografica (angio‐RM, angio‐TC) • Doppler transcranico o Idrocefalo Acuto: per passaggio di sangue nel sistema ventricolare Subacuto: per ostruzione delle vie liquorali o Infarcimento cerebrale o Ematoma intracerebrale o Complicanze extracraniche Infarto miocardico Aritmie Edema polmonare Ulcera gastrica Diagnosi differenziale con: MAV, emorragie cerebrali primitive, meningiti, tumori sanguinanti, discrasie ematiche, malattie del collageno (LES), apoplessia pituitarica Diagnosi • TC senza mdc: è in grado di individuare il sangue a livello locale o diffuso nello SSA o nell’ambito del parenchima cerebrale, oppure nel sistema ventricolare il sangue fresco appare iperdenso e si diffonde lungo le cisterna • RM: soprattutto con tecnica FLAIR (recupero d’inversione ad attenuazione liquida) • Puntura lombare Terapia • Antipertensiva • Antivasospastica: iperidratazione, nimodipina, neuroprotezione • Endovascolare • Chirurgica Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
Tipi: clipping, trapping, wrapping Tempo d’intervento chirurgico Early surgey: 24‐72 ore Delayed surgery: >72 ore Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ I PROF MORACI NEUROCHIRURGIA Alterazioni del liquor e della circolazione liquorale Par I: Il liquido cerebrospinale Fisiologia del liquido cerebrospinale (LCS) La funzione principale del LCS sembra di tipo meccanico: il liquor si comporta, infatti, come una sorta di “camicia d’acqua” per midollo spinale e cervello, proteggendoli da colpi potenzialmente dannosi alla colonna vertebrale od al cranio e da cambiamenti acuti della pressione venosa. Inoltre fornisce una spinta idrostatica al cervello, cosicchè quest’ultimo galleggia nel liquor. Data, inoltre, l’assenza di vasi linfatici nel cervello e nel midollo spinale, il liquor, attraverso la sua “azione di scarico” serve a rimuovere i prodotti di rifiuto del metabolismo cerebrale, come CO2, lattato ed H+. Il liquor, insieme al liquido intercellulare cerebrale, contribuisce a preservare un ambiente chimicamente stabile per i neuroni e le loro fibre mieliniche. Nell’adulto il volume intracranico medio è di 1700 mL: il volume del cervello è 1200‐1400 mL, quello del liquor di 70‐
160 mL, quello del sangue di 150 mL. La velocità di formazione del liquor è di circa 500 mL/gg (circa 20 mL/ora): quindi il liquor viene ricambiato circa 4 volte al giorno. Con l’avanzare dell’età si assiste ad una diminuzione della produzione.. Formazione del liquor I plessi corioidei, situati nel pavimento dei ventricoli laterali e del terzo e del quarto ventricolo, sono le sedi principali di formazione del LCS. Le sottili pareti vasali dei plessi corioidei consentono la diffusione passiva di sostanze dal plasma allo spazio extracellulare che circonda le cellule corioidee; inoltre, le cellule epiteliali corioidee hanno la capacità di secrezione tramite trasporto attivo ATP‐dipendente. Il trasporto del sodio, principale catione del liquor, si realizza, infatti, in corrispondenza della superficie apicale delle cellule del plesso corioideo grazie ad una pompa a scambio ionico sodio‐potassio ATP‐dipendente (i farmaci che la inibiscono inibiscono la formazione del liquor). Alla secrezione del sodio segue il passaggio dell’acqua. La produzione di liquor è costante, non influenzata dalle variazioni dei parametri vitali. Circolazione del liquor Dalla sua principale sede di formazione, cioè il plesso corioideo dei ventricoli laterali, il LCS fluisce verso il basso attraverso il forame di Monroe, il terzo ventricolo, l’acquedotto di Silvio ed il quarto ventricolo. Attraverso i forami di Magendie medialmente e di Luschka lateralmente alla base del bulbo, entra negli spazi subaracnoidei perimidollari e perispinali; quindi, risale il tronco cerebrale, arrivando alle cisterne ambiens e basale attraverso l’apertura del tentorio, per giungere infine alle superfici superiore e laterale degli emisferi cerebrali, dove viene in gran parte riassorbito. Nel caso di ostruzione di questo sistema, la pressione transparietale sale, comprimendo i tessuti periventricolari e causando dilatazione dei ventricoli e flusso transependimale di liquor. Il liquor viene riassorbito tramite i villi aracnoidei, protrusioni microscopiche dell’aracnoide che penetrano nella dura e protrudono nel seno sagittale superiore ed in altre strutture venose. Numerosi villi sono agglomerati in queste stazioni a formare le granulazioni (corpi di Pacchioni): il riassorbimento avviene passivamente per gradiente di pressione. Gli spazi subaracnoidei principalmente coinvolti sono quelli intracranici, della base e delle convessità, e spinali. Volume e pressione Gli aumenti di pressione arteriosa cerebrale fanno aumentare poco la pressione del liquor per un meccanismo di autoregolazione. Al contrario, l’aumento di pressione venosa esercita un’azione quasi immediata sulla pressione liquorale, aumentando il volume ematico in vene e venule cerebrali e nei seni durali, con aumento di volume del liquor. Quindi, un aumento della pressione intracranica può aversi per scompenso cardiaco e per tumori del mediastino con compressione della cava superiore. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
L’aumento della Pco2 determina una diminuzione del pH liquorale: ne conseguono vasodilatazione cerebrale ed ipertensione endocranica. Il cranio ed il canale vertebrale integri, insieme con la dura madre, relativamente indeformabile, formano un contenitore rigido, cosicchè l’aumento di un elemento qualsiasi del suo contenuto (cervello, sangue o liquor) causerà un innalzamento della PIC. Inoltre, un aumento di uno dei 3 deve avvenire a spese degli altri due: ad esempio, piccoli incrementi del volume cerebrale non fanno innalzare immediatamente la PIC, grazie all’azione controbilanciante dello spostamento del liquor dalla cavità cranica a quella spinale. Una volta esaurite queste misure di compenso, una massa all’interno del compartimento durale porta a dislocazione del cervello da un distretto a quello adiacente. Ogni ulteriore aumento del volume cerebrale riduce il volume del sangue intracranico contenuto nelle vene e nei seni durali. Una volta superato un certo volume, ed esauriti i meccanismi di compenso, la PIC aumenta in maniera esponenziale: se la PIC si avvicina alla pressione di perfusione arteriosa intracranica il volume di perfusione cerebrale risulta ridotto, fino all’ischemia cerebrale ed alla morte. Cause di ipertensione endocranica • Massa cerebrale od extracerebrale: tumore cranico, infarto massivo con edema, contusione traumatica estesa, ematoma parenchimale, subdruale od extradurale, un ascesso. Queste forme tendono ad essere localizzate ed a deformare il tessuto cerebrale adiacente • Rigonfiamento cerebrale generalizzato: stati ischemico‐anossici, insufficienza epatica acuta, encefalopatia ipertensiva, ipercapnia, sindrome epatocerebrale di Reye. In questi casi l’aumento di PIC riduce la pressione di perfusione cerebrale, ma gli spostamenti tissutali sono minimi perché l’effetto massa è ampiamente distribuito in tutto il contenuto cranico • Aumento della pressione venosa: trombosi dei seni venosi cerebrali, insufficienza cardiaca, ostruzione delle vene mediastiniche superiori o giugulari • Ostruzione al flusso ed al riassorbimento di LCS: in caso di ostruzione in ambito ventricolare o nello spazio sub aracnoideo alla base del cervello, il risultato è un idrocefalo. Un altro meccanismo è rappresentato da un’estesa patologia meningea da varie cause (infettive, carcinomatose, granulomatose, emorragiche) • Qualsiasi processo che espanda il LCS (meningite, emorragia sub aracnoidea) o, raramente, che ne aumenti la produzione (tumore dei plessi corioidei) Par II: Idrocefalo Classificazione eziologica • Idrocefalo ipersecretivo o Flogosi dei plessi e dell’ependima o Tumore dei plessi corioidei (papillomi: generalmente causano anche ostruzione) • Idrocefalo aresorptivo (mancanza di riassorbimento) o Leptomeningite adesiva o Esiti di emorragie subaracnoidee o Mancanza congenita dei villi • Idrocefalo ostruttivo: si tratta generalmente di una condizione nella quale vi è una dilatazione ventricolare come risultato di un’ostruzione al flusso del LCS in qualche punto del suo percorso. Il liquor si accumula con pressione crescente all’interno dei ventricoli, dilatandoli ed ampliandone gli emisferi o Non comunicante: causato da ostruzione a livello di: Forame di Monro: cisti, tumori, esiti cicatriziali Terzo ventricolo: come sopra Acquedotto di Silvio: difetti dello sviluppo o lesioni acquisite associate a gliosi periacqueduttale (atresia o biforcazione determinate geneticamente, ependidimiti, emorragie, tumori), stenosi Forami di Luschka e Magendie: sindrome di Dandy‐Walker o Comunicante Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Leptomeningiti: un blocco del LCS nello spazio subaracnoideo, come in corso di meningite fibrosa infiammatoria od emorragica, causa dilatazione di tutto il sistema ventricolare Tumori della regione optochiasmatica
Clinica • Nel neonato: le cause più frequenti sono: emorragie intraventricolari della matrice meningea, infezioni, malformazione di Arnold‐Chiari II, stenosi ed atresia dell’acquedotto, sindrome di Dandy‐Walker. In questi casi, l’idrocefalo è definito manifesto per l’evidente ingrandimento della testa. o Aumento della circonferenza e del volume cranico con possibile diastasi delle ossa craniche o Struttura ossea assottigliata (“a ferro battuto”) o Aumento di tensione nelle fontanelle o Bozze frontali sporgenti (“bozzute”) o Brachicefalia: la faccia sembra piccola e schiacciata, la cute sovrastante è tesa con le vene in risalto o Globi oculari ruotati in basso (segno del sole calante: le palpebre superiori sono retratte, gli occhi ruotati in basso, lo sguardo verso l’alto paralizzato, le sclere sopra l’iride visibili) o Vomito o In assenza di papilledema, la papilla ottica è pallida e la visione ridotta o Paralisi dell’abducente o Para‐ o tetra‐paresi spastica con possibili altri segni piramidali o Crisi epilettiche o Esito in ritardo psicomotorio • Nel bambino: il quadro è simile al precedente, ma piuttosto variabile o Riduzione del visus o Turbe caratteriali, irritabilità, anoressia o Cefalea o Vomito e nausea o Paralisi dell’abducente • Nell’adulto: in questi casi l’idrocefalo è definito occulto per l’assenza di un evidente ingrandimento della testa; il quadro è lentamente progressivo e, comunque, variabile (spesso è così lieve da non dare manifestazioni cliniche, ma solo accidentale riscontro radiologico) o Cefalea o Vomito o Vertigine o Disturbi dello stato mentale e della deambulazione: lentezza di risposta mentale (abulia), disattenzione, distraibilità, incapacità di pianificare un’attività o di sostenere qualsiasi tipo di funzione cognitiva complessa, lieve alterazione della memoria. Queste alterazioni sembrano spiegate dal fatto che l’espansione ventricolare è massima nel lobo frontale, rendendo ragione di queste disfunzioni comportamentali e motorie o Paralisi dell’abducente o Rigidità nucale o Sindrome di Parinaud: lieve dilatazione delle pupille, che reagiscono all’accomodazione, ma non alla luce • Nell’idrocefalo normoteso: in questi casi il riassorbimento riesce a bilanciare l’ostruzione. La triade clinica caratteristica è: disturbi della marcia, incontinenza sfinterica e deterioramento delle funzioni mentali • Nell’idrocefalo acuto: causato da emorragia subracnoidea da rottura di aneurisma, dal sanguinamento conseguente a malformazioni artero‐venose e da emorragia emisferica profonda, da ostruzione ventricolare soprattutto per tumori, è caratterizzato da: o Cefalea accompagnata da oscuramento della vista e vomito o Stato soporoso o stuporoso fino al coma o Segno di Babinski o Miosi, occhi in posizione ortotopica ed incapaci di movimenti: alla fine le pupille sono midriatiche Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
o Paralisi degli abducenti e limitazione dello sguardo verso l’alto Diagnosi o Transilluminazione del cranio nel neonato o Rx cranio o Ecoencefalografia o TC cranio: dd con dilatazione ventricolare mal formativa o RM o Monitoraggio PIC Terapia o Conservativa: è limitata ad alcuni casi, come infiammazione delle meningi, dei ventricoli e dell’acquedotto, e consiste in una terapia cortisonica ed antibiotica o Chirurgica: Derivazione ventricolo‐peritoneali Derivazione ventricolo‐atriale Terzo ventricolo‐cisternotomia endoscopica Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ II PROF MORACI Alcune malformazioni dell’infanzia Par I: Malformazione di Chiari Generalità La malformazione di Chiari (MC) è una sindrome da erniazione cerebellare congenita: se ne distinguono due tipi, cui possono esserne aggiunti un altro o altri due: • MC I: malformazione cerebello‐bulbare con protrusione delle tonsille cerebellari (>5 mm) attraverso il forame magno nel canale cervicale senza meningomielocele • MV II: malformazione cerebello‐bulbare con protrusione delle tonsille cerebellari e meningomielocele e dislocazione del midollo allungato nel canale cervicale insieme alla parte inferiore del IV ventricolo • MC III: ernia cerebellare • MC IV: ipoplasia cerebellare Quindi, si possono riscontrare alcune differenza tra le due forme principali: • Strutture erniate o I: tonsille cerebellari o II: verme, bulbo, IV ventricolo • Spina bifida o I: possibile o II: solitamente presente • Idrocefalo o I: possibile o II: solitamente presente • Età d’esordio clinico o I: giovane adulto o II: infanzia • Presentazione usuale o I: dolore cervicale e suboccipitale, cefalea o II: idrocefalo progressivo, distress respiratorio Alcuni dati epidemiologici sono: • Femmine leggermente più colpite • Discreta prevalenza (3,5%) • Età d’esordio 30‐35 anni nel tipo I, nell’infanzia nel tipo II • Esiste una certa familiarità • Anomalie associate o Siringomelia (37‐75%) o Scoliosi (5‐57%) o Impressione basilare (18‐33%) o Platibasia (7‐25%) o Occipitalizzazione dell’atlante (5‐31%) Patogenesi Non esiste un consenso sulla patogenesi, ma solo alcune teorie, che consentono, nel loro insieme, una certa spiegazione della MC: • Teoria della trazione: o Tethering del midollo a livello del difetto spinale o Crescita staturale del paziente o Stretching del midollo e retrazione del cervelletto Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
Teoria idrodinamica: si basa sul concetto del “martello d’acqua”. Il normale flusso di liquor dal canale centrale al quarto ventricolo ed il suo scarico sarebbero ostacolati dall’ostruzione dei forami di Luschka e Magendie: di conseguenza, un’onda pulsante di pressione del liquor, generata dalle pulsazioni sistoliche dei plessi corioidei, viene trasmessa al midollo dal quarto ventricolo attraverso il canale centrale. Il liquor circostante il midollo cervicale, sottoposto ad una maggiore pressione durante uno stiramento od uno sforzo fisico a causa di un’ostruzione subaracnoidea nel punto di giunzione cranio‐cervicale, entra nel midollo spinale lungo gli spazi di Virchow‐Robin od altri canali subpiali. Nel corso di lunghi periodi di tempo, favorite forse da lesioni anche microtraumatiche, piccole raccolte di liquido si uniscono a formare una cavità: originariamente le cavità si formerebbero indipendentemente da canale centrale, ma, in un secondo momento, le due strutture si connettono, consentendo un allargamento secondario del canale (idromielia ex vacuo). In definitiva, la progressione della siringomielia è indotta dall’azione compressiva delle tonsille cerebellari, che occludono parzialmente lo spazio subaracnoideo a livello del forame magno e creano onde di pressione che comprimono il midollo spinale dall’esterno e non dall’interno; le onde di pressione sospingono caudalmente il liquido contenuto nella cavità ad ogni battito cardiaco. Esiste, pertanto, una relazione tra base del cranio, colonna cervicale, malformazione spino‐cerebellare di Chiari, siringomielia ed alterazione idrodinamica del liquor perispinale. Teoria della dissociazione pressoria o Meccanismo a valvola a livello del forame magno o Durante la tosse il liquor, non potendo superare l’ostacolo, viene “sbattuto” (slosh effect) contro il canale centrale: ne deriva siringomielia o Una volta formata la cavità siringomielica viene mantenuta attraverso il “risucchiamento” (suck effect) del liquor che risale Teoria transmidollare o Iniezione intratecale di mdc o Accumulo del mdc all’interno della cavità siringomielica o Flusso del mdc attraverso gli spazi di Virchow‐Robin Teoria dell’effetto pistone Teoria dell’overcrowding Neuropatologia Il ponte ed il bulbo sono allungati e l’acquedotto ristretto: il tessuto bulbo‐cerebellare spostato, inoltre, ostruisce il forame occipitale ed anche la restante porzione cerebellare viene spostata, in modo tale da obliterare la cisterna magna. I forami di Luschka e Magendie si aprono nel canale cervicale ed il tessuto aracnoideo intorno al tronco cerebrale ed al cervelletto è fibrotico: tutti questi fattori concorrono alla formazione dell’idrocefalo, sempre associato. Frequente, come detto, è l’associazione con la siringomielia. Possono coesistere anomalie di sviluppo del cervello (polimicrogiria), del midollo spinale (filum terminale: l’estremità inferiore del midollo spinale si spinge fino all’osso sacro) e delle ossa craniche (fossa posteriore piccola, forame occipitale allargato, ma soprattutto l’impronta basilare, cioè la base cranica appiattita od infossata dalla pressione esercitata dalla colonna cervicale). Quadro clinico Nella MCII, con mielomeningocele, il problema è essenzialmente quello di un idrocefalo progressivo. Comunque, nei primi mesi di vita, possono essere, in diverse combinazioni, presenti: anomalie dei nervi cranici inferiori, stridore laringeo, fascicolazioni della lingua, paralisi sternomastoidea, ipostenia della muscolatura facciale, sordità, paralisi bilaterale dell’abducente. Se il paziente sopravvive fino all’adolescenza, possono svilupparsi i sintomi o i segni della MCI. Nella MCI, i sintomi neurologici possono non comparire fino all’adolescenza od all’età adulta: in questo caso, la diagnosi è spesso tardiva, per confusione con SM, SLA, disturbi psichiatrici. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Il quadro clinico può essere dovuto a: • Aumento della pressione intracranica: cefalea • Atassia cerebellare progressiva • Tetraparesi spastica progressiva • Nistagmo • Siringomielia cervicale: amiotrofia segmentale e perdita sensitiva, con o senza dolore • Disturbi dei nervi cranici inferiori • Disturbi del bulbo e del midollo spinale: disturbi dei fasci sensitivi e motori Quindi, il quadro clinico può così caratterizzarsi: • Sintomi o Dolore: cefalea, cervicalgia, dolore agli arti o Alterazione della sensibilità agli arti o Ipostenia agli arti o Altro: disfagia, disartria, apnea nel sonno, disturbi visivi, atassia, ipoacusia, tinnito, incontinenza vescicale, sincope tussigena • Segni o Deficit sensitivi agli arti o Deficit motori agli arti o Atrofia muscolare o Spasticità ed iperreflessia (talvolta iporeflessia) o Nistagmo o Segni da alterazione dei nervi cranici‐inferiori • Sindromi o Centro‐midollare o Del forame magno o Cerebellare o Da ipertensione endocranica o Piramidale Diagnosi • Rx: evidenzia eventuali anomalie ossee, a livello del cranio, della giunzione cranio‐vertebrale o del rachide • RM: la lingua di tessuto cerebellare ed il midollo cervicale attorcigliato ostacolano il flusso verso l’alto del colorante di contrasto e conferiscono un profilo radiologico altamente caratteristico, in particolare in proiezione sagittale. • Cine‐RM: determina la quantità di liquor che attraversa il forame magno. È particolarmente utile nelle forme borderline • TC: anche l’esame di sezioni assiali alla TC, a livello del forame magno, dimostra il riempimento del canale cervicale superiore da parte del tessuto cerebellare dislocato in direzione caudale. Può, in sezione coronale, identificare impressione basilare • Mielografia Terapia Il trattamento della MC è di gran lunga insoddisfacente. In caso di pazienti asintomatici è bene attenersi solo ad un attento follow‐up con intervento chirurgico solo alla comparsa dei sintomi. In pazienti sintomatici occorre, invece, un intervento chirurgico entro 2 anni dall’esordio dei sintomi; le tecniche, in approccio suboccipitale mediano, proposte sono: • Decompressione ossea e durale: craniectomia mediana suboccipitale + laminectomia C1‐C2: la membrana atlo‐occipitale rappresenta il landmark per il forame magno; la dura viene incisa ad Y e sospesa con suture. • Ricostruzione cisterna magna Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
Tonsillectomia o coartazione tonsillare con caogulazione bipolare: si osserva la risalita delle tonsille Decompressione osteo‐durale con lisi delle aderenze aracnoidee: discesa della tonsilla destra a C2 Duroplastica: patch durale con sutura continua Eco‐color‐Doppler intraoperatorio o Valuta l’adeguatezza della decompressione ossea o Creazione di uno spazio retrocerebellare sufficiente (8‐10mm3) o Ripresa di flusso liquorale ottimale (3‐5 cm/sec) Decompressione ossea con dura intatta o Nei bambini o Non si effettua laminectomia C1 o Preserva l’anatomia vascolare Prognosi È altamente variabile: molti dei pazienti che hanno tratto beneficio dall’intervento chirurgico tendono in seguito a ritornare allo stato clinico preoperatorio o, addirittura, a peggiorare. Vi sono fattori prognostici: • Favorevoli: segni e sintomi di siringomielia, atrofia, atassia, nistagmo • Sfavorevoli: ipertensione endocranica acuta, sindrome cerebellare, sindrome del forame magno, fossa posteriore piccola Inoltre, vi sono sintomi che, alla terapia, rispondono: • Bene: cefalea, dolore, debolezza senza atrofia, scoliosi • Male: nistagmo, atrofia e debolezza con atrofia, disturbi sensitivi Par II: Siringomielia Generalità La siringomielia (dal greco “syrinx”, “canna” o “bambù”) può essere definita come un disturbo cronico, progressivo, degenerativo o dello sviluppo del midollo spinale, caratterizzato clinicamente da ipostenia non dolorosa ed atrofia delle mani e delle braccia (amiotrofia brachiale) e deficit sensitivo segmentale di tipo dissociato (perdita della sensibilità termica e dolorifica con risparmio di quella tattile, di posizione e vibratoria). Da un punto di vista anatomopatologico, vi è una cavitazione delle parti centrali del midollo spinale, solitamente nella regione cervicale, che si estende verso l’alto raggiungendo in alcuni casi il bulbo ed il ponte (siringobulbia) o verso il basso ad interessare i segmenti toracici e persino quelli lombari. Frequentemente si associano alterazioni dello sviluppo della colonna vertebrale (scoliosi toracica, fusione delle vertebre, anomalia di Klippel‐Feil), della base del cranio (platibasia ed invaginazione basilare) e, soprattutto, del cervelletto e del tronco encefalico (MC I: circa il 90% dei casi di siringomielia presenta la MC I e circa il 50% dei casi di MC I presenta siringomielie). Infine, c’è anche un gruppo di siringomielie meno frequenti, ma ben descritte, che derivano da processi patologici acquisiti: tumori intramidollari (astrocitoma, emangioblastoma, ependimoma), necrosi traumatica od emorragica del midollo spinale. Comunque, indipendentemente da come si è formata (vedi sopra), la cavità va inizialmente ad occupare la sostanza grigia centrale della parte cervicale del midollo spinale, dove interrompe le fibre crociate della sensibilità dolorifica e termica della commessura anteriore in diversi segmenti del midollo spinale. Man mano che la cavità si ingrandisce, si estende in modo simmetrico od asimmetrico nelle corna posteriori ed anteriori e successivamente nei cordoni laterali o posteriori e può provocare ingrossamento del midollo spinale. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Classificazioni Una prima classificazione distingue: • Tipo I: siringomielia con ostruzione del forame magno e dilatazione del canale centrale (forma connessa con lo sviluppo) o Associata alla MC I o Associata ad altre lesioni ostruttive del forame magno • Tipo II: siringomielia senza ostruzione del forame magno (forma idiopatica connessa con lo sviluppo) • Tipo III: siringomielia con altre patologie dello sviluppo (forme acquisite) o Tumori del midollo spinale: solitamente intramidollari, particolarmente emangioblastoma o Mielopatia traumatica o Aracnoiditi e pachimeningiti spinali o Mielomalacia secondaria a compressione midollare (tumore, spondilosi) o infarti, ematomielia • Tipo IV: idromielia pura (dilatazione del canale centrale in corso di sviluppo), con o senza idrocefalo Un’altra classificazione distingue: • siringomielia comunicante con il IV ventricolo: dilatazione del canale centrale in continuità col IV ventricolo • siringomielia non comunicante con il IV ventricolo: dilatazione del canale centrale non in continuità col IV ventricolo • cavitazioni parenchimali primitive: dilatazioni del canale non in continuità col canale centrale o con il IV ventricolo o siringomielia ex vacuo: siringhe atrofiche con mielomalacia o cisti neoplastiche A queste condizioni può aggiungersi un caratteristico stato presiringomielico, caratterizzato da una mielopatia che precede la siringomielia, ma che è potenzialmente reversibile Clinica Il quadro clinico varia nei quattro diversi tipi: le differenze dipendono non solo dall’estensione della cavità, ma anche dalle concomitanti alterazioni patologiche, in particolare quelle collegate alla malformazione di Chiari Nel tipo I, collegato alla MC I, i sintomi esordiscono in modo subdolo nella prima età adulta (20‐40 anni), per decorrere poi in maniera progressiva‐intermittente, costringendo in 5‐20 anni il paziente sulla sedia a rotelle. Il quadro clinico sarà caratterizzato da: • debolezza segmentaria ed atrofia di mani e braccia • assenza di alcuni o di tutti i riflessi tendinei • anestesia segmentaria di tipo dissociato (dissociazione siringomielica): perdita della sensibilità termica e dolorifica con conservazione di quella tattile, vibratoria e propiocettiva, nel collo, nelle braccia e nelle spalle (“a mantella”) • presenza in un terzo o nella metà dei casi di dolore, tipico delle forme associate a MC I • nei casi con cavità estese fino al bulbo: coinvolgimento dei fasci piramidali, coinvolgimento dei nervi cranici (disfagia, raucedine, atrofia linguale, diplopia) e del cervelletto (nistagmo, disartria) • malformazioni cervico‐occipitali associate nel 25%: collo corto, bassa attaccatura dei capelli, strana postura della testa e del collo, fusione od assenza di vertebre cervicali) In caso di anomalia sensitivo‐motoria a carattere siringomielico esteso a diversi segmenti del corpo, si dovrebbe sospettarre la presenza di una siringomielia associata ad un tumore intramidollare (tipo III): nella sindrome di von Hippel‐Lindau la diagnosi si basa sul riscontro di caratteristici emangioblastomi vascolari cerebellari, retinici e delle siringa. L’idromielia (tipo IV) è una dilatazione del canale centrale, ben definita e relativamente non progressiva, a livello di alcuni segmenti dorsali, che solitamente provoca scarsi o nulli segni. La diagnosi si avvale di RM, mielografia con mdc e TC con mdc, la terapia della decompressione chirurgica del forame magno e del canale cervicale superiore. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Par III: Malformazioni vertebro‐midollari Generalità Possono aversi: • schisi: mancata chiusura degli archi vertebrali posteriori • disrafismi spinali: mancata o alterata fusione della placca neurale con anomalia mesenchimale e neurale o amielia: per l’assenza del midollo spinale, è incompatibile con la vita o spina bifida aperta: è una malformazione dovuta alla mancata od alterata fusione della placca neurale con schisi vertebrale, distinta in mielocele: è la più grave, con midollo rudimentale, ed incompatibile con la vita mielomeningocele: consiste in una sacca, più o meno sporgente, localizzata al dorso, in sede lombo‐sacrale, sulla linea mediana, che ricopre la schisi vertebrale e che contiene, oltre alle meningi, anche radici nervose e porzioni del midollo spinale. La sintomatologia è caratterizzata da paralisi flaccida, con interessamento sfinterico a seconda del livello e deficit della sensibilità meningocele: è una malformazione cistica costituita da un diverticolo di aracnoide ripieno di liquor, che protrude attraverso una schisi per un difetto durale e non contiene radici nervose o midollo spinale. La cute di solito è atrofica e translucida, i segni neurologici sono solitamente assenti. Il trattamento è finalizzato alla ricostruzione plastica per evitare le reazioni flogistico‐infettive o spina bifida occulta: è la mancata chiusura degli archi vertebrali posteriori, localizzata di solito a livello lombo‐sacrale, raramente a livello cervicale. Nelle forme lievi è interessata una sola vertebra, senza interessamento delle strutture radicolari e meningee, risultando asintomatica, al massimo con ipertricosi e qualche teleangectasia nella cute sovrastante la schisi. Nelle forme sintomatiche, invece, il quadro è dovuto all’interessamento radicolare, con algie, o midollare, con anestesie e disturbi sfinterici. La diagnosi è ottenuta con Rx e TC, la terapia è riservata solo alle forme sintomatiche meningocele occulto: è una forma particolare di spina bifida, nella quale la malformazione interessa solo gli involucri meningei senza schisi vertebrale. Ne consegue uno sviluppo anteriore o laterale, in regione toracica o lombare o sacro‐coccigea. In sede sacrale spesso la sacca contiene radici della cauda (mielomeningocele occulto) e la sintomatologia risulta caratterizzata da disturbi sfinterici e della sensibilità seno dermico: è una cavità tubulare tappezzata da epitelio estesa dalla cute allo spazio subaracnoideo. Complicanze sono la trasformazione epidormoide ed infiammatorie‐
infettive lipomielomeningocele: è un mielomeningocele che coinvolge anche il tessuto adiposo fibrolipoma del filum terminale: fisiologicamente il filum va dal cono alla superficie dorsale della I vertebra coccigea ed è <2 mm di spessore. Nel fibrolipoma vi è, invece, un aumento dello spessore con infiltrazione di tessuto adiposo. È asintomatico o clinicamente evidente come tethered cord lipomi intradurali: sono lipomi situati al di sotto della pia madre, a sede posteriore mediana o paramediane, lombosacrale od olocord o diastematomielia: è un difetto di sviluppo della notocorda che causa la presenza di uno sperone osseo sagittale, che origina dalla faccia posteriore di un corpo vertebrale a livello lombare, che divide il canale spinale in due metà, ciascuna con le proprie meningi. Ne conseguono deficit motori a carico degli arti inferiori, disturbi della deambulazione, con o senza turbe secretive o sfinteriche. È diagnosticabile in caso di danno da trazione al midollo: questo, ancorato allo sperone, non può seguire verso l’alto per seguire l’accrescimento del rachide. È individuabile con indagini radiologiche dirette, con la TC e la RM spinali. Può sovente associarsi ad altre malformazioni vertebro‐midollari come la spina bifida occulta, le fistole dermiche o gli angiomi. La terapia correttiva è chirurgica. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
o
siringomielia thetered cord: è il cosiddetto “midollo ancorato”, in cui strutture anelastiche legano il midollo spinale e le sue radici. La cause più frequenti sono: filum terminale corto, tumori, fibrosi cicatriziali, malformazioni ossee o midollari Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ III PROF MORACI NEUROCHIRURGIA Neurochirurgia funzionale Par I: Generalità La neurochirurgia funzionale (NCF) è quella parte della neurochirurgia che si occupa del trattamento di malattie del SN non determinate da lesioni strutturate (tumori, malformazioni vascolari etc.), ma da un’alterata funzionalità delle funzioni cerebrali, connesse alle diverse attività come il movimento (MP, tremore essenziale, distonie), sensibilità (dolore), tono muscolare (spasticità) e vigilanza (epilessia). La neurochirurgia funzionale tende a correggere i sintomi, modificando le funzioni anomale: • Neurochirurgia del dolore: nevralgia del trigemino e del glossofaringeo • Tecniche chirurgiche • Neurochirurgia dell’epilessia • Neurochirurgia del MP • Neurochirurgia della spasticità Par II: Sindromi trattate con la NCF Nevralgia trigeminale E’ una nevralgia caratterizzata da dolori parossistici localizzati strettamente nel territorio di distribuzione del nervo trigemino. È la patologia trigeminale più frequente, con frequenza massima in età avanzata, maggiore nelle donne e nelle branche 2 e 3 (V2> V3> V1). Si distinguono: • Forma essenziale (più frequente) o Eziopatogenesi Ipotesi centrale: iperattività del nucleo trigeminale: vi sarebbe una compressione delle radici trigeminali, con danno assonale (false sinapsi) ed ipereccitabilità neuronale. La patogenesi sarebbe dovuta a: • Stimoli trigger cutanei • Iperattività cellule gangliari • Scarica dell’ignition focus • Iperpolarizzazione dell’ignition focus • Periodo refrattario Ipotesi periferica o neurovascolare: vi sarebbe una vasodilatazione con compressione ed irritazione delle fibre mieliniche, conseguente demielinizzazione, cross‐talk ephapsis e parossismi dolorosi o Clinica Forma tipica: dolore limitato al territorio di distribuzione del nervo trigemino (con o senza trigger points), lancinante, parossistico, con comparsa e cessazioni rapide. Le crisi parossistiche sono di breve durata (20”), intervallate da periodi liberi: tuttavia, se non trattate, possono divenire subentranti. Forma atipica: dolore limitato al territorio di distribuzione del trigemino, senza trigger points, ma sempre presente, seppur di intensità variabile o Diagnostica per immagini Diagnosi differenziale con forme secondarie: RM cerebrale con o senza gadolino Ricerca del conflitto neurovascolare: angio RM, RM ad elevata risoluzione (RM CISS: consente una ricostruzione tridimensionale di strutture nervose e vascolari) o Terapia Medica • Carbamazepina Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
• Carbamazepina + lamotrigina • Gabapentin, oxcarbazepina, fenilidantoina Trigeminal root ganglion procedures: pazienti candidati sono quelli con età superiore ai 65 anni, rifiuto dell MVD, presenza di fattori di rischio operatori, sclerosi multipla, ASA elevato • Termocoagulazione cutanea • Rizolisi con glicerolo • Microcompressione del ganglio di Gasser Decompressione microvascolare: pazienti candidati sono quelli con età inferiore ai 65 anni, assenza di fattori di rischio, storia clinica recente, assenza di precedenti trattamenti, interessamenti di V1 Radiochirurgia: gamma‐knife Forma sintomatica o secondaria (rara) o Lesioni espansive APC o Sclerosi multipla o Frattura basicranica Nevralgia del glossofaringeo È caratterizzata da dolore intenso, parossistico, lancinante, distribuito nel territorio di innervazione del nervo glossofaringeo. È molto rara, colpisce tra i 40 e gli 80 anni, con un picco ai 70 anni. • Patogenesi o Forma primaria: si ipotizza un conflitto neurovascolare o Forma secondaria: processi espansivi dell’angolo ponto‐cerebellare • Clinica o Irradiazione del dolore: Timpanica: dall’orecchio alla gola Orofaringea: dalla gola all’orecchio o Coinvolgimento del nervo vago: bradicardia, sincope, arresto cardiaco o Parossismi dolorosi: sono evocati ingoiando bevande fredde, parlando, masticando, tossendo, starnutendo o Zone trigger: sono rare, ma talvolta la nevralgia può essere scatenata stimolando la radice della lingua, la regione del trago o la tonsilla faringea o Attacchi dolorosi episodici a grappolo, durando giorni o mesi e con frequenti recidive • Diagnosi o Anamnesi o Clinica: tramite anestesia delle zone trigger o RM ed angio‐RM: escludono le forme sintomatiche ed evidenziano eventuali conflitti neuro vascolari • Terapia o Medica: come per la nevralgia trigeminale o Chirurgica Termocoagulazione percutanea del IX a livello del forame giugulare: dà spesso esiti soddisfacenti, ma non raramente residuano disfagia e raucedine Sezione extracranica delle branche del IX: può dare immediata risoluzione della sintomatologia, ma è spesso associata a reicidiva Sezione intracranica delle branche del IX: dà spesso una completa risoluzione sintomatologica ed è in genere ben tollerata, anche se possono residuare disfagia, paralisi delle corde vocali, intorpidimento del riflesso faringeo Decompressione microvascolare: si è dimostrata molto efficace e consente di evitare le suddette complicanze NCF • Chirurgia stereotassica Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
o Indicazioni: lesioni cistiche, lesioni profonde o Tecniche: frame‐based, frame‐less Radiochirurgia stereotassica: si basa, a differenza della radioterapia, sulla emissione di una singola dose di radiazioni. Non rimuove la lesione, ma altera il DNA delle cellule malate, distruggendole: o Radiochirurgia a protoni: ciclotrone o Radiochirurgia a raggi‐gamma (cobalto‐60): gamma‐knife: metodica di funzionamento: Posizionamento del casco stereotassico sul capo del paziente Individuazione della sede da trattare mediante applicazione del casco alla RM Sistemazione del paziente col casco nella gamma‐knife Bombardamento del target mediante raggi‐gamma al cobalto‐60 o Acceleratore lineare: cyber‐knife, clinac, X‐knife NCF di altre condizioni • Epilessia: nei casi di epilessia farmaco‐resistente, può instaurarsi una terapia chirurgica, non da tutti accettata. o Tecniche diagnostiche Non invasive (di solito sufficienti per evidenziare l’eventuale localizzazione della causa): RM, TC, PET, SPECT, video‐EEG Invasive: • Elettrocorticografia: registrazione della superficie corticale • Stereo‐EEG: registrazione delle strutture profonde o Tecniche chirurgiche Resezioni • Del focus epilettico • Della lesione nelle epilessie secondarie Disconnessioni: impiegate quando interessato l’emisfero dominante o per separare l’attività elettrica dei due emisferi • Amigdalippocampectomia • Callostomia (sezione del corpo calloso) • Transezioni multiple subpiali • Malattia di Parkinson: la selezione del paziente candidato alla terapia chirurgica si basa sull’insensibilità alla terapia medica, seguita da un peggioramento sintomatologico, con conservazione di uno stato psicologico accettabile e senza gravi disturbi della circolazione cerebrale. Procedure chirurgiche sono: o Pallidotomia‐ talamotomia: sono eseguite mediante radiochirurgia stereotassica o Deep brain stimulation: termocoagulazione delle strutture profonde mediante stereo atassia o Trapianto di cellule dopaminergiche • Spasticità: il trattamento chirurgico è riservato ai casi in cui la terapia medica non sia efficace o gli effetti collaterali della terapia medica non siano tollerati o Procedure non ablative: baclofen intratecale o Procedure ablative con perseverazione della deambulazione: blocchi nervosi, neurotomie selettive, DREZ‐tomie, mielotomie o Procedure ablative con sacrificio della deambulazione: cordectomia, neurectomia Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ II PROF ROTONDO Traumi cranio‐cerebrali Par I: Generalità Introduzione I traumi cerebrali sono tra le più frequenti e gravi malattie neurologiche: la clinica è da un lato semplice, per l’immediata evidenza dell’eziologia, e dall’altro complessa, per la varietà di effetti ritardati. Comunque, il neurologo dovrà indagare sulle modalità del trauma, indicare l’eventuale presenza di escoriazioni, lacerazioni e contusioni dei tessuti molli, evidenziare l’eventuale frattura e l’alterazione dello stato di coscienza concomitante al trauma. In base a tali raccordi clinico anamnestici è possibile classificare i traumi: • in base all’insorgenza o Diretto: quando un corpo urta il cranio o viceversa, occorre nell’istante del trauma Fratture del cranio Contusione cerebrale Lacerazione cerebrale Danno assonale diffuso o Indiretto: ha luogo nelle ore o nei giorni successivi Ematomi Ipertensione endocranica Edema Ischemia Contusione secondaria Sviluppo di penombra ipossica • In base alla posizione del capo o A capo fisso: la lesione è localizzata a livello dell’impatto o Con capo in movimento: il cervello subisce lesioni da accelerazione rotatoria o rettilinea • In base all’alterazione delle strutture periossee o Aperto: quando la dura madre è lacerata o Chiuso: prevalentemente causati da forze smusse • In base al meccanismo patogentico o Commotivo: quando è accompagnato da perdita di coscienza di breve durata o Lacero‐contuso: quando è presente una soluzione di continuo cutanea o una lesione delle parti molli Aspetti importanti in caso di lesione cerebrale traumatica sono: • La differenza di mobilità del capo e del cervello • I vincoli della parte superiore del tronco cerebrale in presenza di una certa libertà di movimento degli emisferi cerebrali • Relazioni delle parti offese del cervello con i setti durali e le prominenze ossee • La frequente, e solitamente temporanea, perdita di coscienza • I possibili danni macroscopici, anche in assenza di penetrazione attraverso la teca: contusioni, lacerazioni, emorragie, edema Par II: Principali manifestazioni cliniche di trauma cranico Lesioni delle parti molli Sono lesioni a carico del cuoio capelluto, della galea e dei piani muscolari, che si manifestano come abrasioni, escoriazioni e contusioni, con possibile formazione di ematomi sottocutanei e sottoaponeurotici. Clinicamente, si riscontrano dolore focale e cefalea diffusa. La terapia prevede, a seconda della gravità della lesione, l’uso di comuni analgesici, di antibiotici o la toilette chirurgica, con la profilassi tetanica da applicare secondo le indicazioni previste. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Fratture craniche Un tempo rappresentavano la frazione largamente dominante dei traumi cranici: oggi, invece, l’evidenza che il capo, per quanto rigido, è abbastanza flessibile da sopportare, senza fratture, colpi sufficienti a provocare danni al cervello, ha spostato l’attenzione su quella gran parte di casi caratterizzati da lesioni cerebrali in assenza di fratture. Inoltre, spesso la frattura dissipa di per sé l’energia traumatica, esentando il cervello da disturbi gravi e prolungati. Comunque, le fratture sono importanti in quanto indicano la sede e la probabile gravità del danno cerebrale, forniscono una spiegazione per alcune paralisi dei nervi cranici e creano potenziali vie d’ingresso per batteri od aria o d’uscita per il liquor. Le fratture possono classificarsi: • In rapporto all’integrità delle strutture craniche o Aperte: quando interessano una cavità comunicante con l’esterno come l’orecchio o le cavità paranasali o Chiuse: quando la cute e lo strato muscolo‐aponeurotico sono integri, sono prevalentemente a carico dei tavolati o Esposte: quando cute e strato muscolo‐aponeurotico sono lesi • In rapporto all’interessamento o Della volta o Della base o Di entrambe • In rapporto all’estensione: o Incomplete limitate al tavolato esterno: causate prevalentemente da taglienti o Incomplete limitate al tavolato interno: causate da traumi tangenziali o Affossate: quando i frammenti sono avvallati con introflessione degli stessi • In rapporto ai frammenti formatisi o Lineare o Depressa o Diastasata Le fratture della base sono spesso difficili da individuare nelle normali radiografie del cranio, ma vanno sempre sospettate in presenza dei caratteristici segni clinici (vedi dopo). La frattura della piramide petrosa spesso deforma il canale acustico esterno o lacera la membrana timpanica con otorrea (fuoriuscita di liquor), oppure si può osservare l’accumulo di sangue dietro la membrana timpanica intatta. Le fratture della base a carico della parte anteriore del cranio possono causare anche un passaggio di sangue nei tessuti periorbitali, conferendo al viso il caratteristico aspetto “a panda”. Una frattura all’interno o in prossimità della sella turcica può ledere il peduncolo dell’ipofisi, causando diabete insipido. Comunque, sintomi e segni sono: • Fossa cranica anteriore: epistassi, rinoliquorrea, ecchimosi congiuntivali e palpebrali, esoftalmo, ipo‐
anosmia, diminuzione del visus o cecità omolaterale • Fossa cranica media: otorragia, otoliquorrea, paralisi periferica faciale, , sindromi vestibolari, ipoacusia, ecchimosi tardive retro mastoidee • Fossa cranica posteriore: ecchimosi tardive, ematoma retrofaringeo Generalmente, l’esistenza di una frattura della base è indicata dai segni di danneggiamento dei nervi cranici: • Nervi olfattori: anosmia, specie a seguito di traumi della parte posteriore • Nervo oculomotore: ptosi, divergenza dei globi oculari con l’occhio colpito fisso in posizione abdotta e leggermente abbassata, perdita dei movimenti mediali e verticali, diplopia e midriasi fissa • Nervo trocleare: diplopia con inclinazione compensatoria della testa. Il lungo decorso subaracnoideo di questo nervo ne giustifica l’elevato coinvolgimento in caso di traumi cranici • Branca oftalmica o mascellare del trigemino: intorpidimento, parestesie e dolore nelle aree interessate Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
• Nervo facciale: paresi facciale • Nervo acustico: perdita di udito, vertigini, nistagmo La terapia delle fratture si basa sulla sostituzione di osso autologo con resine biomeccaniche e reti metalliche Fistola carotido‐cavernosa È una comunicazione fra tratto intracavernoso della carotide interna ed il seno cavernoso, causato dalla rottura della parete della carotide in seguito ad un trauma. Generalmente, una frattura che interessi lo sfenoide e la rocca petrosa può lacerare l’arteria carotide interna o una delle sue branche a livello del seno cavernoso. Entro alcune ore si manifesta un grave esoftalmo pulsante, per l’entrata del sangue arterioso nel seno cavernoso, con conseguente distensione delle vene oftalmiche, superiore ed inferiore, che sfociano nel seno stesso. Alla palpazione l’orbita è tesa e dolente, mentre l’occhio può diventare parzialmente o del tutto immobile a causa della pressione sui nervi oculomotori che attraversano il seno. Possibile è anche il coinvolgimento dell’abducente. Inoltre, può esservi una compromissione del visus per l’interessamento del nervo ottico e della retina (amaurosi). Comunque, importante è il rumore di soffio, percepito col fonendoscopio nel punto di proiezione della lesione sottostante, solitamente avvertito in regione temporale od orbitale. Possono essere presenti congestione dei vasi palpebrali e della sclera e chemosi bulbare. La diagnosi può avvalersi dell’angiografia e della RM. Circa il 5‐10% delle fistole si risolve spontaneamente, ma la quota restante richiede l’obliterazione con metodiche di radiologia terapeutica (embolizzazione) o una riparazione chirurgica a cielo aperto della fistola. Non tutte le fistole carotido‐cavernose sono di tipo traumatico, ma possono essere anche di natura malformatova (aneurisma sacculare intracavernoso, sindrome di Ehlers‐Danlos). Complicanze da passaggio di aria o liquor In caso di lacerazione della cute sovrastante la frattura cranica e di strappamento delle meningi, o in caso di passaggio della frattura attraverso un seno paranasale, aria o batteri possono penetrare nella cavità cranica, causando una meningite o un ascesso. Inoltre, il liquor può passare nel seno e dar luogo ad una perdita acquosa dal naso (rinoliquorrea): il liquor che cola dal naso può essere identificato tramite ricerca del glucosio con una striscia reattiva (il muco nasale, infatti, non contiene glucosio)o tramite tamponi nasali, evidenziando la fluoresceina precedentemente iniettata nel liquor. Il liquor può fuoriuscire spontaneamente o abbassando il capo, la compressione delle vene giugulari aumenta la fuoriuscita di liquor. La rinoliquorrea si determina in seguito a lesioni, traumatiche o neurochirurgiche, della fossa cranica anteriore o a seguito di ipertensione endocranica. La sintomatologia è cefalgica, con ipotensione e possibilità di complicanze infettive meningitiche: pertanto, il trattamento di avvale di antibiotici, inibitori dell’anidrasi carbonica (per ridurre l’ipertensione endocranica) e clinostatismo); in caso di fallimento, è indicato l’intervento di plastica della fistola liquorale. Spesso, comunque, la regressione è spontanea La fuoriuscita di liquor dall’orecchio (otorrea) può essere dovuta a lesioni, traumatiche o neurochirurgiche, della fossa cranica media: è meno frequente della rinoliquorrea. Una raccolta d’aria nelle cavità craniche (aerocele) è un’evenienza comune in seguito a fratture craniche o ad estesi interventi neurochirurgici: si riscontra di solito nello spazio epidurale o subdurale sopra le convessità cerebrali o fra gli emisferi ed ha il significato di indicare una possibile via d’ingresso dei batteri nel cranio. Piccole raccolte vengono riassorbite, ma grandi raccolte agiscono come massa (pneumocranio ipertensivo). Lo pneumocefalo indica la presenza di aria negli spazi endocranici per soluzione di continuo della teca, della mucosa della regione interessata o della dura. Può essere raramente extra durale, più frequentemente subaracnoideo, subdurale od endoventricolare, ancor più frequentemente intracerebrale. Se precoce ed a sede subdurale, non ha segni particolari, tranne la possibilità di associarsi a liquorrea; se tardivo, a sede intracerebrale od endoventricolare, può dare ipertensione o ipotensione endocranica, con segni focali, cefalea parossistica e segni meningei. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Commozione cerebrale Si può definire come una paralisi traumatica reversibile delle funzione nervose, sempre immediata, non accompagnata da lesione anatomica cerebrale. Condizione tipicamente scatenante è quella in cui si ha una variazione improvvisa del momento della testa, cioè quando un colpo impartisce un movimento alla testa precedentemente ferma o il movimento di quest’ultima è arrestato da una superficie rigida e fissa (tipo accelerativo e tipo decelerativo). Il cervello risulta quindi sottoposto a forze di taglio causate dalla rotazione, prevalentemente sul piano sagittale, attorno al punto di attacco sul mesencefalo rostrale e sul subtalamo: la lacerazione a livello della sostanza reticolare spiegherebbe l’immediata perdita di coscienza. Altro fattore importante è l’estesa lesione della sostanza bianca, sia a livello emisferico sia tronco encefalico, con conseguente degenerazione delle fibre nervose sottoposte a stiramento o lacerazione a causa delle forze di taglio durante l’accelerazione rotatoria del capo (danno assonale diffuso, vedi dopo). I segni clinici caratteristici di un danno commotivo consistono in: • Immediata abolizione dello stato di coscienza • Diminuzione od abolizione della sensibilità a diversi stimoli, della motilità volontaria e riflessa (con caduta a terra se il soggetto era in piedi) • Arresto transitorio della respirazione o prolungato fino alla morte • Bradicardia ed ipotensione • “convulsioni commotive” • Postumi: amnesia, astenia (dapprima retrograda, poi anterograda), cefalea, vertigini, sindrome ansioso‐
depressiva reattiva post‐traumatica Il periodo di tempo necessario al recupero varia da secondi o minuti a diversi giorni. La terapia si avvale di un periodo di riposo a letto, di analettici cardiaci e respiratori, talvolta di cortisonici ed ansiolitici. Danno assonale diffuso Il danno assonale diffuso definisce una degenerazione delle fibre lunghe della sostanza bianca in seguito ad un trauma (tipicamente a seguito di incidenti stradali): la patogenesi varia a seconda del trauma implicato: • Traumi cerebrali da accelerazioni/ decelerazioni del capo, senza impatto: in tal caso si svilupperebbero delle forze di compressione, tensione e slittamento che, attraversando il parenchima cerebrale, sarebbero responsabili della rottura delle fibre. Il danno assonale risulterebbe quindi primitivo, non associato ad ipertensione endocranica, edema cerebrale diffuso o danno ipossico • Insulto traumatico diffuso corticale, con danno ischemico, ipertensione endocranica ed edema cerebrale diffuso Comunque, il danno assonale diffuso produce una trazione sulle fibre nervose e sulle piccole arterie che si traduce in minime lesioni focali, prevalentemente emorragiche, di 0,5‐1,5 cm di diametro. Sedi più colpite sono: • Corpo calloso • Quadranti dorso‐laterali rostrali del tronco encefalico • Peduncoli cerebrali superiori • Più raramente, nuclei della base e talamo Il quadro clinico è caratterizzato da: • Punteggio al GCS inferiore ad 8 • Stato di coma immediatamente successivo al trauma, senza intervallo libero • Postura in estensione • Nei bambini: stati di agitazione, movimento degli arti, espressione terrifica del volto • Raramente, altre lesioni primarie post‐traumatiche La prognosi è solitamente infausta e la gravità del quadro sintomatologico è direttamente proporzionale alla diffusione del danno. Le indagini radiologiche evidenziano delle microemorragie periventricolari, specie adiacenti al IV ventricolo: Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
RM: garantisce un’alta definizione d’immagine, specie per la fossa posteriore, ma generalmente in Pronto Soccorso gli viene preferita la TC • TC: viene eseguito per le emergenza La terapia è solitamente mirata alla risoluzione dell’edema. Contusione e lacerazione cerebrale La contusione è caratterizzata dalla presenza di un focolaio lacero‐contusivo del parenchima cerebrale, con edema perilesionale e, talvolta, ematoma subdurale satellite. Il focolaio è caratterizzato da necrosi ed infarcimento emorragico del parenchima nervoso, con aree di infarto: ne consegue un effetto massa, con sintomatologia focale (afasia, emiparesi, etc.). A causa dell’edema si verifica una sindrome da ipertensione endocranica. La sintomatologia è aspecifica e non sempre si accompagna a perdita di coscienza, anche se una commozione grave accompagnata da midriasi (attenzione alla midriasi che può preludere ad uno stato di coma) è frequente. Nei casi più gravi può raggiungersi lo stato di coma apallico. Alla ripresa dello stato di coscienza possono aversi disturbi focali e psichici (eccitamento e confusione psicomotori) con sindrome di Korsakoff. Possono aversi crisi di tipo decerebrato caratterizzate da iperestensione di testa‐tronco (opistotono), iperpronazione degli avambracci, pugni chiusi, piedi flessi plantarmente ed intraruotati. A distanza di tempo, in seguito alle proprietà irritative della cicatrice conseguente al focolaio lacero‐contuso, possono presentarsi delle crisi comiziali. La terapia medica è simile a quella vista per la commozione cerebrale, quella chirurgica è richiesta nei casi di fratture avvallate associate. Ematomi extradurali (o epidurali) • Causa: sono raccolte ematiche tra teca cranica e dura madre, dovute ad emorragie arteriose dell’arteria meningea media o dei suoi rami o del seno durale, soprattutto nella zona pariteo‐temporale scollabile del Marchand. Frequente è il riscontro di ematomi multipli. • Localizzazione: convessità cerebrali laterali • Evoluzione: ore • Profilo clinico: o Intervallo di lucidità, seguito da stupor e quindi coma; in alternativa insorgenza senza intervallo libero o Midriasi, ipertensione arteriosa, ipertensione endocranica o Ipostenia controlaterale e poi bilaterale degli arti o Deficit dei nervi cranici o Possibile progressione fino all’interessamento del tronco encefalico • Età a rischio: bambini, giovani • Aspetto radiologico: o Coagulo epidurale sporgente acuto, legato alle suture craniche o Forma lenticolare • Intervento chirurgico: lembo chirurgico per evacuazione urgente o Rimozione del volet osseo o Evacuazione dell’ematoma o Coagulazione o Sospensione della dura Ematomi subdurali acuti • Causa: sono raccolte ematiche localizzate tra dura madre ed aracnoide, dovute a strappamento delle vene e delle arteri piali a ponte, che collegano la rete piale con il seno longitudinale superiore, o dei seni stessi • Localizzazione tipica: convessità cerebrali laterali • Evoluzione: molte ore Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
Profilo clinico o Dopo un brevissimo intervallo libero, stato commotivo o Periodo di stato: cefalea, vomito, obnubilamento del sensorio, turbe del respiro o Deficit focali: emiparesi controlaterale Età a rischio: tutte Aspetto radiologico: ampia rima di sangue a livello della convessità cerebrale Intervento chirurgico: evacuazione urgente se abbastanza vasto da causar sintomi Ematoma subdurale cronico • Causa: trauma, anche minimo con rottura delle vene a ponte e stato infiammatorio cronico. Fattori di rischio sono coagulopatie, terapie anticoagulanti, derivazioni liquorali e gravi atrofie cerebrali • Localizzazione: convessità cerebrali laterali, anche bilateralmente • Evoluzione: giorni o settimane • Profilo clinico: cefalea ed alterazione progressiva dello stato mentale, con deficit psichici e sindrome da ipertensione endocranica, con o senza segni neurologici focali • Età a rischio: anziani • Aspetto radiologico: iper‐ od iso‐densità, unilaterale o bilaterale • Intervento chirurgico: evacuazione in alcune circostanze Emorragie subaracnoidee • Causa: escludere sottostante rottura di aneurisma • Localizzazione: cisterne basilari • Evoluzione: minuti, ore • Profilo clinico: cefalea, meningismo, manifestazioni ritardate, vasospasmo, idrocefalo per alterazione della dinamica liquorale ed ostacolato riassorbimento liquorale • Età a rischio: tutte • Aspetto radiologico: sangue lungo la corteccia nello spazio sub aracnoideo • Intervento chirurgico: generalmente non necessario Emorragie intracerebrale • Causa: sono raccolte ematiche intracerebrali arteriose, che possono essere satellite di un focolaio lacero‐
contuso. Possono derivare anche da un sanguinamento di origine tumorale o da malformazione vascolare • Sedi: frontale, temporo‐parietale, più raramente della fossa cranica posteriore • Clinica: intervallo libero breve, deficit focali (emiplegie, afasie, crisi epilettiche, deficit dei nervi cranici) • Diagnosi: TC, angiografia • Terapia o Conservativa: antiedemigeni osmotici e monitoraggio o Chirurgico Par III: Traumi vertebro‐midollari (TVM) Generalità I TVM possono suddividersi in: • TMV amielico: con frattura e/o lussazione senza interessamento midollare • TMV mielico con frattura e/o lussazione ed interessamento midollare • Spinal cord injury: interessamento midollare senza interessamento osteo‐ligamentoso Il danno midollare può presentarsi come: • Commozione midollare: visibile solo all’osservazione anatomopatologica, con microscopiche aree necrotico‐
emorragiche, si rileva clinicamente come perdita totale della funzione spinale al di sotto della lesione, che si risolve in pochi minuti o in ore Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
Contusione midollare: vi è un edema importante a carico del midollo, con microlesioni necrotico‐
emorragiche. Col passare dei giorni l’edema si riduce, ma resta una cicatrice sierotica in relazione all’infiltrazione linfocitaria e gliale • Lacerazione midollare: si osserva spesso in seguito a gravi fratture, la dura spesso è lacerata in più punti ed il canale vertebrale occupato da frammenti ossei. L’area midollare coinvolta risulta in una massa necrotico‐
emorragica Da un punto di vista epidemiologico, la fascia d’età più colpita è tra i 16 ed i 30 anni, i maschi sono più colpiti. Le eziologie più frequenti sono: incidenti stradali, cadute, violenze. La patogenesi è riconducibile a lesioni da: iperflessione, flessione‐rotazione, iperestensione, estensione‐rotazione, compressione. Clinica • Instabilità vertebrale: perdita della capacità di sopportare carichi statici e dinamici o Complicanza maggiore dei TVM o Responsabile di dolore, deficit neurologici e deformità o Si realizza per lesione di due pilastri di Louis (anteriore, medio o posteriore) • Spinal cord injures o Lesione incompleta Sindrome centrale del midollo spinale Sindrome di Brown‐Séquard Sindrome dell’arteria spinale anteriore Sindrome dei cordoni posteriori o Lesione completa: shock spinale: perdita transitoria di tutte le funzioni neurologiche. Può osservarsi sia dopo una lacerazione che dopo una commozione cerebrale, poiché sarebbe dovuta alla brusca cessazione dell’attività degli interneuroni e dei sistemi vegetativi sui circuiti alfa e gamma. Fase iniziale o della diaschisi • Paralisi • Anestesia • Areflessia osteotendinea • Ipotonia • Ritenzione urinaria e fecale e priapismo Fase dell’ipereccitabilità o dell’automatismo • Ipertonia di tipo piramidale sino alla spasticità • Iperreflessia osteotendinea • Automatismo vescicale e rettale Fase terminale o dell’ipoeccitabilità • Incontinenza vescicale e rettale • Atrofia muscolare Sindromi correlate, infine, sono: • Vescica neurologica: è una disfunzione neurologica del basso apparato urinario, che può manifestarsi in maniera variabile, dalla ritenzione all’incontinenza urinaria: o incontinenza da sforzo: nasce da un problema allo sfintere, causato da lesioni sacrali midollari o dei nervi periferici; o incontinenza da urgenza: è sintomo di vescica iper‐reflessica. Il paziente distingue l’urgenza alla minzione, ma può non raggiungere il bagno per tempo; o incontinenza di tipo riflesso: causata da lesioni nervose complete; o incontinenza da rigurgito: in fase di riempimento la pressione intravescicale supera quella di chiusura uretrale, causando un continuo gocciolamento d’urina che può provocare escoriazioni e rossore dei genitali esterni Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
incontinenza urinaria totale: vescica e uretra sono virtualmente un condotto aperto. È un tipo d’incontinenza raramente causata da una disfunzione vescicale neurologica. o Cause lesioni o traumi dovuti ad estesa chirurgia pelvica (es. resezione addomino‐perineale per carcinoma del retto e isterectomia radicale); patologie evolutive del midollo spinale (es. diabete mellito, sclerosi multipla); patologie neurologiche pediatriche (es. mielodisplasia, agenesia sacrale); lesioni sovrapontine (es. Morbo di Parkinson); agenti infettivi; tossine (es. alcool o metalli pesanti); infezioni da herpes (herpes zoster); agenesia sacrale; tumori del midollo osseo (cauda equina). Sindrome della cauda equina: rappresenta una serie di condizioni neurologiche caratterizzate da una perdita acuta della funzione del plesso lombare e di quello sacrale in conseguenza di una lesione delle radici dei nervi spinali localizzate all'interno del canale vertebrale, caudalmente al termine del midollo spinale(che si localizza intorno alle vertebre L2‐L3 e viene definito cono midollare), nella cosiddetta cauda equina. o Cause Lesioni traumatiche, anche iatrogene, come a seguito di anestesia spinale con rottura del catetere e rilascio dell’anestetico nella cauda Ernia discale Neoplasie Artriti, spondilolistesi, spondilite anchilosante, tubercolosi ossea o Clinica Paraplegia flaccida ed abolizione dei riflessi rotulei Ritenzione urinaria seguita da incontinenza urinaria (vescica neurogena) Incontinenza anale Disfunzione erettile Anestesia “a sella” (localizzata all’inguine) Dolore o
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ IV PROF MORACI TUMORI CEREBRALI Par I: Generalità Introduzione I tumori cerebrali sono diversi e possono provocare numerosi sintomi a causa delle loro dimensioni, della loro sede e delle loro caratteristiche di invasività. Generalmente, distruggono i tessuti in cui sono situati, spostano quelli circostanti, sono una causa frequente di aumento della pressione intracranica e spesso hanno esito letale. Vi sono, inoltre, una serie di nozioni generali preliminari da conoscere: • Molti tipi di tumori, sia primari che secondari, si sviluppano nella cavità cranica e nel canale spinale. Alcuni sono molto più frequenti di altri e tendono a manifestarsi in particolari gruppi di età • Alcuni tumori, come il craniofaringioma, il meningioma e lo schwannoma, hanno una propensione a crescere in aree particolari della cavità cranica, dando origine, quindi, ad alcune sindromi neurologiche altamente caratteristiche • La presenza di alcune patologie, come l’AIDS, di un disturbo ereditario, come la neurofibromatosi, o di alcune forme cancerose sistemiche, predispone allo sviluppo di tumori del SN • La velocità di crescita e l’invasività dei tumori è variabile: alcuni, come il glioblastoma, sono altamente maligni, mentre altri, come il meningioma, sono benigni, evolvono lentamente ed hanno azione piuttosto compressiva • Le neoplasie sistemiche possono, attraverso meccanismi poco conosciuti, esercitare effetti remoti sul SN, totalmente distinti dalle loro azioni compressive, infiltranti o metastatiche (effetti paraneoplastici). Tali effetti possono spesso rappresentare la presentazione iniziale o l’unica manifestazione clinica della neoplasia di base. • Le neoplasie metastatiche sono molto più comuni dei tumori primitivi del SN. Alcuni tipi di cancro, inoltre, tendono a metastatizzare più di altri. In generale, la tendenza dei tumori sistemici a metastatizzare al SN, come dimostrato dalle autopsie, è elevatissima (25%), solo che spesso non danno segni clinici Classificazione i tumori endocranici possono essere di natura primitiva o secondaria, cioè metastatici: come detto, i secondi sono più frequenti. I tumori primitivi sono stati classificati dall’OMS secondo la morfologia, l’istogenesi e la biologia (prima nel 2000, poi modificata nel 2007): • Tumori neuroepiteliali o gliomi o Tumori atrocitari Astrocitoma pilocitico (I grado: i gradi indicano la biologia del tumore, da benigno a maligno) Astrocitoma diffuso (II grado) Astrocitoma anaplastico (III grado) Glioblastoma multiforme (IV grado) Astrocitoma subependimale a cellule giganti (I grado) Xantoastrocitoma pleiomorfico (II grado) o Tumori oligodendrogliali Oligodendroglioma (II) Oligodendroglioma anaplastico (III) o Tumori ependimali Ependimoma (II) Ependimoma mixopapillare e subependimoma (I) Ependimoma anaplastico (III) o Tumori misti Oligoastrocitoma (II) Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Oligoastrocitoma anaplastico (III) Altro (es: ependimo‐astrocitoma) o Tumori di origine incerta Glioma angiocentrico (I) Glioma cordoide del III ventricolo (II) Spongioblastoma polare (IV) Astroblastoma (IV) Gliomatosis cerebri (IV) o Tumori dei plessi corioidei Papilloma dei plessi corioidei (I) Papilloma atipico (II) Carcinoma (III) o Tumori neuronali e misti neurogliali Gangliocitoma (I) Ganglioglioma (I) Gangliocitoma displastico del cervelletto (sindrome di Lhermitte‐Duclos) Ganglioma anaplastico (III) Astrocitoma desmoplastico infantile e ganglio glioma (I) Tumore neuro epiteliale disembrioplastico (I) Neurocitoma centrale (II) Neurocitoma extraventricolare (II) Neuroblastoma olfattorio (estesioneuroblastoma) Liponeurocitoma cerebellare (II) Paraganglioma spinale (I) Tumore glioneuronale papillare (I) Tumore glioneuronale formante rosette del IV ventricolo o Tumori pineali Pinealocitoma (I) Tumori pineali a differenziazione intermedia (II‐III) Pinealoblastoma (IV) Forma mista o Tumori embrionali Medulloblastoma (IV) • Desmoplastico • A cellule giganti • Melanotico • Medullomioblastoma Tumori neuro ectodermici (PNET, IV) medulloepitelioma Tumore rabdoide/teratoide atipico (IV) Neuroblastoma Retino blastoma Ependimoblastoma Tumori dei nervi periferici o Schwannoma (I, neurinoma, neurilemmoma) o Neurofibroma (I) o Perineurinoma (I‐III) o Tumori delle guaine nervose periferiche (, o schwannoma maligno, II‐IV) Tumori meningei o Tumori meningoteliali Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
•
•
•
•
Meningioma (I) Meningioma atipico (II) Meningioma anaplastico o maligno (III) o Tumori non meningoteliali Mesenchimale benigni: osteocartilagineo, lipoma, istiocitoma fibroso Mesenchimali maligni: condrosarcoma, emangiopericitoma, rabdomiosarcoma, sarcomatosi meningea Lesioni melanocitiche primitive: melanosi diffusa, melanocitoma, melanoma maligno Tumori ematopoietici: linfoma maligno, plasmocitoma, sarcoma granulocitico Di incerta istogenesi: emangioblastoma Tumori emopoietici o Linfoma maligno primitivo o Plasmocitomi o Sarcoma granulocitico Tumori a cellule germinali o Germinomi (o seminomi) o Carcinomi embrionali o Carcinomi del sacco vitellino o Corion carcinomi o Teratomi (maturi, immaturi, con trasformazione maligna) o Misti Tumori della regione sellare o Craniofaringioma (I) o Tumore a cellule granulari della neuroipofisi (I) o Pituicitoma (I) o Oncocitoma a cellule fusate dell’adenoipofisi (I) Tumori regionali o Paraganglioma (o chemodectoma) o Condroma o Condrosarcoma o Carcinoma Tumori metastatici: singoli o multipli Cisti e lesioni simil‐tumorali o Cisti della tasca di Rathke o Epidermoide o Dermoide o Cisti colloide del terzo ventricolo o Cisti enterogena o Cisti neuro gliale o Tumore a cellule granulari (coristoma, adenocitoma) o Amartoma neuronale ipotalamico o Eterotopia naso‐gliale o Granuloma plasmacellulare Importante è citare i tumori più frequenti: • Nel bambino: astrocitoma pilocitico ed altri astrocitomi, glioma maligno, medulloblastoma, craniofaringioma, tumori delle cellule germinali • Nell’adulto e nell’anziano: glioblastoma, meningioma, linfomi, adenoma ipofisario, tumori dei nervi cranici e spinali Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Clinica generale I tumori benigni nella loro evoluzione esercitano un’azione compressiva sul parenchima cerebrale: in caso di crescita lenta, la plasticità del parenchima cerebrale consente un adattamento del cervello attorno alla lesione, con sintomatologia tardiva. I tumori maligni, invece, hanno carattere infiltrante e recidivante dopo asportazione; non danno metastasi per via ematica, ma per via liquorale. L’insorgenza della sintomatologia è più rapida, in rapporto non solo al carattere infiltrante, ma anche alla rapidità di crescita, che non consente un adattamento del cervello al nuovo processo occupante spazio. Comunque, in generale, possono aversi: • Segni focali (vedi dopo) • Sindrome d’ipertensione endocranica: triade tipica composta da: o Cefalea o Vomito a getto: a digiuno e non preceduto da nausea o Papilla da stasi • Fenomeni irritativi correlati con la gliosi reattiva attorno alla lesione • Altro: bradicardia, deficit di nervi cranici • Compromissione della coscienza fino al coma negli stadi tardivi Clinica per sede • Regione prefrontale: gliomi, meningiomi, metastasi. Deriva una sindrome clinica caratterizzata da: o Disturbi psichici (particolarmente gravi in caso di interessamento del corpo calloso) con turbe della memoria a breve termine o Perdita della capacità critica o Scarsa o nulla partecipazione emozionale alla propria malattia o Facile irritabilità e tratti moriatici del comportamento o Possibili anche disturbi dell’equilibrio, motori ed aprassici o Afasia di Broca per interessamento dell’emisfero dominante • Base del lobo frontale: i disturbi in questa sede sono dovuti per tumori a localizzazione basale anteriore o, più spesso, extracerebrale, come i meningiomi. Alla sindrome prefrontale si aggiungono: o Anosmia omolaterale al tumore o Disturbi visivi mono‐ e bi‐laterali o Sindrome di Foster‐Kennedy: atrofia ottica primaria omolaterale ed edema papillare controlaterale • Giro prefrontale (area motoria) o Emiparesi contro laterale o Crisi epilettiche motorie tonico‐cloniche jacksoniane o generalizzate • Lobulo paracentrale: qui si localizzano, solitamente meningiomi. La sintomatotologia è caratterizzata da: o Paresi dell’arto inferiore contro laterale o Possibili crisi motorie jacksoniane • Tumori parietali o Parestesie ed anestesie dell’emisoma controlaterale: bruciori, dolori, diminuzione della sensibilità tattile e/o profonda e della sensibilità spaziale (astereognosia) o Possibile associazione di segni piramidali o Somatoagnosia in caso di lesioni nell’emisfero non dominante (il paziente non riconosce l’emisoma contro laterale alla lesione), con aprassia ed agnosia o Afasia di Wernicke in caso di lesioni all’emisfero dominante, con agnosia digitale (fingeragnosia) • Tumori temporali o Crisi uncinate: caratterizzate da allucinazioni olfattive e gustative, associate ad atti della deglutizione e della masticazione, cui seguono alterazioni della coscienza o Possibile interessamento delle vie ottiche Allucinazioni visive, visioni complesse, macropsie, micropsie, “deja vu” Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Alterazioni del campo visivo: emianopsia contro laterale omonima Pseudo assenze temporali: il paziente per breve tempo perde il contatto con l’ambiente, con obnubilamente del sensorio, e compie atti automatici o Allucinazioni uditive e vertiginose o Afasia di Wernicke in caso di localizzazione all’emisfero dominante Tumori occipitali o Deficit campimetrici: emianopsia o quadrantopsia contro laterali o Crisi epilettiche o Allucinazioni visive o Disturbi della motilità coniugata degli occhi con deviazione verso il lato della lesione Tumori dei nuclei della base: soprattutto gliomi o Striato: discinesia, distonia o Talamo: disturbi della sensibilità o Coinvolgimento della capsula interna: emiparesi contro laterale, emianestesia, emianopsia contro laterale Tumori della regione sellare: adenomi ipofisari, craniofaringiomi, ma anche meningiomi e gliomi o Sindrome chiasmatica: emianopsia bitemporale o Turbe endocrine In caso di adenomi secretivi: ipersecrezione In fase tardiva: insufficienza ipofisaria con ipogonadismo, disturbi del ciclo mestruale, amenorrea, impotenza o Ipertensione endocranica: soprattutto nei bambini, sia perché in questi casi i disturbi visivi sono scarsamente riferiti, sia perché le lesioni sono più facilmente ostruttive Tumori endoventricolari: ependimomi, ependimoblastomi, papillomi epidermoidi, cisti colloidi del III ventricolo o Segni di ipertensione endocranica: precoci in caso di localizzazione al III o IV ventricolo, tardivi in caso di localizzazione ai ventricoli laterali o Crisi epilettiche o Nei tumori del III ventricolo: si associano deficit del visus e disturbi ipotalamici o Nei tumori del IV ventricolo: sono soprattutto infantili e si presentano con idrocefalo triventricolare con ipertensione endocranica, segni cerebellari, nistagmo, disturbi dell’equilibrio e deficit dei nervi cranici Tumori cerebellari: medulloblastomi, tipici dell’infanzia, ed ependimomi o Del verme: sindrome cerebellare statica: disturbi dell’equilibrio e della stazione eretta, segno di Romberg positivo, andatura a gambe allargate, nistagmo, ipotono, posizione coatta del capo, inclinato dal lato della lesione, sindrome da ipertensione endocranica ad insorgenza precoce o Degli emisferi (anche astrocitomi ed emangioblastomi): sindrome cerebellare dinamica: deviazione omolaterale della marcia, dismetria alla prova indice‐naso e tallone‐ginocchio, adiadococinesia, asinergia omolaterale, nistagmo, vertigini, ipotono e diminuzione dei riflessi profondi dal lato della lesione Tumori del tronco: gliomi; sindromi alterne o Sindrome di Weber: paralisi omolaterale dell’oculomotore, emiparesi contro laterale o Sindrome di Millard‐Gubler: deficit dell’abducente e del faciale omolaterale, emiparesi contro laterale Tumori dell’angolo ponto‐cerebellare: neurinomi a partenza dalle cellule di Schwann della porzione vestibolare del nervo acustico, meno frequentemente meningiomi e colesteatomi o Primo stadio: acufeni, paracusie omolaterali, vertigini, disturbi dell’equilibrio, scomparsa del riflesso corneale omolaterale o Secondo stadio: parestesie nel territori del trigemino, paralisi faciale periferica omolaterale, atassia cerebellare o
•
•
•
•
•
•
•
Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
Terzo stadio: ipertensione endocranica, con compromissione dei nervi misti (IX, X, XI): disfagia, disfonia, deficit di sternocleidomastoideo e trapezio Altre caratteristiche generali • Diagnosi o Clinica o Neurofisiologica: EEG, PEV o Neuraradiologica: Rx, TC, RM (con e senza mdc), angiografia, angio‐RM o Medicina nucleare: PET, SPET • Terapia o Chirurgica: asportazione radicale ove possibile o Radioterapia: gamma‐knife, radiochirurgia stereotassica o Chemioterapia Par II: Tumori gliali Introduzione Sono chiamati gliomi tutti i tumori che originano dalle cellule della neuroglia; secondo l’ultima classificazione OMS possono essere inclusi tutti i tumori di origine neuroepiteliale. La sintomatologia è rappresentata da sintomi focali e sintomi d’ipertensione endocranica: l’esordio e l’evoluzione sono in rapporto alla velocità di crescita, e pertanto al grado di malignità biologica, ed alla relazione anatomica del tumore con strutture vascolo‐nervose o ventricolari. Esami neuroradiologici consistono in: • TC: è il primo esame da praticare, senza e con mdc, in caso di sospetto clinico di tumore endocranico o Gliomi a basso grado (I‐II): appaiono ipodensi, con margini non ben definiti e scarso effetto massa, con basso o nullo enhancement dopo infusione di mdc o Astocitoma anaplastico e glioblastoma multiforme: appaiono disomogenei, con margini irregolari e con notevole edema perilesionale, con enhanncement dopo infusione di mdc • RM: ha la capacità di dare immagini multiplanari, evidenziando meglio le caratteristiche morfologiche e consentendo una migliore localizzazione: o Gliomi a basso grado: aree omogenee o Gliomi ad alto grado: aree disomogenee con edema perifocale La terapia più valida è quella chirurgica, seguita da quella radiante per la prevenzione di eventuali recidive: • Craniotomia a cielo aperto in corrispondenza del tumore: se in sede frontale, parietale, temporale, occipitale o combinata • Biopsia stereotassica: se in sedi non aggredibili a cielo aperto (nuclei della base, tronco encefalico) o per le gravi condizioni del paziente. Tale approccio viene eseguito come segue: si pratica un piccolo foro di trapano sulla volta del paziente e si introduce, grazie alla guida di un casco stereotassico, una sottile sonda di pochi millimetri di diametro attraverso la quale si introducono, nella compagine del tumore, sostanze radioattive. L’elevata chemioresistenza delle neoplasie gliali e la presenza della BEE rappresentano i principali ostacoli che hanno rallentato l’applicazione della chemioterapia ai gliomi: un tempo utilizzata la nitrosurea, oggi si utilizza la temozolomide. Questo chemioterapico è particolarmente importante in associazione alla radioterapia: difatti esso inattiva l’enzima O‐6‐metilguanina‐DNA‐metiltransferasi, enzima che, a seguito di irradiazione, ripara il danno al DNA della cellula. Pertanto, in caso di irradiazione e concomitante blocco dell’enzima di riparo, il danno risulta maggiore. Tumori astrocitici • Astrocitoma pilocitico o Benigno (I) o Tipico del bambino, con un picco intorno ai 10 anni, ma frequente anche nei giovani adulti Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Sede tipica cerebellare (astrocitoma cerebellare), ma anche lungo le strutture della linea mediana e nei nervi ottici (glioma ottico). Altre sedi colpite possono essere: III ventricolo, talamo, tronco cerebrale e la superficie mediale del lobo temporale o Talora interessamento del II nervo cranico o Prognosi benigna Astrocitoma o Grado II o Varianti: fibrillare, gemistocitico, protoplasmatico o Rappresenta il 10‐15% dei tumori endocranici o Picco d’incidenza: 30‐40 anni o Localizzazione tipica: convessità degli emisferi cerebrali, meno frequentemente a livello dei gangli della base, del tronco cerebrale e del corpo calloso o Caratteristiche infiltranti o Possibili recidive dopo chirurgia Astrocitoma anaplastico o Maligno (III) o Picco d’incidenza: 30‐40 anni o Prognosi infausta Glioblastoma multiforme o Altamente maligno (IV) o Picco d’incidenza: 45‐60 anni o Localizzazione: emisferi cerebrali. Tipica è anche una localizzazione, se a partenza dal corpo calloso, bilaterale interemisferica, assumendo il tipico aspetto di “glioblastoma a farfalla”, a prognosi altamente infausta o Frequente diffusione allo spazio subaracnoideo, al sistema ventricolare e lungo gli spazi periventricolari o Prognosi molto infausta (speranza di vita da alcuni mesi ad 1‐2 dalla diagnosi) o Frequenti recidive dopo asportazione chirurgica o
•
•
•
Tumori oligodendrogliali Sono rappresentati dall’oligodendroglioma (II) e dall’oligodendroglioma anaplastico (III‐IV): rappresentano circa il 5% dei gliomi ed hanno una massima incidenza intorno ai 30‐40 anni. Sono localizzati negli emisferi cerebrali e nel tronco ed hanno una lentissima evoluzione. Gli oligodendrogliomi puri sono le neoplasie gliali a prognosi migliore, con sopravvivenze mediane di 8‐10 anni (II) e 4‐
5 anni (III). Gli oligoastrocitomi, invece, presentano popolazioni cellulari sia astrocitari che oligodendrogliali (una popolazione oligodendrogliale si considera rilevante se rappresenta almeno il 25% della neoplasia) ed hanno una prognosi intermedie tra le forme oligodendrogliali pure e quelle astrocitarie. Il trattamento è chirurgico, seguito eventualmente da radioterapia e follow‐up. Par III: Tumori del sistema ventricolare •
Tumori ependimali o Tipologie: Ependimoma (II): cellulare, papillare, a cellule chiare Ependimoma anaplastico (III) Ependimoma mixopapillare (I) Subependimoma (I) o Generalità: sono tumori originati dalle cellule dell’ependima, all’interno od in prossimità delle cavità ventricolari, con massima frequenza nel IV ventricolo, e quindi nella fossa cranica Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
posteriore, ma osservabili anche nel III ventricolo, nell’acquedotto di Silvio e nel canale ependimale spinale. Rappresentano il 5‐10% dei gliomi, con un’incidenza maggiore in bambini e giovani adulti o Sintomatologia: nelle localizzazioni encefaliche è analoga ai gliomi occupanti spazio, con sindrome d’ipertensione endocranica ed idrocefalo ostruttivo Tumori del plesso corioideo: sono tumori rari, che originano dai plessi corioidei, più frequentemente nel IV ventricolo, e quindi nella fossa cranica posteriore. Colpiscono l’età adulta e danno una sintomatologia analoga a quella degli ependimomi. Possono metastatizzare per via liquorale. o Papilloma (I) o Carcinoma (II) Cisti colloidi (o neuroepiteliali): sono tumori primitivi del III ventricolo, derivanti dall’epitelio embrionario‐
ependimale. Hanno una bassa incidenza ed una frequenza maggiore fra i 30 ed i 50 anni. Sono tumori ovoidali, che tendono a riempire il III ventricolo, attaccati alla tela corioidea, o più raramente al plesso corioideo, da un piccolo peduncolo. Crescono lentamente, il contenuto è gelatinoso e la parete cistica formata da una sottile capsula fibrosa rivestita da cellule ependimali. La loro crescita ostacola il deflusso liquorale, provocando idrocefalo e sindrome da ipertensione endocranica Par IV: Tumori della fossa cranica posteriore e dell’angolo ponto‐cerebellare Medulloblastoma È uno dei più frequenti tumori della fossa cranica posteriore dei bambini, soprattutto fra i 5 ed i 10 anni, rappresentando circa il 15‐20% dei tumori dei bambini; può comunque colpire anche gli adulti. Di solito origina e si localizza nel verme cerebellare, da dove diffonde nella regione del IV ventricolo, delle tonsille cerebellari e degli emisferi cerebellari; talvolta, può essere localizzato primitivamente a livello degli emisferi cerebellari. È un tumore di origine neuroepiteliale, costituito da elementi immaturi ed indifferenziati (medulloblasti) e può raggiungere notevoli dimensioni. Istologicamente è un tumore ad altissima densità cellulare, con disposizione a pseudorosette e scarsa vascolarizzazione. Una volta raggiunta la superficie, il tumore si diffonde infiltrando lo SSA e le cellule, trasportate dal liquor, metastatizzano lungo l’asse cerebrospinale sino alla cauda equina. • Sintomatologia: o Periodo prodromico: astenia, irritabilità, facile affaticamento o Segni di ipertensione endocranica: in particolare cefalea e vomito, scatenati da movimenti del capo; papilla da stasi con compromissione del visus o Segni di interessamento vermiano: disturbi della stazione eretta e della deambulazione (sindrome cerebellare statica) o Segni di interessamento emisferico: ipotonia, dismetria, disartria, adiadococinesia, asinergia, tremori, parola scandita, nistagmo orizzontale (sindrome cerebellare dinamica) o Deficit dell’abducente con diplopia o In caso di progressione protratta in assenza di intervanto terapeutico: deficit del faciale, del glosso‐
faringeo e del vago; sofferenza del ponte e del bulbo o Cerebellar fits: crisi dovute ad impegno tonsillare nel forame magno ed erniazione transtentoriale del verme con compromissione mesencefalica Violento dolore suboccipitale Iperestensione del tronco con capo in opistotono Globi oculari ruotati verso l’alto Bradicardia Irregolarità del respiro fino all’arresto respiratorio per compressione bulbare Perdita di coscienza • Neuroradiologa o Radiografia del cranio: evidenzia i segni dell’ipertensione endocranica. Ne bambini è frequente la diastasi delle suture con aumento delle impressioni digitate Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
TC: i medulloblastomi si presentano come masse omogenee di lieve iperintensità, talvolta isodense, sulla linea mediana della fossa cranica posteriore, a margini ben definiti. L’iniezione del mdc produce un omogeneo enhancement o RM: è superiore alla TC per l’alta definizione anatomica dei rapporti con le strutture neuro vascolari. Sia in T1 che in T2 si osserva una massa isointensa, o leggermente ipointensa, omogenea, talora circondata da vasi, dislocante il IV ventricolo, che disomogeneamente aumenta d’intensità dopo iniezione di Gadolino o Angiografia: raramente utilizzata, consente di evidenziare: Spostamento in avanti della porzione inferiore dell’arteria basilare contro il clivus Deformazione e dislocazione dell’arteria cerebellare inferiore Spostamento in alto e laterale della vena del recesso laterale del IV ventricolo Prognosi: è un tumore altamente maligno, che dopo asportazione tende alla rapida recidiva. Inoltre, tende a dare metastasi per via liquorale anche se trattato con radio‐ e chemio‐terapia. La mortalità a 2‐3 anni è elevatissima Terapia o Prima dell’intervento chirurgico Secondo alcuni: derivazione liquorale per diminuire la pressione intracranica e facilitare l’intervento chirurgico Secondo altri: massive dosi di corticosteroidi, sempre per ridurre la PIC o Intervento chirurgico: asportazione del tumore, preferibilmente a frammenti per evitare trazioni sul tronco. L’uso del laser e dell’aspiratore ad ultrasuoni ha aumentato la possibilità di un’exeresi con pochi o nessun danno alle strutture vicine o Dopo l’intervento: Radioterapia centrata a livello del cranio e del rachide chemioterapia o
•
•
Schwannoma del nervo acustico • Caratteristiche generali o Tumore benigno, più frequente nelle donne e tra i 35 ed i 55 anni o Se bilaterale, è patognomonico della neurofibromatosi II o Origina dalla branca vestibolare nel suo tratto entro il canale acustico interno o Cresce per espansione, comprimendo le strutture vicine, come cervelletto, bulbo, ponte, radici trigeminali • Sintomatologia o Fase otologica: Disturbi della porzione cocleare: acufeni Disturbi della porzione vestibolare:ipoacusia, sindrome vertiginosa o Seconda fase: paresi faciale periferica, parestesi, algie ed ipoestesie nei territori delle radici trigeminali eventualmente coinvolte o Terza fase: compressione di altre strutture o Sindrome da ipertensione endocranica Par V: Tumori della regione ipotalamo‐ipofisaria Adenoma ipofisario • Generalità: sono tumori benigni che originano dal lobo anteriore dell’ipofisi e si presentano prevalentemente tra i 25 ed i 50 anni • Sintomatologia o Adenomi secernenti GH‐secernenti: • In età prepubere: gigantismo Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
• Nell’adulto: acromegalia Prolattina‐secernenti: sono tra i più frequenti e si manifestano con amenorrea, galattorrea, riduzione della libido e cefalea ACTH‐secernenti: sono rari, si manifestano con la sindrome di Cushing o Adenomi non secernenti Progressiva insorgenza di insufficienza ipofisaria con ipogonadismo, disturbi del ciclo mestruale, amenorrea, impotenza, ipotensione arteriosa Estensione in sede sovrasellare e laterosellare: cefalea, turbe del visus e del campo visivo (sindrome chiasmatica), deficit dei nervi oculomotori e del trigemino Possibili segni di sofferenza del lobo frontale e/o temporale Diagnosi o Test endocrinologici o Neuroradiologia Tecniche: Rx, scintigrafia, TC, RM Quadro: sella turcica slargata ed occupata dalla lesione. Occorre valutare attentamente il grado di interessamento delle strutture vascolo‐nervose di questa regione Terapia o Farmacologica: somatostatina e bromocriptina nelle forme secernenti o Radioterapica o Chirurgica Per via trans‐sfenoidale per i tumori con modesto sviluppo sovra sellare Per via intracranica per gli adenomi più voluminosi
•
•
Craniofaringioma • Generalità: è un tumore epiteliale ad origine da nidi di cellule squamose della pars puberali (residui embrionali dell’adenoipofisi). Possono insorgere, in età adulta, per alterazioni cellulari o metaplasia di cellule ipofisarie. Comunque, la loro incidenza è più elevata nell’infanzia e nell’adolescenza. Crescono nella regione sellare con sviluppo infra‐ e sovra‐sellare, interessando talvolta il III ventricolo, con conseguenti fenomeni compressivi sull’adenoipofisi. Sono di natura benigna e quindi a crescita extra‐assiale e lenta, non infiltrante. Possono avere dimensioni variabili e presentare parti solide, cistiche e calcficate • Sintomatologia o Nel bambino: Ostruzione delle vie liquorali con sindrome d’ipertensione endocranica: disturbi del visus e del campo visivo Segni di ipopituitarismo: soprattutto con ritardo di accrescimento o Nell’adulto Alterazioni del visus e del campo visivo Disturbi della sfera sessuale: dismenorrea, amenorrea, riduzione della libido, impotenza Altro: obesità, diabete insipido, polifagia e disturbi psichiatrici • Neuroradiologia o Rx: evidenzia calcificazioni del cranio ed alterazioni sellari o TC e RM: danno immagini disomogenee per le componenti calcifiche e cistiche della lesione, consenteno di definire i rapporti con le strutture limitrofe o Angiografia ed angio‐RM: sono utili per programmare l’approccio chirurgico • Terapia o Chirurgica: asportazione con tecnica microchirurgica Per via intracranica nelle forme ad estrinsecazione sovra sellare Per via trans‐sfenoidele nelle forme infrasellari ed a prevalente natura cistica Approcci comibati: intracranico seguito da sfenoidale o Stereotassica: in alternativa a quella chirurgica Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
o
Radiante: post‐chirurgica Par VI: Meningiomi Tipi e caratteristiche • Meningioma benigno (I) o Caratteristiche generali 15‐20% dei tumori endocranici dell’adulto Incidenza massima tra i 30 ed i 50 anni F>M : sono infatti tumori ormono‐dipendenti • Sviluppo a 30‐50 anni: periodo di massima attività gonadica • Associazione con obesità ed altri carcinomi Origine dagli involucri meningei, in particolare da “nidi” di cellule aracnoidee localizzate nello spessore della dura madre Sono ad accrescimento lento e comprimono il parenchima cerebrale senza infiltrarlo Infiltrazione dei canali haversiani dell’osso: prevalenza a volte dei fenomeni erosivi, a volte di quelli proliferativi con iperostosi Possibilità di recidiva dopo asportazione anche totale (la terapia è chirurgica) o Anatomia patologica Ben capsulati, a superficie liscia o bernoccoluta, di colore rosso o giallastro e di consistenza duro‐elastica, oppure più molle e friabile Forma variabile con la sede • Sferica per meningiomi degli emisferi cerebrali • Ovale per i meningiomi della convessità • A clessidra per quelli della falce • A placca per quelli della base del cranio o Sottotipi Meningoteliale (o sinciziale o endoteliale): il citoplasma delle cellule è indistinto, risultando in grandi cellule endoteliali disposte a buccia di cipolla Transazionale: le cellule sono più allungate e formano vortici. In caso di degenerazione di questi vortici e di formazione di sali di calcio, si formano corpi psammomatosi (meningioma psammomatoso) Fibroblastico: possiede cellule simil‐fibroblastiche, che formano reticolino e fibre collagene Angiomatoso (emangioblastico ed emangiopericitico): meno frequente e più aggressivo, è formato da capillari o lacune vascolari • Meningioma anaplastico o Evoluzione maligna (III) o Raro o Carattere infiltrante, anche del parenchima cerebrale o Recidiva anche dopo asportazione totale Sintomatologia I meningiomi sono tumori a sviluppo assai lento: pertanto, possono presentare una sintomatologia solo quando il volume diventa notevole, causando segni focali. Per la loro origine meningea, non infiltrano il parenchima cerebrale (tumori “extracerebrali”): esordiscono spesso con crisi jacksoniane, che possono precedere di anni i sintomi focali. Possono aversi: interessamento dei nervi cranici, specie per localizzazioni alla base cranica; modificazioni della teca cranica, se interessata; sindrome da ipertensione endocranica, specie tardiva, ma anche precoce; segni focali. I meningiomi maligni, per le intense reazioni di edema perifocale, danno sintomi da ipertensione endocranica più precoce e più intensi, tali solitamente da mascherare i sintomi focali. Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Possono aversi meningiomi: • Parasagittali o Del terzo anteriore o Del terzo medio o Del terzo posteriore • Della falce • Della convessità o Frontali o Fronto‐centrali e centro‐parietali o Temporali o Occipitali • Della base cranica o Della piccola ala dello sfenoide o Del terzo interno o clinoidei o Del terzo medio od alari o Del terzo esterno o dello pterion o Delle docce olfattorie o Del tuberculum sellae e dello jugum sfenoidale • Della fossa media • Della roccia petrosa • Del clivus • Del forame occipitale • Della fossa posteriore • Intraventricolari • “en plaque” • Meningiomatosi Diagnosi • Rx o Manifestazioni di ipertensione endocranica Dislocamento della pineale Accentuazione delle impronte vascolari sulla teca cranica Assottigliamento dei rilievi ossei della base cranica e delle ossa della teca o Segni più specifici Calcificazioni Lesioni ossee prodotte dal tumore, con modifiche da rarefazione ed addensamento • TC: massa isodensa, ben delimitata ed a margini rotondeggianti, con calcificazioni in un terzo dei casi, circondata da un alone ipodenso da edema perilesionale. L’iniezione di mdc determina un’omogenea ed intensa iperdensità, precisando le dimensioni e la forma della massa • RM: il meningioma appare isointenso al parenchima cerebrale in T1 e leggermente iperintenso in T2. Dopo infusione di Gadolino, assume un grosso enhancemente con possibile “dural tail”, assunzione di mdc anche di una piccola porzione della dura adiacente alla sede di impianto del tumore • Angiografia: i vasi arteriosi penetrano nel tumore ed arrivano sino al suo centro per sfioccarsi in una rete di vasi fini, che drenano poi in grosse vene. Questa disposizione anatomica, unita all’accentuato rallentamento del circolo endotumorale, consente al mdc di rendere evidente il tumore sottoforma di “blush”, che permane anche dopo che gli altri distretti vascolari si sono svuotati dal mdc Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ V PROF MORACI Tumori spinali Par I: Generalità Introduzione I tumori spinali si distinguono, in primis, in primitivi e secondari. Possono originare dal midollo, dalle sue radici, dalle meningi, dai vasi intramidollari o dall’astuccio osseo. Possono quindi distinguersi anche in: • Extradurali: benigni e maligni (neurinoma, meningioma, angioma, lipoma; linfosarcoma, infiltrati leucemici, linfomi di Hodgkin, metastasi). Un tumore extradurale può, attraverso i canali di coniugazione, estendersi nello spazio epidurale assumendo il tipico aspetto “a clessidra”. Possono originare da: o Tessuto osteogenico Benigni: osteoma osteoide, osteoblastoma, osteocondroma, tumore a cellule giganti Maligni: osteosarcoma, condrosarcoma, sarcoma a cellule giganti o Tessuto connettivo Benigni: fibroma, emangioma, cisti aneurismatica Maligni: fibrosarcoma, angiosarcoma, sarcoma a cellule chiare o Tessuto reticolo‐endoteliale ed ematopoietico Benigni; granuloma eosinofilo Maligni: sarcoma di Ewing, mieloma multiplo, linfoma, leucemia • Intradurali o Extramidollari: benigni (neurinoma, neurofibromi, meningioma, epidermoide, dermoide, ependimoma del filum terminale) o Intramidollari: benigni e maligni (astrocitomi, oligodendrogliomi, ependimomi, emangioblastoma, angioreticulomi; astrocitomi anaplastici, metastasi) L’incidenza varia con l’età: • Adulti o Extradurali (78%): metastasi, mieloma, neurofibromi, linfomi o Extramidollari (18%): meningioma, schwannoma o Intramidollari (4%): astrocitomi, emangioblastoma, ependimomi • Bambino o Extradurali (18%): metastasi, linfomi o Extramidollari (64%): dermoidi, epidermoidi o Intramidollari (18%): astrocitomi, gangliogliomi I tumori spinali sono molto meno frequenti di quelli endocranici. Ad eccezione dei meningiomi, che colpiscono preferenzialmente le donne,gli altri tumori si distribuiscono equamente tra i due sessi; inoltre la terza e la quarta decade di vita sono le più colpite. I tumori benigni sono più frequenti di quelli maligni (70 vs 30%) in tutte le età. Clinica La sintomatologia causata dai tumori extradurali ed extramidollari è dovuta alla compressione esercitata sulle radici, sul midollo e sui vasi midollari, mentre quella derivante dai tumori intramidollari è dovuta a distruzione del parenchima midollare. Concorrono allo sviluppo del quadro sintomatologico la formazione di edema parenchimale, nonché sindromi ischemiche date dalla compressione di strutture arteriose e venose (stasi venosa) da parte del tumore, con effetti anche a distanza dalla sede di lesione. Ne derivano: • Sindrome lesionale per compromissione di una o più radici con: o Dolori radicolari: inizialmente molto forti e continui, unilaterali o bilaterali, accentuati da tosse e starnuti, con esacerbazioni parossistiche spontanee, prevalentemente notturne Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
o Disturbi motori: paralisi ed amiotrofie circoscritte ai mielomeri interessati o Abolizione dei ROT corrispondenti o Ipoestesie metameriche Sindrome sottolesionale per interruzione dei fasci midollari o Disturbi motori di tipo piramidale o ROT patologici con segno di Babinski o Disturbi sensitivi Dolori a morso o parestesie al di sotto del livello della lesione Sensibilità termica e dolorifica compromessa più gravemente rispetto a quella propiocettiVa Infine, anestesia sottolesionale completa o Disturbi sfinterici tardivi Sindrome rachidea o Rigidità segmentaria della colonna o Deviazione scoliotica antalgica o Dolore alla digitopressione delle apofisi spinose In aggiunta al diverso interessamento longitudinale, può esservi un diverso interessamento trasversale, che può essere completo o parziale: • Sindrome trasversa completa o Deficit motori del primo e del secondo motoneurone o Deficit sensitivi: anestesia completa o Disturbi vegetativi: gravi disturbi della funzione vescicale, rettale e sessuale • Sindrome trasversa incompleta o Sindrome centrale del midollo: interessamento della sostanza grigia o Sindrome di Brown‐Séquard: interessamento solo di una metà laterale del midollo. Ne risulta un quadro caratteristico: Omolateralmente alla lesione • Paralisi motoria spastica da interessamento del fascio piramidale e flaccida da lesione del secondo motoneurone • Assenza della sensibilità profonda (vibratoria, tattile discriminativa e propiocettiva) per interessamento dei fasci di Goll e di Burdach • Disturbi vegetativi: vasodilatazione, ipotermia, anidrosi, assenza del riflesso pilomotore da lesione delle vie simpatiche Controlateralmente alla lesione: anestesia termica e dolorifica e parzialmente tattile per lesione del fascio spino‐talamico o Sindrome dell’arteria midollare anteriore: interessamento della metà anteriore del midollo Comunque, i principali sintomi sono: • Dolore o Vertebrale: cupo, profondo, continuo o subcontinuo, limitato ad alcuni metameri ossei, esacerbato da condizioni che aumentano la pressione endorachidea, con contrattura muscolare (terminazioni nocicettive durali anteriori superficiali, distese dalla neoplasia, e strutture osteoligamentose: nervo di Luschka) o Radicolare: algie violenti, irradiate, più frequenti nei tumori sottodurali intramidollari o Cordonale Per stimolazione del fascio spino‐talamico: algie intense sottolesionali controlaterali Per stimolazione del cordone posteriore: algie violente omolaterali Algie diffuse senza una precisa localizzazione radicolare: tipiche dei gliomi • Disturbi motori Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
Paralisi spastiche, flaccide o miste, a seconda dell’interessamento midollare Più frequenti nelle neoplasie intramidollari (angiomi, gliomi), meno in quelle extradurali Possibili quadri apoplettici in tumori scompensati son edema ed emorragia Progressione Discendente nei tumori intramidollari Ascendente in quelli extramidollari: per la rappresentazione delle fibre piramidali: quelle interne dirette agli arti superiori, quelle esterne agli arti inferiori Disturbi sensitivi o Aree di ipo‐anestesia superficiale o profonda, con o senza livello lesionale, talora indefinito (“anestesia sospesa” come nei tumori intramidollari) o Rappresentazione del disturbo Metamerica: lesioni di corna e radici Cordonale: fasci ascendenti compressi da tumori benigni extramidollari Radicolare: soprattutto da neurinomi o Parestesie e disestesie (formicolii, sensazione di puntura di spillo) Tumori extramidollari: iniziale interessamento dei dermatomeri distali con progressione ascendente Tumori intramidollari: deficit sensitivo prossimale alla lesione con progressione discendente Disturbi sfinterici e sessuali: rari come sintomi d’esordio, si presentano in genere a distanza, specie nelle lesioni intramidollari (angiomi, gliomi) della regione del cono midollare Emorragia subracnoidea o Spontanea o dopo sforzo e/o trauma o Dolore violento tipo stilettata in regione dorso‐lombare, con algie nucali, cruralgia, sciatalgia, contrattura muscolare diffusa, segni di irritazione meningea o Cause più frequenti: angiomi ed ependimomi cono‐cauda Claudicatio neurogena: ipostenia durante la marcia e la prolungata stazione eretta, evolvente in paraparesi spastica, è tipica di gliomi e malformazioni vascolari a sede dorsale (insufficienza vascolare da compressione diretta od indiretta o
o
o
o
•
•
•
•
Diagnosi • Rx diretta • TC senza e con mdc • Mielo‐TC • RMN senza e con mezzo paramagnetico • Angiografia spinale: anche per embolizzazione pre‐operatoria di lesioni vascolarizzate • EMG • SEP • Studio urodinamico Terapia • Medica: mannitolo, glicerolo, diuretici, cortisonici • Radioterapica • Chemioterapica • Chirurgica o Biopsia TC‐guidata o Asportazione completa di meningiomi, neurinomi, metastasi o Asportazione parziale o totale di gliomi o Stabilizzazione vertebrale o Microscopio, aspiratore ad ultrasuoni, endoscopia Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
LEZ IV PROF ROTONDO Malattie da compressione Par I: Ernie discali Generalità Si distinguono: • Bulging (protrusione): le fibre dell’anulus sono stirate ed allungate con perdita di elasticità, ma non interrotte • Ernia molle: erniazione esclusiva del nucleo polposo • Ernia dura: nucleo polposo degenrato, quasi calcificato, associato ad osteofitosi dei corpi vertebrali La terapia conservativa generale prevede: • Riposo a letto • Terapia antinfiammatoria • Miorilassanti • Cortisonici: o Dosaggio elevato o No nel diabete insulino‐dipendente o Associare gastroprotezione • Blocco intratecale • Infiltrazione radicolare TC‐guidata • Chinesiterapia • Manipolazioni vertebrali • Agopuntura Possono aversi: • Ernia discale cervicale o Interessamento Laterale: cervicobrachialgia, deficit radicolari (motori, sensitivi, alterazione dei riflessi) Mediano: sindrome piramidale o Terapia chirurgica Approccio posteriore: foraminotomia posteriore Approccio anteriore: atrodesi intersomatica, artroplastica cervicale • Ernia discale dorsale o Clinica: nevralgia intercostale, mielopatia dorsale o Terapia chirugica: discectomia Approccio posteriore trans peduncolare Approccio laterale e costo‐trasversectomia Approccio anteriore trans toracico • Ernia discale lombare o Interessamento L3‐L4: lombocruralgia, ROT rotuleo, ipo‐anestesia nel territorio radicolare di L4, ipostenia muscolo quadricipite L4‐L5: lombosciatalgia, ipo‐anestesia nel territorio radicolare di L5, ipostenia muscolo tibiale anteriore e estensore lungo dell’alluce L5‐S1: lombosciatalgia, ROT achilleo medioplantare, ipo‐anestesia territorio radicolare di S1, ipostenia muscolo tricipite della sura o Terapia Microchirurgica Percutanea • Indicazione: ernie discali contenute Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
o
Azione: rimozione di parte del nucleo polposo per ridurre la pressione centro discale • Vantaggi: anestesia locale, day surgery Nucleoaspirazione Laserchirurgia: dopo aver introdotto una fibra ottica, il laser produce una vaporizzazione del nucleo polposo con conseguente riduzione della pressione intradiscale Ozonoterapia: può essere praticata sia nei muscoli paravertebrali che nel disco. Il meccanismo d’azione non è chiaro, quelli chiamati in causa sono: potere antiossidante, liberazione di H2O dai mucopolisaccaridi presenti nel disco, diminuzione della pressione intradiscale Termocoagulazione Nucleoplastica Terapia della stenosi del canale spinale: laminectomia + fusione intersomatica con CAGE + stabilizzazione con viti trans peduncolari e barre Par II: Sindromi canalicolari Riguardano la compressione dei nervi che decorrono all’interno dei canali ossei o fibromuscolari: la sintomatologia è caratterizzata da dolori e parestesie nel territorio di distribuzione del nervo interessato: • Sindrome del tunnel carpale: è dovuta alla compressione del nervo mediano al polso nel suo passaggio attraverso il tunnel carpale (canale localizzato al polso, formato dalle ossa carpali e dal legamento trasverso del carpo teso su di esse). La patogenesi occupazionale sembra la causa più frequente: prolungati e/o ripetitivi movimenti di flesso‐estensione del polso (utilizzatori di PC): o Fattori di rischio Lavoro (vedi sopra) Malattie sistemiche: DM, artrite reumatoide, mixedema, amiloidosi Situazioni fisiologiche: gravidanza, contraccettivi orali, menopausa Traumi: pregresse fratture al polso con deformità articolari Artriti ed artrosi deformanti o Clinica Formicolii, dolore, sensazione di intorpidimento o gonfiore alla mano, prevalenti alle prime 3 dita della mano Perdita di sensibilità alle prime tre dita, perdita di forza della mano, atrofia dell’eminenza thenar o Diagnosi Esame obiettivo neurologico Esame elettromio‐neurografico • Neuropatia da compressione del nervo ulnare al gomito da compressione: dopo il nervo mediano, l’ulnare è il nervo che più frequentemente va incontro a neuropatie da compressione (sindromi canalicolari) o Cause Riduzione delle dimensioni della doccia epitrocleo‐olecranica (DEO) Eccesso di volume del contenuto della DEO Alterazioni della dinamica di movimento al gomito ed alterazioni anatomiche dei legamenti o Clinica Disturbi irritativi a carica del IV e V dito: deficit sensitivi Ipotrofia dei muscoli dell’eminenza ipotenar e dei muscoli mediali dell’avambraccio Amiotrofia del primo spazio interosseo, riduzione della forza di presa della mano soprattutto della presa pollice‐indice Scaricato da www.sunhope.it
Appunti di Raffaele Vanacore
•
•
Mano benedicente: atteggiamento ad artiglio incompleto della mano da lesione completa del nervo ulnare; l'anulare e il mignolo avranno la prima falange iperestesa e le altre flesse (paralisi dei muscoli interossei, del terzo e quarto lombricali e prevalenza dell'estensore comune delle dita), mentre l'indice ed il medio avranno la prima falange estesa e le altre tendenzialmente semiflesse (paralisi dei muscoli interossei) o Diagnosi (come sopra) o Terapia: trasposizione del nervo Sindrome di Guyon: è la sindrome da compressione del nervo ulnare al polso nel canale di Guyon (tunnel osseo fibroso tra osso piriforme ed uncinato e legamento piso‐uncinato) o Cause Dirette: anomalie vascolari, piccole neoformazioni (cisti) Indirette: reazioni infiammatorie, microtraumi professionali o Fasi cliniche Irritativa: dolore, parestesie Compressiva: deficit dei muscoli interossei (mano benedicente) Sindrome dell’egresso toracico: è dovuta a compressione delle strutture nervose e vascolari a livello della regione laterocervicale del collo, in particolare del plesso brachiale, dell’arteria e della vena succlavia o Cause: sindrome della costa soprannumeraria, compressione da parte dello scaleno anteriore, anomali congenite, anomali acquisite (esiti scomposti di frattura di clavicola) o Diagnosi Clinica Strumentale: Rx rachide cervicale, ecodoppler dell’arteria succlavia, elettromiografia o Trattamento: Fisioterapia Chirurgia Scaricato da www.sunhope.it