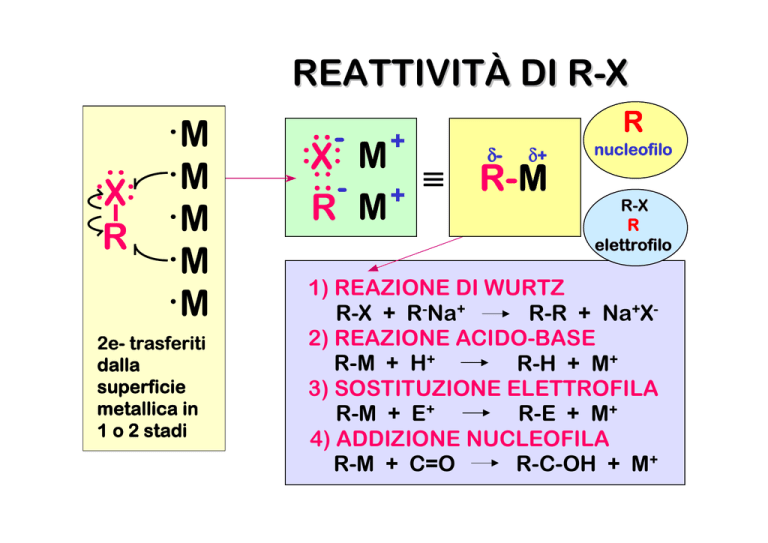
REATTIVITÀ DI R-X
.
.
.. ..
X
R
.M
.M
.M
.M
.M
2e2e- trasferiti
dalla
superficie
metallica in
1 o 2 stadi
.. . . ..X
.. ..
-
+
M
≡
R- M
+
R M
δ-
δ+
R
nucleofilo
R -X
R
elettrofilo
1) REAZIONE DI WURTZ
R-X + R-Na+
R-R + Na+X2) REAZIONE ACIDO-BASE
R-M + H+
R-H + M+
3) SOSTITUZIONE ELETTROFILA
R-M + E+
R-E + M+
4) ADDIZIONE NUCLEOFILA
R-M + C=O
R-C-OH + M+
LEGAMI CARBONIOCARBONIO-METALLO
COMPOSTI ORGANOMETALLICI
R -M
RR -M-X
RR-M-R
R è un residuo organico
M è un metallo
Composti Organometallici
Gli alchil alogenuri (R(R-X) reagiscono con alcuni
metalli per dare composti organometallici:
organometallici:
composti con un legame carboniocarbonio-metallo
Metalli Monovalenti (M = Na, Li)
R- X + 2 M
R-M + MX
Metalli Bivalenti (M = Mg, Cd)
R- X + M
R- M - X
R- X + 2 M
R-M-R + MX2
esempio:
CH3-Li
esempio:
CH3-MgMg-Br
esempio:
CH3-CdCd-CH3
IL LEGAME NEI
COMPOSTI ORGANOMETALLICI
LEGAMI ORGANOMETALLICI
(CARBONIO(CARBONIO-METALLO)
δ-
δ+
C M
covalente
I legami carboniocarboniometallo sono di solito
classificati sulla base del
loro “carattere ionico”,
usando un indice
chiamato il percento di
carattere ionico.
Questo indice
definisce il contributo
della forma di
risonanza ionica
rispetto a quella
covalente.
carbanione
I legami carboniocarboniometallo sono legami
+
polari che possono
C: M
essere rappresentati
dalla risonanza tra una
struttura covalente e
ionico
una ionica.
base più forte
più reattivo
legame
% ionico
C-K
C-Na
C-Li
C-Mg
C-Zn
C-Cd
C-Cu
51
47
43
35
18
15
9
Li e Mg
sono i metalli
usati più
spesso
nucleofilo migliore
meno reattivo
BASI E NUCLEOFILI
Questi reagenti reagiscono come
nucleofili o come basi
BASE di LEWIS
C
M
NUCLEOFILO
+
donatore di
una coppia
di elettroni
il grado di carattere covalente
dipende dal metallo
ORGANOMETALLICI DA
METALLI MONOVALENTI
Na
K
Li
METALLI MONOVALENTI Na K Li
Reagenti organosodio e organopotassio sono troppo
reattivi per poter essere utilizzati.
Quando si formano RR-Na or RR-K vi sono dei problemi:
E2 deidroalogenazione, soprattutto quando
l’alogenuro è 2° o 3°;
SN2 si formano dimeri.
Gli organolitio (R
(R-Li)
Li) vanno generalmente meglio.
ORGANOMETALLI DI NA E K
( troppo reattivi,
reattivi, RR-M è una base forte )
- δ+
δ
CH 3CH 2CH 2CH 2-Na
CH 3CH 2CH 2CH 2-Cl + Na
ELIMINAZIONE
CH 3CH 2CH =CH 2
CH 3CH 2 CH CH 2 Cl
H
-:CH CH CH CH
2
2
2
3
Na+
Na+ :CH 2CH 2CH 2CH 3
CH 3CH 2CH 2CH 2-Cl
SN 2
E2
REAZIONE DI WURTZ
CH 3CH 2CH 2CH 2-CH 2CH 2CH 2CH 3
In entrambi i casi il reattivo reagisce con
il composto di partenza !
FENILSODIO
Il fenilsodio è un eccezione!
Si forma senza difficoltà.
Br + Na
Na
Il Bromobenzene non subisce né E2 né SN2
perché non ha H in beta estraibili, e il bromo è
legato a un carbonio sp2.
Il fenilsodio ha un forte
carattere ionico ed è una
base molto forte.
+
Na
:
COMPOSTI ORGANOLITIO
Formazione di Reagenti Organolitio
2 Li + RR-X
R-Li + LiX
LiX
R = 1°, 2°, alcuni 3°, vinile, fenile
velocità: X = I > Br > Cl (bromo è preferito)
solventi: eteri, pentano, benzene
ESEMPI
CH 3CH 2CH 2CH 2CH 2-Br
+
etere anidro
2 Li
CH 3CH 2CH 2CH 2CH 2-Li
+
LiBr
pentillitio
Br + 2 Li
Li
benzene
anidro
fenillitio
+ LiBr
SOLVENTI USATI
CH3CH2
..
O CH2CH3
dietil etere
..
THF
tetraidrofurano
..
O
..
CH3CH2CH2CH2CH3
pentano
benzene
..
O
..
..
O
..
1,41,4-diossano
Questi solventi non
reagiscono con i
metalli né con i
composti
organometallici che
si formano.
ORGANOMETALLICI DA
METALLI DIVALENTI
REAGENTI DI GRIGNARD
Formazione dei Reattivi di Grignard
R X
+
Mg
etere
anidro
R
Mg X
R = 1°, 2°, 3°, arile
2 R-MgX
MgX
R2Mg + MgX
MgX2
Questa reazione fu scoperta dal francese
Victor Grignard - Premio Nobel nel 1912
REATTIVITÀ DEGLI ALOGENURI
RX + Mg
RR-MgMg-X
VELOCITÀ RELATIVE :
VELOCE
R-I > RR--Cl
R-Br > R
costoso,
non
facilmente
disponibile
buon
compromesso
LENTO
meno reattivo,
ma facile da
preparare o
comprare
FORMAZIONE DI UN REATTIVO DI
GRIGNARD
CH3
CH3
H 3C C H
+ Mg
Cl
etere
H3 C C H
MgCl
Gli eteri sono solventi obbligatori per la reazione di
Grignard. La reazione non funziona senza un etere
come solvente.
CH3CH2
O CH2CH3
O
O
THF
O
Tipici eteri sono:
Dietil etere (p.e. 35oC)
Tetraidrofurano (p.e. 65oC)
Diossano (p.e. 101oC)
GLI ETERI COORDINANO CON GLI ORBITALI 3p
Mg:
[Ne]3s2
promozione
3s
3p
3s
3p
. Mg .
+RX
R.
X.
due legami
si formano
R-MgMg-X
3s
3p
due eteri
coordinano
Gli eteri stabilizzano il Complesso di
Grignard
Et
Et
..
O
..
IL COMPLESSO
DI GRIGNARD
R
Et
..
O
Et
Mg
:
Le molecole di
etere si
coordinano agli
orbitali vuoti 3p
del magnesio
X
La formazione del
complesso è esotermica,
tanto da far bollire la
soluzione senza
riscaldare.
33_13.05.05
Il reattivo di Grignard è un ibrido di risonanza.
R-MgX
R:
MgX
δ δ
R MgX
RMgX è una fonte di carbanioni (R:-)
proprio come RLi.
I reattivi di Grignard sono sia basi
forti che buoni nucleofili.
nucleofili.
REAZIONI DEI
COMPOSTI ORGANOLITIO
e
DEI REATTIVI DI GRIGNARD
1
REATTIVITÀ DEGLI
ORGANOMETALLICI COME BASI
R-MgMg-X
≡
R-Li
Gli organolitio e i reattivi di Grignard sono basi forti e
reagiscono facilmente con qualunque idrogeno
leggermente acido.
R-MgX + H+
R-H + MgX+
R-Li + H+
R-H + Li+
Qualunque fonte di H+ opererà questa reazione:
H2O (e umidità dell’aria)
HX
ROH
ROH
RNH
RNH2
RCOOH
RCOOH
RC≡
RC≡CH etc.
Qualsiasi legame -O-H, -S-H, o -N-H
è sufficientemente acido da reagire.
Qualsiasi legame -O-H, -S-H, o -N-H
è sufficientemente acido da reagire.
.-.
R ..
+
O
H-O-C
R
.-.
R ..
+
H-O-H
R- H
+
-O-H
.-.
R ..
+
H-O-R
R- H
+
-O-R
R- H
+
RCOO-
Dato che reagiscono con H2O, bisogna escludere
rigorosamente l’acqua dall’ambiente di reazione
(vetreria, solventi, aria).
R-Li
R-MgBr
…però può essere utile
QUESTI COMPOSTI SI USANO QUANDO SI HA
BISOGNO DI UNA BASE FORTISSIMA
Quando le basi normali come NaOH o NaOR non sono
abbastanza forti, si possono usare R
R--Li or PhPh-Na.
CH3
CH3 N+ CH3
CH3
CH3
CH3 N+ CH3
CH3
+
NaOH
o
NaOEt
PhNa
+
o
CH3CH2CH2CH2-Li
butillitio
reagisce
lentamente
CH3
CH3 N+ CH3
CH
.. 2
reazione
buona
-
C: è una base più forte di O:- poiché l’ossigeno è più
elettronegativo e porta meglio la carica. Per la stessa
ragione è più forte di NH2-.
RIMUOVERE UN ALOGENO
La reazione con acqua è un modo per ridurre (o dealogenare)
un alogenuro alchilico o arilico, convertendo CC-X in CC-H.
H
Li
Br
Li
H2O
etere
CH 3
CH 3
CH 3
C Br
C
-
Li
+
C H
H O
H
Br viene
rimosso
UNA FONTE DI DEUTERIO
R
CH3 CH2 CH CH3
Br
Mg
etere
CH3 CH2 CH CH3
MgBr
D2O
R,S
Non è un metodo
stereospecifico.
CH3 CH2 CH CH3
D
2
REAZIONI DI SOSTITUZIONE
ELETTROFILA
IL REATTIVO DI GRIGNARD FUNGE DA
NUCLEOFILO
Cl
Mg
etere
MgCl
I2
I
Sostituzione elettrofila
(I+ sostituisce MgCl+)
Scambio di metallo
Br
Li
Li
ZnCl2
ZnCl
3
REAZIONI DI ADDIZIONE
NUCLEOFILA
REATTIVITÀ DEL GRUPPO CARBONILICO
gli elettrofili si
legano all’O
ossigeno
nucleofilo
.. δO:
C
δ-
δ+
R-Li
δ+
+
δ- δ+
R-MgX
o E+
.. :O:
C
Nu:
H+
carbonio
elettrofilo
i nucleofili
attaccano
il carbonio
ADDIZIONE NUCLEOFILA
Reazione con composti carbonilici
R
R
+
etere
R-C-O- MgX H2O R-C-OH
+
R-MgX
C=O
R
R
R
R
•
•
•
•
RLi e RMgX reagiscono con:
formaldeide H2C=O
alcoli primari RR-CH2OH
altre aldeidi RCH=O
alcoli secondari R2CHOH
chetoni R2C=O
alcoli terziari R3COH
CO2
acidi carbossilici RCOOH
SINTESI DI ALCOLI
SINTESI DI ALCOLI
Reazione di RLi (o RMgX) con formaldeide, aldeidi e chetoni.
H
R-Li
O
+
H
H
H2O
R-C-O-Li+
H
formaldeide
R
R-Li
+
O
H
altre aldeidi
H
R-C-OH
H
alcoli primari
R
R
H2O
R-C-O-Li+
R-C-OH
H
H
alcoli secondari
(anche aromatiche)
R
R-Li
+
O
R1
chetoni
(anche aromatici)
R
R-C-O-Li+
R
H2O
R
R-C-OH
R
alcoli terziari
CI SONO DIVERSI MODI PER
SINTETIZZARE UN ALCOOL
Li
O
OH
Partire con due
gruppi legati al
carbonile e
aggiungere il terzo
Li
O
O
Li
SINTESI DI ACIDI
CARBOSSILICI
REAZIONE CON CO2
Biossido di carbonio reagisce con RLi
e RMgX per dare acidi carbossilici.
R-Li + CO2 etere R-COO- Li+
R-MgX + CO2
etere
H3O+
R-COOH
H3O+
+
R-COO MgX
R-COOH
Per la sintesi si usa biossido di carbonio solido (ghiaccio secc
secco)
o)
SINTESI DI ACIDI CARBOSSILICI
Esempi
COO-Li+
Li
+ CO 2
fenillitio
ghiaccio
secco
tritato
Br
Mg
COOH
etere
benzoato
di litio
MgBr 1) CO2
etere
bromuro
di benzile
H3O+
acido
benzoico
COOH
2) H3O+
benzilmagnesio
bromuro
acido
fenilacetico
ALOGENURI CHE NON
SI POSSONO USARE
QUESTE REAZIONI NON PROCEDONO….
Br
MgBr
Mg
X
etere
OH
OH
O
O
Mg
X
etere
Br
COOH
Br
MgBr
Mg
etere
X
COOH
MgBr
GRUPPI CHE INTERFERISCONO !












