OGM :
organismi geneticamente modificati
Organismi ottenuti tramite manipolazione genica.
Caratterizzati dalla presenza di modifiche nel genoma introdotte
in maniera artificiale.
Le tecniche di manipolazione genica consentono di trasformare
singole cellule.
Per ottenere organismi geneticamente modificati è necessario
ricorrere a tecniche che consentono la riproduzione di un intero
organismo a partire da una singola cellula.
Tecniche diverse per ottenere OGM animali e vegetali
Diversi sistemi di espressione
Batteri
Lievito
Baculovirus
Cellule di
mammifero
Piante
Animali
transeginici
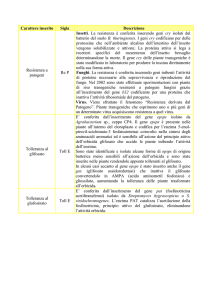
Caracteristica
E. coli
Lievito
Cell. Insetto
Cell. Mammifero
Crescita
30 min
90 min
18-24 h
24 h
Terreno
Semplice
Semplice
Complesso
Complesso
Basso
Basso
Alto
Alto
Alto
Basso-Alto
Basso-Alto
Basso-Medio
Periplasma
Terreno
Terreno
Terreno
Costo coltura
Expr. level
Expr. extracell
Modifiche
Postraduzionali
Folding Corretto
Non sempre
Non sempre
Si
Si
N-glicosilazione
NO
High lev Mannosio
Semplice
Complessa
O-glicosilazione
NO
SI
SI
SI
Fosforilazione
NO
SI
SI
SI
Acetilazione
NO
SI
SI
SI
Acilazione
NO
SI
SI
SI
γ-Carbossilazione
NO
NO
NO
NO
Piante geneticamente modificate
La rigenerazione nelle piante
Si sterilizza una foglia e
si “pela” uno strato di
epidermide
Si pone lo strato di
epidermide su un terreno
contenente cellulasi e
pectinasi
Coltura di protoplasti
Centrifugazione e recupero
dei protoplasti
Coltura dei protoplasti
su cellule nutrici
Coltura di callo
Rigenerazione
Coltura di cellule in sospensione
Coltura di Calli
Induzione di radici
su terreno ad alto rapporto
auxina/citochinina
Induzione di germogli
su terreno a basso rapporto
auxina/citochinina
Agrobacterium Tumefaciens
8
La tecnologia ricombinante nelle piante
Agrobacterium tumefaciens.
Agrobacterium tumefaciens è l’agente del tumore del colletto o della galla,
malattia che si manifesta con la formazione di neoplasie sulla pianta infettata.
L’instaurarsi della malattia richiede che nel genoma della pianta si inserisca il
T-DNA, che corrisponde ad una parte del plasmide batterico (Ti-plasmid) detto
induttore di tumore (Tumor inducing).
Il plasmide Ti contiene diverse informazioni
• Geni vir:
codificano per proteine Vir, che permettono
l’inserzione del T-DNA nella cellula ospite
• Geni per Opine (sintesi e catabolismo):
codificano per enzimi in grado di trasformare
aminoacidi e zuccheri della cellula in composti
che solo il batterio è in grado di metabolizzare
grazie a specifici enzimi sempre codificati dal
plasmide Ti.
• Geni induttori del tumore:
codificano per enzimi necessari alla sintesi
degli ormoni vegetali che provocano la crescita
incontrollata della cellula infettata
• T-DNA:
porzione di DNA delimitata da specifiche
sequenze (bordo destro e sinistro) che
corrisponde al DNA trasferito alla cellula ospite.
Codifica per gli enzimi necessari alla sintesi
degli ormoni vegetali e quella delle opine
o Contatto con bersaglio
(geni chv)
o Adesione superficiale
(vitronectina)
o Trasferimento T-DNA
(geni vir)
11
12
La
conseguenza
diretta
dell’inserzione del plasmide
Ti nella cellula è la crescita
di un’escrescenza tumorale
di tipo “Crown Gall” (tumore
del colletto)
13
Un processo del tutto analogo si ha con un’altra specie di batterio. L’
Agrobacterium Rhizogenes, infatti, mediante meccanismi molecolari
analoghi a quelli utilizzati da A. Tumefaciens, genera dei tumori
identificabili come formazioni piliformi in soprannumero, soprattutto a
livello radicale. Si parla infatti di formazioni di tipo “Hairy Roots”.
L’A. Rhizogenes, si serve
per l’infezione, come A.
Tumefaciens
di
un
plasmide particolare (Ri)
contenente geni deputati ai
meccanismi di virulenza e
di trasporto e integrazione,
nel genoma della cellula
ospite, della sequenza da
trasferire.
Metaboliti indotti dal plasmide Ti
Auxine e citochinine: ormoni vegetali che regolano la crescita
Opine: prodotti di condensazione tra aminoacidi, chetoacidi e zuccheri
Il metabolismo delle opine
Reazione di biosintesi della octopina
Octopina: piruvato + arginina
Nopalina: α-chetoglutarato + arginina
Mannopine: mannosio + aminoacido
Sintesi di Auxina e citochinine
I plasmidi Ti possono essere ingegnerizzati in E.coli attraverso l’inserzione
del gene d’interesse all’interno della zona T.
Questi plasmidi vengono usati per veicolare nuovi geni all’interno dell’ospite
vegetale
Agrobacterium tumefaciens
DNA contenente il
gene prescelto
Infezione di cellule
vegetali in coltura
Inserimento del gene nel
plasmide mediante
l’enzima di restrizione e la
DNA-ligasi
Crescita
della pianta
Cellula vegetale
2
1
3
Plasmide
Ti
T-DNA
Sito di restrizione
Plasmide Ti
ricombinante
Il T-DNA inserito
porta il nuovo gene
Pianta con
caratteristiche nuove
I SISTEMI VETTORI DERIVATI DAL PLASMIDE Ti
Sistema vettore binario
Gene bersaglio
Vettore binario
Confine
destro
Gene marcatore
selezionabile vegetale
Confine
destro
Confine
sinistro
Sistema vettore cointegrato
Gene marcatore
per E. coli e
Gene marcatore
selezionabile
vegetale
Gene marcatore per E. coli
e A. tumefaciens
Vettore
cointegrato
E. coli ori
Gene bersaglio
A. tumefaciens
E. coli ori
A. tumefaciens ori
RICOMBINAZIONE
Sequenza DNA omologa
Confine
sinistro
Geni vir
Plasmide Ti
disarmato
A. tumefaciens ori
La piastra per l’inoculazione è provvista di cellule nutrici (protoplastiche) ed è
selettiva per plasmidi resistenti ad un antibiotico (Canamicina).
excisione di dischi fogliari
di circa 2 mm
Breve incubazione dei dischi
fogliari con una coltura di
Agrobatteri (5-10 x 106/ml)
contenenti il gene d’interesse
clonato in un vettore binario
Co-coltivazione in terreno a
basso
rapporto
auxina/
citochinina, in presenza di
carbellicina o kanamicina
Dopo la germinazione i trasformanti si
trasferiscono
in
terreno
di
radicazione
La piastra per l’inoculazione è provvista di cellule nutrici (protoplastiche) ed è
selettiva per plasmidi resistenti ad un antibiotico (Carbellicina o Kanamicina)
Questa tecnica è ormai di routine nella trasformazione di un
gran numero di dicotiledoni.
L’utilizzo di questa tecnica nelle monocotiledoni è possibile
solo se l’Agrobacterium è trattato con un essudato di ferite
di piante normalmente suscettibili al batterio (dicotiledoni
come i tuberi della patata).
La trasformazione tramite agrobatterio
tuttavia ha
un’efficienza molto bassa nelle monocotidedoni. Per queste
piante, di grande interesse agronomico, sono stati
sviluppati sistemi di trasformazione alternativi.
• Trattamento di protoplasti con metodiche analoghe a quelle
utilizzate per le cellule in coltura
- fosfato di calcio (bassa efficienza)
- elettroporazione (alta efficienza)
• Bombardamento con microparticelle
BOMBARDAMENTO CON MICROPROIETTILI
Metodi alternativi di trasferimento genico vegetale:
cannoncino balistico
Promotore per cellule vegetali
Microparticelle (1µm)
di tungsteno
Ap
gene d’interesse
ori
Precipitazione del DNA
sulle microparticelle
Percussore
microproiettile
Caricamento del cannoncino balistico
Tessuto vegetale bersaglio
Piastra di trattenimento
Carica a salve
microparticelle rivestite di DNA
Le particelle di tungsteno (oro, plastica) su cui è
adsorbito il DNA estraneo, non interferiscono con la
crescita della pianta.
25
Il rivestimento delle particelle sferiche (0,4 - 1,2 m) con DNA
si ottiene mediante precipitazione con CaCl2, spermidina o PEG
(polietileneglicol).
Le particelle rivestite vengono accelerate ad alta velocità (da
300 a 600 m/s) con il cannone da particelle, che impiega la
polvere da sparo, l’aria compressa o l’elio per fornire la forza
propulsiva.
Le cellule situate nella traiettoria diretta del tiro vengono
uccise, ma c’è una zona in cui il proiettile penetra le cellule
senza ucciderle.
Il proiettile è in grado di penetrare almeno uno strato di
tessuto (ad es: fogliare) e può quindi raggiungere il mesofilo.
Parametri importanti per il processo biolistico sembrano essere:
o Dimensioni dei microproiettili: in funzione della parete della
cell target
o Massa dei microproiettili: deve poter raggiungere una energia
cinetica adeguata all’attraversamento delle pareti cellulari.
Oro e tungsteno sembrano i più adatti anche perché
chimicamente inerti e quindi non reagiscono con le
componenti cellulari.
o Energia cinetica dei microproiettili: in funzione dello spessore
della parete e dello strato di cellule che costituisce il bersaglio.
Viene regolata calibrando l’accelerazione dei microproiettili.
o Numero di bombardamenti: variabili in base al bersaglio.
Maggiore è il numero di bombardamenti maggiori sono i danni
al tessuto.
27
Questo metodo di trasformazione, come tutti, presenta:
Vantaggi
o Metodo genotipo indipendente
o Può essere applicato a tutti i tessuti modificando i
parametri di sparo
Svantaggi
o Frammentazione del DNA
o Profilo di integrazione del DNA complesso
o Integrazione di un gran numero di copie del transgene
Elettroporazione
L’ elettroporazione a partire da protoplasti risulta essere il
metodo più efficace qualora non sia possibile utilizzare la
trasformazione mediata da A. Tumefaciens.
Efficienza
di
trasformazione
tra lo 0,1 e l’1%
in protoplasti di
riso e mais.
Un’ alta concentrazione di DNA plasmidico contenente il gene di interesse
viene mescolata a una sospensione di protoplasti e sottoposti per pochi
secondi ad un intenso campo elettrico dell’ordine di 250-500 V/cm.
Il trattamento provoca la formazione di pori transienti sulla
membrana delle cellule e quindi la possibilità di entrata del
DNA.
In realtà l’intensità del campo elettrico varia in base al tipo
cellulare, alla specie di provenienza, alla fase del ciclo cellulare
in cui si trova e quindi a tutta una serie di parametri che
rendono indispensabile una valutazione del voltaggio caso per
caso.
Inoltre è necessaria anche una valutazione circa i sali impiegati.
Molto spesso, infatti, erronee valutazioni dei parametri di
reazione portano alla morte di un gran numero di cellule.
L’elettroporazione è per lo più impiegata in processi di
trasformazione su “larga scala”, come la creazione di libraries
genomiche. Per trasformazioni di un singolo plasmide vengono
impiegate altre tecniche, come lo shock termico, a efficienza
minore, ma più semplice e meno costoso.
Trasformazione mediata da Liposomi
Il DNA viene incapsulato in un liposoma artificiale. La membrana dei liposomi
si fonde con quella dei protoplasti ed il DNA può entrare nel nucleo.
Permeabilizzazione mediata da PEG
Il polietileneglicole permette di permeabilizzare la membrana
cellulare ed è quindi utilizzabile per la trasformazione diretta
di protoplasti mediante semplice uptake di DNA estraneo.
Microiniezione
Viene utilizzato per il trasferimento genico in situ. Il DNA
viene introdotto negli organi riproduttivi.
Presenta come svantaggi la necessità di apparecchiature
complesse e implica la trasformazione di una cellula alla
volta.
Laser microbeam
Anche in questo caso si ha necessità di apparecchiature
complesse e si può trasformare una cellula alla volta.
APPLICAZIONI
PIANTE TOLLERANTI A
STRESS E SENESCENZA
La maturazione dei frutti
Alcuni dei geni indotti nel corso della maturazione dei frutti codificano gli
enzimi cellulasi e poligalatturonasi.
Si è quindi supposto di poter ritardare la maturazione interferendo con
l’espressione di uno o più di questi geni, creando piante transgeniche
produttrici di RNA antisenso per i suddetti geni.
Pomodori Flavr Savr
Pomodori GM attraverso l’inserimento
del gene codificante per Rna antisenso
in grado di silenziare il gene della
Poligalatturonidasi
enzima responsabile della maturazione
del pomodoro wild type
Risultato: il processo di degradazione
del frutto viene notevolmente rallentato.
Il regolatore della crescita della pianta è l’ETILENE che inducel’espressione di
una serie di geni che partecipano alla maturazione e alla senescenza dei
frutti.
Gene
esogeno
ACC deaminasi
NH4+ +
α- Chetobutirrato
PIANTE TOLLERANTI STRESS E
SENESCENZA
Stress ossidativo
Piante di tabacco trasformate con un gene della superossido
dismutasi (SOD) controllato dal promotore 35S del virus del
mosaico del cavolfiore hanno espresso l’enzima acquistando
la tolleranza al danno da radicali ossigenati.
PIANTE RESISTENTI
A PARASSITI E VIRUS
LE PIANTE RESISTENTI AGLI INSETTI
Per conferire resistenza agli insetti predatori sono state poste in opera
parecchie strategie, e una di esse si basa sul gene di una protossina
insetticida prodotta da un a tra le parecchie sottospecie del batterio
Bacillus thuringiensis:
VETTORE DI CLONAZIONE COINTEGRATO
gene della tossina B.t.
tNOS
p35S
Spcr
Confine destro
Plasmide Ti
pNOS
Gene marcatore sel.
Vegetale (neomicina
fosfo-transferasi
NPT)
tNOS
Ori di E.Coli
Sequenza di
DNA omologa
IL GENE DELLA
PROTOSSINA E’ STATO
INTRODOTTO IN
MOLTE SPECIE DI
PIANTE
PATATA
RISO
MAIS
MELO
MELANZANA
RAVIZZONE
NOCE
PIOPPO
ABETE
MIRTILLO
COTONE
Bacillus thuringiensis
La tossina Bt
Modo di azione delle tossine di B.thuringiensis
• Gli insetti ingeriscono i cristalli parasporali
• L’ambiente alcalino dell’intestino (pH7.5-8.0)
solubilizza il cristallo a formare la protossina
• Specifiche proteasi digestive presenti nell’intestino
dell’insetto tagliano la protossina generando la tossina
attiva
• Nell’uomo e negli animali non sono presenti le
proteasi specifiche
• La tossina si inserisce nella membrana delle cellule
epiteliali dell’intestino creando un canale ionico
• Ciò determina un’alterazione dei flussi ionici e quindi
la lisi delle cellule epiteliali
• L’insetto smette di mangiare, si disidrata e muore
Modo di azione delle tossine di B.thuringiensis
Applicazioni delle tossine di B.thuringiensis
Mais Bt
Bacillus Thuringiensis è un batterio che produce diversi tipi di endotossine
tossiche per diversi parassiti delle piante ma non per l’uomo, gli animali o
altri insetti benefici.
Vantaggi:
- L'agricoltore non ha più bisogno di ricorrere agli insetticidi, quindi
l'ambiente circostante non è più esposto a dosi massicce di insetticida
nocivo.
Svantaggi:
- Gli insetti sono avvelenati per un periodo di tempo superiore rispetto a ciò
che avviene quando un agricoltore irrora una o due volte i campi. In questo
modo gli insetti possono sviluppare una resistenza al veleno.
- Una moltitudine di insetti rischia di essere uccisa, compresi gli insetti
predatori che si nutrono di insetti dannosi per le colture.(Negli Stati Uniti,
dove si fa gran uso di Bt-mais, si è acceso il dibattito sugli effetti nocivi del
Bt-mais sulla splendida farfalla monarca.)
-Il cotone e le patate sono altri esempi di piante geneticamente modificate
che producono insetticida.
ALTRE TECNICHE PER CONFERIRE
RESISTENZA AGLI INSETTI
Gli inibitori delle proteasi
L’inibitore dell’α-amilasi
Il gene batterico della colesterolo ossidasi
Gene inibitore della tripsina di V. sinensis
tNOS
p35S
Confine
destro
tNOS
Gene NPT
Plasmide Ti
pNOS
Ori
Confine
sinistro
Kan r
PIANTE RESISTENTI AI FUNGHI E AI BATTERI
Le piante rispondono spesso all’invasione di un patogeno o ad altre sollecitazioni
ambientali sintetizzando un gruppo di proteine dette proteine correlate con la
patogenesi (PR).
Le proteine PR comprendono le chitinasi, le β-1,3-glucanasi, le proteine traumatinasimili e gli inibitori delle proteasi.
Per realizzare piante resistenti ai funghi patogeni sono state attuate manipolazioni
tali da consentire alle piante di esprimere costitutivamente una o più proteine PR.
Cassetta del gene di
resistenza all’igromicina
Cassetta del gene
della chitinasi
La realizzazione di piante di patata transgeniche in grado di esprimere attivamente
il lisozima del batteriofago T4 ha dato luogo a specie resistenti al batterio patogeno
del suolo Erwinia carotovora e altri microrganismi
p35S
Lisozima T4 tCaMV
Pep. Segnale della
α-amilasi di orzo
PIANTE RESISTENTI AI VIRUS
I virus delle piante causano spesso danni considerevoli alle
coltivazioni e ne riducono significativamente le rese.
Per tale motivo si è fatto recentemente ricorso alle tecniche
di ingegneria genetica per realizzare piante transgeniche
resistenti ai virus.
RESISTENZA AI VIRUS
Geni delle proteine di rivestimento virali
Sequenze antisenso di geni virali
E` stato osservato che piante transgeniche, che esprimono un gene che
codifica una proteina di rivestimento di un virus, risultano resistenti
all'infezione da parte di quel virus
Il meccanismo di resistenza si basa su una sorta di silenziamento, per cui
la presenza di tale gene nel genoma delle cellule vegetali interferisce con la
formazione di particelle virali quando queste infettano la cellula ,
interrompendo così il ciclo di replicazione del virus.
Le proteine di rivestimento espresse sono quelle del virus del mosaico del
tabacco (TMV), virus del mosaico del cavolfiore (CaMV), virus del mosaico
giallo della zucchina ecc.
Per rendere le piante transgeniche resistenti a più di un virus,
si è fatto uso di vettori binari basati sul plasmide Ti che
esprimevano uno o più geni delle proteine di rivestimento:
Costrutti T-DNA con gene
della neomicina
fosfotrasferasi (NTP II) come
marcatore selezionabile e
gene della β glucuronidasi
come gene reporter.
WMV2: Gene della proteina
di rivestimento del virus 2 del
mosaico dell’anguria.
CMV: Gene della proteina di
rivestimento del virus del
mosaico del cetriolo.
ZYMV: Gene della proteina di
rivestimento del virus del
mosaico giallo delle zucchine.
PIANTE RESISTENTI
A ERBICIDI
STRATEGIE:
Inibire l’assunzione dell’erbicida
Sovraprodurre la proteina bersaglio sensibile all’erbicida così da
farne rimanere abbastanza per le funzioni cellulari, nonostante la
presenza dell’erbicida.
Attenuare l’attitudine della proteina bersaglio sensibile all’erbicida
a fissare l’erbicida stesso.
Conferire alle piante la capacità di inattivare metabolicamente
l’erbicida.
PIANTE RESISTENTI AL GLIFOSATO
PIANTE RESISTENTI AL
BROMOSSINILE
NITRILASI
L’ebicida glifosato
• Il glifosato è un erbicida sistemico ad ampio spettro,non selettivo
• E’ letale per tutti i tipi di piante
• L’erbicida è assorbito attraverso le foglie e i tessuti giovani del fusto e trasportato in
tutta la pianta
• Le piante trattate muoiono in giorni o settimane
• Il Glifosato agisce inibendo l’azione dell’enzima vegetale EPSP(5-enolpiruvil
shikimato-3-fosfato sintasi) implicato nella sintesi degli aminoacidi aromatici
Aminoacidi
aromatici
Soia Rundup
resistente all’erbicida glifosato
La Soia Runpdup è stata ottenuta attraverso l’inserimento del gene per l’ESPS
batterico, un enzima con bassa affinità per il glifosato, che permette alle piante
transgeniche di sopravvivere in presenza del glifosato.
Vantaggi:
- Si può estendere la piantagione perché è più semplice combattere le
erbacee insetti infestanti.
- Si possono usare tali erbicidi per eliminare numerose specie di infestanti
nella coltura senza distruggere le piante-GM,riducendo il numero di
trattamenti spray con erbicidi che distruggono solo una o poche specie di
infestanti.
Svantaggi:
-La soia può impollinare e trasmettere i geni alle erbacce che crescono
nello stesso campo, rendendo così resistenti anche le erbe infestanti.
Vantaggi:
- Si può estendere la piantagione perché è più semplice combattere le
erbacee insetti infestanti.
- Si possono usare tali erbicidi per eliminare numerose specie di infestanti
nella coltura senza distruggere le piante-GM,riducendo il numero di
trattamenti spray con erbicidi che distruggono solo una o poche specie di
infestanti.
Svantaggi:
-La soia può impollinare e trasmettere i geni alle erbacce che crescono
nello stesso campo, rendendo così resistenti anche le erbe infestanti.
MIGLIORAMENTO DELLE QUALITA’
NUTRIZIONALI
La SOIA TRANSGENICA è arrichita di acidi grassi
insaturi per risolvere molte patologie cardiovascolari
(trombosi,arteriosclerosi…) che affliggono una larga
fetta della popolazione adulta dei paesi sviluppati.
Il GOLDEN RICE. Nel 1991, gruppi di ricerca di Zurigo (una squadra
guidata dal Dr. Ingo Potrykus dell'Istituto Federale Svizzero di Tecnologia)
di Friburgo e della Germania (Beier et al.) hanno sviluppato l'idea di
introdurre il beta-carotene nell'endosperma del riso, per poter tentare di
convertire questa coltivazione primaria in una fonte di Vitamina A nelle
zone afflitte da VAD (vitamin A deficency).
I ricercatori hanno manipolato geneticamente una varietà da laboratorio
di riso giapponese (Taipei 309, adatto al clima temperato dellíEuropa
piuttosto che a quello delle aree tropicali) introducendo una via
metabolica per convertire in Beta-carotene una parte di un precursore
ormonale (geranyl geranyl difosfato) presente nel riso. Nel gennaio 2000
il gruppo di scienziati ha pubblicato i suoi risultati su "Science“.
Il principale finanziatore del progetto per il riso GM negli ultimi sei anni è
stata la Fondazione Rockefeller.
Golden Rice
La carenza di vitamina A causa la cecità parziale o totale a 500.000
bambini ogni anno, ma i metodi tradizionali di miglioramento sono stati
inefficaci nel produrre colture ad elevato livello in vitamina A.
Al contrario del riso wild type che produce beta-carotene solo nei
compartimenti fogliari, il riso GM presenta un aumento nella produzione di
beta- carotene a livello dell’endosperma (la parte commestibile del riso).
Il Golden Rice è stato ottenuto attraverso la trasformazione con 2 geni:
- psy (phytoene synthase) dal narciso (Narcissus pseudonarcissus)
- crt1 dal batterio della soia Erwinia uredovora
I geni psy e crt1 esogeni
trasformati nel genoma nucleare del
riso sotto il controllo di un
promotore specifico per
l’endosperma.
desaturasi
Gene lyc endogeno codificante
per una ciclasi che permette
trasformazione del
licopene(rosso) in beta carotene
(giallo).
Via biosinteica del beta-carotene:
Via biosinteica del beta-carotene:
I geni psy e crt1 esogeni
trasformati nel genoma nucleare del
riso sotto il controllo di un
promotore specifico per
l’endosperma.
Gene lyc endogeno codificante
per una ciclasi che permette
trasformazione del
licopene(rosso) in beta carotene
(giallo).
MODIFICA DEL CONTENUTO NUTRIZIONALE
contenuto e tipo di lipidi
MODIFICA DEL SAPORE E DELL’ASPETTO DELLE PIANTE DA
FRUTTO
Inibizione degli enzimi coinvolti nelle fasi iniziali dello
scolorimento dei frutti e delle verdure (es. polifenolo
ossidasi, che catalizzano l’ossidazione dei monofenoli e
degli o-bifenoli ad o-chinoni).
PIANTE COME BIOREATTORI
produzione di proteine ricombinanti
polimeri per uso industriale (poli-idrossialcanoati)
OGM ANIMALI
Animali nei quali, grazie a procedimenti di ingegneria genetica, è stata
modificata,aggiunta o eliminata, una porzione di patrimonio genetico allo
scopo di ottenere nuove caratteristiche, non presenti in natura e non
ottenibili tramite incroci
VANTAGGI
Superamento barriere naturali di
incompatibilità sessuale tra specie
Specificità di mutazione
Velocità di comparsa della mutazione
Trasformazione Animale
Per produrre animali
geneticamente modificati si
possono utilizzare:
Oociti fecondati
inserendo il DNA estraneo
nel pronucleo maschile.
Cellule staminali
embrionali (in particolare
ricavate dalla cavità della
blastocisti).
67
Microiniezione dell’uovo fecondato
• Negli ovociti prelevati da topine
gravide si inietta il gene d’interesse,
nel pronucleo maschile (è quello di
dimensioni maggiori)
• quando l’embrione arriva allo stato di
blastula , viene impiantato in una
topina pseudo-gravida (ottenuta
tramite preparazione ormonale)
La transgenesi avviene mediante microiniezione di un
costrutto contenente il gene che codifica per la proteina di
interesse in cellule uovo appena fecondate in vitro o in vivo
(in questo caso le uova vengono recuperate mediante
lavaggio uterino.
Generalmente vengono iniettati con una microsiringa 1-2
picolitri di DNA contenenti circa 100-200 copie del gene di
interesse.
Il costrutto viene posto sotto un promotore specifico per il
tessuto in cui si vuole ottenere l’espressione, ad esempio
sotto il promotore per le caseine nel caso in cui si vuole
espressione nella ghiandola mammaria e conseguente
purificazione del prodotto di interesse nel latte.
Gli oociti così ingegnerizzati vengono poi trapiantati in
femmine riceventi.
71
Riconoscimento di una progenie
transgenica
insieme al gene d’interesse si inserisce un gene
per il colore del pelo, così riconosco subito tra la
progenie il topo transgenico
Prelievo di un campione di tessuto per fare
un’analisi Southern Blotting (per vedere in quante
copie si è inserito il gene)
Si definisce fondatore (founder) l’individuo che
porta il transgene anche nella linea germinale
Sviluppo dello zigote fino allo stadio di blastocisti
Preparazione di cellule staminali embrionali (ES)
Si prendono delle cellule staminali embrionali dalla blastocisti e si mettono
su piastra con un feeder layer
Le cellule staminali vengono manipolate
geneticamente e poi reinserite in altre
blastocisti accettrici prese da altre topine
gravide.
Se le blastocisti attecchiscono e la gravidanza
prosegue, nasceranno topi chimerici: avranno
sia cellule normali che cellule transgeniche
Ogni cellula della blastocisti è il
precursore di un tessuto del topo
Se l’inserzione è avvenuta nelle
cellule della linea germinale, la
progenie successiva porterà il
transgene.
Questo metodo permette o un
knock-out specifico di un gene,
oppure una sostituzione di un
gene con ricombinazione
omologa.
La blastula si riorganizza bene
dopo la colonizzazione delle
blastocisti transgeniche e il topo
non presenterà squilibri.
Trasferimento nucleare
Clonaggio
Oocita privato del pronucleo femminile
Prelievo di un nucleo diploide da una cellula adulta
Inserimento del nucleo nell’oocita enucelato e
stimolazione
L’oocita inizia lo sviluppo embrionale protando alla
formazione di un individuo identico al donatore del nucleo
Non tutte le cellule somatiche sono in grado di originare
individui clonati (le migliori sono: cellule epiteliali, cellule
staminali, cellule germinali, cellule embrio-staminali o ES)
Trasferimento nucleare
Clonaggio
Trasferimento nucleare - OGM
Cloning terapeutico
Terapia genica
TOPI KNOCK-OUT
Formazione di cellule staminali embrionali portatrici
di una mutazione (knock-out)
Nel costrutto si utilizzano
un gene di resistenza alla
neomicina ed un gene di
sensibilizzazione al
ganciclovir.
Questo garantisce una
doppia possibilità di
selezione, positiva e
negativa, che assicuri
l’avvenuta
ricombinazione omologa.
Questo sistema detto a
“doppia selezione” consiste in:
o selezione positiva:
sopravvivono solo le cellule
che posseggono il gene di
resistenza.
o selezione negativa:
sopravvivono solo le cellule
che non posseggono il gene di
sensibilizzazione.
Procedura generale per
produrre topi knock-out
gene specifici
I topi chimerici ottenuti
vengono analizzati per
individuare quali tra essi
posseggono il transgene nella
linea germinale.
L’analisi viene condotta
mediante screening della
progenie.
Qualora il chimerico ha il
transgene nella linea
germinale la progenie sarà
costituita interamente da topi
transgenici.
89
Molecular Farming
La produzione di proteine ricombinanti è
effettuata in molte specie animali, tra cui:
mucche, capre, conigli, pecore e polli.
L’uso di promotori tessuto-specifici
garantisce l’espressione della proteina
transgenica nei fluidi corporei
(latte,uova,sangue, urina e fluidi seminali)
dai quali è possibile purificarla
Le ghiandole mammarie sono attualmente i bioreattori
più efficienti sia per la grande quantità di latte
prodotto, che l’elevata espressione della proteina
transgenica (1g/L)
Più di 20 proteine sono state prodotte fino ad ora.
Ad es.: anticorpi umani monoclonali, attivatore del
plasminogeno tissutale, ecc.
Produzione di proteine ricombinanti nel latte
Inserire il gene di interesse sotto il promotore del gene della beta-lattoglobulina
Prelevare cellule uovo fecondate dalla capra
Inserire il costrutto nel pronucleo di una cellula uovo
Impiantare in una madre psudogravida e selezione della progenie GM
Estrazione della proteina direttamente dal latte
Proteine terapeutiche prodotte in latte di animali transgenici
Proteine espresse
Origine del
transgene
Promotore
Livello di
esp (g/L)
Mucca
Lattoferrina
cDNA
Alpha-S1 caseina bovina
Capra
Anticorpi monoclonali
tPA
Genomico
cDNA
beta-caseina caprina
beta-caseina caprina
10
6
Maiale
Fattore VIII
Proteina C
cDNA
cDNA
Proteina acida di siero di latte
murina (WAP)
3
1
Pecora
Alpha-1 antitripsina
Fattore IX
Fibrinogeno
Minigene
cDNA
genomico
beta-lattoglobulina ovina
beta-lattoglobulina ovina
beta-lattoglobulina ovina
35
0,005
5
Coniglio
Calcitonina
SOD
Eritropoietina
Ormone della crescita
IL-2
Proteina di fusione
cDNA
cDNA
Genomico
genomico
beta-lattoglobulina ovina
WAP murina
WAP di coniglio
WAP murina
beta-caseina di coniglio
2,1
2,9
0,05
0,05
0,0005
/
Produzione di proteine ricombinanti nell’uovo
L’uovo fecondato nel magmun rappresenta un potenziale stadio
d’intervento per il trasferimento genico. Sfortunatamente i pronuclei non
possono essere subito visualizzati parché il tuorlo e l’opacità della
membrana vitellina interferiscono con l’illuminazione
La manipolazione viene
effettuata sull’uovo
appena deposto.
Aprendo una fenditura
sulla superficie del guscio
si ha accesso alla
blastocisti che può così
essere manipolata
(trasferimento di DNA o
inserimento di cellule ES
precedentemente
manipolate).
L’apertura sul guscio
viene sigillata e l’uovo è
incubato per permettere
lo sviluppo dell’embrione,
generando così individui
chimerici.