Patologia Generale II
13/12/2012
Gli Oncogeni – Parte 2
Gli oncogeni subiscono mutazioni con gain of function che in genere sono dominanti,
cioè agiscono essenzialmente in eterozigosi; quelle degli oncosoppressori sono
recessive, cioè entrambi gli alleli devono essere mutati.
I meccanismi di attivazione degli oncogeni in genere sono di quattro tipi:
mutazione puntiforme attivante
amplificazione genica
traslocazione con formazione di proteine ibride
traslocazione che pone un gene intero sotto il controllo di un promotore di un altro
gene.
Oncogeni: recettori accoppiati a proteine G
I carcinomi tiroidei si dividono in:
Carcinomi di origine follicolare, cioè che derivano dalle cellule che circoscrivono
il follicolo. Questi tumori possono avere istologia papillare o follicolare.
Carcinomi di origine neuroectodermica, cioè che derivano dalle cellule
calcitonina-positive (dette cellule C). Questi tumori sono detti midollari.
Nell’ambito delle cellule follicolari le vie mitogeniche principali sono essenzialmente
due: quella dei recettori tirosin-chinasici (in particolare EGF) e quella del cAMP,
associata al recettore del TSH (il principale ormone che regola crescita e
differenziazione della cellula tiroidea).
L’attivazione della via del cAMP,
comporta l’attivazione della PKA e la
trascrizione genica attraverso il fattore
di trascrizione CREB.
Due mutazioni attivanti in due geni di
questa cascata sono stati ritrovati nel
recettore del TSH e nella subunità α
della proteina Gs che si associa al
recettore del TSH.
Il risultato di queste mutazioni è una
proliferazione clonale della cellula
follicolare tiroidea che porta alla
generazione
di
un
adenoma
iperfunzionante.
La proteina Gs è a valle di molti recettori tra cui quelli di TSH, ACTH, LH, FSH, ecc,
e utilizza come secondo messaggero il cAMP.
Importante dal punto di vista oncologico è anche la subunità Gi2, inibitoria sul cAMP,
mutata in alcuni tumori.
Degli oltre 1000 recettori accoppiati a proteine G e subunità di proteine G, quelli più
frequentemente mutati sono:
Gαs: in adenomi tiroidei e ipofisari
Gαi: in tumori ovarici e della corteccia surrenalica
TSHR: in adenomi e carcinomi tiroidei
FSHR: in tumori ovarici
LHR: in iperplasie delle cellule di Leydig
Vie di trasduzione a valle di Ras
Ras è una proteina G monomerica e uno degli oncogeni più mutati nei tumori. Finora
i trattamenti che hanno come bersaglio molecolare l’oncogene Ras non hanno avuto
successo.
Ras ha almeno tre vie di trasduzione a valle (da sinistra a destra):
Fosfoinositidi
MAPK
Piccole proteine G
Era atteso che così come può essere mutata Ras, si possono trovare mutazioni nelle
molecole che sono a valle di Ras.
Oncogene RAF
Nel 2002 si è scoperto che un oncogene mutato a valle di Ras è RAF (la prima
chinasi nella cascata delle MAPK).
La famiglia dell’oncogene RAF comprende tre membri: A-Raf, B-Raf e C-Raf. Di
questi, l’unico che è stato trovato mutato in molti tumori aggressivi è B-Raf; oggi
esistono dei farmaci che lo inibiscono.
L’attivazione di Raf è mediata dall’interazione con Ras-GTP, e a sua volta Raf
fosforila la seconda proteina della via delle MAPK.
L’oncogenicità delle proteine Raf era da attendersi in quanto alcune di queste forme
erano state trovate nei retrovirus, in particolare un virus del sarcoma murino.
Le proteine RAF sono simili tra loro, a partire dall’N-terminale, hanno i domini:
CR1: con funzione di regolazione. Comprende una regione che interagisce con Ras
(RBD o Ras Binding Domain) e una ricca di cisteina (CRD).
CR2: dominio di regolazione che mantiene la molecola in conformazione chiusa.
CR3: il dominio catalitico (serina-treonina chinasi).
Tutti i geni che codificano per proteine RAF comprendono queste regioni.
Le mutazioni di B-Raf sono mutazioni puntiformi; la maggior parte delle mutazioni,
cioè oltre il 90%, colpisce un unico amminoacido, la valina in posizione 599 o 600
che diventa acido glutammico (carico negativamente). In realtà il numero corretto è
600 (e la mutazione è V600E) perché successivamente all’aggiornamento dei dati
sulle sequenze del genoma umano si è visto che la proteina B-Raf possedeva un
amminoacido in più. L’amminoacido V600 si trova nel dominio catalitico.
Le altre mutazioni colpiscono con più frequenza 4 regioni all’interno del dominio
catalitico (CR3). A partire dal C-terminale, le proteine Ras nel dominio CR3 hanno
un segmento di attivazione che blocca il sito attivo (loop catalitico) quando la
proteina è inattiva.
Le mutazioni in questa regione, tra cui V600E e gli amminoacidi adiacenti,
determinano una maggiore facilità di attivazione; ciò è dovuto alla presenza di residui
che vengono fosforilati (serina e treonina). La fosforilazione aggiunge cariche
negative e contribuisce all’attivazione del dominio catalitico; se un amminoacido
neutro (valina) viene sostituito con uno carico negativamente (acido glutammico),
sostanzialmente si mima l’effetto della fosforilazione.
Altre mutazioni colpiscono il loop catalitico, un loop ricco di glicina (con funzione
strutturale) e regione N-terminale (con funzione poco nota).
Il gene che codifica B-Raf è mutato nella maggior parte dei melanomi, e questo
influisce sulla terapia, perché si ricercano le 4-5 mutazioni più frequenti di B-Raf e se
risulta alterata, il paziente può essere trattato con una molecola, il sorafenib, che è un
inibitore specifico della chinasi Raf.
I primi studi clinici su pazienti con melanoma sono molto promettenti perché c’è una
buona regressione dei tumori.
Mutazioni di B-Raf sono presenti raramente anche nei carcinomi del colon, nei
gliomi, nei carcinomi del polmone, nei tumori della mammella, e con maggiore
frequenza nei carcinomi tiroidei (anche qui la principale mutazione è V600E).
Il tipo istologico è quello classico del carcinoma papillare (PTC); un’altra alterazione
associata all’istotipo papillare è il riarrangiamento di Ret/PTC.
Il 40% dei carcinomi papillari presenta il riarrangiamento di Ret/PTC, il 50%
presenta mutazioni di B-Raf e il 10% presenta il riarrangiamento di TRK (recettore di
NGF). Queste alterazioni sono mutualmente esclusive, cioè non possono essere
presenti contemporaneamente.
I pazienti con mutazioni di B-Raf hanno tumori che sono più aggressivi
(metastatizzano al polmone più frequentemente, progrediscono a carcinomi
dedifferenziati o anaplastici) rispetto a quelli che hanno mutazioni di Ret/PTC, ma
ancora non è chiaro il perché.
Sia Ret/PTC che B-Raf hanno farmaci molecolari che permettono un trattamento
selettivo.
Oncogeni: via dei fosfoinositidi
L’altra via importante nella trasduzione del segnale a valle di Ras è quella dei
fosfoinositidi. L’enzima fosfoinositide 3-chinasi (PI3K) genera i fosfoinositidi;
l’oncosoppressore PTEN è la fosfatasi lipidica che defosforila i fosfoinositidi.
I fosfoinositidi attivano la chinasi Akt la quale ha un ruolo importante nell’inibizione
dell’apoptosi, nella stimolazione della sintesi proteica e della proliferazione cellulare.
I fosfoinositidi sono formati da due acidi grassi, glicerolo e inositolo che può essere
fosforilato in diverse posizioni: quella importante è la posizione 3.
La generazione dell’inositolo fosfato è dovuta a PI3K; PTEN rimuove il fosfato in
posizione 3.
Le proteine Akt con il dominio N-terminale interagiscono con i fosfoinositidi,
vengono reclutate sotto la membrana e attivate.
Quindi PI3K attiva Akt e PTEN la inattiva; tutto questo in un contesto fisiologico
dipende dall’attivazione dei recettori.
Le alterazioni di questa via di segnalazione sono molto numerose, soprattutto quelle
di PTEN, e riguardano molti istotipi diversi: il glioblastoma, il carcinoma ovarico, il
carcinoma della mammella, il carcinoma dell’endometrio, ecc.
L’effetto dell’attivazione di Akt è antiapoptotico, proliferativo e di crescita, dovuto
alla fosforilazione di diversi substrati.
Gli oncogeni in questa via sono la subunità catalitica di PI3K e la proteina Akt:
La PI3K è un oncogene che è stato isolato in un retrovirus difettivo del sarcoma
del pollo (ASV16). Questo retrovirus è difettivo in quanto possiede una porzione
tronca dei geni env e gag, e manca la polimerasi; nel genoma di questo virus è
presente una sequenza trasformante per il pollo che è stata denominata v-p3k.
La maggior parte di queste sequenze trasformanti, come Src e Ras, trovate nei
retrovirus derivano dal genoma cellulare della specie che il virus infetta.
Per la sequenza v-p3k si è scoperta una controparte nel genoma dei polli, ma anche
dei mammiferi, il cui gene codifica per la subunità catalitica della proteina PI3K.
L’enzima è fatto di una subunità regolativa (p85) e una catalitica (p110).
La proteina p110 presenta un dominio catalitico al C-terminale, diversi domini di
regolazione e due domini di legame per p85 e Ras.
In una condizione fisiologica il recettore viene attivato, si autofosforila e recluta la
proteina p85 legata a p110; questo dimero è avvicinato alla membrana, trova i
fosfolipidi che sono i suoi substrati e fosforila in posizione 3.
Il gene di riferimento mappa sul cromosoma 3, ma esistono diverse famiglie di
proteine con attività di fosfoinositide 3-chinasi. Essenzialmente ci sono quattro
subunità catalitiche (p110α, β, γ e δ) e quattro regolative (p85α, β, γ e p101), che si
combinano in dimeri.
Quelle di interesse oncologico (le altre sono di interesse immunologico in quanto
coinvolte nell’attivazione dei linfociti B e T) sono la p85α e la p110α, che
costituiscono il dimero importante nella trasduzione del segnale dei recettori tirosinchinasici.
PS. Non è necessario conoscere le altre subunità.
L’attivazione di p110α avviene per:
Mutazioni puntiformi attivanti di p110
Amplificazione del gene p110
Mutazioni inattivanti di p85
Le mutazioni di p85 si localizzano quasi tutte nel dominio SH2 (quello di interazione
con il recettore), viceversa le mutazioni che colpiscono p110 cadono o nel dominio
catalitico o nel dominio di regolazione (helical domain).
Questo gene è mutato in molti tumori, tra cui tumori del colon, tumori della
mammella, tumori dell’endometrio, glioblastoma, ecc.
Per questo tipo di proteina mutata ci sono diversi trials clinici in fase 2 e 3 con
inibitori molto potenti, che sembrerebbero avere un effetto positivo; oggi sono in
sviluppo farmaci che targettano in modo specifico le diverse subunità, che sono
espresse in tessuti diversi e sono correlate con patologie differenti (questa via di
segnalazione è importante anche nel diabete).
Qualche anno fa è stata trovata una mutazione anche nella proteina a valle di PI3K,
cioè AKT1. La proteina Akt mappa sul cromosoma 14 ed è fatta da un dominio PH
(N-terminale) che permette il reclutamento di membrana perché interagisce con i
fosfoinositidi, un dominio chinasico e un dominio regolatorio (C-terminale).
La mutazione che colpisce Akt è E17K (dove l’acido glutammico carico
negativamente è sostituito dalla lisina che è carica positivamente), all’interno del
dominio PH.
La presenza della lisina in posizione 17 cambia la conformazione e il risultato è che il
dominio PH acquisisce una maggiore affinità per i fosfoinositidi rispetto alla forma
non mutata, di conseguenza la proteina si localizza più di frequente in prossimità
della membrana e viene attivata più frequentemente.
Akt fosforila a valle diversi substrati, e ha attività antiapoptotica, proliferativa e
metabolica.
Se Akt è mutata nel dominio PH, l’effetto trasformante è simile per certi versi a
quello dell’alterazione della subunità catalitica della PI3K.
Oncogene Abl
La proteina Abl è una tirosin-chinasi che viene attivata dalla prima traslocazione che
è stata identificata, cioè quella tra i cromosomi 9 e 22, che si ritrova nella leucemia
mieloide cronica.
Circa il 95% dei casi di leucemia mieloide cronica portano questo tipo di
traslocazione identificabile citogeneticamente (tramite la tecnica della FISH), l’altro
5% viene identificato molecolarmente; virtualmente il 100% dei pazienti affetti da
leucemia mieloide cronica è portatore della traslocazione t(9;22).
Il cromosoma 22 risultante viene chiamato Philadelphia, dal luogo dove è stato
scoperto negli anni ’60.
Uno dei geni implicati nella
traslocazione è stato chiamato
Abl perché era simile a un
gene identificato in un
retrovirus murino responsabile
di leucemia (Abelson murine
leukemia virus).
Il cromosoma Philadelphia è
un cromosoma 22 più corto,
legato a un pezzo del
cromosoma 9.
Nel riarrangiamento la chinasi
Abl si fonde con il gene Bcr
(breakpoint cluster region), che prende questo nome perché può rompersi in diversi
siti. Infatti i prodotti della traslocazione sono diversi a seconda del sito in cui avviene
la rottura di Bcr, e sono essenzialmente tre: p190 (più frequente e caratteristica della
leucemia mieloide classica), p210 e p230 (si osservano in leucemia con fenotipi
diversi).
Il gene chimerico BCR-Abl (o BCR-Abelson):
inibisce l’apoptosi
riduce la necessità di fattori trofici
riduce l’adesione cellulare: interferisce con i rapporti tra cellule mieloidi e stroma
induce instabilità genomica: è un meccanismo con cui le cellule tumorali
acquisiscono la variabilità
attiva vie molecolari come Ras, PI3K, ecc.
Anche per questa chinasi c’è un farmaco, il primo a bersaglio molecolare ad essere
sintetizzato, chiamato Gleevec. È un farmaco che ha avuto grande importanza per tre
motivi: ha dimostrato sul campo che la terapia molecolare potesse essere utile, ha
aumentato la sopravvivenza dei pazienti e poiché molti pazienti sviluppano recidive
ha permesso di capire il meccanismo attraverso cui le cellule tumorali sviluppano
resistenza al farmaco.
Oncogene Myc
Un’altra classe di oncogeni è quella dei fattori di trascrizione.
Il fattore di trascrizione Myc è implicato nel riarrangiamento t(8;14); Myc mappa sul
cromosoma 8 e viene ad essere giustapposto al locus delle immunoglobuline.
Questo riarrangiamento è importante in una grave patologia che colpisce i bambini
africani, il linfoma di Burkitt. È un
linfoma essenzialmente mascellare, molto
aggressivo e conduce a morte in tempi
abbastanza veloci.
Rispetto
alla
traslocazione
t(9;22),
l’oncogene Myc viene posto integro sotto il
locus delle immunoglobuline, quindi viene
espresso ad alti livelli nei linfociti B.
Myc è un fattore molto importante per il ciclo cellulare e ne controlla diverse
funzioni.
Quando è espresso ad alti livelli, lega promotori ed enhancer dei geni target,
producendo alti livelli delle relative proteine e questo riduce il controllo sulla
proliferazione cellulare.
Le cellule B sono particolarmente sensibili ad alti livelli di attività di Myc, e gli
effetti dell’inappropriata trascrizione in fase G1 sono iperproliferazione e
dedifferenziamento.
Myc attiva geni che promuovono la crescita, reprime geni che bloccano la crescita e a
sua volta è un bersaglio della trasduzione del segnale mediato da Ras.
Myc è a valle della via delle MAPK e a sua volta trascrive i geni di:
ciclina D: è un importante sensore di fattori
di crescita e insieme alle Cdk promuove il
ciclo cellulare. Quando Myc è overespresso
perché traslocato sotto il locus delle
immunoglobuline, c’è un aumento dei livelli
di ciclina D, del legame ciclina D-Cdk e della
fosforilazione di Rb; ciò porte le cellule nella
fase S.
E2F: è un fattore di trascrizione che lega
Rb e media la trascrizione dei geni implicati
nella transizione G1/S.
Complesso SCF: è un’ubiquitina-ligasi che
aumenta la degradazione degli inibitori del
ciclo cellulare come p27 (inibitore del
complesso ciclina-Cdk).
Tutto questo ha un effetto generale
sull’entrata in fase S, quindi Myc è un gene
iperproliferativo.
L’attività di Myc è abbastanza complessa
perché è un fattore di trascrizione che agisce
come dimero o con la proteina Max o con la proteina Miz-1. Myc e Max sono in
equilibrio stechiometrico; quando Myc è overespresso, la quantità di Myc supera
quella di Max e questo determina un cambiamento nella sua attività trascrizionale
pertanto viene attivata la trascrizione di E2F, ciclina D, geni che degradano gli
inibitori delle chinasi.
Myc è importante non solo nel linfoma di Burkitt, ma anche in un’altra serie di
neoplasie, fra le quali il neuroblastoma infantile.
Anche Myc fa parte di una famiglia di geni, e quello implicato nel neuroblastoma
infantile è N-Myc (N sta per neuroblastoma) che mappa sul cromosoma 2.
Il gene che è implicato nel linfoma di Burkitt è c-Myc e mappa sul cromosoma 8.
N-Myc può essere amplificato in due modi
diversi:
Generazione di double minutes: piccole
molecole di DNA all’interno del nucleo.
Ripetizione di più copie all’interno del
cromosoma: si forma una regione che ha una
colorazione uniforme detta HSR (homogeneously
stained region) perché la densità di basi G-C è
simile; non c’è più il bandeggio che si alterna sul
cromosoma.
Il dosaggio genico di N-Myc è importante perché la prognosi dei bambini che hanno
meno di 10 copie geniche di N-Myc è buona, mentre quella dei pazienti che ne hanno
più di 10 è pessima.
La curva di Kaplan-Meier in figura illustra la mortalità media, e nei pazienti con più
di 10 copie di N-Myc la sopravvivenza a 6
mesi dalla diagnosi è minore del 50%.
Viceversa a distanza di 8 anni i pazienti con
meno di 10 copie continuano a sopravvivere.
Come nel caso di c-Myc, il ruolo di N-Myc è di
fattore
di
trascrizione
con
effetto
sostanzialmente sulle stesse molecole.
N-Myc non è l’unico gene ad essere amplificato, ma molti geni sono soggetti ad
amplificazione in una grande quantità di tumori. Questi geni possono essere recettori
tirosinchinasici (es. erbB1 che è il recettore di EGF, erbB2), fattori di trascrizione (cMyc, N-Myc), ecc.
L’amplificazione genica così come la traslocazione e la fusione di più cromosomi è
un evento frequente.
Oncogeni: geni antiapoptotici
Un’altra classe di oncogeni è quella relativa
alla funzione antiapoptotica. L’apoptosi è
regolata in maniera estrinseca da parte dei
recettori e intrinseca dal mitocondrio.
Il processo comune a cui arrivano entrambe
le vie è l’attivazione delle caspasi regolatrici
(es. 8 e 9), che a loro volta attivano le
caspasi effettrici, le quali degradano le
diverse proteine all’interno della cellula.
Nella via dell’apoptosi è presente p53 che è
un fattore di trascrizione. p53 induce
apoptosi sulla base del danno al DNA,
producendo Bax che forma il poro di
transizione mitocondriale e permette la
fuoriuscita del citocromo C. Inoltre p53
regola la proteina IGFBP-3 che sequestra
IGF-1 all’esterno della cellula, e blocca la
via di IGF-1R (tramite PIP3 e Akt) che è la
principale nel controllo del survival di molte
cellule (es. neuroni).
Quindi la sensibilità delle cellule all’apoptosi può essere modificata se sono presenti
alterazioni di PI3K, PTEN, Akt, p53.
Una delle proteine principali a integrare il processo apoptotico è Bcl-2, che
interagisce con le proteine del poro (es. Bax o Bad), e questa interazione determina se
la cellula andrà o meno in apoptosi.
Bcl-2 (l’acronimo sta per B-cell lymphoma) è un oncogene implicato nella
formazione di linfoma follicolare (un tumore degli anziani poco aggressivo) che si
determina attraverso la traslocazione tra il cromosoma 14 dove mappano le
immunoglobuline e il cromosoma 18 dove mappa Bcl-2.
Come succede per Myc, Bcl-2 è messa sotto il controllo del locus delle catene pesanti
delle immunoglobuline ed è iperespressa.
La sintesi di Bcl-2 porta all’inibizione dell’apoptosi perché è alterata l’interazione tra
Bcl-2 e Bad, e ciò impedisce la formazione del poro di transizione mitocondriale.
Il linfoma follicolare è poco aggressivo perché è caratterizzato da cellule che si
accumulano, non proliferano molto ma non muoiono. In alcuni pazienti ci può essere
un’accelerazione della malattia e si è scoperto che in questi pazienti ci sono anche
alterazioni nei geni che regolano la proliferazione cellulare (soprattutto Ras o Myc).
Dall’interazione tra inibizione dell’apoptosi e stimolazione della proliferazione
cellulare deriva la formazione di un tumore particolarmente aggressivo.
Questo si può vedere anche nei topi transgenici per Myc e Bcl-2: i topi che portano il
transgene Bcl-2 sviluppano una malattia simile a quella umana, con scarsa attività
proliferativa dove si accumulano cellule in G0 che non muoiono; se a questi topi si
aggiunge il transgene Myc, si sviluppano tumori molto aggressivi che proliferano e
non muoiono, e inoltre sono resistenti alla terapia.
Questa è una dimostrazione in sistemi sperimentali della possibilità di cooperazione
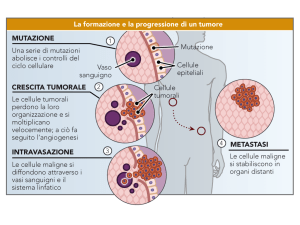
tra oncogeni. Non basta un singolo oncogene a indurre la formazione di un tumore,
ma è necessario l’accumulo di più alterazioni e in genere questo accumulo determina
la capacità delle cellule tumorali di proliferare, inibire l’apoptosi, immortalizzarsi,
indurre angiogenesi e metastasi.