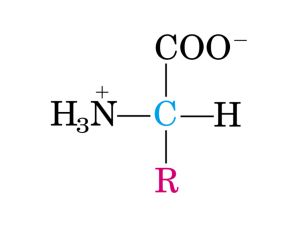
Metabolismo degli amminoacidi
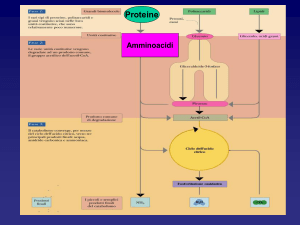
Gli amminoacidi derivati in gran parte dalla degradazione delle proteine
della dieta o intracellulari possono essere ossidati per generare energia.
La quantità di energia ricavata dall’ossidazione degli amminoacidi varia in
funzione del tipo di organismo e della situazione metabolica.
Il catabolismo degli amminoacidi nelle piante è in genere correlato alla
produzione di metaboliti per altre vie biosintetiche.
Tre situazioni in cui gli amminoacidi negli animali subiscono una
degradazione ossidativa:
1) Durante la sintesi e degradazione delle proteine cellulari (turnover delle
proteine), alcuni amminoacidi, se non necessari per la sintesi di altre proteine
possono essere ossidati.
2) Quando una dieta è ricca di proteine e gli amminoacidi sono in eccesso per
la sintesi di proteine; non si possono formare riserve di amminoacidi!
3) Durante il digiuno prolungato.
La prima tappa del catabolismo degli amminoacidi in qualunque organismo
consiste normalmente nella rimozione del gruppo α-amminico.
La rimozione del gruppo α-amminico (con la formazione di un α-chetoacido)
è dovuta all’azione di enzimi chiamati amminotransferasi o transaminasi.
Nel loro insieme le amminotransferasi convogliano il gruppo α-amminico
della maggior parte degli amminoacidi all’α-chetoglutarato formando
glutammato.
Il glutammato viene trasportato dal citosol nei mitocondri dove viene
sottoposto a deaminazione ossidativa catalizzata dalla L-glutammato
deidrogenasi.
L’α-chetoglutarato prodotto dalla reazione della glutammato deidrogenasi è
un intermedio del ciclo dell’acido citrico.
La glutammato deidrogenasi è un enzima allosterico molto complesso.
-Il GTP, un prodotto della succinil-CoA sintetasi nel ciclo dell’acido citrico,
ne è un modulatore negativo
La glutammina trasporta ammoniaca attraverso il sangue.
Composto con carica
negativa
Nei tessuti extraepatici lo ione NH4+ per
l’escrezione prodotto dalla reazione catalizzata
dalla glutammato deidrogenasi, reagisce col
glutammato per formare glutammina, un
trasportatore non tossico di gruppi amminici
che può attraversare le membrane cellulari.
Durante questa reazione, catalizzata dalla
glutammina sintetasi viene idrolizzato ATP.
Composto neutro
La glutammina entra nel circolo sanguigno e
raggiunge il fegato.
Nei mitocondri epatici il gruppo amminico è
nuovamente convertito in NH4+ , con
l’intervento della glutamminasi.
Il principale trasportatore di ammoniaca dal muscolo al fegato è l’alanina.
L’alanina viene prodotta quando i gruppi amminici, raccolti dal glutammato,
sono trasferiti al piruvato. Questa reazione è catalizzata dalla alanina
transaminasi.
Nel fegato il gruppo amminico trasportato è trasferito dall’alanina
nuovamente all’α-chetoglutarato generando glutammato e piruvato.
Il piruvato può essere utilizzato dal fegato per la gluconeogenesi.
Il ciclo del glucosio-alanina
L’ammoniaca libera è molto tossica e non può essere accumulata nell’organismo.
I gruppi amminici se non vengono riutilizzati per la sintesi di altri amminoacidi o
altri prodotti azotati devono essere eliminati
Molti organismi acquatici rilasciano l’ammoniaca semplicemente sotto forma di
ioni NH4+.
Gli organismi che eliminano ammoniaca non possono vivere in ambienti in cui
l’acqua è limitata.
L’evoluzione delle specie terrestri è sostanzialmente dipesa dallo sviluppo delle
capacità di convertire l’ammoniaca in composti non tossici da eliminare in un
piccolo volume di acqua.
La maggior parte dei vertebrati terrestri converte l’ammoniaca in urea (uomo,
altri mammiferi, anfibi adulti) o in acido urico (uccelli e rettili)
Negli uccelli e nei rettili, la disponibilità di acqua è un elemento fondamentale
nello scegliere l’acido urico come via di eliminazione dell’azoto
-l’urea viene escreta con le urine (+ acqua)
-l’acido urico, poco solubile, viene escreto con le feci sotto forma di cristalli di
acido urico.
La prima tappa nella produzione dell’urea
consiste nella formazione del carmamil
fosfato catalizzata dalla carbamil fosfato
sintetasi I.
carbossifosfato
Questo processo avviene all’interno della
matrice mitocondriale epatica e porta
all’accoppiamento covalente di un azoto
del NH4+ con un atomo di carbonio. Nella
reazione si consumano 2 ATP.
Carbamil fosfato
Il ciclo dell’urea
Il gruppo carbamilico ha un
elevato potenziale di trasferimento
a causa del suo legame anidride e
viene trasferito all’ornitina per
formare citrullina.
2Pi
La citrullina è trasportata dalla
matrice mitocondriale nel citosol
dove si condensa con l’aspartato, il
donatore del secondo gruppo
amminico.
L’argininosuccinasi
scinde
l’argininsuccinato in arginina e
fumarato.
L’arginina è infine idrolizzata in
urea e ornitina.
L’ornitina
è
trasportata
nuovamente nel mitocondrio per
iniziare un nuovo ciclo, mentre
l’urea
è
eliminata
tramite
escrezione.
La sintesi del fumarato è importante perché lega il ciclo dell’urea al ciclo
dell’acido citrico.
Il fumarato viene idratato a malato che a sua volta viene ossidato ad
ossalacetato.
L’ossalacetato ha diversi possibili destini metabolici:
1) Transaminazione ad aspartato
2) Conversione a glucosio attraverso la via gluconeogenetica (via
fosfoenolpiruvato)
3) Condensazione con l’acetil CoA per la sintesi di citrato (ciclo dell’acido
citrico)
4) Conversione in piruvato.
La reazione netta nella formazione del carbamil fosfato più il ciclo dell’urea è:
O
O
CO2 + NH4+ + 3 ATP + -O - C - CH2 - CH - C - ONH3+
Aspartato
O
2HN
O
O
- C - NH2 + 2 ADP + 2 Pi + AMP + PiPi + 7 H+ + -O - C - CH = CH - C - OUrea
Fumarato
2 Pi
L’escrezione dell’urea e l’idrolisi del pirofosfato spingono la reazione verso il
compimento.
Uno degli atomi di azoto proviene da NH4+, mentre l’altro dall’aspartato.
La reazione netta nella formazione del carbamil fosfato più il ciclo dell’urea è:
O
O
CO2 + NH4+ + 3 ATP + -O - C - CH2 - CH - C - ONH3+
Aspartato
O
2HN
O
O
- C - NH2 + 2 ADP + 2 Pi + AMP + PiPi + 7 H+ + -O - C - CH = CH - C - OUrea
Fumarato
2 Pi
Considerando l’idrolisi del pirofosfato, durante la produzione di una sola
molecola di urea vengono scissi 4 legami fosfoanidridici.
La detossificazione di NH4+ è un processo che richiede energia.
Destino degli scheletri carboniosi degli amminoacidi
La strategia della degradazione degli amminoacidi è quella di convertire gli
scheletri carboniosi in intermedi metabolici di primaria importanza, che possono
essere trasformati in glucosio o ossidati nel ciclo dell’acido citrico.
Gli amminoacidi che sono degradati a acetil CoA o acetoacetil CoA sono detti
chetogenici, in quanto possono dare origine a corpi chetonici oppure essere
utilizzati per la sintesi di acidi grassi.
Gli amminoacidi che sono degradati a piruvato o ad intermedi del ciclo dell’acido
citrico sono detti glucogenici perché possono essere utilizzati per la sintesi netta di
glucosio.
I mammiferi non hanno una via metabolica per la sintesi diretta di glucosio a
partire da acetil CoA o acetoacetil CoA.
Destino degli scheletri carboniosi degli amminoacidi
Gli amminoacidi glucogenici sono colorati in violetto, mentre quelli chetogenici sono
colorati in giallo. Quasi tutti gli amminoacidi sono sia glucogenici che chetogenici
Biosintesi degli amminoacidi
L’azoto è un componente essenziale degli amminoacidi
L’atmosfera è ricca di azoto gassoso (N2), una molecola poco reattiva.
Certi organismi come i batteri che vivono nei noduli radicali del Trifolium
aureum sono in grado di convertire l’azoto gassoso in ammoniaca.
Questo composto può essere utilizzato per sintetizzare prima glutammato e
glutammina e poi altri amminoacidi.
Il ciclo dell’azoto
Alcuni batteri in
condizioni anaerobiche
La fissazione dell’azoto
Soltanto poche specie di batteri possono convertire l’azoto atmosferico (N2) in
ammoniaca (NH3).
La fissazione dell’azoto è mediata da due enzimi che sono uniti in un complesso noto
come complesso della nitrogenasi, la nitrogenasi riduttasi e la nitrogenasi.
Gli elettroni per la riduzione dell’N2 provengono di solito dall’ossidazione di composti
organici o dalla fotosintesi.
Gli elettroni fluiscono dalla ferredossina (generata nella fotosintesi o in altri processi
ossidativi) alla riduttasi (una ferroproteina) e raggiungono la nitrogenasi (una proteina
molibdeno-ferro) per ridurre l’azoto ad ammoniaca.
L’idrolisi dell’ATP nella riduttasi determina alcune modificazioni conformazionali
necessarie per un efficiente trasferimento degli elettroni.
Per ciascun elettrone trasferito vengono idrolizzate 2 molecole di ATP.
La fissazione dell’azoto (b)
Sebbene solo 6 elettroni siano richiesti per ridurre l’N2 a 2 NH3, 8 elettroni
debbono passare attaverso il complesso della nitrogenasi per ridurre una
molecola di N2. I due elettroni in più sono dovuti alla produzione obbligatoria di
una molecola di H2.
La reazione catalizzata dalla nitrogenasi è:
N2 + 8 H+ + 16 ATP + 16 H2O ' 2 NH3 + 16 ADP + 16 Pi + H2
La fissazione dell’azoto è un processo costoso dal punto di vista del consumo
energetico.
Il complesso della nitrogenasi è estremamente sensibile all’inattivazione da parte
dell’O2.
I noduli che fissano l’azoto
Alcuni batteri che fissano l’azoto vivono
quali simbionti nei noduli delle radici delle
piante leguminose.
Le piante forniscono l’energia per la
fissazione dell’azoto sotto forma di
carboidrati.
Le piante producono una proteina che lega
l’O2, la leghemoglobina, che evita che l’O2
interferisca col complesso della nitrogenasi.
I noduli che fissano l’azoto
Fotografia al microscopio elettronico di una sezione sottile di un nodulo di una radice
di pisello.
In rosso i batteri simbiontici, in giallo/verde il nucleo della cellula vegetale.
L’azoto ridotto, sotto forma di ione ammonio NH4+ è incorporato nelle
biomolecole attraverso il glutammato e la glutammina.
Il glutammato e la glutammina sono poi utilizzati direttamente o
indirettamente come fonte di azoto per la biosintesi di altri composti azotati
(altri amminoacidi, purine, pirimidine)
La glutammato deidrogenasi
La glutammato deidrogenasi catalizza
l’amminazione riduttiva dell’α-chetoglutarato.
Base
di Schiff
Gli equivalenti riducenti necessari alla reazione
sono forniti dal NADPH.
Nei mammiferi la glutammato deidrogenasi
catalizza la reazione inversa durante il
catabolismo degli amminoacidi (usando NAD+
come ossidante)
La glutammina sintetasi
La glutammina sintetasi catalizza la produzione
dipendente da ATP di glutammina da
glutammato e NH4+ .
La reazione catalizzata dalla glutammina
sintetasi rappresenta il punto d’ingresso
dell’azoto ridotto nel metabolismo cellulare.
La glutammina sintetasi è il sito di regolazione
del metabolismo dell’azoto.
Numerosi prodotti finali del metabolismo
della glutammina sono inibitori allosterici
dell’enzima.
La glutammina sintetasi è soggetta oltre alla
regolazione allosterica anche a regolazione
covalente (aggiunta reversibile di unità di
AMP, adenilazione, o di UMP, uridilazione)
Il
gruppo α-amminico della maggior parte degli
amminoacidi proviene dal gruppo α-amminico del
glutammato per transamminazione.
La glutammina fornisce il suo atomo di azoto della catena
laterale nella biosintesi di numerosi composti, tra cui il
triptofano e l’istidina.
Biosintesi degli amminoacidi
L’alanina, l’aspartato e il glutammato vengono prodotti ciascuno tramite una reazione
di transamminazione che si svolge in una sola tappa.
Per sintetizzare ciascuno degli altri amminoacidi non essenziali sono necessarie tappe
ulteriori.
Famiglie biosintetiche di amminoacidi in batteri e piante
L’insieme delle vie biosintetiche degli amminoacidi
= precursori dalla glicolisi
*
= precursori dal ciclo dell’acido citrico
= precursori dalla via del pentosio fosfato
*
*
*
*
* = amminoacidi essenziali
*
*
*
*