La chimica del benzene e dei suoi derivati
I derivati del benzene vengono chiamati ‘composti aromatici’ poiché
inizialmente vennero isolati dal catrame nel 1800 ed erano
caratterizzati da un odore ‘aromatico’
‘aromatico’.. Il benzene fu identificato da
Faraday
y nel 1825.
1825. Kekulé nel 1865 p
propose
p
una struttura ciclica con tre
insaturazioni in equilrio tra due forme identiche
identiche.. Ora noi sappiamo che
è una struttura con i sei legami della stessa lunghezza, un ibrido di
risonanza di due forme equivalenti
equivalenti..
Strutture di Kekulé
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Stabilità del benzene (entalpie di idrogenazione) –
Energia di risonanza
Energia di risonanza: differenza tra il ∆H°idrogen (benzene) e ∆H°idrogen
(cicloesatriene). Benzene è una molecola molto stabile
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
1
Aromaticità
Regola di Hückel (4n + 2). Una molecola è aromatica quando
ha un sistema Π planare, ininterrotto e ciclico che contiene
4n+2 elettroni (n=0, 1, 2, 3, 4, etc…).
Origina dall’energia degli orbitali molecolari dei composti
aromatici
ti i
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
3
Orbitali molecolari (MO)
Un possibile modo per semplificare la teoria quantica che
definisce i legami chimici è quella della teoria dell’orbitale
molecolare.
Essa descrive i legami considerando le strutture elettroniche di
un gruppo di atomi come un’entità singola. Il numero di orbitali
molecolari di un determinato sistema è uguale al numero di
orbitali atomici (AO) che lo formano. Anche in questo caso
valgono la regola di Hund e il principio di esclusione di Pauli
Molecola di Idrogeno
4
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
Molecola di idrogeno – diagramma di energia
σ= orbitale di legame; σ* =orbitale di antilegame
5
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Legame CH – diagramma di energia
σ= orbitale di legame; σ* =orbitale di antilegame
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
3
Legame CH – diagramma di energia
σ= orbitale di legame; σ* =orbitale di antilegame
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
7
Interazione tra orbitali p dei doppi legami – etilene
diagramma di energia
σ, Π= orbitale di legame; σ*,Π* =orbitale di antilegame
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
8
4
Interazione tra orbitali p dei doppi legami – dieni
coniugati
diagramma di energia
σ, Π= orbitale di legame; σ*,Π* =orbitale di antilegame
9
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ciclobutadiene (annulene)
Molecola non stabile a temperatura ambiente
Molecola antiaromatica – due doppi legami di eguale energia e di
lunghezza differente dai legami singoli
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
10
5
Anione ciclopentadienile (molecola aromatica)
pKa=16
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
11
Composti aromatici con anelli multipli o eteroatomi
Eterocicli
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
12
6
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Derivati del benzene - nomenclatura
orto, meta, para (o,m,p)
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
14
7
Derivati del benzene - nomenclatura
15
16
8
NMR di benzeni sostituiti
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1H
17
NMR Benzeni sostituiti
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
18
9
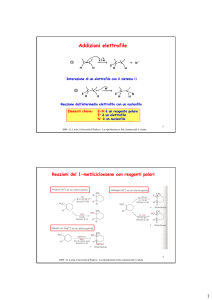
Sostituzioni Elettrofile Aromatiche
Il benzene ha il sistema Π ricco di elettroni e quindi può agire da
nucleofilo e regire con un sito elettrofilo.
elettrofilo. La reazione consiste in
due passaggi:
passaggi:
• Generazione del carbocatione intermedio, rds
• Rigenerazione del sistema aromatico
dell’intermedio carbocationico
via
deprotonazione
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
19
Intermedio carbocationico (stabilizzato per risonanza)
20
10
Elettrofili usati nella sostituzione elettrofila aromatica
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
21
Benzene con bromo o cloro in presenza di un acido di Lewis
Nitrazione del benzene con acido nitrico
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
22
11
Solfonazione del benzene con acido solforico o oleum
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
23
Alchilazioni e acilazioni di FriedelFriedel-Crafts
Si utilizzano carbocationi come agenti alchilanti (elettrofili). In
presenza di un acido di Lewis possono avvenire molti processi
secondari e quindi spesso è una reazione poco selettiva.
Si utilizza con R= t-butile o ii-propile
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
24
12
Alchilazioni di FriedelFriedel-Crafts - polialchilazione
Reazione reversibile – migrazione di gruppo alchilico
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
25
Acilazioni di FriedelFriedel-Crafts
26
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Acilazioni di FriedelFriedel-Crafts – riduzione del carbonile
Sintesi di alchil benzeni via acilazione
acilazione/riduzione
/riduzione
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
27
Sostituzioni elettrofile aromatiche di benzene derivati
Per i derivati del benzene le posizioni non sono più equivalenti e quindi la
sostituzione elettrofila aromatica porta ad ottenere miscele di isomeri
costituzionali.
Alcuni sostituenti attiveranno e altri disattiveranno il substrato, oltre a
dirigere in specifiche posizioni la sostituzione. L’influenza dipende da tre
fattori principali:
Effetti sterici: è più importante per gli orto/para attivatori e favoriscono
la formazione del prodotto parapara-sostituito
Effetti induttivi: la maggior parte degli eteroatomi sono più
elettronegativi del carbonio, rimuovono densità di carica dal benzene e lo
disattivano nei confronti degli elettrofili
Effetti di risonanza: stabilizzano il sistema Π o possono stabilizzare o
destabilizzare l’intermedio carbocationico
28
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
14
29
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Gruppi alchilici: gruppi orto/para direttori e attivanti
Perché orto/para?
30
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
15
Intermedi carbocationici – formule di risonanza
31
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Diagramma della coordinata di reazione per il primo passaggio di
formazione del carbocatione (rate determining step).
step). Hammond
postulate predice che la formazione dei carbocationi orto/para sostituiti
hanno una più bassa energia di attivazione
32
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
16
Benzeni O/N sostituiti orto/para direttori - anisolo
Anisolo più reattivo del benzene: perché?
L’effetto induttivo lo rende
meno reattivo del benzene
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
33
L’anisolo
L’
anisolo è un miglior nucleofilo e quindi più reattivo
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
34
17
Aniline: molto reattive, sostituzione multipla
Aniline: mono sostituzione via
trasformazione nell’acetanilide
nell’acetanilide
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
35
Alogeni: orto/para direttori, disattivanti
Gli effetti induttivi, che rendono il sistema meno nucleofilo sono più
importanti di quelli di risonanza. Sistema meno reattivo del benzene
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
36
18
Meta--Direttori: sostituenti con cariche positive o parzialmente positive
Meta
Gruppi con atomi elettrofili direttamente legati all’anello fenilico
37
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Il sostituente disattiva le posizioni orto/para che diventano meno nucleofile
Entrambi gli effetti induttivi e di risonanza diminuiscono la densità elettronica
dell’anello che diventa meno reattivo rispetto al benzene
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
38
19
Aniline: controllo della regiochimica della solfonazione, meta vs para
meta
para
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
39
Gruppi attivanti/deattivanti e orto/para o meta direttori
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
40
20
Ossidazione del benzene e derivati
Il benzene è difficilmente ossidabile poiché ha una chimica molto differente da
quella degli alcheni. Al contrario carboni sp3 legati a un fenili sono più reattivi dei
corrispondenti derivati legati a un carbonio sp3.
Si generano dei radicali che poi possono essere ossidati facilmente da forti
ossidanti come il bicromato di sodio
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
41
Sali di Diazonio
L’elettrofilo NO+ reagisce con l’NH2 dell’anilina (nucleofilo) portando,
dopo una serie di equilibri acido
acido--base, al sale di diazonio
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
42
21
Sali di Diazonio
N2 ottimo gruppo uscente
In presenza di nucleofili si
ottengono differenti derivati
del benzene
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
43
Sintesi di fenoli (H2O)
Iodo derivati
I-, forte nucleofilo. La
iodurazione diretta è
scarsamente efficace, a
differenza della bromurazione
e clorurazione
La sostituzione con Cl, Br o CN
può avvenire in presenza di un
sale di rame
(Reazione di Sandmeyer
Sandmeyer))
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
44
22
Sali di diazonio tetrafluoroborati
tetrafluoroborati:: Sali stabili e isolabili
Per riscaldamento il sale si decompone e si ottiene il corrispondente fluoruro
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
45
Sali di diazonio: reazione con acido ipoforforoso
La bromurazione
b o
a io e diretta
di etta dell’acido
dell’a ido benzoico
be oi o non
o cii avrebbe
a ebbe portato
o tato all’acido
all’a ido
2,4,6 tribromobenzoico
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
46
23
Sali di diazonio: reazione di coupling,
coupling, sintesi degli azo derivati
E’ un elettrofilo. Per reazione con un
sistema aromatico attivato si può ottenere
il prodotto di coupling.
coupling. Solitamente sono
composti
ti molto
lt colorati
l
ti
Colorante per il legno
Colorante per la margarina
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
47
Sostituzioni Nucleofile Aromatiche
Un alogenuro arilico non fornisce la reazione di sostituzione nucleofila
via meccanismo SN1 o SN2. Se in posizione para all’alogeno c’è un
gruppo nitro, ad esempio, il carbonio diventa elettrofilo e quindi riesce a
reagire con dei nucleofili.
Contribuisce anche
l’elettronegatività
del cloro
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
48
24
Sostituzioni Nucleofile Aromatiche ((S
SNAr
Ar))
Reazione del parapara-cloro nitrobenzene con lo ione metilato
Nelle SNAr lo ione fluoruro è un buon gruppo uscente, a differenza che
nelle SN1 o SN2. Rende il carbonio a cui è legato molto elettrofilico
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
49
50
25