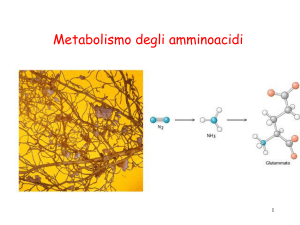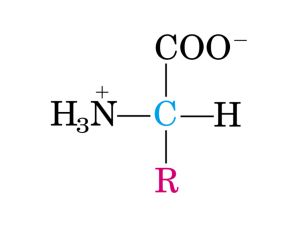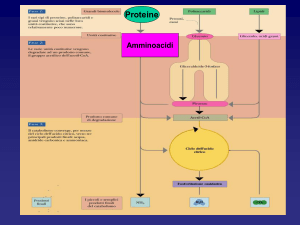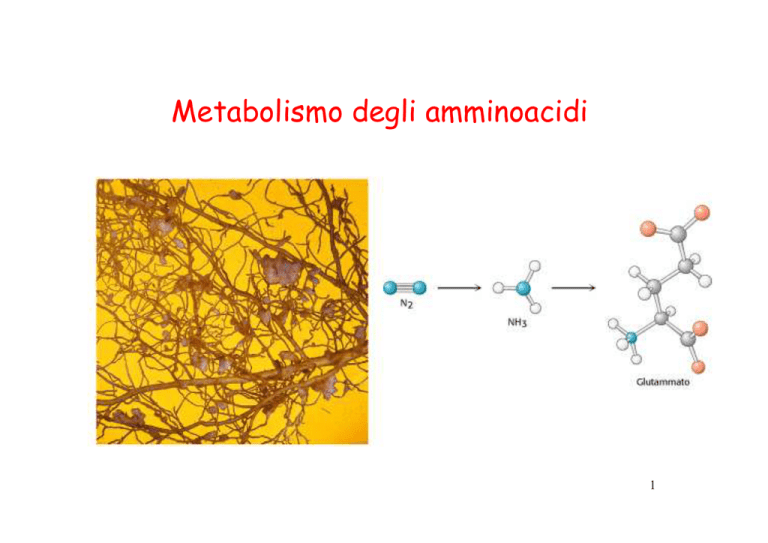
Metabolismo degli amminoacidi
1
2
Glicina, Serina, Alanina e Cisteina sono degradate a piruvato
3
Il glutammato è un amminoacido glucogenico
glutammato
H
O
-OOC-C-CH -CH -C-NH
2
2
2
NH3
O
H
-OOC-C-CH -CH -C-O2
2
H2O
NH3
NH3
glutammina
NADP+
NADPH + NH3
O
-OOC-C-CH -CH -C-O2
2
O
α-chetoglutarato
4
L’α-chetoglutarato è il punto di ingresso metabolico di molti amminoacidi
che sono inizialmente trasformati in glutammato
5
Nel tessuto nervoso il glutammato per decarbossilazione forma il
GABA
2
1
glutammato decarbossilasi
GABA
Nel tessuto cerebrale
questo processo è
alternativo al ciclo di Krebs
transaminasi
deidrogenasi
6
Il GABA è il principale neurotrasmettitore inibitorio
del cervello.
7
(nel fegato)
S-adenosilmetionina è il principale
donatore di metili
Degradazione della metionina
succinil CoA
8
La S-adenosil-metionina è il principale donatore di gruppi metilici
9
Metilazione del DNA
SAM metila le basi dei nucleotidi del DNA formando,
nei vertebrati, metilcitosina.
I gruppi metilici si proiettano nella scanalatura
maggiore del DNA dove interagiscono con le
proteine che legano il DNA
La loro funzione è quella di spegnere
l’espressione genica negli eucarioti.
10
Degradazione degli amminoacidi a
catena ramificata: ISOLEUCINA,
VALINA, LEUCINA
La mancanza dell’enzima
α-chetoacido deidrogenasi
(decarbossilazione ossidativa) causa
la malattia delle urine a sciroppo
d’acero (accumulo di α-chetoacidi a
catena ramificata nelle urine)
isoleucina
α-chetoacido deidrogenasisi
(unico enzima per i 3
amminoacidi)
valina
leucina
ritardo fisico
e mentale
11
Due vie di degradazione del triptofano:
1. formazione di acetoacetato
12
Vie di degradazione del triptofano:
2. Formazione di serotonina
*
importante neurotrasmettitore
nel cervello
Morbo di Hartnup: alterato trasporto
transmembrana del triptofano
melatonina: implicata nella regolazione dei
ritmi circadiani. Inibisce la sintesi e la
secrezione di altri neurotrasmettitori,
quali DOPA e GABA
*
13
La mancanza dell’enzima
fenilalanina idrossilasi o del coenzima
tetraidrobiopterina provoca
fenilchetonuria: in questo caso l’unica via
degradativa della Phe è quella che porta a
1
fenilpiruvato (2).
2
a
b
14
Formazione, utilizzo e rigenerazione della tetraidrobiopterina nella reazione
della fenilalanina idrossilasi
Phe-idrossilasi= ossidasi a funzione
mista poiché utilizza un cofattore e
l’ossigeno molecolare per compiere la
reazione di idrossilazione.
L’ossigeno necessario per la reazione di
idrossilazione proviene dalla molecola
biatomica dell’O2.
L’altro atomo di ossigeno che rimane
si unisce ai due atomi di idrogeno
portati dalla tetraidrobiopterina
formando acqua.
*
Il ripristino della forma ridotta
tetraidrobiopterina si ha con la reazione
di riduzione catalizzata dalla
diidrobiopterina reduttasi che usa
NADH *
15
Fenilchetonuria
I soggetti colpiti tendono ad avere:
•ritardo mentale
•scarsa pigmentazione
•andatura e postura insolite
•crisi epilettiche
Prevenzione per una diagnosi precoce:
•screening nei neonati
•dieta carente di Phe ma arricchita di Tyr per i primi 4-5 anni
•dieta a scarso contenuto proteico per tutta la vita
•aspartame = Asp-Phe-metilestere
Le madri omozigoti per il difetto hanno una probabilità molto elevata di
partorire bambini affetti dall’errore congenito e da ritardo mentale a
meno che non venga controllata la loro assunzione di Phe.
16
Esistono casi di fenilalaninemia dovuti ad un difetto a livello della
sintesi o della riduzione della bipterina, il cofattore dell’enzima
fenilalanina idrossilasi.
Il deficit di diidrobiopterina è molto più grave poichè la biopterina è
necessaria anche per la biosintesi delle catecolamine e della
serotonina che agiscono da neurotrasmettitori
Trattamento:
•somministrazione di biopterina nella dieta
•somministrazione di precursori della serotonina e delle catecolamine
17
Fenilalanina
Fenilalnina
idrossilasi
Tirosina
[PKU]
tirosina idrossilasi
DOPA
Melanina
[albinismo]
tetraidro
biopterina
diiidro
biopterina
Dopamina
Noradrenalina
Adrenalina
Tirosinasi
Omogentisato
omogentisato ossidasi
[ALCAPTONURIA]
Maleilacetoacetato
Fumarilacetoacetato
Fumarato
Acetoacetato
18
In condizioni normali la Phe viene
idrossilata a tirosina
1
2
a
b
19
Catabolismo della tirosina (a)
Nella porzione midollare
della ghiandola surrenale:
tirosina idrossilasi
tetraidrobiopterina
SAM
DOPA decarbossilasi
Piridossalfosfato
(prodotto finale nella
substantia nigra)
20
Morbo di Parkinson (1817)
•tremori sempre più intensi che interferiscono con la funzionalità motoria di
vari gruppi muscolari
•causa: degenerazione delle cellule presenti in piccoli nuclei cerebrali noti
collettivamente come “substantia nigra” e “locus coeruleus”
•presente nei tossicodipendenti che utillizzavano MTPT (metil-fenil-tetraidropiridina) tossico per le cellule produttrici di dopamina
•trattamento con L-DOPA, il precursore della dopamina: effetti collaterali
quali nausea, vomito, ipotensione, aritmia cardiaca e vari sintomi a carico del
SNC dovuti alla trasformazione della DOPA in dopamina in compartimenti
diversi dal SNC
•gli effetti collaterali scompaiono con la contemporanea somministrazione di
analoghi della DOPA che inibiscono l’enzima DOPA decarbossilasi ma che non
sono in grado di oltrepassare la BBB
21
Catabolismo della tirosina (b)
1
2
a
b
22
b
omogentisato ossidasi: la sua deficienza
provoca alcaptonuria
23
Alcaptonuria
•soggetti con un deficit di omogentisato ossidasi eliminano quasi tutta la tirosina
sotto forma di acido omogentisico, idrochinone incolore che tende ad
autoossidarsi nel corrispondente chinone che polimerizza producendo una
sostanza di colore bruno intenso
•l’eliminazione di urine nerastre è la sola conseguenza di questa patologia nei
primi anni di vita
•l’acido omogentisico forma con gli anni pigmenti che si depositano nelle ossa, nel
tessuto connettivo e in vari organi (OCRONOSI) e ciò rappresenta la causa delle
complicazioni artritiche riscontrate in questi pazienti
24
b
I prodotti del metabolismo
della Phe entrano nel ciclo di
Krebs
25
Fenilalanina
Fenilalnina
idrossilasi
Tirosina
[PKU]
Tirosinasi
Melanina
[albinismo]
tetraidro
biopterina
DOPA
diiidro
biopterina
Dopamina
Noradrenalina
Adrenalina
Omogentisato
omogentisato ossidasi
[ALCAPTONURIA]
Maleilacetoacetato
Fumarilacetoacetato
Fumarato
Acetoacetato
26
BIOSINTESI DEGLI AMMINOACIDI
27
Principali precursori degli
amminoacidi
28
Sintesi di alanina, aspartato, glutammato, asparagina e glutammina
29
30
La cisteina si trova nella molecola del glutatione: γ-glutammil-cisteinilglicina
31
Il glutatione è presente in grande quantità negli eritrociti dove ha la funzione
di eliminare l’H2O2 ed i perossidi organici che possono danneggiare
irreversibilmente l’emoglobina
2 GSH + R-O-O-H
GSSG + ROH + H2O
E’ di vitale importanza per
l’integrità degli eritrociti un
rifornimento continuo di
NADPH che è prodotto
dall’attività dell’enzima G6PD
(via del pentoso fosfato)
32
L’amminoacido lisina è il precursore della carnitina, composto che lega l’acil CoA
e ne permette l’entrata all’interno del mitocondrio dove viene ossidato con
liberazione di energia.
33
Gli amminoacidi arginina e glicina sono i precursori della creatina
34
La creatina che si forma nel fegato, viene fosforilata nel mucolo.
La fosfocreatina rappresenta un deposito di energia immediatamente
utilizzabile.
35
nel muscolo:
36
L’amminoacido ornitina è il precursore delle poliamine:
ORNITINA
esse svolgono un importante ruolo
nel controllo della sintesi del
DNA e dell’RNA
ornitina decarbossilasi
PLP dipendente
PUTRESCINA
SAM
spermidina sintetasi
SPERMIDINA
SAM
spermina sintetasi
In queste reazioni SAM è donatore
di un gruppo amminopropile
H3N-(CH2)3
SPERMINA
37
Biosintesi degli amminoacidi
della famiglia del glutammato
38
Conversione del 3-fosfoglicerato in serina
39
Biosintesi degli amminoacidi della famiglia del piruvato
40