N 1/2015
IN VIGILO…..
…. farmacovigilanza e tanto altro
S.C. Farmacia in collaborazione con: Servizio Risk Managment - Servizio trasfusionale
A.O. Circolo e Fondazione Macchi Varese
Farmacovigilanza
Sommario:
Pag.2 - Errori terapeutici con il farmaco
Broncovaleas® (salbutamolo)
Pag.3 - Fingolimod (Gilenya®) e infezione
da virus varicella Zoster
Pag.4 - Rischio di ipoglicemia con tramadolo
Pag.5 - L’uso dell’allopurinolo nel paziente anziano
Pag.6 - Possibile grave interazione Cotrimossazolo e inibitori del sistema
renina-angiotensina
Pag.8 - Interazione tra claritromicina e
statine non metabolizzate dal
citocromo CYP3A
Pag.10 - Andamento dell’attività di segnalazione delle ADR nell’anno 2014
Errori terapeutici con il farmaco
Broncovaleas® (salbutamolo)
Broncovaleas® è un medicinale a base di salbutamolo indicato
per il trattamento dell’asma bronchiale e della broncopatia ostruttiva con componente asmatica. È presente in commercio come
sciroppo 2mg/5ml, sospensione pressurizzata per inalazione 100
mcg/spruzzo e come soluzione da nebulizzare 5mg/ml 15ml.
Quest’ultima formulazione è stata oggetto di diverse note informative pubblicate da AIFA in accordo con Valeas Spa, ditta titolare dell’autorizzazione all’immissione in commercio (AIC), e conseguenti alla segnalazione di reazioni avverse (ADR) gravi a carico di bambini, anche al di sotto dei 2 anni di età, imputabili ad
errori di somministrazione, di posologia o scambio di farmaco.
Le ADR inserite nella Rete Nazionale di Farmacovigilanza (RNF),
principalmente tremori e tachicardia, sono state gravi ed hanno
richiesto l’ospedalizzazione del paziente. Tutti i casi segnalati
hanno avuto come esito la risoluzione della sintomatologia dopo
la sospensione del trattamento.
Per tale motivo AIFA ha limitato l’uso di Boncovaleas® 5mg/ml
15ml soluzione da nebulizzare ai bambini di età superiore ai 2
anni.
Inoltre, allo scopo di minimizzare il rischio di errore posologico, le
informazioni del prodotto sono state aggiornate in relazione al
dosaggio da utilizzare nei bambini da 2 a 12 anni di età.
Pag.12 - Come segnalare una ADR?
Segue
P
2
IN VIGILO...
COSA FARE?
• Prescrivere Broncovaleas® soluzione da nebulizzare soltanto nei bambini al di sopra dei 2 anni di
età indicando sempre il corretto dosaggio da utilizzare;
• Prestare particolare attenzione alla corrispondenza tra gocce - millilitri - milligrammi in rapporto al
peso corporeo del bambino;
1 goccia = 0,05ml = 0,25mg
• All’atto della prescrizione, informare i genitori in merito al corretto dosaggio ed alla via di somministrazione da utilizzare.
• Bambini da 2 a 12 anni
Il dosaggio deve basarsi sul peso corporeo (da 0,1 a 0,15 mg/Kg per dose) con successiva titolazione
fino a raggiungimento della risposta clinica desiderata. La dose massima non deve mai superare i
2,5mg 3-4 volte al giorno per nebulizzazione.
POSOLOGIA
RACCOMANDATA
Peso corporeo
(Kg)
Dose
(milligrammi)
Volume di soluzione
(millilitri)
Numero gocce
10 - 15 Kg
1,25 mg
0,25 ml
5 gtt
> 15 Kg
2,5 mf
0,5 ml
10 gtt
• Adulti e bambini al di sopra dei 12 anni di età
Il dosaggio è di 2,5mg di salbutamolo somministrati 3-4 volte al giorno per nebulizzazione. Non sono
raccomandate frequenza di somministrazione superiore a 4 volte al giorno o dosi superiori a 2,5mg
per nebulizzazione.
Per somministrare 2,5 mg di salbutamolo, diluire 0,5 ml della soluzione per inalazione 5mg/ml con 2,5
ml di soluzione fisiologica sterile. La velocità di flusso dell'inalatore deve essere regolata in modo da
somministrare la dose in un tempo compreso tra 5 e 15 minuti.
P
3
IN VIGILO...
Farmacovigilanza
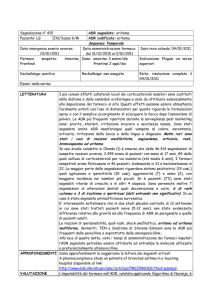
Fingolimod (Gilenya®) e infezione da virus varicella Zoster
Un’indagine internazionale ha verificato i tassi di infezione da virus della varicella-zoster in corso di trattamento
con fingolimod (Gilenya®). I risultati si riferiscono a pazienti di entrambi i sessi ed età compresa tra i 18 e i 60 anni
con sclerosi multipla recidivante-remittente, arruolati sia negli studi di fase II e III (3.916 partecipanti, studi con
disegno caso-controllo, dosi di 0,5mg o 1,25mg al giorno, braccio di controllo con placebo o con interferon β-1a)
sia in quelli ad accesso allargato successivi all’autorizzazione (3.553 partecipanti, studi non controllati, dosi di 0,5
mg al giorno). I tassi di infezione da virus varicella-zoster sono stati bassi ma comunque maggiori nel gruppo di
trattamento rispetto a quello di controllo negli studi e si sono mantenuti costanti nel tempo. Inoltre, si è osservato
uno sbilanciamento nella frequenza di infezioni nel gruppo trattato con fingolimod rispetto ad altri farmaci che modificano il decorso della malattia, ma non nella frequenza di casi gravi.1
FARMACO
REAZIONE
AVVERSA
Nei pazienti con sclerosi multipla sono sovente segnalati casi di infezione da virus varicella-zoster.
Ciò rappresenta un motivo di preoccupazione, tanto più forte in considerazione dell’utilizzo crescente
di farmaci che modificano la risposta immunitaria mediata dai linfociti T, come fingolimod.
Il rischio di infezione da virus di varicella.zoster è indicato anche nel riassunto delle caratteristiche
del prodotto (RCP) del medicinale. Nello specifico, nel capitolo “avvertenze speciali e precauzioni di
impiego” è infatti riportato che è necessario che i pazienti siano stati valutati in merito al loro stato di
immunità per la varicella prima di iniziare il trattamento con fingolimod. In assenza di storia di varicella confermata da un medico o di prove che attestino che sia stato effettuato un ciclo vaccinale completo contro la varicella, si raccomanda di sottoporre i pazienti al dosaggio degli anticorpi verso il
virus varicella-zoster (VZV) prima di iniziare la terapia e per i pazienti con titolo anticorpale negativo
è raccomandato un ciclo vaccinale completo contro la varicella prima di iniziare la terapia.
N. ADR
1
3
1
5
8
2
1
2
1
1
25
Dal 1/01/2009 al 31/12/2014 sono state inserite nella RNF 25
ADR da fingolimod aventi come descrizione infezione da virus
varicella-zoster.
Il 76% delle ADR ha interessato donne mentre nel 24% uomini,
ciò può essere spiegato sia con la maggior frequenza con cui le
donne sono interessate da ADR sia perché questa patologia
interessa prevalentemente le donne. È stato stimato che la
sclerosi multipla è più frequente nelle donne piuttosto che negli
uomini: su scala globale le donne si ammalano il doppio degli
uomini, con un rapporto medio uomo/donna pari 0,5. Se si
guarda la distribuzione in Italia si vede che il maggior numero di
segnalazioni si è avuto in Lombardia, grazie anche ai molti progetti di farmacovigilanza attivi.
COSA FARE?
REGIONE
Calabria
Campania
Emilia Romagna
Lazio
Lombardia
Marche
P.A. Bolzano
Sicilia
Toscana
Veneto
Totale
SEGNALAZIONI
1
Fingolimod è un medicinale indicato per il trattamento della sclerosi multipla recidivante-remittente
ad alta attività. Presenta una struttura analoga alla sfingosina ed agisce come modulatore del recettore per la sfingosina-1-fosfato (S1P).
Si tratta di un profarmaco che, per opera dell’enzima sfingosina-chinasi, viene trasformato nel metabolita attivo fingolimod fosfato. Il metabolita attivo riduce la capacità delle cellule T di spostarsi dai
linfonodi verso il cervello e il midollo spinale, limitando quindi i danni che causano nella sclerosi multipla. Esercita tale effetto legandosi al recettore S1P1 localizzato sulla superficie dei linfociti e nel
sistema nervoso centrale agisce come antagonista funzionale dei recettori S1P e inibisce la capacità
dei linfociti di fuoriuscire dai linfonodi. Ciò determina una ridistribuzione degli stessi nell’organismo e
una riduzione dell'infiltrazione dei linfociti patogeni nel SNC, dove sarebbero coinvolti nell'infiammazione a carico dei nervi e nel danno tissutale.
Dai dati emerge che l’impiego di steroidi per il trattamento delle recidive favorisce la riattivazione
virale ed è particolarmente controproducente. Infatti i 2 casi fatali di infezione si sono verificati in pazienti in trattamento anche con steroidi. E’ perciò necessario, secondo gli autori, che prima di utilizzare questi farmaci il paziente sia stabile dal punto di vista immunitario e immunizzato (naturalmente
o con vaccino) rispetto all’infezione da varicella-zoster.
Non sembra indicata la profilassi antivirale, mentre per l’impiego di steroidi, anche con schemi di
somministrazione pulsatile, deve essere attentamente considerato il rapporto rischi-benefici. E’ poi
indispensabile in corso di terapia un’attenta sorveglianza del paziente per cogliere gli eventuali sintomi iniziali di infezione da virus della varicella-zoster.
Arvin AM, Wolinsky JS, et al. Varicella-Zoster virus infections in patients treated with fingolimod: risk assessment and consensus recommendations for management. JAMA Neurol 2014; doi: 10.1001/jamaneurol.2014.3065.
P
4
IN VIGILO...
Farmacovigilanza
Rischio di ipoglicemia con tramadolo
Uno studio condotto dai ricercatori dello Jewish General Hospital di Montreal suggerisce che l’impiego di tramadolo possa associarsi a un rischio significativo di ipoglicemia grave.1
FARMACO
Il tramadolo è un analgesico oppiaceo ad azione centrale. È un agonista puro non selettivo dei recettori µ, δ, e κ degli oppiacei con maggior affinità per i recettori µ.
Altri meccanismi che contribuiscono al suo effetto analgesico sono l'inibizione della ricaptazione
neuronale della noradrenalina e l'aumento del rilascio di serotonina.
Il tramadolo ha un effetto antitussivo. A dosi analgesiche e, se si rispettano gli intervalli di somministrazione riportati in scheda tecnica, non ha effetti depressivi sulla respirazione e non influisce sulla
motilità gastrointestinale; mentre gli effetti sul sistema cardiovascolare tendono ad essere di lieve
entità.
Si parla di ipoglicemia quando i livelli di glucosio nel sangue scendono al di sotto di 70 mg/dl. Si distinguono tre gradi di ipoglicemia:
REAZIONE
AVVERSA
• lieve con sintomi solo di carattere neurogenico (come tremori, palpitazione e sudorazione),
• Moderato dove accanto ai sintomi neurogenici si aggiungono sintomi neuroglicopenici (come
confusione e debolezza),
• severo caratterizzato da uno stato di coscienza alterato dell’individuo.
Dal momento che il cervello utilizza il glucosio come unica fonte energetica, in caso di ipoglicemie
severe è il primo organo a risentirne e ciò spiega gli effetti a carico del SNC, se il problema non viene risolto rapidamente può degenerare in uno stato comatoso fatale.
SEGNALAZIONI
Consultando l'United Kingdom Clinical Practice Research Datalink, il registro di dati sanitari del National Health Service messo a punto per facilitare gli studi osservazionali e la ricerca clinica, è stata
selezionata una coorte di 334.034 pazienti con dolore non oncologico trattati per la prima volta con
tramadolo (n=28.110) o con codeina (n=305.924) nel periodo 1998-2012.
Utilizzando successivamente l’Hospital Episode Statistics database, che raccoglie le informazioni su
tutti i ricoveri effettuati nel Regno Unito, sono stati identificati nell’ambito della coorte 1.105 casi (età
media 65 anni) di ricovero per ipoglicemia (incidenza 0,7% all’anno), 112 dei quali (10,1%) fatali. E’
stato rilevato che nei 15 anni di osservazione l’uso di tramadolo è cresciuto di circa 8 volte.
L’impiego del tramadolo ha comportato, rispetto alla codeina, un aumento significativo del rischio di
ospedalizzazione per ipoglicemia (odds ratio 1,52, CI al 95% da 1,09 a 2,1), specie nel primo mese
di terapia (odds ratio 2,61, CI al 95% da 1,61 a 4,23). Tale rischio a breve termine è confermato sia
dall’analisi di coorte (hazard ratio 3,6, CI al 95% da 1,56 a 8,34) sia dallo studio con disegno crossover (odds ratio 3,8, CI al 95% da 2,64 a 5,47).
Nella RNF dal 1/1/2009 al 31/12/2014 sono state inserite 5 ADR aventi come descrizione
“ipoglicemia” e come farmaco sospetto tramadolo. Di queste 1 è riferita ad un tentato suicidio mentre 2 presentano tra i farmaci sospetti anche un antidiabetico. Se si effettua la ricerca considerando
lo stesso periodo temporale e la medesima descrizione dell’evento ma definendo il medicinale tramadolo come farmaco concomitante vengono selezionate 15 segnalazioni, di cui 13 in associazione
ad un antidiabetico.
Concludendo…
L’ipoglicemia non è riportata né tra le controindicazioni né tra gli effetti indesiderati dei medicinali a base di tramadolo. Si tratterebbe quindi di un evento nuovo e inatteso.
Ulteriori dati sono necessari per stabilire una relazione causale, in questa fase è bene prestare attenzione
quando si prescrive tramadolo a pazienti diabetici.
1
Fournier JP, Azoulay L, et al. - Tramadol use and the risk of hospitalization for hypoglycemia in patients with noncancer pain
JAMA Intern Med 2014; doi:10.1001/jamainternmed.2014.6512
P
5
IN VIGILO...
Farmacovigilanza
L’uso dell’allopurinolo nel paziente anziano
L’allopurinolo è un farmaco che ha numerose interazioni farmacologiche e che richiede una riduzione del dosaggio in alcuni pazienti soprattutto in quelli anziani sottoposti a politerapie e con comorbilità.
FARMACO
L’allopurinolo è un farmaco di uso molto comune per il trattamento dell’iperuricemia, definita per
valori di acido urico superiori a 6,8mg/dl o 7mg/dl. Le principali manifestazioni cliniche da deposito di
acido urico/urato sono: gotta articolare, tofi e/o interessamento renale per precipitazione di cristalli o
per urolitiasi.
È spesso prescritto per l’iperuricemia asintomatica, tale terapia trova indicazione solo nel caso di:
• iperuricemia persistente nei pazienti con livelli di acido urico superiori a 13 mg/dl nell’uomo o 10
mg/dl nella donna;
• escrezione urinaria di acido urico a 1.100 mg/die, associata ad un rischio del 50% di sviluppare
calcoli di acido urico;
• nei pazienti sottoposti a radioterapia o chemioterapia per prevenire la nefropatia da acido urico
e altre manifestazioni della sindrome da lisi tumorale.
SEGNALAZIONI
Circa il 5% dei pazienti che iniziano ad assumere allopurinolo deve sospenderlo a causa di eventi
avversi.
Le ADR più frequenti associate all’utilizzo dell’allopurinolo sono reazioni cutanee, disturbi gastrointestinali ed ematologici.
Tra le reazioni cutanee gravi potenzialmente fatali sono state segnalate la sindrome di StevensJohnson, la sindrome di Lyell (necrolisi epidermica tossica) con un’incidenza <1%. Più rara è la sindrome DRESS, detta anche AHS (Allopurinol Hypersensitivity Syndrome), caratterizzata da rash
cutaneo, eosinofilia, leucocitosi, febbre, alterazione della funzionalità renale ed epatica e con un
tasso di mortalità superiore al 27%.
Nel solo anno 2014 nella RNF sono state inserite 1.190 sospette ADR nelle quali l’allopurinolo è stato riportato come farmaco sospetto, 985 (82%) hanno coinvolto la popolazione con età maggiore di
65 anni e 630 (53%) è sono state indicate come gravi.
Tra le reazioni riportate, il 60% circa ha interessato il tessuto cutaneo e sottocutaneo e tra queste 6
segnalazioni hanno riportato la sindrome DRESS e 3 la sindrome di Lyell.
I fattori di rischio per l’insorgenza di ADR da allopurinolo sono svariati: l’età avanzata, la funzionalità
renale compromessa, la presenza dell’allele HLA-B*5801, l’uso di diuretici, l’alcolismo, alti dosaggi
di allopurinolo e la disfunzione epatica grave.
Uno studio osservazionale condotto dal 2001 al 2010 dall’Università di Cagliari ha valutato le ADR
cutanee gravi da farmaco verificatesi in pazienti (età media 74 anni) seguiti dal Reparto di dermatologia di un ospedale della Sardegna del Sud, rilevando che il 10,7% di queste era stato causato
dall’allopurinolo. Nel 96% dei casi si è resa necessaria l’ospedalizzazione per la gravità della manifestazione clinica. Nel 95,5% dei casi l’indicazione alla terapia con allopurinolo era l’iperuricemia
asintomatica e il 12% aveva già presentato una reazione all’allopurinolo a una precedente somministrazione.
Concludendo…
Un’attenta valutazione del rischio di ADR dovrebbe essere effettuata in ogni paziente tenendo conto dell’età
avanzata e del numero di farmaci assunti (>3), includendo i diuretici tiazidici, che risultano implicati nella riduzione dell’eliminazione dell’allopurinolo.
Solo il 14,3% dei pazienti analizzati assumeva un dosaggio di farmaco adeguato alla propria clearance della
creatinina.
Anche se l’iperuricemia gioca un ruolo in alcune patologie renali, cardiovascolari e metaboliche spesso associate alla gotta, non sono disponibili evidenze che giustifichino il trattamento dell’iperuricemia asintomatica se non
nei tre casi precedentemente descritti.
P
6
IN VIGILO...
Interazioni farmacologiche
Possibile grave interazione tra cotrimossazolo ed inibitori
del sistema renina-angiotensina
Da un recente studio retrospettivo caso-controllo, pubblicato su BritishMedical Journal, è emerso che l’uso di cotrimossazolo (Bactrim®) è associato ad un aumentato rischio di morte improvvisa in pazienti anziani che assumono inibitori dell’enzima di conversione dell’angiotensina (ACE-inibitori) o bloccanti del recettore dell’angiotensina
(ARB o sartani).
L’analisi è stata condotta in Ontario (Canada) su una popolazione di 1.601.542 pazienti di età ≥ 66 anni trattati
con un inibitore dell’enzima di conversione o un bloccante del recettore dell’angiotensina nel periodo compreso
tra il 1 aprile 1994 e il 1 gennaio 2012.
Di tale popolazione sono stati considerati solamente i casi di morte improvvisa avvenuta successivamente ad una
prescrizione ambulatoriale di uno dei seguenti antibiotici: cotrimossazolo, amoxicillina, ciprofloxacina, norfloxacina
o nitrofurantoina.
L’outcome principale valutato è stato l’odds ratio per l’associazione tra morte improvvisa e l’esposizione ad ogni
antibiotico, rispetto all’amoxicillina, dopo aggiustamento per i predittori di morte improvvisa in base ad un indice di
rischio di malattia.
Delle 39.879 morti improvvise, 1.027 si sono verificate entro sette giorni di esposizione ad un antibiotico e sono
state abbinate a 3.733 controlli. Rispetto all’amoxicillina, il cotrimossazolo è stato associato ad un aumentato rischio di morte improvvisa (odds ratio aggiustato 1,38, IC 95% 1,09-1,76); il rischio era leggermente superiore a
14 giorni (odds ratio aggiustato 1,54, 1,29-1,84). Ciò corrisponde a circa tre morti improvvise entro 14 giorni per
1.000 prescrizioni di cotrimossazolo. Anche la ciprofloxacina, di cui è nota come reazione avversa il prolungamento dell’intervallo QT, è stata associata ad aumentato rischio di morte improvvisa (odds ratio aggiustato 1,29,
1,03-1,62), mentre tale rischio non è stato osservato per la nitrofurantoina e la norfloxacina.
I FARMACI
Cotrimossazolo è una combinazione antibiotica con rapporto fisso di 5:1 tra sulfametossazolo e trimetoprim. Tale associazione rappresenta un esempio di sinergismo di potenziamento tra due molecole determinando un’azione farmacologica superiore rispetto a quella esercitata dai singoli farmaci.
Nello specifico, viene attuato un blocco sequenziale della via metabolica per la sintesi dei folati nella
cellula batterica. Il cotrimossazolo ha uno spettro d’azione molto ampio che comprende numerosi
Gram+ e Gram- ed è indicato per il trattamento di infezioni delle vie respiratorie, di infezioni renali e
delle vie urinarie, di infezioni dell’apparato genitale e dell’apparato digerente.
Gli ACE-inibitori e i bloccanti del recettore dell’angiotensina sono farmaci utilizzati per la terapia dell’ipertensione arteriosa, nel post-infarto del miocardio e dell'insufficienza cardiaca cronica.
Gli ACE-inibitori inibiscono l’enzima di conversione dell’angiotensina impedendo così la sintesi
dell’angiotensina II, un potente vasocostrittore, e la degradazione della bradichinina.
I bloccanti del recettore dell’angiotensina, invece, bloccano selettivamente il recettore AT1 localizzato sulle membrane cellulari di diversi tessuti e l’attività dell’angiotensina II.
L’attività di questi farmaci determina la caduta del tono dei vasi sanguigni, la riduzione della secrezione di angiotensina II e della secrezione di aldosterone, tutto ciò si traduce in diminuzione della pressione sanguigna.
INTERAZIONE
I ricercatori hanno collegato le morti improvvise verificatesi nella popolazione analizzata all’iperkaliemia. Il potassio è il principale catione intracellulare e il principale determinante del potenziale di membrana a riposo.
L'aumento della concentrazione di potassio extra-cellulare diminuisce la negatività del potenziale di
riposo della cellula cardiaca, depolarizzandola in parte. Di conseguenza diminuisce anche l'intensità
del potenziale d'azione e determina l’alterazione del ritmo cardiaco.
L’iperkaliemia può essere asintomatica finché non compaiono i segni di tossicità cardiaca. Le modificazioni iniziali dell’ECG consistono nell’accorciamento dell’intervallo QT e nella comparsa di onde T
alte e appuntite. In presenza di concentrazioni di potassio più elevate (solitamente > 5,5 mEq/l), l’iperkaliemia può causare aritmie nodali e ventricolari, accompagnate da complessi QRS slargati e
intervalli PR prolungati. Nelle fasi terminali si può sviluppare fibrillazione ventricolare o asistolia.
Segue
1
M. Fralick, E. Macdonald, T. Gomes, T. Antoniou, S. Hollands, M. Mamdani, D. Juurlink - Co-trimoxazole and suddendeath in
patientsreceivinginhibitors of renin-angiotensinsystem: populationbasedstudy – BMJ2014;349.
PAGINA 7
IN VIGILO...
Concludendo…
L’iperkaliemia è riportata come reazione avversa comune nell’elenco degli effetti indesiderati del Riassunto delle
Caratteristiche del Prodotto (RCP) di Bactrim® e dei medicinali contenenti un ACE-inibitore o un bloccante del
recettore dell'angiotensina.
Inoltre è noto che l’associazione di farmaci che inibiscono l’angiotensina II o i suoi effetti con altri medicinali che
possono aumentare i livelli di potassio può portare ad iperkaliemia.
L’importanza dei risultati di tale studio è sottolineata dal fatto che sia il cotrimossazolo che gli ACE-inibitori e i
sartani sono farmaci ampiamente prescritti, quest’ultimi soprattutto nella popolazione anziana e comunque affetta
da patologia cardiovascolare.
La somministrazione di cotrimossazolo a pazienti in terapia con un farmaco attivo sul sistema reninaangiotensina è associato ad un maggior rischio di ospedalizzazione per iperkaliemia, sette volte maggiore rispetto all’amoxicillina, e tale interazione farmacologica può causare pericolo di vita per iperkaliemia.
Infine, la morte improvvisa dovuta ad iperkaliemia rischia di essere attribuita erroneamente alla malattia cardiaca,
in particolare nei pazienti anziani con malattia cardiovascolare o diabete.
COSA FARE?
Gli autori suggeriscono che, quando clinicamente appropriato, è preferibile scegliere antibiotici alternativi o limitare la dose e la durata del trattamento con cotrimossazolo nei pazienti in terapia con un
ACE-inibitore o un sartano.
Nel caso in cui la prescrizione non può essere evitata è però consigliato nei pazienti a rischio un attento monitoraggio dei livelli ematici di potassio.
PAGINA 8
IN VIGILO...
Interazioni farmacologiche
Interazione tra claritromicina e statine non metabolizzate
dal citocromo CYP3A
Da un recente studio di coorte, pubblicato sul Canadian Medical Association Journal (CMAJ), è emerso un lieve,
ma significativo, aumento del rischio di ospedalizzazione per danno renale o iperkaliemia nei pazienti anziani che
assumono una statina non metabolizzata dal CYP3A4 in associazione a claritromicina.
La popolazione studiata è costituita da adulti anziani (età media 74 anni) in terapia con una statina non metabolizzata dal CYP3A4 (rosuvastatina, pravastatina o fluvastatina) che hanno assunto una terapia antibiotica con claritromicina (51.523 pazienti) o azitromicina (52.518 pazienti); il periodo preso in esame è stato quello compreso tra
il 2002 e il 2013.
È stato scelto come gruppo di controllo una coorte di pazienti che hanno ricevuto come antibiotico azitromicina:
tale macrolide, a differenza della claritromicina, non influisce sull’attività del CYP3A4 e dei trasportatori di membrana OATP1B1 e OATP1B3.
Gli outcome presi in esame sono stati il ricovero ospedaliero con un codice diagnostico per rabdomiolisi, insufficienza renale acuta o iperkaliemia, e mortalità per tutte le cause.
Rispetto al gruppo di controllo, tra i pazienti con co-prescrizione di claritromicina e una statina non metabolizzata
dal CYP3A4 è stato registrato un aumentato rischio di ricovero per danno renale acuto (RR 1.65; IC 95% 1,312,09), per iperkaliemia (RR 2,17; IC 95% 1,22-3,86), per rabdomiolisi (RR 2,27; IC 95% 0,86-5,96) e di mortalità
per tutte le cause (RR 1,43; IC 95% 1,15-1,76).
I FARMACI
La Claritromicina è un antibatterico per uso sistemico appartenente al gruppo dei macrolidi. La sua
azione antibatterica si esplica per inibizione della sintesi proteica microbica tramite il legame alla proteina 23S della subunità 50S del ribosoma batterico.
Presenta un ampio spettro d’azione che comprende sia Gram+ che Gram-, includendo aerobi ed
anaerobi.
In commercio sono disponibili diverse formulazioni per somministrazione orale ed endovenosa: compresse orali da 250mg e da 500mg, granulato per soluzione orale da 125 mg/5ml e da 250 mg/5ml e
flaconcini di polvere da 500mg per infusione endovenosa.
Le Statine sono farmaci di uso molto comune indicati per il trattamento delle ipercolesterolomie e per
la prevenzione della malattia cardiovascolare nei pazienti considerati ad alto rischio. Nello specifico,
tali molecole inibiscono la sintesi endogena del colesterolo agendo sull’enzima idrossimetilglutarilCoA reduttasi, responsabile della conversione della 3-idrossi-3-metilglutaril-CoA in acido mevalonico,
precursore del colesterolo.
La claritromicina è sia substrato che potente inibitore del CYP3A4, ovvero un isoenzima del CYP450
che contribuisce al metabolismo di circa il 50% dei farmaci utilizzati: la co-somministrazione della claritromicina con un farmaco substrato di tale isoenzima può determinare un aumento delle concentrazioni plasmatiche di quest’ultimo e di conseguenza un aumento del rischio di effetti collaterali.
INTERAZIONE
La simvastatina, l’atorvastatina e la lovastatina sono ampiamente metabolizzate dal CYP3A4 e la loro
co-somminsitrazione con la claritromicina è in genere controindicata in quanto associata ad un elevato rischio di miopatia e rabdomiolisi, effetti collaterali di classe delle statine.
Tale controindicazione è riportata nel Riassunto delle caratteristiche del prodotto (RCP) di tali medicinali ed è riportata anche nella banca dati Micromedex.
Tale studio ha però rilevato un aumento, se pur modesto, del rischio di ospedalizzazione e decesso
nella popolazione anziana in cui vi è co-somministrazione di claritromicina con una statine non metabolizzate dal CYP3A4 (rosuvastatina, pravastina o fluvastatina).
Nel loro articolo, i ricercatori spiegano tale interazione con l’inibizione da parte del macrolide dei polipeptidiorganici trasportatori di anioni specifici del fegato (OATP1B1 e OATP1B3), responsabili del
trasporto transmembrana di anioni, ma anche di diverse molecole farmacologiche tra cui anche le
statine.
Segue
1
Li DQ, Kim R, McArthur E, et al. - Risk of adverse events among older adults following co-prescription of clarithromycin and statins not metabolized by cytochrome P450 3A4 - CMAJ 10.1503/cmaj.140950
P
9
IN VIGILO...
Nel caso di somministrazione di claritromicina con una statina metabolizzata dal CYP3A4
(simvastatina, atorvastatina o lovastatina):
• La co-somministrazione è controindicata.
• Il trattamento con claritromicina dovrebbe essere evitato e presa in considerazione la sostituzione con azitromicina o altro antibiotico alternativo.
• Se il trattamento con claritromicina risulta necessario, la terapia con la statina deve essere so•
COSA FARE?
•
spesa durante il trattamento con l’antibiotico.
Nelle situazioni in cui l’uso concomitante di claritromicina e la statine non può essere evitato, si
raccomanda di prescrivere la dose più bassa registrata della statina oppure valutare la possibilità di sostituire quest’ultima con una statina non metabolizzata dal CYP3A4 (es. fluvastatina,
pravastatina o rosuvastatina).
Nel caso di co-somministrazione monitorare segni e sintomi di miopatia o insufficienza renale.
Nel caso di co-somministrazione di claritromicina con statina non metabolizzata dal CYP3A4
(rosuvastatina, pravastatina o fluvastatina)
• In genere la prescrizione concomitante della clatritromicina con una statina non metabolizzata
•
•
dal CYP3A4 è raccomandata.
Tale studio ha però messo in evidenza un modesto, ma statisticamente significativo, aumento
del rischio di eventi avversi nel caso di co-somministrazione con claritromicina e statine non
metabolizzate dal CYP3A4.
Nel caso di necessità di somministrazione di una terapia antibiotica in paziente anziano in terapia con una statina non metabolizzata dal CYP3A4, preferire azitromicina, macrolide che
non inibisce il CYP3A4 e i trasportatori OATP1B1 e OATP1B3, o altro antibiotico rispetto alla
claritromicina.
Nella situazione in cui l’uso concomitante non può essere evitato monitorare attentamente segni e sintomi di miopatia o insufficienza renale.
P
10
IN VIGILO...
Farmacovigilanza
Andamento dell’attività di segnalazione delle ADR
nell’anno 2014
Nel corso dell’anno appena conclusosi sono state ricevute in Farmacia 152 segnalazioni di sospetta ADR. Di
queste 151 sono state inserite nella Rete Nazionale di Farmacovigilanza (RNF) mentre 1, riferita ad un radiofarmaco per uso diagnostico (Technescan®) privo di AIC, è stata inoltrata direttamente alla ditta produttrice e ad AIFA come previsto dalla normativa vigente.
Tale dato risulta essere leggermente in diminuzione rispetto all’anno precedente nel corso del quale sono state
inviate 157 schede di segnalazioni (-3%).
Il 67% delle segnalazioni sono state effettuate da medici ospedalieri o specialisti (-9% rispetto al 2013) seguiti,
per numerosità, dal personale infermieristico con il 20% (-30% rispetto al 2013).
La restante parte delle segnalazioni si possono suddividere nel seguente modo:
• 8% (13 ADR) biologo nell’ambito del progetto regionale FARMAREL presso l’U.O. di Oncologia,
• 2% (3 ADR) farmacista,
• 1% (1 ADR) Centro Antiveleni di Milano nell’ambito del progetto di farmacovigilanza multiregionale dedicato,
• 2% (3 ADR) Azienda Farmaceutica a seguito di colloquio con personale medico della nostra A.O..
UU.OO.
N.
160
Oncologia
47
140
Radiologia Varese e
Luino
24
Ginecologia A/B
Malattie Infettive
Reumatologia
Pronto Soccorso
Medicina II
Medicina I
Pneumologia
Cardiologia II
Ematologia
Farmacia
Pronto Soccorso Luino
Dermatologia
Geriatria
Ginecologia Cittiglio
Day surgery Varese
Medicina Luino
Medicina Nucleare
Neurologia
Neuroradiologia
Oncologia Cittiglio
Pediatria Cittiglio
Psichiatria
22
6
6
5
4
4
4
3
3
3
3
2
2
2
1
1
1
1
1
1
1
1
180
135
152
157
152
120
108
100
80
80
60
40
20
38
19
0
2007
2008n.segnalazioni/anno
2009
2010 (2007-2014)
2011
2012
Fig.1 - Distribuzione
Fig.1 - Distribuzione n. segnalazioni/anno (2007-2014)
2013
2014
Fig.2 - Distribuzione segnalazioni per fonte anno 2014
Segue
P
11
IN VIGILO...
Analisi per sesso ed età
Le ADR hanno coinvolto nel 62% dei casi donne e nel 38% uomini; mentre la distribuzione del numero delle segnalazioni in base all’età del paziente è di seguito definita:
• tra 0 e 19 anni: 2% (3);
• tra 20 e 40 anni: 10% (15);
• tra 41 e 65 anni: 43,4% (66);
• tra 66 e 79 anni: 35,5% (54);
• ≥ 80 anni: 9% (14).
Gravità
Le segnalazioni di ADR gravi sono state il 37% del totale
(57 segnalazioni).
Il dato risulta essere sovrapponibile rispetto all’anno precedente e superiore al valore fissato dall’OMS come gold
standard utilizzato per definire la qualità dell’attività di segnalazione spontanea.
Le 57 schede di ADR gravi possono essere così suddivise:
• Altra condizione clinicamente rilevante: 38% (22)
• Ospedalizzazione o prolungamento osp.: 33% (19)
• Pericolo di vita: 27% (15)
• Invalidità grave o permanente: 2% (1)
Fig.3 - Distribuzione % per gravità anno 2014
Analizzando l’esito delle ADR gravi si può osservare che nella maggior parte dei casi c’è stata un’evoluzione
positiva dell’evento: in 35 casi (61%) l’esito è stato la risoluzione completa della reazione entro pochi giorni
dall’insorgenza e in 13 casi (22,8%) il miglioramento del quadro clinico del paziente. Per la restante parte delle
ADR gravi l’esito è stato:
• paziente non ancora guarito: 7% (4);
• non disponibile: 5,2% (3);
• risoluzione con postumi: 4% (2).
Si ricorda che la non disponibilità dell’esito della ADR rappresenta un bias per la qualità del dato inserito in quanto rende difficile la definizione del nesso di causalità da parte del Centro Regionale di Farmacovigilanza.
Farmaci sospetti
Analizzando la distribuzione delle ADR per categorie terapeutiche (ATC) dei farmaci sospetti si osserva che la
classe maggiormente segnalata è quella degli antineoplastici e immunomodulatori (ATC L) che rappresenta il
55%, di questi il 15% è riferito a farmaci immunosoppressori e anticorpi monoclonali prescritti nell’ambito di patologie croniche diverse da quella onco-ematologica. A seguire, per numero di segnalazioni, i mezzi di contrasto
(compresi nella categoria ATC V) con il 16% e i farmaci antinfettivi generali per uso sistemico (ATC J) che raccolgono il 11% delle segnalazioni.
Fig.4 - Distribuzione % per ATC anno 2014
P
12
IN VIGILO...
COME SEGNALARE UNA ADR?
Reazione Avversa
Download della scheda dall’area farmacia
della rete aziendale
Segnalatore
Scheda di segnalazione
Invio della scheda compilata in Farmacia tramite FAX (0332-393631) o mail
([email protected])
Il farmacista contatta il segnalatore telefonicamente o attraverso mail aziendale per le informazioni mancanti.
Farmacia
Valutazione della corretta compilazione
NO
SI
Dopo l’inserimento in RNF, si invierà una notifica
al segnalatore attraverso posta elettronica
(all’indirizzo e-mail aziendale o altro se specificatamente richiesto).
NB: La segnalazione di sospetta reazione avversa a farmaco non va inserita all’interno della cartella clinica, ma in essa vanno registrate le reazioni rilevate e i provvedimenti adottati.
Inserimento in RNF
P
13
IN VIGILO...
S.C. Farmacia:
Dr.ssa Anna Malesci
Dr.ssa Raffaella Cavi
Dr.ssa Liliana Ciannarella
Dr Dario Galli
Dr Giorgio Perriccioli
Dr.ssa Laura Sereni
Dr.ssa Valeria Valentini
Dr.ssa Paola Polesel
Dr.ssa Laura Potenza
Dr.ssa Maria Scattareggia
Hanno collaborato:
Servizio Risk Managment :
Dr Enrico Malinverno
Servizio Trasfusionale:
Dr Davide Rossi
Dr.ssa Claudia Rinaldini
Contatti:
Referenti Farmacovigilanza:
Dr.ssa Anna Malesci
Dr.ssa Liliana Ciannarella
Dr.ssa Laura Potenza
Dr.ssa Maria Scattareggia
E-mail:
[email protected]
Telefono:
3566, 3055, 2521