A05
20
Elementi di enzimologia
Guida allo studio
a cura di
Salvatore Passarella
ARACNE
Copyright © MMVII
ARACNE editrice S.r.l.
www.aracneeditrice.it
[email protected]
via Raffaele Garofalo, 133 A/B
00173 Roma
(06) 93781065
ISBN
978–88–548–1005–1
I diritti di traduzione, di memorizzazione elettronica,
di riproduzione e di adattamento anche parziale,
con qualsiasi mezzo, sono riservati per tutti i Paesi.
Non sono assolutamente consentite le fotocopie
senza il permesso scritto dell’Editore.
I edizione: febbraio 2007
5
INDICE
INDICE....................................................................................................5
PREFAZIONE ...........................................................................................9
PARTE 1 .............................................................................................11
1. ENZIMI: CENNI GENERALI .................................................................13
2. CINETICA ENZIMATICA .....................................................................25
3. CARATTERIZZAZIONE DI UNA REAZIONE ENZIMATICA ......................35
Dipendenza della velocità di una reazione enzimatica dalla
concentrazione di substrato.............................................................36
Dipendenza della velocità di una reazione enzimatica dalla
concentrazione di enzima................................................................37
Dipendenza della velocità di una reazione enzimatica dal pH........38
Dipendenza della velocità di una reazione enzimatica dalla
temperatura......................................................................................39
4. INIBIZIONE ENZIMATICA ...................................................................43
Inibizione competitiva.....................................................................43
Inibizione non competitiva..............................................................48
Inibizione acompetitiva...................................................................51
PARTE 2 .............................................................................................55
5. RICERCA IN BANCA DATI E RICERCA DI SIMILARITÀ DI SEQUENZA ....57
Ricerca in banca dati .......................................................................58
Ricerca di similarità di sequenza ....................................................63
PARTE 3 .............................................................................................71
6. INDIVIDUAZIONE ED ISOLAMENTO DEL SISTEMA BIOLOGICO ............73
Il mitocondrio in sintesi ..................................................................73
Struttura .........................................................................................73
Funzione .........................................................................................74
Isolamento dei mitocondri ..............................................................76
Cenni storici ...................................................................................76
Principi generali ............................................................................77
Particolari accorgimenti ................................................................78
Isolamento e purificazione dei mitocondri da tubero di patata
(PTM)..............................................................................................79
Materiale utilizzato per l’estrazione dei mitocondri......................79
Caratteristiche dei media ...............................................................80
6
Preparazione del gradiente ........................................................... 81
Procedura di isolamento................................................................ 82
PARTE 4............................................................................................. 85
7. DOSAGGI ENZIMATICI ...................................................................... 87
Trasmittanza e assorbanza .............................................................. 87
Utilità delle misure di assorbanza ................................................. 88
Applicazioni qualitative delle misure di assorbanza: spettro di
assorbanza ..................................................................................... 89
Applicazioni quantitative delle misure di assorbanza ................... 91
Limiti di applicabilità della legge di Lambert-Beer ...................... 93
Fluorescenza: principi generali e applicazioni ............................... 93
Dosaggi enzimatici ......................................................................... 96
Scelta della tecnica di dosaggio .................................................... 96
Metodi di dosaggio diretti ed indiretti........................................... 97
Dosaggio di substrato ..................................................................... 97
Dosaggio del piruvato ................................................................... 97
Dosaggio dell’aspartato .............................................................. 100
Dosaggio dell’ATP ...................................................................... 101
Dosaggio dell’ADP...................................................................... 101
Dosaggio di attività enzimatica .................................................... 102
Misure cinetiche mediante spettrofotometria .............................. 103
Scelta delle concentrazioni di substrato saturanti....................... 104
Criteri da seguire nel dosaggio dell’attività enzimatica ............. 104
Dosaggio della LDH.................................................................... 105
Dosaggio della AAT..................................................................... 107
PARTE 5........................................................................................... 109
8. ELETTROFORESI ............................................................................. 111
Principi generali............................................................................ 111
Supporto....................................................................................... 114
Caratteristiche del gel ................................................................. 116
Tampone....................................................................................... 117
Campione ..................................................................................... 117
Concentrazione del tampone ....................................................... 117
Applicazioni analitiche ................................................................ 118
Elettroforesi su gel di poliacrilammide con sodio dodecilsolfato
(SDS-PAGE) ................................................................................ 118
9. WESTERN BLOTTING ...................................................................... 125
Immunoblotting ............................................................................ 128
7
Elettroforesi (procedura sperimentale)..........................................130
Uso e montaggio dell’apparato elettroforetico Mini Protean
(Biorad) ........................................................................................134
Preparazione del gel ....................................................................138
Assemblaggio dell’unità elettroforetica .......................................140
Preparazione dei campioni ..........................................................141
Trasferimento ................................................................................143
Materiale occorrente....................................................................143
Immunoblotting.............................................................................151
Materiale occorrente....................................................................151
Sviluppo della lastra.....................................................................154
Stripping .......................................................................................155
PREFAZIONE
Questo libro non sostituisce le lunghe ed esaurienti trattazioni di tanti eccellenti testi di
Biochimica, ma le integra in una forma adatta alla preparazione e alla mentalità degli studenti italiani.
Queste pagine hanno la funzione di offrire informazioni e, cosa più utile, formazione
agli studenti attenti e determinati: attenti a cogliere parola per parola il significato di
quanto scritto e determinati a sostituire allo studio superficiale, cui sono sfortunatamente abituati, con qualche eccezione, studio critico che non lasci spazio ad interrogativi irrisolti.
Definiti il punto di partenza e quello di arrivo, ogni processo di apprendimento si avvale di logiche semplici e rigorose alle quali non si deve contrapporre da parte dello
studente, un modo di studiare individuale, talvolta superficiale per pigrizia o scarso
zelo, talvolta faticoso per eccesso di approfondimento, spesso inutile.
Si tenga presente che quanto si legge in corsivo con caratteri ridotti è stato scritto immaginando quale possa o debba essere la riflessione di chi legge ed elabora, alla luce
della sua preparazione, quanto appena letto. Lo studio può essere anche interrotto da
un sorriso o da riflessioni; in quest’ottica si accettino osservazioni e stile “non tradizionali” e le massime e le citazioni distribuite qua e là.
Roberto Pizzuto* ha raccolto i testi elaborandoli in maniera coerente allo spirito del
libro; con Gianluca Paventi ha organizzato secondo le istruzioni dell’editore tutto il
materiale trattato e preparato grafici e tracce sperimentali. Gianluca Paventi, Lidia de
Bari* e Gabriella Chieppa hanno scritto parti specifiche del libro. Ringraziamo Anna
Atlante e Daniela Valenti, alla quale si deve la stesura di una prima bozza di parte
di questo libretto, per la lettura critica del testo e per alcuni utili consigli.
Giuliana Fasolino ha contributo all’esecuzione di esperimenti riportati nel testo e ha
dato primo riscontro alle bozze preliminari, consentendone graduali modifiche.
Campobasso, gennaio 2007
S.P.
*
Roberto Pizzuto e Lidia de Bari sono stati supportati finanziariamente dal Progetto INTERREG III
TIORCAS.
PARTE 1
C’è una verità elementare, la cui ignoranza uccide innumerevoli idee e splendidi piani: nel momento in cui uno si impegna a fondo,
anche la provvidenza allora si muove.
Infinite cose accadono per aiutarlo, cose che altrimenti mai sarebbero avvenute…
Qualunque cosa tu possa fare, o sognare di poter fare,
INCOMINCIALA.
L’audacia ha in sé genio, potere e magia.
Johann Wolfgang Goethe
Enzimi: cenni generali
1. ENZIMI: CENNI GENERALI
Fa conto che quanto è scritto in corsivo è scritto dal tuo “enzima guida” che ti aiuterà nello studio.
Sii obbediente, paziente, evita che tu possa essere compreso tra gli studenti definibili con l’acronimo (parola formata con una o più lettere iniziali di altre) C.P.P.P.sV.
C ciucci (persone ignoranti)
P presuntuosi (che si credono più di quanto non siano, che ritengono di saperne più
degli altri)
P permalosi (che si risentono per cose futili)
P pretenziosi (che coltivano un’alta opinione di sé e pretendono di avere riconoscimenti che in realtà non meritano)
sV senza vergogna (che non hanno il senso di mortificazione che si prova per un
comportamento proprio o altrui, sentito come sconveniente, scorretto o comunque
riprovevole).
Devo sempre tenere presente il mio programma di studio e quindi cercare con molta
attenzione di dare priorità alle ”cose” essenziali e non a quelle che sono più gradite, forse perché a me congeniali. E’ vero che è difficile sapere a priori che cosa sia
prioritario, ma a questo deve pensare chi insegna; devo comunque fare un’attenta
analisi personale. Anche se può essere elegante sapere certi argomenti, ci sono cose
sicuramente più importanti e …difficili.
BISOGNA SAPER SCEGLIERE!
Gli enzimi sono biocatalizzatori, ossia specie chimiche presenti nella
materia vivente che determinano aumento della velocità della reazione
cui partecipano, rimanendo inalterati al termine della stessa. Tutti gli
enzimi sono proteine (fanno eccezione un piccolo gruppo di molecole
di RNA ad attività catalitica).
Attenzione! Cominciano le definizioni: devo sapere e non dimenticare mai che presupposto indispensabile della conoscenza è la capacità di identificare in modo corretto l’oggetto di cui si discute. Dunque, procediamo con ordine avvalendoci, se necessario di un comune vocabolario.
Che cosa vuol dire bio? È una radice di origine greca che sta per “vita”. Ogni volta
che avrò trovato bio, dovrò tener presente che c’è di mezzo la vita. (In italiano circa
500 parole iniziano con bio!)
So (dovrei sapere!) dalla chimica (?) che cosa è un catalizzatore (un composto che
accelera la velocità di una reazione, e che rimane immutato quando la reazione ha
avuto termine).
13
Capitolo I
14
Prima di continuare è opportuno chiarire che cosa è la velocità di reazione.
Ricordo che cosa è la velocità di reazione e come una reazione avviene? Se sì, bene;
se no, devo provvedere.
In questo come in altri casi c’è però un problema di non trascurabile importanza:
come faccio a sapere che non so? Non è certo conveniente apprenderlo tardi in sede di esame. Devo dunque disporre di criteri certi e facili che mi tranquillizzino sul
fatto di sapere quello che devo sapere. (Non ti agitare per questo che sembra un
diabolico gioco di parole!).
Se so che cosa è la velocità di reazione devo sicuramente conoscere le “dimensioni”
nelle quali la velocità si misura, … forse in Km/h, m/s o che altro!
Anche se la tentazione di abbandonare questo corsivo è forte, DEVI RESISTERE e
procedere con la stessa determinazione con cui, con costante pervicacia, ti adoperi
per ottenere quello che desideri.
Se non sai, abbandona queste righe e vai a recuperare il sapere di quei crediti che
fortuitamente (e senza profitto per te) hai già acquisito (in alternativa continua comunque a leggere fiducioso/a).
Considerata la semplice reazione:
S
P
dove S e P sono rispettivamente il substrato e il prodotto della reazione, la velocità della reazione ad un tempo t è definita come
v
d[S ]
dt
d [ P]
dt
con ovvio significato dei simboli.
La velocità di una reazione ad un certo tempo si ottiene come tangente
alla curva che riporta in ordinata [P] ed in ascissa il tempo t di reazione. Ugualmente si può misurare la velocità come tangente alla curva
che riporta in ordinata [S] ed in ascissa il tempo t di reazione (Fig. 1).
Nota che, il segno negativo deriva dal fatto che nel tempo [S] diminuisce, ma la velocità deve essere positiva.
Enzimi: cenni generali
[C] (mM)
1,2
[P]
1,0
0,8
15
Figura 1. Dipendenza della concentrazione di substrati e prodotti di una reazione in funzione
del tempo di reazione.
0,6
0,4
0,2
0
[S]
0
4
8
12
16 20 24
28
tempo (sec)
Mi devo chiedere che cosa significa quella d che precede il termine di concentrazione con al denominatore dt. È un simbolo che indica la seguente operazione: data
una grandezza misurabile riportata sull’asse delle y che varia in funzione del tempo,
riportato in ascisse, sottrarre da un valore di y scelto ad un tempo t il valore della
stessa y ad un tempo appena inferiore.
Ti ricordi la derivata? No?! ...torna sui banchi delle scuole superiori o dei primi
corsi universitari!
Alla luce del principio di Le Chatelier Brown (vedi di seguito), è ovvio che nel tempo il valore della tangente (la pendenza), ad ogni tempo delle curve di Fig. 1 di cui sopra, tende a diminuire. Quando una
reazione è terminata, la sua velocità è zero, la tangente alla curva diventa una parallela all’asse delle ascisse, come ovvio se la concentrazione del prodotto è costante nel tempo e quindi d[P] e d[S] sono uguali a 0.
E al termine di una reazione qual è la concentrazione del substrato?
La risposta corretta è “quella prevista dalle condizioni di equilibrio”.
Se la reazione è tutta spostata a destra, la [S] sarà prossima a 0. In caso opposto se la reazione è spostata a sinistra, si avrà [S] maggiore di
[P] e addirittura [P] potrebbe essere minima.
Sì, però tu non farai il chimico teorico, dovrai essere in grado di misurare effettivamente la velocità della reazione… e allora? Ragiona: alla luce di quanto appena
detto, devi essere in grado di misurare a tempi definiti la concentrazione di un composto, non importa che sia substrato o prodotto di una reazione.
16
Capitolo I
Se esiste una relazione matematica tra un parametro misurabile con strumenti a
disposizione e la concentrazione, allora misurare la concentrazione si tradurrà nel
misurare questo parametro e nel fare poi qualche semplice calcolo matematico.
Dire che questo corsivo è incomprensibile, è opinabile: forse devi dire “per la mia
scarsa, superficiale ed incompleta conoscenza di nozioni che avrei dovuto avere –
non si spiegherebbe in caso contrario come mai io mi sia “maturato” o abbia superato l’esame di...- non sono in grado di elaborare semplici e sintetiche frasi. Forse
nell’interesse mio e della mia famiglia, che spesso inganno attribuendo alla responsabilità dei docenti ed al mondo cinico e baro i miei insuccessi nello studio, sarà il
caso di cambiare registro. Absit iniuria verbis! (Che altro adesso! penserai, tradotto
letteralmente “dalle parole sia assente ingiuria”).
La relazione più conveniente tra il parametro, chiamiamolo y, e la
concentrazione è quella lineare del tipo y = m · [S] o y = m · [P], nella
quale m è una costante. Dunque, conosciuta la costante, e misurata la
y, si può determinare [S] o [P]. Analogamente la velocità della reazione sarà ottenuta studiando come varia y in funzione del tempo.
Intuirai che y sarà un parametro misurabile in molte maniere, come avrai imparato
studiando le basi di chimica generale ed analitica o come potrai approfondire in
seguito.
Ricorda che la derivata del prodotto di una costante (m) per una variabile (A) è m · la derivata di A. Se [P] = m · A, allora d[P] = m · dA.
Quindi misurando come varia A nel tempo si può ottenere il valore
della velocità: la derivata è ottenibile come la tangente in ciascun punto della curva di un grafico nel quale in ordinata si riporta la grandezza
al “numeratore” (A) e in ascissa quella al “denominatore” (t).
Un’ulteriore sintetica semplificazione: considerato un grafico in cui si
riporta [P] in funzione di t, la velocità della reazione si ottiene dal rapporto tra i cateti y e x di un triangolo rettangolo qualsiasi di cui la tangente alla curva al tempo t sia l’ipotenusa. Ovviamente y sarà espresso
in termini di concentrazione e x in termini di tempo.
Gli enzimi sono in grado di causare un aumento della velocità di una
reazione fino a 1016 volte rispetto ai valori di velocità in assenza di
enzima.
Mi chiedo: come un enzima può accelerare la velocità di reazione?
Enzimi: cenni generali
17
Tenendo presente che un enzima è un catalizzatore e conoscendo le proprietà dei
catalizzatori, devo dedurre che un enzima diminuisce l’energia di attivazione (della
quale conosco definizione e significato!).
L’equilibrio della reazione catalizzata dall’enzima non è alterato, ciò
equivale ad affermare che il catalizzatore non influisce sul valore della
costante di equilibrio della reazione considerata, cosa ovvia del resto,
se si pensa che esso non è un elemento che “gioca nella sua stechiometria”.
ATTENZIONE rifletti con calma e fa che questo concetto ti sia chiaro. Ti chiedi che
cosa sia l’equilibrio: “stato di un sistema nel quale non intervengono cambiamenti
se non a causa di perturbazioni esterne” o “stato di un sistema in cui i processi che
intervengono non modificano l’assetto complessivo”, da queste definizioni devi dedurre che quando il sistema biologico è in equilibrio le concentrazioni dei substrati
e dei prodotti sono costanti (attenzione!!!! COSTANTI… NON UGUALI). Se però
intervengono situazioni in cui un substrato deve essere utilizzato o sintetizzato con
velocità maggiore o minore, che cosa succede?
A questa domanda c’è una risposta generale che si basa sul principio dell’equilibrio
mobile di Le Chatelier Brown. Questo Principio sia per te il primo da considerare
in ogni analisi biochimica, biologica, patologica etc. “ogni sistema all’equilibrio,
sottoposto a variazione si oppone ad essa”. Questo principio si può estendere anche
al di là di una semplice reazione, per cui se uno sforzo muscolare avrà richiesto un
consumo di ATP (molecola ad alto livello energetico) con velocità maggiore di quella di sintesi in quel momento, la cellula muscolare risponderà “opponendosi” cioè
aumentando la velocità di sintesi di ATP; questo deriverà dalla attivazione di tutti i
processi che sono coinvolti nella sintesi di ATP. Se dopo lo sforzo riposiamo, la velocità di sintesi di ATP dovrà diminuire, essendo stata ridotta la richiesta. Il sistema
si oppone e quindi rallenta la velocità di sintesi di ATP e di tutti quei processi che
sono coinvolti nella sintesi di ATP. Se mangiassimo a riposo carboidrati, per esempio biscotti, il sistema si opporrebbe ad un aumento di glucosio etc. nel sangue facendo accumulare sostanze di riserva derivanti dal glucosio.
Non ti sembri inutile ripetere le stesse parole e gli stessi concetti. REPETITA IUVANT!
Le reazioni biologiche non potrebbero avvenire, in assenza di enzimi,
in tempi compatibili con la vita.
La specificità e la possibilità di essere sottoposti a regolazione sono
due proprietà che caratterizzano gli enzimi.
La specificità dell’enzima riguarda sia le molecole con cui interagisce,
vale a dire specificità nei confronti del/i substrato/i, sia la reazione catalizzata, ossia specificità di azione. La stretta interazione tra un enzi-
18
Capitolo I
ma ed i suoi substrati avviene attraverso un “riconoscimento” molecolare basato sulla complementarietà strutturale tra il/i substrato/i ed uno
o più domini proteici dell’enzima.
Infine, la regolazione dell’attività enzimatica è realizzata in cellula in
modi diversi, che vanno dal controllo, mediato da diversi segnali cellulari (come gli ormoni), della quantità di proteina enzimatica presente
(dipendente dall’equilibrio dinamico tra processi di sintesi e degradazione della proteina) ad una modulazione più rapida dell’attività
dell’enzima mediante interazioni reversibili con inibitori e attivatori
metabolici.
La maggior parte degli enzimi necessita, per svolgere la propria funzione catalitica, di componenti di natura non proteica, chiamati cofattori, che possono essere ioni metallici o molecole organiche note come
coenzimi e gruppi prostetici. I coenzimi e i gruppi prostetici sono per
lo più derivati da vitamine. Alcuni coenzimi si legano reversibilmente
all’enzima nel corso della reazione (come ad esempio i coenzimi piridinici), altri possono essere stabilmente legati (a volte anche covalentemente) all’enzima e sono definiti gruppi prostetici dell’enzima; in
entrambi i casi agiscono da trasportatori di gruppi funzionali.
Sapresti fare un esempio di coenzima piridinico? Ricorda: una buona conoscenza
della chimica organica costituisce un fondamento imprescindibile della tua preparazione e, aspetto non trascurabile, ti renderà più agevole la comprensione dei processi che studierai in futuro in questa, come in altre materie.
Il complesso cataliticamente attivo costituito dalla proteina e dal suo
gruppo prostetico è detto oloenzima. La proteina priva di gruppo prostetico si chiama apoenzima ed è cataliticamente inattiva.
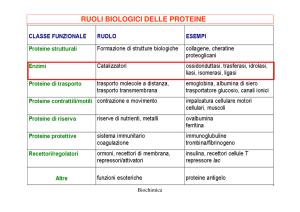
Gli enzimi sono denominati e classificati secondo le reazioni che catalizzano.
La maggior parte degli enzimi è denominata aggiungendo il suffisso
“asi” al nome di uno dei substrati delle reazioni che catalizzano o a
quello del tipo di reazione catalizzata. Il Comitato dell’Unione Internazionale di Biochimica ha pubblicato uno schema per la classificazione, che assegna a ciascun enzima una serie di numeri e li raggruppa
in sei classi principali secondo la reazione chimica che essi catalizzano:
Enzimi: cenni generali
19
1. ossidoreduttasi - catalizzano reazioni di ossido-riduzione. Per
lo più sono note come deidrogenasi, ossigenasi o reduttasi,
perossidasi, ossidasi;
2. transferasi - catalizzano reazioni di trasferimento di gruppi
funzionali. Molte richiedono la presenza di coenzimi. Esempi
sono le transchetolasi, transaldolasi, transaminasi;
3. idrolasi - catalizzano reazioni di idrolisi. Possono considerarsi
come una classe particolare di transferasi nelle quali l’H2O
funziona da accettore del gruppo trasferito;
4. liasi - catalizzano reazioni di eliminazione non idrolitiche e
non ossidative dette di lisi di un substrato. In senso opposto catalizzano l’addizione di un substrato a un doppio legame di un
secondo substrato;
5. isomerasi - catalizzano reazioni di isomerizzazione. Esempi
sono le racemasi, epimerasi, cis-trans isomerasi;
6. ligasi - catalizzano l’unione di due substrati in reazioni di sintesi, che richiedono l’energia potenziale chimica di un nucleotide trifosfato, quale l’ATP. Sono anche dette sintetasi.
Ti renderai conto che non è necessario memorizzare, tuttavia “memoria minuitur
nisi exerceas” (la memoria diminuisce se non la eserciti!).
All’interno di ciascuna classe sono individuate sottoclassi e poi, ancora all’interno delle sottoclassi si distinguono sotto-sottoclassi in cui
sono elencati i singoli enzimi. Classi, sottoclassi, sotto-sottoclassi e
singole registrazioni sono tutte numerate in modo che una serie di
quattro numeri possa identificare ogni enzima. Si usa far precedere la
serie dei quattro numeri identificativi di ciascun enzima dalle lettere
E.C., iniziali di ”Enzyme Commission”.
Lo studio degli enzimi può essere realizzato in vivo, con l’enzima nel
proprio ambiente subcellulare, cellulare o di tessuto, o in vitro, per esempio con l’enzima isolato. In entrambi i casi è opportuno operare in
condizioni quanto più vicine possibili a quelle fisiologiche.
L’esistenza degli organismi viventi è resa materialmente possibile da
una numerosa serie di reazioni che hanno lo scopo di rinnovare continuamente i componenti cellulari e di fornire l’energia necessaria a
queste e a tutte le altre funzioni attraverso le quali la vita si manifesta.
A tal fine, gli alimenti sono trasformati in pochi composti semplici:
20
Capitolo I
parte di questi e di quelli derivanti dalla degradazione endogena, è
metabolizzata, in modo da produrre l’energia indispensabile per la sintesi dei costituenti cellulari e per il corretto svolgimento delle funzioni
delle cellule.
La funzionalità cellulare richiede l’equilibrio tra tutti i processi degradativi e tutti i processi di sintesi, indipendentemente dalla loro
complessità e dalle situazioni nelle quali i primi possono produrre più
di quanto richiesto dai secondi o viceversa. Questo equilibrio può essere raggiunto soltanto se esiste la possibilità di regolare adeguatamente le velocità dei processi metabolici in funzione delle specifiche
esigenze dell’organismo.
Forse è meglio rileggere e riflettere.
Sono ormai noti molteplici meccanismi attraverso i quali, verosimilmente, le cellule degli organismi viventi possono controllare i flussi
metabolici in situazioni anche molto differenti. Se ne riportano di seguito una serie.
1. Regolazione della concentrazione enzimatica.
Tutto il materiale proteico degli organismi viventi è continuamente
sintetizzato e degradato, anche se con velocità notevolmente diverse:
la concentrazione di ciascuna proteina, funzione delle sue velocità istantanee di sintesi e di degradazione, può quindi variare nel tempo.
Questo è uno dei molteplici meccanismi alla base della regolazione
dell’attività degli enzimi.
La regolazione della concentrazione del materiale proteico è molto
complessa e ancora largamente indefinita.
2. Variazioni delle proprietà degli enzimi.
Il controllo dell’attività di un enzima è realizzabile anche attraverso
variazioni delle sue proprietà. Le variazioni possono essere intrinseche, com’è per le forme isoenzimatiche (i), o conseguenti a:
- interazioni con (macro)molecole genericamente definite effettori (ii).
- interazioni con altre proteine o materiale biologico (iii).
- modificazioni covalenti, irreversibili o reversibili (iv).
Enzimi: cenni generali
21
(i) Isoenzimi.
Sono enzimi che hanno in comune solo la proprietà di catalizzare la
stessa reazione.
Gli isoenzimi possono avere differente localizzazione cellulare, di tessuto o di organo e diversa affinità per i substrati (vedi in seguito).
(ii) Variazioni indotte da effettori.
In biochimica un effettore è una sostanza che influenza la velocità di
una reazione enzimatica. Gli effettori si dividono in inibitori, i quali
manifestano la loro azione diminuendo la velocità di reazione a loro
volta classificati come competitivi, non competitivi e acompetitivi o
misti (vedi pagine successive), e attivatori i quali agiscono aumentando la velocità della reazione.
(iii) Variazioni dei parametri cinetici indotte da altre interazioni.
I parametri cinetici di enzimi isolati risultano spesso differenti quando
i loro valori sono determinati in presenza di particolari proteine o altro
materiale biologico, lasciando presumere una qualche forma di interazione.
(iv) Variazioni indotte da modificazioni covalenti.
Le modificazioni covalenti possono essere irreversibili o reversibili.
Il primo tipo di modificazione è ben esemplificato dall’attivazione dei
precursori di diverse proteine attraverso proteolisi limitata: chimotripsinogeno, tripsinogeno, procarbossipeptidasi, pepsinogeno, proelastasi, profosfolipasi e protrombina sono i casi più noti di proenzimi (zimogeni). Il secondo tipo è dovuto alla fosforilazione ed alla defosforilazione di siti regolatori delle proteine (enzima).
Non ti preoccupare di questo si leggerà in seguito.
3. Controllo di sequenze metaboliche.
Le reazioni che possiedono i requisiti per controllare la velocità di una
via metabolica sono quelle più lente o fisiologicamente lontane
dall’equilibrio.
La velocità di un processo metabolico che è costituito da diverse reazioni è quella della reazione che costituisce lo stadio lento.
Rifletti! In un processo metabolico i prodotti delle reazioni che avvengono prima di
quella responsabile dello stadio lento si accumuleranno nel tempo. In ogni caso tie-
22
Capitolo I
ni presente che le concentrazioni di ogni metabòlita sono quelle che derivano dalla/e velocità di formazione e dalla/e velocità di trasformazione in altri prodotti. Il
termine “dalla/e” suggerisce che un substrato può derivare da diverse reazioni e
dare diversi prodotti.
Di seguito sono riportati due meccanismi di regolazione molto frequenti delle vie metaboliche.
(i) Inibizione retroattiva.
Questa è l’inibizione esercitata dal prodotto finale (x) di una sequenza
metabolica, sulla prima reazione della stessa sequenza metabolica attraverso la quale si realizza la sua sintesi.
L’inibizione retroattiva è un meccanismo di controllo della velocità di
sequenze metaboliche molto diffuso, almeno tra i microrganismi. La
ragione di questa circostanza risiede probabilmente nella semplicità e
nella funzionalità di questo tipo di controllo. Difatti, esso consente di
evitare l’inutile produzione di intermedi di una via metabolica, quando
il prodotto finale si accumula.
Ricorda che la cellula opera alla luce del “PRINCIPIO DI MASSIMA ECONOMIA
DI PARTI E PROCESSI”. È questo un principio fondamentale, che dovrai tenere
sempre a mente, che ti aiuterà nella interpretazione dei processi biologici e nella
previsione di eventi ipotizzabili nel corso dello studio.
Se questa situazione si verifica solo parzialmente, cioè se uno o più
intermedi non fossero completamente inutili o addirittura dovessero
avere altri destini perché la via metabolica è ramificata (vedi punto 4),
l’inibizione retroattiva potrebbe assumere forme molto più raffinate
ma, sempre straordinariamente semplici e funzionali alle specifiche
situazioni.
(ii) Sistemi multienzimatici organizzati.
Gli enzimi che catalizzano le reazioni di una sequenza metabolica sono spesso organizzati in qualche modo tra loro.
Nei mammiferi, ad esempio, tutte le attività enzimatiche richieste per
la sintesi di palmitato da acetil-CoA e malonil-CoA sono localizzate su
una sola proteina, definita perciò multifunzionale.
Le decarbossilazioni ossidative del piruvato e del 2-chetoglutarato
sono catalizzate rispettivamente dai complessi multienzimatici piruva-
Enzimi: cenni generali
23
to deidrogenasi e 2-chetoglutarato deidrogenasi, isolati come aggregati di differenti proteine oligomeriche aventi tutte le attività enzimatiche richieste.
In questi casi, è evidente che le interazioni tra le componenti polipeptidiche sono così forti da resistere alle condizioni usate durante
l’isolamento. In altri casi invece, è probabile che interazioni di questo
tipo siano deboli o comunque, non tali da consentire l’isolamento del
sistema nella forma organizzata in cui è presumibilmente presente nella cellula, a giudicare da altre evidenze che sono necessariamente indirette.
4. Regolazione di vie metaboliche multifunzionali.
È intuitivo che le molteplici funzioni delle vie metaboliche ramificate,
richiedono un tipo di controllo più articolato perché è necessaria una
coordinazione tra le regolazioni delle diverse sequenze dalle quali risulta costituita la via.
Questo argomento, come del resto quelli sintetizzati nei punti 5 e 6, meriterebbe una
più ampia dissertazione che, però, va oltre gli scopi di questo libro.
5. Controllo chemioterapico delle reazioni enzimatiche.
Insieme alle regolazioni fisiologiche del decorso delle reazioni enzimatiche, viene dato un cenno a un tipo di controllo ottenuto mediante
sostanze definite chemioterapici, aventi la funzione di inibire, possibilmente in modo completo e definitivo, i processi indotti negli organismi da cellule estranee.
Il principio fondamentale di questo tipo di controllo è la tossicità selettiva del chemioterapico, che deve inibire un processo vitale per le
cellule ospitate, impedendone la crescita e la riproduzione, senza avere, al limite, alcun effetto sulle cellule dell’organismo ospitante.
6. Analisi del Controllo Metabolico.
Nella parte precedente sono stati descritti i più importanti meccanismi
probabili mezzi di regolazione del metabolismo cellulare. Tuttavia,
come già detto, le nostre conoscenze sulla regolazione metabolica so-
24
Capitolo I
no quasi esclusivamente qualitative perché derivano, per lo più, da risultati ottenuti in vitro, con enzimi isolati o con sistemi ricostituiti.
Purtroppo le proprietà dei sistemi biologici non possono essere completamente dedotte da quelle dei loro componenti o, in altri termini, i
sistemi biologici presentano proprietà ulteriori rispetto a tutte quelle
degli elementi dai quali sono formati.
Da questo dato di fatto, deriva la necessità di indagini su sistemi interi
e, preliminarmente, di una base teorica che consenta di interpretare in
termini quantitativi i risultati ottenuti.
Le proprietà dei sistemi utilizzate per analizzarne il controllo sono i
coefficienti di controllo del flusso, C ji, che descrivono la risposta del
flusso metabolico J alla variazione di un parametro in grado di influenzarlo, come, ad esempio, la capacità catalitica di un enzima.
Per adesso lasciamo perdere!
So comunque di questi coefficienti e, nel caso mi sia utile potrò sempre approfondire.