Chimica Fisica – Biotecnologie sanitarie
Lezione n. 11
Reazioni enzimatiche
Michaelis-Menten
Dipendenza di k da T
Antonino Polimeno
1
senza catalizzatore ...
con catalizzatore ...
Antonino Polimeno
2
Catalisi
Un esempio: decomposizione dell’acqua
ossigenata ad acqua ed ossigeno
La reazione è molto lenta (a T ambiente
non procede in modo apprezzabile);
l’aggiunta di un catalizzatore (ioduro di
potassio), accelera la reazione in modo
drammatico
H2O2(aq) + I-(aq) Æ OI-(aq) + H2O(l)
H2O2(aq) + OI-(aq) Æ H2O(l) + O2(g) + I-(aq)
Antonino Polimeno
3
Enzimi (1)
Gli enzimi sono proteine con strutture tridimensionali (conformazioni)
e caratteristiche chimiche che si esplicano in una attività di catalisi di
specifiche reazioni chimiche.
L’attività catalitica è selettiva, si applica cioè solo ad una particolare
reazione chimica.
Gli enzimi sono molecole di
dimensioni relativamente grandi
rispetto alle molecole coinvolte
nelle reazioni catalizzate, e
presentano
di
solita
una
specifica zona reattiva detta
centro di reazione dove la
reazione chimica catalizzata ha
luogo.
Antonino Polimeno
4
Enzimi (2)
gliossalase I umana
due
ioni Zn sono necessari per
catalizzare
la
reazione
di
detossificazione del metilgliossale
(un
carcinogeno)
prodotto
dall’organismo in modo naturale.
La gliossalase I è alla base di studi
per lo sviluppo di farmaci contro
infezioni da batteri e protozoi (e.g.
contro la tripasonomiasi)
Antonino Polimeno
5
Antonino Polimeno
6
Antonino Polimeno
7
MM (1)
Un esempio di meccanismo di reazione che coinvolge un enzima
viene fornito dal meccaniscmo di Michaelis-Menten
k1
k3
⎯⎯
→ ES ⎯⎯
E + S ←⎯⎯
→P + E
k2
E: enzima
S: substrato
ES: complesso enzima-substrato
P prodotto
Il meccanismo MM ha la forma di un pre-equilibrio di formazione
del complesso substrato-enzima, che poi decade ad enzima e
prodotti.
Antonino Polimeno
8
k BC
k AB
A ⎯⎯→
B ⎯⎯→
C
k BC / k AB = 0.5
d [A]
= − k AB [A]
dt
d [B]
= k AB [A] − k BC [B]
dt
[C] = [A]0 − [A] − [B]
k BC / k AB = 10
Antonino Polimeno
9
MM (2)
La concentrazione approssimata del complesso si ottiene
applicando l’approssimazione dello STATO STAZIONARIO, che
pone circa a zero la velocità di formazione del complesso stesso
d [ES]
= k1[E][S] − k2 [ES] − k3 [ES] ≈ 0
dt
k1[ E ][ S ]
[ ES ] ≈
k 2 + k3
Antonino Polimeno
10
MM (3)
La concentrazione dell’enzima in totale si indica con [E]0; vale
un bilancio di massa:
[E] + [ES] = [E]0
Combinando le due equazioni precedenti si ottiene la
concentrazione del complesso in funzione della concentrazione
del substrato e della concentrazione totale di enzima
k1[E]0 [S]
[ES] =
k2 + k3 + k1[S]
Antonino Polimeno
11
MM (4)
La velocità di formazione del prodotto si scrive quindi come
k3 [S][E]0
d [P]
= k3 [ES] =
= k[E]0
dt
K M + [S]
k3 [S]
k=
K M + [S]
k 2 + k3
KM =
k1
KM viene chiamata costante di Michaelis.
Antonino Polimeno
12
MM (5)
La velocità della reazione di enzimolisi è lineare con la
concentrazione di enzima mentre ha una dipendenza complessa
dalla concentrazione di substrato.
Antonino Polimeno
13
MM (6)
Quando la concentrazione del substrato è grande, la reazione è
di ordine zero rispetto al substrato
[S ] K M →
d [P]
≈ k3 [E]0
dt
Quando la concentrazione del substrato è piccola, la reazione è
di primo ordine rispetto al substrato.
[S ] K M
d [P] k3
[E]0 [S]
→
≈
dt
KM
Antonino Polimeno
14
MM (7)
Misurando la costante di velocità k a varie concentrazioni di
substrato, si possono ottenere informazioni dirette sulle costanti
k3 e KM, impiegando il grafico di Lineweaver-Burk:
1 1 KM 1
= +
k k3 k3 [S]
Equivalente a
KM 1
1
1
=
+
v vmax vmax [S]
La velocità massima di enzimolisi è data da
vmax = k3 [E]0
Antonino Polimeno
15
Antonino Polimeno
16
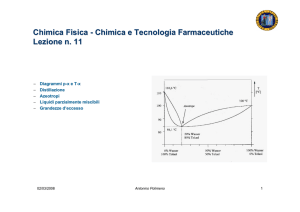
Costanti cinetiche e temperatura
La costante cinetica di una reazione (elementare) dipende dalla
temperatura:
k
→P
A+B ⎯⎯
k = A exp(− Ea / RT )
L’interpretazione della dipendenza dalla temperatura della
costante cinetica di una reazione richiede l’applicazione di
concetti molecolari: la velocità di una reazione dipende dal
contenuto energetico delle molecole reagenti.
Antonino Polimeno
17
Interpretazione molecolare (1)
Una reazione chimica avviene a livello molecolare come
1.
2.
3.
Collisione tra molecole di reagenti
Formazione di un complesso attivato
Trasformazione del complesso attivato nei prodotti
Antonino Polimeno
18
Interpretazione molecolare (2)
Solo se le molecole che si incontrano hanno un’energia
sufficientemente elevata può avvenire la trasformazione del
complesso attivato a prodotti.
Antonino Polimeno
19
Interpretazione molecolare (3)
La coordinata di reazione descrive il “cammino” che le molecole
dei reagenti devono seguire per trasformarsi in prodotti.
L’ energia di attivazione è l’energia necessaria per superare la
barriera che impedisce la formazione dei prodotti.
Antonino Polimeno
20
Esempio
Sostituzione nucleofila SN2
Antonino Polimeno
21
Interpretazione molecolare (4)
L’energia necessaria a superare la barriera tra reagenti e
prodotti deriva dall’energia termica delle molecole che entrano
in collisione.
L’energia termica delle molecole è tanto maggiore quanto
maggiore è la temperatura, favorendo perciò la formazione dei
prodotti.
Antonino Polimeno
22
Interpretazione molecolare (5)
La legge di Arrhenius
descrive la dipendenza dalla
temperatura della costante
cinetica di una reazione
elementare:
k = A exp(− Ea / RT )
Antonino Polimeno
23