Composti Carbossilici
Reattività
Composti carbossilici
O
R C N
O
R'
R'
Ammide
RCONR'2
O
O
O
R C O R'
R C O C R
R C X
Estere
RCOOR'
Anidride
(RCO)2O
Alogenuro acilico
RCOX
• I composti carbossilici hanno la caratteristica
comune di possedere un gruppo carbonilico al quale
è legato un atomo molto elettronegativo.
• Tale struttura comporta la presenza di tre forme
di risonanza che influiscono sulla reattività di tali
composti.
R
R
C
H Y
I
R
O
R
C
H Y
II
+
R
O
R
C
H Y
+
III
O
Reattività
• Gli acidi carbossili ed i loro derivati presentano
tre forme di risonanza che influiscono sulla loro
reattività:
– L’atomo di carbonio carbonilico porta una parziale carica
positiva e può essere attaccato dai nucleofili.
:Nu
R
R
C
H Y
I
R
O
R
+ O
C
H Y
II
R
R
C
+
H Y
III
O
Reattività
• Gli acidi carbossili ed i loro derivati presentano
tre forme di risonanza che influiscono sulla loro
reattività:
– L’ossigeno carbonilico può essere protonato aumentando
la carica positiva sull’atomo di carbonio carbonilico e
quindi la reattività nei confronti dei nucleofili.
R
R
C
H Y
I
R
O
R
H+
+ O
C
H Y
II
R
R
C
+
H Y
III
O
Reattività
• Gli acidi carbossili ed i loro derivati presentano
tre forme di risonanza che influiscono sulla loro
reattività:
– La presenza di due atomi elettronegativi legati all’atomo
di carbonio carbonilico rende acido il protone legato in α.
R
R
C
R
O
R
H Y
I
+ O
C
H Y
:B
II
R
R
C
+
H Y
III
O
Reattività
• La reattività iniziale di tali composti è quindi del
tutto analoga a quella dei composti carbonilici
semplici.
• La presenza dell’atomo elettronegativo legato al
carbonio carbonilico però fa si che l’attacco
iniziale su tali substrati sia seguito da una uscita
dell’atomo elettronegativo, con i suoi elettroni di
legame, cosa che non è possibile nei composti
carbonilici semplici che hanno attaccato al gruppo
carbonilico atomi (C, H) di paragonabile
R
R
elettronegatività.
O
O
R
C
H Y
R
C
H R'
Sostituzione nucleofila acilica
I nucleofili si addizionano quindi al gruppo carbossilico
dei derivati acilici per dare una reazione di
sostituzione (addizione + eliminazione) in quanto Y è
un buon gruppo uscente.
Questo differenzia la loro reattività da quella delle aldeidi e dei
chetoni
O
R C Y
O
R C OH
Composto
Acido
acilico carbossilico
O
R C NR'2
Ammide
O
R C OR'
Estere
O
O
O
R C O C R
Anidride
R C X
Alogenuro acilico
Meccanismo
• La reazione non è una sostituzione diretta in
quanto consiste di due stadi:
stadi
– Il primo è una addizione del nucleofilo all’atomo di
carbonio carbonilico per formare un intermedio
tetraedrico (come nelle aldeidi).
– Il secondo è l’eliminazione del gruppo uscente con il
ripristino del sistema π del gruppo carbonilico.
• Il nucleofilo può reagire come anione o come
reagente neutro
• La reazione è catalizzata dagli acidi che
aumentano la parziale carica positiva sull’atomo di
carbonio
Meccanismo con nucleofili
neutri
*
O
:Nu
H
+
R
X
O
R
O
X
R
Nu
)
O
R
)
Nu H + X
*
H
O
R
Nu
+ HX
)
Nu H + X
*
Proton Transfer
Durante la reazione si hanno dei trasferimenti di protone che possono avvenire
tra atomi diversi, prima, dopo o durante i diversi stadi.
*
O
O
H
R
Y)
Nu + HY
R
Nu
O
:Nu
H
+
R
O
Y
*
O
R
Y
)
Nu H + Y
R
*
Nu
)
H
OH
R
)O
Y
R
H
Nu + Y
*
Nu
Tutti questi stadi sono in equilibrio e sono presenti contemporaneamente in
misura diversa
Meccanismo con nucleofili
anionici (catalisi basica)
* Nu
B + HNu
*
+
R
O
O
O
* Nu
+ BH)
Y
R
R
Y
Nu
*Y
+ BH)
B + HY
Nu +
*Y
Meccanismo con catalisi acida
O
R
OH
OH
Y +
)H
R
)
Y
+ NuH
R
Y
Nu
H
OH
R
OH
Y
Nu
)
R
Nu
H
Y)
H
- YH
) OH
R
Nu
)
O
- )H
R
Nu
Reattività
Ammonolisi
Alcolisi
Idrolisi
Riduzione
Reazioni di Grignard
Reattivit
à degli acidi
Reattività
carbossilici
Reattività
Le reazioni di SNAcilica procedono su tutti i derivati
degli acidi tranne che sugli acidi stessi in quanto in
questo caso il nucleofilo anziché addizionarsi agisce da
base strappando il protone acido.
O
R
O
OH
+
* OH
R
O
+ H2O
Reattività
• L’anione carbossilato che si forma è ricco
di elettroni e tende a respingere i
nucleofili;
• Inoltre su di esso non esiste più un vero e
proprio gruppo carbonilico che può subire
l’attacco del nucleofilo, essendo la carica
negativa delocalizzata.
O
O
R
R
R
O
O
O
*
O
Catalisi acida
La reazione di SN sugli acidi carbossilici si ha
solamente in presenza di catalisi acida in quanto
in questo modo il centro più elettrofilo si sposta
dal protone carbossilico al carbonio carbossilico.
)
O
R
OH
H2SO4
R
OH
OH
OH
Acido
Centro elettrofilo
)
OH
Acido protonato
O
R C O H
R
O
+ )H
H
R C O H
)
Centro elettrofilo
Esterificazione di Fischer
• La reazione di un acido con un alcol (in ambiente
acido) porta alla formazione di un estere + acqua.
• La reazione avviene solo con catalisi acida.
• Tutti gli stadi sono reversibili.
• La reazione procede fino al raggiungimento
dell'equilibrio.
O
O
H+
OH + H O CH CH
2
3
O CH2 CH3
+ H2O
Esterificazione di Fisher
)
O
R
+ H2SO4
OH
R
OH
OH
OH
OH
R )
- HSO4*
+ CH3OH
OH
R
O
H3C ) H
H
O
OH
R
OH
O
H3C ) H
R
H3C
H + HSO4*
O)
H - H2SO4
O
OH
O
+ H2O
R
O
CH3
La rimozione di acqua sposta l'equilibrio verso destra
Formazione di Ammidi
• La reazione degli acidi carbossilici con le ammine
porta alla formazione di ammidi con un meccanismo
che non è una sostituzione nucleofila acilica.
• L'ammina (basica) rimuove infatti un protone
dall'acido carbossilico attraverso una reazione
acido-base formando un sale.
• Il riscaldamento del sale a temperature > 100°C
favorisce l'eliminazione di acqua e porta alla
formazione dell'ammide.
O
R C O H + NH3
O
R C O* NH4)
stabile
O
calore
- H2O
R C NH3
Il legame peptidico delle
proteine
• Le proteine sono
catene di aminoacidi
(AA) uniti tra loro.
• Il gruppo carbossilico
COOH di un AA ed il
gruppo amminico NH2
di un altro AA
reagiscono formando
l’ammide, con un
legame denominato
peptidico.
I peptidi
H3C
O
H
OH
C
H2N
H2N
C
C
H
O
Alanina
(ala)
H3C
OH
CH2OH
Serina
(ser)
H
C
H2N
C
C
H
O
N
C
C
OH
CH2OH
H
O
Alanilserina
(ala-ser)
HOH2C
O
H
OH
C
H2N
H2N
C
C
serina
(ser)
HOH2C
OH
CH3
H
O
alanina
(ala)
H
C
H2N
C
H
O
N
C
C
O
C
H
OH
CH3
serilAlanina
(ser-ala)
Le proteine
Riduzione
• Gli acidi sono ridotti ad alcoli con agenti riducenti
forti come il LiAlH4
O
1) LiAlH4
R C O H
2) H3
Acido carbossilico
Acido fenilacetico
R C O H
H
Alcol primario
H
O
C C O H
H2
O+
H
1) LiAlH4
2) H3
O+
C C O H
H2
H
2-Feniletanolo (75%)
• La reazione passa attraverso la formazione
dell’aldeide che viene ulteriormente ridotta ad alcol.
• E' difficile fermare la riduzione allo stadio di
aldeide.
Reattivit
à dei derivati
Reattività
carbossilici
Reattività
La reattività dipende dalla grandezza della
parziale carica positiva sull'atomo di carbonio
carbonilico che dipende sia da effetti induttivi
che da effetti di risonanza
O
R
O
NH2
Ammidi
R
O
O
OR'
Esteri
R
O
Anidridi
O
R
R
Cl
Alogenuri
Effetti di risonanza
La reattività sarà tanto maggiore
quanto meno sarà importante la
forma III
R C
O
)
R C
O
*
R C
Y
Y
Y)
I
II
III
O*
Effetti induttivi
• L’effetto induttivo elettron attrattore
aumenta all’aumentare
dell’elettronegatività dell’atomo
aumentando la reattività del composto
elettronegatività
δ−
O
δ−
δ−
R C NHR'
δ+
O
δ−
R C OR'
δ+
O
δ−
δ−
δ−
δ−
O
O
R C O C R
reattività
δ+
δ+
R C Cl δ −
δ+
Effetti di risonanza
• La forma III è tanto più importante quanto meno
l’atomo Y è elettronegativo
R C
Y
O
R C
+
Y
I
O
R C
O
+
+
Y
II
III
• La minor reattività dell’estere rispetto all’anidride è
dovuta al fatto che in quest’ultima l’atomo di ossigeno
centrale può essere delocalizzato su due gruppi
carbonilici e la forma III diventa poco importante
O
R C
O
R C
III
+
R C
O
R C
O
O
R C
II
O
R C
O
+
O
R C
I
O
+
O
R C
O
O
R C
R C
II
O
O
III
+
O
Derivati degli acidi
La reattività decresce quanto più il gruppo uscente è basico.
Interconversione dei Derivati
• I derivati più
reattivi possono
esser convertiti in
quelli meno
reattivi.
Le reazioni degli alogenuri acilici
O
R
H2O
O
R
Cl
R'COOH
alogenuro acilico
OH
O
O
acido carbossilico
R'OH
NH3
R
O
R'
anidride
O
O
R
OR'
estere
R
NH2
ammide
Le reazioni vengono condotte in presenza di piridina per bloccare l’acido cloridrico che si sviluppa
Esteri da Alogenuri
• I cloruri acilici reagiscono con gli alcoli per
dare gli esteri con buone rese.
O
O
Cl
+ H O CH2 CH3
N
O CH2 CH3 +
+
N
H
• La reazione viene fatta in presenza di una
base come la piridina per eliminare l'acido
cloridrico che si forma dalla reazione.
Cl-
Ammidi da Alogenuri
• I cloruri acilici reagiscono con ammoniaca
per dare le ammidi.
O
O
Cl
N
+ H2N CH2CH3
NH CH2CH3
+
+
N
H
• La reazione viene fatta in presenza di una
base come la piridina per eliminare l'acido
cloridrico che si forma dalla reazione.
Cl-
Le reazioni delle anidridi
O
O
R
H2O
R'
O
anidride
NH3
O
R
O
OH
acido carbossilico
R
R'OH
NH2
ammide
O
R
OR'
estere
Le reazioni vengono condotte in presenza di piridina per bloccare l’acido carbossilico che si sviluppa
Le reazioni degli esteri
O
R
R
R'MgX
H2O
O
OH
( H+
o
OR
estere
R'
R'
R
OH
OH- )
LiAlH4
R'OH
acido carbossilico
alcol 3°
NH3
H
O
R
R
O
OR'
estere
H
OH
alcol 1°
R
NH2
ammide
Idrolisi degli esteri
SAPONIFICAZIONE
In ambiente basico
O
O
R
OR' + -OH
R
OR'
OH
O
O
R
OH + R'O -
R
O
+
R'OH
I trigliceridi
• I trigliceridi sono esteri neutri del
glicerolo, formati da tre acidi grassi a
lunga catena. Essi costituiscono una
parte importante dell'olio vegetale e
del grasso animale.
• Il glicerolo è l’alcool a tre atomi di
carbonio che contiene un gruppo
ossidrilico su ogni atomo di carbonio.
• Gli acidi grassi sono uniti all'alcool
tramite legami esterei.
Trilinolenina
Saponi
• I saponi vengono prodotti riscaldando un grasso
(trigliceride) in presenza di NaOH per produrre il
sale sodico di un acido grasso che funziona come
sapone.
• Esso è infatti costituito da una lunga catena di
atomi di carbonio (coda idrofobica) e da un gruppo
carbossilato terminale (testa idrofilica)
O
O
H
O
R1
3 HO
O
O
R3
O
R1
O
O
O H
R2
H
O
O
+
R2
O
O
O
R3
O
Saponi
Un esempio di sapone è lo stearato di sodio, CH3(CH2)16COO- Na+.
Reazione di Reattivi di Grignard
• La reazione degli esteri con i reattivi di
Grignard porta alla formazione degli alcoli
in quanto i chetoni che si formano per
sostituzione nucleofila vengono
ulteriormente attaccati dai reattivi di
Grignard
O
O
R'
OR + R MgX
δ- δ +
R'
MgX
OR
R
O
R'
R + ROMgX
+ R MgX
+ H+
OH
R'
R
R
Riduzione
• Gli esteri possono essere ridotti ad alcoli
primari dal litio alluminio idruro (LiAlH4).
O
R C O R'
LiAlH4
etere
Estere
H
R C O H
H
Alcol primario
+ R'OH
Le reazioni delle ammidi
O
R
H2O
O
R
OH
NH2
ammide
O
R'MgX
( H+ o OH- )
R
R'
acido carbossilico
chetone
LiAlH4
H
R
H
NH2
ammina
Reazione di Reattivi di Grignard
• La reazione delle ammidi con i reattivi di
Grignard si ferma allo stadio di chetone in
quanto il prodotto dell'addizione del Grignard
sull'ammide è stabile e per essere
trasformato in chetone necessita di una
catalisi acida che distrugge anche il Grignard
in eccesso.
O
O
R'
N(CH3)2+ R MgX
R'
MgX
N(CH3)2
R
stabile
H3O+
O
R'
R
Riduzione
• Per riduzione con LiAlH4 le ammidi sono
ridotte ad ammine.
O
R'
R C N R'
LiAlH4
H
R'
R C N R'
H
Ammide
O
H3C C
H2
Ammina
LiAlH4
N(CH3)2
H3C C C N(CH3)2
H2 H2
Le reazioni dei nitrili
R C N
H2O
O
R
OH
nitrile
O
R'MgX
( H+ o OH- )
R
R'
acido carbossilico
chetone
LiAlH4
H
R
H
NH2
ammina
Idrolisi dei Nitrili
• In condizioni blande i nitrili idrolizzano ad
ammide.
H3C
C
N
H3 C
+ -OH
C
N
H3 C
OH
C
NH
H3 C
O
C
H 2O
NH
H3 C
O
O
• Riscaldando in soluzione acquosa acida o
basica l’idrolisi porta alla formazione
dell’acido carbossilico.
O
+ -OH
C
N
H 2O
C
O
NH 2
+ -OH
Δ
C
C
O
+ NH 3
NH2
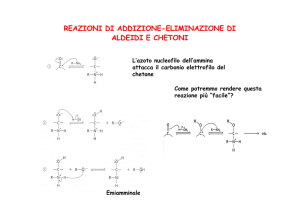
Addizione di Reattivi di
Grignard
• L’addizione porta alla formazione
dell’immina che poi idrolizza
spontaneamente a chetone
H3C C N + R MgX
δ- δ+
H3C
C
R
N MgX
H3C
H2O
C
R
NH
H3C
H+
C
R
O
Reattività in α
Reazioni in α
• Il gruppo carbossilico ancor più di quello
carbonilico ha la capacità di rendere leggermente
acido l’atomo di idrogeno legato all'atomo di
carbonio in α.
-OEt
R O
R
OEt
H
R C
- EtOH
R O
R O
OEt
R C
OEt
carbanione delocalizzato
• Per trattamento con una base sufficientemente
forte si può avere quindi la formazione dell'anione
coniugato che può reagire come nucleofilo.
Condensazione di Claisen
• La reazione di un estere con etilato sodico porta
alla formazione del prodotto di condensazione tra
due molecole di estere.
O
O
O
O
H2C
OEt + H3C
H3C
OEt
OEt - -OEt H3C
CH2
CH2
O
O
OEt
O
+ -OEt
- EtOH
OEt
β-chetoestere
• L'equilibrio è spostato verso destra per la
formazione della base coniugata del prodotto
finale.
H3C
-
CH
O
OEt
Alchilazione in α
• Per reazione con un alogenuro alchilico l'anione
del'estere acetoacetico può essere alchilato in
posizione α attraverso una SN in cui il carbanione
agisce da nucleofilo.
O
H3C
CH2
O
+ -OEt
- EtOH
O
OEt
H3C
- CH
O
OEt
O
R X
- X-
H3C
HC R
O
H2O, H+
- EtOH
O
OEt
H3C
HC R
O
Δ
- CO2
O
OH
acetoacetato di etile
• Il prodotto alchilato può essere trasformato in
chetone per idrolisi e successiva
decarbossilazione.
H3C
C R
H2