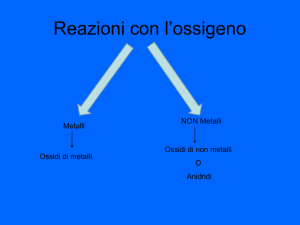
Metallo + O2→ Ossido (Ossido Basico)
•
2Na + ½ O2 → Na2O
Ossido di Sodio
•
Mg + ½ O2 → MgO
Ossido di Magnesio
•
2 Zn + O2 → 2 ZnO
Ossido di Zinco
•
4 Al + 3 O2 → Al2O3
Ossido di Alluminio o sesquiossido di alluminio o triossido di
dialluminio
•
2Cu + ½ O2 → Cu2O
Ossido Rameoso (Ossido di Rame (I))
•
Cu + ½ O2 → CuO
Ossido Rameico (Ossido di Rame (II)) o Monossido di Rame
•
Sn + ½ O2 → SnO
Ossido Stannoso (Ossido di Stagno (II)) o Monossido di Stagno
•
Sn + O2 → SnO2
Ossido Stannico (Ossido di Stagno (IV)) o Diossido di Stagno
•
Fe + ½ O2 → FeO
Ossido Ferroso (Ossido di Ferro (II))
•
2Fe + 3/2 O2 → Fe2O3
Ossido Ferrico (Ossido di Ferro (III)) o Sesquiossido di Ferro
•
Pb + ½ O2 → PbO
Monossido di Piombo (Ossido di Piombo (II) – Litargirio)
•
2Pb + 3/2 O2 → Pb2O3
•
Pb + O2 → PbO2
Sesquiossido di Piombo (Ossido di Piombo (II,IV) - Ossido
misto detto Minio)
Diossido di Piombo (Ossido di Piombo (IV))
•
Mn + ½ O2 → MnO
Ossido Manganoso......MEGLIO (Ossido di Manganese (II))
•
2Mn + 3/2 O2 → Mn2O3
Ossido Manganico.......MEGLIO (Ossido di Manganese (III))
•
Mn + O2 → MnO2
Ossido di Manganese (IV) o anche Diossido di Manganese
•
2Mn + 7/2 O2 → Mn2O7
Anidride Permanganica... (Ossido di Manganese (VII) *
•
Cr + 1/2 O2 → CrO
Ossido Cromoso.....MEGLIO (Ossido di Cromo (II))
•
2Cr + 3/2 O2 → Cr2O3
Ossido Cromico.....MEGLIO (Ossido di Cromo (III))
•
Cr + 6/2 O2 → CrO3
Anidride Cromica (Ossido di Cromo (VI) *
* attenzione: non si comportano più da ossidi basici!
Non Metallo + O2→ Anidride (ossido acido)
•
S + O2 → SO2
Anidride Solforosa o Diossido di Zolfo
•
S + 3/2 O2 → SO3
Anidride Solforica o Triossido di Zolfo
•
C + O2 → CO2
Anidride Carbonica o Diossido di Carbonio
•
C + ½ O2 → CO
Monossido di Carbonio (non ha carattere acido)
•
Si + O2 → SiO2
Diossido di silicio (detto anche Silice )
•
B + 3/2 O2 → B2O3
Anidride Borica (spesso usato Ossido di Boro)
•
Cl2 + ½ O2 → Cl2O
Anidride Ipoclorosa o Monossido di Dicloro
•
Cl2 + 3/2 O2 → Cl2O3
Anidride Clorosa o Triossido di Dicloro
•
Cl2 + 5/2 O2 → Cl2O5
Anidride Clorica o Pentaossido di Dicloro
•
Cl2 + 7/2 O2 → Cl2O7
Anidride Perclorica o Eptaossido di Dicloro
•
N2 + ½ O2 → N2O
Anidride Iponitrosa (Protossido di Azoto – gas esilarante)
•
N2 + O2 → 2NO
Ossido di Azoto (monossido di azoto)
•
N2 + 3/2 O2 → N2O3
Anidride Nitrosa (triossido di diazoto)
•
N2 + 2 O2 → N2O4
Tetraossido di Diazoto (dimero di NO2 )
•
N2 + 5/2 O2 → N2O5
Anidride Nitrica
•
P4 + 3 O2 → P4O6
Anidride Fosforosa (Ossido di Fosforo (II))
•
P4 + 4 O2 → P4O8
Tetraossido di (di)Fosforo (Ossido di Fosforo (IV))
•
P4 + 5 O2 → P4O10
Anidride Fosforica o Pentaossido di (di)Fosforo o
(Ossido di Fosforo (V))
Ossido + H2O → Base (idrossido)
•
Na2O + H2O → 2NaOH
Idrossido di Sodio (per gli amici Soda Caustica)
•
CaO + H2O → Ca(OH)2
Idrossido di Calcio
•
SnO2 + 2 H2O → Sn(OH)4
Idrossido Stannico
•
FeO + H2O → Fe(OH)2
Idrossido Ferroso (o idrossido di Ferro(II))
•
Fe2O3 + 3 H2O → 2Fe(OH)3
Idrossido Ferrico (o idrossido di Ferro(III))
•
NH3 + H2O → NH4OH
Idrossido d’Ammonio
Anidride + H2O → Acido (ossiacido)
•
SO2 + H2O → H2SO3
Acido Solforoso
•
SO3 + H2O → H2SO4
Acido Solforico
•
N2O + H2O → 2 HNO (H2N2O2)
Acido Iponitroso (reazione non vera, vera la contraria)
•
N2O3 + H2O → 2 HNO2
Acido Nitroso
•
N2O5 + H2O → 2 HNO3
Acido Nitrico (in realtà la reazione di preparazione
dell’acido nitrico avviene secondo la seguente: )
•
3NO2 + H2O → 2 HNO3 + NO
Poi l’ NO prodotto viene riossidato a NO2 ....
•
Cl2O + H2O →
2 HClO
Acido Ipocloroso
•
Cl2O3 + H2O →
2 HClO2
Acido Cloroso
•
Cl2O5 + H2O →
2 HClO3
Acido Clorico
•
Cl2O7 + H2O →
2 HClO4
Acido Perclorico
•
SiO2 + 2 H2O → Si(OH)4
Acido Silicico
•
P4O6 + 6 H2O → 4 H2PHO3
Acido Fosfonico (erroneam. chiamato Acido Fosforoso)
•
P4O8 + 4 H2O → 4 H2PO3 (H4P2O6)
Acido Ipofosforico
•
P4O10 + 6 H2O → 4 H3PO4
Acido Fosforico (Ortofosforico)
•
CO2+ H2O → H2CO3
•
CO + H2O non reagisce!
Acido Carbonico
ECCEZIONE: i metalli in alto stato di ossidazione.
•
CrO3 + H2O →
•
Mn2O7 + H2O → 2 HMnO4
H2CrO4
Acido Cromico
Acido Permanganico
Non-Metallo + H2 → Idracidi
•
F2 + H2 → 2 HF
Acido Fluoridrico
•
Cl2 + H2→ 2 HCl
Acido Cloridrico
E così via tutti gli alogeni...
•
S6 + 6 H2 → 6 H2S
Acido Solfidrico
Ma attenzione:
•
O2 + 2 H2 → H2O
(così poco acida che per ora non la consideriamo tale)
•
N2+ 3/2H2→ NH3
Ammoniaca (non acida!)
•
P4 + 6 H2→ 4 PH3
Fosfina (non acida!)
Acidi + Basi → Sali
•
NaOH + HClO3 → NaClO3 + H2O
Clorato di Sodio
•
2KOH + H2SO4 → K2SO4 + 2 H2O
Solfato di Potassio
•
Fe(OH)3 + 3HCl → FeCl3 + 6H2O
Cloruro Ferrico
•
3 Ca(OH)2 + 2H3PO4 → Ca3(PO4)2 + 6H2O
Fosfato di calcio
•
Mg(OH) 2 + 2 HNO3 + 4 H2O → Mg(NO3) 2· 6 H2O Nitrato di Magnesio Esaidrato
•
Fe(OH)3 + HCl → Fe(OH)2Cl + H2O
Cloruro Ferrico Dibasico (Diidrossi
cloruro di ferro (III))
•
Fe(OH)3 + 2HCl → Fe(OH)Cl2 + 2H2O
Cloruro Ferrico Basico (Idrossi dicloruro
di Ferro (III))
•
Ca(OH)2 + H3PO4 → CaHPO4 + 2 H2O
Fosfato Acido di Calcio
•
NaOH + H2SO4 → NaHSO4 + H2O
Solfato Acido di Sodio (Bisolfato di
Sodio)
•
NaOH + H2CO3 → NaHCO3 + H2O
Carbonato Acido di Sodio (Bicarbonato
di Sodio)
•
Ca(OH)2 + 2H2CO3 → Ca(HCO3)2 + 2H2O
Bicarbonato di Calcio
•
Ca(OH)2 + H2CO3 → CaCO3 + 2H2O
Carbonato di Calcio
Ossido + Acido → Sale
•
UO2+ 4HF → UF4 + 2H2O
•
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
•
CaO + H2SO4 + H2O → CaSO4· 2H2O Solfato di Calcio diidrato (Alabastro)
•
CaSO4 · 2H2O (Essicazione a bassa temp.) → CaSO4 · ½ H2O + 3/2 H2O ↑ Gesso
•
CaSO4 · 2H2O (∆) → CaSO4 + 2H2O↑ Anidrite
Metallo + Acido → Sale
•
Fe + 2HCl → FeCl2+ H2↑
•
Mg + H3PO4 → MgHPO4+ H2↑
•
Cu + HCl
Non reagisce
•
Ag + HCl
Non reagisce
•
Au + HCl
Non reagisce
•
K + H2O → KOH + ½ H2 + calore forte! (attenti al botto....)
Idrossido + Anidride → Sale
(sono reazioni in fase eterogenea gas solido, piuttosto lente, necessitano idrossidi basi forti)
•
2 NaOH + CO2 → Na2CO3 + H2O
•
NaOH + CO2 → NaHCO3
•
Ca(OH)2 + CO2 → CaCO3 + H2O
•
Ba(OH)2 + SO3 → BaSO4 + H2O
Ossido + Anidride → Sale
(sono reazioni in fase eterogenea gas solido, piuttosto lente, necessitano ossidi o anidridi reattive)
•
Na2O + CO2 → Na2CO3
•
CaO + SO3 → CaSO4
Metallo + non Metallo → Sale
(anidridi e metalli molto reattivi; spesso solo reazioni superficiali o necessità di innescare con energia)
•
Na + ½ Cl2 → NaCl + molta energia!
•
Zn + S →
ZnS
Metallo + H2 → Idruro
•
Na + ½ H2→ NaH
•
Li + ½ H2→ LiH
•
Ca + H2 → CaH2
•
Al + 3/2 H2→ AlH3
•
LiH + AlH3 → Li[AlH4]
Idruro di Sodio
Litio Alluminio Idruro
che però si ottiene più convenientemente secondo:
•
AlBr3 + 4LiH → Li[AlH4] + 3LiBr
Dissociazioni Ioniche
•
CaCl2 → Ca2+ + 2Cl-
•
KOH → K+ + OH-
•
H2SO4 → SO42- + 2H+
•
H3PO4→ HPO42- + 2H+
•
NaHCO3 → Na+ + CO32- + H+
•
NaH2PO4 → Na+ + PO43- + 2 H+
Reazioni di Scambio (dette anche di spostamento)
•
Na2S + H2SO4 → Na2SO4 + H2S ↑
•
NaHCO3 + CH3COOH → Na(OOCCH3) + CO2 + H2O (infatti H2CO3 → CO2 + H2O)
•
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
•
Al2(SO4)3 + 6 NH4OH → 3(NH4)2SO4 + 2Al(OH)3 ↓
•
BaCl2+ CO2 + H2O → BaCO3 ↓ + 2HCl
•
AgNO3 + Cl -→ AgCl + ↓ NO3-
Reazioni di Decomposizione
•
Cl2
•
O3
•
MgCl2· 6H2O ( ∆ ) → Mg(OH)Cl + HCl + 5H2O
•
Mg(NO3)2· 6H2O ( ∆ ) → MgO + 2HNO3 + 5H2O
•
Ca(HCO3)2 (∆,H2O) → CaCO3↓ + H2O + CO2
•
Al2Cl6 + 12 H2O → 2[Al(H2O)6]Cl3
•
2[Al(H2O)6]Cl3 ( ∆ ) → Al2O3 + 9HCl + 9H2O ( Decomposizione )
+
+
luce blu → 2 Cl·
(formazione di Radicali Liberi)
radiazione ultravioletta → O2 + O·
( reazione di Idratazione)
Acidi “atipici”
•
SnO2+ 2 KOH → K2SnO3 + H2O
•
Al(OH)3 + NaOH → Al(OH)4- + Na+
•
2 Al + 2 NaOH + 2 H2O → 2 NaAlO2 + 3H2↑ Alluminato di Sodio
•
AuCl3 + HCl → HAuCl4
Acido Cloroaurico (più esattamente è un cloro
complesso, nome: acido tetracloro aurico)
•
AuCl3 + NaCl → NaAuCl4
Tetracloro aurato di sodio
•
HAuCl4 (H2O) → AuCl4- + H+
L’acido dissocia come un normale acido...
•
HAuCl4 + 4 KOH→ Au(OH)3↓ + 4 KCl + H2O In ambiente basico precipita l’idrossido aurico
•
CrO3 + H2O → H2CrO4
(Acido Cromico)
•
H2CrO4 + 2 NaOH → Na2CrO4 + 2H2O
(Cromato di Sodio)
•
Na2CrO4 + 2H + ↔ 2Na+ + Na2Cr2O7 + H2O
Bicromato di Sodio
N.B.: NON è un'ossidoriduzione è solo un equilibrio
determinato dal valore di pH
Stannato di Potassio
Impropriamente chiamato Alluminato di
Sodio (più esattamente è un idrossi complesso,
nome: tetraidrosso alluminato di sodio )