Editor in chief
Giorgio Lambertenghi Deliliers
Anno 6
Numero 3
2009
Seminari
di Ematologia
Oncologica
NEL PROSSIMO NUMERO
L’ANZIANO IN ONCOEMATOLOGIA
Principi di trattamento •
Leucemia mieloide acuta •
Leucemia linfoblastica acuta •
Linfomi maligni •
Leucemia
mieloide acuta
EDIZIONI
INTERNAZIONALI srl
Edizioni Medico Scientifiche - Pavia
Leucemia
mieloide acuta
Vol. 6 - n. 3 - 2009
Profilo genetico
5
MARINO CLAVIO, MAURIZIO MIGLINO,
MARCO GOBBI
Editor in Chief
Giorgio Lambertenghi Deliliers
Università degli Studi, Milano
Editorial Board
Sergio Amadori
Università degli Studi Tor Vergata, Roma
Mario Boccadoro
Università degli Studi, Torino
Leucemie secondarie
therapy-related
Alberto Bosi
Università degli Studi, Firenze
31
Federico Caligaris Cappio
Università Vita e Salute, Istituto San Raffaele, Milano
Antonio Cuneo
GIUSEPPE LEONE, MARIA TERESA VOSO,
LUANA FIANCHI, LIVIO PAGANO
Università degli Studi, Ferrara
Marco Gobbi
Università degli Studi, Genova
Mario Petrini
Università degli Studi, Pisa
Terapie innovative
51
Giorgina Specchia
ADRIANO VENDITTI, LICIA OTTAVIANI,
CHIARA SARLO, LUIGI DI CAPRIO,
MICOL QUARESIMA, SVITLANA GUMENIUK,
MARIA GIOVANNA CEFALO, ELEONORA CERESOLI,
MARIA ILARIA DEL PRINCIPE, LUCA MAURILLO,
FRANCESCO BUCCISANO, SERGIO AMADORI
La malattia in età pediatrica
CARMELO RIZZARI, TIZIANA COLIVA,
MARCO SPINELLI, ANDREA BIONDI
Giovanni Pizzolo
Università degli Studi, Verona
Università degli Studi, Bari
Direttore Responsabile
Paolo E. Zoncada
Registrazione Trib. di Milano n. 532
del 6 settembre 2007
73
Edizioni Internazionali srl
Divisione EDIMES
Edizioni Medico-Scientifiche - Pavia
Via Riviera, 39 - 27100 Pavia
Tel. +39 0382 526253 r.a. - Fax +39 0382 423120
E-mail: [email protected]
Seminari
2
Periodicità
Quadrimestrale
Scopi
Seminari di Ematologia Oncologica è un periodico di aggiornamento che nasce come servizio per i medici con l’intenzione di
rendere più facilmente e rapidamente disponibili informazioni su
argomenti pertinenti l’ematologia oncologica.
Lo scopo della rivista è quello di assistere il lettore fornendogli
in maniera esaustiva:
a) opinioni di esperti qualificati sui più recenti progressi in forma
chiara, aggiornata e concisa;
b) revisioni critiche di argomenti di grande rilevanza pertinenti gli
interessi culturali degli specialisti interessati;
NORME REDAZIONALI
1) Il testo dell’articolo deve essere editato utilizzando il programma
Microsoft Word per Windows o Macintosh.
Agli AA. è riservata la correzione ed il rinvio (entro e non oltre 5
gg. dal ricevimento) delle sole prime bozze del lavoro.
2) L’Autore è tenuto ad ottenere l’autorizzazione di «Copyright»
qualora riproduca nel testo tabelle, figure, microfotografie od
altro materiale iconografico già pubblicato altrove. Tale materiale illustrativo dovrà essere riprodotto con la dicitura «per
concessione di …» seguito dalla citazione della fonte di provenienza.
3) Il manoscritto dovrebbe seguire nelle linee generali la seguente
traccia:
Titolo
Conciso, ma informativo ed esauriente.
Nome, Cognome degli AA., Istituzione di appartenenza senza
abbreviazioni.
Nome, Cognome, Foto a colori, Indirizzo, Telefono, Fax, E-mail del
1° Autore cui andrà indirizzata la corrispondenza.
Introduzione
Concisa ed essenziale, comunque tale da rendere in maniera chiara ed esaustiva lo scopo dell’articolo.
Parole chiave
Si richiedono 3/5 parole.
Corpo dell’articolo
Il contenuto non deve essere inferiore alle 30 cartelle dattiloscritte
(2.000 battute cad.) compresa la bibliografia e dovrà rendere lo stato
dell’arte aggiornato dell’argomento trattato. L’articolo deve essere corredato di illustrazioni/fotografie, possibilmente a colori, in file ad alta
risoluzione (salvati in formato .tif, .eps, .jpg).
Le citazioni bibliografiche nel testo devono essere essenziali, ma
aggiornate (non con i nomi degli AA. ma con la numerazione corrispondente alle voci della bibliografia), dovranno essere numerate
con il numero arabo (1) secondo l’ordine di comparsa nel testo e
comunque in numero non superiore a 100÷120.
di Ematologia
Oncologica
Periodico di aggiornamento
sulla clinica e terapia
delle emopatie neoplastiche
Bibliografia
Per lo stile nella stesura seguire le seguenti indicazioni o consultare
il sito “International Committee of Medical Journal Editors Uniform
Requirements for Manuscripts Submitted to Biomedical Journals:
Sample References”.
Es. 1 - Articolo standard
1. Bianchi AG, Rossi EV. Immunologic effect of donor lymphocytes
in bone marrow transplantation. N Engl J Med. 2004; 232: 2847.
Es. 2 - Articolo con più di 6 autori (dopo il 6° autore et al.)
1. Bianchi AG, Rossi EV, Rose ME, Huerbin MB, Melick J, Marion
DW, et al. Immunologic effect of donor lymphocytes in bone marrow transplantation. N Engl J Med. 2004; 232: 284-7.
Es. 3 - Letter
1. Bianchi AG, Rossi AV. Immunologic effect of donor lymphocytes
[Letter]. N Engl J Med. 2004; 232: 284-7.
Es. 4 - Capitoli di libri
1. Bianchi AG, Rossi AV. Immunologic effect of donor lymphocytes.
In: Caplan RS, Vigna AB, editors. Immunology. Milano: MacGrawHill; 2002; p. 93-113.
Es. 5 - Abstract congressi (non più di 6 autori)
1. Bianchi AG, Rossi AV. Immunologic effect of donor lymphocytes
in bone marrow transplantation [Abstract]. Haematologica. 2002;
19: (Suppl. 1): S178.
Ringraziamenti
Riguarda persone e/o gruppi che, pur non avendo dignità di AA.,
meritano comunque di essere citati per il loro apporto alla realizzazione dell’articolo.
Edizioni Internazionali Srl
Divisione EDIMES
EDIZIONI MEDICO SCIENTIFICHE - PAVIA
Via Riviera, 39 • 27100 Pavia
Tel. 0382526253 r.a. • Fax 0382423120
E-mail: [email protected]
3
Editoriale
GIORGIO LAMBERTENGHI DELILIERS
Università degli Studi di Milano
U.O. Ematologia 1 - Centro Trapianti di Midollo
Fondazione IRCCS Ospedale Maggiore Policlinico,
Mangiagalli e Regina Elena
Seminari di Ematologia Oncologica propone in
questo numero le nuove acquisizioni sulla leucemia mieloide acuta, malattia che comprende un
insieme di entità diverse sul piano clinico e biologico. La scoperta di questa eterogeneità è
dovuta all’identificazione di markers citogenetici
e molecolari, che hanno portato al riconoscimento di vari sottotipi a prognosi differente e soprattutto alla prospettiva di potenziare la terapia convenzionale con nuovi farmaci più mirati in senso
patogenetico. Infatti accanto alla morfologia, alla
citochimica e alla citofluorimetria oggi è consigliabile completare l’iter diagnostico con indagini di
citogenetica e genetica molecolare, che permettono il rilievo di alterazioni cromosomiche o mutazioni geniche correlate, sia in età pediatrica che
adulta, al blocco dei processi di differenziazione
o alla disregolazione del ciclo cellulare e dei processi di apoptosi o allo stimolazione dei precursori leucemici.
Nelle leucemie secondarie le rotture e le traslocazioni cromosomiche da parte di agenti citotossici favoriscono l’acquisizione delle mutazioni
geniche, la cui attività neoplastica viene favorita
anche da una suscettibilità individuale dipendente da fattori ereditari, quali i polimorfismi del
metabolismo dei farmaci o i difetti di riparazione
del DNA. La conferma viene anche dalla pediatria dove specifiche condizioni genetiche sono
associate ad una maggiore incidenza di malattia
leucemica. Nell’adulto una predisposizione specifica appare associata anche dal tipo di tumore
solido primitivo, come dimostrato dal rischio di
leucemia acuta promielocitica nelle donne trattate per un carcinoma della mammella.
La terapia della leucemia mieloide acuta è tuttora ancorata a farmaci tradizionali come le antracicline e la citosina arabinoside, che negli ultimi
anni non hanno portato a sostanziali miglioramenti della sopravvivenza.
Tuttavia interessanti prospettive vengono dalla
sperimentazione clinica con nuove molecole che
mirano a trattare la malattia nelle sue diverse
espressioni genetico molecolari con un’azione
mirata sugli eventi epigenetici e sulle diverse
mutazioni.
5
Profilo genetico
MARINO CLAVIO, MAURIZIO MIGLINO, MARCO GOBBI
Clinica Ematologica, Università degli Studi di Genova
Marco Gobbi
n INTRODUZIONE
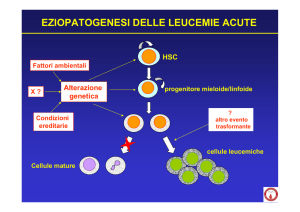
La leucemia mieloide acuta (LMA) comprende un
insieme di entità clinico-ematologiche molto diverse, caratterizzate da un’espansione clonale della
mielopoiesi in cui sono spesso associati un incremento della proliferazione ed un blocco maturativo (1). Sulla base dei reperti osservabili con la
microscopia ottica (colorazioni May Grumwald
Giemsa e reazioni citochimiche) il gruppo FAB ha
riconosciuto sei varietà (2) distinguibili in base al
grado e al tipo di differenziazione del clone leucemico.
L’utilizzo sempre più ampio e raffinato delle metodiche citofluorimetriche ha consentito negli anni
successivi una caratterizzazione sempre più precisa dei vari sottotipi, ha individuato numerosissimi fenotipi aberranti utili per il monitoraggio quantitativo del clone leucemico ed evidenziato nuove
varietà (leucemie indifferenziate, leucemie bifenotipiche, leucemie bilineari…). Ben presto è risultato evidente che l’eterogeneità morfologica,
immunofenotipica e clinica era in relazione con la
presenza di una vasta gamma di aberrazioni citogenetiche e/o di mutazioni geniche o da alterazioParole chiave: Leucemia mieloide acuta, Prognosi,
Profilo genico, WT1 NPM
Indirizzo per la corrispondenza
Dott. Marino Clavio
Clinica Ematologica
Università degli Studi di Genova
Viale Benedetto XV, 6 - 16132 Genova
E-mail: [email protected]
ni della funzione o dell’espressione di numerosi
geni. Il ruolo centrale delle alterazioni genetiche
è stato riconosciuto dalla WHO che ha pubblicato nel 1999 una nuova classificazione, in cui sono
elencate diverse entità clinico-ematologiche associate a precise alterazioni citogenetiche (3, 4). Le
alterazioni genomiche influenzano la funzione delle molecole di segnale, dei fattori di trascrizione
e dei recettori dei fattori di crescita e la risposta
al trattamento. Inoltre spesso coesistono in una singola cellula leucemica e riflettono gli eventi trasformanti che si accumulano nel clone durante lo sviluppo della leucemia (5).
L’identificazione di sottotipi genetici ha migliorato
considerevolmente la stratificazione prognostica,
precedentemente basata unicamente su elementi morfologici e clinico-ematologici e, in alcuni casi, ha consentito l’individuazione di terapie
adattate sul difetto molecolare, come nel caso della leucemia acuta promielocitica (LAP).
Negli ultimi anni le indagini molecolari si sono concentrate sulle LMA a cariotipo normale (CN), che
costituiscono circa il 50-55% delle forme, producendo una mole considerevole di dati non sempre concordi.
Nella fase attuale la disponibilità di tecniche di biologia molecolare capaci di studiare (per mutazione o espressione) svariati geni ha ingenerato nell’ematologo clinico una certa incertezza. Il significato prognostico dei vari profili genetici è in qualche caso ancora incerto, come il rapporto con particolari alterazioni citogenetiche e opzioni terapeutiche (ad esempio il trapianto di cellule staminali
allogeniche).
La presente revisione è finalizzata a fare il punto
aggiornato sul significato prognostico delle prin-
6
Seminari di Ematologia Oncologica
cipali alterazioni citogenetico-molecolari ma soprattutto a fornire al clinico delle indicazioni pratiche
sulle modalità di utilizzo di tutte queste informazioni nella fase della programmazione terapeutica e nel follow-up.
n ALTERAZIONI CITOGENETICHE
Una trattazione esaustiva degli innumerevoli
apporti della citogenetica nella definizione diagnostica, nella delucidazione dei meccanismi leucemogenetici e nella messa a punto delle strategie
terapeutiche richiederebbe un intero volume ed
esulerebbe dagli scopi di questa revisione.
Nella già menzionata nuova classificazione WHO
(3, 4) il primo gruppo comprende le forme di LMA
con ricorrenti anomalie genetiche e cioè:
- la LMA con t(8;21)(q22;q22) in cui si verifica la
formazione del gene ibrido AML1/ETO;
- la LMA con eosinofilia midollare e inv(16) o
t(16;16)(p13;q22) e formazione del gene ibrido
CBFB/MYH11;
Anomalia citogenetica
Traslocazioni/inversioni
t(8;21)(q22;q22)
inv(16)(p13q22)
o t(16;16)(p13;q22)
t(15;17)(q22;q11-21)
t(9;11)(p22;q23)
t(6;11)(q27;q23)
inv(3)(q21q26)
o t(3;3)(q21;q26)
t(6;9)(p23;q34)
Aneuploidie/delezioni
+8
-7/7q-5/5q-17/17p-20/20q9q+22
+21
+13
+11
Cariotipo complesso
Cariotipo normale
- la LAP con t(15;17)(q22;q11-21) e varianti;
- la LMA con anomalie 11q23 (MLL), ad esempio t(9;11)(p22;q23) e t(6;11)(q27;q23).
Esistono, come è ben noto, numerosissime altre
alterazioni citogenetiche, classificabili come bilanciate (traslocazioni, inversioni) e non bilanciate
(delezioni parziali, monosomie, trisomie…). Le principali sono riportate nella tabella 1. Ci limiteremo
in questa sede a evidenziare l’utilità prognostica
dello studio del cariotipo, con particolare attenzione ai lavori più recenti.
Numerosi studi retrospettivi e prospettici hanno
dimostrato che il cariotipo rappresenta uno dei
più importanti fattori prognostici per risposta all’induzione, rischio di ricaduta e sopravvivenza (611). I cariotipi pre-trattamento sono raggruppati
attualmente in tre gruppi prognostici di rischio (favorevole, intermedio e sfavorevole) e sono riportati
nella tabella 2.
I sistemi proposti dai vari gruppi collaboratori presentano molti aspetti comuni ma anche alcune differenze importanti. Il gruppo a prognosi favorevole include i pazienti che alla diagnosi presentano
Alterazione genetica
FAB
Incidenza
RUNX1/CBFA2T1
CBFB/MYH11
M2
M4 eo
6%
7%
PML/RARalfa
MLL/AF9
MLL/AF6
EVI1/RPN1
M3
M5
M4 ed M5
M1, M4, M6, M7
7%
2%
1%
1%
DEK/CAN
M2, M4
1%
?
?
?
TP53
?
?
?
?
?
MLL
-
M2, M4, M5
M4, M4 eo
M0-M1
M1,M2
-
9%
7%
7%
5%
3%
3%
3%
2%
2%
2%
10%
44%
TABELLA 1 - Le più frequenti alterazioni citogenetiche.
Profilo genetico
Gruppo di rischio
Alterazioni citogenetiche
Favorevole
Intermedio
Sfavorevole
t(8;21)(q22;q22) inv(16)(p13q22) t(16;16)(p13;q22) t(15;17)(q22;q11-21)
cariotipo normale; -Y; +8; +11; +13; +21; del(20q)
cariotipo complesso; inv(3)(q21q26), t(3;3)(q21;q26)
-7, t(6;9)(p23;q34), t(6;11)(q27;q23), t(11;19)(q23;213.1) -5; del(5q); del(9q);
t(9;11)(p22;q23); del(11q)
In grassetto le alterazioni citogenetiche con significato prognostico largamente condiviso dai vari gruppi cooperatori
TABELLA 2 - Gruppi di rischio in rapporto alle alterazioni citogenetiche (ECOG-SWOG).
t(8;21)(q22;q22), inv(16)(p13;q22), t(15;17); essi
sono circa il 20% e hanno più spesso un’età inferiore a 60 anni, l’85% di possibilità di ottenere una
remissione completa ed il 30-40% di andare incontro ad una ricaduta. Il gruppo definito a prognosi
intermedia comprende circa il 45% dei soggetti
affetti da LMA, con outcome molto diversificato.
Solo il 25% dei pazienti si può definire come lungo-sopravvivente. Infine il terzo gruppo è costituito da coloro che hanno un cariotipo complesso
(con tre o più anomalie), delezione del cromosoma 5 o 7, tipiche delle LMA secondarie all’esposizione a farmaci o sostanze, oppure anomalie
dell’11q, t(9;11), t(6;9). Questi pazienti rispondono in modo deludente a qualsiasi tipo di terapia
e hanno una probabilità di sopravvivenza a 5 anni
inferiore al 5%.
Numerose anomalie citogenetiche incluse nel
gruppo a cattiva prognosi [ad esempio -5, -7,
del(5q), abn3q, del(7q), abn11q23 ecc.] sono spesso osservate assieme ad altre anomalie. Si configura così quello che è definito un cariotipo complesso, nella cui definizione conta solo il numero
(spesso ≥3) e non il tipo di alterazioni cariotipiche.
Un recente lavoro in pazienti fino a 60 anni ha
dimostrato che le monosomie autosomiche (dei
cromosomi 5, 7 o di altri cromosomi) conferiscono la prognosi peggiore (12). Al contrario trisomie, tetrasomie, anelli o altre aberrazioni strutturali hanno minor significato prognostico.
L’impatto negativo di due o più monosomie autosomiche o di una monosomia associata ad un’altra anomalia (il cosiddetto indice di monosomia
cariotipica) è molto forte (OS a 4 anni del 4%)
e superiore a quello precedentemente indicato
dal cosiddetto cariotipo complesso. I pazienti con
cariotipo complesso (anomalie maggiori o uguali a 3 o a 5) che non soddisfano i criteri del cario-
tipo monosomico presentano infatti una prognosi migliore.
n DAL “GENE PROFILE”
ALLE ALTERAZIONI GENICHE
Principi metodologici
Nuovi orizzonti si sono sicuramente aperti dopo
la mappatura completa del genoma umano.
Mentre è ancora in corso l’identificazione della funzione e della esatta localizzazione dei vari geni,
si sono sviluppate nuove tecnologie che mirano
ad entrare sempre più nei fini meccanismi di
espressione e regolazione genica.
- Gene expression profile: questa tecnologia è
basata sullo studio contemporaneo dell’espressione anche di migliaia di geni. Si basa sull’uso di
microcard contenenti da un lato il cDNA in esame e dall’altro svariate sonde specifiche. Attraverso
complicate analisi computerizzate si giunge
all’identificazione di un vero e proprio profilo genico in cui si possono identificare contemporaneamente geni silenziati e geni overespressi.
L’obiettivo, che peraltro in certi casi è stato raggiunto, è distinguere nella malattia in esame diversi sottogruppi con uguali caratteristiche molecolari. LMA accomunate da caratteristiche citogenetiche precise e non random possono presentare
peculiari profili di espressione genica. La stessa
presenza di marcatori molecolari specifici si può
associare a profili ben distinti. In questo modo si
compie il primo vero passo verso la differenziazione puramente molecolare e patogenetica delle patologie in esame, identificando gruppi di entità che dovrebbero essere considerate in tutto e
per tutto autonome. D’altro canto questa tecnologia permette anche di identificare nuovi genotipi
7
8
Seminari di Ematologia Oncologica
e rappresenta il punto di partenza per lo studio di
nuovi marcatori prognostici (13-20 ).
- MicroRNA profiling: non troppo tempo è trascorso da quando si è arrivati a capire che minuscole sequenze di RNA variabilmente presenti nel
nostro organismo rivestono un importante e insostituibile ruolo nelle regolazione e modulazione dell’espressione genica. In seguito si è giunti alla
dimostrazione che esistono svariati profili di
assetto e che questi possono essere specifici per
ciascuna entità patologica. Si è sviluppato così un
nuovo filone di ricerca che mira a sottoclassificare le LMA sulla base dell’assetto di microRNA. È
stato evidenziato ancora che entità citogeneticamente o molecolarmente definite posseggono un
profilo distinto. Esistono segnalazioni che dimostrano l’importanza prognostica di profili differenti di
microRNA. Ulteriori indagini sono in corso per
costruire il quadro patogenetico ed il ruolo di queste minuscole sequenze non codificanti di RNA
nella definizione fenotipica della malattia (21-25).
- Analisi di polimorfismi genici: è ben noto come
l’espressione genica ed in parte la sua funzione
possa essere alterata da mutazioni, delezioni,
inserzioni, duplicazioni anche di una singola
base. Svariati sono i metodi per analizzare tali polimorfismi. La comparative genomic hybridization
(CGH) permette di evidenziare polimorfismi anche
a carico di un singolo nucleotide (26). Accanto a
questa esistono altre metodiche basate sull’amplificazione mediante PCR del segmento di DNA
o RNA specifico e su particolari elettroforesi in grado di evidenziare l’alterata corsa del segmento
mutato. Tutto si basa sul fatto che la corsa sul gel
di elettroforesi, in determinate condizioni, dipende non solo dal peso molecolare, ma anche e
soprattutto dalla sequenza nucleotidica del segmento in questione. Qui si fa riferimento all’SSCP
(27-30), un’elettroforesi ad amperaggio o voltaggio e temperatura costante su un gradiente di acrilamide, al DGGE, tecnica elettroforetica per la
separazione di frammenti di DNA in base alle loro
differenti proprietà di dissociazione o melting (31,
32), al TGGE, tecnica in cui viene formato un gradiente di temperatura per la separazione in una
seconda dimensione e in cui la separazione avviene in base a differenze di conformazione (33).
Ulteriori metodiche meno diffuse sono l’analisi
degli eteroduplex, il non isotopic Rnase Clevage
Assay (NIRCA), il Protein Truncation Test (PTT),
e in particolari situazioni i test basati sulla digestione enzimatica del segmento amplificato
Ultimamente molto usato è la DHPLC (Denaturing
High Performance Liquid Chromatography) una
tecnica che, in condizioni parzialmente denaturanti e sotto un diretto controllo della temperatura, permette di discriminare all’interno di prodotti eterogenei di PCR, molecole di DNA eteroduplex rispetto alle molecole omoduplex.
La tecnica sviluppata nel laboratorio del Prof.
Cavalli Sforza alla Stanford University (USA) per
la rilevazione di mutazioni del DNA si basa quindi, sulla differente velocità di eluizione in una colonna cromatografia per gli eteroduplex e gli omoduplex. Questi duplex si formano quando frammenti amplificati di DNA vengono denaturati termicamente e lasciati ricombinare. Una qualsiasi variazione (mutazione o polimorfismo) tra le due forme alleliche di un frammento porta alla formazione di un eteroduplex (combinazione di due catene di DNA a singola catena, non perfettamente
corrispondenti, caratterizzata dalla presenza di una
bolla a livello della quale si trova il mismatch).
L’eteroduplex si comporta cromatograficamente in
modo differente sia dall’omoduplex non mutato che
dall’omoduplex mutato: l’eteroduplex è solitamente più veloce (meno trattenuto) degli omoduplex e da ciò si può caratterizzare la presenza di
una variazione nucleotidica in un campione. La presenza di una mutazione o di un polimorfismo si
evidenzia quindi, mediante picchi ulteriori o con
un profilo diverso rispetto al wild-type (34).
Tutti questi metodi sono in grado di identificare la
presenza di sequenze mutate. Il passo successivo d’obbligo è il sequenziamento diretto della
sequenza mutata, al fine di identificarne la natura. Molto scarsi sono i dati in letteratura sul significato e sulla valenza prognostica delle differenti
mutazioni dei vari geni marker. Allo stesso tempo molto importante è identificare alterazioni di
sequenza non random e correlarle clinicamente
e biologicamente.
- Analisi di espressione genica: a tal fine viene
comunemente utilizzata la Real-Time PCR su
cDNA 8 cioè ottenuto per trascrizione inversa
dall’RNA totale del paziente. La Real-Time PCR
è una PCR in cinetica in cui l’amplificazione ed
il rilevamento dell’amplificato avvengono nello
Profilo genetico
stesso momento. Questo è possibile grazie all’introduzione all’interno della reazione di una molecola fluorescente, che ci dà la possibilità di seguire la reazione da un punto di vista visivo, grazie
all’ausilio di appositi software. Sono generalmente utilizzate sonde taqman (o taqman probes). Si
tratta di oligonucleotidi lineari di 25-28 pb marcate al 5’ con il reporter ed al 3’ con il quencer. Il
quencer estingue la fluorescenza del reporter solo
quando la sonda è integra; quando la sonda viene tagliata, il quencer ed il reporter si liberano in
soluzione e si manifesta la fluorescenza (35-38).
n SIGNIFICATO PROGNOSTICO
DELLE ALTERAZIONI
DELL’ESPRESSIONE GENICA
WT1
Il gene del tumore di Wilms, localizzato sul cromosoma 11p13, è stato clonato per la prima volta nel 1990. WT1 codifica per una proteina con
le caratteristiche di un fattore di trascrizione. Al
momento i geni ritenuti regolati da WT1 sono molto pochi: il gene per il recettore dell’EGF, sydecan 1, bcl 2, E-caderina.
Dopo l’isolamento del gene, vari esperimenti ne
hanno messo in luce il profilo di espressione in
diversi tessuti. A differenza di altri geni oncosoppressori quali P53, Rb, la cui espressione è
sostanzialmente ubiquitaria, l’espressione di WT1
è ristretta a pochi tessuti.
Il ruolo di WT1 nelle neoplasie renali appare ormai
abbastanza chiaro, mentre il suo ruolo nella ematopoiesi appare ancora poco conosciuto. WT1
risulta particolarmente espresso nei precursori del
sistema ematopoietico e va incontro ad un rapido processo di down-regulation nel corso del processo di differenziamento cellulare. Il ruolo di WT1
nella leucemogenesi è ancora molto dibattuto. La
maggior parte delle leucemie acute mieloidi e linfoidi esprime elevati livelli di WT1 suggerendo che
questo gene oncosoppressore possa avere paradossalmente un’attività oncogenica nelle cellule
ematopoietiche.
Alcuni lavori hanno dimostrato che linee cellulari transfettate in modo permanente con WT1
mostrano difetti nella risposta ad agenti differenzianti e questo fenomeno potrebbe contribuire alla
genesi della leucemia. Alcuni modelli sperimentali riportano una tendenza all’aumentata proliferazione cellulare, altri un arresto di crescita.
Al momento esistono sostanzialmente due ipotesi contrastanti sul ruolo di WT1 nelle leucemie:
secondo una teoria WT1 agisce come un oncogene e rappresenta la tappa finale di diverse vie
di trasformazione attivate all’interno della cellula;
una seconda teoria parte dall’assunto che WT1
agisca come oncosoppressore. La sua overespressione, pertanto, costituirebbe semplicemente un epifenomeno in risposta ai segnali trasformanti attivati all’intero della cellula. Questa
dualità funzionale al momento non è ben interpretata, ma è opinione diffusa che il ruolo di WT1
possa variare da cellula a cellula anche solo per
il grado di differenziazione di queste (39-45).
Aldilà del suo significato biologico nella leucemogenesi, dopo l’introduzione delle tecniche di RTPCR, WT1 è diventato un utile marker molecolare. I livelli di WT1 e la loro variazione in corso
di terapia possono infatti essere utilizzati come
indici di malattia residua minima e sembrano assumere un significato prognostico in alcune neoplasie ematologiche (46).
Il ruolo prognostico dei livelli di espressione di
WT1 alla diagnosi nelle LMA non è in realtà ancora ben definito. Le prime segnalazioni in letteratura sembravano dimostrarne una correlazione fra
elevata espressione e prognosi negativa, come
già dimostrato nelle sindromi mielodisplastiche
(46-48). Più recentemente tale ruolo negativo non
è stato confermato ed in un recente studio del
gruppo spagnolo l’espressione di WT1 alla diagnosi non riveste alcun ruolo prognostico (49).
Esistono infine segnalazioni in cui si dimostra un
associazione fra elevata espressione di WT1 e
cariotipo favorevole (50). Nelle core binding factor LMA inoltre elevati valori di WT1 sono stati
associati ad una maggiore probabilità di raggiungere la remissione completa (51). Come si vede
non vi è ancora chiarezza, e questo in parte è
legato a motivi statistici. Parliamo di valori elevati, ma non è chiaro se si debba porre un valore
cut-off che identifichi due distinti gruppi prognostici o se si debba considerare WT1 come variabile continua o ancora se i vari laboratori debbano condurre un’analisi suddividendo in percentili i vari valori.
9
10
Seminari di Ematologia Oncologica
Un parziale chiarimento potrà essere raggiunto nel
momento in cui l’analisi verrà standardizzata, e
saranno definiti i valori normali di espressione e
le fasce di rischio. Al momento ciascun laboratorio deve costruirsi la propria curva di normalità analizzando l’espressione in soggetti normali, utilizzando reagenti e macchinari non codificati. Per
questi motivi i risultati presentati dai vari gruppi,
al momento, possono essere confrontati con qualche difficoltà.
ERG
Il gene ETS (correlato ad ERG) codifica per un
effettore delle vie di transduzione del segnale di
regolazione della proliferazione. ERG è localizzato sul cromosoma 21q22. La prima descrizione del
coinvolgimento di ERG nei processi di tumorigenesi deriva dall’analisi di un caso di sarcoma di
Ewing che presentava la traslocazione cromosomica t(21;22)(q22;q12), che a livello molecolare
corrisponde al riarrangiamento fra ERG e EWS.
Altri riarrangiamenti citogenetici o molecolari coinvolgenti tale zona sono stati descritti in LMA e nel
carcinoma della prostata.
ERG risulta overespresso in LMA a cariotipo complesso, con alterazioni a carico del cromosoma 21
anche criptiche, ma anche in LMA a cariotipo normale (52, 53). Overespressione di ERG è stata
descritta anche in leucemie linfoblastiche acute
soprattutto a fenotipo T. Alcuni studi dimostrano
come la overespressione di ERG alla diagnosi di
LMA sia associata a prognosi sfavorevole. Anche
in questo caso in assenza di standardizzazione
del metodo a fini statistici i pazienti vengono suddivisi in quartili sulla base dell’espressione di ERG
alla diagnosi.
In questo modo si arriva a parlare genericamente di valori alti o bassi. Il significato prognostico della overespressione di ERG viene perduto nei
pazienti FLT3-ITD positivi, mentre viene mantenuto in quelli negativi. Parimenti il significato prognostico negativo di ERG è mantenuto nei pazienti
NPM1 mutati, mentre viene perduto in quelli NPM1
wild-type. Inoltre elevati livelli di espressione di
ERG si associano spesso ad elevata espressione di BAALC, configurando un sottotipo di LMA
a prognosi particolarmente sfavorevole (54-57). Tali
correlazioni necessitano di conferma su ampia
scala.
BAALC
Il gene brain and acute leucemia, cytoplasmic
(BAALC) è localizzato sul cromosoma 8q22.3.
Codifica nell’uomo per almeno 8 trascritti che presentano splicing alternativi. La funzione è sconosciuta, e non sono note altre proteine che presentino analogie strutturali. È tuttavia dimostrata la overespressione di BAALC in cellule CD34 positive.
Tale espressione viene down-regolata negli stadi
maturativi successivi. Di qui l’ipotesi che BAALC
rappresenti un marcatore molecolare specifico dei
progenitori emopoietici più immaturi. Una elevata
espressione di BAALC alla diagnosi nelle LMA ha
valenza prognostica negativa.
Nel 2006 Baldus (58) analizzando 307 pazienti di
età inferiore ai 60 anni e con cariotipo normale
dimostrò che l’elevata espressione di BAALC correlava con un’inferiore percentuale di RC e con
una ridotta sopravvivenza. Rispetto ai pazienti con
bassa espressione di BAALC alla diagnosi, quelli con elevata espressione erano più frequentemente resistenti alla chemioterapia di induzione (16%
vs 6%) e presentavano una maggiore mortalità nei
tre anni di follow-up (64% vs 56%). Le osservazioni di Baldus sono state confermate da Langer
in 172 pazienti affetti da LMA con cariotipo normale ed età <60 anni (59). Nell’analisi multivariata l’elevata espressione di BAALC correlava con
ridotta percentuale di RC e una sopravvivenza più
breve indipendentemente da FLT3-ITD, NPM1,
CEBPA e conta dei leucociti alla diagnosi. In particolare elevate espressioni di tale gene si rinvengono in pazienti che già presentano fattori prognostici negativi, come il cariotipo sfavorevole, FLT3ITD, NPM1 wild-type o elevata espressione di
ERG.
BAALC potrebbe rappresentare, pertanto, un indicatore generale della presenza di alterazioni sfavorevoli. Rappresenterebbe quindi non un fattore
prognostico autonomo, ma un mero indicatore di
particolare instabilità genica della cellula staminale leucemica. Contraddittori sono, infatti, i risultati che si ottengono quando si analizza il valore prognostico di BAALC in coorti di pazienti che, per
altri marcatori, vengono considerati a basso
rischio.
Esperienze condotte su pazienti a cariotipo favorevole o NPM1 mutati, FLT3-ITD negativi non
dimostrano alcun valore prognostico per i livelli di
Profilo genetico
espressione di BAALC. D’altro canto quando si
analizzano i profili genici di LMA ad alto rischio, il
gene BAALC risulta sempre overespresso. In particolare, poi, essendo BAALC marcatore molecolare specifico di cellule emopoietiche alquanto indifferenziate, la sua overespressione si associa a
LMA a fenotipo immaturo (60-62).
MN1
Il gene meningioma 1 (MN1) è localizzato sul cromosoma 22q12. Codifica per una proteina membro di un complesso regolatorio trascrizionale
associato con il recettore nucleare RAR-RXR o
con il recettore della vitamina D. Il coinvolgimento di MN1 nelle neoplasie umane è stato descritto per la prima volta in un meningioma che presentava la traslocazione cromosomica t(12;22).
Recentemente è stata descritta overespressione
di MN1 in LMA che presentavano inv-16.
In un’altra segnalazione MN1 rappresentava il partner di fusione di ETV6 nel gene chimerico derivante dalla t(12;22 ).
Parimenti in modelli murini è stata dimostrata la
cooperazione fra MN1 e CBFB-MYH11 nei processi di leucemogenesi. In generale, sebbene non
sia ancora nota la precisa funzione di MN1 nei processi di oncogenesi, pare dimostrato il fatto che
alti livelli di MN1 alla diagnosi connotino un gruppo di LMA a cattiva prognosi. Anche in questi casi,
in mancanza di standardizzazione del metodo,
l’analisi statistica è stata condotta per percentili.
In particolare è stato rilevato come i percentili di
maggiore espressione siano associati a bassa incidenza di NPM1 mutato e alta incidenza di elevati valori di espressione di BAALC. A tal riguardo,
considerata la stretta corrispondenza fra elevata
espressione di MN1 e di BAALC, si è valutato,
recentemente, il profilo di espressione di microRNA
nei due distinti gruppi di pazienti e si è mostrato
come fossero presenti profili di espressione del tutto similari. Si può pertanto ipotizzare una cooperazione fra BAALC e MN1 nei processi di leucemogenesi. I prossimi sviluppi tenderanno ad
identificare i possibili partner di questi due geni e
le vie geniche ad essi correlati (63-67).
EVI1
Il gene ecotropic virus integration-1 mappa sul cromosoma 3q26. Alterazioni cromosomiche coinvol-
genti tale locus come la t(3;3)(q21;q26) o la
inv3(q21;q26) che inevitabilmente alterano
l’espressione di EVI1 sono implicate nello sviluppo di LMA ad alto rischio. La overespressione di
EVI1, presente in circa il 6% dei casi, rappresenta un fattore prognostico negativo anche in
assenza di alterazioni coinvolgenti il cromosoma
3. In realtà esistono varie isoforme di EVI1, tutte
sono legate a diversità strutturali della zona 5’ non
codificante e per tutte probabilmente l’overespressione costituisce un fattore di rischio. La overespressione di una isoforma in particolare, denominata EVI1-1D, presente in circa il 2% dei casi,
riveste significato prognostico particolarmente
negativo.
Un discorso a parte va fatto sulla frequente presenza nelle cellule di LMA del gene di fusione fra
EVI1 e il gene MDS1 (ME). Tale gene mappa 140
kb a valle di EVI1, ha funzione sconosciuta, e per
un probabile meccanismo di splicing intergenico
si trova giustapposto a EVI1. Esistono a questo
riguardo due forme distinte di LMA, quelle
EVI1+ME+ e quelle EVI1+ME-.
Queste ultime spesso presentano alterazioni del
cromosoma 3q26, anche solo in forma criptica.
Tale alterazione cromosomica, come noto, si associa ad una forma particolarmente aggressiva di
LMA. La forma EVI1+ME+ d’altro canto si associa
spesso ad alterazioni del cromosoma 11q23, locus
dove mappa MLL, suggerendo un possibile ruolo regolatorio di quest’ultimo sulla espressione di
EVI1 e di ME.
Va ancora ricordato che le fisiologiche cellule
CD34+ presentano alti livelli sia di EVI1 che di ME.
Pertanto da un lato la overespressione del primo
identifica un fenotipo LMA immaturo, dall’altro la
mancata espressione del secondo conferisce
caratteristiche di aggressività particolarmente
elevate (68-74).
n SIGNIFICATO PROGNOSTICO
DELLE MUTAZIONI GENICHE:
Per quanto concerne il loro contributo alla leucemogenesi le mutazioni geniche possono essere
ordinate in alcuni gruppi.
Mutazioni che interferiscono con la trascrizione.
Si tratta di mutazioni che modificano la funzione
11
12
Seminari di Ematologia Oncologica
di fattori di trascrizione o interferiscono indirettamente con la trascrizione (75) e determinano alterazioni nel processo di differenziazione e/o l’acquisizione di aberranti proprietà di self-renewal dei
progenitori emopoietici. Appartengono a questa
classe i geni di fusione derivanti dalle mutazioni
t(8;21), inv(16)/t(16;16), t(15;17) e le mutazioni nei
geni CEBPA, MLL e RUNX1.
Mutazioni di attivazione. Sono mutazioni che attivano vie di trasduzione del segnale, determinando un aumento della proliferazione o della sopravvivenza dei precursori leucemici. Appartengono a
questa classe le mutazioni di FLT3, di RAS e di
JAK2.
Mutazioni che interferiscono con il ciclo cellulare e l’apoptosi. Sono rappresentate principalmente dalle mutazioni di NPM1 e da delezioni di TP53.
Le mutazioni somatiche più frequentemente rilevate in pazienti affetti da LMA con cariotipo normale interessano i seguenti geni: NPM1, FLT3,
CEBPA, MLL, RAS, WT1, RUNX1. Da segnalare
però che queste mutazioni possono essere presenti anche in pazienti con cariotipo anomalo.
Mutazioni in NPM1
Nel 2005 il gruppo di Falini ha dimostrato che in
una porzione significativa di pazienti con LMA si
osserva una delocalizzazione citoplasmatica della proteina NPM1 a causa di una mutazione somatica del gene NPM1. Il gene è localizzato nel cromosoma 5q35 ed è frequentemente traslocato o
mutato in malattie oncoematologiche (76). Il gene
codifica per una proteina chaperon presente in elevate concentrazioni nel nucleolo che svolge
importanti funzioni quali il trasporto di sostanze tra
nucleo e citoplasma, la promozione della genesi
ribosomiale, il controllo della duplicazione del centrosoma durante il ciclo cellulare, la regolazione
di geni oncosoppressori come p53 e p14ARF e l’attivazione dell’apoptosi a seguito di danni subiti dal
patrimonio genetico cellulare. Le diverse funzioni
di NPM1 sono determinate da vari domain proteici. Si può comprendere che le alterazioni del
gene suddetto siano coinvolte nella patogenesi di
diversi disordini ematopoietici, anche se non sono
sufficienti per determinare la malattia, ma devono cooperare con altri fattori.
Nelle cellule leucemiche di pazienti affetti da LMA
sono stati osservati più di 40 tipi diversi di muta-
zioni, che consistono principalmente di inserzioni di paia di basi (77).
La comune conseguenza di tali mutazioni è la perdita di un triptofano necessario per il legame con
il nucleolo e la generazione di nuclear export signal
motif per cui la proteina perde la sua specificità
per il nucleolo e si accumula nel citoplasma (78).
L’aberrante rilocalizzazione citoplasmatica inibisce
la sua normale funzione di shuttle fra il nucleo ed
il citoplasma, che è essenziale per la sua partecipazione a certe tumor suppressor pathway (ARF,
p53). I meccanismi leucemogenetici delle mutazioni NPM1 non sono pienamente compresi in
quanto la proteina NPM1 è coinvolta in altri processi cellulari, come la regolazione della funzione del centrosoma o il processing di molecole di
pre-RNA (78).
Le mutazioni del gene della NPM1 sono state trovate in circa il 35% dei pazienti adulti affetti da LMA
e nel 60% di coloro che presentano alla diagnosi un cariotipo normale (76, 78). Queste sono presenti più frequentemente in pazienti di sesso femminile, con un’elevata conta leucocitaria e importante blastosi midollare. L’analisi immunofenotipica di questi pazienti dimostra l’assenza dei tipici
marcatori delle cellule staminali emopoietiche
(CD34 e CD133) e la presenza di altri marcatori
mieloidi (CD13 e CD33). Le AML con NPM1 mutata appartengono a tutti i sottotipi FAB eccetto che
alla M3, con frequenza bassa nelle M2(20%) e più
alta nelle M4(45%) e M5b (90%).
L’espressione di NPM1 mutata alla diagnosi è stata associata in molti studi ad una prognosi favorevole (79-82). In un recente studio (83) i pazienti NPM1 mutati presentavano rispetto a quelli non
mutati una maggiore percentuale di RC dopo terapia di induzione (80% vs 57%), più lunga sopravvivenza libera da eventi avversi (EFS) e sopravvivenza totale (OS). Altri studi non hanno potuto
dimostrare questi effetti favorevoli.
Circa il 40% dei pazienti con mutazioni di NPM1
è portatore anche di mutazioni a carico di FLT3
(più spesso FLT3 ITD). Numerosi studi hanno
dimostrato che il genotipo NPM1 mutato senza
FLT3 ITD rappresenta un marker prognostico favorevole (84, 85). Il lavoro più importante è quello
di Schlenk et al. (85) che riporta i risultati del gruppo tedesco ed austriaco per la LMA (AMLSG). Il
lavoro suggerisce che i pazienti con questo feno-
Profilo genetico
tipo possono essere esentati dal trapianto allogenico in prima RC, dato che l’outcome dopo trapianto allogenico non è stato superiore a quello dopo
chemioterapia convenzionale di consolidamento.
Il ruolo del trapianto allogenico nei pazienti LMA
con NPM1 mutato e concomitante FLT3-ITD rimane controverso (86). Circa il 15% dei pazienti LMA
con NPM1-mutato presenta alterazioni cromosomiche, che rappresentano probabilmente eventi
secondari. In uno studio recente volto a stabilire
il significato prognostico di queste anomalie
genetiche addizionali è stato riscontrato che nelle LMA con NPM mutato la prognosi non è influenzata dal cariotipo (87).
Il riscontro di questo marcatore molecolare è
importante, inoltre, per valutare la risposta alla terapia (ottenimento di RC) e la malattia residua essendo espresso da tutte le cellule leucemiche (88-90).
Mutazioni di FLT3
Il gene FLT3 codifica per un recettore emopoietico ad attività tirosino chinasica che viene espresso precocemente dai progenitori emopoietici e gioca un ruolo importante nella proliferazione delle
cellule staminali emopoietiche, nella loro differenziazione e sopravvivenza. Analizzando il DNA delle cellule leucemiche è stato evidenziato che le
mutazioni somatiche che inducono un’attivazione
costitutiva di FLT3 interessano principalmente due
domini funzionali del recettore, quello iuxtamembrana (JM) e l’activation loop del domain tirosin
chinasico (TKD). Il dominio JM, cruciale per l’auto inibizione del recettore, è interessato da mutazioni nel 28-34% dei pazienti LMA con CN (9194), più spesso per Internal Tandem Duplication
(ITD), più raramente per mutazioni somatiche. Le
FLT3-ITD sono localizzate negli esoni 14 e 15 e
determinano una dimerizzazione ed autofosforilazione ligando-indipendente del recettore con attivazione downstream delle vie metaboliche
RAS/MAPK, STAT5, PI3K/AKT (95).
L’activation loop del domain tirosin chinasico è interessato da mutazioni puntiformi, piccole inserzioni o delezioni nell’11-14% delle LMA con cariotipo normale, più spesso a carico dell’esone 20 (93,
94, 96). Da un punto di vista clinico le mutazioni
di FLT3 sono importanti sia per i risvolti prognostici sia per il ruolo che potrebbero svolgere come
target di future terapie citotossiche.
Numerosi studi hanno dimostrato che i pazienti
affetti da LMA con CN e FLT3-ITD hanno una prognosi peggiore (<EFS e OS) rispetto ai soggetti
che non presentano questa mutazione (91).
Queste mutazioni hanno un ruolo prognostico
dominante rispetto ad altri marcatori molecolari.
Ad esempio la già citata mutazione di NPM1 è un
fattore prognostico positivo, ma solo nei pazienti
senza FLT3-ITD (97, 98).
Nello studio di Donher del 2005 (99) si dimostra
che il gruppo di pazienti con NPM1mut/FLT3-ITDneg
a 110 mesi di follow-up ha il 25% di sopravviventi senza ricaduta e pazienti vivi in più rispetto a
quello composto da pazienti NPM1mut/FLT3-TDpos.
Questi risultati sono stati confermati da Boonthimat
nel 2008 in uno studio condotto su 105 pazienti
(100).
FLT3-ITDs sono state osservate nel 76% di 55
pazienti con LMA e t(6;9)(p23;q34), traslocazione considerata a cattiva prognosi. Paragonati ai
pazienti con FLT3 wild-type i pazienti con FLT3ITD presentavano una ridotta percentuale di RC
(36% vs 75%, p 0.042) e inferiore DFS e OS. La
prognosi negativa dei pazienti con questa alterazione citogenetica deriva quindi non soltanto dalla presenza del gene di fusione DEK-NUP214 ma
anche dalla presenza di mutazioni FLT3. Alcune
ricerche sembrano indicare che non tanto la semplice presenza ma piuttosto il livello quantitativo
dell’allele mutato abbia rilevanza prognostica. In
uno studio del 2001 Whitman et al. (92) dimostrano che FLT3-ITD non ha impatto prognostico negativo nei pazienti eterozigoti, ma solo in quelli con
perdita di funzione dell’allele wild-type ed in uno
studio successivo Thiede et al. (94) riesce a determinare dei valori di cut off dell’allele mutante con
significato prognostico. Il gruppo di pazienti con
genotipo NPM1mut/FLT3- ITDneg e cariotipo normale è quello collegato alla migliore prognosi assoluta, e sembra non beneficiare del trapianto (85).
Il valore prognostico delle mutazioni FLT3-TKD
rimane controverso. Un’ampia meta-analisi condotta su 1.150 casi di LMA (FLT3 wt 833; FLT3ITD 243; FLT3-TKD 84) ha assegnato un valore
prognostico negativo alla mutazione FLT3-TKD
(101). Anche Whitman (102) in uno studio del
CALGB ha confermato in 139 pazienti con età <60
anni e cariotipo normale in analisi multivariata il
loro valore prognostico negativo (per EFS), indi-
13
14
Seminari di Ematologia Oncologica
pendentemente dall’espressione di NPM1 e dalla conta dei blasti alla diagnosi.
Viceversa uno studio condotto dall’MRC su 1.107
giovani adulti arruolati nei trials AML10 e 12 ha
evidenziato un possibile ruolo prognostico positivo delle mutazioni FLT3-TKD (presenti nel 12%
di tutte le AML e nell’11% di quelli a cariotipo normale) (103).
In questo studio è stata effettuata una valutazione quantitativa percentuale dei livelli di allele mutato ed i pazienti con mutazioni FLT3-TKD presenti in più del 25% degli alleli totali presentavano
un’OS superiore rispetto ai pazienti con livelli inferiori. In questo studio l’impatto delle mutazioni
FLT3-TKD nei pazienti con cariotipo normale era
al limite della significatività statistica e non è stata effettuata un’analisi multivariata considerando
altre mutazioni genetiche (come NPM1). Nel recente ampio studio di Bacher et al. (104), condotto
su una coorte totale di 1.720 casi con informazioni di follow-up disponibili, la prognosi non era
influenzata dalla presenza di mutazioni FLT3- TKD.
Mutazioni di CEBPA
Il fattore trascrizionale CCAAT/enhancer binding
protein alpha (CEBPA) è una molecola chiave nella differenziazione della cellula staminale multipotente nei neutrofili maturi (105).
Le mutazioni del gene CEBPA sono state scoperte per la prima volta nel 2001 e sono osservate
più frequentemente nei pazienti con CN e in quelli con delezione 9q al di fuori di un cariotipo complesso. Sono riscontrabili nel 5-14% delle LMA, in
una percentuale quindi inferiore di pazienti rispetto ai marcatori precedentemente descritti. Nel gene
codificante per questa proteina, che si trova sul
cromosoma 19q13.1, sono stati riscontrati più frequentemente due tipi di mutazione: una mutazione nonsense nella regione N-terminale che impedisce l’espressione dell’intera proteina e un’altra
nella zona C-terminale che riduce la funzione di
trascrizione del DNA.
Le mutazioni di CEBPA sono state associate concordemente con un buon outcome, sia in pazienti con cariotipo intermedio (106, 107) sia in pazienti con CN (108) ed associate con maggior durata di EFS o OS. Queste mutazioni hanno un ruolo protettivo in quanto upregolano un fattore proapoptotico su cui agiscono i farmaci chemiotera-
pici. Wouters et al. (109) hanno studiato 598 casi
di LMA denovo, individuando 41 casi non ambigui di mutazione (6,9%). La maggior parte dei
pazienti aveva due mutazioni di CEBPA e questi
pazienti presentavano una migliore EFS e OS
rispetto ai pazienti con una sola mutazione e persistenza di CEBPA wild-type. I casi con doppia
mutazione presentavano anche un pattern caratteristico negli studi GEP. La spiegazione biologica di questa duplicità di comportamento non è
chiara: è possibile che due mutazioni siano sufficienti per la leucemogenesi, mentre con una sola
debbano intervenire altri fattori determinanti una
prognosi peggiore.
L’impatto favorevole sulla prognosi delle mutazioni di CEBPA è osservato solamente in assenza
di cariotipo complesso e di FLT3-ITD. Nella revisione condotta da Renneville (110) i 638 pazienti affetti da LMA con mutazioni CEBPA vennero
divisi in due gruppi, uno (8%) costituito da soggetti che presentavano la mutazione di CEBPA e
l’altro da quelli che non la presentavano (CEBPAwt).
Il 20% dei pazienti del primo gruppo presentava
FLT3-ITD e il 30% un cariotipo complesso. Egli
dimostrò con un’analisi multivariata che questi ultimi fattori determinavano una cattiva prognosi indipendentemente dalla presenza di CEBPAmut.
Viceversa i pazienti con CEBPAmut senza FLT3-ITD
e con CN presentavano EFS e OS maggiori rispetto ai pazienti con CEBPAwt.
Mutazioni di MLL
Il gene MLL è situato alla banda 11q23 e codifica per una proteina di circa 450 KDa con attività
istone metil transferasica, che regola l’espressione dei geni HOX durante lo sviluppo delle cellule
staminali ematopoietiche (111). A seguito di traslocazioni o, meno frequentemente, inserzioni e
inversioni coinvolgenti la banda 11q23 la porzione N-terminale del gene MLL è fusa con la porzione C-terminale di un gene partner di fusione.
Questi riarrangamenti intercromosomici interferiscono con la regolazione operata da MLL nella trascrizione e con l’espressione del gene HOX (112).
In aggiunta a questi riarrangiamenti cromosomici esistono dei riarrangiamenti intragenici per cui
il gene MLL può andare in contro a partial tandem
duplications (PTD) a carico degli esoni 5-12. Sono
in genere intepretate come mutazioni con incre-
Profilo genetico
mento di funzione. PTD del gene MLL si osservano nel 5-11% dei pazienti affetti da LMA de novo
(113-115). Nel primo grande studio in pazienti LMA
con CN (113) i pazienti con MLL-PTD (11%) presentavano una minore durata della RC rispetto ai
pazienti senza MLL-PTD (7 mesi vs 23 mesi,
rispettivamente; p .01) mentre l’OS non era
diversa. La gran parte degli studi successivi, tra
cui lo studio di Dohner su 221 pazienti LMA con
CN, ha confermato questi risultati (114-116).
Mutazioni di NRAS
Si osservano nel 9-14% dei giovani adulti con LMA
e CN (84, 117, 118) ed interessano quasi esclusivamente i codoni 12,13 e 61, determinando una
perdita dell’attività GTP-asica ed un’attivazione
costitutiva della proteina RAS. Nessun studio ha
dimostrato rilevanza prognostica per queste mutazioni (84, 118), che tuttavia potrebbero essere
importanti come bersaglio di terapia orientata da
un punto di vista molecolare.
Mutazioni di WT1
Le mutazioni di WT1 consistono in sostituzioni o
delezioni dell’esone 7 o 9 che annullano le sue funzioni promuovendo la proliferazione e il blocco della differenziazione delle cellula staminali. Mutazioni
di WT1 si ritrovano in circa il 12% dei pazienti affetti da LMA, più spesso di giovane età, con elevata
blastosi periferica ed elevati livelli serici di LDH.
Sono state riportate per la prima volta da KingUnderwood e Pritchard-Jones nel 1996 (119).
Il ruolo di WT1mut nel determinare la prognosi è
ancora controverso. Summers nel 2007 dimostrò
in 70 pazienti con LMA e CN che queste mutazioni (presenti nell’11% dei pazienti) erano associate al fallimento della terapia di induzione (120).
In modo simile Virappane et al., analizzando 470
pazienti affetti da LMA (121) afferma che le mutazioni di WT1 sono un indicatore prognostico negativo indipendente da FLT3-ITD. I pazienti che esprimono WT1mut hanno una ridotta percentuale di RC
rispetto a quelli che hanno WT1 normale (79% vs
90%), di sopravvivenza libera da eventi avversi
(22% vs 44%) e di sopravvivenza a 5 anni (26%
vs 47%). Nel recente lavoro di Paschka (122) dei
196 pazienti affetti da LMA con CN i 21 che presentavano WT1mut avevano una percentuale di RC
simile a quella del gruppo con WT1nor (83% vs
84%), ma andavano in contro a ricaduta più frequentemente (88% vs 51%). Il rischio di morire si
è rivelato tre volte superiore nei soggetti con
WT1mut rispetto a quelli senza la mutazione. Lo
stesso autore, con un’analisi multivariata, ha dimostrato che l’impatto della mutazione di WT1 sulla
prognosi è indipendente dall’espressione di altri
marcatori molecolari prognostici a dalle caratteristiche cliniche alla diagnosi e che WT1mut annulla l’effetto positivo della presenza di mutazioni a
carico di NPM1, in assenza di FLT3-ITD.
Nel lavoro di Gaidzik et al. (123) condotto su 617
pazienti LMA con CN i soggetti WT1mut /FLT3ITDpos presentavano una percentuale di RC inferiore rispetto a quelli WT1mut/FLT3neg (CR rates 63%
vs 92%) ma non erano dimostrate differenze significative di RFS e OS fra i pazienti con o senza
mutazioni WT1.
Mutazioni in RUNX1 (AML1)
RUNX1 codifica per un fattore trascrizionale che
è coinvolto nella differenziazione emopoietica normale, attraverso la dimerizzazione con il fattore di
trascrizione CBFB. Sia RUNX1 sia CBFB sono
coinvolte nelle traslocazioni cromosomiche associate ad AML. Mutazioni di RUNX1 sono state
recentemente osservate nel 10% dei pazienti con
CN (124). Il loro significato prognostico è ancora
sconosciuto.
Mutazioni di KIT nelle CBF LMA
Le leucemie CBF sono definite dalla presenza delle traslocazioni t(8;21)(q22;q22) o inv(16)(p13.1
q22)/t(16;16)(p13.1;q22) e rappresentano circa il
10-15% delle LMA. Sono associate con outcome
favorevole anche se esiste una marcata eterogeneità clinica in quanto il 30-40% dei pazienti giovani ricade.
In questi pazienti è stato studiato il significato prognostico di mutazioni del gene KIT, presenti nel
30% dei casi (125, 126). Per quanto concerne le
LMA con t(8;21) la presenza di mutazioni nel gene
KIT (in particolare le mutazioni al codone 817) hanno significato prognostico negativo (125). Uno studio del CALGB in paziente con inv(16) / t(16;16)
ha mostrato che i pazienti con mutazioni di KIT a
carico dell’esone 17 presentavano un maggior
rischio cumulativo di ricaduta e una minore OS
(126).
15
16
Seminari di Ematologia Oncologica
n UTILIZZO PRATICO
DEI MARCATORI
CITOGENETICO-MOLECOLARI
Nella fase diagnostica iniziale, come già ricordato in precedenza, lo studio del cariotipo è stato
affiancato da una gran numero di indagini molecolari. Le ricadute sulla definizione prognostica e
sulla programmazione terapeutica vengono didatticamente esposte di seguito attraverso la risposta ad alcune domande fondamentali.
Si può fare a meno
dello studio citogenetico alla diagnosi?
La risposta non può che essere negativa. Al
momento attuale lo studio del cariotipo ci fornisce
delle informazioni prognostiche di grande rilevanza che hanno ricevuto conferma in numerosi studi prospettici. Inoltre permette di evidenziare la forma M3 che richiede una condotta terapeutica del
tutto differente e ormai ampiamente sperimentata (127) e le cosiddette leucemie CBF, cioè le forme con t(8;21), l’inv(16); t(16;16), caratterizzate da
una prognosi favorevole, per cui è opportuno effettuare un consolidamento fondato su alte dosi di
Ara-C (HDAC) ed in cui non è indicato effettuare
trapianto allogenico in prima RC.
Il significato prognostico di alcuni marcatori molecolari dipende poi dal tipo di cariotipo presente.
Ad esempio la presenza di alterazioni FLT3-ITD
sembra avere rilevanza prognostica per quanto
concerne DFS e forse OS nei pazienti con CN ma
non nelle forme con t(15;17) (128).
È molto importante essere certi che un paziente
con LMA abbia un cariotipo normale. Per questo
motivo è opportuno che le indagini di citogenetica
siano effettuate da esperti e che le metodiche classiche siano integrate dalla FISH e dalle tecniche
di RT-PCR per documentare la presenza dei principali geni di fusioni associati con alcune anomalie citogenetiche (84, 129). Esiste infatti la possibilità, rara, di inserzioni criptiche di piccoli frammenti cromosomici non evidenziabili dalla citogenetica.
Qual è la combinazione minima
di marcatori citogenetico-molecolari
con il maggior significato prognostico?
Numerosi studi, retrospettivi e prospettici hanno
cercato di rispondere a questa domanda.
Nello studio italiano (83) sono stati caratterizzati
443 pazienti con meno di 60 anni di età che hanno ricevuto un trattamento uniforme, secondo il
protocollo GIMEMA LMA99P (pretrattamento con
idrossiurea, induzione con Ara-C, daunorubicina,
etoposide; consolidamento con Ara-C e daunorubicina; trapianto allogenico e autologo in rapporto alla disponibilità di un donatore). Correlavano
significativamente con il raggiungimento di una RC
il cariotipo (percentuale di RC del 92%, 67% e 39%
nei tre gruppi prognostici citogenetici, p=0.0001)
e le mutazioni di NPM1 (percentuale di RC del
76% e del 60% nella popolazione globale per i
pazienti NPM1+ e NPM1-; RC 81% e 61% nei
pazienti con CN). L’analisi multivariata ha indicato che il cariotipo a basso rischio e la presenza
di mutazioni NPM1 erano fattori che indipendentemente correlavano con la probabilità di ottenere una RC. Le percentuali di DFS erano influenzate dal gruppo cariotipico e dalla presenza o
meno di mutazioni FLT3-ITD (26% e 61% nei
pazienti con o senza mutazioni FLT3-ITD) ma non
dallo stato mutazionale di NPM1. L’analisi multivariata per quanto concerne DFS ha evidenziato
il notevole impatto prognostico delle mutazioni
FLT3-ITD (p<0.001), del gruppo prognostico
cariotipico e del numero di globuli bianchi alla diagnosi
IL gruppo tedesco ha valutato l’incidenza e l’impatto prognostico di 5 geni (NPM1, FLT3, CEBPA, MLL e RAS) in 872 adulti con <60 anni e CN
arruolati in 4 trials prospettici (85). Tutti i trials prevedevano doppia terapia di induzione con idarubicina, Ara-C ed etoposide, un ciclo di consolidamento basato su HDAC ed un secondo consolidamento che prevedeva trapianto allogenico in presenza di donatore HLA matched o, a random, chemioterapia o trapianto autologo in assenza di donatore HLA identico.
Mutazioni di NPM1 sono state osservate nel 31%
dei pazienti, di FLT-ITD nel 31%, di FLT3-TKD
nell’11%, di CEBPA nel 13%, MLL partial tandem
duplications nel 7% e mutazioni di NRAS nel 13%.
Per quanto concerne l’ottenimento della RC, l’analisi multivariata ha evidenziato che la presenza di
mutazione di CEBPA, il fenotipo NPM1 mutato in
assenza di FLT3 ITD e l’età più giovane rappresentavano fattori favorevoli. I pazienti NPM1
mutati senza FLT3-ITD e quelli con mutazioni a
Profilo genetico
carico di CEBPA presentavano un RFS a 4 anni
statisticamente superiore rispetto ai pazienti con
altri genotipi (55% e 50% rispettivamente vs 16%;
p<0.001). Simili significative differenze sono state riscontrate per quanto riguarda l’OS.
Santamaria et al. (49) in 120 LMA denovo con CN
hanno studiato il significato prognostico delle
espressione di WT1 e delle mutazioni di FLT3 e
di NPM1 e di 9 altri markers molecolari (ERG,
EVI1, MLL-PTD, MN1, PRAME, RHAMM). Il livello di espressione di WT1 non è risultato significativo né per RFS né per OS, mentre è stato confermato per RFS (ma non per OS) il significato protettivo del fenotipo NPT mutato /FLT3 neg, anche
in multivariata. In analisi multivariata è risultato molto elevato il significato prognostico di ERG, EVI1
e PRAME. Assegnando un punteggio di 0 ai parametri molecolari favorevoli (bassa espressione di
ERG ed EVI1 ed elevata espressione di PRAME)
e di 1 ai parametri molecolari sfavorevoli (inverso
dei precedenti) gli autori hanno pertanto elaborato uno score prognostico in grado di stratificare i
pazienti in 4 gruppi prognostici per OS e RFS. Il
sistema prognostico è stato in grado di stratificare per OS e RFS anche gli 83 pazienti appartenenti al gruppo molecolare a rischio intermedioTipo di alterazione
Alter. espressione genica
>WT1
>ERG
>EVI1*
>EVI1/ME-**
>BAALC*
>MN1
Mutazioni geniche
NPM1§
FLT3ITD
FLT3-TKD
NPM1mut/FLT3ITDneg
MLL-PTD
CEBPA
CEBPAmut/FLT3ITDneg
RAS
WT1
RUNX1
alto sulla base di NPM1 ed FLT3 (FLT3wt/NPMwt;
FLT3-ITD/NPM1 mut; FLT3-ITD/NPMwt). In questa sottoanalisi le OS a 2 anni erano 100%, 64%,
39% e 27% per i pazienti con score di 0,1,2 e 3,
rispettivamente. La tabella 3 riassume l’impatto prognostico dei vari marcatori molecolari precedentemente analizzati.
In che modo i marcatori
citogenetico-molecolari influenzano
la terapia di induzione?
Nell’ambito delle LMA l’unica terapia di induzione
diversa, basata sull’associazione di antraciclina (in
genere idarubicina) e acido transretinoico (o sull’associazione di ATRA e triossido di arsenico) viene
riservata ai pazienti affetti da LMA-M3 e riarrangiamento PML-RARalfa.
È noto che le rare forme di LMA M3 con t(11;17)
e riarrangiamento PLZF-RARalfa non sono responsive ad ATRA (130). A parte il caso della LMA-M3
un recente contributo di Schlenk et al, derivante
da una analisi retrospettiva dei pazienti con più di
60 anni arruolati nel trial AMLHD98D del gruppo
austro-tedesco AMLSG, sembra indicare che
sono i pazienti con fenotipo NPMmut/FLT3 wt quelli che beneficiano dell’aggiunta di acido transreti-
Frequenza
CRrate
Impatto su DFS/EFS
OS
75-100%
5-10%
6-7%
3%
50%
40-50%
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
neg
60% CN
30%
15-18%
12-15%CN
10-12%
10%
5-6%
9-14%
12%
3-4% CN
pos
?
?
pos
neg
pos
pos
?
?
neg/?
pos
neg
?
pos
neg
pos
pos
?
?
neg
pos
neg
?
pos
?
pos
pos
?
?
?
*Associate a cariotipo sfavorevole e fenotipo immaturo; **associate ad alterazioni di 3q26; §associate a cariotipo normale CN = cariotipo normale.
TABELLA 3 - Significato prognostico delle principali alterazioni geniche.
17
18
Seminari di Ematologia Oncologica
noico alla terapia intensiva di induzione e al consolidamento (131). La probabile efficacia di ATRA
in questo sottogruppo di pazienti potrebbe dipendere dal fatto che NPM1mut si comporta come un
repressore della differenziazione cellulare indotta
dall’acido retinoico, per cui aumentando le dosi
disponibili nell’organismo si riesce a vincere questo blocco.
Uno studio prospettico del gruppo austro-tedesco,
attualmente in corso, è stato disegnato per confermare le osservazioni riportate nei pazienti con
età <60 anni.
In che modo i marcatori
citogenetica-molecolari influenzano
la terapia post-remissionale e come
si combinano con i fattori prognostici
clinico-ematologici?
Dopo l’ottenimento di una RC l’obbiettivo successivo è l’eradicazione della malattia residua minima, che può essere classicamente perseguito con
chemioterapia, trapianto autologo e trapianto
allogenico di cellule staminali emopoietiche. I vantaggi dell’opzione trapiantologica allogenica, legati all’effetto immunologico graft-versus-leukemia
con conseguente riduzione del rischio di ricaduta, sono controbilanciati dal significativo rischio di
mortalità e di mortalità legato alle complicanze del
trapianto (graft-versus-host disease ed infezioni)
(132). Per queste ragioni, già da molti anni il trapianto allogenico non viene effettuato in prima
remissione nei pazienti con un pattern citogenetico favorevole e cioè nei pazienti con t(8;21) o
inv(16)/t (16;16) (132, 133).
Nell’ambito dei pazienti con CN sono stati individuati due fenotipi relativamente favorevoli per elevata propensione a ottenere una RC e basso
rischio di ricaduta. Il primo fenotipo, che rappresenta circa il 16% di tutte le LMA nei pazienti <60
anni, è stato individuato grazie al lavoro del gruppo austro-tedesco. Nella già citata esperienza prospettica del gruppo tedesco (85) durante la terapia postremissionale un trapianto allogenico è stato effettuato in 150 pazienti (82% di quelli con
donatore HLA identico). Dei 481 pazienti senza
donatore 147 hanno effettuato chemioterapia e
334 sono stati trattati a random con trapianto autologo o chemioterapia. Non sono state osservate
differenze in Sopravvivenza Libera da Ricaduta
(RFS) e OS fra i pazienti trattati con chemioterapia o con trapianto autologo, sia in intention to treat sia sulla base del trattamento effettivamente ricevuto. Per le analisi successive sono stati quindi individuati due gruppi uniformi: il gruppo dei pazienti con donatore e quello senza donatore. Il relapse free survival dei pazienti con donatore HLA
identico (donor group) risultò superiore a quello
del gruppo di pazienti senza donatore (no donor
group) (p 0.009), senza però significative ricadute sulla sopravvivenza.
La mortalità correlata a trapianto (TRM) dei
pazienti sottoposti a trapianto allogenico è risultata essere del 20%. Al fine di comprendere per
quale sottogruppo molecolare di pazienti fosse
utile effettuare un trapianto allogenico sono stati analizzati separatamente i pazienti NPM1
mutati e FLT3ITD neg (n. 130) e quelli caratterizzati da altri genotipi, con esclusione di CEBPA (170 pazienti).
Nei pazienti con fenotipo NPM1 mutato e FLT3 ITD
neg il gruppo con donatore presentava una curva esattamente sovrapponibile a quella dei
pazienti senza donatore (RFS 53% circa per donor
e no donor). Viceversa nel gruppo con fenotipo
molecolare meno favorevole la presenza di un
donatore conferiva un vantaggio significativo
(RFS 32% e 10% nei gruppi donor e no donor,
rispettivamente; p=0.003).
Il secondo fenotipo favorevole, per cui non sembra indicato effettuare un trapianto allogenico in
prima RC, è definito dalla presenza di mutazioni
del gene CEBPA, in assenza di altre mutazioni sfavorevoli. Si osserva in circa l’8% delle LMA e nello studio del gruppo austro-tedesco il limitato
numero di casi non ha permesso un’analisi simile a quella che è stata effettuata per il fenotipo precedente.
Per tutti questi sottogruppi di pazienti la terapia
post-remissionale deve basarsi su HDAC ed il trapianto allogenico dovrebbe essere riservato a
pazienti in seconda RC.
Al contrario altri marcatori citogenetico-molecolari o altre combinazioni sembrano indicare l’assoluta necessità di effettuare un trapianto allogenico appena raggiunta la prima RC. Esempi di questi marcatori sono: le alterazioni citogenetiche sfavorevoli, elevata espressione di BAALC, FLT3-ITD,
NPMwt/FLT3-ITD.
Profilo genetico
Vi è assoluta necessità di programmare studi prospettici con la finalità di valutare nei singoli sottogruppi citogenetico-molecolari l’effettiva utilità del
trapianto allogenico. Inoltre la grande varietà di tipologie trapiantologiche, differenti fra loro per l’intensità del condizionamento e la fonte di cellule staminali (donatori familiari HLA identici, MUD, donatori aploidentici, cordone ombelicale), richiederà
verosimilmente una grande mole di ricerca per individuare il tipo di trapianto più adatto per ogni sottotipo citogenetico-molecolare (5).
Negli algoritmi decisionali per definire l’indicazione al trapianto allogenico trovano sempre più spazio alcuni marcatori molecolari (84; 129), soprattutto nei pazienti con CN.
La figura 1 rappresenta un tentativo provvisorio di
algoritmo decisionale terapeutico sulla base della valenza prognostica dei citati marcatori citogenetici e molecolari.
Negli ultimi anni l’attenzione della ricerca si è focalizzata sull’individuazione di marcatori citogenetici e molecolari ma non bisogna però dimentica-
Cariotipo favorevole
Cariotipo sfavorevole
Iter terapeutico specifico per la LAP t(15;17)
Induzione standard
t(8;21), inv(16), t(16)(16) consolidamento con HDAC
Consolidamento
trapianto allogenico in II RC
Trapianto allogenico
Cariotipo intermedio
FLT3-ITD
pos
CEBPA
mutato
FLT3-ITD
neg
NPM1
non mut
BAALC >
o EVI 1 >
o MN1 >
NPM1
mut
BAALC <
e EVI 1 <
e MN1 <
MLL
PTD pos
ERG >
ERG <
MLL
PTD neg
Trapianto allogenico in
Prima RC
FIGURA 1 - Algoritmo decisionale terapeutico sulla base del profilo citogenetico-molecolare.
HDAC
ASCT
19
20
Seminari di Ematologia Oncologica
re che da tempo sono stati individuati importanti
fattori prognostici di tipo clinico-ematologico, tra cui
ricordiamo soltanto l’età, il numero di globuli bianchi alla diagnosi, il valore dell’LDH, la presenza
di una precedente sindrome mielodisplastica o di
un’altra malattia ematologica, la presenza di una
precedente radio-chemioterapia, il tempo di raggiungimento della RC (dopo uno o due cicli di induzione). Il valore di questi indicatori prognostici è
oggi completamente tramontato oppure mantengono ancora valore?
Come è possibile eventualmente integrarli con la
citogenetica ed i markers molecolari in uno score prognostico composito? I gruppi HOVON
(Dutch Belgian Cooperative Group) e SAKK
(Swiss Leukemia Cooperative Group) hanno cercato di rispondere a queste domande analizzando i dati di 1975 pazienti fino a 60 anni di età,
registrati nei loro studi prospettici fino al 2004 (con
citogenetica) ed i dati di 424 pazienti in cui erano disponibili marcatori molecolari. Ne è derivato uno score di stratificazione prognostica in graRischio (% dei casi)
do di distinguere alcuni gruppi con differente outcome, riportato nella tabella 4.
n UTILIZZO DEI MARCATORI
MOLECOLARI NEL FOLLOW-UP
DEI PAZIENTI
Grandi speranze vanno riposte nella stratificazione prognostica dei pazienti e nella ricerca di una
terapia sempre più orientata in senso patogenetico. Un applicazione clinica in questo ambito non
è al momento pensabile.
Altro discorso va, invece, fatto per l’utilizzo di alcuni marcatori nella analisi della malattia minima residua (MMR) durante la remissione clinica comunque indotta.
Detti marcatori in generale sono da considerarsi
specifici della patologia in atto, evitando in tal modo
il verificarsi di risultati falsi positivi. Va poi detto che,
trattandosi di anomalie geniche o citogenetiche
coinvolte nella patogenesi di malattia, ci si può
attendere a tal riguardo un ruolo predittivo: cioè
RC%
EFS 5 aa
OS 5aa
94
94
93
84
100
51
59
44
48
51
65
68
68
61
57
Intermedio (20%)
IR1
t(8;21), GB >20
IR2
CN, -X, -Y GB ≤100
RC precoce
99
87
100
42
32
43
51
46
51
Sfavorevole (30%)
PR1
CN, -X, -Y GB ≤100
non RC precoce
PR2
CN, -X, -Y GB >100
RC precoce
PR3
CA, non CBF, non abn3q26
EVI1-
75
69
19
17
25
23
74
23
27
79
20
25
60
48
65
79
3
2
8
10
7
4
19
17
Buono (30%)
GR1
GR2
GR3
GR4
t(8;21), GB <20
inv(16)/t(16;16)
non MK, CEBPAmut
nonMK,
FLT3ITDneg/NPM1mut
RC precoce
Molto sfavorevole (20%)
VPR1 Monosomal karyotype
VPR2 abn3q26
VPR3 EVI1+
Modificato da ASH 2008, educational book, pag 7.
Legenda: MK = cariotipo monosomico: RC precoce = RC dopo un solo ciclo di induzione; CN = cariotipo normale; CA = cariotipo alterato
TABELLA 4 - Score prognostico HOVON/SAKK (<60 aa) basato su citogenetica, markers molecolari, fattori ematologici e clinici.
Profilo genetico
ciascun marcatore per essere realmente applicabile nello studio della MMR quando presente deve
predire il cambiamento dello stato clinico. In tal
caso possiamo parlare di predittività prognostica
e di conseguenza di assenza della possibilità di
risultati falsi negativi.
Va, poi, affrontata, una volta risolto il problema della specificità (predittività e coerenza con la patologia in esame) precedentemente accennato, la
ricerca della sensibilità metodologica appropriata. Certo che tutti i marcatori analizzabili in nestedPCR possono essere a tal fine adeguati. Ma è
altrettanto certo che la sensibilità raggiunta nello
studio in nested-PCR della presenza di una mutazione puntiforme non è certamente così elevata
da consentirne l’utilizzo routinario in clinica.
A ciò va aggiunto un discorso di applicabilità universale, e cioè la moderna biologia molecolare nella razionalizzazione dell’utilizzo delle risorse
richiede la ricerca di marcatori quanto più possibile universali.
La frequenza della presenza delle mutazioni in
generale ne esclude l’applicabilità come marcatori di MMR. Ed ancora la necessità di utilizzare
metodiche di elettroforesi complicate non è in
accordo con la necessità di potersi avvalere di
metodiche semplici e ripetibili. Infine in questo
ambito la quantificazione ne risulterebbe estremamente indaginosa. Nel caso, tuttavia, dell’esistenza di metodiche standardizzate di real-time-PCR
il discorso cambierebbe radicalmente. Si tratta di
metodica ripetibile, quanto meno nello stesso laboratorio, semplice ed applicabile contemporaneamente ad un buon numero di campioni in esame.
È il caso dello studio in real-time-PCR della presenza di mutazioni di NPM1. La presenza quantificabile dell’espressione dell’allele mutato predice ricaduta di malattia; la riduzione della sua quantità può essere utilizzato per valutare l’efficacia terapeutica.
Mutazioni di NPM1 sono presenti in una determinata percentuale di casi: vi è necessità di ulteriori marcatori ancor più universalmente applicabili.
Questo è il caso dell’espressione di Wt1. Come
noto Wt1 è overespresso alla diagnosi quasi nella totalità dei casi di LMA. Al di là del suo significato prognostico, come noto, ancora oggetto di
discussioni, ben chiaro è il suo significato nel follow-up del paziente.
La sua precoce diminuzione dopo la terapia di
induzione è indice di buona risposta alla terapia,
mentre l’aumento progressivo della sua espressione durante la fase di remissione predice ricaduta di malattia con un anticipo di tempo dal relapse clinico che, per esperienza personale, va dai
90 ai 60 giorni dalla prima evidenza di overespressione. Assolutamente necessario all’uopo, come
peraltro già segnalato, è la costruzione di una curva di valori normali.
Parleremo di overespressione ogniqualvolta il valore della espressione di Wt1 dovesse risultare superiore a detto range di normalità. Non noto, poi, è
il significato del gap di espressione che talvolta si
verifica all’interno dei valori di normalità. L’aumento
della espressione di Wt1 si associa alla ricomparsa più o meno precoce degli altri marcatori molecolari eventualmente presenti in una data LMA in
analisi. I tempi dipendono in parte dalla sensibilità della metodica utilizzata nell’analisi ed in parte verosimilmente a una non ben precisabile cinetica molecolare cellulare di ricaduta. Wt1, pertanto, al momento rappresenta il marcatore molecolare universale per le LMA; non vi è rischio di risultati falsi positivi o negativi, la sensibilità della metodica in oggetto è accettabile e la quantificazione
è relativamente agevole.
Attualmente si raccomanda di seguire il follow-up
di ciascun paziente con seriate analisi dell’espressione di Wt1 (generalmente su midollo; non esistono analisi su vasta scala dello studio seriato su
sangue periferico).
Il significato terapeutico del riscontro di impending
relapse rappresenta probabilmente uno dei prossimi passi che si faranno nella costruzione di una
terapia mirata e precoce, sulla scorta di quanto
già avvenuto nella gestione della ricaduta molecolare delle leucemie promielocitiche acute o della leucemia mieloide cronica.
n PROSPETTIVE TERAPEUTICHE
MIRATE SUL DIFETTO
MOLECOLARE
Come già ampiamente ricordato la risposta alla
terapia dipende principalmente dall’età dei pazienti e dal loro genotipo. Fino ad oggi è stata sviluppata una sola terapia specifica basata sull’appli-
21
22
Seminari di Ematologia Oncologica
cazione dell’acido transretinoico nei pazienti con
LMA-M3 e t(15;17) e ciò ha modificato in modo
radicale le prospettive terapeutiche, sia nei pazienti giovani sia in quelli più anziani. È possibile però
che lo sviluppo di terapie mirate in modo specifico al difetto genetico possano contribuire a
migliorare la tollerabilità e l’efficacia del trattamento in moltri altri sottotipi genetici di LMA. Tentiamo
qui di seguito di fare un rapido punto della situazione attuale.
Mutazioni di FLT3
L’elevata incidenza di mutazioni di FLT3 nei
pazienti con LMA ha stimolato la sperimentazione di numerosi inibitori di FLT3 (RTK). Sono stati sperimentati inibitori specifici per FLT3 (ad esempio tandutinib) ed inibitori meno specifici (SU5416;
sunutinib; SU11248).
Sebbene siano molto eterogenei per struttura chimica, farmacocinetica, profilo tossico tutti questi
farmaci sono in grado di ridurre la proliferazione
leucemica e di aumentare l’apoptosi, in seguito ad
upregolazione delle proteine proapoptotiche. In
monoterapia i risultati clinici sono stati piuttosto
modesti e transitori, per rapido sviluppo di resistenza (134-137).
Mutazioni di KIT
Il gene KIT codifica per un recettore ad attività tirosin chinasica che in caso di mutazione è attivato
in modo costitutivo. Si è gia precedentemente ricordato il significato prognostico negativo delle
mutazioni di KIT nelle leucemie CBF (mutazioni
presenti nel 40% dei pazienti). Lo sviluppo di farmaci mirati al cKIT è interessante in quanto lo stem
cell factor c-KIT 117 è espresso in più del 70%
delle LMA. Imatinib è in grado di inibire la funzione di KIT prevenendo la sua autofosforilazione e
inibendo il signaling a valle (mediato da MAPK e
AKT). I risultati degli studi in vitro e dei primi studi clinici in pazienti con LMA con mutazioni di KIT
sono contradditori.
Alcuni studi hanno mostrato un certo beneficio in
pazienti con LMA 117 pos, pur in assenza di documentate mutazioni di KIT (138, 139).
In uno studio su 40 pazienti anziani con LMA o
MDS ad alto rischio con blasti esprimenti c-KIT
(cioè positivi per CD117) l’associazione di basse
dosi di Ara-C e imatinib ha determinato una
sopravvivenza del 20% a due anni che è assolutamente paragonabile a quella ottenuta nei
pazienti sottoposti a chemioterapia intensiva
(140).
Sono iniziate le sperimentazioni in vitro e cliniche
con il dasatinib (141).
Mutazioni di NPM-1
La leptomicina B è un prodotto naturale che si lega
in modo covalente ed inibisce in modo irreversibile CRM1, il recettore di esportazione delle proteine contenenti NES (nuclear export signals) (142,
143). In vitro gli inibitori di CRM1 non sono però
in grado di redirigere la proteina NPM1 al nucleolo. Un altro problema della leptomicina e la sua
elevatissima tossicità, che non è affatto sorprendente, in quanto CRM1 media il trasferimento dal
nucleo al citoplasma di molte preteine e di molti
RNA, in cellule normali e neoplastiche. Sono in corso di sviluppo nuovi inibitori meno tossici di leptomicina (144).
Un approccio più razionale potrebbe essere lo sviluppo di piccole molecole finalizzate a ridirigere le
proteine delocalizzate al corretto compartimento
cellulare (il nucleolo, nel caso della proteina
NPM1). Un’alternativa terapeutica nelle LMA con
mutazioni NPM1 è interferire con la funzione del
gene NPM1 wild-type codificato dal normale allele (145). Il razionale per questo approccio è che
le mutazioni di NPM1 sono quasi sempre eterozigoti (146).
Ciò suggerisce che una certa quantità di proteina NPM1 wild-type è necessaria per la sopravvivenza delle cellule leucemiche. Ci sono evidenze
sperimentali su topi knock-out che la completa
delezione del gene NPM1 induca a morte durante l’embriogenesi (147).
È possibile ipotizzare che piccole molecole in grado di bloccare l’attività NPM1 residua (ad esempio alterando la struttura nucleolare e dislocando
la nucleofosmina nel nucleoplasma) possano
aumentare la propensione di queste cellule a morire o ad essere uccisa da farmaci chemioterapici.
Dato che le LMA con mutazione di NPM1 contengono molto meno NPM1wt nucleolare delle normali cellule emopoietiche, è possibile che bassi
dosaggi di queste molecole interferenti possano
eliminare selettivamente le cellule leucemiche,
risparmiando quelle normali (terapia selettiva).
Profilo genetico
Un’altra strategia potenziale è l’interferenza con
le alterazioni del traffico nucleo-citoplasmatico
indotte dalla mutazione NPM1. Ad esempio le
mutazioni di NPM1 dislocano HEXIM1 nel citoplasma e di conseguenza inducono un aumento della trascrizione P-TEFb-dipendente.
I farmaci capaci di inibire P-TEFb (come flavopiridolo e CYC202) potrebbero pertanto essere efficaci (148).
Mutazioni MLL e farmaci epigenetici
Whitman et al. (149) hanno dimostrato che il trascritto MLL wild-type non è espresso nei blasti
MLL-PTD e che una riattivazione dell’allele WT può
essere ottenuta con gli inibitori della DNA metiltransferasi (decitabina) e/o con gli inibitori dell’istone deacetilasi (depsipeptide).
Questo lavoro sembra aprire possibilità specifiche
di terapia con agenti demetilanti in questo sottogruppo di LMA a prognosi particolarmente sfavorevole. Un recente lavoro di Blum et al in 158
pazienti LMA ha dimostrato che la decitabina può
indurre risposte in circa il 40% di pazienti trattati
in ricaduta o alla diagnosi (150).
Potrebbe essere inoltre promettente la combinazione di agenti ipometilanti e inibitori dell’istone
deacetilasi (151).
Mutazioni di RAS
Una attivazione costitutiva della cascata di segnale mediata dalla mitogen-activated protein kinase (MAPK) è presente in un’elevata proporzione
di casi di LMA. Spesso l’attivazione è mediata da
mutazioni di RAS, presenti nel 15% delle LMA
(117).
Il legame delle proteine RAS alla membrana richiede alcune modifiche strutturali che sono catalizzate da enzimi specifici. L’inibizione di tali enzimi
indotta dagli inibitori della farnesiltransferasi (FTI)
è in grado di indurre apoptosi e riduzione della proliferazione (152).
Il tipifarnib è stato ampiamente sperimentato come
monoterapia nei pazienti con LMA, sia in pazienti ricaduti-refrattari (153-155) sia in pazienti anziani non pretrattati (156). Sono state osservate risposte (per lo più parziali) nel 20-30% dei pazienti.
Sembrano particolarmente interessanti le prospettive di associazione con altri farmaci, tra cui il bortezomib (15).
n BIBLIOGRAFIA
1. Lowenberg B, Downing JR, Burnett A. Acute myeloid
leukaemia. N Eng J Med. 1999; 341: 1051-62.
2. Bennet JM, Catowsky D, Daniel MT, Flandrin G,
Galton DA, Gralnick HR, et al. Proposals for the classification of acute myeloid leukaemia: a report of the
French-American-British Cooperative Group. Br J
Haematol. 1976; 33: 451-8.
3. Harris NL, Jaffe ES, Diebold J, Flandrin G, MullerHermelink HK, Vardiman J, et al. World Health
Organization classification of neoplastic diseases of the
hematopoietic and lymphoid tissues: report of the Clinical
Advisory Committee meeting-Airlie House, Virginia,
November 1997. J Clin Oncol. 1999; 17: 3835-49.
4. Vardiman JW, Harris NL, Brunning RD. The World
Health Organization (WHO) classification of the
myeloid neoplasms. Blood. 2002; 100: 2292-302.
5. Löwenberg B. Diagnosis and prognosis in acute
myeloid leukemia - the art of distinction. N Engl J Med.
2008; 358: 1960-2
6. Leith C, Kopecky K, Godwin J, McConnell T, Slovak
ML, Chen IM, et al. Acute myeloid leucemia in the elderly: assessment of multidrug resistance (MDR1) and
cytogenetics distinguishes biologic subgroups with
remarkably distinct responses to standard chemotherapy. A Southwest Oncology Group study. Blood. 1997;
89: 3323-9.
7. Mrozek K, Heinonen K, de la Chapelle A, Bloomfield
CD. Clinical significance of cytogenetics in acute
myeloid leukemia. Semin Oncol. 1997; 24: 17-31.
8. Grimwade D, Walker H, Oliver F, Wheatley K,
Harrison C, Harrison G, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of
1,612 patients entered into the MRC AML 10 trial.
Blood. 1998; 7: 2322-333.
9. Slovak ML, Kopecky KJ, Cassileth PA, Harrington DH,
Theil KS, Mohamed A, et al. Karyotypic analysis predicts outcome of preremission and postremission therapy in adult acute myeloid leukemia: a Southwest
Oncology Group/Eastern Cooperative Oncology
Group study. Blood. 2000; 96: 4075-83.
10. Byrd JC, Mrózek K, Dodge RK, Carroll AJ, Edwards
CG, Arthur DC, et al. Pretreatment cytogenetic
abnormalities are predictive of induction success,
cumulative incidence of relapse, and overall survival
in adult patients with de novo acute myeloid leukemia:
results from Cancer and Leukemia Group B (CALGB
8461). Blood. 2002; 100: 4325-36.
11. Mrózek K, Heerema NA, Bloomfield CD. Cytogenetics
in acute leukemia. Blood Rev. 2004; 18: 115-7.
12. Breems DA, Van Putten WL, De Greef GE, Van
Zelderen-Bhola SL, Gerssen-Schoorl KB, Mellink CH,
et al. Monosomal karyotype in acute myeloid leukemia:
a better indicator of poor prognosis than a complex
karyotype. J Clin Oncol. 2008; 26: 4791.
13. Schoch C, Kohlmann A, Schnittger S, Brors B, Dugas
23
24
Seminari di Ematologia Oncologica
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
M, Mergenthaler S, et al. Acute myeloid leukemias with
reciprocal rearrangements can be distinguished by
specific gene expression profiles. Proc Natl Acad Sci
USA. 2002; 99: 10008-13.
Vey N, Mozziconacci MJ, Groulet-Martinec A, Debono
S, Finetti P, Carbuccia N, et al. Identification of new
classes among acute myelogenous leukaemias with
normal karyotype using gene expression profiling.
Oncogene. 2004; 23: 9381-91.
Debernardi S, Lillington DM, Chaplin T, Tomlinson S,
Amess J, Rohatiner A, et al. Genome-wide analysis
of acute myeloid leukemia with normal karyotype
reveals a unique pattern of homeobox gene expression distinct from those with translocation-mediated
fusion events. Genes Chromosomes Cancer. 2003;
37: 149-58.
Virtaneva K, Wright FA, Tanner SM, Yuan B, Lemon
WJ, Caligiuri MA, et al. Expression profiling reveals
fundamental biological differences in acute myeloid
leukemia with isolated trisomy 8 and normal cytogenetics. Proc Natl Acad Sci USA. 2001; 98: 1124-9.
Bullinger L, Dohner K, Bair E, Fröhling S, Schlenk RF,
Tibshirani R, et al. Use of gene-expression profiling
to identify prognostic subclasses in adult acute
myeloid leukemia. N Engl J Med. 2004; 350: 1605-16.
Valk PJ, Verhaak RG, Beijen MA, Erpelinck CA,
Barjesteh van Waalwijk van Doorn-Khosrovani S, Boer
JM, et al. Prognostically useful gene-expression profiles in acute myeloid leukemia. N Engl J Med. 2004;
350: 1617-28.
Ross ME, Mahfouz R, Onciu M, Liu HC, Zhou X, Song
G, et al. Gene expression profiling of pediatric acute
myelogenous leukemia. Blood. 2004; 104: 3679-87.
Wouters BJ, Alberich Jordà M, Keeshan K, Louwers
I, Erpelinck-Verschueren CA, Tielemans D, et al.
Distinct gene expression profiles of acute myeloid/Tlymphoid leukemia with silenced CEBPA and mutations in NOTCH1. Blood. 2007; 110: 3706-14.
Garzon R, Garofalo M, Martelli MP, Briesewitz R,
Wang L, Fernandez-Cymering C, et al. Distinctive
microRNA signature of acute myeloid leukemia bearing cytoplasmic mutated nucleophosmin. Proc Natl
Acad Sci USA. 2008; 105: 3945-50.
Garzon R, Volinia S, Liu CG, Fernandez-Cymering C,
Palumbo T, Pichiorri F, et al. MicroRNA signatures
associated with cytogenetics and prognosis in acute
myeloid leukemia. Blood. 2008; 111: 3183-9.
Jongen-Lavrencic M, Sun SM, Dijkstra MK, Valk PJ,
Löwenberg B. MicroRNA expression profiling in relation to the genetic heterogeneity of acute myeloid
leukemia. Blood. 2008; 111: 5078-5.
Alcalay M, Tiacci, Bergomas R, Bigerna B, Venturini
E, Minardi SP, et al. Acute myeloid leukemia bearing
cytoplasmic nucleophosmin (NPMc+ AML) shows a
distinct gene expression profile characterized by upregulation of genes involved in stem-cell maintenance.
Blood. 2005; 106: 899-902.
25. Marcucci G, Radmacher MD, Maharry K, Mrózek K,
Ruppert AS, Paschka P, et al. MicroRNA expression
in cytogenetically normal acute myeloid leukemia, N
Engl J Med. 2008; 358: 1919-28.
26. Rucker FG, Bullinger L, Schwaenen C, Lipka DB,
Wessendorf S, Fröhling S, et al. Disclosure of candidate genes in acute myeloid leukemia with complex
karyotypes using microarray-based molecular characterization. J Clin Oncol. 2006; 24: 3887-94.
27. Chen PM, Yen CC, Wang WS, Lin YJ, Chu CJ, Chiou
TJ, et al. Down-regulation of Notch-1 expression
decreases PU.1-mediated myeloid differentiation signaling in acute myeloid leukemia. Int J Oncol. 2008;
32: 1335-41.
28. Meyer S, Barber LM, White DJ, Will AM, Birch JM,
Kohler JA, et al. Spectrum and significance of variants and mutations in the Fanconi anaemia group G
gene in children with sporadic acute myeloid
leukaemia. Br J Haematol. 2006; 133: 284-92.
29. Lee JW, Kim YG, Soung YH, Han KJ, Kim SY, Rhim
HS, et al. The JAK2 V617F mutation in de novo
acute myelogenous leukemias. Oncogene. 2006;
25: 1434-6.
30. Wojcik I, Szybka M, Golanska E, Rieske P, Blonski
JZ, Robak T, et al. J.Abnormalities of the P53, MDM2,
BCL2 and BAX genes in acute leukemias. Neoplasma.
2005; 52: 318-24.
31. Aggerholm A, Grønbaek K, Guldberg P, Hokland P.
Mutational analysis of the tumour suppressor gene
MMAC1/PTEN in malignant myeloid disorders. Eur J
Haematol. 2000; 65: 109-13.
32. Visser M, Hofstra RM, Stulp RP, Wu Y, Buys CH,
Willemze R, et al. Absence of mutations in the RET
gene in acute myeloid leukemia. Ann Hematol. 1997;
75: 87-90.
33. Hestekin CN, Barron AE. The potential of electrophoretic mobility shift assays for clinical mutation
detection. Electrophoresis. 2006; 27: 3805-15.
34. Bianchini M, Ottaviani E, Grafone T, Giannini B,
Soverini S, Terragna C, et al. Rapid detection of Flt3
mutations in acute myeloid leukemia patients by denaturing HPLC. Clin Chem. 2003; 49: 1642-50.
35. Bacher U, Zander AR, Haferlach T, Schnittger S,
Fehse B, Kröger N. Minimal residual disease diagnostics in myeloid malignancies in the post transplant period. Bone Marrow Transplant. 2008; 42: 145-57.
36. Kern W, Haferlach C, Haferlach T, Schnittger S.
Monitoring of minimal residual disease in acute
myeloid leukemia. Cancer. 2008; 112: 4-16.
37. Sakhinia E, Farahangpour M, Tholouli E, Liu Yin JA,
Hoyland JA, Byers RJ. Comparison of gene-expression profiles in parallel bone marrow and peripheral
blood samples in acute myeloid leukaemia by realtime polymerase chain reaction. J Clin Pathol. 2006;
59: 1059-65.
38. Picard C, Silvy M, Gabert J. Overview of real-time RTPCR strategies for quantification of gene rearrange-
Profilo genetico
ments in the myeloid malignancies. Methods Mol Med.
2006; 125: 27-68.
39. Park S, Schalling M, Bernard A, Maheswaran S,
Shipley GC, Roberts D, et al. The Wilms tumour gene
WT1 is expressed in murine mesoderm-derived tissues and mutated in a human mesothelioma. Nat
Genet. 1993; 4: 415-20.
40. Pritchard-Jones K, Fleming S. Cell types expressing
the Wilms’ tumour gene (WT1) in Wilms’ tumours:
implications for tumour histogenesis. Oncogene.
1991; 6: 2211-20.
41. Baird PN, Simmons PJ. Expression of the Wilms’ tumor
gene (WT1) in normal hemopoiesis. Exp Hematol.
1997; 25: 312-20.
42. Maurer U, Brieger J, Weidmann E, Mitrou PS,
Hoelzer D, Bergmann L. The Wilms’ tumor gene is
expressed in a subset of CD34+ progenitors and
downregulated early in the course of differentiation in
vitro. Exp Hematol. 1997; 25: 945-50.
43. Menssen HD, Renkl HJ, Entezami M, Thiel E. Wilms’
tumor gene expression in human CD34+ hematopoietic progenitors during fetal development and early
clonogenic growth. Blood. 1997; 89: 3486-7.
44. Menssen HD, Renkl HJ, Rodeck U, Maurer J, Notter
M, Schwartz S, et al. Presence of Wilms’ tumor gene
(wt1) transcripts and the WT1 nuclear protein in the
majority of human acute leukemias. Leukemia. 1995;
9: 1060-7.
45. Miwa H, Beran M, Saunders GF. Expression of the
Wilms’ tumor gene (WT1) in human leukemias.
Leukemia. 1992; 6: 405-9.
46. Inoue K, Sugiyama H, Ogawa H, Nakagawa M,
Yamagami T, Miwa H, et al. WT1 as a new prognostic factor and a new marker for the detection of minimal residual disease in acute leukemia Blood. 1994;
84: 3071-9.
47. Barragán E, Cervera J, Bolufer P, Ballester S, Martín
G, Fernández P, et al. Prognostic implications of Wilms’
tumor gene (WT1) expression in patients with de novo
acute myeloid leukemia. Haematologica. 2004; 89:
926-33.
48. Garg M, Moore H, Tobal K, Liu Yin JA. Prognostic significance of quantitative analysis of WT1 gene transcripts by competitive reverse transcription polymerase
chain reaction in acute leukaemia. British Journal of
Hematology. 2003; 123: 49-59.
49. Santamaría CM, Chillón MC, García-Sanz R, Pérez
C, Caballero MD, Ramos F, et al. Molecular stratification model for prognosis in cytogenetically normal acute myeloid leukemia.Blood. 2009; 114: 14852.
50. Rodrigues PC, Oliveira SN, Viana MB, Matsuda EI,
Nowill AE, Brandalise SR, et al. Prognostic significance
of WT1 gene expression in pediatric acute myeloid
leukemia. Pediatr Blood Cancer. 2007; 49: 133-8.
51. Lasa A, Carricondo M, Estivill C, Bussaglia E, Gich
I, Brunet S, et al. WT1 monitoring in core binding fac-
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
tor AML: Comparison with specific chimeric products.
Leuk Res. 2009; 33: 1643-9.
Moore SD, Offor O, Ferry JA, Amrein PC, Morton CC,
Dal Cin P. ELF4 is fused to ERG in a case of acute
myeloid leukemia with a t(X;21)(q25-26;q22). Leuk
Res. 2006; 30: 1037-42.
Marcucci G, Maharry K, Whitman SP, Vukosavljevic T,
Paschka P, Langer C, et al; Cancer and Leukemia
Group B Study. High expression levels of the ETS-related gene, ERG, predict adverse outcome and improve
molecular risk-based classification of cytogenetically normal acute myeloid leukemia: a Cancer and Leukemia
Group B Study. J Clin Oncol. 2007; 25: 3337-43.
Marcucci G, Baldus CD, Ruppert AS, Radmacher MD,
Mrózek K, Whitman SP, et al. Overexpression of the
ETS-related gene, ERG, predicts a worse outcome
in acute myeloid leukemia with normal karyotype: a
Cancer and Leukemia Group B study. J Clin Oncol.
2005; 23: 9234-42.
Eid MA, Attia M, Abdou S, El-Shazly SF, Elahwal L,
Farrag W, et al. BAALC and ERG expression in acute
myeloid leukemia with normal karyotype: impact on
prognosis. Int J Lab Hematol. 2009; 23 [Epub unhead
of print].
Baldus CD, Liyanarachchi S, Mrózek K, Auer H, Tanner
SM, Guimond M, et al. Acute myeloid leukemia with
complex karyotypes and abnormal chromosome 21:
Amplification discloses overexpression of APP, ETS2,
and ERG genes. Proc Natl Acad Sci USA. 2004; 101:
3915-20.
Metzeler KH, Dufour A, Benthaus T, Hummel M,
Sauerland MC, Heinecke A, et al. ERG Expression
Is an Independent Prognostic Factor and Allows
Refined Risk Stratification in Cytogenetically Normal
Acute Myeloid Leukemia: A Comprehensive Analysis
of ERG, MN1, and BAALC Transcript Levels Using
Oligonucleotide Microarrays. J Clin Oncol. 2009; 27:
5031-8.
Baldus CD, Thiede C, Soucek S, Bloomfield CD, Thiel
E, Ehninger G. BAALC expression and FLT3 internal
tandem duplication mutations in acute myeloid
leukemia patients with normal cytogenetics: prognostic implications. J Clin Oncol. 2006; 24: 790-7.
Langer C, Radmacher MD, Ruppert AS, Whitman SP,
Paschka P, Mrózek K, et al. Cancer and Leukemia
Group B (CALGB). High BAALC expression associates with other molecular prognostic markers, poor
outcome, and a distinct gene-expression signature
in cytogenetically normal patients younger than 60
years with acute myeloid leukemia: a Cancer and
Leukemia Group B (CALGB) study. Blood. 2008; 111:
5371-9.
Qi X, Shen Y, Cen J, Chen H, Sun Y, Sheng H, et al.
Up-regulation of BAALC gene may be an important
alteration in AML-M2 patients with t(8;21)translocation. J Cell Mol Med. 2008; 12: 2301-4.
Satoskar AA, Tanner SM, Weinstein M, Qualman SJ,
25
26
Seminari di Ematologia Oncologica
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
de la Chapelle A. Baalc, a marker of mesoderm and
muscle. Gene Expr Patterns. 2005; 5: 463-73.
Baldus CD, Tanner SM, Ruppert AS, Whitman SP,
Archer KJ, Marcucci G, et al. BAALC expression predicts clinical outcome of de novo acute myeloid leukemia
patients with normal cytogenetics: a Cancer and
Leukemia Group B Study. Blood. 2003; 102: 1613-8.
Langer C, Marcucci G, Holland KB, Radmacher MD,
Maharry K, Paschka P, et al. Prognostic importance
of MN1 transcript levels, and biologic insights from
MN1-associated gene and microRNA expression signatures in cytogenetically normal acute myeloid
leukemia: a cancer and leukemia group B study. J Clin
Oncol. 2009; 27: 3198-204.
Meester-Smoor MA, Janssen MJ, Grosveld GC, de
Klein A, van IJcken WF, Douben H, et al. MN1 affects
expression of genes involved in hematopoiesis and
can enhance as well as inhibit RAR/RXR-induced
gene expression. Carcinogenesis. 2008; 29: 2025-34.
Carella C, Bonten J, Sirma S, Kranenburg TA,
Terranova S, Klein-Geltink R, et al. MN1 overexpression is an important step in the development of inv(16)
AML. Leukemia. 2007; 21: 1679-90.
Dohner K, Hinrichsen T, Rudolph C, Schambach A,
Baum C, Schlegelberger B,et al. MN1 overexpression
induces acute myeloid leukemia in mice and predicts
ATRA resistance in patients with AML. Blood. 2007;
110: 1639-47.
Heuser M, Beutel G, Krauter J, Döhner K, von Neuhoff
N, Schlegelberger B, et al. High meningioma 1 (MN1)
expression as a predictor for poor outcome in acute
myeloid leukemia with normal cytogenetics. Blood.
2006; 108: 3898-905.
Konrad TA, Karger A, Hackl H, Schwarzinger I,
Herbacek I, Wieser R. Inducible expression of EVI1
in human myeloid cells causes phenotypes consistent with its role in myelodysplastic syndromes. J
Leukoc Biol. 2009; 86: 813-22.
Park TS, Choi JR, Yoon SH, Song J, Kim J, Kim SJ,
et al. Acute promyelocytic leukemia relapsing as secondary acute myelogenous leukemia with translocation t(3;21)(q26;q22) and RUNX1-MDS1-EVI1 fusion
transcript. Cancer Genet Cytogenet. 2008; 187: 61-73.
Spensberger D, Vermeulen M, Le Guezennec X,
Beekman R, van Hoven A, Bindels E, et al. Myeloid
transforming protein Evi1 interacts with methyl-CpG
binding domain protein 3 and inhibits in vitro histone
deacetylation by Mbd3/Mi-2/NuRD. Biochemistry.
2008; 47: 6418-26.
Graubert T. AML1 and Evi1: coconspirators in
MDS/AML? Blood. 2008; 111: 3916-7.
Lugthart S, van Drunen E, van Norden Y, van Hoven
A, Erpelinck CA, Valk PJ, et al. High EVI1 levels predict adverse outcome in acute myeloid leukemia:
prevalence of EVI1 overexpression and chromosome
3q26 abnormalities underestimated. Blood. 2008; 111:
4329-37.
73. Haas K, Kundi M, Sperr WR, Esterbauer H, Ludwig
WD, Ratei R, et al. Expression and prognostic significance of different mRNA 5’-end variants of the oncogene EVI1 in 266 patients with de novo AML: EVI1
and MDS1/EVI1 overexpression both predict short
remission duration. Genes Chromosomes Cancer.
2008; 47: 288-98.
74. Cuenco GM, Ren R. Both AML1 and EVI1 oncogenic
components are required for the cooperation of
AML1/MDS1/EVI1 with BCR/ABL in the induction of
acute myelogenous leukemia in mice. Oncogene.
2004; 23: 569-79.
75. Gilliland DG, Jordan CT, Felix CA. The molecular basis
of Leukemia. Hematology Am Soc Hematol Educ
Program. 2004; 80-97.
76. Falini B, Nicoletti I, Bolli N, Martelli MP, Liso A, Gorello
P, et al. Translocations and mutations involving the
nucleophosmin (NPM1) gene in lymphomas and
leukemias. Haematologica 2007; 92: 519-32.
77. Falini B, Mecucci C, Tiacci E, Alcalay M, Rosati R,
Pasqualucci L, et al., GIMEMA Acute Leukemia
Working Party. Cytoplasmic nucleophosmin in acute
myelogenous leukemia with a normal karyotype N
Engl J Med. 2005; 352: 254-66.
78. Falini B, Bolli N, Shan J, Martelli MP, Liso A,
Pucciarini A Both carboxy-terminus NES motif and
mutated tryptophan(s) are crucial for aberrant nuclear export of nucleophosmin leukemic mutants in
NPMc+ AML. Blood 2006; 107: 4514-23.
79. Schnittger S, Schoch C, Kern W, Mecucci C, Tschulik
C, Martelli MF, et al. Nucleophosmin gene mutations
are predictors of favorable prognosis in acute myelogenous leukemia with a normal karyotype. Blood 2005;
106: 3733-9.
80. Dohner K, Schlenk RF, Habdank M, Scholl C, Rucker
FG, Corbacioglu A, et al. Mutant nucleophosmin
(NPM1) predicts favorable prognosis in younger adults
with acute myeloid leukemia and normal cytogenetics: interaction with other gene mutations. Blood 2005;
106: 3740-6.
81. Verhaak RG, Goudswaard CS, van Putten W, Bijl MA,
Sanders MA, Hugens W et al. Mutations in nucleophosmin (NPM1) in acute myeloid leukemia (AML):
association with other gene abnormalities and previously established gene expression signatures and their
favorable prognostic significance. Blood. 2005; 106:
3747-54.
82. Thiede C, Koch S, Creutzig E, Steudel C, Illmer T,
Schaich M, et al. Prevalence and prognostic impact
of NPM1 mutations in 1485 adult patients with acute
myeloid leukemia (AML). Blood. 2006; 107: 4011-20.
83. Lo-Coco F, Cuneo A, Pane F, Cilloni D, Diverio D,
Mancini M, et al. Acute Leukemia Working Party of
the GIMEMA group. Prognostic impact of genetic characterization in the GIMEMA LMA99P multicenter study
for newly diagnosed acute myeloid leukemia.
Haematologica. 2008; 93: 1017-24.
Profilo genetico
84. Mrózek K, Marcucci G, Paschka P, Whitman SP,
Bloomfield CD. Clinical relevance of mutations and
gene-expression changes in adult acute myeloid
leukemia with normal cytogenetics: are we ready for
a prognostically prioritized molecular classification?
Blood. 2007; 109: 431-48.
85. Schlenk RF, Döhner K, Krauter J, Fröhling S,
Corbacioglu A, Bullinger L, et al; German-Austrian Acute
Myeloid Leukemia Study Group. Mutations and treatment outcome in cytogenetically normal acute myeloid
leukemia. N Engl J Med. 2008; 358: 1909-18.
86. Gale RE, Green C, Allen C, Mead AJ, Burnett AK, Hills
RK et al. The impact of FLT3 internal tandem duplication mutant level, number, size and interaction with
NPM1 mutations in a large cohort of young adult
patients with acute myeloid leukemia. Blood. 2008;
111: 2776-84.
87. Haferlach C, Mecucci C, Schnittger S, Kohlmann A,
Mancini M,Cuneo A, et al. AML with mutated NPM1
carrying a normal or aberrant karyotype show overlapping biological, pathological, immunophenotypic, and prognostic features. Blood. 2009; 23: 13614.
88. Gorello P, Cazzaniga G, Alberti F, Dell’Oro MG,
Gottardi E, Specchia G, et al. Quantitative assessment
of minimal residual disease in acute myeloid leukemia carrying nucleophosmin (NPM1) gene mutations.
Leukemia. 2006; 20: 1103-8.
89. Chou WC, Tang JL, Wu SJ, Tsay W, Yao M, Huang
SY, et al. Clinical implications of minimal residual disease monitoring by quantitative polymerase chain
reaction in acute myeloid leukemia patients bearing
nucleophosmin (NPM1) mutations. Leukemia. 2007;
21: 998-1004.
90. Schnittger S, Kern W, Tschulik C, Weiss T, Dicker F,
Falini B, et al. Minimal residual disease levels
assessed by NPM1 mutation-specific RQ-PCR provide important prognostic information in AML. Blood.
2009; 114: 2220-31.
91. Kottaridis PD, Gale RE, Frew, ME, Harrison G,
Langabeer SE, Belton AA, et al. The presence of a
FLT3 internal tandem duplication in patients with acute
myeloid leucemia (AML) adds important prognostic
information to cytogenetic risk group and response to
the first cycle of chemotherapy: analysis of 854 patients
from the United Kingdom Medical Research Council
AML 10 and 12 trials. Blood. 2001; 98: 1752-9.
92. Whitman, SP, Archer KJ, Feng L, Baldus C, Becknell
B, Carlson BD, et al. Absence of the wild-type allele
predicts poor prognosis in adult de novoacute myeloid
leukemia with normal cytogenetics and the internaltandem duplication of FLT3: a Cancer and Leukemia
Group B study. Cancer Research. 2001; 61: 7233-9.
93. Frohling S, Schlenk RF, Breitruck J, Benner A,
Kreitmeier S, Tobis K, et al. Prognostic significanceof activating FLT3 mutations in younger adults (16 to
60 years) withacute myeloid leukemia and normal
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
105.
cytogenetics: a study of theAML Study Group Ulm.
Blood. 2002; 100: 4372-80.
Thiede C, Steudel C, Mohr B, Schaich M, Scha¨kel
U, Platzbecker U, et al. Analysis of FLT3-activating
mutations in 979 patients with acute myelogenous
leukemia: associationwith FAB subtypes and identification of subgroups with poor prognosis. Blood. 2002;
99: 4326-35.
Stirewalt DL, Radich JP. The role of FLT3 in
haematopoietic malignancies. Nature Reviews Cancer.
2003; 3: 650-65.
Beran M, Luthra R, Kantarjian H, Estey E. FLT3 mutation and response to intensive chemotherapy in young
adult and elderly patients with normal karyotype.
Leukemia Research. 2004; 28: 547-50.
Döhner K, Döhner H. Molecular characterization of
acute myeloid leukemia. Haematologica. 2008; 93:
976-82.
Dohner H. implications of the molecular characterization of AML. Hematology Am Soc Hematol Educ
Program. 2007; 412-9.
Dohner K, Schlenk RF, Habdank M, Scholl C, Rucker
FG, Corbacioglu A, et al. Mutant nucleophosmin
(NPM1) predicts favorable prognosis in younger adults
with acute myeloid leukemia and normal cytogenetics: interaction with other gene mutations. Blood. 2005;
106: 3740-6.
Boonthimat C, Thongnoppakhun W, Auewarakul CU.
Nucleophosmin mutation in Southeast Asian acute
myeloid leukemia: eight novel variants, FLT3 coexistence and prognostic impact of NPM1/FLT3 mutations.
Haematologica. 2008; 93: 1565-9.
Yanada M, Matsuo K, Suzuki T, Kiyoi H, Naoe T.
Prognostic significance of FLT3 internal tandem
duplication and tyrosine kinase domain mutations for
acute myeloid leukemia: a meta-analysis. Leukemia.
2005; 19: 1345-9.
Whitman SP, Ruppert AS, Radmacher MD, Mrózek
K, Paschka P, Langer C, et al. FLT3 D835/I836 mutations are associated with poor disease-free survival
and a distinct gene-expression signature among
younger adults with de novo cytogenetically normal
acute myeloid leukemia lacking FLT3 internal tandem
duplications. Blood. 2008; 111: 1552-9.
Mead AJ, Linch DC, Hills RK, Wheatley K, Burnett AK,
Gale RE. FLT3 tyrosine kinase domain mutations are
biologically distinct from and have a significantly more
favorable prognosis than FLT3 internal tandem duplications in patients with acute myeloid leukemia. Blood.
2007; 110: 1262-70.
Bacher U, Haferlach C, Kern W, Haferlach T,
Schnittger S. Prognostic relevance of FLT3-TKD mutations in AML: the combination matters - an analysis
of 3082 patients. Blood. 2008; 111: 2527-37.
Pabst T, Mueller BU, Zhang P, Radomska HS,
Narravula S, Schnittger S, et al. Dominant-negative
mutations of CEBPA, encoding CCAAT/enhancer bind-
27
28
Seminari di Ematologia Oncologica
106.
107.
108.
109.
110.
111.
112.
113.
114.
115.
116.
ing protein-a (C/EBPa), in acute myeloid leukemia.
Nature Genetics. 2001; 27: 263-70.
Preudhomme C, Sagot C, Boissel N, Cayuela J-M,
Tigaud I, deBotton S, et al. Favorable prognostic significance of CEBPA mutations in patients with de novo
acute myeloid leukemia:a study from the Acute
Leukemia French Association (ALFA). Blood 2002;
100: 2717-23.
Barjesteh van Waalwijk van Doorn-Khosrovani S,
Erpelinck C, Meijer J, van Oosterhoud S, van Putten
WLJ, Valk PJM, et al. Biallelic mutations in the CEBPA gene and low CEBPA expression levels as prognostic markers in intermediate-risk AML. Hematology
Journal. 2003; 4: 31-40.
Frohling S, Schlenk RF, Stolze I., Bihlmayr J, Benner
A, Kreitmeier S, et al. CEBPA mutations in younger
adults with acute myeloid leukemia and normal cytogenetics: prognostic relevance and analysis of cooperating mutations. Journal of Clinical Oncology. 2004;
22: 624-33.
Wouters BJ, Löwenberg B, Erpelinck-Verschueren
CA, van Putten WL, Valk PJ, Delwel R. Double CEBPA mutations, but not single CEBPA mutations, define
a subgroup of acute myeloid leukemia with a distinctive gene expression profile that is uniquely associated with a favorable outcome. Blood. 2009; 113:
3088-91.
Renneville A, Roumier C, Biggio V, Nibourel O, Boissel
N, Fenaux P, et al. Cooperating gene mutations in
acute myeloid leukemia: a review of the literature.
Leukemia. 2008; 22: 915-31.
Hess J.L. MLL: a histone methyltransferase disrupted in leukemia. Trends in Molecular Medicine. 2004;
10: 500-75.
Armstrong SA, Staunton JE, Silverman LB, Pieters
R, den Boer ML, Minden MD, et al. MLL translocations specify a distinct gene expression profile that distinguishes a unique leukemia. Nat Genet. 2002; 30:
41-707.
Caligiuri MA, Strout MP, Lawrence D, Arthur DC, Baer
MR,Yu F, et al. Rearrangement of ALL1 (MLL) in acute
myeloid leukemia with normal cytogenetics. Cancer
Research. 1998; 58: 55-9.
Schnittger S, Kinkelin U, Schoch C, Heinecke A,
Haase D, Haferlach T, et al. Screening for MLL tandem duplication in 387 unselected patients with AML
identify a prognostically unfavourable subset of AML.
Leukemia. 2000; 14: 796-804.
Dohner K, Tobis K, Ulrich R, Frohling S, Benner A,
Schlenk RF, et al. Prognostic significance of partial tandem duplications of the MLL gene in adult patients
16 to 60 years old with acute myeloid leukemia and
normal cytogenetics: a study of the Acute Myeloid
Leukemia Study Group Ulm. J. Clinic. Oncol. 2002; 20:
3254-61.
Munoz L, Nomdedeu JF, Villamor N, Guardia R,
Colomer D, Ribera JM, et al. Acute myeloid leukemia
117.
118.
119.
120.
121.
122.
123.
124.
125.
126.
127.
with MLL rearrangements: clinicobiological features,
prognostic impact and value of flow cytometry in the
detection of residual leukemic cells. Leukemia. 2003;
17: 76-82.
Bowen DT, Frew ME, Hills R, Gale RE, Wheatley K,
Groves MJ, et al. RAS mutation in acute myeloid
leukemia is associated with distinct cytogenetic subgroups but does not influence outcome in patients
younger than 60 years. Blood. 2005; 106: 2113-9.
Bacher U, Haferlach T, Schoch C, Kern W, Schnittger
S. Implications of NRAS mutations in AML: a study
of 2502 patients. Blood. 2006; 107: 3847-53.
King-Underwood L, Pritchard-Jones K. Wilms’ tumor
(WT1) gene mutations occur mainly in acute myeloid
leukemia and may confer drug resistance. Blood. 1998;
91: 2961-8.
Summers K, Stevens J, Kakkas I, Smith M, Smith LL,
Macdougall F, et al. Wilms’ tumour 1 mutations are
associated with FLT3-ITD and failure of standard
induction chemotherapy in patients with normal karyotype AML. Leukemia. 2007; 21: 550-1.
Virappane P, Gale R, Hills R, Kakkas I, Summers K,
Stevens J, et al. Mutation of the Wilms’ tumor 1 gene
is a poor prognostic factor associated with chemotherapy resistance in normal karyotype acute myeloid
leukemia: the United Kingdom Medical Research
Council Adult Leukaemia Working Party. J Clin
Oncol. 2008; 26: 5429-35.
Paschka P, Marcucci G, Ruppert AS, Whitman SP,
Mrózek K, Maharry K, et al. Wilms’ tumor 1 gene mutations independently predict poor outcome in adults with
cytogenetically normal acute myeloid leukemia: a cancer and leukemia group B study. J Clin Oncol. 2008;
26: 4595-602.
Gaidzik VI, Schlenk RF, Moschny S, Becker A,
Bullinger L, Corbacioglu A, et al. German-Austrian
AML Study Group. Prognostic impact of WT1 mutations in cytogenetically normal acute myeloid leukemia:
a study of the German-Austrian AML Study Group.
Blood. 2009; 113: 4505-11.
Schnittger S, Dicker F, Kern W, Haferlach T, Haferlach
C. Cooperating molecular mutations in AML/RUNX1
mutated AML differ dependent on the cytogenetic subgrou [Abstract]. Blood. 2007; 110: 114a.
Schnittger S, Kohl TM, Haferlach T, Kern W,
Hiddemann W, Spiekermann K, et al. KIT-D816 mutations in AML1-ETO positive AML are associated with
impaired eventfree and overall survival. Blood. 2006;
107: 1791-9.
Paschka P, Marcucci G, Ruppert AS, Mrózek K, Chen
H, Kittles RA, et al. Adverse prognostic significance
of KIT mutations in adult acute myeloid leukemia with
inv(16) and t(8;21): a Cancer and Leukemia Group B
Study. J Clin Oncol. 2006; 24: 3904-11.
Tallman MS, Jessica K. Altman curative strategies in
acute promyelocytic leukemia american society of
hematology education program book. 2008; 391-9.
Profilo genetico
128. Gale RE, Hills R, Pizzey AR, Kottaridis PD, Swirsky
D, Gilkes AF, et al., NCRI Adult Leukaemia Working
Party. Relationship between FLT3 mutation status, biologic characteristics, and response to targeted therapy in acute promyelocytic leukemia. Blood. 2005; 106:
3768-76.
129. Baldus CD, Mrózek K, Marcucci G, Bloomfield CD.
Clinical outcome of de novo acute myeloid leukaemia
patients with normal cytogenetics is affected by molecular genetic alterations: a concise review. Br J
Haematol. 2007; 137: 387-400.
130. Guidez F, Ivins S, Zhu J, Söderström M, Waxman S,
Zelent A. Reduced retinoic acid-sensitivities of nuclear
receptor corepressor binding to PML- and PLZFRARalpha underlie molecular pathogenesis and
treatment of acute promyelocytic leukemia. Blood.
1998; 91: 2634-42.
131. Schlenk RF, Döhner K, Kneba M, Götze K, Hartmann
F, Del Valle F, et al., German-Austrian AML Study
Group (AMLSG). Gene mutations and response to
treatment with all-trans retinoic acid in elderly patients
with acute myeloid leukemia. Results from the
AMLSG Trial AML HD98B. Haematologica. 2009; 94:
54-60.
132. Cornelissen JJ, van Putten WL, Verdonck LF, Theobald
M, Jacky E, Daenen SM, et al. Results of a HOVON/
SAKK donor versus no-donor analysis of myeloablative HLA-identical sibling stem cell transplantation in
first remission acute myeloid leukemia in young and
middle-aged adults: benefits for whom? Blood. 2007;
109: 3658-66.
133. Schlenk RF, Pasquini MC, Pérez WS, Zhang MJ,
Krauter J, Antin JH, et al. CIBMTR Acute Leukemia
Working Committee. HLA-identical sibling allogeneic
transplants versus chemotherapy in acute myelogenous leukemia with t(8;21) in first complete remission:
collaborative study between the German AML
Intergroup and CIBMTR. Biol Blood Marrow Transplant.
2008; 14: 187-96.
134. Weisberg E, Boulton C, Kelly LM, et al. Inhibition of
mutant FLT3 receptors in leukemia cells by the small
molecule tyrosine kinase inhibitor PKC412. Cancer
Cell. 2002; 1: 433-43.
135. Stone RM, DeAngelo DJ, Klimek V, Galinsky I, Estey
E, Nimer SD, et al. Patients with acute myeloid
leukemia and an activating mutation in FLT3 respond
to a small-molecule FLT3 tyrosine kinase inhibitor,
PKC412. Blood. 2005; 105: 54-60.
136. Zhang W, Konopleva M, Shi YX, McQueen T, Harris
D, Ling X, et al. Mutant FLT3: a direct target of
sorafenib in acute m yelogenous leukemia. J Natl
Cancer Inst. 2008; 100: 184-198.
137. DeAngelo DJ, Stone RM, Heaney ML, Nimer SD,
Paquette RL, Klisovic RB, et al. Phase 1 clinical results
with tandutinib (MLN518), a novel FLT3 antagonist,
in patients with acute myelogenous leukemia or highrisk myelodysplastic syndrome: safety, pharmacoki-
netics, and pharmacodynamics. Blood. 2006; 108:
3674-81.
138. Kindler T, Breitenbuecher F, Marx A, Beck J, Hess G,
Weinkauf B, et al. Efficacy and safety of imatinib in
adult patients with c-kit-positive acute myeloid
leukemia. Blood. 2004; 103: 3644-54.
139. Cammenga J, Horn S, Bergholz U, Sommer G,
Besmer P, Fiedler W, et al. Extracellular KIT receptor
mutants, commonly found in core binding factor AML,
are constitutively active and respond to imatinib mesylate. Blood. 2005; 106: 3958-61.
140. Heidel F, Cortes J, Rucker FG, Aulitzky W, Letvak L,
Kindler T, et al. Results of a multicenter phase II trial
for older patients with c-Kit-positive acute myeloid
leukemia (AML) and high-risk myelodysplastic syndrome (HR-MDS) using low-dose Ara-C and Imatinib.
Cancer. 2007; 109: 907-14.
141. Schittenhelm MM, Shiraga S, Schroeder A, Corbin AS,
Griffith D, Lee FY, et al. Dasatinib (BMS-354825), a
dual SRC/ABL kinase inhibitor, inhibits the kinase
activity of wild-type, juxtamembrane, and activation
loop mutant KIT isoforms associated with human
malignancies. Cancer Res. 2006; 66: 473-81.
142. Kudo N, Matsumori N, Taoka H, Fujiwara D, Schreiner
EP, Wolff B, et al. Leptomycin B inactivates
CRM1/exportin 1 by covalent modification at a cysteine residue in the central conserved region. Proc Natl
Acad Sci USA 1999; 96: 9112-7.
143. Dong X, Biswas A, Suel KE, Jackson LK, Martinez
R, Gu H, et al. Structural basis for leucine-rich nuclear
export signal recognition by CRM1. Nature. 2009; 458:
1136-1141.
144. Newlands ES, Rustin GJ, Brampton MH. Phase I
trial of elactocin. Br J Cancer. 1996; 74: 648649.116.
145. Perera Y, Farina HG, Gil J, Rodriguez A, Benavent F,
Castellanos L, et al. Anticancer peptide CIGB-300
binds to nucleophosmin/B23, impairs its CK2-mediated phosphorylation, and leads to apoptosis through
its nucleolar disassembly activity. Mol Cancer Ther.
2009; 8: 1189-96.
146. Falini B, Nicoletti I, Martelli MF, Mecucci C. Acute
myeloid leukemia carrying cytoplasmic/mutated nucleophosmin (NPMc+ AML): biologic and clinical features.
Blood. 2007; 109: 874-885.58.
147. Grisendi S, Bernardi R, Rossi M, Cheng K, Khandker
L, Manova K, et al. Role of nucleophosmin in embryonic development and tumorigenesis. Nature. 2005;
437: 147-153.3.
148. Benson C, White J, De Bono J, O’Donnell A,
Raynaud F, Cruickshank C, et al. A phase I trial of the
selective oral cyclindependent kinase inhibitor seliciclib (CYC202; R-Roscovitine), administered twice daily for 7 days every 21 days. Br J Cancer. 2007; 96:
29-37.
149. Whitman SP, Liu S, Vukosavljevic T, Rush LJ, Yu L,
Liu C, et al. The MLL partial tandem duplication: evi-
29
30
Seminari di Ematologia Oncologica
150.
151.
152.
153.
dence for recessive gain-of-function in acute myeloid
leukemia identifies a novel patient subgroup for molecular-targeted therapy. Blood. 2005; 106: 345-52.
Blum W, Klisovic RB, Hackanson B, Liu Z, Liu S,
Devine H, et al. Phase I study of decitabine alone or
in combination with valproic acid in acute myeloid
leukemia. J Clin Oncol. 2007; 25: 3884-91.
Gore SD, Baylin S, Sugar E, Carraway H, Miller CB,
Carducci M, et al. Combined DNA methyltransferase
and histone deacetylase inhibition in the treatment of
myeloid neoplasms. Cancer Res. 2006; 66: 6361-69.
Sebti SM, Hamilton AD. Farnesyltransferase and geranylgeranyltransferase I inhibitors and cancer therapy:
lessons from mechanism and bench-to-bedside translational studies. Oncogene. 2000; 19: 6584-93.
Karp JE, Lancet JE, Kaufmann SH, End DW, Wright
JJ, Bol K, et al. Clinical and biologic activity of the farnesyltransferase inhibitor R115777 in adults with
refractory and relapsed acute leukemias: a phase 1
154.
155.
156.
157.
clinical-laboratory correlative trial. Blood. 2001; 97:
3361-9.
Burnett AK, Kell J. Tipifarnib in acute myeloid
leukemia. Drugs Today (Barc.) 2007; 43: 795-800.
Harousseau JL, Lancet JE, Reiffers J, Lowenberg B,
Thomas X, Huguet F, et al. A phase 2 study of the
oral farnesyltransferase inhibitor tipifarnib in patients
with refractory or relapsed acute myeloid leukemia.
Blood. 2007; 109: 5151-6.
Lancet JE, Gojo I, Gotlib J, Feldman EJ, Greer J,
Liesveld JL, et al. A phase 2 study of the farnesyltransferase inhibitor tipifarnib in poor-risk and elderly
patients with previously untreated acute myelogenous
leukemia. Blood. 2007; 109: 1387-94.
Yanamandra N, Colaco NM, Parquet NA, Buzzeo RW,
Boulware D, Wright G, et al. Tipifarnib and bortezomib
are synergistic and overcome cell adhesionmediated
drug resistance in multiple myeloma and acute
myeloid leukemia. Clin Cancer Res. 2006; 12: 591-9.
31
Leucemie secondarie
therapy-related
GIUSEPPE LEONE, MARIA TERESA VOSO, LUANA FIANCHI,
LIVIO PAGANO
Istituto di Ematologia, Università Cattolica S. Cuore, Roma
n INTRODUZIONE
Il termine leucemia secondaria è stato attribuito
a leucemie di diversa natura e origine, che comunque sono riconducibili a tre gruppi (1, 2):
1° Leucemie precedute da un disordine ematologico primitivo, tra queste in primis sindromi mielodisplastiche o altre patologie ematologiche di tipo
mieloproliferativo di cui la leucemia secondaria, per
lo più mieloide acuta, può rappresentare una naturale evoluzione della patologia primitiva;
2° Leucemie che si manifestano come secondo
tumore in pazienti non trattati o trattati con la sola
chirurgia;
3° Leucemie che si manifestano dopo trattamento chemio e/o radioterapico per una neoplasia o
altra patologia, più comunemente di tipo immune.
Queste leucemie vengono chiamate therapy-related e saranno oggetto della nostra esposizione.
Sono ritenute analoghe a queste le leucemie che
conseguono ad esposizione a carcinogeni ambientali quale il benzene e le radiazioni ionizzanti (3).
Le leucemie therapy-related sono per la maggior
Parole chiave: Leucemie secondarie, leucemie therapy-related alchilanti, inibitori delle topoisomerasi
Indirizzo per la corrispondenza
Prof. Giuseppe Leone
Istituto di Ematologia
Università Cattolica
Largo Gemelli, 8 - 00168 Roma
e-mail: [email protected]
Giuseppe Leone
parte di tipo mieloide, spesso sono precedute da
una breve fase mielodiplastica (SMD) tant’è che
spesso si parla di mielodisplasia/leucemia mieloide acuta therapy-related (t-SMD/LMA) (3).
Nel gruppo delle leucemie therapy-related a volte è difficile stabilire quanto abbia influito sull’insorgere della leucemia la terapia e quanto la patologia stessa, anche se la terapia il più delle volte
ha un ruolo prevalente (4, 5). Le leucemie secondarie a chemio/radioterapia sono generalmente di
tipo mieloide, anche se si riconoscono leucemie
secondarie di tipo linfoide (6), e come tali sono raggruppate nella odierna classificazione della World
Health Organization (WHO) nel sottogruppo specifico delle leucemie acute mieloidi come therapy-related myeloid neoplasms (7). In effetti una fra
le complicanze più temibili legate ai trattamenti chemioterapici per una neoplasia maligna primitiva,
è la possibilità dell’insorgenza di un nuovo tumore (5) (Figura 1).
n FARMACI CITOTOSSICI
A molti dei più di 50 farmaci utilizzati nelle associazioni terapeutiche antineoplastiche, alchilanti,
analoghi delle purine, radiazioni ionizzanti, usati
nelle terapie antiblastiche ed immunosoppressive,
è riconosciuta un’attività carcinogenetica per l’uomo secondo la International Agency for Research
on Cancer (8).
Anche le leucemie che conseguono ad una esposizione accidentale alle radiazioni ionizzanti e al
benzolo sono considerate leucemie secondarie (3,
32
Seminari di Ematologia Oncologica
FIGURA 1 - La leucemia secondaria therapyrelated come modello di carcinogenesi.
9, 10). Sebbene un’aumentata incidenza di tSMD/LMA sia stata osservata anche dopo la sola
radioterapia, è la chemioterapia a determinare un
maggior rischio leucemogeno, che tuttavia si
incrementa con l’associazione alla radioterapia,
riconosciuta scarsamente leucemogena, se limitata a piccoli campi (1, 9). Gli agenti chemioterapici ad accertata attività leucemogena includono
gli agenti alchilanti (melfalan ciclofosfamide, mostarde azotate, ecc.), gli inibitori della topoisomerasi II
(etoposide, doxorubicina, daunorubicina, mitoxantrone, ecc.), gli analoghi delle purine, e i deri-
vati del platino (3) (Tabella 1). Le leucemie therapy related sono più frequenti dopo agenti alchilanti (11, 12) e inibitori della topoisomerasi 2 (11-13),
ma vengono descritte sempre più frequentemente anche dopo alcuni anti-metaboliti analoghi delle purine quali la azotioprina e la fludarabina (3,
14).
I farmaci citotossici sono spesso dati in combinazione e a volte associati alla radioterapia, rendendo difficile l’attribuzione della capacità leucemogena di ciascun farmaco (15). La combinazione
della chemoterapia con la radioterapia sicuramen-
Agenti alchilanti
Inibitori della
Topo-isomerasi 2
Anti-metaboliti
Derivati del platino
RTX
Busulfano
Carmustine
Chlorambucil
Ciclofosfamide
Dacarbazina
Diidrossibuslfano
Lomustine
Mechlorethamine
Melfalan
Procarbazina
Semustina
Thiotepa
Bimolano
Dactinomycina
Daunorubicina
Daxorubicina
Epidoxorubicina
Etoposide
Mitoxantrone
Razoxano
Teniposide
Azatioprina
Fludarabina
Mercaptopurina
Methotrexate
Carboplatino
Cisplatino
Oxiplatino
Esposizione
alle radiazioni
ionizzanti e
al Benzolo
TABELLA 1 - Farmaci e agenti citossici, suddivisi per classe, implicati nello sviluppo delle neoplasie mieloidi correlate alla terapia
(t-SMD/LMA).
Leucemie secondarie therapy-related
Agenti
alchilanti
Inibitori
topoisomerasi-II
Latenza
3-8 aa
1-3 aa
Cariotipo
-7, 7q-5, 5q-
11q23; t(15;17)
t(8;21)
Metilazione
Mutazioni
Fase mielodisplastica
p15
p53
AML1 (IR)
Presente
Assente
Incidenza
2-20%
2-12%
Sottotipo FAB
M1-M2
M3, M4, M5
TABELLA 2 - Caratteristiche delle leucemie secondarie ad alchilanti
ed a inibitori delle topoisomerasi.
te aumenta il rischio di leucemia secondaria che
è anche influenzata dalla dose e dal tipo e temporalità di somministrazione (3, 15).
La maggior parte delle leucemie secondarie che
sono conseguenza dell’uso di farmaci citotossici
possono essere divise in due gruppi (Tabella 2)
in ragione del fatto che il paziente abbia ricevuto
farmaci alchilanti o farmaci che bloccano la topoisomerasi II (3, 11, 15). Le leucemie che fanno
seguito ad analoghi delle purine ricordano quelle da alchilanti mentre quelle secondarie a radiazioni ionizzanti non hanno un unico pattern (16).
n RADIAZIONI IONIZZANTI
Forme comuni di radiazioni ionizzanti sono le radiazioni elettromagnetiche quali i raggi x, che non contengono masse o cariche, e le radiazioni da particelle che includono elettroni, protoni, neutroni, e
particelle varie (9).
Una radiazione ionizzante è comunque una
radiazione di energia sufficiente a rimuovere gli
elettroni dagli atomi quando passa attraverso un
tessuto biologico e la energia deposta produce tratti di ionizzazione e di eccitazione altamente strutturati. I raggi x furono scoperti da Roentgen nel
1895, e la prima radiografia fu fatta nel 1896, mentre i primi reports di un aumento casi di leucemia
nei radiologi appaiono negli anni 40 (9). È stata
anche descritta un’aumentata incidenza di leucemia in pazienti trattati con radioterapia per malattie benigne quali la spondilite anchilosante (16).
Lo studio di pazienti che hanno ricevuto radioterapia in assenza di chemioterapia dimostra una
maggiore incidenza di LMA o di SMD rispetto ad
una pure aumentata incidenza di leucemia linfatica acuta (LLA) o di leucemia mieloide cronica
(LMC), mentre non sembra aumentata l’incidenza di leucemia linfatica cronica (LLC) (1, 9). La leucemia radiogenica meglio documentata è quella
successiva alla esplosione delle bombe di
Hiroshima e Nagasaki con lo studio sui 120.000
sopravvissuti (17). Dopo l’esplosione dell’atomica
la LMA era la leucemia più comune, risultava inoltre aumentata la LMC con una maggiore frequenza nei giovani rispetto alle forme de novo.
Sulla base degli studi giapponesi il rischio nella
vita di sviluppare una leucemia dopo esposizione corporea completa di 1 Gy è di 85 casi per
10000 abitanti (17). Ugualmente un certo aumento di leucemie acute mieloidi si è avuto in
Ucraina, dopo l’incidente di Chernobyl, ma senza raggiungere i livelli di Hiroshima (18).
Dal punto di vista citogenetico nei pazienti sottoposti a radioterapia sono state riscontrate delezioni dei cromosomi 5 e 7, ma sono state trovate
anche traslocazioni bilanciate tipo la t(15;17) (9,
11, 12). Nelle t-SMD-LMA secondarie a radioterapia e a esposizione casuale sono state anche
descritte frequentemente mutazioni somatiche del
gene AML1/RUNX1 (19).
n AGENTI ALCHILANTI
Gli agenti alchilanti utilizzati comunemente nelle
chemioterapie comprendono ciclofosfamide, ifosfamide, clorambucile, busulfano, e nitrosuree e sono
in gran parte derivate dal primo chemioterapico
usato, la mostarda azotata (Tabella 1) La maggior
parte degli agenti alchilanti danneggia il DNA sia
metilandolo sia formando dei legami reciproci tra
le 2 eliche del DNA (crosslinking). Gli agenti metilanti, quali procarbazina, dacarbazina, e temozolomide, contengono un gruppo metilico strutturale che può formare monoaddotti di DNA a livello
degli atomi N7 e O6 della guanina, degli atomi N1
ed N3 della adenina, e degli atomi N3 della citosina (20). Invece altri alchilanti quali melfalan, ciclofosfamide, chlorambucil e mitomycina C, contengono 2 gruppi alchilici che possono legarsi a 2 basi
33
34
Seminari di Ematologia Oncologica
FIGURA 2 - Azione dei farmaci e dei carcinogeni sul DNA.
opposte dei 2 filamenti complementari del DNA
creando un legame incrociato (crosslinking).
Sebbene gli agenti che causano un crosslinking
fra i filamenti di DNA possano generare anch’essi monoaddotti, la loro citotossicità è direttamente legata ai legami incrociati interfilamenti (20, 21).
I legami covalenti fra basi opposte del DNA bloccano efficacemente la replicazione durante la divisione cellulare e possono dare inizio alla formazione di rotture del DNA potenzialmente letali (morte cellulare) o mutageni (leucemia secondaria)
(Figura 2) (20, 21).
Le caratteristiche della leucemia secondaria
indotta da agenti alchilanti sono descritte nella
tabella 2. Tra gli alchilanti esiste una certa gradazione nella capacità di indurre leucemia secondaria. Le nitrosouree e la procarbazina sono associate con una frequenza di leucemie secondarie
maggiore (22), e il busulfano e il melfalan sono più
leucemogeni della ciclofosfamide (23). Di recente sono state riportati casi di leucemia secondaria anche in pazienti trattati con temozolamide (24).
Le leucemie conseguenti al trattamento con
alchilanti (3, 15, 20) si manifestano dopo almeno
2 anni, hanno il loro picco di incidenza dopo 5-7
anni e raggiungono un plateau dopo 8-10 anni. La
malattia può iniziare con i chiari segni della leucemia con interessamento trilineare, ma più frequentemente in almeno il 70% dei casi è prece-
duta da una fase preleucemica, caratterizzata da
pancitopenia periferica e midollo con segni di mielodisplasia. La SMD secondaria ad alchilanti evolve frequentemente (>50%) e rapidamente (<12
mesi) in LMA (3, 11, 12, 15, 20).
Nei pazienti che esordiscono con franca leucemia
si riscontra in genere un sottotipo FAB M1 e M2
anche se la caratterizzazione accurata del sottotipo FAB può essere difficile a causa dell’interessamento multilineare (3, 12). L’analisi citogenetica rivela nelle leucemie, come nelle SMD secondarie, anomalie cromosomiche non random nel 7590% dei casi (11, 12, 25). La maggior parte di queste forme mieloidi hanno un pattern citogenetico
con monosomia del cromosoma 5 o perdita e delezione del 5q (-5/5q-) e/o monosomia del cromosoma 7 o delezione e perdita del 7q (-7/7q-) (11,
12, 26, 29). Le forme t-SMD/LMA secondarie con
alterazioni del cromosoma 5 (-5/ 5q-) e 7 (-7/7q)
presentano un simile andamento clinico e differenze biologiche poco significative, tali da essere raggruppate insieme. Attualmente si tende a distinguere un primo sottogruppo che include pazienti
con alterazioni del cromosoma 5 (-5/5q-) con o
senza alterazioni del cromosoma 7 e un secondo sottogruppo con la sola alterazione del cromosoma 7. Nel primo sottogruppo sono spesso presenti alterazioni del cromosoma 17, monosomia
o delezione o perdita de17p(-17/17p-), mutazioni
Leucemie secondarie therapy-related
della P53, duplicazione ed amplificazione della
banda q23 del cromosoma 11 ed un cariotipo complesso con aberrazioni cromosomiche non identificate (26). Il secondo sottogruppo con l’interessamento del solo cromosoma 7 presenta la metilazione del promotore del gene P15(CDKN4B) (27)
e la mutazione somatica di RUNX1 (11, 19).
Questa suddivisione è supportata da recenti studi con i microarray (29).
n ANALOGHI DELLE PURINE
Gli analoghi delle purine sono farmaci antineoplastici appartenenti alla categoria degli anti-metaboliti (purine, azatioprina, 6-tioguanina, fludarabina)
e condividono somiglianze strutturali con composti presenti in natura quali i nucleotidi. Possono
essere incorporati nel DNA e/o nel RNA, causando una inibizione della proliferazione cellulare (14).
La azatioprina è grandemente usata come immunosoppressore nelle malattie autoimmuni o nei
riceventi i trapianti di organo spesso in associazione con la ciclosporina e gli steroidi.
Malgrado il meccanismo di azione degli analoghi
delle purine non sia completamente conosciuto,
a dispetto dell’uso clinico ultratrentennale, è
generalmente accettato che la incorporazione della tiopurina e della tioguanina nel DNA ne determina la citotossicità e l’effetto terapeutico, legato
anche alla capacità del DNA 6-T ad essere facilmente metilato con meccanismi non enzimatici
(14). Un eccesso di casi di LMA è stato trovato
tra i pazienti trattati con azatioprina dopo trapianto d’organo o per patologie autoimmuni (30, 31).
Per spiegare l’insorgenza del clone leucemico dopo
chemioterapia con alchilanti o analoghi delle purine bisogna ricordare il meccanismo del DNA
mismatch repair (MMR) e della sua possibile deficienza (14, 30).
Le tiopurine e gli agenti alchilanti differiscono marcatamente nella loro struttura e nel meccanismo di
azione ma hanno in comune la possibilità di indurre danno al DNA che poi deve essere riparato dallo stesso meccanismo del MMR (14, 30) Esiste una
resistenza crociata tra i 2 tipi di farmaci che possono provocare entrambi aumento della instabilità
dei microsatelliti del DNA e quindi SMD e LMA (14).
In aggiunta al frequente comune riscontro di insta-
bilità dei microsatelliti, i pazienti trattati con farmaci alchilanti e gli analoghi delle purine condividono
altre caratteristiche come per esempio la perdita di
parte o tutto il cromosoma 5 o 7 (31, 32).
La instabilità dei microsatelliti (MSI), la cui presenza denuncia una carenza del MMR, è stata trovata nelle cellule midollari di tutti i 7 pazienti con
t-SMD/LMA successiva a trattamento con tiopurine (30).
Poiché la MSI si ritrova raramente nelle SMD/LMA
de novo, gli autori concludono che la selettiva proliferazione di cellule mieloidi deficienti nel MMR e
resistenti alla azatioprina può contribuire in maniera significativa allo sviluppo di un clone leucemico
nei pazienti trapiantati d’organo ed in trattamento
immunosoppressivo (14, 30).
La fludarabina è un antimetabolita che inibisce la
sintesi di DNA ed è l’analogo delle purine attualmente più frequentemente usato, essendosi rivelato di grande efficacia nelle LLC, nei linfomi indolenti (32-34) e nella macroglobulinemia di
Waldestrom (MW) (35).
La fludarabina è un profarmaco che è convertito
nel nucleoside libero 9-beta-D-arabinosyl-2-fluoroadenina, che entra nelle cellule e si accumula
come composto 5-trifosforilato, il 9-beta-D-arabinosil-2-fluoroadenosina trifosfato (F-ara-ATP). Il Fara-ATP inibisce la ribonucleotide reduttasi, come
pure la DNA ligasi e la DNA primasi. In aggiunta
il F-ara-ATP viene incorporato nel DNA e ne impedisce una ulteriore polimerizzazione (14).
La fludarabina è stata utilizzata anche in combinazione con altri agenti chemoterapici ed in particolare con la ciclofosfamide, un agente alchilante
che induce danno del DNA e ne aumenta l’efficacia e probabilmente anche l’incidenza di leucemie
secondarie (3, 32-34) e con il mitoxantrone,
anch’esso chiamato spesso in causa come leucemogeno in associazione (36).
Anche da sola è in grado di indurre leucemie
secondarie e questo è stato verificato in pazienti
trattati con la sola fludarabina per linfomi indolenti o per la Malattia di Waldestrom (MW). (33, 35).
L’uso di idrossiurea (HU) come agente mielosoppressivo presenta un rischio limitato di trasformazione leucemica (37). Da uno studio del Research
Council (MRC, UK) sembra che l’uso della sola HU
non aumenti il rischio di t-SMD/LMA nella trombocitemia essenziale e nella policitemia vera (38).
35
36
Seminari di Ematologia Oncologica
n INIBITORI DELLA
TOPISOMERASI II
Alcuni dei farmaci clinicamente più efficaci come
antiblastici provocano la morte cellulare interagendo con le topoisomerasi I o II. I farmaci che agiscono sulla topoisomerasi II si dividono in agenti intercalanti (es. doxorubicina) e non-intercalanti, come le epipodofillotossine (es. etoposide e teniposide). Un solo inibitore della topoisomerasi I, il
topotecan, è usato attualmente in clinica. Il farmaco intercalante actinomicina D interagisce sia con
la topoisomerasi I che II. Gli inibitori delle topoisomerasi comunemente usati in clinica, agiscono
legandosi al complesso enzima/DNA al momento del clivaggio dei filamenti successivo all’azione della topoisomerasi (13).
Il farmaco blocca la reazione enzimatica attraverso una rilegazione ed una liberazione dell’enzima
che lascia il DNA con una rottura permanente tra
i filamenti. Le rotture multiple tra i filamenti conducono a morte cellulare, attraverso l’induzione
della apoptosi, mentre l’interruzione del processo
di replicazione è importante nella inibizione da
topoisomerasi I. C’è evidenza che sia l’effetto antineoplastico che l’effetto leucemogeno mediati dalle epidofillotossine sono dovuti a una rottura dei
cromosomi e spesso una successiva ricomposizione bilanciata, che si risolve in una traslocazione con la trasformazione leucemica (13).
Il rischio di t-SMD-LMA dopo epipodofillotossine
va dal 2 al 12% (13) (Tabella 2). Al di là del farmaco stesso, alcuni fattori collaterali sembrano
favorire la trasformazione leucemica, tra questi è
segnalato il contemporaneo uso di asparaginasi
e di G-CSF, meno importante sembra il ruolo della dose cumulativa (39, 40). L’esposizione agli inibitori della topoisomerasi II come l’etoposide si
associa generalmente alla traslocazione del gene
MLL, che si trova sulla banda q23 del cromosoma 11 (13, 39-41). Il gene MLL è un tipico regolatore di trascrizione e alcune tipiche traslocazioni che interessano MLL suggeriscono che un guadagno delle sue funzioni contribuisce criticamente alla leucemogenesi. Le anomalie del gene MLL,
per lo più traslocazioni reciproche e più raramente duplicazioni interne, delezioni ed inversioni si
ritrovano anche nelle leucemie de novo del bambino (in circa il 10%) e dell’adulto (in circa il 5%)
(13, 40). Circa il 10% delle leucemie con l’interessamento di MLL sono therapy-related.
In un sistema di colture cellulari di cellule staminali emopoietiche CD34+ in presenza di etoposide, si assiste frequentemente ad alterazioni del
gene MLL, alle quali può seguire una incompleta ed incongrua riparazione e conseguente formazione di duplicazioni tandem, traslocazioni con possibilità di delezioni e inserzioni aggiuntive (41, 42).
La trasformazione leucemica con interessamento di MLL è più frequente nei pazienti giovani e
può interessare sia la linea mieloide che linfoide
dimostrando un profilo genico che suggerisce che
il riarrangiamento di MLL inizia nella cellula staminale emopoietica indifferenziata (43). Tuttavia è
di rilievo che il gene partner di MLL è generalmente il cromosoma 4 nella LLA (6) e il cromosoma
9 nella LMA (13, 43).
Oltre alle alterazioni del cromosoma 11, dopo epipodofillotossine sono state descritte leucemie acute a promielociti (LPA) con la tipica traslocazione
t(15;17) (13, 44), descritta soprattutto in pazienti
dell’Europa mediterranea affetti da istiocitosi di
Langherans, dove però la trasformazione leucemica potrebbe anche essere indipendente dal trattamento (44). Ma altri inibitori delle topoisomerasi occupano un ruolo di rilievo nell’indurre la LAP
descritta dopo somministrazione di bimolano, un
altro inibitore delle DNA topoisomerasi II, in pazienti affetti da psoriasi (45). Inoltre ci sono diversi
reports di LAP in pazienti con sclerosi multipla trattati unicamente con mitoxantrone (46-48). Il mitoxantrone sembra inoltre essere un fattore di rischio
per le leucemie che si sviluppano nelle pazienti
con tumore della mammella, che è tra le neoplasie più frequentemente associate a promielocitiche secondarie (49).
I punti di rottura delle traslocazioni in questi casi
sono strettamente raggruppati nella regione di 8bp dell’introne 6 del gene PML (47, 48). Mediante
esami di tipo funzionale si è potuto dimostrare che
questo hot spot e il punto di rottura di RARA sono
comuni siti di clivaggio indotti dalla topoisomerasi sotto l’influenza del mitoxantrone. Sia la doxorubicina che il mitoxantrone erano in grado di indurre questo stesso tipo di clivaggio.
Analogamente a MLL, il fattore di trascrizione
AML1 (CBFA2), localizzato sul cromosoma 21
banda q, è interessato in traslocazioni bilanciate
Leucemie secondarie therapy-related
con diversi partners nelle leucemie secondarie a
epipodofillotossine o mitoxantrone (50, 51).
n DERIVATI DEL BENZOLO
La LMA che si sviluppa dopo esposizione al benzolo presenta aspetti simili a quella therapy-related (10). Gli individui a rischio si riscontrano tra i
lavoratori di oli minerali, meccanici e lavoratori dei
calzaturifici. Il pericolo di leucemie in queste categorie di lavoratori si è molto attenuato (52) sino a
scomparire (10, 53) nei paesi occidentali, ma tende a rimanere alto tra i lavoratori delle industrie
nei paesi in vai di sviluppo come la Cina (54, 55).
n INCIDENZA DELLE T-SMD/LMA
La loro incidenza è andata man mano aumentando negli anni sia per il prolungamento della sopravvivenza dei pazienti con precedenti neoplasie, sia
per l’uso più frequente di terapie aggressive a scopo antineoplastico o immunodepressivo (56).
Dato che l’intervallo di tempo tra somministrazione del farmaco ed insorgenza della leucemia può
essere anche di 10 anni è naturale che solo un
lungo follow-up ci può dare indicazioni attendibili
sulla esatta incidenza della forma secondaria. Ma
oltre ai farmaci bisogna considerare anche la patologia primitiva. Le malattie neoplastiche che più frequentemente precedono una t-SMD/LMA sono
nell’adulto le malattie linfoproliferative, più di fre-
quente il linfoma di Hodgkin (LH) e i linfomi non
Hodgkin (LNH), i tumori della mammella e dell’apparato riproduttivo (ovaio e testicolo) e nel bambino la LLA e i tumori del sistema nervoso centrale (SNC) (1, 3, 56) (Tabella 3).
L’incidenza della leucemia secondaria dipende sia
dal tipo di terapia, dal tipo di malattia primitiva e
da fattori individuali di tipo ambientale e genetico
(3). Fino al 10% dei pazienti con malattia linfoproliferativa, trattati con terapia convenzionale e successivamente con terapia di salvataggio e autotrapianto di cellule staminali emopoietiche può sviluppare entro 10 anni una leucemia secondaria
(1). Nei pazienti con LH il rischio di andare incontro a una leucemia secondaria varia fra <0.5% e
10% a seconda del tipo di terapia, dell’ampiezza
della popolazione studiata e della durata del follow-up (1). Bisogna però dire che anche nelle grandi casistiche si è notata nel tempo una diminuzione dell’incidenza delle leucemie secondarie man
mano che venivano evitati i farmaci maggiormente leucemogeni e ridotta la estensione delle irradiazioni (57, 58). Infatti un rischio più alto si è subito notato in pazienti sottoposti alla terapia con il
regime MOPP rispetto all’ABVD e alla sola radioterapia (59, 60). L’aggiunta della radioterapia
aumenta il rischio particolarmente se è associata alla MOPP (59-61) (Tabella 4). Riguardo agli
schemi di terapia attualmente in uso, l’incidenza
di leucemia secondaria dopo ABVD continua ad
essere riportata estremamente bassa, come confermano i dati di Brusamolino et al. (62) che non
ha riportato casi di leucemia secondaria in 120
Neoplasie ematologiche
Tumori solidi
Malattie non neoplastiche
Linfoma di Hodgkin
I linfomi Non-Hodgkin
Mieloma multiplo
Leucemia linfoblastica acuta
Leucemia mieloide acuta
Malattie mieloproliferative croniche
Carcinomi
Mammellla
Ovaio
Prostata
Polmone
Cervice
Testicolo
Sarcoma di Ewing
Neuroblastoma
Osteosarcoma
Tumore di Wilms
Rabdomiosarcoma
Artrite reumatoide
Granulomatosi di Wegener
Epilessia
Psoriasi
Sclerosi multipla
Neutropenia severe congenita
Trapianti d’organo
TABELLA 3 - Malattie neoplastiche e non, più frequentemente trattate con farmaci a rischio di indurre leucemie secondarie.
37
38
Seminari di Ematologia Oncologica
Riferimenti
Pazienti (n.)
Terapia
SMD/LMA (n.)
Rischio cum. %
Brusamolino et al. (59)
Josting et al. (60)
24
304
ABVD
0
1
0
0.3
Brusamolino et al. (62)
118
ABVD±/Radio
involved field
0
Schwartz et al. (64)
209
ABVE-PC
3
1.4%
Engert et al. (63)
261
469
466
COPP+ABVD
BEACOP baseline
BEACPP escalated
1
7
14
0.4 (10 yrs)
2.2 (10 aa)
3.2 (10 aa)
Forrest et al. (66)
Sirohi et al. (65)
202
195
Chemio+ABMT
Chemio+ABMT
4
7
2 (7 aa)
4 (10 aa)
TABELLA 4 - Rischio cumulativo di t-SMD/LMA in patient sottoposti a chemio-radioterapia per LH in riferimento ai trattamenti attualmente
più impiegati.
pazienti con malattia non-bulky stadio I-IIA, trattati con 4 cicli di ABVD e campi limitati di radioterapia. Lo stesso non può dirsi con cicli anche di
recente introduzione come il BEACOPP (bleomicina, etoposide, adriamicina, ciclofosfamide, vincristina, procarbazina e prednisone) negli adulti
(63) e l’ABVE-PC (doxorubicina, bleomicina, vincristina, etoposide, prednisone, ciclofosfamide) nei
bambini (64). In questi ultimi 2 cicli, rispetto
all’ABVD-MOPP ibrido, viene esclusa la dacarbazina, considerata leucemogena in primo grado e
si è sostituto il cloramin con la ciclofosfamide, che
probabilmente è meno leucemogena; tuttavia si è
introdotto l’etoposide, che ha un’attività leucemogena ampiamente dimostrata. Un significativo
aumento della incidenza di t-SMD/LMA è stato
soprattutto riscontato nel BEACOPP escalated
(63). Un ulteriore incremento della incidenza di leucemia secondaria si ha nei pazienti recidivati pluritrattati che raggiungano una durevole remissione completa (RC) con o senza autotrapianto (65),
specie se in età avanzata (66).
Per quanto riguarda i LNH, gli studi sono diversi:
ci limitiamo a riportare i più recenti, rimandando a
review specialistiche per i dati meno recenti (1-3,
15). In uno studio britannico apparso nel 2006 (67)
su 2.456 pazienti, di età <60 anni, in cui non si differenzia tra LNH indolento e aggressivo, trattati dal
1973 al 2000, venivano segnalate 123 seconde
neoplasie, di queste 17 erano LMA con un rischio
relativo 10.5. Il rischio maggiore si aveva quando
alla chemioterapia veniva associata la radioterapia, mentre la sola radioterapia non aumentava il
rischio di leucemie. Tra i farmaci inoltre il rischio era
maggiore quando i pazienti erano trattati con il clorambucil (RR 19.2, 9.6-34.3) rispetto al CHOP (RR
14.2, 6.8-26,2). Il rischio relativo era simile nei linfomi aggressivi e indolenti e diminuiva con l’aumento dell’età al primo trattamento.
Passando ai farmaci introdotti più recentemente
nelle patologie linfoproliferative poco aggressive,
nei pazienti con LNH indolente è stato trovato un
aumentato rischio di neoplasie secondarie ed in
particolare di t-SMD/LMA quando i pazienti erano trattati con fludarabina (33-37, 68). Ad un follow-up mediano di 62 mesi, la incidenza cumulativa di seconda neoplasia a 12 anni era di 10.5 in
563 pazienti italiani trattati con differenti schemi.
Fattori di rischio indipendenti erano l’età avanzata, il sesso maschile e i regimi di terapia contenente fludarabina (68).
Il massimo di incremento di leucemia secondaria
si è avuto nei pazienti sottoposti a chemio/radioterapia eradicante seguita da trapianto di cellule
staminali emopoietiche autologhe, sia eseguito nei
pazienti resistenti come salvataggio, che impiegato nella terapia di prima linea (69, 70) (Tabella 5).
Un aumento di neoplasie secondarie ed in particolare di LMA e SMD è stato ugualmente osservato nei pazienti con LLC o con MW trattati con
fludarabina (32, 34, 35). L’incidenza era massima
nei pazienti con LLC successivamente sottoposti
ad autotrapianto di midollo dopo eradicazione con
radiochemioterapia (71). Per quanto riguarda la
MW, in un recente studio americano (35) venivano esaminati 439 pazienti con un simile follow-up,
Leucemie secondarie therapy-related
Riferimenti
Pazienti (n.)
Terapia
CHOP
Chlorambucil
Radioterapia
SMD/LMA (n.)
Rischio cum. %
Fattori di rischio
14.2
19.2
0
9
0
0.3
Mudie NJ et al. (67)
Brit. Cohort Study
2456
McLaughlin et al. (36)
202
Flu-MitoxDesa±R
5
4
Fludarabina
Mitoxantrone
Sacchi S et al. (68)
GISL
563
ALK±Antrac
± Fludara
12
2.1
Fludarabina
Gyan et al. (70)
GOLEAN
80
CHT intensiva
CHVP + IFN
1
0.8
Gyan et al. (70)
GOLEAN
86
CHT intensiva
TBI+ABMT
6
7
TBI
TABELLA 5 - Rischio cumulativo di t-SMD/LMA in patienti che sottoposti a chemio/radioterapia per LNH.
di cui 193 trattati con fludarabina, 136 senza e 110
senza alcuna terapia. Ad un follow-up mediano di
5 anni, 12 (6.2%) dei 439 patienti trattati con fludarabina erano andati incontro o ad una trasformazione in linfoma aggressivo (n=9; 4.7%) o in tSMD/LMA (n=3; 1.6%). Undici dei 12 pazienti con
evoluzione di malattia erano stati tratatti con fludarabina, mentre 1 solo paziente non trattato con
fludarabina e nessuno dei pazienti non trattati avevano una malattia evolutiva (35). I 3 pazienti con
t-SMD/LMA decedevano nel giro di 5 mesi, mentre i pazienti in trasformazione linfomatosa venivano recuperati da una terapia di salvataggio.
Nei LNH aggressivi il gruppo francese GELA (72)
nel 2004 ha riportato dei dati molto significativi su
un gruppo di 2.837 pazienti trattati tra il 1984 ed
il 1998 con il regime ACVBD (adriamicina, bleomicina, vindesina, ciclophosphamide e prednisone). Ad un follow-up mediano di 74 mesi venivano riportate 81 neoplasie secondarie di cui 17
ematologiche, con un aumento statisticamente
significativo soprattutto per le t-SMD/LMA, il cui
rischio aumentava di 15 volte. Più recentemente
Sacchi et al. (73) ha riportato i dati del gruppo italiano GISL su una serie di 1280 LNH a grandi cellule B, trattati tra il 1988 e 2003. Sono state osservate 48 neoplasie secondarie di cui 8 casi di tSMD/LMA. Il rischio cumulativo attuariale a 5, 10
e 15 anni era di 1.5, 3.3 e 6.8 per i tumori solidi
e di 0.8, 1.4, e 1.4 e per le t-SMD/LMA, dimostrando ancora una volta che la LMA secondaria è
evento raro trascorsi 10 anni dalla terapia, mentre l’incremento delle neoplasie solide continua.
Metayer et al. (74) hanno riportato un ampio studio policentrico in 12 istituzioni americane su 2.739
pazienti (955 LH e 1784 LNH) sottoposti a terapia antiblastica sovra massimale, trattati tra 1989
e 1995. Venivano riportati 56 pazienti con tSMD/LMA, che rappresentano un rischio cumulativo a 7 anni del 3.7% (3.3% per il LH e 3.9%
per i LNH). In una valutazione caso-controllo su
168 pazienti con le stesse caratteristiche, all’analisi multivariata apparivano significativi, nel determinare il rischio leucemico, l’intensità della terapia pre-trapianto con la mecloretamina (RR da 2.0
a 4.3 a seconda delle dosi) e con clorambucile (RR
= da 3.8 a 8.4), rispetto ai regimi contenenti ciclofosfamide. In questo gruppo di pazienti la total-body
irradiation (TBI) costituiva un fattore di rischio solo
alla dose superiore a 13.2 G. L’uso di cellule staminali del sangue periferico costituiva un fattore
di rischio scarsamente significativo. Il rischio leucemogeno della radioterapia nel condizionamento pretrapianto appare dunque un dato costante,
potendosi ritrovare come si è detto anche nei
pazienti con LNH indolente (70) e nei pazienti con
LLC (71). Inoltre il condizionamento radioterapico sembra costituire ugualmente un fattore di
rischio, mentre non sembra accertato il ruolo della mobilizzazione e dei fattori di crescita (75). Nella
nostra esperienza l’uso della sola chemioterapia
ad alte dosi seguita da autotrapianto con cellule
staminali del sangue periferico non ha indotto un
aumento significativo delle t-SMD-LMA, mentre è
risultato ancora una volta evidente come fattore
di rischio il pregresso uso della fludarabina (76).
39
40
Seminari di Ematologia Oncologica
Nella popolazione pediatrica i tumori secondari therapy-related hanno un ruolo di particolare importanza, considerata la lunga attesa di vita dei
pazienti trattati per una neoplasia (57). La tSMD/LMA ha un certo impatto nella sopravvivenza nei pazienti pediatrici affetti da LH, osteosarcoma e neuroblastoma (57), e rimane uno dei problemi più importanti tra le complicanze tardive nella LLA del bambino (40, 57, 77, 78), mentre ha
un minore impatto nella forma dell’anziano (78, 79).
Tuttavia, le esperienze sono diverse tra le varie
scuole ed in genere il gruppo tedesco (80), che
utilizza lo schema BFM, riporta una incidenza molto inferiore a quella del gruppo americano del St.
Judes Hospital (40, 77) e anche dei gruppi nordici (81). In uno studio retrospettivo al St. Judes,
Hijiva et al. (77) hanno analizzato l’incidenza di
neoplasie secondarie nell’arco di 30 anni. Una neoplasia secondaria sviluppava come primo evento
in 123 dei 2.169 patienti trattati, includendo 46 neoplasie mieloidi, 3 linfomi, 22 tumori cerebrali e 16
meningiomi. Il rischio cumulativo di seconda neoplasia a 15 anni era del 4.17% e continuava a salire dopo i 20 anni, per portarsi al 10.58% a 30 anni.
Il rischio di LMA è maggiore nei bambini con LLA
che ricevono alte dosi cumulative di epipodofillotossina in dosi settimanali o bisettimanali e che
ricevono G-CSF o irradiazione craniale (39, 77),
passando dal 2.7% al 11% e al 12.3 % nei pazienti trattati con G-CSF o radioterapia. Un aumento
molto inferiore viene riportato dal gruppo tedesco
(79), mentre l’aumento è più significativo nel gruppo nord-europeo (81), che in un lavoro recentis-
Riferimenti
Pazienti (n.)
simo mette in evidenza l’importanza del trattamento di mantenimento con purinetol e metotrexate e
l’importanza dei polimorfismi della metiltrasferasi
in grado di produrre un aumento della tossicità da
purine e quindi la leucemia secondaria. Questa
evenienza non è stata confermata nei pazienti
tedeschi trattati con il BFM (80).
Tra i tumori solidi che possono precedere una
t-SMD-LMA si riscontrano in primis i tumori tipici
del sesso femminile, mammella, ovaio, cervice, e
quindi prostata, urotelio, polmone (1, 56). I tumori della mammella (Tabella 6) occupano un ruolo
particolare sia per l’elevata incidenza, rappresentando più di 1/3 dei tumori solidi quale primo tumore, sia per il particolare rapporto con le leucemie
(2, 3, 56). Diversi studi epidemiologici di coorte indicano che l’incidenza di tutte le leucemie è
aumentata nelle donne che hanno sofferto di una
neoplasia mammaria (82, 83); la LMA è la neoplasia secondaria più frequente nelle donne giovani con pregresso tumore della mammella
(Tabella 6) in tutti gli studi epidemiologici europei
ed americani con un rischio RR sempre superiore a 2, indipendentemente dalla terapia e dallo stadio di malattia (82, 83). A differenza delle malattie ematologiche, il rischio relativo è superiore nelle pazienti giovani rispetto alle anziane (83, 84),
inoltre una maggiore frequenza di t-SMD-LMA
veniva riscontrato nelle pazienti con una anamnesi familiare positiva per neoplasie specie della sfera ginecologica (85, 86). Da questi studi appare
evidente come la pregressa neoplasia mammaria predisponga alla leucemia secondaria (83-87),
Terapia
SMD/LMA (n.)
Rischio cum. %
Praga et al. (90)
7110
1427
903
Epirubicin regimens
CMF
Tp ormonale
28
1
1
0.55 (8 y)
0.07
0.11
Smith et al. (88)
6018
2545
Doxo+CTX
Doxo+CTX+G-CSF
21
22
0.12
0.86
Bernard-Marty et al. (89)
255
267
CMF
Epirubicina regimens
0
3
0.9 (6 y)
1569
3330
2837
890
Doxo regimens
CTX regimens
Radiotherapy
GCS-F/GM-CSF
18
40
38
16
1.14
1.20
1.33
1.79
Hershman et al. (92)
TABELLA 6 - Rischio di t-SMD/LMA in pazienti che ricevevano la radio/chemioterapia per tumore mammario.
Leucemie secondarie therapy-related
di converso numerosi studi caso/controllo hanno
dimostrato l’importanza fondamentale della chemio/radioterapia. L’impiego frequente di alcuni degli
inibitori delle topoisomerasi in particolare del mitoxantrone, che ha un potere leucemogeno superiore alla adriamicina (3) nelle terapie antiblastiche del tumore della mammella, giustifica l’alta frequenza di LAP (49, 88). Negli studi caso controllo è più evidente ed individuabile il ruolo della chemioradioterapia (3, 88-94). Praga et al. (90) analizzando 9796 casi di tumore della mammella in
19 trial randomizzati ha trovato un rischio cumulativo di leucemia secondaria dello 0.55%, che
però variava grandemente (dallo 0,37% al 4,97%)
a seconda della dose cumulativa di epirubicina
ricevuta. In un recente studio francese (91) è stata messa in evidenza nel tumore della mammella la maggiore leucemogenicità del mitoxantrone
rispetto all’adrialastina e l’effetto leucemogeno dell’aggiunta di G-CSF alla chemioterapia.
Quest’ultimo dato, già segnalato nel 2003 (88)
veniva sottolineato da un contemporaneo dato
americano su un notevole numero di pazienti (92),
ma non confermato da un altro studio sui soggetti anziani (93). In definitiva sembra accertato un
aumentato rischio per fattori genetici ed ambientali, l’importanza degli inibitori della topoisomerasi, e tra questi in primis del mitoxantrone, della
radioterapia e probabilmente dell’uso del G-CSF.
n FATTORI PREDISPONENTI
I fattori predisponenti e la patogenesi delle t-SMDLMA sono ancora in via di definizione, ma è improbabile che la leucemia secondaria sia un evento
del tutto casuale. Dal momento che soltanto una
piccola percentuale dei soggetti esposti a terapia
citotossica sviluppa una t-MDS/AML therapy-related, è ipotizzabile una predisposizione individuale genetica. Tale suscettibilità potrebbe dipendere da fattori ereditari, quali i polimorfismi del metabolismo dei farmaci o della riparazione del DNA
(94, 95), che sembra importante in particolare per
le forme con anomalie dei cromosomi 5 e/o 7, dove
i fattori predisponenti sono simili (5, 20). Una predisposizione specifica appare associata non solo
al tipo di trattamento, ma anche al tumore primitivo, come dimostrato per la LAP secondaria a car-
cinoma della mammella o a sclerosi multipla, trattate con mitoxantrone (47-49, 84-87).
Gli enzimi del metabolismo svolgono un ruolo
importante nel metabolismo, trasformazione e
detossificazione dei farmaci o degli xenobiotici (3,
94). Gli enzimi di fase I (Attivazione) comprendono la superfamiglia del citocromo P450, mentre gli
enzimi di fase II (Detossificazione) includono
diverse superfamiglie di enzimi, fra cui sulfotrasferasi, glucuronosiltrasferasi, NAD(P)H:chinone ossidoreduttasi (NQO), epossido-idrolasi (EPH), glutatione S-trasferasi (GST) e N-acetil-trasferasi
(NAT). La coniugazione delle sostanze mediante
gli enzimi di fase II aumenta l’idrofilia e l’eliminazione delle sostanze tossiche nella bile e/o nell’urina, e di conseguenza influenza la detossificazione e l’eliminazione in ultimo di molti farmaci e xenobiotici. In alcuni casi, la coniugazione con gli enzimi di fase II può indurre la formazione di metaboliti attivati e aumentarne la tossicita (94) (Figura 2).
Le epipodofillotossine, etoposide e teniposide, così
come ciclofosfamide, ifosfamide, vinblastina, e vindesina sono substrati del metabolismo mediante
CYP3A, il componente del sistema CYP piu’
abbondante nel fegato (13, 93, 96). Una variante
del CYP3A4 nella regione del suo promotore
(CYP3A4-V) influenza la produzione del metabolita delle epipodofillotossine catecolo, che è il precursore della chinina, con caratteristiche genotossiche simili al benzolo (97). Molti autori, incluso il
nostro gruppo (98), hanno dimostrato una ridotta
prevalenza del polimorfismo CYP3A4-V nelle
t-SMD-LMA, suggerendo che il genotipo CYP3A4nativo potrebbe aumentare la produzione di
metaboliti intermedi genotossici, e aumentare il
rischio leucemico (96, 98).
Un altro enzima importante per il metabolismo del
benzene è il NAD(P)H:chinone ossidoriduttasi
(NQO1), che trasforma l’idrochinone e altri metaboliti idrossilici in metaboliti meno tossici. I difetti
del sistema di NQO1 causano inoltre un più veloce accorciamento dei telomeri e inducono ematopoiesi clonale a seguito dello stress ossidativo
(54). Nei lavoratori del benzene è stata descritta
un’alterazione ematologica simil-SMD, associata
ai polimorfismi MPO -463GG e NQO1 465CT, in
particolare se associati (54). Inoltre è stato dimostrato che la frequenza degli eterozigoti per NQO1
era più alta nei pazienti affetti da leucemia rispet-
41
42
Seminari di Ematologia Oncologica
to alla popolazione generale, e che gli omozigoti
erano circa il 4% delle LMA de novo e l’11% delle t-LMA (98, 99). Queste percentuali aumentavano ulteriormente nei pazienti con anomalie dei cromosomi 5 e/o 7, da sole o associate, o nei pazienti trattati con agenti alchilanti per la neoplasia primitiva.
Molti farmaci citostatici come l’adriamicina, BCNU,
bleomicina, clorambucile, cisplatino, etoposide,
melfalan, mitomicina C, mitoxantrone, vincristina
e ciclofosfamide vengono inattivati inoltre dalle
GST (100). Molti enzimi della famiglia delle GST
presentano polimorfismi frequenti nella popolazione e per questo interessanti nella leucemogenesi. In particolare il gene di GSTP1 presenta un allele variante, con una sostituzione della isoleucina
a valina a livello del codone aminoacidico 105
(Ile105Val), che è presente in circa il 30% delle
popolazioni caucasiche ed è associata a ridotta
attività enzimatica (3, 94, 100). Tale polimorfismo
si presenta frequentemente in eterozigosi nelle
t-SMD-LMA, in particolare in seguito a precedente trattamento chemioterapico con noti substrati
di GSTP1, e non in seguito a trattamento esclusivamente radioterapico (100).
Un altro meccanismo di leucemogenesi secondaria sono i difetti di riparazione del DNA (95). Le
rotture a doppia elica del DNA sono la classe più
importante di danno perché inducono la morte cellulare o la perdita di materiale genetico, che induce a sua volta anomalie cromosomiche e/o traslocazioni. Una riparazione inefficiente permette l’acquisizione e la persistenza delle mutazioni, mentre una riparazione eccessiva può inibire l’apoptosi e consentire alle cellule danneggiate di tentare di riparare il danno al DNA, e quindi sopravvivere con un DNA riparato in maniera non corretta. Le rotture a doppia elica vengono riparate
nei mammiferi dai sistemi della ricombinazione
omologa o dell’end-joining non omologo.
Una delle proteine più importanti della ricombinazione omologa è RAD51, che si lega al DNA e
induce un appaiamento delle eliche ATP-dipendente, favorendo così la riparazione del danno.
RAD51 interagisce con BRCA1 e BRCA2 ed è
essenziale per la sopravvivenza e stabilità genetica della cellula: modelli murini di knock-out per
RAD 51 sono letali in fase embrionaria, probabilmente a causa di un accumulo di rotture cromo-
somiali. La proteina XRCC3 svolge anch’essa un
ruolo nella riparazione delle rotture della doppia
elica e interagisce direttamente con RAD51, stabilizzandolo.
Il gene di RAD51 presenta un polimorfismo G/C
nella posizione -135 (RAD51-G135C), mentre
XRCC3 presenta un polimorfismo del codone 241.
Studiando 51 pazienti con t-SMD-LMA veniva
riportata una frequenza del polimorfismo RAD51G135C significativamente aumentata rispetto ai
controlli normali, di simile età e razza, e ciò aumentava di 6-volte il rischio di leucemia secondaria.
(94). La presenza dei due polimorfismi RAD51135C e XRCC3-241Met contemporaneamente
aumentava il rischio di LMA di 6 volte in presenza, mentre il rischio di t-SMD-LMA aumentava di
8 volte (94).
Anche il meccanismo di riparazione mediante
escissione dei nucleotidi sembra coinvolto nella
leucemogenesi secondaria: la ridotta attività del
gene per lo xeroderma pigmentosum gruppo D
(XPD) dovuta a polimorfismo si associava a ridotta sopravvivenza nella leucemia acuta e a un
rischio aumentato di 2 volte di sviluppare una leucemia secondaria dopo chemioterapia (101).
Il sistema di DNA mismatch repair è invece importante per la correzione di errori replicativi che sfuggono ai controlli della DNA polimerasi (102). Negli
uomini i complessi MSH2/MSH6 e MSH2/MSH3
riconoscono e legano mismatch di singole basi e
sequenze di inserzioni/delezioni del DNA. Il sistema di riparazione, viene particolarmente inibito da
una ridotta funzione di MSH2 o MLH1 (102, 103).
Studiando 3 markers mononucleotidici quasi
monomorfici, si evidenziava una bassa percentuale di instabilità dei microsatelliti nelle LMA de novo
(0-30% dei casi), mentre essa risultava significativamente più elevata (38%) nei casi di t-AML. In
questo senso anche i polimorfismi di MLH1 erano più frequenti nelle t-SMD-LMA (102). Le
mutazioni di caspase-5, FANCD2 e NF1 possono anch’esse essere alla base della instabilità dei
micro satelliti nelle t-LMA (104).
Le mutazioni del gene oncosoppressore p53, fondamentale per la difesa della cellula da molti agenti dannosi per il DNA, sono importanti per la patogenesi delle t-SMD/LMA. Conseguentemente è
stato dimostrato che due varianti funzionali comuni della via di p53, che ne riducono l’attività, col-
Leucemie secondarie therapy-related
laboravano nell’aumentare il rischio di t-SMD-LMA,
in particolare nei portatori di delezioni dei cromosomi 5 e/o 7 (105).
L’elevata frequenza di instabilità dei microsatelliti
e l’evidenza della perdita di funzione di MSH2 nelle t-SMD-LMA suggerisce che una disfunzione del
DNA mismatch repair potrebbe essere l’evento iniziatore della malattia. Il conseguente accumulo di
eventi genetici secondari potrebbe indurre la proliferazione di cellule con attività ridotta di p53,
aumento dell’espressione dei geni della ricombinazione omologa (incluso RAD51), eccessiva riparazione del DNA, e aumento dell’instabilità cromosomica, che conduce alle anomalie tipiche delle
t-SMD/LMA.
Questo potrebbe essere inoltre favorito dalla presenza di polimorfismi del metabolismo degli
xenobiotici dal momento che le specie reattive che
sfuggono ai meccanismi di detossificazione o che
vengono prodotte in eccesso possono danneggiare il DNA, che viene poi riparato in maniera errata da meccanismi di riparazione difettosi. Ciò conduce all’espansione clonale delle cellule danneggiate e alla fase mielodisplastica. La trasformazione in LMA procede quindi come un’evoluzione
naturale e la t-SMD/LMA possono essere considerate come un’unica malattia. Quest’ipotesi è
sostenuta dal numero significativo di pazienti con
un difetto combinato di detossificazione e riparazione del DNA (97, 98).
n POSSIBILITÀ DI TRATTAMENTO
Il trattamento delle t-SMD-LMA-related è molto
complesso ed è stato oggetto di pochi studi chiari e completi. Daremo soltanto alcuni linee di comportamento rimandando a pubblicazioni specifiche che saranno riportate in altri capitoli di questa rivista. In molti report terapeutici si raggruppano le LMA post-SMD con le secondarie a chemio-radioterapia (106, 107) e anche con le leucemie che si presentano come secondo tumore
(108), indipendentemente dalla terapia che è stata eseguita per il tumore primitivo. D’altra parte
la t-SMD-LMA non ha delle stimmate morfologiche e citogenetiche particolari, ma la diagnosi è
basata unicamente sul dato anamnestico (7), la
pregressa chemioterapia con farmaci riconosciu-
ti come leucemogeni o la radioterapia, senza una
specificazione di temporalità e nemmeno chiara indicazione nominale dei farmaci ritenuti leucemogeni, per cui possono non venir inclusi casi
di mera coincidenza temporale o di stessa
suscettibilità di due neoplasie (la primitiva e la
neoplasia mieloide therapy-related) a fattori cancerogeni diversi ma comuni. Pertanto si dovrà
tener conto della sola letteratura che specificatamente parla di leucemie secondarie therapyrelated.
Quando si dovrà scegliere la terapia per questo
particolare tipo di leucemia bisognerà fare una
valutazione clinica del singolo caso che tenga conto della malattia primitiva e distinguere se si tratti di una neoplasia ematologica o non ematologica o una malattia autoimmune (56), verificare se
la malattia di base è in fase attiva o meno, verificare i danni provocati dalla pregressa neoplasia
e soprattutto dalla terapia antiblastica e radioterapica (110, 111). È noto infatti che le comorbidità influenzano la prognosi dei pazienti leucemici
sia che essi vengano trattati con la sola classica
chemioterapia, che con l’aggiunta di trapianto di
midollo (111-113). In particolare andrà valutato il
danno cardiovascolare e polmonare delle pregresse terapie in quanto generalmente poco reversibile (109, 110). La prognosi e la risposta alla terapia della leucemie therapy-related, come delle de
novo, sono strettamente dipendenti dalle alterazioni citogenetiche presenti (114, 115).
Sicuramente le leucemie therapy-related che
insorgono senza essere precedute da una SMD
e che presentano una traslocazione hanno una
prognosi migliore delle forme precedute da una
fase mielodisplastica, rispondendo al trattamento antiblastico convenzionale in maniera simile alle
de novo e come tali vanno trattate (56, 109). È
dubbio se le leucemie therapy-related insorte senza una fase mielodisplastica abbiano la stessa
prognosi delle de novo, come riportato dalla esperienza GIMEMA (109). La maggior parte degli
autori (56, 116) sostiene che la patogenesi postchemio di per sè condizioni in ogni caso negativamente la prognosi. Ci sono alcuni dati che fanno pensare ad una minore sensibilità ai farmaci,
come riportato recentemente per le forme interessanti CBFA sia nella translocazione t(8;21) che
nella inversione del 16, per cui la specifica sen-
43
44
Seminari di Ematologia Oncologica
sibilità di queste due forme alla citosina arabinoside sarebbe inferiore nelle therapy-related rispetto alle forme de novo con lo stesso interessamento di CBFA (116). Lo stesso non si può dire delle LPA therapy-related che sembrano rispondere ugualmente bene ai classici trattamenti impieganti l’acido retinoico e le antracicline (49, 87).
Le forme precedute da SMD e in genere e caratterizzate da delezione o monosomia dei cromosomi 5 o 7 dovrebbero essere trattate, quando
possibile, immediatamente con trapianto di cellule staminali emopoietiche, preceduto da un regime di condizionamento chemioterapico standard
o ridotto tenendo conto dell’età del paziente (117,
118), similmente a quanto proposto per le SMD
ad alto rischio (112). Si possono ottenere delle
remissioni complete e lunghe sopravvivenze dal
20 al 50% dei casi. Il trapianto di midollo preceduto da un condizionamento di tipo classico eradicante o ad intensità ridotta sembra produrre delle buone risposte (sopravvivenza a 3 anni >50%)
nei pazienti con precedente neoplasia solida, in
genere tumore mammario (117-119) e senza fase
mielodisplastica, che condiziona la prognosi sia
nei pazienti con leucemia de novo che secondaria (117, 118).
A nostro giudizio per le le forme citopeniche con
displasia il trapianto va fatto in prima battutta o
dopo terapia con farmaci demetilanti. Nei pazienti con pregressa malattia ematologica proliferativa (117) in specie il LH la prognosi è decisamente peggiore, come sottolineato dal gruppo tedesco. Anche i bambini che vanno incontro a una
LMA dopo una LLA hanno una prognosi sfavorevole anche se trapiantati (<20% lunghe remissioni complete) (57).
I pazienti non candidabili al trapianto o anziani con
comorbidità cardiovascolare nella nostra esperienza possono rispondere molto bene accusando
poca tossicità all’associazione citosina-arabinoside a dosi classiche con il priming di G-CSF e
l’aggiunta di mylotarg al termine del ciclo di terapia (120). Altri autori hanno utilizzato nei pazienti con gravi comorbidità la Citosin-Arabinoside a
basse dosi o il solo supporto trasfusionale e nei
pazienti giovani alte dosi del farmaco con risultati momentaneamente discreti, con remissioni
complete nel 50% dei casi, ma seguite invariabilmente da recidiva (57).
n BIBLIOGRAFIA
1. Leone G, Mele L, Pulsoni A, Equitani F, Pagano L.
The incidence of secondary leukemias. Haematologica. 1999; 84: 937-45.
2. Pagano L, Pulsoni A, Tosti ME, Camera A, Melillo L,
Leone G, et al., Gruppo Italiano Malattie Ematologiche
Maligne dell’Adulto. Clinical and biological features of
acute myeloid leukaemia occurring as second malignancy: GIMEMA archive of adult acute leukaemia. Br
J Haematol. 2001; 112: 109-17.
3. Leone G, Pagano L, Ben-Yehuda D, Voso MT.
Therapy-related leukemia and myelodysplasia: susceptibility and incidence. Haematologica. 2007; 92:
1389-98.
4. Perera FP. Environment and cancer: who are susceptible? Science. 1997; 278: 1068-1073.
5. Allan JM, Travis LB. Mechanism of the therapy related carcinogenesis. Nature Canc Rev. 2005; 5: 244-55.
6. Andersen MK, Christiansen DH, Jensen BA, Ernst P,
Hauge G, Pedersen-Bjergaard J. Therapy-related
acute lymphoblastic leukaemia with MLL rearrangements following DNA topoisomerase II inhibitors, an
increasing problem: report on two new cases and
review of the literature since 1992. Br J Haematol.
2001; 114: 539-43.
7. Vardiman JW, Thiele J, Arber DA, Brunning RD,
Borowitz MJ, Porwit A, et al. The 2008 revision of the
World Health Organization (WHO) classification of
myeloid neoplasms and acute leukemia: rationale and
important changes. Blood. 2009; 114: 937-51.
8. IARC Carcinogens to Humans Monographs Volumes
1-100A, 2009; http://monographs.iarc.fr/ENG/
Classification/crthgr01.php
9. Wright EG. Ionizing radiation and leukaemia: more
questions than answers. Hematol Oncol. 2005; 23:
119-12.
10. Natelson EA. Benzene-induced acute myeloid
leukemia: a clinician’s perspective. Am J Hematol.
2007; 82: 826-30.
11. Pedersen-Bjergaard J, Christiansen DH, Desta F,
Andersen MK. Alternative genetic pathways and cooperating genetic abnormalities in the pathogenesis of
therapy-related myelodysplasia and acute myeloid
leukemia. Leukemia. 2006; 20: 1943-9.
12. Smith SM, Le Beau MM, Huo D, Karrison T, Sobecks
RM, Anastasi J et al. Clinical-cytogenetic associations
in 306 patients with therapy-related myelodysplasia
and myeloid leukemia: the University of Chicago
series. Blood. 2003; 102: 43-52.
13. Felix CA. Secondary leukemias induced by topoisomerase-targeted drugs. Bioch Biophys Acta. 1998;
1400: 233-55.
14. Karran P, Attard N. Thiopurines in current medical practice: molecular mechanisms and contributions to therapy-related cancer. Nat Rev Cancer. 2008; 8: 24-36.
Review.
Leucemie secondarie therapy-related
15. Larson RA. Therapy-related myeloid neoplasms.
Haematologica. 2009; 94: 454-9.
16. Court-Brown WM, Doll R. Mortality from cancer and
other causes after radiotherapy for ankylosing spondylitis. Br Med J. 1965; 5474: 1327-32.
17. Preston DL, Kusumi S, Tomonaga M, et al. Cancer
incidence in atomic bomb survivors, Part III.
Leukaemia, lymphoma and multiple myeloma, 19501987. Radiat Res. 1994; 137: S68-S97.
18. Davis S, Day R, Kopecky K, Mahoney M, McCarthy
P, Michalek A, et al. Childhood leukaemia in Belarus,
Russia, and Ukraine following the Chernobyl power
station accident: results from an international collaborative population-based case-control study. Int J
Epidemiol. 2006; 35: 386-96.
19. Zharlyganova D, Harada H, Harada Y, Shinkarev S,
Zhumadilov Z, Zhunusova A, et al. High frequency of
AML1/RUNX1 point mutations in radiation-associated myelodysplastic syndrome around Semipalatinsk
nuclear test site. J Radiat Res. 2008; 549-55.
20. Worrillow LJ, Allan JM. Deregulation of homologous
recombination DNA repair in alkylating agent-treated
stem cell clones: a possible role in the aetiology of
chemotherapy-induced leukemia. Oncogene. 2006; 25:
1709-20.
21. Helleday T, Lo J, van Gent DC, Engelward BP. DNA
double-strand break repair:from mechanistic understanding to cancer treatment. DNA Repair. 2007; 6:
923-35.
22. Collins CM, Morgan DS, Mosse C, Sosman J.
Dacarbazine induced acute myeloid leukemia in
melanoma. Melanoma Res. 2009; 19: 337-40.
23. Greene MH, Harris EL, Gershenson DM, Malkasian
GD Jr, Melton LJ 3d, Dembo AJ, et al. Melphalan may
be more potent leukemogen than cyclophospamide.
Ann Int Med. 1986; 105: 360-7.
24. Su YW, Chang MC, Chiang MF, Hsieh RK. Treatmentrelated myelodysplastic syndrome after temozolomide
for recurrent high-grade glioma. J Neurooncol. 2005;
71: 315-18.
25. Christiansen DH, Andersen MK, Pedersen-Bjergaard
J. Mutations with loss of heterozygosity of p53 are
common in therapy-related myelodysplasia and acute
myeloid leukemia after exposure to alkylating agents
and significantly associated with deletion or loss of 5q,
a complex karyotype, and a poor prognosis. J Clin
Oncol. 2001; 19: 1405-13.
26. Christiansen DH, Andersen MK, Pedersen-Bjergaard
J. Mutations of AML1 are common in therapy-related
myelodysplasia following therapy with alkylating
agents and are significantly associated with deletion
or loss of chromosome arm 7q and with subsequent
leukemic transformation. Blood. 2004; 104: 1474-81.
27. Christiansen DH, Andersen MK, Pedersen-Bjergaard
J. Methylation of p15INK4B is common, is associated with deletion of genes on chromosome arm 7q and
predicts a poor prognosis in therapy-related myelodys-
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
plasia and acute myeloid leukemia. Leukemia. 2003;
17: 1813-9.
Andersen MK, Christiansen DH, Pedersen-Bjergaard
J. Centromeric breakage and highly rearranged chromosome derivatives associated with mutations of
TP53 are common in therapy-related MDS and AML
after therapy with alkylating agents: an M-FISH study.
Genes Chrom Cancer. 2005; 42: 358-71.
Quian Z, Fernald AA,Godley LA, Larson RA, Le Beau
MM. Expression profiling of CD34+ hematopoietic
stem/progenitor cells reveales distinct subtypes of therapy-related acute myeloid leukemia . Proc Natl Acad
Sci USA. 2002; 99: 14925-30.
Offman J, Opelz J, Doehler B, Cummins D, Halil O,
Banner NR, et al. Defective DNA mismatch repair in
acute myeloid leukemia/myelodysplastic syndrome
after organ transplantation. Blood. 2004; 104: 822-8.
Knipp S, Hildebrandt B, Richter J, Haas R, Germing
U, Gattermann N: Secondary myelodysplastic syndromes following treatment with azathioprine are associated with aberrations of chromosome.
Haematologica. 2005; 90: 691-3.
Morrison VA, Rai KR, Peterson BL, Kolitz JE, Elias
L, Appelbaum FR, et al. Therapy-related myeloid leukemias are observed in patients with chronic lymphocytic leukemia after treatment with fludarabine and
chlorambucil: results of an intergroup study, Cancer
and Leukemia Group B 9011. J Clin Oncol. 2002; 20:
3878-84.
Misgeld E, Germing U, Aul C, Gattermann N.
Secondary myelodysplastic syndrome after fludarabine therapy of a lowgrade non-Hodgkin’s lymphoma. Leuk Res. 2001; 25: 95-8.
Tam CS, O’Brien S, Wierda W, Kantarjian H, Wen S,
Do KA, et al. Long-term results of the fludarabine,
cyclophosphamide, and rituximab regimen as initial
therapy of chronic lymphocytic leukemia. Blood.
2008; 112: 975-80.
Leleu X, Soumerai J, Roccaro A, Hatjiharissi E, Hunter
ZR, Manning R, et al. Increased incidence of transformation and myelodysplasia/acute leukemia in
patients with Waldenström macroglobulinemia treated with nucleoside analogs. J Clin Oncol. 2009; 27:
250-5.
McLaughlin P, Estey E, Glassman A, Romaguera J,
Samaniego F, Ayala A, et al. Myelodysplasia and acute myeloid leukemia following therapy for indolent lymphoma with fludarabine, mitoxantrone, and dexamethasone (FND) plus rituximab and interferon alpha.
Blood. 2005; 105: 4573-5.
Finazzi G, Caruso V, Marchioli R, Capnist G, Chisesi
T, Finelli C, et al. Acute leukaemia in polycythemia
vera: an analysis of 1638 patients enrolled in a
prospective observational study. Blood. 2005; 105:
2664-70.
Harrison CN, Campbell PJ, Buck G, Wheatley K, East
CL, Bareford D, et al. Hydroxyurea compared with ana-
45
46
Seminari di Ematologia Oncologica
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
grelide in high-risk essential thrombocythemia. N Engl
J Med. 2005; 353: 33-45.
Relling MV, Boyett JM, Blanco JG, Raimondi S, Behm
FG, Sandlund JT, et al. Granulocyte colony-stimulating factor and the risk of secondary myeloid malignancy after etoposide treatment. Blood. 2003; 101:
3862-7.
Pui CH, Ribeiro RC, Hancock ML, Rivera GK, Evans
WE, Raimondi SC, et al. Acute myeloid leukemia in
children treated with epipodophillotoxins for acute lymphocytic leukemia. N Engl J Med. 2001; 325: 1682-7.
Libura J, Slater DJ, Felix CA, Richardson C. Therapyrelated acute myeloid leukemia-like MLL rearrangements are induced by etoposide in primary human
CD34+ cells and remain stable after clonal expansion
Blood. 2005; 105: 2124-31.
Ng A, Taylor GM, Eden OB. Genotoxicity of etoposide:
greater susceptibility of MLL than other target genes
Canc Gen and Cytogen. 2006; 164-7.
Metzler M, Strissel PL, Strick R, Niemeyer C,
Roettgers S, Borkhardt A, et al. Emergence of translocation t(9;11)-positive leukemia during treatment of
childhood acute lymphoblastic leukemia. Gen Chrom
Canc. 2004; 41: 291-6.
Haupt R, Fears TR, Heise A, Gadner H, Loiacono G,
De Terlizzi M, Tucker MA. Risk of secondary leukemia
after treatment with etoposide (VP-16) for
Langerhans’cell histiocytosis in Italian and AustrianGerman populations. Int J Cancer. 1997; 71: 9-13.
Xue Y, Lu D, Guo Y, Lin B. Specific chromosomal
translocations and therapy-related leukemia induced
by bimolane therapy for psoriasis. Leuk Res. 1992; 16:
1113-23.
Novoselac AV, Reddy S, Sanmugarajah J. Acute
promyelocytic leukemia in a patient with multiple sclerosis following treatment with mitoxantrone. Leukemia.
2004; 18: 1561-2.
Mistry AR, Felix CA, Whitmarsh RJ, Mason A, Reiter
A, Cassinat B, et al. DNA topoisomerase II in therapy-related acute promyelocytic leukemia. N Engl J
Med. 2005; 352: 1529-38.
Hasan SK, Mays AN, Ottone T, et al. Molecular analysis of t(15;17) genomic breakpoints in secondary acute
promyelocytic leukemia arising after treatment of multiple sclerosis. Blood. 2008; 112: 3383-90.
Pulsoni A, Pagano L, Lo Coco F, Avvisati G, Mele L,
Di Bona E, et al. Clinicobiological features and outcome of acute promyelocytic leukemia occurring as
a second tumor: the GIMEMA experience. Blood.
2002; 100: 1972-6.
Nakada S, Katsuki T, Imoto I, Yokoyama T, Nagasawa
M, Inazawa J, et al. Early G2/M checkpoint failure as
a molecular mechanism underlying etoposide-induced
chromosomal aberrations. J Clin Invest. 2006; 116: 809.
Ottone T, Hasan SK, Montefusco E, Curzi P, Mays AN,
Chessa L et al. Identification of a potential “hotspot”
DNA region in the RUNX1 gene targeted by mitoxantrone in therapy-related acute myeloid leukemia with
t(16;21) translocation. Gen Chrom Canc. 2009; 48:
213-2.
52. Sorahan T, Kinlen LJ, Doll R. Cancer risks in a historical UK cohort of benzene exposed workers. Occup
Environ Med. 2005; 62: 231-6.
53. Costantini AS, Benvenuti A, Vineis P, Kriebel D, Tumino
R, Ramazzotti V, Rodella S, et al. Risk of leukemia
and multiple myeloma associated with exposure to
benzene and other organic solvents: evidence from
the Italian Multicenter Case-control study. Am J Ind
Med. 2008; 51: 803-11.
54. Lan Q, Zhang L, Li G, Vermeulen R, Weinberg RS,
Dosemeci M, et al. Hematotoxicity in workers exposed
to low levels of benzene. Science. 2004; 306: 1774-6.
55. Vermeulen R, Li G, Lan Q, Dosemeci M, Rappaport
SM, Bohong X, et al. Detailed exposure assessment
for a molecular epidemiology study of benzene in two
shoe factories in China. Ann Occup Hyg. 2004; 48:
105-16.
56. Larson RA. Etiology and management of therapy-related myeloid leukemia. Hematology Am Soc Hematol
Educ Program. 2007: 453-9.
57. N, Ness KK, Ribeiro RC, Hudson MM. Acute leukemia
as a secondary malignancy in children and adolescents: current findings and issues. Cancer. 2009; 115:
23-35.
58. Schonfeld SJ, Gilbert ES, Dores GM, Lynch CF,
Hodgson DC, Hall P, et al. Acute myeloid leukemia
following Hodgkin lymphoma: apopulation-based
study of 35,511 patients. J Natl Cancer Inst. 2006;
98: 215-8.
59. Brusamolino E, Anselmo AP, Klersy C,Santoro M,
Orlandi E, Pagnucco G, et al. The risk of acute
leukemia in patientstreated for Hodgkin’s disease is
significantly higher after combined modality programs
than after chemotherapy alone and is correlated with
the extend of radiotherapy and type and durationof
chemotherapy. a case control study. Haematologica.
1998; 83: 812-23.
60. Josting A, Wiedenmann S, Franklin J, May M, Sieber
M, Wolf J, et al. Secondary myeloid leukemia and
myelodysplastic syndromes in patients treated for
Hodgkin’s disease: a report from the German
Hodgkin’s Lymphoma Study Group. J Clin Oncol.
2003; 21: 3440-6.
61. Delwail V, Jais JP, Colonna P, Andrieu JM. Fifteen-year
secondary leukaemiarisk observed in 761 patients with
Hodgkin’s disease prospectively treated by MOPP or
ABVD chemotherapy plus high-dose irradiation. Br J
Haematol. 2002.
62. Brusamolino E, Baio A, Orlandi E, Arcaini L,
Passamonti F, Griva V, et al. Long-term events in adult
patients with clinical stage IA-IIA nonbulky Hodgkin’s
lymphoma treated with four cycles of doxorubicin,
bleomycin, vinblastine, and dacarbazine and adjuvant
Leucemie secondarie therapy-related
63.
64.
65.
66.
67.
68.
69.
70.
71.
radiotherapy: a single-institution 15-year follow-up. Clin
Cancer Res. 2006; 12: 6487-93.
Engert A, Diehl V, Franklin J, Lohri A, Dörken B, Ludwig
WD, et al. Escalated-Dose BEACOPP in the Treatment
of Patients With Advanced-Stage Hodgkin’s
Lymphoma: 10 Years of Follow-Up of the GHSG HD9
Study. J Clin Oncol. 2009 Aug 24. [Epub ahead of print].
Schwartz CL, Constine LS, Villaluna D, London WB,
Hutchison RE, Sposto R, et al. A risk-adapted,
response-based approach using ABVE-PC for children
and adolescents with intermediate- and high-risk
Hodgkin lymphoma: the results of P9425. Blood. 2009;
114: 2051-9.
Sirohi B, Cunningham D, Powles R, Murphy F, Arkenau
T, Norman A, Oates J, Wotherspoon A, Horwich A.
Long-term outcome of autologous stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma.
Ann Oncol. 2008; 19: 1312-9.
Forrest DL, Hogge DE, Nevill TJ, Nantel SH, Barnett
MJ, Shepherd JD, et al. High-dose therapy and autologous hematopoietic stem-cell transplantation does
not increase the risk of second neoplasms for
patients with Hodgkin’s lymphoma: a comparison of
conventional therapy alone versus conventional therapy followed by autologous hematopoietic stem-cell
transplantation. J Clin Oncol. 2005; 23: 7994-8002.
Mudie NY, Swerdlow AJ, Higgins CD, Smith P, Qiao
Z, Hancock BW, Hoskin PJ, Linch DC Risk of second malignancy after non-Hodgkin’s lymphoma: a
British Cohort Study. J Clin Oncol. 2006; 24: 1568-74.
Sacchi S, Marcheselli L, Bari A, Marcheselli R, Pozzi
S, Luminari S, et al. Secondary malignancies after
treatment for indolent non-Hodgkin’s lymphoma: a 16year follow-up study. Haematologica. 2008; 93: 398404.
Lenz G, Dreyling M, Schiegnitz E, Haferlach T, Hasford
J, Unterhalt M, et al. Moderate increase of secondary hematologic malignancies after myeloablative
radiochemotherapy and autologous stem-cell transplantation in patients with indolent lymphoma: results
of a prospective randomized trial of the German
LowGrade Lymphoma Study Group. J Clin Oncol.
2004; 22: 4926-33.
Gyan E, Foussard C, Bertrand P, Michenet P, Le Gouill
S, Berthou C, et al. Groupe Ouest-Est des Leucémies
et des Autres Maladies du Sang (GOELAMS). Highdose therapy followed by autologous purged stem cell
transplantation and doxorubicin-based chemotherapy in patients with advanced follicular lymphoma: a
randomized multicenter study by the GOELAMS with
final results after a median follow-up of 9 years. Blood.
2009; 113: 995-1001.
Milligan DW, Kochethu G, Dearden C, Matutes E,
MacConkey C, Catovsky D on behalf of the UK
National Cancer Research Institute (NCRI)
Haematological Studies Group. High incidence of
myelodysplasia and secondary leukaemia in the UK
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
Medical Research Council Pilot of autografting in
chronic lymphocytic leukaemia. Brit J Haematol. 2006;
133: 173-75.
Andrè M, Mounier N, Leleu X, Sonet A, Brice P, HenryAmar M, et al. Second cancers and late toxicities after
treatment of aggressive non-Hodgkin lymphoma with
the ACVBP regimen: a GELA cohort study on 2.837
patients. Blood. 2004; 103: 1222-8.
Sacchi S, Marcheselli L, Bari A, Marcheselli R, Pozzi
S, Gobbi PG, et al. Second malignancies after treatment of diffuse large B-cell non-Hodgkin’s lymphoma:
a GISL cohort study. Haematologica. 2008; 93: 133542.
Metayer C, Curtis RE, Vose J, Sobocinski KA,
Horowitz MM, Bhatia S, et al. Myelodysplastic syndrome and acute myeloid leukemia after autotransplantation for lymphoma: a multicenter case-control study. Blood. 2003; 101: 2015-23.
Hake CR, Graubert TA, Fenske TS. Does autologous
transplantation directly increase t risk of secondary
leukemia in lymphoma patients? Bone Marrow
Transplant. 2007; 39: 59-70.
Laurenti L, Tarnani M, Chiusolo P, La Torre G, Garzia
M, Zollino M, et al. Low incidence of secondary neoplasia after autotransplantation for lymphoproliferative
disease: the role of pre-transplant therapy. Clin
Transplant. 2008; 22: 191-9.
Hijiya N, Hudson MM, Lensing S, Zacher M, Onciu
M, Behm FG, et al. Cumulative incidence of secondary neoplasms as a first event after childhood acute
lymphoblastic leukemia. JAMA. 2007; 297: 1207-15.
Pagano L, Annino L, Ferrari A, Camera A, Martino B,
Montillo M, et al. Secondary haematological neoplasm
after treatment of adult acute lymphoblastic leukemia:
analysis of 1170 adult ALL patients enrolled in the
GIMEMA trials. Gruppo Italiano Malattie Ematologiche
Maligne dell’Adulto. Br J Haematol. 1998; 100: 66976.
Verma D, O’Brien S, Thomas D, Faderl S, Koller C,
Pierce S, et al. Therapy-related acute yelogenous
leukemia and myelodysplastic syndrome in patients
with acute lymphoblastic leukemia treated with the
hyperfractionated cyclophosphamide, incristine, doxorubicin, and dexamethasone regimens. Cancer. 2009;
115: 101-10.
Stanulla M, Schaeffeler E, Möricke A, Coulthard SA,
Cario G, Schrauder A, et al Thiopurine methyltransferase genetics is not a major risk factor for secondary malignant neoplasms after treatment of childhood
acute lymphoblastic leukemia on Berlin-FrankfurtMünster protocols. Blood. 2009; 114: 1314-8.
Schmiegelow K, Al-Modhwahi I, Andersen MK,
Behrendtz M, Forestier E, Hasle H et al. Nordic Society
for Paediatric Haematology and Oncology. Methotrexate/6-mercaptopurine maintenance therapy influences the risk of a second malignant neoplasm after childhood acute lymphoblastic leukemia: results from the
47
48
Seminari di Ematologia Oncologica
NOPHO ALL-92 study. Blood. 2009; 113: 6077-84.
82. Howard RA, Gilbert ES, Chen BE, Hall P, Storm H,
Pukkala E et al. Leukemia following breast cancer: an
international population-based study of 376,825
women. Breast Cancer Res Treat. 2007; 105: 359-68.
83. Martin MG, Welch JS, Luo J, Ellis MJ, Graubert TA,
Walter MJ. Therapy related acute myeloid leukemia
in breast cancer survivors, a population-based study.
Breast Cancer Res Treat. 2009 Mar 26. [Epub ahead
of print].
84. Pagano L, Pulsoni A, Mele L, Tosti ME, Cerri R, Visani
G, et al. Gruppo Italiano Malattie Ematologiche
dell’Adults. Acute myeloid leukemia in patients previously diagnosed with breast cancer: experience of the
GIMEMA group. Ann Oncol. 2001.
85. Verkooijen HM, Fioretta G, Rapiti E, Vlastos G,
Neyroud-Caspar I, Chappuis PO, Bouchardy C.
Family history of breast or ovarian cancer modifies the
risk of secondary leukemia after breast cancer: results
from a population-based study. Int J Cancer. 2008; 122:
1114-7.
86. Beadle G, Baade P, Fritschi L. Acute myeloid
leukemia after breast cancer: a population-based comparison with hematological malignancies and other
cancers. Ann Oncol. 2009; 20: 103-9.
87. Beaumont M, Sanz M, Carli PM, Maloisel F, Thomas X,
Detourmignies L, et al. Therapy-related acute promyelocytic leukemia. J Clin Oncol. 2003; 21: 2123-37.
88. Smith RE, Bryant J, DeCillis A, Anderson S. National
surgical adjuvant breast and bowel project experience.
Acute myeloid leukemia and myelodysplastic syndrome after doxorubicin-cyclophosphamide adjuvant
therapy for operable breast cancer: the National
Surgical Adjuvant Breast and Bowel Project
Experience. J Clin Oncol. 2003; 21: 1195-204.
89. Bernard-Marty C, Mano M, Paesmans M, Accettura
C, Munoz-Bermeo R, Richard T, et al. Second malignancies following adjuvant chemotherapy: 6-year
results from a Belgian randomized study comparing
cyclophosphamide, methotrexate and 5-fluorouracil
(CMF) with an anthracycline-based regimen in adjuvant treatment of node-positive breast cancer patients.
Ann Oncol. 2003; 14: 693-8.
90. Praga C, Bergh J, Bliss J, Bonneterre J, Cesana B,
Coombes RC, et al. Risk of acute myeloid leukemia
and myelodysplastic syndrome in trials of adjuvant
epirubicin for early breast cancer: correlation with doses of epirubicin and cyclophosphamide. J Clin Oncol.
2005; 23: 4179-91.
91. Le Deley MC, Suzan F, Cutuli B, Delaloge S,
Shamsaldin A, Linassier C, et al. Anthracyclines, mitoxantrone, radiotherapy, and granulocyte colony-stimulating factor: risk factors for leukemia and myelodysplastic syndrome after breast cancer. J Clin Oncol.
2007; 25: 292-300.
92. Hershman D, Neugut AI, Jacobson JS, Wang J, Tsai
WY, McBride R, et al. Acute myeloid leukemia or
myelodysplastic syndrome following use of granulocyte colony-stimulating factors during breast cancer
adjuvant chemotherapy. J Natl Cancer Inst. 2007; 99:
196-205.
93. Patt DA, Duan Z, Fang S, Hortobagyi GN, Giordano
SH. Acute myeloid leukemia after adjuvant breast cancer therapy in older women: understanding risk. J Clin
Oncol. 2007; 25: 3871-6.
94. Seedhouse C, Russell N. Advances in the understanding of susceptibility to Treatment-related acute myeloid
leukaemia. Br J Haematol. 2007; 137: 513-29.
95. Guillem V, Tormo M. Influence of DNA damage and
repair upon the risk of treatment related leukemia. Leuk
Lymphoma. 2008; 49: 204-17.
96. Felix CA, Walker AH, Lange BJ, Williams TM, Winick
NJ, et al. Association of CYP3A4 genotype with treatment-related leukemia. Proc Natl Acad Sci USA. 1998;
95: 13176-81.
97. Barreto G, Madureira D, Capani F, Aon-Bertolino L,
Saraceno E, Alvarez-Giraldez LD. The role of catechols and free radicals in benzene toxicity: An oxidative DNA damage pathway. Environ Mol Mutagen.
2009 May 15
98. Voso MT, Fabiani E, D’Alò F, Guidi F, Di Ruscio A, Sica
S, et al. Increased risk of acute myeloid leukaemia due
to polymorphism in detoxification and DNA repair
enzymes. Ann Oncol. 2007; 18: 1523-8.
99. Larson RA, Wang Y, Banerjee M, Wiemels J, Hartford
C, Le Beau et al. Prevalence of the inactivating 609C>T polymorphism in the NAD(P)H:quinine oxidoreductase (NQO1) gene in patients with primary and therapy-related myeloid leukemia. Blood. 1999; 94: 803-7.
100. Allan JM, Wild CP, Rollinson S, Willett EV, Moorman
AV, Dovey GJ, et al. Polymorphism in glutathione Stransferase P1 is associated with susceptibility to
chemotherapy-induced leukemia. Proc Natl Acad Sci
USA 2001; 98: 11592-7. Erratum in: Proc Natl Acad
Sci. 2001; 98: 15394.
101. Allan JM, Smith AG, Wheatley K, Hills RK, Travis LB,
Hill DA, et al. Genetic variation in XPD predicts treatment outcome and risk of acute myeloid leukemia following chemotherapy. Blood. 2004; 104: 3872-7.
102. Worrillow LJ, Travis LB, Smith AG, Rollinson S, Smith
AJ, Wild CP, et al. An intron splice acceptor polymorphism in hMSH2 and risk of leukemia after treatment
with chemotherapeutic alkylating agents. Clin Cancer
Res. 2003; 9: 3012-20.
103. Worrillow LJ, Smith AG, Scott K, Andersson M,
Ashcroft AJ, Dores GM, et al. Polymorphic MLH1 and
risk of cancer after methylating chemotherapy for
Hodgkin lymphoma. J Med Genet. 2008; 45: 142-6.
104. Offman J, Gascoigne K, Bristow F, Macpherson P,
Bignami M, Casorelli I, et al. Repeated sequences in
CASPASE-5 and FANCD2 but not NF1 are targets for
mutation in microsatellite-unstable acute leukemia/
myelodysplastic syndrome. Mol Cancer Res. 2005; 3:
251-60.
Leucemie secondarie therapy-related
105. Ellis NA, Huo D, Yildiz O, Worrillow LJ, Banerjee M,
et al. MDM2 SNP309 and TP53 Arg72Pro interact to
alter therapy-related acute myeloid leukemia susceptibility. Blood. 2008; 112: 741-9.
106. Rowe JM. Therapy of secondary leukemia. Leukemia.
2002; 16: 748-50.
107. Rizzieri DA, O’Brien JA, Broadwater G, Decastro CM,
Dev P, Diehl L, et al. Outcomes of patients who undergo aggressive induction therapy for secondary acute
myeloid leukemia. Cancer. 2009; 115: 2922-9.
108. Pagano L, Pulsoni A, Vignetti M, Tosti ME, Falcucci P,
Fazi P, et al. GIMEMA. Secondary acute myeloid
leukaemia: results of conventional treatments. Experience
of GIMEMA trials. Ann Oncol. 2005; 16: 228-33.
109. Goodman KA, Riedel E, Serrano V, Gulati S,
Moskowitz CH, Yahalom J. Long-term effects of highdose chemotherapy and radiation for relapsed and
refractory Hodgkin’s lymphoma. J Clin Oncol. 2008;
26: 5240-7.
110. Broder H, Gottlieb RA, Lepor NE. Chemotherapy and
cardiotoxicity. Rev Cardiovasc Med. 2008; 9: 75-83.
111. Breccia M, Frustaci AM, Cannella L, Stefanizzi C,
Latagliata R, Cartoni, et al. Comorbidities and FLT3ITD abnormalities as independent prognostic indicators of survival in elderly acute myeloid leukaemia
patients. Hematol Oncol. 2009; 27: 148-53.
112. Sorror ML, Sandmaier BM, Storer BE, Maris MB,
Baron F, Maloney DG, et al Comorbidity and disease
status based risk stratification of outcomes among
patients with acute myeloid leukemia or myelodysplasia receiving allogeneic hematopoietic cell transplantation. J Clin Oncol. 2007; 25: 4246-54.
113. Schoch C, Kern W, Schnittger S, Hiddemann W,
Haferlach T. Karyotype is an independent prognostic
parameter in therapy-related acute myeloid leukemia
(t-AML): an analysis of 93 patients with t-AML in comparison to 1091 patients with de novo AML. Leukemia.
2004; 18: 120-5.
114. Larson RA. Is secondary leukemia an independent
115.
116.
117.
118.
119.
120.
poor prognostic factor in acute myeloid leukemia? Best
Pract Res Clin Haematol. 2007; 20: 29-37.
Borthakur G, Lin E, Jain N, Estey EE, Cortes JE,
O’Brien S, et al Survival is poorer in patients with secondary,core-binding factor acute myelogenous
leukemia compared with de novo core-binding factor
leukemia. Cancer. 2009; 115: 3217-21.
Chang C, Storer BE, Scott BL, Bryant EM, Shulman
HM, Flowers ME, et al. Hematopoietic cell transplantation in patients with myelodysplastic syndrome or
acute myeloid leukemia arising from myelodysplastic
syndrome: similar outcomes in patients with de novo
disease and disease following prior therapy or
antecedent hematologic disorders. Blood. 2007; 110:
1379-87.
Kroger N, Brand R, van Biezen A, Zander A,
Dierlamm J, Niederwieser D, et al. Risk factors for therapy-related myelodysplastic syndrome and acute
myeloid leukemia treated with allogeneic stem cell
transplantation. Haematologica. 2009; 94: 542-49.
Pullarkat V, Slovak ML, Dagis A, Bedell V, Somlo G,
Nakamura R, Stein AS,O’Donnell MR, Nademanee
A, Teotico AL, Bhatia S, Forman SJ. Acute leukemia
and myelodysplasia after adjuvant chemotherapy for
breast cancer: durable remissions after hematopoietic stem cell transplantation. Ann Oncol. 2009 Jun 29.
[Epub ahead of print].
Josting A, Wiedenmann S, Franklin J, May M, Sieber
M, Wolf J, Engert A, Diehl V. German Hodgkin’s
Lymphoma Study Group. Secondary myeloid leukemia
and myelodysplastic syndromes in patients treated for
Hodgkin’s disease: a report from the German
Hodgkin’s Lymphoma Study Group. J Clin Oncol.
2003; 21: 3440-6.
Fianchi L, Pagano L, Leoni F, Storti S, Voso MT,
Valentini CG, et al. Gemtuzumab ozogamicin, cytosine
arabinoside, G-CSF combination (G-AraMy) in the
treatment of elderly patient with poor-prognosis acute
myeloid leukemia. Ann Oncol. 2008; 19: 128-34.
49
51
Terapie innovative
ADRIANO VENDITTI, LICIA OTTAVIANI, CHIARA SARLO, LUIGI DI CAPRIO,
MICOL QUARESIMA, SVITLANA GUMENIUK, MARIA GIOVANNA CEFALO,
ELEONORA CERESOLI, MARIA ILARIA DEL PRINCIPE, LUCA MAURILLO,
FRANCESCO BUCCISANO, SERGIO AMADORI
Cattedra di Ematologia, Fondazione Policlinico Tor Vergata, Roma
n INTRODUZIONE
Nonostante gli evidenti progressi registrati nelle ultime due decadi, i limiti della chemioterapia intensiva impiegata nel trattamento della leucemia mieloide acuta (LMA) dell’adulto rimangono considerevoli. Circa il 20-25% dei pazienti di età <60 anni
non ottiene la remissione completa (RC) con la
terapia di induzione (citosina arabinoside + antraciclina ± etoposide), mentre circa il 60-70% di quelli che la ottengono sono destinati a morire a causa della ripresa di malattia, entro 4 anni circa dalla diagnosi. Per i pazienti di età >60 anni la prognosi è significativamente peggiore con un overall survival rate a 5 anni non superiore al 10-15%
(1, 2). È probabile quindi, che le attuali strategie
chemioterapiche abbiano espresso il massimo delle loro potenzialità, cosicché non è lecito attendersi ulteriori miglioramenti in termini di efficacia terapeutica se non a prezzo di inaccettabile tossicità.
Emerge quindi, la richiesta di nuove molecole
capaci di potenziare l’efficacia delle terapie convenzionali, di superare la resistenza ad esse od
infine disponibili per pazienti anziani non in grado di tollerare i regimi chemioterapici correnti. Per
Parole chiave: leucemia mieloide acuta, terapie innovative, inibitori di tirosin-chinasi, terapia epigenetica, analoghi dei nucleosidi.
Indirizzo per la corrispondenza
Prof. Adriano Venditti
Reparto di Ematologia
Fondazione Policlinico Tor Vergata
Viale Oxford, 81 - 00133 Roma
e-mail: [email protected]
Adriano Venditti
questa ultima categoria, l’esigenza di nuove strategie terapeutiche è ancora più avvertita; si stima
che al 70% circa, dei pazienti anziani con LMA non
venga offerta nessuna forma di terapia a causa
del cattivo performance status, della presenza di
patologie associate o della semplice percezione
che il paziente possa non tollerare chemioterapia
intensiva (1). L’evolversi della terapia della LMA sta
attraversando una fase di transizione in cui i risultati clinici non riflettono fedelmente i notevoli progressi compiuti nella comprensione dei meccanismi patogenetici (3, 4). Un modello, recentemente proposto come paradigma patogenetico della
LMA, è quello che prevede la cooperazione di due
diverse classi di mutazioni: di tipo I e di tipo II, le
prime con funzioni mitogeniche ed anti-apoptotiche e le seconde di inibizione della differenziazione (1, 5). Numerose molecole (Tabella 1) in grado di interferire con i pathways di tali mutazioni
sono in corso di valutazione nel contesto di trials
clinici, come singoli agenti o in associazione a chemioterapia. Questo modello, così detto two-hits, è
di estremo interesse biologico ed è verosimile che
rispecchi con ragionevole accuratezza la patogenesi multistep della LMA, ciò nonostante non spiega in modo convincente l’emergenza di forme particolari quali quelle associate ad alterazioni del cromosoma 5 e/o 7. È verosimile che per queste forme, il modello two-hits vada corretto per la presenza di ulteriori variabili, come ad esempio l’evento epigenetico, ormai considerato un passaggio
eziopatogenetico chiave nella leucemogenesi.
I meccanismi epigenetici, così come le stesse
mutazioni della classe II, possono essere target
di specifica terapia mediante inibitori delle DNAmetil-trasferasi e delle istone-deacetilasi (Tabella
52
Seminari di Ematologia Oncologica
Evento patogenetico
Agente terapeutico
Classe I
Mutazioni di FLT3
Inibitori di FLT3
(PKC-412, CEP-701,
MLN-518, SU-11248)
Mutazioni di KIT
Inibitori di c-KIT
(imatinib, dasatinib,
AMN107)
Mutazioni di RAS
Inibitori di Farnesyl
transferasi (tipifarnib,
lonafarnib)
Iperespressione di BCL2
“Antisense” di BCL
(oblimersen)
Attivazione NFk-B
Inibitori del
proteasoma
(bortezomib)
Attivazione di PI3K/Ak/mTOR Inibitori di mTor
(rapamicina, sirolimus,
temsirolimus)
Classe II
RUNX1-MTG8
CBFβ-MYH11
MLL PTD
Terapia epigenetica
(inibitori DNA
metil-transferasi#
e istone-deacetilasi§)
Ipermetilazione
Terapia epigenetica
(inibitori DNA metil-transferasi# e istone-deacetilasi§)
#
5-Azacitidina, Decitabina. §Acido Valproico, Depsipetide, Vorinostat
(SAHA).
TABELLA 1 - Potenziali “targets” in relazione alle classi di
mutazioni osservabili nella leucemogenesi.
2). È quindi auspicabile che un approccio terapeutico mirato soddisfi, più efficacemente di quello
convenzionale, l’esigenza oramai universalmente
percepita di trattare non la LMA bensì le sue diverse “espressioni genetico-molecolari” che rendono
tale patologia estremamente eterogenea. Alcuni
di questi aspetti saranno discussi di seguito, così
come la disponibilità di nuovi agenti citotossici e
di nuove molecole potenzialmente in grado di interagire con specifici target intracellulari (Tabella 2).
n INIBITORI DEL SIGNALLING
INTRACELLULARE
Inibitori delle tirosin chinasi
Molti dei meccanismi leucemogenetici dipendono
dalla fosforilazione, tirosin chinasi mediata, di resi-
Classe
Agente
Immunoterapici
Gemtuzumab
Ozogamicin,
Lintuzumab, antirecettori GM-CSF,
vaccino-terapia (WT1)
Bevacizumab,
Talidomide,
Lenalidomide
MK-0457, VX-680,
AZD1152
Amonafide
Clofarabina,
Troxacitabina, Triapina,
Sapacitabina, Citosina
Arabinoside coniugata
ad acido elaidico
Cloretiazina
Antiangiogenetici
Inibitori di aurora chinasi
Inibitori di topoisomerasi II
Analoghi dei nucleosidi
Alchilanti
TABELLA 2 - Nuove classi di farmaci e nuovi farmaci di classi
note in corso di valutazione per il trattamento della leucemia
mieloide acuta.
dui tirosinici di proteine coinvolte nei processi proliferativi, di regolazione dell’apoptosi e dell’angiogenesi. Le tirosin chinasi sono enzimi che catalizzano il trasferimento di un gruppo fosfato sul residuo tirosinico di proteine bersaglio, influenzandone la funzione o la destinazione (Figura 1) (6).
Anomalie genetiche che comportano mutazioni
delle tirosin chinasi o dei loro recettori ne inducono un’attivazione costitutiva. FLT3 è un recettore
tirosin chinasico transmembranario, intensamente espresso nel 70-100% dei pazienti con LMA.
In circa il 25-30% di questi, FLT3 si caratterizza
per una mutazione nota come internal tandem
duplication (ITD) che occorre nel dominio juxtamembranario, in circa il 5-10% dei pazienti è invece presente una mutazione puntiforme dell’ansa
di attivazione di FLT3. Entrambe le condizioni attivano costitutivamente il recettore, a sua volta in
grado di innescare la cascata del signalling a valle così promuovendo la proliferazione cellulare (46). Le mutazioni di FLT3 sono, dopo quelle di
NPM1, le più frequenti nelle LMA a cariotipo normale e sono associate, in particolare ITD, ad una
prognosi sfavorevole (4-6).
Queste osservazioni hanno fatto da background
allo sviluppo di specifici inibitori di FLT3 e, sebbene numerose molecole siano state riportate ave-
Terapie innovative
re attività inibitoria nei confronti di questo, al
momento solo alcuni farmaci di questa classe sono
al vaglio della sperimentazione clinica: PKC412
(midostaurin), CEP701 (lestaurtinib), MLN518
(tandutinib), SU11248 (sunitinib) e BAY439006
(sorafenib) (7). PKC412 o midostaurin è un inibitore orale di FLT3 la cui efficacia è stata valutata, come singolo agente, in uno studio iniziale di
fase II che ha arruolato 25 pazienti con LMA (8).
In 7 (25%) di questi si è osservata una riduzione
della blastosi midollare e di quella periferica del
50% e 70%, rispettivamente. Tali effetti sono stati comunque transitori e della durata non superiore ai 2-3 mesi.
A seguito di tali risultati, è stato generato un successivo studio di fase IB, in cui midostaurin veniva combinato con daunorubicina e citosina arabinoside, per pazienti con LMA di nuova diagnosi (9). La frequenza globale di RC osservata era
del 71% con una significativa prevalenza nei
pazienti con mutazione rispetto a quelli wild-type.
Infatti, di 12 pazienti con ITD, 11 ottenevano la RC
suggerendo una maggiore efficacia dell’inibitore
nei mutanti rispetto ai wild-type. Il Cancer and
Leukemia Group B (CALGB) in collaborazione con
altri gruppi statunitensi ed europei, fra i quali il
Gruppo Italiano Malattie Ematologiche dell’Adulto
(GIMEMA), ha recentemente avviato uno studio
di fase III che prevede la somministrazione randomizzata di midostaurin a pazienti con LMA de
novo e mutazioni di FLT3, di età <60 anni e che
riceveranno un ciclo di induzione con daunorubicina e citosina arabinoside (3+7). CEP701 o
lestaurtinib è un inibitore di FLT3 con ottima biodisponibilità orale. In uno studio randomizzato di
fase III, pazienti con LMA in prima recidiva e mutazioni di FLT3 venivano trattati con chemioterapia
± lestaurtinib. Lo schema di chemioterapia adottato dipendeva dalla durata della precedente remissione; i pazienti con precedente durata della remissione ≤6 mesi ricevevano un ciclo secondo schema MEC (mitoxantrone, etoposide, citosina arabinoside), quelli con una precedente durata di RC
di >6-24 mesi venivano trattati con alte dosi di citosina arabinoside (10).
Dei 22 pazienti trattati nel braccio chemioterapia
+ lestaurtinib, 5 ottenevano la RC e 5 la remissione parziale (RP); dei 22 trattati nel braccio solo
chemioterapia, 3 ottenevano la RC e 3 la RP, indicando un trend a favore del braccio di combina-
FLT3 ligando
1. Legame tra recettore
e suo ligando
SCF
a
Mem br an
cellu lare
2. Omodimerizzazione
dei recettori
FLT3
c-KIT
P
P
P
3. Autofosforilazione
dei residui tirosinici
recettoriali
P
Autofosforilazione
4. Attivazione del
“signalling”
intracellulare
Attivazione
SRC
Jak2
Ras
Pkc
PI3K/Akt
Membrana nucleare
mTOR
FoxO3
NFkB
Stat
Trascrizione dei geni “target”
C-Myc
5. Attivazione
di fattori della
trascrizione
6. Regolazione
di proliferazione,
differenziazione
e sopravvivenza
FIGURA 1 - La figura mostra il pathway di attivazione del segnale intracellulare mediato dai
recettori tirosin-chinasici. A seguito del legame fra il dominio extramembranario del recettore e suo ligando, i recettori stessi omodimerizzano ed attivano i processi di fosforilazione
a valle che conducono alla trascrizione genica. Le mutazioni dei recettori determinano uno
stato di attivazione costitutivo, generando
segnali proliferativi continui.
53
54
Seminari di Ematologia Oncologica
zione. Gli autori hanno anche dimostrato che, con
il dosaggio di 80 mg due volte al giorno, è possibile ottenere concentrazioni plasmatiche adeguate in più del 60% dei pazienti.
Questo è un dato rilevante, poiché gli stessi autori dimostrano anche che la combinazione di attività plasmatica inibente FLT3 e suscettibilità in vitro
a leustartinib correlano significativamente con la
risposta clinica. MLN518 o tandutinib è un inibitore di FLT3 biodisponibile per via orale ed impiegato in un iniziale studio di fase I per pazienti con
LMA in recidiva/resistente o con sindrome mielodisplastica (SMD) ad alto rischio.
Sono stati reclutati 40 pazienti, con o senza mutazioni di FLT3, i quali hanno ricevuto tandutinib
come singolo agente alla dose di 525 mg due volte al giorno (11).
Gli studi di farmacodinamica condotti nel corso del
trial, indicano che con questo dosaggio l’effetto di
riduzione del contenuto in FLT3 fosforilato comincia già poche ore dopo la somministrazione del
farmaco e persiste per diversi giorni. In un successivo studio di fase II che ha incluso pazienti con
LMA ITD positiva, si è osservata una riduzione del
50% della blastosi midollare in 11 di 25 pazienti,
1 paziente ha ottenuto la RC. Anche l’effetto sulla blastosi periferica è stato drammatico poiché in
diversi dei 25 casi è stata riportata l’induzione di
una leucopenia (12). A seguito di tali risultati, è stato attivato uno studio di fase I/II in cui tandutinib
è stato combinato a chemioterapia convenzionale (3+7 standard) per il trattamento di pazienti con
diagnosi di LMA de novo; tandutinib veniva somministrato per via orale nei giorni 0-14 (13). La frequenza di risposta globale è stata del 70% e 21
di 30 pazienti hanno ottenuto la RC. Tali risultati
indicano che tandutinib possiede attività clinica e
che ulteriori trials clinici sono necessari per caratterizzare al meglio il profilo di efficacia di questa
molecola. Due ulteriori inibitori di FLT3 sono stati investigati, come singoli agenti, in studi clinici di
fase I; questi sono sunitinib (14) e sorafenib (15).
L’impiego delle due molecole in monoterapia ha
fornito risposte parziali di breve durata. Quindici
pazienti con LMA resistente, sono stati trattati con
sunitinib per 4 cicli settimanali, seguiti da sospensione del farmaco per 1-2 settimane (14). Alla dose
iniziale di 50 mg non sono state osservate tossicità limitanti la dose, quella successiva di 75 mg
è stata abbandonata per la comparsa, in un caso,
di scompenso cardiaco. Tutti i pazienti con FLT3
mutato hanno risposto almeno in modo parziale,
al contrario solo 2 dei 10 valutabili senza mutazione, hanno ottenuto una risposta; le risposte erano comunque transitorie e di breve durata.
Sorafenib è stato impiegato in uno studio di fase
I, in 15 pazienti con LMA resistente o in recidiva
o con SMD ad alto rischio (15). Lo studio era di
dose finding e di confronto di due diverse schedule. Era quindi prevista la somministrazione di una
dose iniziale di 200 mg due volte al giorno fino a
quella massima di 1.200 mg, secondo un disegno
standard 3+3. I pazienti venivano randomizzati in
un braccio A (sorafenib per 5 giorni a settimana)
o B (sorafenib per 14 giorni ogni 21). Dieci pazienti hanno ricevuto almeno un ciclo di sorafenib e 6
hanno risposto (3 nel braccio A e 3 nel B). Gli autori concludono che sorafenib è sicuro e che la dose
massima tollerata non è ancora stata raggiunta.
Non sono a tutt’oggi riportati studi di combinazione chemioterapia più sunitinib o sorafenib. In generale, nessuno dei 5 inibitori di FLT3 in sperimentazione clinica, ha dimostrato di offrire vantaggi
superiori rispetto agli altri. Tutti sono in grado, come
confermato dai test farmacodinamici, di inibire il
target farmacologico, ciononostante le risposte cliniche osservate sono modeste e limitate ad una
transitoria clearance dei blasti periferici e/o midollari. È ragionevole ritenere che la modesta efficacia clinica degli inibitori di FLT3 impiegati come singoli agenti, possa esser imputata al fatto che le
mutazioni di FLT3 costituiscano soltanto una delle possibili alterazioni genetiche somatiche necessarie per la trasformazione leucemica. Questa
osservazione e quella di una azione sinergistica
in vitro tra inibitori di FLT3 e chemioterapici, quando quest’ultimi vengano somministrati simultaneamente o precedentemente agli stessi inibitori (16),
hanno appunto stimolato lo sviluppo di protocolli
di associazione per il trattamento delle LMA con
mutazioni di FLT3. È concepibile che un’ulteriore
linea di sperimentazione clinica consista nel tentativo di interferire con pathways multipli coinvolti nella leucemogenesi; questo si potrà ottenere
mediante la combinazione di inibitori di FLT3 con
altri agenti diretti contro targets molecolari oppure mediante l’impiego di inibitori cosiddetti multitargeted come ad esempio ABT869, capace di ini-
Terapie innovative
bire contemporaneamente la fosforilazione di FLT3,
STAT5 e ERK (17).
Inibitori di farnesyl transferasi
La farnesyl transferasi (FT) agisce farnesilando i
residui terminali di cisteina di una ampia gamma
di proteine fra le quali quelle della famiglia delle
retrovirus-associated DNA sequence viral oncogene homologue (RAS), coinvolte in pathways di
attivazione fitogenica (18). Circa il 30% delle LMA
sono descritte avere mutazioni di RAS la cui conseguente attivazione costitutiva stimola la proliferazione cellulare; le mutazioni di RAS potrebbero
quindi avere un ruolo patogenetico nella leucemogenesi. Gli inibitori di FT interferendo con la farnesilazione di RAS ne bloccano il trasferimento alla
membrana citoplasmatica e precludono quindi, la
trasduzione di segnali mitogenici. È verosimile
comunque che anche la inibizione della farnesilazione di altre proteine sia elemento rilevante per
l’attività degli inibitori di FT (19). Attualmente, sono
al vaglio della sperimentazione clinica due inibitori di FT: tipifarnib (R115777) e lonafarnib
(SCH66336) (20). Tipifarnib è un inibitore di FT
disponibile per via orale e studiato tanto in LMA
de novo che in recidiva o refrattarie. Lancet et al.
(21) hanno riportato l’ottenimento della RC in 22
(14%) di 158 pazienti anziani affetti da LMA de
novo ad alto rischio e trattati con tipifarnib, 600 mg
due volte al giorno per 21 giorni, ogni 28 giorni,
per un massimo di 4 cicli. La RP è stata osservata in 15 pazienti (9%), per un overall response rate
del 23%. La durata mediana della RC è stata di
7 mesi, quella della sopravvivenza 18 mesi, per i
pazienti rispondenti. La somministrazione del farmaco è stata ben tollerata e l’inibizione della farnesilazione è stata dimostrata nella maggioranza
dei campioni biologici esaminati. Harousseau et
al. (22) hanno somministrato tipifarnib con la medesima schedula impiegata da Lancet, ad una coorte di 252 pazienti affetti da LMA in recidiva o refrattaria. Undici (4%) pazienti hanno ottenuto la RC
e la sopravvivenza mediana per questi è stata di
369 giorni. In entrambe le esperienze si sottolinea
come la mielosoppressione sia stata l’evento
avverso più frequente. Fra gli eventi avversi
extraematologici si osservavano principalmente
febbre, nausea ed ipokaliemia. Recentemente,
Raponi et al. (23) hanno identificato un profilo geni-
co potenzialmente in grado di predire la risposta
alla terapia con tipifarnib. In particolare, gli autori
hanno identificato due geni, RASGRP1, un attivatore di RAS che regola lo scambio nucleotidico di guanina, e APTX, convolto nei meccanismi
di riparo del DNA, il cui rapporto di espressione
è correlato con la probabilità di risposta. Come singolo agente, tipifarnib è stato testato in uno studio di fase III che intendeva confrontare l’efficacia di tipifarnib verso la miglior terapia di supporto (inclusa, laddove necessario, idrossiurea), in
pazienti anziani non eleggibili per chemioterapia
intensiva (24). Alla dose convenzionale di 600 mg
due volte al giorno per 21 giorni, ogni 28, tipifarnib non ha offerto benefici superiori a quelli della
terapia di supporto. In uno studio di fase II, tipifarnib è stato anche somministrato in regime di mantenimento alla dose di 400 mg due volte al giorno, per 14 giorni ogni 21, a partire dal recupero
ematopoietico dopo terapia di consolidamento
(25). I pazienti arruolati erano 48 adulti con diagnosi di LAM de novo, ad alto rischio per età >60
anni, citogenetica sfavorevole o diagnosi di LMA
secondaria. La durata mediana della sopravvivenza libera da malattia era di 13,5 mesi, significativamente superiore rispetto a quella di 23 pazienti con caratteristiche similari ed utilizzati come controllo storico. Gli autori concludono che tipifarnib
potrebbe avere un ruolo nella terapia di mantenimento di pazienti con LMA ad alto rischio ma sottolineano anche la necessità di ulteriori studi per
confermare tale ipotesi. Infine, è recentissima la
segnalazione da parte di Karp et al. della potenziale efficacia di tipifarnib in associazione ad etoposide orale. In uno studio di fase I, 84 pazienti
di età >70 anni e non eleggibili per chemioterapia intensiva, sono stati trattati con l’associazione tipifarnib 300-600 mg, due volte al giorno per
14-21 giorni, ogni 28 più etoposide orale alla dose
di 100-200 mg, somministrato nei giorni 1-3.
Ventuno (47%) pazienti hanno ottenuto la RC, indicando come tale associazione possa essere promettente quando usata in pazienti non altrimenti
trattabili (26). È anche da segnalare, per i suoi
potenziali sviluppi terapeutici, la recente osservazione che in vitro tipifarnib possiede una potente
attività inibitoria nei confronti di MDR-1 (multi drug
resistance associated protein 1) ed un sinergismo
citotossico con daunorubicina (27). Lonafarnib
55
56
Seminari di Ematologia Oncologica
(SCH66336) è una molecola meno attivamente
investigata ed i dati disponibili sono relativi ad uno
studio dose finding di fase I, in cui pazienti con
LMA sono stati trattati insieme ad altri con diverse patologie ematologiche neoplastiche quali leucemie linfoblastiche acute, leucemie mieloidi croniche in fase blastica e SMD ad alto rischio (19,
20). I risultati di questo studio hanno identificato
la dose raccomandata in quella di 200 mg due volte al giorno. L’efficacia di tale dose è stata quindi
valutata in uno studio di fase II che ha incluso una
coorte di pazienti con emopatie maligne in fase
avanzata (19, 20). Una interim analysis condotta
su 54 pazienti di cui 19 con LMA, ha fornito una
frequenza di risposta globale del 19% (10/54); uno
dei 10 pazienti rispondenti era affetto da LMA.
Sono ovviamente necessari ulteriori studi clinici per
meglio definire il profilo di efficacia di lonafarnib
nel trattamento della LMA.
Inibitori del proteasoma
Il sistema ubiquitina-proteasoma è un complesso
proteasico fondamentale per la funzione cellulare poiché presiede ai meccanismi di degradazione di proteine ubiquitinate. Le proteine da degradare sono marcate con una catena di ubiquitina,
successivamente la proteina ubiquitinata è degradata dal proteasome con rilascio di peptidi e ubiquitina libera (Figura 2) (19, 28, 29). A causa della sua funzione il complesso ubiquitina-proteasome è coinvolto nella modulazione di numerosi fattori trascrizionali e regolatori dell’apoptosi, di cicline, di inibitori delle chinasi ciclino-dipendenti quali P27, di geni soppressori quali Tp53 e proto-oncogeni quali c-Jun (19, 28-30). In questo scenario è
vitale, per il fisiologico svolgersi dei programmi
intracellulari, il controllo funzionale del nuclear factor NF-kB strettamente dipendente dalla inibizione, appunto ubiquitina-proteasome mediata, della proteina IkBα (28, 29). In altri termini, l’attivazione di NF-kB avviene successivamente alla
degradazione proteolitica del suo inibitore IkBα.
La degradazione di IkBα è un evento finemente
regolato dal sistema ubiquitina-proteasoma. Dato
che NF-kB è costitutivamente attivato in numerose neoplasie fra le quali le LMA, inibire il proteasoma determinerebbe accumulo intracellulare di
NF-kB inattivo, con conseguente arresto del ciclo
ed induzione dell’apoptosi (31-33). Bortezomib
(PS-341) è un inibitore ad azione reversibile del
proteasoma, la cui efficacia e profilo di tossicità
sono stati valutati in un iniziale studio di fase I, in
pazienti pediatrici con LMA resistente (34). I
pazienti hanno tratto scarso beneficio dalla somministrazione di bortezomib e la neutropenia e confusione di grado severo sono stati gli eventi avversi dose-limitanti. Uno studio sovrapponibile è stato condotto in 15 pazienti adulti con LMA resistente o in recidiva (35). Cinque dei 15 in studio hanno risposto in modo tale da soddisfare i criteri del
miglioramento ematologico, inteso come risoluzione della blastosi periferica. La diarrea, la nausea,
la ritenzione di liquidi e l’ipotensione ortostatica erano gli eventi avversi più frequentemente osservati. La modesta efficacia di bortezomib come singolo agente ha stimolato la generazione di trials
di fase I-II volti ad esplorare un possibile effetto
sinergico tra bortezomib e terapia citotossica.
Trentuno pazienti adulti con LMA (22 de novo e
9 in recidiva), hanno ricevuto un trattamento che
associava bortezomib ad idarubicina e citosina arabinoside (36). Tale combinazione ha dato prova di
Ubiquitinazione
O
UBI
UBI
NH2
HN
Lisina
Lisina
Proteina substrato
UBI
UBI
UBI
UBI
UBI
Proteina ubiquitinata
Proteasome
UBI = ubiquitina
Proteina degradata
FIGURA 2 - La figura mostra il pathway ubiquitina-proteasoma. Le proteine substrato da
degradare sono coniugate a ubiquitina ad opera di enzimi noti come ubiquitina-ligasi. Il complesso che si forma è una proteina poliubiquitinata che viene riconosciuta dal proteasoma
e degradata. La degradazione della proteina
substrato libera ubiquitina, che si rende disponibile per un nuovo ciclo di poliubiquitinazione. L’inibizione del proteasoma determina l’accumulo intracellulare di proteine substrato in
grado di interferire con il processo proliferativo ed apoptotico.
Terapie innovative
sicurezza, grazie ad un profilo di tossicità accettabile e di efficacia clinica poiché il 61% dei pazienti ha ottenuta la RC. Sulla base di questi risultati
il CALGB ha avviato uno studio di fase III per il
trattamento di pazienti anziani con LMA non precedentemente trattata. Infine, sono di interesse, per
le potenziali implicazioni terapeutiche, le osservazioni che in vitro bortezomib è sinergico con tipifarnib nell’inibire la chemioresistenza cell-adhesion
mediata e che nelle LMA vi è una estrema eterogeneità nel profilo di attività proteasomica dipendente dalla esistenza di almeno sei subunità proteasomiche, ciascuna con variabile sensibilità a
bortezomib (37).
Inibitori di mTOR
mTOR (mamalian target of rapamycin) è una chinasi coinvolta nella regolazione della crescita e proliferazione cellulare in virtù della sua capacità di
controllo translazionale della funzione di alcune
proteine quali ad esempio p27kip1 (inibitore delle chinasi ciclina-dipendenti), la proteina del retinoblastoma, c-myc, ciclina D1 o STAT3. (38)
Ancora più recentemente è stato dimostrato che
mTOR è un complesso costituito da due scaffold
proteins denominate raptor e rictor noti anche
come complesso mTORC1 e mTORC2, rispettivamente. L’interesse di tale osservazione risiede
RTK
Ras
Attivazione
nel fatto che mentre raptor (mTORC1) è rapamicina-sensibile, rictor (mTORC2) attiva un pathway
rapamicina-resistente (39) (Figura 3). È peraltro
ormai evidente che mTOR rappresenta il terminale di una cascata di attivazione che vede coinvolti altri due enzimi che sono PI3K (phosphatidylinositol 3-kinase) e AKT (serine/threonine protein
kinase Akt); l’insieme di tali enzimi costituisce un
sistema noto come PI3K/AKT/mTOR pathway.
Circa il 50-80% dei pazienti con LMA mostra un’attivazione costitutiva dell’asse PI3K/AKT/mTOR,
conseguenza della fosforilazione di AKT (39);
accanto a questa, anche le mutazioni di classe I
(Tabella 1) possono fungere da potenziali attivatori del pathway PI3K/AKT/mTOR (40, 41).
Sebbene non vi sia nessuna evidenza che correli lo stato di attivazione di PI3K/AKT/mTOR con
aspetti clinico-biologici quali classificazione FAB
(French-American-British), percentuale di infiltrazione blastica nel midollo od alterazioni citogenetiche (42), alcune segnalazioni iniziali hanno indicato una più breve durata di sopravvivenza e intervallo libero da malattia per quei casi con attivazione costitutiva del pathway PI3K/AKT/mTOR (43,
44). Più recentemente e sorprendentemente, è stato riportato che le LMA de novo con attivazione
del pathway PI3K/AKT/mTOR hanno una migliore prognosi grazie ad una minore frequenza di reci-
Recettori delle
tirosin-chinasi
(PDGFr; c-KIT;
ErbR; IGFR; FLT3)
p110
PI3K
p85
Autofosforilazione
AKT
Subunità
mTORC2
Rapamicina
resistente
Rictor
mTOR
Raptor
Promuove la transizione
del ciclo cellulare da G1 in S
interagendo con: 4EBP1, p27 e
Ciclina D1
Subunità
mTORC1
Rapamicina
sensibile
Effetti inibitori su apoptosi interagendo con:
BAD, Bcl-2, p53
FIGURA 3 - Il pathway PI3K/AKT/mTOR può
essere innescato da stimoli a monte mediati da RAS o recettori delle tirosin-chinasi che
attivano PI3K. L’autofosforilazione di AKT
costituisce un’ altra modalità di attivazione del
pathway. In entrambi i casi si determina a
cascata l’attivazione di mTOR che modula, tramite l’interazione con mediatori intermedi, i
processi proliferativi e di morte programmata. L’impiego di inibitori di mTOR deve tener
conto del fatto che questo si compone di due
subunità (mTORC1 o raptor e mTORC2 o rictor). Mentre raptor è rapamicina sensibile, rictor controlla una via di trasmissione del segnale cellulare che è rapamicina resistente.
57
58
Seminari di Ematologia Oncologica
dive rispetto a quelle forme non associate all’attivazione di PI3K/AKT/mTOR (45). Una possibile
spiegazione fornita dagli autori è che l’attivazione di PI3K/AKT/mTOR sarebbe in grado di guidare in fase S anche le cellule leucemiche staminali, aumentandone la suscettibilità all’azione dei
farmaci fase S-specifici (45).
Si tratta di un’osservazione interessante, che attende comunque conferme anche in virtù del fatto che
ulteriori e molto recenti segnalazioni tendono, al
contrario, a riaffermare il significato prognostico sfavorevole della iperattivazione del segnale
PI3K/AKT/mTOR-mediato (46, 47). Alcuni autori
imputano tale prognosi sfavorevole al fatto che il
pathway PI3K/AKT/mTOR controlla anche
l’espressione di membrana degli ATP-binding cassette transporters, alla cui famiglia appartiene
MDR-1, notoriamente coinvolta nei meccanismi di
chemioresistenza (48, 49). L’insieme di queste
osservazioni ha costituito il background sperimentale affinché l’uso di inibitori del sistema
PI3K/AKT/mTOR, come singoli agenti o in combinazione con altri farmaci, venisse posto al vaglio
della ricerca clinica (Tabella 3). La classe degli inibitori di mTOR è certamente quella in fase più
avanzata di sviluppo; a questa appartengono il sirolimus (rapamicina) ed i suoi derivati temsirolimus
(CCI-779), everolimus (RAD001) e deforolimus
(AP23573) (Tabella 3).
Le iniziali esperienze con rapamicina, dimostraFarmaco
Target(S)
Rapamicina
Temsirolimus (CCI-779)
Everolimus (RAD001)
AP23573
UCN-01
BAG956
Perifosina
JNK
Triciribina
mTORC1
mTORC1/mTORC2
mTORC1/mTORC2
mTORC1
PDK1, Chk1, PKC
PDK1, p110 PI3Ks
Akt, MEK/ERK 1/2,
Akt1, Akt2, Akt3
mTORC1: mamalian target of rapamycin complex 1; mTORC2: mamalian target of rapamycin complex 2; PDK1:phosphoinositide-dependent
protein kinase 1; Chk1: checkpoint kinase 1; PKC: protein kinase C; PI3K:
phosphatidylinositol 3-kinase; Akt: serine/threonine protein kinase Akt;
MEK: mitogen-activated protein kinase/extracellular signal related kinase; ERK:extracellular signal-regulated kinase 1/2; JNK; jun NH2-terminal kinase
TABELLA 3 - Inibitori del “pathway” PI3K/Akt/mTOR in corso di
valutazione clinica (modificata da Martelli AM et al. (39)).
no un effetto inibitorio in vitro, effetto peraltro molto selettivo. Infatti, alcuni ricercatori francesi hanno osservato come l’inibizione da rapamicina sia
marcata nei confronti del compartimento clonogenico leucemico mentre quello normale ne è risparmiato. Dei 9 pazienti con LMA de novo, refrattaria o in recidiva trattati con rapamicina, 4 hanno
ottenuto una riduzione della blastosi periferica
>50% con una durata mediana della risposta di
38 giorni (50). A seguito di tale promettente osservazione si è dato impulso all’impiego preferenziale di analoghi di rapamicina (temsirolimus, everolimus) che sperimentalmente hanno mostrato
capacità inibitoria anche verso mTORC2 (rictor),
ossia verso il pathway rapamicina-resistente.
Everolimus è stato valutato in uno studio di fase
I, in pazienti con neoplasie ematologiche, fra le
quali LMA, in recidiva o refrattarie a precedenti trattamenti (51). Non sono state osservate tossicità
limitanti la dose e gli eventi avversi di grado 3 più
comunemente riportati sono stati iperglicemia, ipofosforemia, astenia, anoressia e diarrea. Nessun
dei pazienti con LMA ha mostrato alcuna evidenza di risposta completa o parziale.
Deforolimus è stato testato anch’esso come singolo agente, in uno studio di fase II, in 22 pazienti con diagnosi di LMA (52). Solo in un paziente
si osservava un miglioramento ematologico, inteso come normalizzazione del numero dei polimorfonucleati. Eventi avversi osservati erano dolore
buccale, astenia, nausea e trombocitopenia; tali
effetti collaterali erano comunque di lieve entità e
tutti reversibili. Numerose evidenze sperimentali
suggeriscono un effetto sinergico, additivo o
addirittura di ripristino della chemiosensibilità
quando rapamicina o i suoi analoghi vengano combinati con chemioterapici (53). Di 23 pazienti con
LMA refrattaria, in recidiva o secondaria trattati con
MEC (mitoxantrone, etoposide, ARA-C) più sirolimus, 4 (tutti in prima recidiva) hanno hanno ottenuto la RC. Studi di farmacocinetica condotti parallelamente allo studio clinico, indicano come
miglior schedula quella che prevede una loading
dose di sirolimus di 12 mg al giorno 0, seguita da
una dose di 4 mg giornalieri dal giorno 1 al 10 (54).
Il gruppo GIMEMA ha recentemente avviato uno
studio di fase II che prevede l’associazione di temsirolimus e clofarabina per il trattamento di
pazienti anziani con LMA in prima recidiva o resi-
Terapie innovative
stente ad una prima linea di trattamento. Il gruppo EORTC (European Organization for the
Treatment of Cancer), in collaborazione con lo
stesso gruppo GIMEMA ha in fase di attivazione
uno studio di fase II che prevede l’associazione
everolimus e chemioterapia per il trattamento di
pazienti anziani con LMA de novo.
Inibitori dell’angiogenesi
Il potenziale ruolo della terapia antiangiogenetica
si è venuto delineando grazie all’osservazione che
i livelli plasmatici di mediatori angiogenetici ed il
grado di densità microvascolare del midollo osseo
sono parametri associati ad una cattiva prognosi
nelle LMA (55). In generale, i trials clinici con impiego di un’ampia gamma di agenti antiangiogenetici hanno fornito risultati poco incoraggianti.
Semaxinib (SU5416) è uno tra i primi inibitori del
vascular endothelial growth factor (VEGF) giunto
all’attenzione della ricerca clinica. Si tratta di una
piccola molecola con effetto inibente nei confronti non solo dei recettori 1 e 2 di VEGF ma anche
di FLT3 e c-KIT. In uno studio di fase II, semaxinib, somministrato per via orale, ha mostrato di
possedere attività anti-leucemica sebbene le
risposte indotte fossero di breve durata (56). In un
ulteriore studio di fase II, le risposte cliniche, seppur rare e transitorie, erano correlate ad una riduzione dei livelli circolanti di mRNA-VEGF e della
densità microvascolare midollare (57).
Bevacizumab è un anticorpo monoclonale di classe IgG, umanizzato, ricombinante, diretto contro
VEGF di cui ne impedisce il legame con lo specifico recettore. Con l’obiettivo di intensificare l’effetto anti-leucemico della chemioterapia, bevacizumab è stato impiegato per il trattamento di
pazienti con LMA refrattaria o in recidiva, nel contesto di una schedula sequenziale in cui veniva
somministrato 12 ore dopo il termine di citosina
arabinoside e novantrone. Di 48 pazienti trattati,
16 (33%) hanno ottenuto una RC e 7 (15%) una
RP; in 15 pazienti valutati in modo seriale, la somministrazione del bevacizumab era seguita da una
marcata riduzione della densità microvascolare
midollare e da un effetto neutralizzante sui livelli
plasmatici di VEGF (58). Presso MD Anderson
Cancer Center, è stato recentemente completato e chiuso all’arruolamento uno studio di fase III
in cui pazienti con LMA de novo erano randomiz-
zati per una terapia che prevedeva idarubicina e
citosina arabinoside ± bevacizumab. La talidomide e la lenalidomide sono agenti correntemente
impiegati per il trattamento di diverse forme di neoplasie ematologiche fra le quali SMD e mieloma
multiplo. La loro azione anti-tumorale è verosimilmente dovuta all’interferenza con più di uno dei
meccanismi attivi nella cancerogenesi. Fra i possibili effetti esercitati dalle due molecole vengono
ipotizzati quelli immunomodulatori, l’inibizione
della trascrizione NF-kB-dipendente, l’inibizione
della espressione di molecole di adesione e citochine coinvolte nella neoangiogenesi, l’induzione
di stress ossidativo mitocondriale ed una potente azione antinfiammatoria (59-61). Talidomide e
lenalidomide sono state approvate dalla Food and
Drug Administration per il trattamento rispettivamente, del mieloma multiplo e delle SMD con delezione del braccio lungo del cromosoma 5; attualmente sono in sperimentazione in diversi trias clinici, fra i quali alcuni specificatamente sviluppati
per la terapia della LMA. In studi iniziali di fase III che hanno arruolato pazienti con LMA resistente o in recidiva, sono state somministrate dosi intermedie-alte di talidomide (200-800 mg) con le quali gli autori descrivono una diminuzione della densità microvascolare midollare nei pazienti con una
qualche forma di risposta (62, 63). Un successivo studio di fase II ha esplorato l’efficacia della
associazione talidomide e chemioterapia (fludarabina, carboplatino, e topotecan) per il trattamento di pazienti con LMA ad alto rischio (64). Dei 42
pazienti reclutati allo studio, 10 (24%) hanno ottenuto la RC, eventi avversi gravi di natura tromboembolica sono stati osservati in 5 pazienti suggerendo che la combinazione con citotossici potrebbe essere trombogenica e richiedere una profilassi specifica.
Nei pazienti che raggiungevano la RC era possibile evidenziare una riduzione della densità microvascolare midollare ma non una riduzione dei livelli plasmatici dei mediatori angiogenetici. Gli autori concludono che il ruolo della talidomide nel
potenziare gli effetti della chemioterapia è tutt’altro che chiaro e quindi da meglio esplorare.
Riguardo alla lenalidomide, i dati disponibili sono
prevalentemente relativi a casi aneddotici, in cui
viene dimostrato l’ottenimento della remissione
citogenetica in presenza di alterazioni cromoso-
59
60
Seminari di Ematologia Oncologica
miche quali trisomia 13 (65), delezione del braccio lungo del cromosoma 5 (66) e delezioni del
cromosoma 5 (67). Tali osservazioni indicano che
lenalidomide è meritevole di ulteriori valutazioni
sperimentali e difatti, diversi trials clinici sono in
corso con l’obbiettivo di saggiare l’efficacia del farmaco come singolo agente o in combinazione. In
particolare, l’Università di Ulm sponsorizza uno studio di fase I, di recente attivazione, che recluta
pazienti con LMA de novo, resistente o in recidiva. Si tratta di uno studio di dose finding, che impiega lenalidomide come singolo agente, ad una dose
iniziale di 25 mg.
Inibitori di Bcl-2
Bcl-2 è un oncogene coinvolto nei processi regolatori dell’apoptosi, molto frequentemente iperespresso nelle neoplasie linfoidi e mieloidi. In
situazione fisiologica, i segnali apoptotici viaggiano dalla membrana cellulare verso i mitocondri,
in questa sede avviene l’attivazione del citocromo C che a sua volta induce apoptosi caspasimediata. In questo scenario la funzione di Bcl-2
consiste nello stabilizzare la superficie interna della membrana mitocondriale, prevenendo l’attivazione del citocromo C e prevenendo quindi l’innesco dell’apoptosi medesima (68, 69). Ne deriva quindi, che l’iper-espressione di Bcl-2 conferisce alla cellula leucemica un profilo di resistenza all’apoptosi, anche a quella chemioterapiaindotta, e identifica forme di LMA a peggior prognosi (69, 70). Con lo scopo di inibire il pathway
Bcl-2-dipendente è stato sviluppato un oligonucleotide antisense capace di legare mRNA-Bcl2 citoplasmatico e di indurne la degradazione così
riducendo i livelli intracitoplasmatici della proteina Bcl-2. Tale oligonucleotide, noto come oblimersen, è stato impiegato in un iniziale studio di fase
I in associazione a fludarabina, citosina arabinoside e granulocyte colony-stimulating factor (GCSF), in pazienti con leucemia acuta sia mieloide che linfoide, resistente a precedenti terapie o
in recidiva. Nove di 20 (45%) pazienti hanno risposto, in particolare, 6 (di cui 5 LMA) hanno ottenuto la RC (71). In un successivo studio di fase
I, oblimersen è stato somministrato tanto in induzione, con citosina arabinoside e daunorubicina,
che in consolidamento, con le alte dosi di citosina arabinoside. In questo caso i pazienti eleggi-
bili erano di età >60 anni e con LMA non precedentemente trattata (72). Quattordici di 29 (48%)
pazienti valutabili hanno ottenuto la RC e sulla
base di tali promettenti risultati il CALGB ha avviato uno studio di fase III appunto per valutare il ruolo dell’aggiunta di oblimersen a citosina arabinoside e daunorubicina, in induzione, e alle alte dosi
di citosina arabinoside, in consolidamento, in
pazienti anziani con LMA de novo.
Inibitori di aurora chinasi
Gli inibitori di aurora-chinasi costituiscono una nuova e recente classe di farmaci il cui sviluppo è stato implementato a seguito della dimostrazione dell’esistenza di enzimi definiti aurora chinasi (AK).
La famiglia delle aurora comprende tre chinasi A, B, C - che svolgono un ruolo chiave nel corretto e fisiologico svolgimento della mitosi (73, 74)
(Figura 4). In quanto enzimi associati al ciclo cel-
FIGURA 4 - La figura mostra la funzione svolta da aurora-chinasi A e B nel corso della mitosi. Aurora-chinasi A (quella in rosso) partecipa alla funzione del centrosoma, preparando l’ingresso nella mitosi tramite la formazione del fuso mitotico (profase
e metafase). Aurora B (quella in verde) è un enzima cromosomico “passeggero” che controlla la corretta segregazione cromatidica durante la mitosi e la successiva fase di separazione
degli stessi cromatidi (anafase e telofase). Aurora A e B sono
iperespresse in circa il 30% dei casi di LMA.
Terapie innovative
lulare, le AK sono iper-espresse durante la cancerogenesi; in particolare, nelle cellule di LMA si
è osservato un drammatico incremento dell’attività di AK B e, seppure in misura minore, di AK
A (75). Gli inibitori attualmente in sviluppo clinico
sono: VX680, AZD1152, PHA739358, MLN8054
e CYC116 (76). In vitro, tali inibitori si sono mostrati capaci di inibire la fosforilazione dei substrati di
AK, attivare p53 e l’apoptosi caspasi-dipendente,
esercitare effetti antiproliferativi mediante il blocco della formazione del fuso mitotico, arrestando
le cellule in fase G2/M (75-77). A dispetto di una
così ampia valutazione sperimentale, i dati clinici
generati sono ancora scarsi. Sono attesi i risultati di uno studio di fase I-II con AZD1152, recentemente completato mentre è in corso di attivazione presso diversi centri europei uno studio di
fase II, già aperto all’arruolamento negli Stati Uniti
volto ad esplorare l’efficacia, la sicurezza e la tollerabilità di AZD1152 da sola o in combinazione
con basse dosi di citosina arabinoside, in pazienti anziani con diagnosi di LMA de novo.
n TERAPIA EPIGENETICA
L’evento epigenetico è quello in grado di modificare il profilo di espressione di un determinato
gene senza alterarne la sequenza nucleotidica. Si
tratta di un meccanismo la cui finalità è il controllo trascrizionale, meglio ancora, è un meccanismo
di silenziamento genico. L’esempio paradigmatico
è rappresentato dalla fisiologica e randomica inattivazione di uno dei cromosomi X nella donna; è
questo un processo che si svolge sotto il controllo epigenetico ed avviene tramite silenziamento
genico. I pathways tramite i quali l’evento epigenetico esercita la sua funzione sono:
1) metilazione del DNA mediante enzimi noti
come DNA-metiltransferasi (DNMT);
2) interferenza con il segnale di traslazione ad
opera di microRNA;
3) interferenza con il rimodellamento nucleosomico ad opera di un complesso enzimatico noto
come singed wings locus (SWL);
4) deacetilazione delle code istoniche presenti nella catena di DNA, mediata da enzimi detti istone-deacetilasi (IDAC) (78-80).
Nonostante uno scarso interesse negli anni ’80 ed
agli inizi di quelli ‘90, l’attenzione degli esperti verso questi aspetti biologici si è più recentemente
rivitalizzata grazie alla convincenti dimostrazioni
sperimentali che nella LMA, e più in generale nelle neoplasie, sono attivamente operanti aberranti fenomeni di silenziamento genico (81). Le maggiori novità ed i risultati più promettenti in termini
di ricerca clinica riguardano principalmente le categorie degli inibitori delle DNMT e delle IDAC.
Inibitori di DNMT
Le DNMT determinano silenziamento genico
mediante la metilazione (inserimento di gruppi
CH3) di specifici siti del DNA noti come CpG
islands (cytosine preceding guanosine islands). In
altri termini, la metilazione riguarda solo la citosina che, nella sequenza del DNA, precede la guanosina. L’osservazione che circa la metà dei geni
del genoma umano abbiano il loro promoter alloggiato nelle CpG islands rende ragione del ruolo
fondamentale di quest’ultime. In condizioni fisiologiche le CpG islands sono non-metilate, la loro
metilazione comporta l’inattivazione del promoter
in esse alloggiato e quindi la mancata trascrizione di quel determinato gene che dal quel promoter dipende (silenziamento genico) (81).
Attualmente sono conosciute 5 isoforme di DNMT
(1, 2, 3A, 3B e 3L) di cui si ritiene soltanto 3 essere enzimaticamente attive (1, 3A e 3B); è ovvio
quindi che il rationale che sostiene l’impiego clinico di inibitori di DNMT è quello di bloccare i fenomeni di aberrante metilazione del DNA, ripristinando la trascrizione dei geni silenziati (81, 82). Gli
inibitori più estesamente investigati sono due analoghi dei nucleosidi, noti come azacitidina (AZA)
e decitabina (DAC), già approvati dalla Food and
Drug Administration per il trattamento delle SMD.
L’enorme interesse scientifico riguardo l’uso di queste molecole è testimoniato dal fatto che, presso
il registro statunitense clinicaltrials.gov del National
Institute of Health, sono registrati non meno di 8090 studi clinici, in corso o completati, che impiegano AZA o DAC come singoli agenti o in associazione, per il trattamento della LMA. Uno studio
di fase I, con dosi scalari di DAC (5-20 mg/m2, per
5 giorni a settimana, per 2 settimane consecutive), ha arruolato 50 pazienti di cui 44 con
LMA/SMD ad alto rischio, 5 con leucemia mielomonocitica cronica ed 1 con leucemia linfoide acu-
61
62
Seminari di Ematologia Oncologica
ta (83). Il trattamento è stato ben tollerato a tutti i
livelli di dose, essendo la mielosoppressione l’evento avverso più frequentemente riportato. Risposte
sono state osservate a tutti i livelli di dose ma quella di 15 mg/m2 è apparsa la più efficace con un
65% di risposte (11 di 17 pazienti). Gli autori concludono sottolineando la maggiore efficacia delle
basse dosi di DAC rispetto alle alte. L’analisi dei
risultati di un successivo studio di fase II con DAC
somministrata alla dose di 20 mg/m2 per 5 giorni
ogni 4 settimane, ha fornito una frequenza di RC
del 26% (14 di 55 pazienti valutabili). I pazienti, la
cui età mediana era di 74 anni, erano affetti da
LMA non precedentemente trattata. Gli eventi
avversi di grado 3-4 più frequenti sono stati neutropenia febbrile, dispnea, astenia e polmonite (84).
Silverman et al. hanno pubblicato i risultati di
un’analisi retrospettiva di 309 casi di SMD reclutati in tre studi sequenziali di fase III, in cui i pazienti erano randomizzati per ricevere AZA o miglior
terapia di supporto (85). L’analisi retrospettiva è
consistita nell’enucleare da questi 309 pazienti, i
casi che, sulla base dei criteri della World Health
Organization (WHO), potevano essere ri-classificati come LMA, per valutarne il decorso.
Applicando i criteri diagnostici WHO, 103 di 309
pazienti venivano ri-classificati come LMA. I 27 di
questi che erano stati assegnati al braccio di trattamento con AZA, presentavano una durata
mediana della sopravvivenza di 19.3 mesi verso
12.9 mesi di coloro assegnati al braccio miglior
terapia di supporto. Un’ulteriore analisi retrospettiva, frutto della collaborazione tra diversi centri
ematologici italiani, ha consentito di selezionare
55 pazienti con LMA ad alto rischio per età >60
anni, citogenetica o fase di malattia (LMA refrattarie, in recidiva o de novo in pazienti non eleggibili per chemioterapia intensiva), trattati con AZA.
Di 51 pazienti valutabili, 8 (16%) hanno ottenuto
la RC, 5 (10%) la RP e 5 (10%) un miglioramento ematologico, per una frequenza globale di risposta del 35% (18/51). La probabilità attuariale di
sopravvivenza a 16 mesi era del 45% per i pazienti rispondenti verso il 10% di quelli resistenti
(p=0,0027). Gli autori concludono che in una categoria di pazienti con LMA a prognosi particolarmente sfavorevole, AZA può essere utilizzata con
sicurezza, è efficace e prolunga significativamente la sopravvivenza (86).
Inibitori di IDAC
Le IDAC, di cui sono note 18 isoforme distribuite
in 4 diverse classi, sono così denominate poiché
catalizzano il trasferimento di gruppi acetili dal
coenzima A acetilato ai residui di lisina delle code
istoniche del DNA. Che le code istoniche del DNA
siano acetilate o meno è evento rilevante ai fini
della trascrizione genica, le code istoniche acetilate conferiscono al DNA una conformazione aperta rendendo i geni accessibili agli enzimi trascrizionali, al contrario il DNA assume una conformazione chiusa laddove le code istoniche siano deacetilate, impedendo la trascrizione genica (87, 88).
Quindi, gli inibitori di IDAC agiscono modulando
l’espressione genica tramite l’inibizione della deacetilazione delle code istoniche di DNA e riposizionando il DNA stesso in una conformazione
accessibile agli enzimi trascrizionali. Vi sono evidenze che gli inibitori di IDAC esercitino anche
effetti addizionali quali produzione di radicali
ossigenati, acetilazione di proteine chaperone,
interferenza con il pathway del NF-kB ed induzione di apoptosi (89). Sono noti diversi farmaci ad
azione inibitoria nei confronti delle IDAC quali l’acido valproico (AVP), il fenilbutirrato (FB), alcune
benzamidi come MS-275 e MGCD0103, i peptidi ciclici come romidepsin (depsipeptide) ed in fine,
acidi idroxamici come vorinostat e tricostatina A
(Tabella 4) (88). L’AVP è stato impiegato come sin-
Farmaco
Target inibito
Acidi grassi a catena corta
Acido valproico
Fenilbutirrato
Acidi idroxamici
Vornostat (SAHA)
Tricostatina A
ITF2375
Peptidi biciclici
Depsipeptide (romidepsin)
Trapoxina
FK228
Benzamidi
MS-275
MGCD0103
CI-994
IDAC di classe I-II
IDAC di classe I-II
IDAC di classe I-II
IDAC di classe I e IV
TABELLA 4 - Inibitori di istone deacetilasi in corso di
sperimentazione clinica.
Terapie innovative
golo agente in studi di fase I e II, mostrando un’attività clinica modesta. In uno studio di 20 pazienti anziani con SMD o LMA, AVP è stato somministrato alla dose di 10 mg/kg; di 11 pazienti valutabili in 5 si è osservata una risposta ematologica (90). In un trial successivo, 75 pazienti con SMD
o LMA sono stati trattati con AVP orale in modo
continuativo con lo scopo di ottenere una concentrazione plasmatica dello stesso tra 50 e 100 µg/ml
(91). La frequenza di risposta era del 30% con tossicità caratterizzata da tremori ed astenia. Il FB ha
dato prova anch’esso di modesta attività clinica in
pazienti con SMD o LMA, le risposte erano prevalentemente ematologiche e di breve durata.
L’ulteriore sviluppo clinico del farmaco è stato ostacolato dalla necessità di infusione continua prolungata e dalla tossicità a carico del sistema nervoso centrale (88). Riguardo alle benzamidi, MS275 è stato utilizzato in uno studio di fase I che
ha arruolato 39 pazienti con LMA resistente o in
recidiva. Il farmaco è stato somministrato per via
orale, alla dose di 4-8 mg/m2 a settimana, per 4
settimane di un ciclo della durata di 6. Le risposte sono consistite essenzialmente in miglioramenti ematologici o stabilizzazione di malattia. La dose
massima tollerata è stata identificata in quella di
8 mg/m2, a causa della comparsa di tossicità ematologica (88). Romidepsin è stato a lungo considerato un ottimo candidato per il trattamento dei
disordini mieloproliferativi per la sua capacità di inibire in vitro le IDAC anche a concentrazioni molto basse (88, 92). Di 10 pazienti con LMA trattati con romidepsin, nessuno ha ottenuto una RC/RP
ma uno ha sviluppato una sindrome da lisi tumorale (92). In un successivo studio di 11 pazienti
con LMA/SMD, uno ha ottenuto la RC e 6 mantenevano una malattia stabile (92). A dispetto delle iniziali speranze, romidepsin, come singolo
agente, ha dimostrato un’efficacia clinica molto limitata. Vorinostat, derivato dell’acido idroxamico, è
stato approvato dalla Food and Drug Administration statunitense per il trattamento dei linfomi
cutanei. Riguardo al suo impiego per il trattamento delle LMA, esiste un unico trial clinico di fase I
che ha arruolato 41 pazienti con LMA, SMD e leucemia mielomonocitica cronica. Il farmaco è stato somministrato alla dose di 100-300 mg 2-3 volte al giorno per 2 settimane con una settimana di
intervallo. Risposte si sono osservate in 7 pazien-
ti (2 RC e 2 RC con incompleto recupero ematologico) e la tossicità dose-limitante è consistita in
diarrea, nausea, malessere ed astenia (88, 92).
In generale, l’esperienza con gli inibitori di IDAC,
come singoli agenti, non è stata tale da replicare
quella riportata con gli inibitori di DNMT ed è verosimile che il futuro di tali farmaci sarà quello di
essere impiegati in associazione con altri.
Terapie epigenetiche di combinazione
Sulla base di quanto detto, si è venuto creando
un crescente interesse verso l’uso di terapie che
impieghino inibitori di DNMT e di IDAC in associazione tra di loro o con altri farmaci. Numerosi
studi di fase I-II sono in corso, come testimoniato dal fatto che presso il website del National
Institute of Health (NIH) sono registrati non meno
di 12-15 studi di combinazione. Blum et al. (93)
hanno riportato i risultati di uno studio di fase I che
ha inteso stabilire la dose biologica ottimale di DAC
come singolo agente e quindi, la dose massima
tollerata di AVP combinato a DAC. Sono stati arruolati 25 pazienti di età mediana 70 anni e con LMA
non precedentemente trattata o in recidiva. Di questi 25, 14 sono stati trattati con DAC come singolo agente. Delle due dosi test investigate (15 e 20
mg/m2 per 10 giorni), la dose biologica ottimale è
stata identificata in quella di 20 mg/m2, questo sulla base del superiore effetto di ipometilazione globale del DNA da tale dose indotto. I rimanenti 11
dei 25 pazienti arruolati, sono stati trattati con la
combinazione DAC (20 mg/m2 per 10 giorni) e AVP
a dosi incrementali (15, 20, 25 mg/kg dal giorno
5 al 21). Di 21 pazienti valutabili, 8 hanno ottenuto la RC e 3 la RP, per una frequenza globale di
risposta del 52%, 2 dei 2 pazienti trattati con DAC
e AVP alla dose di 25 mg/kg hanno sviluppato una
encefalopatia dose-limitante. Gli autori concludono che le bassi dosi di DAC sono sicure ed efficaci ma che la comparsa di encefalopatia nella
associazione con AVP richiede l’uso di farmaci
alternativi a quest’ultimo. Lübbert et al. hanno
avviato un trial con DAC per pazienti con LMA de
novo, di età >60 anni e non eleggibili per chemioterapia intensiva (86). DAC è stata somministrata alla dose di 135 mg/m2 in infusione continua per
72 ore, ogni 6 settimane per 4 cicli. Dal giorno 1
al 28 di ciascun ciclo veniva anche somministrato acido all trans retinoico (ATRA) al dosaggio di
63
64
Seminari di Ematologia Oncologica
45 mg/m2. Il protocollo prevedeva anche una fase
di mantenimento con DAC somministrata alla dose
di 20 mg/m2 nei giorni 1-3, ogni 6-8 settimane per
4 cicli. Sono stati reclutati allo studio 155 pazienti tutti valutabili, la frequenza globale di risposta è
stata del 25% (23 RC e 10 RP) con tossicità accettabile. FB è stato uno dei primi inibitori di IDAC usato in combinazione con AZA (95). AZA è stata
somministrata alla dose di 25-75 mg/m2 per 5-14
giorni, seguita da FB alla dose di 375 mg/kg al
giorno per 7 giorni, mediante infusione continua.
I cicli erano ripetuti ogni 28 giorni. Le risposte più
significative (RC e RP) sono state riportate ad una
dose di 50 mg/m2 di AZA. In 12 pazienti veniva
peraltro riportata una assoluta correlazione tra
risposta ed induzione di effetto demetilante (93).
Soriano et al. hanno arruolato 53 pazienti (49 LMA,
4 SMD alto rischio) in uno studio di fase I-II che
combinava AZA (75 mg/m2, giorni 1-7 per via sottocutanea) con alte dosi di AVP (50-70 mg/kg, giorni 1-7 per via orale) e ATRA (45 mg/m2, giorni 35 per via orale). I 49 pazienti con LMA erano anziani, non eleggibili per chemioterapia convenzionale, con malattia resistente o in recidiva (96). Gli
autori riportano una frequenza di RC del 29%,
risposte midollari del 13%, la durata mediana della risposta era di 26 settimane. Voso et al. hanno
recentemente pubblicato i risultati di uno studio
cooperativo GIMEMA che ha arruolato 62 pazienti con SMD a rischio intermedio-2 o alto (90), trattati con AVP fino al raggiungimento di una concentrazione plasmatica ≥50 µg/ml, cui seguiva l’inserimento di AZA per via sottocutanea, alla dose
di 75 mg/m2 al giorno, giorni 1-7 (97). Dei 62
pazienti arruolati 19, poiché affetti da anemia refrattaria con eccesso di blasti, potevano essere riclassificati come LMA, secondo i criteri WHO. La frequenza globale di risposta (RC/RP) è stata del
30,7% con una durata mediana della sopravvivenza di 14,4 mesi. Tra i fattori prognostici significativi per l’impatto sulla sopravvivenza, gli autori identificano l’International Prognostic Scoring System
e una concentrazione plasmatica di AVP ≥50 µg/ml
al momento di iniziare AZA (p=0,013 e 0,007,
rispettivamente). Sebbene la combinazione di
agenti epigenetici rimanga un’area di interesse e
di intensa attività di ricerca, rimane tutt’ora da dimostrare la sua superiorità rispetto all’impiego di inibitori delle DNMT come singoli agenti. Soltanto stu-
di di fase III potranno rispondere a questo quesito e chiarire definitivamente se il dato clinico correla con quello biologico, validando la funzione predittiva di quest’ultimo. Infine, sono anche da segnalare tentativi di investigare schedule di associazione tra inibitori di IDAC ed ATRA. Cimino et al. (98)
hanno condotto uno studio pilota che prevedeva
la somministrazione sequenziale di AVP ed
ATRA. Il rationale biologico era quello di combinare l’azione di rimodellamento cromatinico esercitata da AVP con l’effetto di riprogrammazione differenziativa indotta da ATRA. Sono stati trattati 8
pazienti con LMA ad alto rischio e non eleggibili
per chemioterapie standard. Si sono osservati 2
casi di miglioramento ematologico e 5 pazienti hanno mantenuto una stabilità di malattia di durata
compresa fra 60 e 180 giorni. Da un punto di vista
biologico, in 7 degli 8 pazienti era possibile documentare i segni della differenziazione mediante
tecniche citogenetiche di ibridizzazione in situ; infatti, le lesioni citogenetiche di esordio erano presenti anche nelle cellule più mature confermando la
loro discendenza dal clone leucemico.
n IMMUNOTERAPIA
Il gemtuzumab ozogamicin (GO), un immunoconiugato diretto contro l’antigene CD33, è il prototipo di questa classe e tra gli agenti più estesamente studiati in anni recenti. Il CD33 è una
glicoproteina transmembranaria di 67 kilodalton
appartenente alla famiglia delle siglecs-3 che interagiscono con l’acido sialico. Il CD33 è espresso
in >90% delle LMA ma non dalla cellula staminale pluripotente o dai tessuti extraematopoietici. La sua espressione viene sotto-modulata
durante il processo maturativo della cellula mieloide così che è positivo a bassa intensità sui granulociti del sangue periferico e sui macrofagi tessutali (19, 99). Il GO è un anticorpo monoclonale anti-CD33, di classe IgG4 ed umanizzato per
più del 93% della sua molecola. L’anti-CD33 è
coniugato ad un antibiotico naturale noto come
calicheamicina,
isolato
dall’actinomicete
Micromonospora echinospora calichensis. La
coniugazione tra GO ed anti-CD33 è resa possibile grazie ad un linker bifunzionale (acido butanoico) che ha la caratteristica di essere stabile
Terapie innovative
quando esposto al pH fisiologico ematico di 7,4
e di rilasciare calicheamicina quando esposto al
pH lisosomiale di 4 (99). A seguito del legame con
il CD33 il complesso GO-CD33 viene rapidamente internalizzato nei lisosomi citoplasmatici dove,
per effetto della idrolisi acida del linker, la calicheamicina viene liberata, accede al nucleo e danneggia la doppia elica di DNA. Il danno al DNA viene causato da un derivato della calicheamicina
che si genera per un processo di riduzione della stessa, catalizzato dalla glutatione-reduttasi.
Tale metabolita intermedio della calicheamicina,
danneggia la doppia elica del DNA legandola
mediante un sito di legame definito come DNA
minor groove binding (99, 100). L’uso del GO in
monoterapia è stato inizialmente valutato in tre
studi di fase II condotti in Europa e negli Stati Uniti.
Il report finale circa questi studi era relativo a 277
pazienti di età mediana di 61 anni e con LMA in
prima recidiva (101). I pazienti avevano ricevuto
GO alla dose di 9 mg/m2 al giorno 1 e 15. Il 13%
dei pazienti ha ottenuto una RC ed il 13% una
RC con incompleto recupero ematologico. La
durata mediana della sopravvivenza era di 4,9
mesi mentre la durata della risposta era compresa fra i 4,5 mesi dei pazienti con RC con incompleto recupero ematologico ed i 6,4 mesi di quelli con RC. Sulla base di questi dati, il farmaco ha
ottenuto l’approvazione della Food and Drug
Administration per l’uso come singolo agente in
pazienti anziani con LMA CD33 positiva, in recidiva e non eleggibili per trattamenti intensivi. A
seguito di ciò, gli sforzi si sono concentrati sull’efficacia delle terapie di combinazione tra GO e
chemioterapia convenzionale. Un gruppo francese ha recentemente riportato i risultati di uno studio in cui GO è stato associato a mitoxantrone e
dosi intermedie di citosina arabinoside per il trattamento di pazienti con LMA CD33 positiva, refrattaria o in recidiva. Sono stati trattati 62 pazienti
con età mediana di 55 anni (102). Trentuno (50%)
hanno ottenuto la RC ed 8 (13%) una RC con
incompleto recupero piastrinico per una frequenza di risposta globale del 63%. La sopravvivenza e l’intervallo libero da malattia a due anni erano del 41% e 53%, rispettivamente. Gli autori concludono che il regime impiegato è efficace in
pazienti con LMA ad alto rischio e sottolineano
la necessità di sviluppare studi di fase III. Due suc-
cessivi studi di fase II, disegnati da gruppi cooperativi, hanno invece coinvolto pazienti affetti da
LMA non precedentemente trattata. L’EORTC/
GIMEMA ha esplorato l’uso di GO front-line alla
dose convenzionale di 9 mg/m2 giorno 1 e 15,
seguito da mitoxantrone, etoposide e citosina arabinoside (MICE), in pazienti di età >60 anni (103).
Una iniziale risposta al GO è stata documentata
in 20 (35%) di 57 pazienti, la risposta globale al
termine della intera sequenza d’induzione
(GO+MICE) era del 54%. Questa stessa terapia
sequenziale, seppure con una riduzione della
dose di GO a 6 mg/m2 per ridurre l’incidenza di
epatotossicità, è stata ulteriormente valutata in
uno studio di fase III (protocollo EORTC/GIMEMA AML-17), i cui risultati sono in corso di elaborazione. Kell et al. (104) hanno verificato la fattibilità di una combinazione di basse dosi di GO
(3 mg/m2) in associazione a tre diversi regimi di
trattamento come terapia di prima linea per 72
pazienti affetti da LMA e con età di 17-59 anni.
Gli autori hanno osservato una frequenza di RC
tra 86% e 91%, la schedula di terapia contenente la tioguanina era quella correlata ad una maggiore incidenza di tossicità epatica di grado 4. Tale
esperienza ha costituito il background per lo studio successivo di fase III (Medical Research
Council AML15) dalla cui analisi preliminare non
emerge alcuna differenza in termini di frequenza
di RC tra i regimi con o senza GO, si dimostra
invece un beneficio in termini di disease free survival per pazienti appartenenti a classi citogenetiche a prognosi favorevole/intermedia (105).
Anche altri gruppi cooperativi (Eastern Cooperative
Oncology Group, Southwest Oncology Group,
Dutch-Belgian Hemato-Oncology Cooperative
Group) stanno conducendo studi di fase III volti
ad esplorare i possibili posizionamenti del GO
(induzione, mantenimento, purging in vivo prima
del trapianto di cellule staminali autologhe) durante il percorso terapeutico del paziente affetto da
LMA de novo (vedi anche www.cancer.gov/clinicaltrials). Dall’insieme delle esperienze pubblicate emerge che il GO ha attività limitata come singolo agente e come tale il suo più promettente
impiego potrebbe essere nella eradicazione della malattia minima residua, sulla scorta di quanto osservato nella leucemia promielocitica acuta
(106).
65
66
Seminari di Ematologia Oncologica
n NUOVI AGENTI CITOTOSSICI
Analoghi dei nucleosidi
La clofarabina è un analogo nucleosidico di seconda generazione, sviluppata come una molecola
ibrida di fludarabina e cladribina. Clofarabina è un
potente inibitore della ribonucleasi reduttasi e delle DNA polimerasi. Ciò comporta una riduzione del
pool nucleotidico intracitoplasmatico ed un effetto di blocco della sintesi del DNA con morte cellulare. A queste caratteristiche si aggiunge anche
quella di essere più resistente di fludarabina e cladribina alla deaminazione catalizzata dalla adenosina deaminasi (107).
A completare il suo interessante profilo di attività
farmacologica, vi sono evidenze che clofarabina
sia in grado di interferire con i meccanismi di DNA
repair (108, 109).
Come singolo agente, la sua efficacia è stata inizialmente esplorata in uno studio di fase II che ha
incluso pazienti con LMA ad alto rischio (refrattaria o in recidiva) ed i cui obiettivi erano non solo
clinici ma anche farmacologici (110). Diciassette
(55%) di 31 pazienti trattati, hanno ottenuto la
RC/RP. Successivamente, clofarabina in monoterapia è stata investigata negli studi di fase II BIO121 (111) e CLASSIC II (112). Entrambi gli studi
hanno arruolato pazienti anziani, con LMA non precedentemente trattata e non eleggibili per chemioterapia intensiva. Il BIO-121 ha arruolato 66 pazienti trattati con clofarabina 30 mg/m2 nei giorni 1-5,
ogni 28 giorni. La frequenza globale di risposta (RC
+ RC con incompleto recupero ematologico) è stata del 44%, la sopravvivenza a 21 mesi del 23%.
Tra gli eventi avversi è stata documentata insufficienza renale acuta, verosimilmente precipitata da
concomitanti episodi settici, ma comunque tale da
richiedere una riduzione di dose nei cicli successivi al primo.
Al CLASSIC II sono stati arruolati 112 pazienti trattati con la medesima schedula impiegata nel BIO121. La frequenza globale di risposta (RC + RC
con incompleto recupero ematologico) è stata del
46%, la durata mediana della sopravvivenza 41
settimane. È significativo il fatto che entrambi gli
studi riportano frequenze di risposte del 29% e
42%, rispettivamente, in pazienti con citogenetica sfavorevole, collocando clofarabina tra i farmaci potenzialmente più attivi nei confronti delle LMA
ad alto rischio. Sulla base di questi risultati è stato condotto uno studio di fase III che ha incluso
70 pazienti anziani con LMA o SMD ad alto rischio
non precedentemente trattata (113). Lo studio ha
confrontato clofarabina come singolo agente verso clofarabina e basse dosi di citosina arabinoside. La frequenza di risposte nel braccio clofarabina è stata del 31% verso il 63% del braccio di
combinazione. Sorprendentemente, nel braccio
clofarabina si osservava una maggiore frequenza di mortalità (31% verso 19%); gli autori identificano nel disegno statistico la causa di tale differenza.
Lo studio randomizzava i casi secondo un modello Bayesiano che potrebbe aver comportato la concentrazione dei pazienti con i fattori clinici più sfavorevoli nel braccio clofarabina. Il National Cancer
Research Institute inglese ha attualmente in corso un trial clinico (AML-16) per pazienti anziani
affetti da LMA o SMD ad alto rischio non precedentemente trattata.
Lo studio si compone di due parti separate, un
braccio intensivo ed uno non-intensivo. Il braccio
intensivo randomizza i pazienti per un trattamento daunorubicina e citosina arabinoside ± GO verso daunorubicina e clofarabina ± GO. Dopo il ciclo
di consolidamento, che replica quello di induzione ma senza GO, i pazienti sono ulteriormente randomizzati per ricevere AZA come mantenimento
verso no terapia. Il braccio non-intensivo randomizza i pazienti tra basse dosi di citosina arabinoside e la combinazione di questa con diversi
agenti quali clofarabina, GO, tipifarnib e triossido
di arsenico. L’obiettivo primario è la sopravvivenza a sei mesi, la combinazione più efficace nel soddisfare questo obiettivo sarà poi investigata in una
successiva fase III di confronto con le basse dosi
di citosina arabinoside. Ulteriori numerosi trial di
fase II-III, sono attualmente in corso per pazienti
con LMA non precedentemente trattata, refrattaria a precedenti terapie o in recidiva (vedi
www.cancer.gov/clinicaltrials).
Alchilanti
La cloretazina è una sulfonilidrazina appartenente alla classe degli alchilanti; studi di fase I hanno identificato in 600 mg/m2 la dose singola raccomandata per studi di fase II.
Di 104 pazienti anziani arruolati ad uno studio di
Terapie innovative
fase II per il trattamento di LMA non precedentemente trattata, il 32% ha ottenuto una risposta (RC
28%, RP 4%) (114). La frequenza di risposta si
innalzava al 50% quando veniva enucleata la sola
categoria di pazienti con LMA de novo; sono attualmente in corso studi clinici di fase II-III che associano cloretazina e citosina arabinoside (vedi
www.cancer.gov/clinicaltrials).
Inibitori di topoisomerasi
Amonafide è un inibitore di topoisomerasi II che
a differenza dei classici inibitori di questa categoria, agisce con un meccanismo ATP-independente e non è un substrato di MDR-1, notoriamente
coinvolta nei meccanismi di chemioresistenza
(115): rappresenta quindi il candidato ideale per
superare il fenomeno dell’estrusione del chemioterapico dalla cellula. In uno studio iniziale di fase
I, amonafide è stata somministrata come singolo
agente a pazienti con LMA ad alto rischio (LMA
secondarie, refrattarie o in recidiva); 4 di 14 pazienti trattati hanno ottenuto la RC. Una frequenza di
RC del 46% è stata osservata in uno studio successivo in cui amonafide era associata a citosina
arabinoside (116).
La popolazione in studio era costituita da 88
pazienti con LMA secondaria (54% con LMA
secondaria a precedenti chemioterapie, 47% con
citogenetica a prognosi sfavorevole). Tali promettenti risultati hanno stimolato l’attivazione di uno
studio internazionale di fase III, in cui amonafide
e citosina arabinoside vengono confrontate con
daunorubicina e citosina arabinoside per il trattamento di LMA secondarie.
n TERAPIA DELLA CELLULA
LEUCEMICA STAMINALE
Una delle ipotesi che spiegano il fallimento della
terapia citotossica è che questa sia scarsamente efficace nei confronti della cellula steminale leucemica (CSL). Sofisticati esperimenti condotti in
topi NOD-SCID hanno fornito prove molto convincenti a sostegno dell’esistenza della CSL (117).
La CSL appare distinta da quella normale avendo collocazione fenotipica nella frazione cellulare
CD34+CD38- (117) e caratterizzandosi per
l’espressione di antigeni quali CD123 (recettore
della interleukina-3), CLL-1 (C-type lectin-like molecole-1; assente su cellule staminali normali) e
CD44, (espresso ad alta intensità). Alcuni degli
antigeni e pathways noti per essere preferenzialmente espressi od attivati nella CSL sono riportati in tabella 5; tali targets sono tutti potenziali candidati per terapie mirate. A conferma di ciò è opportuno sottolineare come siano in fase di sperimentazione clinica farmaci quali anticorpi monoclonali diretti contro CD123 e CD44, inibitori di NF-kB
(partenolide) e di m-TOR (rapamicina ed analoghi) (117).
n CONCLUSIONI
A fronte del dato di fatto che negli ultimi 20 anni
non si siano registrati sostanziali miglioramenti della sopravvivenza dei pazienti con LMA, i protocolli di futura generazione dovranno confrontarsi con
le accresciute conoscenze biologiche di recente
Superficiali
Intracitoplasmatici
Nucleari
Proteine di estrusione
MDR-1, MRP-1, BCRP
Metabolismo colesterolico
Aldeide deidrogenasi
Self-renewal
HoxB4
HoxA9
Bmi-1
Recettori citochinici
CD123, FLT-3, c-KIT
Signalling NOTCH-mediato
γ-secretasi
Fattori trascrizionali
JunB
P53
NF-kB
Altri antigeni
CD44, CLL-1
Signalling intracellulare
Wint/β-catenina/Rac
PI3K/AKT/mTOR
Apoptosi
Telomerasi
WT1
TABELLA 5 - Potenziali ”targets” di terapia della cellula staminale leucemica nella LMA.
67
68
Seminari di Ematologia Oncologica
acquisizione e con la enorme disponibilità di nuovi agenti ad azione mirata. Nonostante appaia non
realistico attendersi che tali agenti abbiano nella
LMA il medesimo impatto che gli inibitori di tirosinchinasi hanno avuto nella leucemia mieloide cronica, essi meritano di esser attentamente investigati nel contesto di studi clinici dedicati. Ciò si rende necessario per valutarne il ruolo nel rifinire e
potenziare l’azione già nota dei trattamenti convenzionali e nel porsi come valida alternativa alla semplice terapia di supporto per pazienti non eleggibili per chemioterapie intensive. In questo senso, va
ricordato come una particolare forma di terapia targeted, quella diretta contro la CSL, sia in fase pressoché embrionale e le sempre maggiori conoscenze che si accumulano in questo ambito contribuiranno anch’esse ad un diverso modo di concepire la terapia della LMA. Grazie alle sue peculiarità di quiescenza e scarsa capacità proliferativa, la
CSL pone alla terapia convenzionale sfide di grande fascino biologico e rilevanza clinica.
n BIBLIOGRAFIA
1. Kolitz JE. Current therapeutic strategies for acute
myeloid leukaemia. Brit. J Haematol. 2006; 134: 55552.
2. Shipley JL, Butera JN. Acute myelogenous leukaemia.
Experimental Hematology. 2009; 37: 649-58.
3. Mrozek K, Marcucci G, Paschka P, Whitman SP,
Bloomfield CD. Clinical relevance of mutations and
gene-expression changes in adult acute myeloid leukemia with normal cytogenetics: are we ready for a
prognostically prioritized molecular classification?
Blood. 2007; 109: 431-48.
4. Löwenberg B. Acute myeloid leukaemia: the challenge of capturing disease variety. In American Society
of Hematology, Education Program Book. 2008; 2-11.
5. Haferlach T. Molecular genetic pathways as therapeutic targets in acute myeloid leukemia. In American
Society of Hematology, Education Program Book.
2008; 400-11.
6. Futreal PA, Coin L, Marshall M. A census of human
cancer genes. Nat Rev Cancer. 2004; 4: 177-83.
7. Stone RM. Targeted agents in AML: much more to do.
BPRCH. 2007; 20: 39-48.
8. Stone RM, DeAngelo DJ, Klimek V, Galinsky I, Estey
E, Nimer SD, et al. Patients with acute myeloid leukemia and an activating mutation in FLT3 respond to
a small-molecule FLT3 tyrosine kinase inhibitor,
PKC412. Blood. 2005; 105: 54-60.
9. Stone RM, Fischer T, Paquette R, Schiller G, Schiffer
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
CA, Ehninger G, et al. Phase IB study of PKC412,
an oral FLT3 kinase inhibitor, in sequential and simultaneous combinations with daunorubicin and cytarabine (DA) induction and high-dose cytarabine consolidation in newly diagnosed adult patients (pts) with
acute myeloid leukemia (AML) under age 61.
[Abstract]. Blood. 2006; 108: 157.
Levis M, Smith D, Beran M, Baer MR, Erba HP, Cripe
L, et al. A randomized, open-label study of lestaurtinib (CEP-701), an oral FLT3 inhibitor, administered in
sequence with chemotherapy in patients with relapsed AML harboring FLT3 activating mutations: clinical response correlates with successful FLT3 inhibition. [Abstract]. Blood. 2005; 106: 403.
DeAngelo DJ, Stone RM, Heaney ML, Nimer SD,
Paquette RL, Bruner-Klisovic R, et al. Phase 1 clinical results with tandutinib (MLN518), a novel FLT3
antagonist, in patients with acute myelogenous leukemia or high-risk myelodysplastic syndrome: safety,
pharmacokinetics, and pharmacodynamics. Blood
2006; 108: 3674-81.
DeAngelo DJ, Amrein PC, Kovacsocics TJ, klisovic RB,
Powell BL, Cooper M. Phase 1/2 study of tandutinib
(MLN518) plus standard induction chemotherapy in
newly diagnosed acute myelogenous leukemia (AML).
[Abstract]. Blood 2006; 108: 158.
DeAngelo DJ, Stone R, Heaney ML, Nimer SD,
Paquette R, Bruner-Klisovic R, et al. Phase II evaluation of the tyrosine kinase inhibitor MLN518 in
patients with acute myeloid leukemia (AML) bearing
a FLT3 internal tandem duplication (ITD) mutation.
[Abstract]. Blood. 2004; 104: 1792.
Fiedler W, Serve H, Döhner H, Schwittay M, Ottmann
OG, O’Farrell AM, et al. A phase I study of SU11248
in the treatment of patients with refractory or resistant
acute myeloid leukemia (AML) or not amenable to
conventional therapy for the disease. Blood. 2005; 105:
986-93.
Quintas-Cardama A, Kantarjian H, Andreef M, Faderl
S, Wright J, Zhang W, et al. Phase I trial of intermittent administration of sorafenib (BAY 43-9006) for
patients (pts) with refractory/relapsed acute myelogenous leukemia (AML). [Abstract]. J Clin Oncol. 2007;
25: 7018.
Levis M, Pham R, Smith BD, Small D. In vitro studies
of a FLT3 inhibitor combined with chemotherapy: sequence of administration is important to achieve synergistic cytotoxic effects. Blood. 2004; 104: 1145-50.
Shankar DB, Li J, Tapang P, Owen McCall J, Pease
LJ, Dai Y, et al. ABT-869, a multitargeted receptor tyrosine kinase inhibitor: inhibition of FLT3 phosphorylation and signaling in acute myeloid leukemia. Blood.
2007; 109: 3400-8.
John AM, Thomas NSB, Mufti GJ, Padua RA.
Targeted therapies in myeloid leukaemia. Seminars
in Cancer Biology. 2004; 14: 41-62.
Stapnes C, Gjertsen BT, Reikvam H, Bruserud Ø.
Terapie innovative
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
Targeted therapy in acute myeloid leukaemia: current
status and future directions. Expert Opin Investig
Drugs. 2009; 18: 433-55.
Harosseau JL. Farnesyltransferase inihibitors in
hematologic malignancies. Blood Reviews. 2007; 21:
173-82.
Lancet JE, Gojo I, Gotlib J, Feldman EJ, Greer J,
Liesveld JL, et al. A phase 2 study of the farnesyltransferase inhibitor tipifarnib in poor-risk and elderly
patients with previously untreated acute myelogenous leukemia. Blood. 2007; 109: 1387-394.
Harousseau JL, Lancet JE, Reiffers J, Lowenberg B,
Thomas X, Huguet F, et al. Farnesyltransferase
Inhibition Global Human Trials (FIGHT) Acute Myeloid
Leukemia Study Group. A phase 2 study of the oral
farnesyltransferase inhibitor tipifarnib in patients with
refractory or relapsed acute myeloid leukemia. Blood.
2007; 109: 5151-6.
Raponi M, Lancet JE, Fan H, Dossey L, Lee G, Gojo
I, Feldman EJ, et al. A2-gene classifier for predicting
response to the farnesyltransferase inhibitor tipifarnib
in acute myeloid leukaemia. Blood. 2008; 111: 258996.
Harousseau JL, Martinelli G, Jedrzejczak WW,
Brandwein JM, Bordessoule, D, Masszi T, et al. A randomized phase 3 study of tipifarnib compared to best
supportive care (including hydroxyurea) in the treatment of newly diagnosed acute myeloid leukemia
(AML) in patients 70 years or older Blood. 2009; 114:
1166-73.
Karp JE, Smith BD, Gojo I, Lancet JE, Greer J, Klein
M, et al. Phase II trial of tipifarnib as maintenance therapy in first complete remission in adults with acute
myelogenous leukaemia and poor-risk features. Clin
Cancer Res. 2008; 14: 3077-82.
Karp JE, Flatten K, Feldman EJ, Greer JM, Loegering
DA, Ricklis RM, et al. Active oral regimen for elderly
adults with newly diagnosed acute myelogenous leukemia: a preclinical and phase 1 trial of the farnesyltransferase inhibitor tipifarnib (R115777, Zarnestra)
combined with etoposide. Blood. 2009; 113: 4841-52.
Medeiros BC, Landau HJ, Morrow M, Lockerbie RO,
Pitts T, Eckhardt SG. The farnesyl transferase inhibitor, tipifarnib, is a potent inhibitor of the MDR1 gene
product, P-glycoprotein, and demonstrates significant
cytotoxic synergism against human leukemia cell lines.
Leucemia. 2007; 21: 739-746.
Glickman MH, Ciechanover A. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction. Physiol Rev. 2002; 82: 373-428.
Zhang HG, Wang J, Yang X, Hsu HC, Mountz JD.
Regulation of apoptosis proteins in cancer cells by ubiquitin. Oncogene. 2004; 23: 2009-15.
Acquaviva C, Bossis G, Ferrara P, Brockly F, JarielEncontre I. Multiple degradation pathways for Fos family proteins. Ann NY Acad SCI. 2002; 973: 426-34.
Dou QP, Smith DM, Daniel KG, Kazi A. Interruption
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
of cell cycl progression through proteasome inhibition:
implication for cancer therapy. Prog Cell Cycle Res.
2003; 5: 441-6.
Nencioni A, Grunebach F, Patrone F, Ballestrero A,
Brossart P. Proteasome Inhibitors: antitumor effects
and beyond. Leukemia. 2007; 1: 30-6.
Vink J, Cloos J, Kaspers GJ. Proteasome inhibition
as novel treatment strategy in leukaemia. Br J
Haematol. 2006; 134: 253-62.
Horton TM, Pati D, Plon SE, Thompson PA, Bomgaars
LR, Adamson PC et al. A phase 1 study of the proteasome inhibitor bortezomib in pediatric patients with
refractory leukemia: a Children’s Oncology Group study. Clin Cancer Res. 2007; 13: 1516-22.
Cortes J, Thomas D, Koller C, Giles F, Estey E, Faderl
S, et al. Phase I study of bortezomib in refractory or
relapsed acute leukemias. Clin Cancer Res. 2004; 10:
3371-6.
Attar EC, De Angelo DJ, Supko JG, D’Amato F,
Zahrieh D, Sirulnik A, et al. Phase I and pharmacokinetic study of bortezomib in combination with idarubicin and cytarabine in patients with acute myelogenous leukaemia. Clin Cancer Res. 2008; 14: 144654.
Yanamandra N, Colaco NM, Parquet NA, Buzzeo RW,
Boulware D, Wright G, Perez LE, Dalton WS, Beaupre
DM. Tipifarnib and bortezomib are synergistic and
overcome cell adhesion-mediated drug resistance in
multiple myeloma and acute myeloid leukemia. Clin
Cancer Res. 2006; 12: 591-9.
Bjornsti MA, Houghton PJ. The TOR pathway: a target for cancer therapy. Nat Rev Cancer. 2004; 4: 33548.
Martelli AM, Evangelisti C, Chiarini F, Grimaldi C,
Manzoli L, McCubrey JA. Targeting the PI3K/AKT/
mTOR signalling network ina cute myelogenous leukemia. Expert Opin Investig Drugs. 2009; 18: 133349.
Muranyi AL, Dedhar S, Hogge DE. Combined inhibition of integrin linked kinase and FMS-like tyrosine
kinase 3is cytotoxic to acute myeloid leucemia progenitor cells. Exp Hematol. 2009; 37: 450-60.
Faderl S, Pal A, Bornmann W, Albitar M, Maxwell D,
Van Q, et al. Kit inhibitor APcK110 induces apoptosis and inhibits proliferation of acute myeloid leukaemia cells. Cancer Res. 2009; 69: 3910-7.
Brandts CH, Sargin B, Rode M, Biermann C, Lindtner
B, Schwäble J, et al. Constitutive activation of Akt by
Flt3 internal tandem duplication is necessary for increased survival, proliferation, and myeloid transformation. Cancer Res. 2005; 65: 9643-50.
Min Yh, Cheong JW, Kim JY, Eom JI, Lee ST, Hahn
JS, et al. Cytoplasmic mislocalization of p27Kip1 protein is associate with constitutive phosphorilation of
Akt or protein kinase B and poor prognosis in acute myelogenous leukaemia. Cancer Res. 2004; 64:
5225-31.
69
70
Seminari di Ematologia Oncologica
44. Kornblau SM, Womble M, Qiu YH, Jackson CE, Chen
W, Konopleva M, et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukaemia. Blood. 2006;
108: 2358-65.
45. Tamburini J, Elie C, Barder V, Chapuis N, Park S, Broët
P, et al. Constitutive phosphoinositide 3-kinase/Akt activation represents a favorable prognostic factor in de
novo acute myelogenous leukemia patients. Blood.
2007; 110: 1025-8.
46. Galley N, Dos Santos C, Cuzin L, Bousquet M,
Simmonet-Gouy V, Chaussade C, et al. The level of
AKT phosphorylation on threonine 308 but not on serine 473 is associated with high-risk cytogenetics and
predicts poor overall survival in acute myeloid leukaemia. Leukemia. 2009; 23: 1029-38.
47. Kornblau SM, Tibes R, Qiu YH, Chen W, Kantarjian
HM, Andreeff M, et al. Functional proteomic profiling
of AML predicts response and survival. Blood. 2009;
113: 154-64.
48. Tazzari Pl, Cappellini A, Ricci F, Evangelisti C, Papa
V, Grafone T, et al. Multidrug resistance-associated protein 1 expression is under the control of the phosphoinositide 3 kinase/Akt signal transduction network in
human acute myelogenous leukemia blasts.
Leucemia.2007; 21: 427-38.
49. Schaich M, Soucek S, Thiede C, Ehninger G, Illmer
T. SHG AML96 Study Group. MDR1 and MRP1 gene
expression are independent predictors for treatment
outcome in adult acute myeloid leukaemia. Br J
Haematol. 2005; 128: 324-32.
50. Rècher C, Beyne-Rauzy O, Demur C, Chicanne G,
Dos Santos C, Mansat-De Mas V, et al. Antileukemic
activity of rapamycin in acute myeloid leukaemia.
Blood. 2005; 105: 2527-34.
51. Yee KW, Zeng Z, Konopleva M, Verstovsek S,
Ravandi F, Ferrajoli A, et al. Phase I/II study of rapamycin inhibitor everolimus (RAD001) in patients with
relapsed or refractory hematologic malignancies. Clin
Cancer Res. 2006; 12: 5165-73.
52. Rizzieri DA, Feldman E, Dipersio JF, Gabrail N, Stock
W, Strair R, et al. A phase 2 clinical trial of deforolimus (AP23573, MK-8669), a novel mammalian target of rapamycin inhibitor, in patients with relapsed
or refractory hematologic malignancies. Clin Cancer
Res. 2008; 14: 2756-62.
53. Janus A, Linke A, Cebula B, Robak T, Smolewski P.
Rapamycin, the mTOR kinase inhibitor, sensitizes acute myeloid leukemia cells, HL-60 cells, to the cytotoxic effect of arabinozide cytarabine. Anticancer Drugs.
2009; 20: 693-701.
54. Luger S, Perl A, Kemner A, Stadtmauer EA, Porter
D, Schuster SJ, et al. A Phase I dose escalation study of the mTOR inhibitor sirolimus and MEC chemotherapy targeting signal transduction in leukemic stem
cells for acute myeloid leukemia. [Abstract]. Blood.
2006; 108: 161.
55. Tallman MS, Gilliland DG, Rowe JM. Drug therapy for
acute myeloid leukaemia. Blood. 2005; 106: 1154-63.
56. Giles FJ, Stopeck AT, Silverman LR, Lancet JE, Cooper
MA, Hannah AL, et al. SU5416, a small molecule tyrosine kinase receptor inhibitor, has biologic activity in
patients with refractory acute myeloid leukemia or
myelodysplastic syndromes. Blood. 2003; 102: 795-801.
57. Fiedler W, Mesters R, Tinnefeld H, Loges S, Staib P,
Duhrsen U, et al. A phase 2 clinical study of SU5416
in patients with refractory acute myeloid leukaemia.
Blood. 2003; 102: 2763-7.
58. Karp JE, Gojo I, Pili R, Gocke CD, Greer J, Guo C,
et al. Targeting vascular endothelial growth factor for
relapsed and refractory adult acute myelogenous leukemias: therapy with sequential 1-beta-darabinofuranosylcytosine, mitoxantrone, and bevacizumab. Clin
Cancer Res. 2004; 10: 3577-85.
59. Kreuter M, Steins M, Woelke k, Buechner T, Berdel
WE, Mesters RM. Downregulation of neuropilin-1 in
patients with acute myeloid leukaemia treated with thalidomide. Eur J Haematol. 2007; 79: 392-7.
60. Braun T, Carvalho G, Fabre, Grosjean J, Fenaux P,
Kroemer G. Targeting NF-kB in hematologic malignancies. Cell Death Differ. 2006; 13: 748-58.
61. Steins MB, Bieker R, Padró T, Kessler T, Kienast J,
Berdel WE, et al. Thalidomide for the treatment of acute myeloid leukemia. Leuk Lymphoma. 2003; 44: 148993.
62. Steins MB, Padró T, Bieker R, Ruiz S, Kropff M,
Kienast J, et al. Efficacy and safety of thalidomide in
patients with acute myeloid leukaemia. Blood. 2002;
99: 834-9.
63. Thomas DA, Estey E, Giles FJ, Faderl S, Cortes J,
Keating M, et al. Single agent thalidomide in patients
with relapsed or refractory acute myeloid leukaemia.
Br J Haematol. 2003; 123: 436-41.
64. Barr P, Fu P, Lazarus H, Kane D, Meyerson H,
Hartman P, et al. Antiangiogenic activity of thalidomide in combination with fludarabine, carboplatin, and
topotecan for high-risk acute myelogenous leukemia.
Leuk Lymphoma. 2007; 48: 1940-9.
65. Fehniger TA, Byrd JC, Marcucci G, Abboud CN,
Kefauver C, et al. Single-agent lenalidomide induces
complete remission of acute myeloid leukemia in
patients with isolated trisomy 13. Blood. 2009; 113:
1002-5.
66. Lancet JE, List AF, Moscinski LC. Treatment of deletion 5q acute myeloid leukemia with lenalidomide.
Leukemia. 2007; 21: 586-8.
67. Mesa RA, Tefferi A, Li CY, Steensma DP. Hematologic
and cytogenetic response to lenalidomide monotherapy in acute myeloid arising from JAK2(V617F) positive,del(5)(q13q33) myelodysplastic syndrome.
Leukemia. 2006; 20: 2063-4.
68. Chanan-Khan A. Bcl-2 antisense therapy in hematologic malignancies. Curr Opin Oncol. 2004; 16: 581-5.
69. Del Poeta G, Bruno A, Del Principe MI, Venditti A,
Terapie innovative
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
Maurillo L, Buccisano F, et al. Deregulation of the mitochondrial apoptotic machinery and development of
molecular targeted drugs in acute myeloid leukemia.
Curr Cancer Drug Targets. 2008; 8: 207-22.
Tallman MS. New strategies for the treatment of acute myeloid leukemia including antibodies and other
novel agents. In American Society of Hematology,
Education Program Book. 2005; 143-50.
Marcucci G, Byrd JC, Dai G, Klisovic MI, Kourlas PJ,
Young DC, et al. Phase I and pharmacodynamic studies of G3139, a bcl-2 antisense oligonucleotide, in
combination with chemotherapy in refactory or relapsed acute leukemia. Blood. 2003; 101: 425-32.
Marcucci G, Stock W, Dai G, Klisovic RB, Liu S,
Klisovic MI, et al. Phase I study of oblimersen sodium,
an antisense to bcl-2, in untreated older patients with
acute myeloid leukemia: pharmacokinetics, pharmacodynamics, and clinical activity. J Clin Oncol. 2005;
23: 3404-11.
Fu J, Bian M, Jiang Q, Zhang C. Roles of aurora kinases in mitosis and tumorigenesis. Mol Cancer Res.
2007; 5: 1-10.
Ducat D, ZhengY. Aurora kinases in spindle assembly and chromosome segregation. Exp Cell Res. 2004;
301: 60-7.
Yang J, Ikezoe T, Nishioka C, Tasaka T, Taniguchi A,
Kuwayama Y, et al. AZD1152, a novel and selective
aurora B kinase inhibitor, induces growth arrest, apoptosis, and sensitization for tubulin depolymerizing agent
or topoisomerase II inhibitor in human acute leukemia
cells in vitro and in vivo. Blood. 2007; 110: 2034-40.
Gautschi O, Heighway J, Mack PC, Purnell PR, Lara
PN, Gandara DR. Aurora Kinases as Anticancer Drug
Targets. Clin Cancer Res. 2008; 14: 1639-48.
Oke A, Pearce D, Wilkinson RW, Crafter C, Odedra
R, Cavenagh J, et al. AZD1152 rapidly and negatively affects the growth and survival of human acute
myeloid leukemia cells in vitro and in vivo. Cancer Res.
2009; 69: 4150-8.
Bhalla KN. Epigenetics and chromatin modifiers as targeted therapy of hematologic malignancies. J Clin
Oncol. 2005; 23: 3971-93.
Jones PA, Baylin SB. The epigenomics of cancer. Cell.
2007; 128: 683-92.
Bi G, Jiang G. The molecular mechanism of HDAC
inhibitors in anticancer effects. Cell Mol Immunol. 2006;
3: 285-90.
Herman JG, Baylin SB. Gene silencing in cancer in
association with promoter hypermethylation. NEJM.
2003; 349: 2042-54.
Goll MG, Bestor TH. Eukaryotic cytosine methyltrasferases. Annu Rev Biochem. 2005; 74: 481-514.
Issa JP, Garcia-Manero G, Giles FJ, Mannari R,
Thomas D, Faderl S, et al. Phase 1 study of low-dose
prolonged exposure schedules of the hypomethylating
agent 5-aza-2’-deoxycytidine (decitabine) in hematopoietic malignancies. Blood. 2004; 103: 1635-40.
84. Amanda F Cashen, Gary J. Schiller, Margaret R.
O’Donnell, Julie S. Larsen, Akhil Baranwal, Michael
T Cullen, et al. [Abstract]. Blood. 2006; 108: 560.
85. Silverman LR, McKenzie DR, Peterson BL, Holland
JF, Backstrom JT, Beach CL, et al. Further analysis
of trials with azacitidine in patients with myelodysplastic syndrome: studies 8421, 8921, and 9221 by the
Cancer and Leukemia Group B. J Clin Oncol 2006;
24: 3895-903.
86. Maurillo L, Spagnoli A, Genuardi M, Lunghi M, Di
Renzo N, D’Arco AM, et al. 5-Azacytidine for the
Treatment of Acute Myeloid Leukemia: A
Retrospective, Multicenter Study of 55 Patients.
[Abstract]. Blood. 2008; 112: 1947.
87. Leone G, D’Alò F, Zardo G, Voso MT, Nervi C.
Epigenetic treatment of myelodysplastic syndromes
and acute myeloid leukemias. Current Medicinal
Chemistry 2008; 15: 1274-87.
88. Griffiths EA, Gore SD. DNA methyltransferase and
histone deacetylase inhibitors in the treatment of
myelodysplastic syndromes. Semin Hematol. 2008; 45:
23-30.
89. Johnstone RW, Licht JD. Histone deacetylase inhibitors in cancer therapy: is transcription the primary target? Cancer Cell. 2003; 4: 13-18.
90. Pilatrino C, Cilloni D, Messa E, Morotti A, Giugliano
E, Pautasso M, et al. Increase in platelet count in
older, poor-risk patients with acute myeloid leukemia
or myelodysplastic syndrome treated with valproic
acid and all-trans retinoic acid. Cancer. 2005; 104:
101-9.
91. Kuendgen A, Knipp S, Fox F, Strupp C, Hildebrandt
B, Steidl C, et al. Results of a phase 2 study of valproic acid alone or in combination with all-trans retinoic acid in 75 patients with myelodysplastic syndrome and relapsed or refractory acute myeloid leukemia. Ann Hematol. 2005; 84: 61-6.
92. Prince HM, Bishton MJ, Harrison SJ. Clinical studies
of histone deacetylase inhibitors. Clin Cancer Res.
2009; 15: 3958-69.
93. Blum W, Klisovic RB, Hackanson B, Liu Z, Liu S,
Devine H, et al. Phase I study of decitabine alone or
in combination with valproic acid in acute myeloid leukemia. J Clin Oncol. 2007; 25: 3884-91.
94. Lübbert M, Rüter B, Claus R, Schmid M, Germing U,
Eimermacher H, et al. Continued low-dose decitabine (DAC) is an active first-line treatment in all cytogenetic subgroups of older aml patients: results of the
FR00331 multicenter phase ii study. [Abstract]. Blood
2007; 110: 300.
95. Gore SD, Baylin SB, Sugar E, Carraway H, Miller CB,
Carducci M, et al. Combined DNA methyltransferase
and histone deacetylase inhibition in the treatment of
myeloid neoplasms. Cancer Res. 2006; 66: 6361-9.
96. Soriano AO, Yang H, Faderl S, Estrov Z, Giles F,
Ravandi F, et al. Safety and clinical activity of the combination of 5-azacytidine, valproic acid, and all-trans
71
72
Seminari di Ematologia Oncologica
97.
98.
99.
100.
101.
102.
103.
104.
105.
106.
retinoic acid in acute myeloid leukemia and myelodysplastic syndrome. Blood. 2007; 110: 2302-8.
Voso MT, Santini V, Finelli C, Musto P, Pogliani E,
Angelucci E, et al. Valproic acid at therapeutic plasma
levels may increase 5-azacytidine efficacy in higher
risk myelodysplastic syndromes. Clin Cancer Res.
2009; 15: 5002-7.
Cimino G, Lo Coco F, Fenu S, Travaglini L, Finolezzi
E, Mancini M, et al. Sequential valproic acid/all-trans
retinoic acid treatment reprograms differentiation in
refractory and high-risk acute myeloid leukemia.
Cancer Res. 2006; 66: 8903-11.
Stasi R, Evangelista ML, Buccisano F, Venditti A,
Amadori S. Gemtuzumab ozogamicin in the treatment
of acute myeloid leukemia. Cancer Treat Rev. 2008;
34: 49-60.
Kumar RA, Ikemoto N, Patel DJ. Solution structure of
the calicheamicin gamma 1I-DNA complex. J Mol Biol.
1997; 265: 187-201.
Sievers EL, Larson RA, Stadtmauer EA, et al.
Efficacy and safety of gemtuzumab ozogamicin in
patients with CD33- positive acute myeloid leukemia
in first relapse. J Clin Oncol. 2001; 19: 3244-54.
Chevallier P, Delaunay J, Turlure P, Pigneux A, Hunault
M, Garand R, et al. Long-term disease-free survival
after gemtuzumab, intermediate-dose cytarabine,
and mitoxantrone in patients with CD33(+) primary
resistant or relapsed acute myeloid leukemia. J Clin
Oncol. 2008; 26: 5192-7.
Amadori S, Suciu S, Willemze R, et al. Sequential
administration of gemtuzumab ozogamicin and
conventional chemotherapy as first line therapy in
elderly patients with acute myeloid leukemia: a phase II study (AML-15) of the EORTC and GIMEMA leukemia groups. Haematologica. 2004; 89: 950-6.
Kell WJ, Burnett AK, Chopra R, Yin JA, Clark RE,
Rohatiner A, et al. A feasibility study of simultaneous
administration of gemtuzumab ozogamicin with intensive chemotherapy in induction and consolidation in
younger patients with acute myeloid leukemia. Blood.
2003; 102: 4277-83.
Burnett AK, Kell WJ, Goldstone AH, Milligan D, Hunter
A, Prentice AG, et al. The addition of gemtuzumab ozogamicin to induction chemotherapy for AML improves
disease free survival without extra toxicity: preliminary analysis of 1115 patients in the MRC AML15 trial.
[Abstract]. Blood. 2006; 108: 13.
Lo-Coco F, Cimino G, Breccia M, Noguera NI, Diverio
D, Finolezzi E, et al. Gemtuzumab ozogamicin
(Mylotarg) as a single agent for molecularly relapsed
acute promyelocytic leukemia. Blood. 2004; 104:
1995-9.
107. Burnett AK, Mohite U. Treatment of older patients with
acute myeloid leukaemia: new agents. Semin Hematol.
2006; 43: 96-106.
108. Kantarjian H, Gandhi V, Kozuch P, Faderl S, Giles FJ,
Cortes J, et al. Phase I clinical and pharmacology study of clofarabine in patients with solid and hematologic cancers. J Clin Oncol. 2003; 6: 1167-73.
109. Musto P and Ferrara F. Clofarabine. In search of combinations for the treatment of patients with high-risk
acute myeloid leukemia. Cancer. 2008; 113: 1995-8.
110. Kantarjian H, Gandhi V, Cortes J, Verstovsek S, Du
M, Garcia-Manero G, et al. Phase 2 clinical and pharmacologic study of clofarabine in patients with
refractory or relapsed acute leukaemia. Blood. 2003;
102: 2379-86.
111. Burnett A, Baccarani M, Johnson P, Yin J, Saunders
A, Russell N, et al. A phase II trial of clofarabine in
older patients with acute myeloid leukaemia for whom
intensive chemotherapy is not considered suitable.
[Abstract]. Blood. 2006; 108: 425.
112. Erba HP, Kantarjian HM, Claxton DF, Arellano M,
Lyons RM, Kovacsovics TJ, et al. Updated remission
duration and survival results of single-agent clofarabine in previously untreated older adult patients with
acute myelogenous leukemia (AML) unlikely to
benefit from standard induction chemotherapy due to
unfavorable baseline risk factor(s). [Abstract]. J Clin
Oncol. 2009; 27: 7062.
113. Faderl S, Ravandi F, Huang X, Garcia-Manero G,
Ferrajoli A, Estrov Z, et al. A randomized study of clofarabine versus clofarabine plus low-dose cytarabine
as front-line therapy for patients aged 60 years and
older with acute myeloid leukemia and high-risk myelodysplastic syndrome. Blood. 2008; 112: 1638-45.
114. Giles FJ, Rizzieri D, Karp JE, Vey N, Ravandi F, Faderl
S,et al. Cloretazine (VNP40101M), a novel sulfonylhydrazine alkylating agent, in patients age 60 years
or older with previously untreated acute myeloid leukemia. J Clin Oncol. 2007; 25: 25-30.
115. Chau M, Christensen JL, Ajami AM, Capizzi RL.
Amonafide, a topoisomerase II inhibitor, is unaffected by P-glycoprotein-mediated efflux. Leukemia
Research. 2008; 32: 465-73.
116. Allen SL, Erba HP, Rizzieri DA, O’Donnell M, Powell
B, Lundberg AS, et al. Secondary acute myeloid leukemia (sAML) treated with amonafide (AS1413) +
cytarabine: durable responses in poor-risk AML.
[Abstract]. Blood. 2008; 112: 2968.
117. Misaghian N, Ligrest Gi, Steelman LS, Bertrand FE,
Basecke J, Libra M, et al. Targeting the leukemic stem
cell: the Holy Grail of leukemia therapy. Leukemia.
2009; 23: 25-42.
73
La malattia
in età pediatrica
CARMELO RIZZARI, TIZIANA COLIVA, MARCO SPINELLI, ANDREA BIONDI
Clinica Pediatrica, Università Milano-Bicocca, Fondazione MBBM,
Ospedale San Gerardo, Monza, Italia
n INTRODUZIONE
ED ASPETTI EPIDEMIOLOGICI
Il termine di leucemia mieloide acuta (LMA) identifica un gruppo eterogeneo di neoplasie ematologiche con connotazioni biologiche e cliniche
peculiari tali da comportare un approccio diagnostico e terapeutico differenziato. Le LMA rappresentano il 10-20% dei casi di leucemia acuta dell’età pediatrica (1). L’incidenza annuale riportata
nei paesi industrializzati è di circa 7-8 casi per
milione di bambini/adolescenti di età inferiore a 18
anni (2). Rispetto alle leucemia acute dell’adulto
le LMA sono in età pediatrica meno frequenti delle leucemie linfoblastiche acute (LLA) con un rapporto LMA/LLA di 1:4, eccetto che nel periodo neonatale nel quale si verifica un picco di incidenza
di LMA. In contrasto con quanto osservato nella
LLA, l’incidenza delle LMA rimane stabile durante l’infanzia mentre se ne osserva un lieve progressivo aumento durante l’adolescenza. Non sono state rilevate significative differenze di incidenza tra
i due sessi, ma sono state invece descritte differenze rilevanti in alcuni gruppi etnici (le LMA sono
Parole chiave: leucemia mieloide acuta, trattamento,
diagnosi, età pediatrica.
Indirizzo per la corrispondenza
Prof. Andrea Biondi
Clinica Pediatrica
Università Milano-Bicocca
Fondazione MBBM
Ospedale San Gerardo
Via Pergolesi, 33 - 20052 Monza (MI)
e-mail: [email protected]
Andrea Biondi
più frequenti per esempio nei bambini neri e in
quelli di origine ispanica). Pur non essendo state
riportate rilevanti differenze di distribuzione dei
diversi sottotipi di LMA nei vari gruppi etnici, la leucemia promielocitica acuta (LPA) risulta di gran lunga più frequente nelle popolazioni ispaniche e latine (3).
Negli anni ’70 la maggior parte dei pazienti affetti da LMA non riusciva ad essere trattata efficacemente ed i pazienti soccombevano alla malattia generalmente a causa della sua progressione; i risultati sono poi progressivamente migliorati e gli studi più recenti riportano una sopravvivenza a lungo termine superiore al 60-65%.
Questa migliore prognosi, che è limitata solo ai
paesi più industrializzati, è essenzialmente legata alla razionalizzazione ed alla intensificazione
dell’uso di farmaci particolarmente efficaci (citarabina e antracicline), alla miglior identificazione
di specifici gruppi di rischio e al conseguente utilizzo di strategie terapeutiche diversificate incluso il trapianto di midollo (TMO) e al miglioramento delle terapia di supporto (terapia antibiotica,
trasfusioni, ecc.) (4, 5).
In questo articolo verranno descritte le principali
caratteristiche biologiche e cliniche della LMA dell’età pediatrica e ne verranno anche discussi gli
aspetti eziopatogenetici, i fattori prognostici, i principi generali e particolari di trattamento e le prospettive future.
n EZIOLOGIA
Nonostante le cause rimangano largamente sconosciute, esistono fattori di rischio che possono
74
Seminari di Ematologia Oncologica
essere principalmente ambientali o secondari a
condizioni predisponenti ereditarie e/o acquisite.
L’esposizione a radiazioni ionizzanti, prodotti chimici (benzene, erbicidi e pesticidi) ed agenti chemioterapici (agenti alchilanti come mostarde
azotate, ciclofosfamide, ifosfamide, clorambucile
e melfalan ma anche epipodofillotossine e agenti immunosoppressivi usati nel trattamento
dell‘anemia aplastica) costituiscono noti fattori di
rischio per lo sviluppo di una LMA (3). Sotto il profilo patogenetico si distinguono forme primarie,
che compaiono acutamente in soggetti per i quali non è dimostrabile un’esposizione ad agenti leucemogeni, e forme secondarie che rappresentano l’evoluzione neoplastica di una precedente sindrome mielodisplastica (SMD) o l’effetto dell’esposizione del soggetto ad agenti leucemogeni (dette in questo caso t-LMA, therapy related LMA). I
termini di LMA secondaria e t-LMA vengono spesso usanti in modo interscambiabile per descrivere una LMA per la quale si ipotizza che un precedente trattamento citotossico possa aver contribuito alla sua eziologia (6). Esistono peraltro prove evidenti che specifiche terapie possano causare una leucemogenesi secondaria (7-10). Si
parla invece di LMA “secondaria de novo” nel caso
di pazienti con una precedente neoplasia che non
sono stati trattati con chemio o radioterapia, per
esempio nei casi di sola resezione chirurgica. In
questo caso si ritiene che la leucemogenesi rifletta una predisposizione genetica allo sviluppo di
multiple neoplasie primitive rispetto alla genotossicità causata dalla chemio o radioterapia (6).
Sebbene la prognosi delle LMA secondarie debba essere considerata generalmente meno favorevole rispetto alla LMA de novo, è invece riportata una prognosi simile per le LPA sia de novo
che secondarie (11, 12). Poichè un certo numero di LPA secondarie sembra essere non correlato alle precedenti terapie (11, 13) ed in considerazione dell’osservazione che la LPA de novo
e le LPA che insorgono dopo altri tumori sono
simili clinicamente, alcuni casi di LPA secondarie sono considerate come neoplasie primitive
secondarie (12).
Le LMA secondarie all’uso di farmaci alchilanti
sono spesso precedute da una fase di SMD con
associata perdita o delezione del cromosoma 5
o 7. Queste t-LMA tendono a presentarsi tardi-
vamente (tipicamente 5-7 anni dopo la terapia);
il tempo tra l’insorgenza della SMD e la t-LMA è
piuttosto variabile e può essere spiegato dalla
necessità del verificarsi di danni genetici successivi alla perdita di materiale dal cromosoma 5 e
7. I sottotipi FAB più frequentemente riscontrati
sono M1 o M2 (6). Le LMA secondarie indotte
dalle epipodofillotossine sono usualmente caratterizzate da sottotipi FAB M4 o M5, sebbene siano stati descritti anche altri sottogruppi (14), e
sono spesso associate a traslocazioni che coinvolgono il gene MLL (1). Diversamente rispetto
alle LMA secondarie al trattamento con agenti
alchilanti che, come abbiamo visto, si presentano tardivamente e con una fase pre-leucemica,
le LMA secondarie al trattamento con epipodofillotossine si manifestano come LMA de novo e
dopo un breve periodo (generalmente 2-3 anni)
dal termine delle terapie (6).
La maggior parte dei casi di LMA insorge in
pazienti che non possiedono una predisposizione genetica né familiare né condizioni tipiche di
sindromi e insufficienze midollari. In alcuni casi esistono invece condizioni genetiche predisponenti
ben inquadrate nosologicamente, quali:
Sindrome di Down. I bambini affetti da sindrome
di Down (DS) presentano un rischio 10-20 volte
superiore rispetto alla popolazione pediatrica di
sviluppare una leucemia acuta (15) e nonostante siano stati identificati numerosi geni, come
AML1, che possono essere implicati nel processo patogenetico, per nessuno di questi è stata
identificata una chiara correlazione eziopatogenetica. Sebbene tali bambini presentino, nella
seconda infanzia, un’incidenza di LLA e LMA
sovrapponibile, nei primi tre anni di vita la LMA
risulta nettamente più frequente (e tra queste è
presente soprattutto il sottotipo megacarioblastico). Va inoltre ricordato che i neonati con DS, nel
10% dei casi (16), possono presentare una patologia mieloproliferativa transitoria transient myeloproliferative disorder (TMD), nella quale i blasti
risultano essere clonali e con caratteristiche
megacarioblastiche. L’esordio può essere anche
molto precoce, entro le prime 2-3 settimane di vita
(17). La diagnosi differenziale deve essere posta
con una reazione leucemoide associata a prematurità, sepsi o asfissia. Solitamente la TMD persiste per alcune settimane ed è associata a muta-
La malattia in età pediatrica
zioni di GATA 1 (17). Alcuni pazienti (20%) con
DS e TMD sviluppano una LMA dopo mesi (fino
anche a 4 anni) dalla risoluzione della TMD; la
prognosi non sembra essere significativamente
diversa da quella delle LMA de novo osservate
nei pazienti con DS (17-19). Non è ancora stato
chiarito se la progressione da TMD verso LMA
possa essere prevenuta da una chemioterapia
profilattica. Diversi studi sono in corso per valutare ulteriormente questo aspetto (4).
Disordini ereditari caratterizzati da un difetto nei
processi di riparazione del DNA e regolazione del
ciclo cellulare: anemia di Fanconi, sindrome di
Bloom e atassia teleangectasia.
Disordini ereditari caratterizzati da alterazione della trasmissione del segnale nei processi di proliferazione e apoptosi cellulare: sindrome di
Kostmann, sindrome di Shwachman-Diamond, sindrome di Blackfan-Diamond, e neurofibromatosi
di tipo I.
Sindrome di Li-Fraumeni.
Esistono poi condizioni predisponenti acquisite:
- anemia aplastica: una quota rilevante dei
pazienti con anemia aplastica trattati con terapia immunosoppressiva sviluppano una SMD e/o
una LMA o entrambe in sequenza;
- emoglobinuria parossistica notturna;
- SMD.
n PATOGENESI
La leucemogenesi è il risultato di alterazioni genetiche che si verificano a livello di una primitiva cellula staminale ematopoietica e che determinano
l’espansione di un clone che è spesso caratterizzato da un blocco incompleto della normale differenziazione (20, 21). Le LMA sono un gruppo
eterogeneo di patologie neoplastiche, caratterizzate da un’elevata variabilità clinica e patogenetica in cui sono descritte numerose alterazioni
molecolari. Le più frequenti alterazioni cromosomiche coinvolgono geni codificanti fattori di trascrizione; come conseguenza di tali anomalie si
generano prodotti chimerici di fusione che contribuiscono al processo di trasformazione (22). Nel
caso, ad esempio della traslocazione t(8;21), si
determina la fusione del gene AML1 (sul cromosoma 21) con il gene ETO (sul cromosoma 8) e
la formazione del gene di fusione AML1-ETO.
Questo gene codifica per una proteina con funzioni ibride, avente cioè la capacità di legare il
DNA sia attraverso il dominio di AML1 che quello di ETO con la conseguente alterazione delle
normali funzioni di AML1 parte integrante dell’attività del core binding factor complex critico per
il normale sviluppo dell’ematopoiesi. Anche le
t(3;21), t(16;16), t(16;21) e Inv(16) determinano
una alterazione del core binding factor complex
che anziché attivare l’espressione di alcuni geni
target diviene un repressore trascrizionale che
abolisce l’attività di questi geni. Questa attività è
mediata dall’attivazione di un enzima con attività deacetilasica sugli istoni (HDACs) che appartiene all’apparato che esercita la repressione trascrizionale. Anche altre traslocazioni come la
t(15;17) che determina il trascritto di fusione PMLRARα sembrano esercitare la loro funzione
attraverso il reclutamento di HDACs con conseguente repressione della trascrizione dei geni target normalmente attivati dal recettore nucleare
RARα (23). Molti oncogeni sono stati implicati nella patogenesi leucemica per mutazioni, amplificazione, delezioni o riarrangiamenti di proto-oncogeni che risultano così deregolati o attivati in modo
tale da determinare la trasformazione neoplastica della cellula (24). Tale fenomeno può avvenire sia per alterazione dei processi di regolazione della crescita, che della differenziazione, apoptosi e riconoscimento immunologico della cellula mieloide così come del processo di riparazione del DNA(25).
I diversi geni che al momento sembrano essere
maggiormente coinvolti nelle anomalie genetiche
presenti nelle LMA possono essere schematicamente classificati in base alla loro funzione:
a) Geni coinvolti nella proliferazione
cellulare
• FLT3 (gene FMS-like tirosin chinasi 3) codifica
per un recettore di membrana tirosin chinasico. Il
legame tra FLT3-ligando e la tirosinchinasi del
recettore FLT3, induce nella cellula ematopoietica una serie di reazioni che prendono parte, insieme ad altri fattori di crescita e interleuchine, ai processi di crescita e differenziazione cellulare.
FLT3 è uno dei geni più frequentemente mutati nelle neoplasie ematologiche, un possibile modello
75
76
Seminari di Ematologia Oncologica
per comprendere meglio i meccanismi alla base
dell’insorgenza delle leucemie e un target per lo
sviluppo di nuove strategie diagnostiche e terapeutiche. Mutazioni del gene FLT3 sono state ritrovate nelle LLA (1-3% dei pazienti), nelle SMD (510%) e nelle LMA (15-35%) (26). Le mutazioni di
FLT3 sono prevalentemente di due tipi: la più frequente è una internal tandem duplication (ITD)
negli esoni 14 e 15 (cromosoma 13q12) (2) (27);
la seconda è una mutazione puntiforme missense nell’esone 20 del dominio tirosin chinasico, che
coinvolge tipicamente il codone D835 o D836 e
meno frequentemente N841 o N841Y (24). La frequenza di mutazioni ITD nell’adulto (20-30%) è
superiore a quella riscontrata nel bambino (1015%) (28, 29).
Per quanto riguarda la correlazione con la classificazione FAB, mutazioni di FLT3-ITD sono state
riscontrate in tutti i sottotipi di FAB, anche se con
una maggiore incidenza nel sottotipo M3, minore in M5 e nelle leucemie con alterazioni della
regione CBF (28, 30).
La mutazione di FLT3-ITD è significativamente più
frequente (20-25%) nel sottogruppo dei pazienti con
cariotipo normale (28) e nella maggior parte dei
casi è presente in eterozigosi ma talvolta è possibile riscontrarlo in omozigosi in seguito alla perdita dell’allelle di FLT3 normale. C’è chiara evidenza che mutazioni di FLT3 siano associate a una
prognosi sfavorevole nelle LMA pediatriche (28, 31),
recentemente però sono emersi dati che indicano
che non sia tanto la presenza della mutazione
FLT3-ITD in sé a correlare con una prognosi sfavorevole quanto il rapporto allelico (AR) tra mutato e wild type: i pazienti con AR <0,4 hanno una
prognosi simile a i pazienti senza FLT3-ITD mentre i pazienti con AR >0,4 hanno un pessimo outcome (32). A seguito di questa scoperta e del
riscontro di una prognosi peggiore per questi
pazienti con associazione di mutazione FLT3-ITD
+ perdita dell’allele wild type (35 val), si è introdotto una nuovo elemento prognostico: il rapporto
FLT3-ITD/wild type (=allelic ratio). La possibilità che
ci siano delle variazioni in questo allelic ratio è spiegata dal fatto che in molti casi la leucemia può essere un processo policlonale, ossia con alcune sottopopolazioni di cellule LMA dotati di mutazione
FLT3-ITD e altre sottopopolazioni contenenti solo
il gene wild type (14 val). Pazienti con un’alta per-
centuale di cloni mutati avranno un alto rapporto
ITD/WT e saranno soggetti a prognosi peggiore e
a maggior rischio di resistenza alla terapia. È interessante che invece le mutazioni puntiformi di FLT3,
presenti in almeno il 7% dei pazienti non siano
associata con una peggior prognosi (32).
• c-KIT, situato sulla banda q12 del cromosoma
4, codifica per una glicoproteina transmemembrana, membro della famiglia RTK di tipo III. Il suo
legame con SCF (stem cell factor) attiva una
cascata di segnali coinvolta nella proliferazione, differenziazione, migrazione e sopravvivenza di cellule staminali emopoietiche. Sono state descritte
diverse mutazioni di c-KIT (tra cui D816V,
D816Y/H/F/I) con variabile frequenza (da 3,3 a
11% in due diversi studi) (31, 33). Per quanto
riguarda la correlazione con la classificazione FAB,
c-KIT nella forma mutata risulta maggiormente
associato alle forme con alterazione della regione CBF (40-50%) (34). Recenti studi suggeriscono che anche mutazioni di c-KIT conferiscano una
prognosi sfavorevole, specialmente nel sottogruppo delle LMA con alterazione della core-binding
factor region, anche se Boissel et al. riportano che
mutazioni di KIT non siano predittive nel sottogruppo con Inv(16) (34, 36); fino ad ora questo criterio non è stato utilizzato per la classificazione in
gruppi di rischio e studi prospettici con una casistica più ampia sono necessari per confermare il
significato prognostico di c-KIT nelle LMA pediatriche (4).
• Geni della famiglia RAS codificano per una famiglia di guanine nucleotide-binding proteins, che
regolano la trasduzione di segnale di una serie di
recettori di membrana, tra cui anche FLT3 e c-KIT,
e giocano un importante ruolo nella proliferazione, nella differenzazione e nei processi apoptotici. Se non mutatate, proteine RAS si trovano in
equilibrio tra forma attiva e quella inattiva. Vi sono
tre geni funzionali: N-RAS, K-RAS e H-RAS.
Mutazioni puntiformi in N- e K-RAS sono presenti in circa il 10-15% rispettivamente di tutte le LMA
e più frequentemente nelle LMA con alterazione
della regione CBF (32%) (31, 32). In realtà studi
recenti mettono in discussione l’utilità di N-RAS
come marker per il follow-up o per la malattia minima residua (MRM) dopo terapia e in genere il ruolo primario delle mutazioni dei geni RAS nella leucemogenesi. In uno studio eseguito su di un cam-
La malattia in età pediatrica
pione di 107 pazienti per lo studio di N-RAS
all’esordio ed in caso di recidiva di malattia, si è
visto infatti che solamente uno di questi ha acquistato la mutazione alla recidiva e 4 degli 8 pazienti mutati per tale gene hanno perso tale mutazione alla recidiva (24).
• PTPN11, situato sulla banda q24 del cromosoma 12, codifica per una proteina citoplasmatica
tirosin-fosfatasica chiamata SHP2, particolarmente espressa nella cellule ematopoietiche, partecipa alla trasduzione di segnale di fattori di crescita, di citochine, di ormoni e di molecole di adesione cellulare ed è coinvolta nella risposta a KITligando, IL-3, IL-6, GM-CSF (granulocyte-macrophage colony - stimulating factor) ed EPO.
Mutazioni somatiche di PTPN11 sono riscontrate nel 20% delle LMA M5 pediatriche in pazienti
del sud Europa e solamente nel 7% dei pazienti
nel Nord Europa (37, 38).
• JAK2 codifica per una tirosin chinasi citoplasmatica, coinvolta nelle vie di trasmissione del segnale. JAK2 gioca un ruolo chiave nella trasduzione
del segnale attivata da diversi recettori dei fattori
di crescita e da citochine necessarie per l’ematopoiesi. Tra le molteplici mutazioni che coinvolgono questo gene, JAK2 V617F è la più ricorrente
e come conseguenza finale porta ad un’iperattivazione di diversi componenti della cascata di attivazione del segnale. La mutazione JAK2 V617F
è presente in più del 90% dei casi di policitemia
vera, in circa il 50% dei casi di trombocitemia
essenziale e di mielofibrosi con metaplasia mieloide, in circa il 70% dei pazienti con LMA secondaria a malattie mieloproliferative e solo nell’1,6%
dei casi di LMA primaria (39).
b) Geni coinvolti nella differenziazione
mieloide
• AML1, situato sulla banda q 22 del cromosoma
21, codifica per una delle due sub unità che formano il complesso trascrizionale core binding factor CBF umano. AML1 è uno dei geni più frequentemente sregolati nelle leucemie per il quale sono
descritte traslocazioni cromosomiche principali che
formano proteine chimeriche quali: AML1-ETO
t(8;21) nelle LMA; AML1-ETV6 nelle forme pediatriche di LLA e più raramente AML1-MDS1
t(3;21) nelle SMD e nella fasi blastiche sporadiche della leucemia mieloide cronica (LMC). Sono
state descritte sia mutazioni germ-line, sia acquisite: queste ultime sono state osservate nel 6-10%
dei casi sporadici di LMA (40).
• WT1 (Wilms’ Tumor 1), localizzato sulla banda
p13 del cromosoma 11, codifica per un fattore di
trascrizione importante per il normale sviluppo e
la normale sopravvivenza delle cellule. Esistono
diverse modificazioni che possono avvenire
durante la trascrizione di questo genere, ma due
sono predominanti e derivano da due splicing
alternativi: lo splicing dell’esone 5 e di un tratto
di 9 nucleotidi (KTS). Dalla combinazione di questi derivano 4 diverse isoforme (A, B, C, D). WT1
ha funzione sia di oncosoppressore che di oncogene in varie forme di cancro (tra cui la LMA);
quello che ancora non è chiaro nell’ultimo caso,
è se tale gene partecipi nel dare inizio alla malattia o piuttosto alla sua progressione. La sua sovraespressione evidenziata in più del 50% dei casi
LAM ne permette l’utilizzo come fattore prognostico e come marcatore di MRM. In letteratura
sono stati riportati dati discordanti sull’impatto prognostico negativo di WT1 overespresso all’esordio: nonostante alcuni autori riportino un forte valore predittivo di questo dato altri non confermano
tali ipotesi (41). Recentemente è stato dimostrato che pazienti con una elevata espressione di
WT1 alla fine dell’induzione presentano un outcome peggiore suggerendo che il monitoraggio
dei livelli di espressione di questo gene possano
essere utilizzati come indicatori di remissione
molecolare (42). Sono state descritte anche mutazioni di WT1 nel 11% dei pazienti pediatrici con
LMA (diversi tipi di mutazioni presenti, tra queste
le più frequentemente riscontrate sono a livello
degli esoni 7 - mutazioni framshift e 9 sostituzioni di singoli aminoacidi, soprattutto a livello dei
codoni D396 ed H397, meno frequentemente a
livello degli esoni 1, 2, 3 ed 8 (43) e sebbene questi pazienti presentino una frequenza di remissione completa simile ai pazienti che non hanno tali
mutazioni, il rischio di ricaduta e la sopravvivenza libera da malattia si sono mostrate marcatamente differenti indicando una prognosi più sfavorevole (44).
L’espressione limitata di WT1 nei tessuti normali
ha suggerito l’utilizzo di questo gene come target
per la terapia. Sono stati avviati studi per lo sviluppo di una immunoterapia diretta specificatamet-
77
78
Seminari di Ematologia Oncologica
ne contro WT1, sottoforma o di T - cell specifiche
o di vaccini contro peptidi WT1 correlati. Altri
approcci terapeutici non immunologici sono in corso di sviluppo, come ad esempio l’utilizzo di oligodesossinecleotidi e ribosomi antisenso. Oggi
parlare di prevenzione di leucemia tramite l’utilizzo di vaccini è sicuramente prematuro ma l’ipotesi di una possibile immunizzazione contro la leucemia attraverso vaccini con bersaglio WT1 è da
tenersi in considerazione per studi futuri (45).
• CEBPα questo gene codifica per una fattore di
trascrizione ematopoietico-specifico della famiglia
Ets utile per il normale sviluppo delle cellule del
sangue e regola una grande varietà di geni target, compresi alcuni geni mieloidi cruciali, come
il recettore per i fattori di crescita G-CSF
(Granulocyte colony stimulating factor) receptor,
l’M-CSF e GM-CSF (46).
Le mutazioni di CEBPα sono presenti in circa il
20% delle LMA negli adulti con cariotipo normale e sono associate a prognosi favorevole (47). Nei
bambini invece le mutazioni vengono riportate nel
4-11% dei casi di LMA e sebbene siano necessari ulteriori studi, anche in questo caso identificherebbero un gruppo di soggetti con cariotipo normale e miglior prognosi.
• PU.1 le mutazioni di PU.1 contribuiscono raramente alla patogenesi delle leucemie mieloidi acute.
c) Geni implicati nella regolazione del ciclo
cellulare o dell’apoptosi
• TP53 localizzato sulla banda p13 del cromosoma 17, è un tumor suppressor gene, con attività
di “guardiano del genoma”. Le funzioni della proteina p53 comprendono: attività da fattore di trascrizione, di regolazione di geni coinvolti a valle
nell’arresto del ciclo cellulare, di riparazione del
DNA e di regolazione a livello dell’apoptosi. La perdita della funzione di p53, conferisce instabilità
genomica, compromette l’apoptosi e riduce il freno del ciclo cellulare. Nella LMA p53 può essere
inattivato da delezioni o mutazioni puntiformi che
sono state però riscontrate in meno del 10% delle LMA primarie. Le mutazioni di p53 sono frequentemente associate a delezioni 17p, solitamente per
traslocazioni sbilanciate tra cui la t(5;17).
• NPM1 mappa in posizione 5q35 e contiene 12
esoni che codificano per una nucleofosmina presente in 3 diverse isoforme: B23.1, B23.2, B23.3,
di cui la più frequente è la B23.1 (48). NPM1 è
coinvolto nella via di trasmissione del segnale regolata dall’oncosoppressore arf-p53. Le mutazioni di
NPM1 sono state ritrovate in differenti sottotipi FAB,
soprattutto M4 e M5, con frequenza molto elevata (50-60%) nei pazienti adulti (48, 49), mentre l’incidenza nei casi pediatrici è intorno al 5-10% con
incidenza crescente con l’età alla diagnosi (50);
la frequenza può però arrivare al 20-30% se si considera soltanto il sottogruppo con cariotipo normale. I bambini con LMA presentano generalmente
mutazioni nelle cellule leucemiche (soprattutto di
tipo B) che differiscono da quelle che vengono
riscontrata negli adulti (soprattutto di tipo A).
Questo potrebbe contribuire a spiegare le differenze di eziopatogenesi delle LMA tra bambini e adulti (51). Le mutazioni di NPM1 sono frequentemente associate a mutazioni nel gene di FLT3 e in questo caso si riduce il loro favorevole impatto prognostico (49, 52).
n DIAGNOSI
Nel 2001 l’organizzazione mondiale della sanità
(WHO) ha pubblicato una nuova classificazione per
le LMA che considera una serie di valutazioni morfologiche, immunofenotipiche e citogenetiche e
contribuisce a effettuare una classificazione più
accurata della LMA in sottogruppi più omogenei
(53).
Morfologia
Tradizionalmente le LMA sono state classificate
grazie alla valutazione morfologica ed istochimica. Il più completo sistema di classificazione istochimico-morfologico per la LMA fu sviluppato dal
French-American-British (FAB) Cooperative Group
a partire dal 1976. Secondo il FAB, le LMA si
distinguono in 8 sottotipi: M0, M1, M2, M3/M3v,
M4/M4eo, M5a/M5b, M6, M7 (Tabella 1a) (54, 56).
Altri sottotipi estremamente rari di LMA sono: la
leucemia eosinofila acuta e la leucemia basofila
acuta. Il 50-60% delle LMA diagnosticate in età
pediatrica è classificato come: M1, M2, M3, M6,
o M7; nel restante 40% dei casi si tratta di forme
M4 o M5. Circa l’80% dei bambini con una diagnosi di LMA al di sotto dei 2 anni d’età è affetto da un sottotipo M4 o M5. La chemioterapia cito-
La malattia in età pediatrica
Sigla
CATEGORIA
Criteri morfologici
M0*
M1
Indifferenziata
Mieloblastica senza maturazione
M2
Mieloblastica con maturazione
M3 **
M3V**
Promielocitica
Promielocitica variante ipogranulare
M4
Mielomonocitica
M4 eo
Mielomonocitica con ipereosinofilia
M5a
Monoblastica
M5b
Monocitica
M6
M7***
Eritroleucemia
Megacarioblastica
MPO <3% NAE negativa
Blasti >90% nel midollo esclusi eritroblasti;
<10% componente monocitaria; <10% granulociti, MPO >3%
Blasti 30<90%; granulociti >10%;
monociti <20% (NE), MPO >3%
>20% promielociti anomali ipergranulari (corpi di Auer), MPO >3%
Nuclei reniformi, granulazioni fini nel citoplasma, poco visibili al MO,
ma MPO +++, MPO >3%
Blasti >30% NE, componente granulocitaria 20<80%, componente
monocitaria 20<80%, >5x109/l monociti nel sangue periferico
o lisozima elevato, MPO >3%
Criteri per M4 associati a eosinofili anormali con granuli eosinofili
e basofili, MPO >3%
>80% NE componente monocitaria;
monoblasti >80% della componente monocitaria, NAE positiva
>80% NE componente monocitaria;
monoblasti <80% della componente monocitaria NAE positiva
Cellule eritroidi >50% delle cellule midollari; blasti >30% NE
Blasti >30% NE; megacarioblasti, blebs, (mielofibrosi)
*M0: MPO e SBB < del 3% in citochimica; markers B e T-lineage negativi (ivi compresi CD3 e CD22 intracitoplasmatici); CD13 e CD33 positivi in circa il 60%
e 80% rispettivamente dei pazienti; co-espressione di CD13 e CD33 in circa il 40% dei casi; almeno uno dei due antigeni deve essere espresso per la diagnosi; CD13 più sensibilmente dimostrato da tecniche immunocitochimiche (immunoperossidasi e APAAP) che dalla citometria a flusso; CD117, CD7 e TdT riscontrati nel 55, 41 e 46% dei casi rispettivamente. **M3: L’identificazione di questo sottotipo è critica per il rischio emorragico potenzialmente fatale che può comparire prima o durante la terapia di induzione. ***M7: Megacarioblasti >30% MO; blebs citoplasmatici e fibrosi midollare; positività per CD61, CD42, CD41 e
antigene fattore VIII-relato; possono inoltre essere utili: dimostrazione ultrastrutturale di Perossidasi piastrinica, dimostrazione che il subset di cellule CD34+ è
CD38+, biopsia ossea.
TABELLA 1a - Classificazione istochimico-morfologica FAB.
tossica determina una risposta relativamente simile in bambini affetti da sottotipi diversi di LMA.
L’unica eccezione è rappresentata dalla categoria FAB M3, per la quale l’acido all-trans retinoico, combinato con un’opportuna chemioterapia,
è in grado di assicurare l’ottenimento della
remissione e la guarigione nella maggioranza dei
casi (23).
I criteri originali FAB prevedevano che per porre
diagnosi di LMA fosse necessaria la presenza a
livello midollare di almeno il 30% di blasti con caratteristiche mieloidi (con eritroblasti inferiori al 50%,
altrimenti tale percentuale deve essere calcolata
sulla quota cellulare non eritroide); la nuova classificazione proposta dal WHO nel 2001 ha ridotto al 20% la quota blastica necessaria per poter
porre diagnosi di LMA prendendo peraltro in considerazione non solo le caratteristiche morfologiche ma anche le anomalie genetico/cliniche presenti (Tabella 1b) (57).
Né la classificazione WHO, che non è stata ancora adottata routinariamente in emato-oncologia
pediatrica, né la classificazione FAB utilizzano criteri correlati all’età per classificare le LMA, non
tenendo quindi conto delle differenze (in termini
di sopravvivenza, distribuzione citogenetica e fattori legati al paziente) che esistono tra gli adulti e
i pazienti in età pediatrica.
In primo luogo con la riduzione della quota blastica necessaria per porre diagnosi di LMA dal 30
al 20%, malattie prima formalmente classificate
come SMD (per esempio anemia refrattaria con
eccesso di blasti in trasformazione - AREB-t) vengono adesso formalmente classificate come LMA
(58).
Secondariamente la classificazione WHO non considera importanti sottogruppi pediatrici come i
pazienti di età inferiore a 1 anno (infants) con LMA
M7 e t(1;22) e quelle con DS (53).
Non è ancora stato dimostrato attraverso studi clinici se questi pazienti beneficino effettivamente dal
trattamento con schemi di terapia intensi utilizzati per le LMA prima di essere sottoposti a HSCT
(4). I dati dell’European Working Group on
79
80
Seminari di Ematologia Oncologica
Myelodysplastic Sindrome (EWOG-MDS) suggeriscono che spesso i bambini con SMD presentano una ipoplasia midollare e il trattamento con
chemioterapia intensa determina aplasie profonLMA con ricorrenti
traslocazioni
citogenetiche
LMA con displasia
multilineare
LMA con sindrome
mielodisplastica,
secondaria a
trattamento
chemioterapico
LMA non altrimenti
classificate
LMA con t(8;21)(q22;q22)
o AML1 (CBF-α)/ETO
Leucemia promielocitica
acuta
LMA con t(15;17)
(q22;212) e sue varianti;
PML/RAR α
LMA con eosinofilia:
Inv(16)(p13;q22) o
t(16;16)(p13;q22);
CBF-β/MYH1
LMA con 11q23 (MLL)
LMA con precedente
MDS
LMA senza precedente
MDS
Secondaria a trattamento
con agenti alchilanti
Secondaria a trattamento
con epipodofillotossine
Altri tipi
LMA con minima
differenziazione
LMA senza maturazione
LMA con maturazione
LMA mielomonocitica
LMA monocitica
LMA eritroide
LMA megacarioblastica
LMA basofila
Panmielosi acuta con
mielofibrosi
TABELLA 1b - Classificazione WHO delle LMA (Modificata da
Ref. 4. Riprodotta con il permesso dell’editore proprietario).
Mieloperossidasi
Esterasi Non Specifica
Cloro-acetato
a-naftol-acetato
Sudan Black B
PAS
*Queste reazioni sono inibite dal fluoride.
TABELLA 2 - Profilo citochimico delle LMA.
de e persistenti con un aumento delle complicanze infettive (59).
Un approccio più pratico per differenziare tra LMA
e SMD, più che una definizione strettamente basata sulla percentuale di blasti, potrebbe essere rappresentato dal sorvegliare la progressione di malattia con un atteggiamento wait and see, ponendo
attenzione a segni indicativi di LMA come la comparsa di epato-splenomegalia o specifiche alterazioni geniche (58).
Citochimica
Il trattamento dei bambini con LMA differisce in
maniera rilevante da quello dei pazienti con LLA
e per tale motivo l’accuratezza della diagnosi assume un ruolo cruciale. Ciò evidenzia la necessità
di eseguire un’attenta e completa valutazione citochimica sugli strisci di sangue midollare di tutti i
bambini con LMA. Le colorazioni più comunemente utilizzate che consentono di identificare alcune
attività enzimatiche e/o la presenza di particolari
sostanze ritenute specifiche per certi tipi cellulari, includono (Tabella 2):
• la mieloperossidasi (MPO) → rileva l’attività mieloperossidasica presente nei granuli primari sia
dei precursori mieloidi che dei monociti;
• i corpi di Auer → accumuli di granuli primari con
forma a bastoncino che sono caratteristici dei
sottotipi M2, M3 e M5;
• la reazione periodica all’acido di Shiff (PAS) →
solitamente negativa nelle mieloidi ad eccezione del sottotipo M6;
• il Sudan Black B (SBB) → identifica i lipidi intracellulari che sono presenti nei granuli secondari dei precursori mieloidi e dei monociti;
• l’esterasi non specifica (NSE) dei positiva prevalentemente sui monociti.
LMA, LPA
(M1-M3)
LMMA
(M4)
LMOA
(M5)
LEA
(M6)
LMCA
(M7)
LLA
M0
-
+
+
+/-
-
-
-
-
+
+
-
+
+*
+
-/+
+*
+/-/+
+
+
--/+*
-
+
La malattia in età pediatrica
Immunofenotipo
Lo studio di antigeni di membrana o citoplasmatici espressi nei blasti leucemici mediante l’utilizzo di anticorpi monoclonali (MoAbs) costituisce
un elemento indispensabile per la conferma della diagnosi citomorfologica. Gli antigeni particolarmente utili per la diagnosi di LMA sono CD11b,
CD13, CD14, CD15, CD33, CD34, CD41, CD42
e CD61, la glicoforina A, l’antigene leucocitario
di classe II (HLA - DR) oltre a c-Kit.
Nella normale maturazione ematopoietica i precursori altamente immaturi sono caratterizzati dall’espressione di CD13, CD33 e CD34. Nel processo di differenziazione si osserva la perdita del
CD34, la progressiva riduzione del CD33 e la
comparsa del CD15. Anche l’antigene HLA-DR
viene espresso progressivamente nel processo
di differenziazione mieloide.
La differenziazione in senso monocitico è
caratterizzata invece dall’espressione del CD14
e questo marcatore viene utilizzato per l’identificazione della leucemia mielomonocitica (M4)
e monocitica (M5). Anche il CD36 e il CD64 possono essere utilizzati per definire la differenziazione monocitaria. Per l’identificazione della
linea eritroide si utilizza la glicoforina A che è
quindi utile nella diagnosi di leucemia eritroblastica (M6).
La differenziazione lungo la linea megacariocitica è rappresentata dall’espressione di proteine
associate alle piastrine come CD14, CD42,
CD61, glicoproteina Ib, glicoproteina IIB/IIIa
(CD41a, 61) o l’espressione dell’antigene del
Fattore VIII che quindi identificano la LMA di tipo
megacariocitario (M7).
L’immunofenotipo è indispensabile per la corretta diagnosi delle forme mieloidi più indifferenziate, perossidasi negative, come le LMA M0, nelle LMA M6 ed M7 o forme miste come le leucemie bifenotipiche (unico clone leucemico le cui
cellule blastiche esprimono sulla superficie più
di una antigene di linee cellulari differenti) e biclonali(definito secondo la classificazione WHO dalla presenza di due diversi cloni leucemici ciascuno con caratteristiche morfologiche, immunofenotipiche, istochimiche e molecolari diverse).
Sono state riportate associazioni tra espressioni particolari di antigeni ed alcuni sottotipi di LMA,
caratterizzati da specifiche anomalie citogeneti-
che quali Inv(16), t(15;17), t(8;21), ma non è mai
stata dimostrata, se non per la LMA M3 (60), una
significativa specificità e sensibilità di questo
approccio nell’identificare sottotipi prognosticamente rilevanti.
L’analisi dell’espressione del pattern di questi antigeni consente la distinzione nel 90% dei casi delle forme di LMA da quelle di LLA ma non esistono antigeni lineage-specifici in modo assoluto che identifichino esclusivamente i blasti di una
LMA. I blasti leucemici possono infatti esprimere anche antigeni non strettamente aderenti alla
linea di appartenenza e alcuni antigeni caratteristici delle LLA possono essere espressi anche
sui blasti mieloidi fino nel 60% dei casi (CD4,
CD7, CD10, CD19 e CD24, CD56). Così anche
antigeni mieloidi possono essere espressi su blasti linfoidi.
Citogenetica e genetica molecolare
Le indagini di citogenetica e genetica molecolare devono essere eseguite in tutti i casi di LMA
all’esordio sia per il corretto inquadramento diagnostico che per l’identificazione di quelle anomalie associate a prognosi differente. Le tecniche convenzionali di bandeggio cromosomico e
di analisi delle metafasi, così come le tecniche
di genetica molecolare o di ibridazione fluorescente in situ (FISH), offrono vantaggi di specificità e sensibilità differenti.
Anomalie cromosomiche clonali sono state identificate nei blasti del 75% dei bambini con LMA
e si sono dimostrate utili nel definire i sottotipi con
caratteristiche particolari:
• M2 con t(8;21) presente nel 10-15% dei casi,
spesso associata a perdita di cromosomi sessuali (delezione del cromosoma X nelle femmine e delezione del cromosoma Y nei maschi);
• M3 con t(15;17) e in alcuni casi t(11;17);
• M4eo con Inv(16), t(16;16) o del(16) a prognosi favorevole ma con più elevata incidenza di ricaduta sul sistema nervoso centrale
(SNC);
• M4 e M5 con riarrangiamento della banda cromosomica 11q23, frequente nei bambini sotto
l’anno e nelle forme secondarie a epipodofillotossine associata a pessima prognosi (61);
• M7 con t(1;22) nei bambini sotto l’anno di vita
(infants).
81
82
Seminari di Ematologia Oncologica
n FATTORI PROGNOSTICI
A differenza di quanto è possibile per la LLA, esistono pochi parametri laboratoristici, clinici o relativi al trattamento utilizzabili come fattori prognostici. I tentativi per formulare valide correlazioni tra
risposta alla terapia e reperti clinici, morfologici e
citogenetica sono numerosi e continui (62). Nelle
LMA pediatriche sono comunque stati identificati alcuni parametri clinici e biologici con significato prognostico, individuabili alla diagnosi quali la
valutazione citogenetica o durante la fase di induzione quale per esempio la risposta precoce al trattamento che può essere valutata o direttamente
con l’esame morfologico del midollo osseo o
mediante lo studio della MRM. Tali parametri vengono utilizzati nella pratica clinica per l’assegnazione dei pazienti a diversi gruppi di rischio ai quali corrisponderanno poi diverse opzioni terapeutiche. L’obiettivo di questa stratificazione è quello di
massimizzare l’efficacia del trattamento e ridurre
gli effetti collaterali, graduando l’intensità delle cure
sulla base delle probabilità di ricaduta del paziente (5). Nello specifico:
a) alterazioni citogenetiche:
- le t(8;21), Inv(16) e t(15;17) sono generalmente considerate a prognosi favorevole (62, 64);
- la t(9;11) viene considerata a prognosi favorevole da alcuni gruppi di studio per esempio la
Nordic Society for Pediatric Hematology and
Oncology (NOPHO) e il St. Jude Childrens’
Research Hospital (65, 66);
- il riarrangiamento del gene MLL presente in circa il 20% dei casi di LMA, generalmente considerato a prognosi intermedia e l’outcome di questi pazienti non differisce significativamente da
quelli che non presentano questa traslocazione
(66);
- la monosomia del cromosoma 5 o 7 e anomalie cariotipiche complesse sono invece considerate a prognosi sfavorevole, nonostante una
recente analisi retrospettiva tra diversi gruppi
pediatrici ha confermato una precedente affermazione riportata da Grimwade et al che i
pazienti con del(7q) abbiano di fatto una prognosi intermedia (67, 68);
- un cariotipo complesso è associato a una peggior prognosi;
b) Alterazioni molecolari:
• il riconoscimento alla diagnosi di lesioni caratteristiche si associa a una prognosi differente a
seconda dei casi:
- Prognosi favorevole in caso di
mutazioni di: CEBPα
AML1-ETO
CBFB-MYH11
NPM1
- Prognosi sfavorevole in caso di
mutazioni di: c-KIT
FLT3
over espression di WT1
c) fattori correlati al paziente:
- età: più elevata è l’età, peggiore è la prognosi;
- razza: quella caucasica avrebbe una prognosi
migliore;
- sesso: quello maschile sembra avere una prognosi peggiore;
- associazione con DS: la prognosi sembra
migliorare, soprattutto se il paziente è di età inferiore ai 2 anni di età;
- variazioni rispetto al peso corporeo ideale
influenzano negativamente la sopravvivenza;
- alterazioni enzimatiche associate al metabolismo
dei farmaci causano un aumento della tossicità ai farmaci e di conseguenza prognosi peggiore;
- risposta alla terapia (valutata precocemente al
giorno +15 del primo ciclo di chemioterapia) riveste ovviamente un rilievo particolarmente importante (69, 71), l’iperespressione della proteina
MDR-1 (multidrug-resistance) è associata a resistenza al trattamento con alcuni farmaci chemioterapici;
- elevato numero di globuli bianchi all’esordio si
accompagna a una peggiore risposta alla chemioterapia di induzione;
- sottotipo FAB: i sottotipi come M0, M5, M6, M7
sono associati a prognosi peggiore;
- forme di LMA secondarie a SMD hanno una prognosi meno favorevole (72).
d. Malattia residua minima (MRM)
Il termine definisce il riscontro di cellule leucemiche nel sangue midollare giudicato in apparente
remissione morfologica (74). Un paziente è definito in remissione morfologica quando le cellule
La malattia in età pediatrica
neoplastiche costituiscono meno del 5% delle cellule midollari nucleate.
La quota di cellule neoplastiche presenti al di sotto di tale livello è indicata come MRM. La determinazione della MRM viene effettuata con scopi
diversi, tra i quali quelli prognostici. Inoltre è possibile valutare l’efficacia del trattamento e l’eventuale interessamento di sedi extramidollari.
Il livello di MRM, determinato al termine della fase
di induzione, sembra rappresentare un fattore prognostico indipendente, in particolare è stata
osservata una correlazione significativa tra i livelli di MRM rilevati in due punti della fase di inizio,
cioè al giorni 14 e 21, e la sopravvivenza (75).
Considerevoli sforzi sono stati effettuati nel ricercare marcatori molecolari utili per valutare la MRM
e per predire la recidiva in una fase precoce, prima quindi che questa si manifesti a livello ematologico e clinico, permettendo così un intervento terapeutico tempestivo (41, 50, 76, 77).
Idealmente i marcatori di MRM dovrebbero avere i seguenti requisiti fondamentali (78):
- avere una sensibilità di almeno 10-3-10-4;
- essere specifici;
- utilizzare marcatori di clone leucemico stabili nel
tempo;
- essere facilmente stardardizzabili e consentire
una rapida raccolta dati dei risultati;
- avere un criterio chiaro e condiviso per quantificare la MRM;
- fornire risultati in tempi compatibili con l’intervento clinico.
I metodi più utilizzati nel monitoraggio della MRM
sono:
- citogenetica convenzionale;
- ibridizzazione in situ tramite fluorescenza (FISH):
ha notevolmente migliorato la sensibilità nel discriminare i riarrangiamenti strutturali, rispetto alla
metodica convenzionale di citogenetica, ma la
sensibilità raggiunta rimane spesso insufficiente;
- immunofenotipizzazione mediante citofluorimetria
(CFM): per il riconoscimento di antigeni espressi solo o in quantità maggiore dalla cellula leucemica. Può essere applicata nella maggior parte delle LMA. Un problema rilevante è legato alla
possibilità che si verifichino shift di espressione
antigenica tra la diagnosi e la ricaduta e alla sensibilità della metodica che varia tra 10-1 e 10-2 (79).
Comunque le tecniche stanno migliorando rapi-
damente e già sono disponibili citofluorimetri a
8-12 colori con conseguente miglioramento della sensibilità della metodica (4);
- polymerase chain reaction (PCR) → amplificazione di sequenze di geni mutati o mediante
retroascrizione dei mRNA generati dai geni di
funzione. La disponibilità di una metodica quantitativa di PCR (RQ-PCR) può potenzialmente
rappresentare un ulteriore avanzamento nella
discriminazione della presenza del clone leucemico nel monitoraggio della MRM, con una sensibilità paria a 10-5. Tuttavia marcatori molecolari specifici e ricorrenti su cui applicare la RQPCR sono presenti solo in circa un quarto di tutti i pazienti con LMA (76);
La MRM potrebbe essere utilizzata per la classificazione dei pazienti in fasce di rischio ma sono
necessari ancora ulteriori dati perché possa
essere inserita tra i criteri di stratificazione degli
studi clinici (18).
n ASPETTI CLINICI
I segni e sintomi della LMA derivano sostanzialmente dalla compromissione della produzione e
differenziazione delle normali cellule emopoietiche. I dati di laboratorio più frequentemente alterati sono quelli legati all’infiltrazione blastica midollare (leucocitosi con neutropenia, anemia e piastrinopenia).
Una conta leucocitaria >100.000/mm3 è riportata
nel 15-20% circa dei pazienti e anemia e piastrinopenia di un certo rilievo sono nel presenti nel
50% circa dei pazienti. Febbre, pallore, diatesi
emorragica sono sintomi di frequente riscontro. La
coagulazione intravascolare disseminata può
complicare ogni esordio di LMA ma è tipicamente associata al sottotipo FAB M3. Nel 20% dei casi
sono presenti dolori ossei.
Se si escludono l’epato e la splenomegalia che
sono presenti singolarmente o insieme in più del
50% dei casi, le localizzazioni extramidollari di LMA
sono infrequenti. La linfoadenopatia all’esordio è
osservata in meno del 25% dei pazienti ed è più
comune nelle LMA di tipo M4 e M5 come pure altre
localizzazioni più peculiari come le lesioni cutanee
(presenti nel 10% dei casi), noduli incolori o lievemente bluastri (blueberry muffin) e l’infiltrazione gen-
83
84
Seminari di Ematologia Oncologica
givale (presente nel 10-15% dei casi). I cloromi, i
mieloblastomi o sarcomi granulocitici, masse localizzate di cellule leucemiche, sono invece tumori di
discrete dimensioni che possono essere anche isolati (ossa e tessuti molli spesso a livello dell’orbita
oculare e dello spazio epidurale), quindi in assenza di un coinvolgimento midollare, e sono associati ai sottotipi M2 con t(8;21), M4, M5 e nei bambini di età <1 anno. I testicoli sono raramente interessati. Il coinvolgimento del SNC all’esordio, più
frequente che nelle LLA, è riscontrato nel 5-15%
dei pazienti e correla con la leucocitosi e il fenotipo FAB M5. Circa la metà di questi pazienti è sintomatico: cefalea, nausea, vomito, fotofobia, papilledema e interessamento dei nervi cranici; raramente si presentano crisi convulsive. Manifestazioni possibili della localizzazione al SNC possono essere
anche il mieloblastoma o infiltrazioni meningee con
o senza paralisi dei nervi cranici.
n FASI DELLA MALATTIA
Esordio: criterio essenziale per porre diagnosi di
LMA nell’infanzia è che nel midollo osseo siano
presenti blasti mieloidi in quantità superiore al 20%
(WHO), con caratteristiche morfologiche, citochimiche ed immuofenotipiche compatibili con LMA.
Nel caso di localizzazioni extramidollari isolate a
livello di ossa e tessuti molli (cloroma), la diagnosi di LMA deve essere anche posta attraverso la
biopsia tissutale.
Remissione: al trattamento di induzione segue in
circa l’80-85% dei pazienti la remissione completa (RC), definita secondo i seguenti criteri:
- blasti <5% nell’aspirato midollare, con popolazione cellulare midollare normale, piastrine
≥50x 109/L e neutrofili ≥1x109/L;
- liquor con <5 globuli bianchi/mm3 e senza evidenza di blasti;
- nessuna evidenza di malattia in ogni altra sede
extramidollare.
Recidiva: ricomparsa di blasti mieloidi in quantità
superiore al 20% (WHO). La prognosi per un bambino con LMA recidivata o resistente è piuttosto
grave anche se è ancora possibile ottenere una
seconda remissione in oltre la metà dei casi. La
probabilità di sopravvivenza globale dei casi di
LMA recidivata non è superiore al 25-30%. Le spe-
rimentazioni cliniche in atto includono il ricorso a
nuovi chemioterapici e/o a nuovi agenti biologici
e/o al TMO da donatore HLA identico familiare ed
anche non familiare.
n PRINCIPI GENERALI
DEL TRATTAMENTO
Il cardine dell’approccio terapeutico della LMA è
rappresentato dall’ottenimento e dal consolidamento della RC con schemi di terapia caratterizzati dall’uso di 2 o 3 farmaci (principalmente
citarabina e antracicline cui sono state spesso
associate epipodofillotossine o 6-thioguanina)
usati spesso a dosi elevate e somministrati in
schemi della durata di pochi giorni (4).
All’ottenimento della RC (raggiunta nell’80-90%
dei casi) (18) seguono ulteriori cicli di chemioterapia intensiva la cui numerosità (generalmente
5-6) e durata (da pochi giorni ad alcune settimane), variano in base al tipo di strategia terapeutica del protocollo di cura. Tali cicli risultano in
generale fortemente mielosoppressivi e sono
basati, allo scopo di prevenire i fenomeni di farmaco-resistenza, sull’uso sequenziale di farmaci non cross-resistenti quali citarabina (generalmente usato ad alte dosi), le antracicline e le epipodofillotossine. Le dosi cumulative totali di citarabina e antracicline pianificate in vari e moderni protocolli internazionali di cura della LMA
pediatriche, risultano talvolta molto diverse fra loro
ma permettono risultati comunque favorevoli. La
durata totale del trattamento chemioterapico è
solitamente di circa 5-6 mesi e in generale non
è prevista alcuna terapia di mantenimento. La
sopravvivenza secondo i risultati pubblicati
recentemente negli studi clinici pediatrici di fase
III condotti negli ultimi 15 anni varia tra il 40 e il
60% (Tabella 3) (4) con il miglior outcome riportato dal gruppo Medical Research Council
(MRC) (overall survival a 5 anni del 68%) (63).
Va comunque sottolineato che i protocolli MRC
AML 10 e 12 hanno utilizzato dosi cumulative di
antracicline piuttosto elevate (550 mg/mq utilizzando una conversione pari 1 a 5 per ottenere
le dosi daunomicina-equivalenti di idarubicina e
mitoxantrone) con un possibile aumentato rischio
di tossicità cardiaca a lungo termine (80).
La malattia in età pediatrica
Studio
Protocollo
AML-BFM
SG
CCG
DCOG
EORTC
LAME
MRC
NOPHO
POG
PPLLSG
St. JUDE
Tokyo CCSG
AML-BFM 98
CCG 2961
AML-92/94
EORTC 58921
LAME 89/91
AML12
AML93
POG9421
AML98
AML97
AML13/14
Pazienti
Periodo di tempo
Follow up
pEFS
pOS
Ref.
473
901
78
177
309
529
219
565
104
96
216
1993-1998
1996-2002
1992-1998
1993-2000
1988-1996
1995-2002
1993-2000
1995-1999
1998-2002
1997-2004
1991-1998
5 years
5 years
5 years
5 years
6 years
5 years
7 years
3 years
5 years
5 years
5 years
49%
27%
42%
49%
48%
58%
49%
36%
47%
44%
56%
62%
52%
42%
62%
60%
66%
64%
54%
50%
50%
62%
Creutzig et al. (110)
Lange et al. (111)
Kardos et al.112
Entz-Werle et al. (113)
Perel et al. (114)
Gibson et al. (63)
Lie et al. (115)
Becton et al. (116)
Dluzniewska et al. (117)
Rubnitz et al. (118)
Tomizawa et al. (119)
AML-BFM SG; AML Berlin-Frankfurt-Munster Study Group; CCG Children’s Cancer Group; DCOG: Dutch Childhood Oncology Group; EORTC: European
Organization of Research and Treatment of Cancer; LAME: leucemie Aique Myeloblastique Enfant; MRC: Medical Research Council; NOPHO: Nordic Society
of Pediatric Hematology and Oncology; POG: Pediatric Oncology Group; PPLSG: Polish Pediatric Leukemia/Lymphoma Study Group.
TABELLA 3 - Risultati recentemente pubblicati di studi clinici di fase III nelle LMA pediatriche (Modificata da Ref. 4. Riprodotta con
il permesso dell’editore proprietario). I risultati dell’AIEOP sono riportati nella tabella 5.
Nel protocollo NOPHO AML 93 è stata maggiormente utilizzata la citarabina (dosi cumulative comprese tra 49.000 e 60.000 mg/m2). Nel protocollo tedesco BFM-AML 98 le dosi cumulative dei due
farmaci si collocano su valori intermedi rispetto ai
due precedenti protocolli, ma la strategia è stata
caratterizzata da un trattamento più prolungato
comprendente, oltre che alcuni blocchi di terapia
intensiva, anche una fase di consolidamento (della durata di 6 settimane e assai simile agli schemi di induzione/reinduzione utilizzati nel protocollo delle LLA), la radioterapia craniale e una lunga fase di mantenimento. I bambini con LMA di
tipo M4 e M5 hanno un’incidenza più alta di meningosi leucemica che varia tra il 5 e il 30% ed è più
frequente nei pazienti con iperleucocitosi, e in quelli di età inferiore ad un anno. La chemioterapia
intratecale è parte integrante dei protocolli per il
trattamento della LMA dell’infanzia ed è considerata oggi una componente standard dell’approccio terapeutico a questa malattia. Per i pazienti senza interessamento del SNC all’esordio il trattamento profilattico è generalmente basato sull’uso di
citarabina intratecale da solo o in associazione a
metotrexate e/o idrocortisone. Nei pazienti con
localizzazione SNC all’esordio il numero iniziale
di rachicentesi è più elevato per ottenere e consolidare la remissione anche a livello liquorale (81).
Come detto in precedenza l’applicazione di una
fase di mantenimento sembra essere di scarsa uti-
lità. Il protocollo nord americano CCG-213 ha
dimostrato con uno studio randomizzato che una
fase di mantenimento non è utile se lo schema di
induzione e quello post remissionale sono adeguatamente intensi. Nella stessa direzione vanno i
risultati di uno studio prospettico randomizzato condotto dal gruppo francese Leuemie Aique
Myeloblastique Enfant (LAME) che dimostrano
come una terapia di mantenimento a basse dosi
non sia raccomandabile in quanto inutile per prevenire le recidive e capace di indurre farmaco resistenza responsabile di una minore efficacia della terapia di recupero delle forme recidivate (114).
Il gruppo Berlin Frankfurt Minister (BFM) continua
tuttavia a utilizzare una fase di mantenimento
(attualmente 12 mesi), caratterizzata dall’uso di
citarabina a basse dosi e 6-thioguanina.
Gli studi clinici di fase III attualmente in corso o
in fase avanzata di disegno nelle LMA pediatriche
affrontano importanti aspetti (Tabella 4):
a) in primo luogo vengono introdotti dei nuovi farmaci in associazione: gemtuzumab ozogamicin (GO, mylotarg®), 2-chlorodeoxyadenosine
(2-CDA, cladribina®) e daunorubicina liposomiale (DNX, daunoxome®);
b) tra gli obiettivi non compaiono solamente la
verifica di una aumentata efficacia anti-leucemica ma anche quelli di una ridotta tossicità
(soprattutto quella cardiaca a lungo termine);
c) in alcuni sottogruppi di LMA viene infine appli-
85
86
Seminari di Ematologia Oncologica
Fase del
trattamento
Gruppo
di studio
Random
Induzione
BFM
Idarubicina vs
daunomicina
liposomiale
Aggiunta di GO
all’induzione
FLAG-IDA vs ADE
Basse vs alte dosi
di ARA-C
Aggiunta di 2-CDA
al consolidamento
negli alti rischi
Aggiunta di GO al
consolidamento
Trattamento con
antracicline vs
blocchi con
citarabina ad alte dosi
Aggiunta di un
blocco di
chemioterapia
Aggiunta di GO in
base all’MRM per
tutti i pazienti non
avviati a trapianto del
midollo osseo
Radioterapia
craniale 12 vs 18 Gy
COG
MRC/DCOG
St. Jude
Consolidamento BFM
COG
MRC/DCOG
MRC
NOPHO
Terapia SNC
BFM
GO: gemtuzumab ozogamicina; ADE: citarabina, daunorubicina ed etoposide; FLAG-IDA: fludarabina, citarabina, GCSF e idarubicina; 2-CDA:
2 chloro-desossiadenosina.
TABELLA 4 - Principali quesiti randomizzati dei principali trials
clinici di fase III condotti a livello internazionale per il
trattamento delle LMA pediatriche (escluse la LPA e la DS
LMA) (Modificata da Ref. 4. Riprodotta con il permesso
dell’editore proprietario).
cato il concetto di terapia mirata somministrando 2-CDA (4) (infatti sebbene siano pochi i casi
è stata riportata una aumentata sensibilità alla
2-CDA nei casi di LMA M5 (82, 83).
n TRAPIANTO DI MIDOLLO (TMO)
L’uso dell’allo-TMO in 1° RC nella LMA è mirato
a ridurre il rischio di ricaduta mediante l’uso di un
condizionamento a base di chemioterapici usati
ad alte dosi (l’uso della TBI si è molto ridotto negli
ultimi 10-15 anni) e l’induzione di una graft ver-
sus leukemia (GvL) da parte delle cellule midollari trapiantate; l’efficacia della GvL sembra peraltro essere correlata all’induzione di una graft versus host disease (GvHD) clinicamente rilevabile.
Per determinare il possibile effetto benefico dell’allo-TMO diversi studi sono stati focalizzati soltanto sulla riduzione del rischio di ricaduta. La mortalità TMO correlata, oggi peraltro piuttosto ridotta rispetto al passato, dovrebbe essere sempre
tenuta in considerazione nel riportare i risultati correlati al TMO (4). Il TMO autologo non ha dimostrato con certezza la propria superiorità rispetto
alla chemioterapia (84, 86) mentre diversi studi
hanno dimostrato la superiorità dell’allo-TMO
rispetto alla chemioterapia (87), anche se la riduzione del rischio di ricaduta sembra essere strettamente dipendente dalla efficacia e dalla intensità del braccio di chemioterapia di controllo (88).
La maggior parte dei gruppi di studio delle LMA
pediatriche ritiene oggi indicato l’allo-TMO in prima remissione completa per i pazienti definiti ad
alto rischio (AR) (4, 86). L’AIEOP ha riportato risultati positivi nell’applicazione dell’allo- e dell’autoTMO nella LMA in prima (RC) (85). Per questo
motivo, il protocollo attualmente in uso in Italia (protocollo AIEOP LAM 2002) prevede, nell’ambito della strategia terapeutica post remissionale, un
ampio uso delle procedure trapiantologiche. In questo protocollo i risultati dei pazienti sottoposti ad
TMO sono stati particolarmente favorevoli, con un
event-free survival (EFS) del 62% per i 64
pazienti sottoposti ad auto-TMO e del 77% per i
57 pazienti sottoposti ad allo TMO. In quest’ultimo gruppo EFS è stato dell’80% e dell’83% per
i 25 ed i 27 pazienti sottoposti ad un TMO da donatore non consanguineo (86).
Un problema particolarmente gravoso nell’avviare un bambino con LMA al TMO in 1° RC è rappresentato dalle note sequele che si osservano
a lungo termine (soprattutto nei pazienti sottoposti a TMO in età molto bassa e sottoposti a TBI:
disturbi endocrini, GVHD cronica, secondi tumori, sterilità, bassa statura, cataratta).
Per questo motivo la scelta di sottoporre oggi un
paziente ad allo-TMO è oggetto di particolare attenzione. In generale, l’uso dell’allo-TMO in 1° RC non
è raccomandato nei soggetti che abbiano fattori prognostici favorevoli quali Inv(16), t(8;21), t(15;17) o
nei pazienti con DS (ammesso che sia stata otte-
La malattia in età pediatrica
nuta la RC). Il TMO da donatore HLA identico non
consanguineo (MUD) viene oggi riservato a ristretti sottogruppi di LMA, quali per esempio quelle originate da SMD o con monosomia del cromosoma
7 o le M7 non DS o le LEA o quelle resistenti ai
primi due cicli di induzione. Si può infine osservare che con il miglioramento dei risultati e il prolungamento della sopravvivenza è aumentata la
necessità di porre attenzione agli effetti collaterali
a lungo termine anche del trattamento chemioterapico. In particolare, per i bambini che ricevono la
chemioterapia intensiva che comprende dosi
cumulative di antracicline particolarmente elevate,
è richiesto nel tempo un attento monitoraggio della funzionalità cardiaca.
n RECIDIVA
Con le moderne strategie terapeutiche il 5-10%
circa dei bambini con LMA non ottiene la RC dopo
i primi due cicli intensivi di chemioterapia. Un ulteriore 30-35% dei bambini apparentemente in RC
dopo l’induzione presenta, in media dopo un anno
dalla diagnosi iniziale, una recidiva che nella maggioranza dei casi è localizzata a livello midollare.
Per questi pazienti è quindi necessario intraprendere adeguate strategie di salvataggio.
La prognosi per un bambino con LMA recidivata
o resistente è particolarmente grave con una
sopravvivenza globale non superiore al 30%; tale
risultato è anche peggiore nei pazienti che presentano una recidiva precoce, entro cioè un anno
dalla diagnosi iniziale. Il tipo e l’efficacia del trattamento di seconda linea risultano estremamente variabili, dipendendo soprattutto del tipo di trattamento che il paziente ha ricevuto nel protocollo front-line, incluso l’eventuale TMO. Nei pazienti recidivati dopo un allo-TMO la possibilità di guarigione sono minime.
Gli schemi di trattamento delle recidive che includono citarabina, mitoxantrone, etoposide, idarubicina e fludarabina (in generale tutti somministrati ad
alte dosi) e consentono ancora di ottenere la seconda remissione completa nel 50%-70% dei casi. Un
allo TMO viene generalmente eseguito nei soggetti che ottengono una seconda remissione completa con risultati finali di disease free survival (DFS)
intorno al 30-40%. Le sperimentazioni cliniche in atto
includono anche il ricorso a nuovi chemioterapici
e/o a nuovi agenti biologici e/o l’uso di TMO anche
da donatore volontario non familiare o aploidentico (91, 93). In ambito internazionale uno sforzo cooperativo in questo campo è stato effettuato
dall’International BFM study group con il protocollo di fase III denominato Relapsed AML 2001/01
nel quale un trattamento convenzionale FLAG (fludarabina 30 mg/m2/die x 5 gg, ARA-C 2 g/m2/die
x 5 gg, e G-CSF 200 µg/m2/dose x 6 gg, a partire
dal g-1) nel primo ciclo di reinduzione è stato randomizzato contro FLAG + daunorubicina liposomiale (DNX 60 mg/m2/die nei gg 1, 3 and 5). Il secondo ciclo consisteva per tutti i pazienti di un ciclo
FLAG. Un auto o allo-TMO da donatore familiare
o non familiare era indicato per tutti i pazienti che
raggiungevano la RC. Non erano eleggibili i pazienti con età >18 anni e quelli con LPA.
Di particolare rilievo il fatto che in questo studio
sono stati arruolati pazienti provenienti da circa 200
centri situati in 20 paesi diversi. Dal Giugno 2002
all’Aprile 2009 sono stati randomizzati 394 pazienti. Il significato prognostico di una favorevole risposta precoce al trattamento è risultato evidente con
una probabilità di survival a 4 anni del 45% (SE
3%) per i good responders (pazienti con quota blastica <20% dopo i primi 2 cicli di terapia) e del 10%
(SE 3%) per i poor responders (p<0.0001). I
pazienti randomizzati per FLAG + DNX hanno presentato una percentuale di good response
dell’81% vs il 69% (p=0.009). Né il pattern di tossicità né l’overall survival osservati nei due bracci sono peraltro risultati statisticamente differenti.
Dai risultati di questo importante studio si può concludere che le LMA recidivata dall’età pediatrica
può ancora essere trattata con successo in una
discreta quota di pazienti, soprattutto in quelli che
mostrano una favorevole risposta precoce al trattamento (90-93).
n LEUCEMIA ACUTA
PROMIELOCITICA (LPA)
È un sottotipo di LMA classificato come M3 secondo il sistema FAB e rappresenta circa il 4-8% delle LMA pediatriche (94). Nelle popolazioni di origine ispanica o latina tale incidenza raggiunge anche
il 25-30% (95). Le cellule promielocitiche sono carat-
87
88
Seminari di Ematologia Oncologica
terizzate da nuclei bi-lobati e da corpi di Auer, e
sono fortemente mieloperossidasi (MPO) positive.
Esiste una variante di M3 (M3v - 25% delle LPA)
caratterizzata da microgranuli nel citoplasma: sotto il profilo clinico tale forma è caratterizzata da iperleucocitosi e da grave coagulopatia, di solito presente già al momento della diagnosi.
La diagnosi può essere effettuata mediante esame morfologico dello striscio di sangue midollare
ma deve essere confermato da dimostrazione della t(15;17) mediante citogenetica convenzionale,
FISH o reverse transcription-polymerase chain
reaction (RT-PCR) (42), analisi immunoistochimica con anticorpi anti PML che evidenziano un particolare pattern nucleare delle proteine PML
determinato dalla traslocazione t(15;17) dei blasti promielocitici o mediante analisi dell’immunofenotipo con citofluorimetria (96).
L’esordio di LPA rappresenta un’emergenza ematologica. La mortalità alla diagnosi e durante l’induzione, principalmente per complicanze emorragiche, è più elevata in questo sottotipo di LMA che
non nelle altre categorie FAB. Il 5% dei pazienti
muore entro le prime ore dall’esordio a causa di
una emorragia, mentre un ulteriore 5% decede
entro la prima settimana dall’esordio.
L’introduzione dell’acido all-trans retinoico (ATRA)
ha profondamente rivoluzionato la prognosi di questa patologia, riducendo il rischio di emorragie legato in particolare alla CID (coagulopatia intravascolare disseminata) in atto. Proprio per questo motivo, la terapia con ATRA viene generalmente iniziata senza attendere la conferma della traslocazione, il giorno stesso dell’ipotesi diagnostica di
LPA (96, 97). Il trattamento chemioterapico è caratterizzato da una terapia di induzione, due-tre cicli
di consolidamento, e una prolungata fase di mantenimento. In tutte le fasi di chemioterapia è prevista la somministrazione di ATRA. In induzione
l’associazione ATRA-antraciclinici riduce il rischio
di recidiva rispetto alla somministrazione esclusiva di ATRA e l’incidenza di sindrome da ATRA.
Questa sindrome è caratterizzata da febbre,
aumento di peso, distress respiratorio e versamento pleurico e pericardico. Insorge in circa il LPA trattati con ATRA (98). In questo caso deve essere
iniziato un trattamento con desametasone fino a
scomparsa della sintomatologia. La valutazione
della risposta precoce al trattamento, a differen-
za di ciò che avviene per gli altri sottotipi di LMA,
nei pazienti affetti da LPA che ricevono ATRA rimane scarsamente informativa infatti è tipica una lenta clearance della quota blastica: il midollo osseo
14-21 giorni dopo l’inizio della terapia può dimostrarsi relativamente ipercellulare e fino a 40-50
giorni dopo possono essere evidenziati blasti in
corso di maturazione o promieloiciti atipici. Anche
lo stato post induzione della PCR non correla con
l’outcome in questi pazienti (96).
L’uso intensivo e prolungato dell’ATRA, in combinazione con la chemioterapia, ha migliorato la
sopravvivenza delle LPA dal 30-40% dagli anni 80
agli attuali al 70%-80% sia nei bambini che negli
adulti (99, 100). Il monitoraggio della MRM mediante PCR quantitativa (RQ PCR) del trascritto PMLRARα consente di identificare ricadute molecolari di malattia che andrebbero trattate prima di raggiungere la recidiva morfologica (101, 102). Ci sono
infatti evidenze che la persistenza di malattia molecolare dopo il consolidamento o l’aumento del livelli del trascritto alla RQ PCR indichino la ricaduta
molecolare che possa evolvere verso una franca
ripresa clinica della malattia (103). Questo consentirebbe di evitare le temute alterazioni della coagulazione associate alla patologia e di ridurre il
rischio di mutazioni secondarie (4).
L’arsenico triossido (ATO) è un agente molto attivo sui blasti di LPA e sembra rappresentare una
nuova ed efficace arma contro la LPA. Studi clinici controllati hanno dimostrato che l’uso dell’ATO
in caso di recidiva molecolare o conclamata di LPA
ha permesso eccellenti risultati sia sul piano molecolare che ematologico (104). Le recidive di LPA
sono trattate quindi con chemioterapia di reinduzione, frequentemente associata ad ATRA e/o ATO
e successivamente TMO. Dati preliminari sembrerebbero sostenere l’ipotesi che un TMO autologo
effettuato durante la fase di remissione molecolare possa determinare una duratura sopravvivenza libera da malattia senza le complicanze legate
a un TMO allo genico (105). Sono attualmente in
corso anche studi mirati a valutare l’uso dell’ATO
come terapia front-line delle LPA (106).
Tra il 1993 ed il 2000, il Gruppo Italiano per le
Malattie Ematologiche dell’Adulto (GIMEMA) e
l’AIEOP hanno condotto un comune protocollo per
il trattamento della LPA denominato AIDA. I risultati hanno dimostrato che il 96% dei 107 pazien-
La malattia in età pediatrica
ti di età <18 anni sottoposti ad una fase di induzione basata sull’uso di ATRA ed Idarubicina ottiene la CR ematologica con un pattern di tossicità
particolarmente favorevole. La overall survival (OS)
e l’event-free survival (EFS) (43) a oltre 10 anni
sono risultati rispettivamente dell’89% (95% CI:
83%-95%) e del 76% (CI: 65%-85%). La conta leucocitaria è risultata di notevole impatto sulla prognosi (i pazienti con GB alla diagnosi ≥10.000/mm3
vs <10.000/mm3 hanno ottenuto un EFS a 10 anni
rispettivamente del 59% vs 83%). Il miglior tipo di
mantenimento è risultato quello caratterizzato da
un prolungato uso (2 anni) di chemioterapia (6mercaptopurina + methotrexate) e di ATRA (98).
È importante sottolineare che l’esperienza e la
competenza sviluppata in Italia nell’ambito della
LPA dell’età pediatrica ha determinato l’affidamento al gruppo AIEOP, nell’ambito del gruppo cooperativo denominato International BFM Study
Group, del disegno e della conduzione di uno studio sulla LPA (che è denominato ICC APL Study
01) al quale hanno aderito numerosi gruppi cooperativi europei, extraeuropei ed anche nordamericani. Lo studio è finalizzato ad una riduzione dell’uso di antracicline ed alla stratificazione dei
pazienti, sulla base della conta leucocitaria, in
rischio standard (SR) (<10.000/mm3) od AR
(≥10.000/mm3). L’ATRA è utilizzato durante tutte
le fasi di trattamento, mentre dosi intermedie di citarabina sono utilizzate durante la fase di consolidamento post-remissionale. I pazienti SR ricevono solamente 2 cicli di consolidamento mentre i
pazienti AR ne ricevono 3. È prevista una fase di
mantenimento di 2 anni con 6-mercaptopurina,
methotrexate ed ATRA. Lo studio prevede un intensivo monitoraggio del trascritto molecolare PMLRARα e sulla base della sua positività sono previsti interventi terapeutici di rescue ed anche l’uso
del TMO. Il protocollo ICC APL Study 01 è già
aperto al reclutamento dei pazienti.
n IL TRATTAMENTO DELLA LMA
NELL’ESPERIENZA DELL’AIEOP
Il periodo dal 1982 al 2002 (protocolli LAM82, -87, -87M e -92)
Dal 1982 in poi l’AIEOP ha condotto nella LMA
dell’età pediatrica 4 studi consecutivi, chiamati
LAM-82, -87, -87M e -92. Il trattamento d’Induzione
dei primi tre studi consisteva nel classico schema
3+7 (daunorubicina 3 giorni + citarabina 7 giorni)
mentre nello studio -92 i pazienti venivano trattati con due cicli di induzione ICE (idarubicina + citarabina + etoposide). I pazienti con LPA erano inclusi solamente nei primi due studi. Il trattamento
postremissionale era di diversi tipi, nei primi studi non particolarmente intenso mentre successivamente fu applicato con sempre maggiore frequenza una procedura trapiantologica. I risultati a
5 anni ottenuti nei pazienti trattati nei vari protocolli è riportato nella tabella 5. In particolare, nei
protocolli LAM-82, -87 ed -87M risultava abbastanza simile fra di loro mentre nello studio LAM-92
è risultato significativamente migliore dei precedenti (P<0.005). In questo studio l’TMO allogenico od autologo venne effettuato in oltre il 75% dei
pazienti (107).
Il protocollo AIEOP LAM 2002
L’esperienza derivata dai protocolli condotti in Italia
dall’AIEOP tra il 1982 e la fine degli anni ’90 ha
ispirato le linee di stratificazione e trattamento dell’attuale protocollo AIEOP LAM 2002 che non prevede peraltro l’arruolamento dei pazienti con LPA
e di quelli con DS per i quali sono previsti specifici protocolli. La strategia chemioterapica post-remissionale ha attinto da blocchi di chemioterapia consolidati derivati dall’esperienza BFM. Nel protocollo AIEOP LAM 2002 i pazienti vengono stratificati in due gruppi, rischio standard (SR, i.e. presenza del trascritto di fusione AML1-ETO oppure di
anomalie della regione CBF-β che abbiano ottenuto la RC dopo il primo ciclo di induzione) e AR
(tutti gli altri pazienti). Per tutti i pazienti sono pre-
Protocollo
AIEOP
No.
pazienti
No.
eventi
pEFS
a 5 anni
LAM 82
LAM 87
LAM 87M
LAM 92
LAM 2002
171
151
77
160
205
122
111
65
74
91
0.31
0.27
0.16
0.54
0.55
pEFS = Probabilità di Event Free Survival
TABELLA 5 - Probabiltà di EFS a 5 anni per i pazienti reclutati nei
protocolli AIEOP LAM 82-87-87M-92 (107) e LAM 2002 (89).
89
90
Seminari di Ematologia Oncologica
visti due cicli ICE seguiti da due ulteriori cicli denominati AVE (citarabina ad alte dosi + etoposide) ed
HAM (citarabina ad alte dosi + mitoxantrone).
I pazienti SR concludono poi il trattamento con un
ciclo di HD-ARA-C (citarabina ad alte dosi) mentre i pazienti AR sono sottoposti ad un allo-TMO
da fratello HLA identico (ove disponibile) oppure
da un TMO autologo con purificazione in vitro effettuata con mafosfamide. L’allo-TMO da donatore
HLA identico non correlato è indicato solamente
per i pazienti con LMA M7 o con età inferiore ad
1 anno cui viene attribuita una prognosi particolarmente negativa. Il regime di condizionamento
prevede l’uso di busulfano, ciclofosfamide e melfalan. Tra il 12/2002 ed il 12/2007, 205 bambini con
nuova diagnosi di LMA sono risultati eleggibili e
valutabili per il trattamento; di questi 34 (16%) e
171 (84%) sono stati assegnati ai gruppi SR ed
AR, rispettivamente. L’82% dei 205 pazienti ha ottenuto la RC dopo l’induzione, con una mortalità del
4,3% ed una percentuale di resistenti dell’11,7%.
Il 35% dei pazienti ha presentato una recidiva. Con
un follow-up mediano di 43 mesi (range 4-86), la
probabilità di OS e di EFS a 5 anni sono stati
rispettivamente del 70% e 55% (Tab. V), mentre
nei pazienti SR è stata del 97% e del 78% e nei
pazienti AR è stata del 64% e 50% rispettivamente. I risultati di questo protocollo relativamente agli
aspetti trapiantologici sono già stati riportati nella
specifica sezione dedicata al TMO. I risultati globali riportati con il protocollo AIEOP LAM 2002
sono oggi da considerarsi favorevoli ed hanno raggiunto l’obiettivo di EFS prefissato al momento
all’apertura del protocollo; inoltre attualmente
questo protocollo unifica il trattamento previsto per
una LMA diagnosticata nell’età pediatrica su quasi tutto il territorio nazionale (89).
Nota
Gli studi AIEOP per la LMA sono stati coordinati
negli anni ’80 e ’90 dal Prof. Franco Mandelli
(Cattedra di Ematologia-Università La SapienzaRoma) mentre a partire dall’anno 2001 il coordinamento è stato affidato al Prof. Andrea PessionPoliclinico S. Orsola-Bologna coadiuvato da un
Comitato Scientifico composto da: Prof. Fiorina
Casale (Napoli), Dott.ssa Franca Fagioli (Torino),
Prof. Franco Locatelli (Pavia), Dott. Luca Lo Nigro
(Catania), Dott. Matteo Luciani (Roma), Dott.
Giuseppe Menna (Napoli), Dott.ssa Concetta
Micalizzi, (Genova), Dott.ssa Caterina Putti
(Padova), Dott. Carmelo Rizzari (Monza), Dott.
Nicola Santoro (Bari) e con la consulenza di: Prof.
Andrea Biondi (Monza), Prof. Giuseppe Basso
(Padova), Dr.ssa Anna Maria Testi (Roma
Ematologia), Dr. Roberto Rondelli (Bologna).
Gli studi AIEOP per le LPA sono stati coordinati
fino ai primi anni dopo il 2000 dal Prof. Franco
Mandelli in collaborazione con la Dr.ssa Anna
Maria Testi, (Cattedra di Ematologia-Università La
Sapienza-Roma) ed in cooperazione con il GIMEMA per lo studio AIDA. L’attuale coordinamento del
nuovo protocollo internazionale (ICC APL study
01 dell’International BFM Study Group) per le LPA
è affidato ad un Comitato Internazionale di cui fanno parte la Dr.ssa Anna Maria Testi ed il Prof.
Andrea Pession.
n CONCLUSIONI E PROSPETTIVE
FUTURE
Il trattamento della LMA infantile sembra aver raggiunto risultati apprezzabili e collocabili oggi, con
le moderne strategie di cura adottate in molti gruppi cooperativi internazionali, intorno al 60-65% di
sopravvivenza a 5 anni. Esiste oggi la ragionevole convinzione che nei pazienti a SR il risultato
dell’80% di EFS sia un obiettivo acquisito ma che
non possa essere ulteriormente migliorato aumentando l’intensità del trattamento se non rischiando
un surplus di tossicità che potrebbe risultare alla
fine intollerabile. Anche nei pazienti ad AR la tossicità legata al trattamento sembra essere già massimale per cui gli eventuali miglioramenti futuri non
potranno che essere legati in questi pazienti all’adozione di strategie così diversificate:
1. uso sempre più attento e tempestivo della terapia di supporto;
2. individuazione sempre più precisa del rischio
di ricaduta dei pazienti utilizzando gli ormai
numerosi markers citogenetici e molecolari presenti all’esordio;
3. monitorizzazione della MRM per effettuare
interventi di rescue precoci;
4. scelta attenta delle strategie trapiantologiche,
anche innovative, più consone al rischio di recidiva;
La malattia in età pediatrica
5. uso precoce di agenti terapeutici di nuova generazione.
Tra questi ultimi vanno ricordati gli ormai numerosi farmaci aventi targets biologici specifici della cellula leucemica come per esempio gli inibitori delle tirosin kinasi, gli inibitori di FLT3 o gli anticorpi
monoclonali come quello contro il CD33 (GO)
(108), oppure chemioterapici di tipo più convenzionale ma apparentemente di maggiore efficacia
e selettività come la clofarabina (109). Anche nelle LPA esiste la più che promettente possibilità di
utilizzare a breve ed in maniera più estensiva anche
nell’età pediatrica l’ATO (108-110) che sembra avere notevoli capacità sinergiche con l’ATRA. Tutti
questi agenti, che sono già in fase avanzata di utilizzazione nell’età adulta, sono attualmente in fase
di avanzata sperimentazione (fasi I e II-III rispettivamente) anche nell’età pediatrica. Certamente
restano ancora aperti molti quesiti tra i quali quando ed a quali pazienti proporre questo tipo di terapie, quali e quante anomalie citogenetiche utilizzare nella stratificazione iniziale dei pazienti,
quanto essere precoci nel giudicare una malattia
anche minimamente “resistente” ed essere autorizzati ad intraprendere terapie innovative basate
su esperienze e risultati ancora numericamente
limitati. Numerosi studi sono attualmente in corso
da parte di gruppi cooperativi pediatrici per tentare di dare una risposta a queste domande.
n BIBLIOGRAFIA
1. Smith MA, Rubinstein L, Anderson JR, Arthur D,
Catalano PJ, Freidlin B, et al. Secondary leukemia or
myelodysplastic syndrome after treatment with epipodophyllotoxins. J Clin Oncol. 1999; 17: 569-77.
2. Stevens RF, Hann IM, Wheatley K, Gray RG. Marked
improvements in outcome with chemotherapy alone
in paediatric acute myeloid leukemia: results of the
United Kingdom Medical Research Council’s 10th
AML trial. MRC Childhood Leukaemia Working Party.
Br J Haematol. 1998; 101: 130-40.
3. Pizzo PA, Poplack DG. Principles and practice of
pediatric oncology. Fifth edition. Lippincott Williams &
Wilkins. Philadelphia. 2006.
4. Kaspers GJ, Zwaan CM. Pediatric acute myeloid leukemia: towards high-quality cure of all patients.
Haematologica. 2007; 92: 1519-32.
5. Kaspers GJ, Creutzig U. Pediatric acute myeloid leukemia: international progress and future directions.
Leukemia. 2005; 19: 2025-9.
6. Hijiya N, Ness KK, Ribeiro RC, Hudson MM. Acute
leukemia as a secondary malignancy in children and
adolescents: current findings and issues. Cancer. 2009;
115: 23-35.
7. Hijiya N, Hudson MM, Lensing S, Zacher M, Onciu M,
Behm FG, et al. Cumulative incidence of secondary
neoplasms as a first event after childhood acute lymphoblastic leukemia. JAMA. 2007; 297: 1207-15.
8. Pui CH, Ribeiro RC, Hancock ML, Rivera GK, Evans
WE, Raimondi SC, et al. Acute myeloid leukemia in children treated with epipodophyllotoxins for acute lymphoblastic leukemia. N Engl J Med. 1991; 325: 1682-7.
9. Felix CA. Leukemias related to treatment with DNA
topoisomerase II inhibitors. Med Pediatr Oncol. 2001;
36: 525-35.
10. Davies SM. Therapy-related leukemia associated with
alkylating agents. Med Pediatr Oncol. 2001; 36: 53640.
11. Pulsoni A, Pagano L, Lo Coco F, Avvisati G, Mele L,
Di Bona E, et al. Clinicobiological features and outcome of acute promyelocytic leukemia occurring as
a second tumor: the GIMEMA experience. Blood.
2002; 100: 1972-6.
12. Pollicardo N, O’Brien S, Estey EH, al-Bitar M, Pierce
S, Keating M, et al. Secondary acute promyelocytic
leukemia. Characteristics and prognosis of 14 patients
from a single institution. Leukemia. 1996; 10: 27-31.
13. Pagana L, Pulsoni A, Tosti ME, Avvisati G, Mele L,
Mele M, et al. Clinical and biological features of acute myeloid leukaemia occurring as second malignancy: GIMEMA archive of adult acute leukaemia. Br J
Haematol. 2001; 112: 109-17.
14. Pui CH, Behm FG, Raimondi SC, Dodge RK, George
SL, Rivera GK, et al. Secondary acute myeloid leukemia in children treated for acute lymphoid leukemia.
N Engl J Med. 1989; 321: 136-42.
15. Nathan DG, Orkin S, et al. Nathan and Oski’s hematology of infancy and childhood. Seventh edition.
Saunders Elsevier. Philadelphia. 2008.
16. Zipursky A. Transient leukaemia - a benign form of leukaemia in newborn infants with trisomy 21. Br J
Haematol. 2003; 120: 930-8.
17. Malinge S, Izraeli S, Crispino JD. Insights into the manifestations, outcomes, and mechanisms of leukemogenesis in Down syndrome. Blood. 2009; 113: 2619-28.
18. Zwaan CM, Kaspers GJ. Possibilities for tailored and
targeted therapy in paediatric acute myeloid leukaemia. Br J Haematol. 2004; 127: 264-79.
19. Dixon N, Kishnani PS, Zimmerman S. Clinical manifestations of hematologic and oncologic disorders in
patients with Down syndrome. Am J Med Genet C
Semin Med Genet. 2006; 142C: 149-57.
20. Kelly LM, Gilliland DG. Genetics of myeloid leukemias.
Annu Rev Genomics Hum Genet. 2002; 3: 179-98.
21. Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem
cells, cancer, and cancer stem cells. Nature. 2001; 414:
105-11.
91
92
Seminari di Ematologia Oncologica
22. Insinga A, Pelicci PG, Inucci S. Leukemia-associated
fusion proteins. Multiple mechanisms of action to drive cell transformation. Cell Cycle. 2005n; 4: 67-9.
23. Lo-Coco F, Ammatuna E, Montesinos P, Sanz MA.
Acute promyelocytic leukemia: recent advances in
diagnosis and management. Semin Oncol. 2008; 35:
401-9.
24. Renneville A, Roumier C, Biggio V, Nibourel O, Boissel
N, Fenaux P, et al. Cooperating gene mutations in acute myeloid leukemia: a review of the literature.
Leukemia. 2008; 22: 915-31.
25. Schimmer AD. Induction of apoptosis in lymphoid and
myeloid leukemia. Curr Oncol Rep. 2006; 8: 430-6.
26. Stirewalt DL, Radich JP. The role of FLT3 in haematopoietic malignancies. Nat Rev Cancer. 2003; 3: 650-65.
27. Meshinchi S, Woods WG, Stirewalt DL, Sweetser DA,
Buckley JD, Tjoa TK, et al. Prevalence and prognostic
significance of Flt3 internal tandem duplication in pediatric acute myeloid leukemia. Blood. 2001; 97: 89-94.
28. Zwaan CM, Meshinchi S, Radich JP, Veerman AJ,
Huismans DR, Munske L, et al. FLT3 internal tandem
duplication in 234 children with acute myeloid leukemia: prognostic significance and relation to cellular
drug resistance. Blood. 2003; 102: 2387-94.
29. Schnittger S, Schoch C, Dugas M, Kern W, Staib P,
Wuchter C, et al. Analysis of FLT3 length mutations
in 1003 patients with acute myeloid leukemia: correlation to cytogenetics, FAB subtype, and prognosis in
the AMLCG study and usefulness as a marker for the
detection of minimal residual disease. Blood. 2002;
100: 59-66.
30. Arrigoni P, Beretta C, Silvestri D, Rossi V, Rizzari C,
Valsecchi MG, et al. FLT3 internal tandem duplication
in childhood acute myeloid leukaemia: association with
hyperleucocytosis in acute promyelocytic leukaemia.
Br J Haematol. 2003; 120: 89-92.
31. Meshinchi S, Stirewalt DL, Alonzo TA, Zhang Q,
Sweetser DA, Woods WG, et al. Activating mutations
of RTK/ras signal transduction pathway in pediatric
acute myeloid leukemia. Blood. 2003; 102: 1474-9.
32. Meshinchi S, Alonzo TA, Stirewalt DL, Zwaan M,
Zimmerman M, Reinhardt D, et al. Clinical implications
of FLT3 mutations in pediatric AML. Blood. 2006; 108:
3654-61.
33. Goemans EA. Incidence and clinical relevance of
receptor tyrosine kinase and RAS-mutations in pediatric AML. [Abstract]. Annals of Hematology, 2004; 83
(Suppl. 1): S28.
34. Goemans BF, Zwaan CM, Miller M, Zimmermann M,
Harlow A, Meshinchi S, et al. Mutations in KIT and RAS
are frequent events in pediatric core-binding factor acute myeloid leukemia. Leukemia. 2005; 19: 1536-42.
35. Boissel N, Leroy H, Brethon B, Philippe N, de Botton
S, Auvrignon A, et al. Incidence and prognostic impact
of c-Kit, FLT3, and Ras gene mutations in core binding factor acute myeloid leukemia (CBF-AML).
Leukemia. 2006; 20: 965-70.
36. Shimada A, Taki T, Tabuchi K, Tawa A, Horibe K,
Tsuchida M, et al. KIT mutations, and not FLT3 internal tandem duplication, are strongly associated with
a poor prognosis in pediatric acute myeloid leukemia
with t(8;21): a study of the Japanese Childhood AML
Cooperative Study Group. Blood. 2006; 107: 1806-9.
37. Tartaglia M, Martinelli S, Iavarone I, Cazzaniga G,
Spinelli M, Giarin E, et al. Somatic PTPN11 mutations
in childhood acute myeloid leukaemia. Br J Haematol.
2005; 129: 333-9.
38. Goemans BF, Zwaan CM, Martinelli S, Harrell P, de
Lange D, Carta C, et al. Differences in the prevalence of PTPN11 mutations in FAB M5 paediatric acute myeloid leukaemia. Br J Haematol. 2005; 130: 8013.
39. Frohling S, Scholl C, Gilliland DG, Levine RL.
Genetics of myeloid malignancies: pathogenetic and
clinical implications. J Clin Oncol. 2005; 23: 6285-95.
40. Elagib KE, Goldfarb AN. Oncogenic pathways of
AML1-ETO in acute myeloid leukemia: multifaceted
manipulation of marrow maturation. Cancer Lett. 2007;
251: 179-86.
41. Willasch AM, Gruhn B, Coliva T, Kalinova M,
Schneider G, Kreyenberg H, et al. Standardization of
WT1 mRNA quantitation for minimal residual disease monitoring in childhood AML and implications of
WT1 gene mutations: a European multicenter study.
Leukemia. 2009; 23: 1472-9.
42. Lapillonne H, Renneville A, Auvrignon A, Flamant C,
Blaise A, Perot C, et al. High WT1 expression after
induction therapy predicts high risk of relapse and
death in pediatric acute myeloid leukemia. J Clin
Oncol. 2006; 24: 1507-15.
43. Gaidzik VI, Schlenk RF, Moschny S, Becker A,
Bullinger L, Corbacioglu A, et al. Prognostic impact
of WT1 mutations in cytogenetically normal acute myeloid leukemia: a study of the German-Austrian AML
Study Group. Blood. 2009; 113: 4505-11.
44. Hollink IH, van den Heuvel-Eibrink MM, Zimmermann
M, Balgobind BV, Arentsen-Peters ST, Alders M, et
al. Clinical relevance of Wilms tumor 1 gene mutations
in childhood acute myeloid leukemia. Blood. 2009; 113:
5951-60.
45. Rosenfeld C, Cheever MA, Gaiger A. WT1 in acute
leukemia, chronic myelogenous leukemia and myelodysplastic syndrome: therapeutic potential of WT1
targeted therapies. Leukemia. 2003; 17: 1301-12.
46. Leroy H, Roumier C, Huyghe P, Biggio V, Fenaux P,
Preudhomme C. CEBPA point mutations in hematological malignancies. Leukemia. 2005; 19: 329-34.
47. Mrozek K, Bloomfield CD. Chromosome aberrations,
gene mutations and expression changes, and prognosis in adult acute myeloid leukemia. American Society
of Hematology, Education Program Book. 2006; 16977.
48. Falini B, Mecucci C, Tiacci E, Alcalay M, Rosati R,
Pasqualucci L, et al. Cytoplasmic nucleophosmin in
La malattia in età pediatrica
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
acute myelogenous leukemia with a normal karyotype. N Engl J Med. 2005; 352: 254-66.
Schnittger S, Schoch C, Kern W, Mecucci C, Tschulik
C, Martelli MF, et al. Nucleophosmin gene mutations
are predictors of favorable prognosis in acute myelogenous leukemia with a normal karyotype. Blood.
2005; 106: 3733-9.
Cazzaniga G, Dell’Oro MG, Mecucci C, Giarin E,
Masetti R, Rossi V, et al. Nucleophosmin mutations
in childhood acute myelogenous leukemia with normal karyotype. Blood. 2005; 106: 1419-22.
Thiede C, Creutzig E, Reinhardt D, Ehninger G,
Creutzig U. Different types of NPM1 mutations in children and adults: evidence for an effect of patient age
on the prevalence of the TCTG-tandem duplication in
NPM1-exon 12. Leukemia. 2007; 21: 366-7.
Hollink IH, Zwaan CM, Zimmermann M, ArentsenPeters TC, Pieters R, Cloos J, et al. Favorable prognostic impact of NPM1 gene mutations in childhood acute myeloid leukemia, with emphasis on cytogenetically normal AML. Leukemia. 2009; 23: 262-70.
Shah M, Agarwal B. Recent advances in management
of acute myeloid leukemia (AML). Indian J Pediatr.
2008; 75: 831-7.
Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton
DA, Gralnick HR, Sultan C. Proposed revised criteria
for the classification of acute myeloid leukemia. A report
of the French-American-British Cooperative Group. Ann
Intern Med. 1985; 103 (4): 620-5.
Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton
DA, Gralnick HR, Sultan C. Criteria for the diagnosis
of acute leukemia of megakaryocyte lineage (M7). A
report of the French-American-British Cooperative
Group. Ann Intern Med. 1985; 103 (3): 460-2.
Bennett JM, Catovsky D, Daniel MT, Flandrin G,
Galton DA, Gralnick HR, Sultan C. Proposal for the
recognition of minimally differentiated acute myeloid
leukaemia (AML-MO). Br J Haematol. 1991; 78 (3):
325-9.
Vardiman JW. The World Health Organization (WHO)
classification of the myeloid neoplasms. Blood. 2002;
7: 2292-302.
Hasle H, Niemeyer CM, Chessells JM, Baumann I,
Bennett JM, Kerndrup G, et al. A pediatric approach
to the WHO classification of myelodysplastic and myeloproliferative diseases. Leukemia. 2003; 17: 277-82.
Stary J, Locatelli F, Niemeyer CM. Stem cell transplantation for aplastic anemia and myelodysplastic syndrome. Bone Marrow Transplant. 2005; 35 (Suppl 1):
S13-6.
Guglielmi C, Martelli MP, Diverio D, Fenu S, Vegna ML,
Cantu-Rajnoldi A, et al. Immunophenotype of adult and
childhood acute promyelocytic leukaemia: correlation
with morphology, type of PML gene breakpoint and
clinical outcome. A cooperative Italian study on 196
cases. Br J Haematol. 1998; 102: 1035-41.
Steudel C, Wermke M, Schaich M, Schakel U, Illmer
T, Ehninger G, et al. Comparative analysis of MLL partial tandem duplication and FLT3 internal tandem duplication mutations in 956 adult patients with acute myeloid leukemia. Genes Chromosomes Cancer. 2003;
37: 237-51.
62. Meshinchi S, Arceci RJ. Prognostic factors and riskbased therapy in pediatric acute myeloid leukemia.
Oncologist. 2007; 12: 341-55.
63. Gibson BE, Wheatley K, Hann IM, Stevens RF, Webb
D, Hills RK, et al. Treatment strategy and long-term
results in paediatric patients treated in consecutive UK
AML trials. Leukemia. 2005; 19: 2130-8.
64. Creutzig U, Zimmermann M, Ritter J, Reinhardt D,
Hermann J, Henze G, et al. Treatment strategies and
long-term results in paediatric patients treated in four
consecutive AML-BFM trials. Leukemia. 2005; 19:
2030-42.
65. Lie SO, Abrahamsson J, Clausen N, Forestier E, Hasle
H, Hovi L, et al. Long-term results in children with AML:
NOPHO-AML Study Group - report of three consecutive trials. Leukemia. 2005; 19: 2090-100.
66. Rubnitz JE, Raimondi SC, Tong X, Srivastava DK,
Razzouk BI, Shurtleff SA, et al. Favorable impact of
the t(9;11) in childhood acute myeloid leukemia. J Clin
Oncol. 2002; 20: 2302-9.
67. Hasle H, Alonzo TA, Auvrignon A, Behar C, Chang
M, Creutzig U, et al. Monosomy 7 and deletion 7q in
children and adolescents with acute myeloid leukemia: an international retrospective study. Blood. 2007;
109: 4641-7.
68. Grimwade D, Walker H, Oliver F, Wheatley K, Harrison
C, Harrison G, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients
entered into the MRC AML 10 trial. The Medical
Research Council Adult and Children’s Leukaemia
Working Parties. Blood. 1998; 92: 2322-33.
69. Creutzig U, Zimmermann M, Ritter J, Henze G, Graf
N, Loffler H, et al. Definition of a standard-risk group
in children with AML. Br J Haematol. 1999; 104: 6309.
70. Chang M, Raimondi SC, Ravindranath Y, Carroll AJ,
Camitta B, Gresik MV, et al. Prognostic factors in children and adolescents with acute myeloid leukemia
(excluding children with Down syndrome and acute
promyelocytic leukemia): univariate and recursive partitioning analysis of patients treated on Pediatric
Oncology Group (POG) Study 8821. Leukemia.
2000; 14: 1201-7.
71. Woods WG, Neudorf S, Gold S, Sanders J, Buckley
JD, Barnard DR, et al. A comparison of allogeneic
bone marrow transplantation, autologous bone marrow transplantation, and aggressive chemotherapy in
children with acute myeloid leukemia in remission.
Blood. 2001; 97: 56-62.
72. Rubnitz JE. Childhood acute myeloid leukemia. Curr
Treat Options Oncol. 2008; 9: 95-105.
73. Pui CH, Schrappe M, Ribeiro RC, Niemeyer CM.
93
94
Seminari di Ematologia Oncologica
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
Childhood and adolescent lymphoid and myeloid leukemia. American Society of Hematology, Education
Program Book. 2004; 118-45.
Campana D, Pui CH. Detection of minimal residual
disease in acute leukemia: methodologic advances
and clinical significance. Blood. 1995; 85: 1416-34.
Campana D. Status of minimal residual disease testing
in childhood haematological malignancies. Br J
Haematol. 2008; 143: 481-9.
Kottaridis PD, Gale RE, Langabeer SE, Frew ME,
Bowen DT, Linch DC. Studies of FLT3 mutations in
paired presentation and relapse samples from
patients with acute myeloid leukemia: implications for
the role of FLT3 mutations in leukemogenesis, minimal residual disease detection, and possible therapy
with FLT3 inhibitors. Blood. 2002; 100: 2393-8.
Beretta C, Gaipa G, Rossi V, Bernasconi S, Spinelli
O, Dell’Oro MG, et al. Development of a quantitativePCR method for specific FLT3/ITD monitoring in acute myeloid leukemia. Leukemia. 2004; 18: 1441-4.
Campana D. Determination of minimal residual disease in leukaemia patients. Br J Haematol. 2003; 121:
823-38.
Langebrake C, Creutzig U, Dworzak M, Hrusak O,
Mejstrikova E, Griesinger F, et al. Residual disease
monitoring in childhood acute myeloid leukemia by
multiparameter flow cytometry: the MRD-AML-BFM
Study Group. J Clin Oncol. 2006; 24: 3686-92.
van Dalen EC, van der Pal HJ, Kok WE, Caron HN,
Kremer LC. Clinical heart failure in a cohort of children treated with anthracyclines: a long-term followup study. Eur J Cancer. 2006; 42: 3191-8.
Pui CH, Howard SC. Current management and challenges of malignant disease in the CNS in paediatric
leukaemia. Lancet Oncol. 2008; 9: 257-68.
Hubeek I, Peters GJ, Broekhuizen R, Zwaan CM, Kaaijk
P, van Wering ES, et al. In vitro sensitivity and crossresistance to deoxynucleoside analogs in childhood acute leukemia. Haematologica. 2006; 91: 17-23.
Krance RA, Hurwitz CA, Head DR, Raimondi SC,
Behm FG, Crews KR, et al. Experience with 2-chlorodeoxyadenosine in previously untreated children with
newly diagnosed acute myeloid leukemia and myelodysplastic diseases. J Clin Oncol. 2001; 19: 2804-11.
Ravindranath Y, Yeager AM, Chang MN, Steuber CP,
Krischer J, Graham-Pole J, et al. Autologous bone marrow transplantation versus intensive consolidation chemotherapy for acute myeloid leukemia in childhood.
Pediatric Oncology Group. N Engl J Med. 1996; 334:
1428-34.
Amadori S, Testi AM, Arico M, Comelli A, Giuliano M,
Madon E, et al. Prospective comparative study of bone
marrow transplantation and postremission chemotherapy for childhood acute myelogenous leukemia. The
Associazione Italiana Ematologia ed Oncologia
Pediatrica Cooperative Group. J Clin Oncol. 1993; 11:
1046-54.
86. Klingebiel T, Reinhardt D, Bader P. Place of HSCT in
treatment of childhood AML. [Abstract]. Bone Marrow
Transplant. 2008; 42 (Suppl 2): S7-9.
87. Bleakley M, Lau L, Shaw PJ, Kaufman A. Bone marrow transplantation for paediatric AML in first remission: a systematic review and meta-analysis. Bone
Marrow Transplant. 2002; 29: 843-52.
88. Creutzig U, Reinhardt D, Zimmermann M, Klingebiel
T, Gadner H. Intensive chemotherapy versus bone
marrow transplantation in pediatric acute myeloid leukemia: a matter of controversies. Blood. 2001; 97:
3671-2; author reply 4-5.
89. Pession ARC, Putti MC, Masetti R, Casale F, Fagioli
F, Lo Nigro L, et al. Results of the AIEOP AML 2002/01
study for the treatmentof children with acute myeloid
leukemia. [Abstract] Blood 2009; 114: 17.
90. Goemans BF, Tamminga RY, Corbijn CM, Hahlen K,
Kaspers GJ. Outcome for children with relapsed acute myeloid leukemia in the Netherlands following initial treatment between 1980 and 1998: survival after
chemotherapy only? Haematologica. 2008; 93:
1418-20.
91. Abrahamsson JCN, Gustafsson G, Hovi L,
Jonmundsson G, Zeller B, Forestier E, et al. Improved
outcome after relapse in children with acute myeloid
leukaemia. Br J Haematol. 2007; 136: 229-36.
92. Reinhardt D, Hempel G, Fleischhack G, Schulz A,
Boos J, Creutzig U. Liposomal daunorubicine combined with cytarabine in the treatment of relapsed/refractory acute myeloid leukemia in children. Klin Padiatr.
2002; 214: 188-94.
93. Kaspers GJL, Reinhardt D, Gibson B, Tamminga R,
Aleinikova O, Armendariz H, et al. Addition of liposomal daunorubicin (DaunoXome®) to FLAG significantly improves early treatment responsein pediatric relapsed AML: final results from the International
Randomised Phase III Study Relapsed AML 2001/01.
[Abstract] Blood 2009; 114: 18.
94. Gregory J Jr, Feusner J. Acute promyelocytic leukaemia in children. Best Pract Res Clin Haematol. 2003;
16: 483-94.
95. Rizzari C, Biondi A. Tailoring treatment strategy for acute promyelocytic leukemia in low-income countries.
Paediatric Blood Cancer. 2009; 53: 303-5.
96. Sanz MA, Tallman MS, Lo-Coco F. Practice points,
consensus, and controversial issues in the management of patients with newly diagnosed acute promyelocytic leukemia. Oncologist. 2005; 10: 806-14.
97. Mann G, Reinhardt D, Ritter J, Hermann J, Schmitt
K, Gadner H, et al. Treatment with all-trans retinoic
acid in acute promyelocytic leukemia reduces early
deaths in children. Ann Hematol. 2001; 80: 417-22.
98. Testi AM, Biondi A, Lo Coco F, Moleti ML, Giona F,
Vignetti M, et al. GIMEMA-AIEOPAIDA protocol for the
treatment of newly diagnosed acute promyelocytic leukemia (APL) in children. Blood. 2005; 106: 447-53.
99. Tallman MS, Nabhan C, Feusner JH, Rowe JM. Acute
La malattia in età pediatrica
promyelocytic leukemia: evolving therapeutic strategies. Blood. 2002; 99: 759-67.
100. Biondi A, Rovelli A, Cantù-Rainoldi A, Fenu S, Basso
G, Luciano A, et al. Acute promyelocytic leukemia in
children: experience of the Italian paediatric hematology and oncology group (AIEOP). Leukemia. 1994;
8: 1264-8.
101. Breccia M, Diverio D, Noguera NI, Visani G, Santoro
A, Locatelli F, et al. Clinico-biological features and outcome of acute promyelocytic leukemia patients with
persistent polymerase chain reaction-detectable
disease after the AIDA front-line induction and consolidation therapy. Haematologica. 2004; 89: 29-33.
102. Grimwade D, Jovanovic JV, Hills RK, Nugent EA,
Patel Y, Flora R, et al. Prospective minimal residual
disease monitoring to predict relapse of acute promyelocytic leukemia and to direct pre-emptive arsenic trioxide therapy. J Clin Oncol. 2009; 27: 3650-8.
103. Grimwade D, Lo Coco F. Acute promyelocytic leukemia: a model for the role of molecular diagnosis and
residual disease monitoring in directing treatment
approach in acute myeloid leukemia. Leukemia. 2002;
16: 1959-73.
104. Estey E, Garcia-Manero G, Ferrajoli A, Faderl S,
Verstovsek S, Jones D, et al. Use of all-trans retinoic
acid plus arsenic trioxide as an alternative to chemotherapy in untreated acute promyelocytic leukemia.
Blood. 2006; 107: 3469-73.
105. Termuhlen AM, Klopfenstein K, Olshefski R, Rosselet
R, Yeager ND, Soni S, et al. Mobilization of PMLRARA negative blood stem cells and salvage with
autologous peripheral blood stem cell transplantation
in children with relapsed acute promyelocytic leukemia. Pediatr Blood Cancer. 2008; 51: 521-4.
106. Sanz MA, Fenaux P, Lo Coco F. Arsenic trioxide in
the treatment of acute promyelocytic leukemia. A
review of current evidence. Haematologica. 2005; 90:
1231-5.
107. Pession A, Rondelli R, Basso G, Rizzari C, Testi AM,
Fagioli F, et al. Treatment and long-term results in children with acute myeloid leukaemia treated according
to the AIEOP AML protocols. Leukemia. 2005; 19:
2043-53.
108. Aplenc R, Alonzo TA, Gerbing RB, Lange BJ,
Hurwitz CA, Wells RJ, et al. Safety and efficacy of
gemtuzumab ozogamicin in combination with chemotherapy for pediatric acute myeloid leukemia: a report
from the Children’s Oncology Group. J Clin Oncol.
2008; 26: 2390-3295.
109. Jeha S, Razzouk B, Rytting M, Rheingold S, Albano
E, Kadota R, et al. Phase II study of clofarabine in
pediatric patients with refractory or relapsed acute
myeloid leukemia. J Clin Oncol. 2009; 27: 4392-7.
110. Creutzig U, Ritter J, Zimmermann M, Reinhardt D,
Hermann J, Berthold F, et al. Improved treatment
results in high-risk pediatric acute myeloid leukemia
111.
112.
113.
114.
115.
116.
117.
118.
119.
patients after intensification with high-dose cytarabine and mitoxantrone: results of Study Acute Myeloid
Leukemia-Berlin-Frankfurt-Munster 93. J Clin Oncol.
2001; 19: 2705-13.
Lange BJ, Smith FO, Feusner J, Barnard DR,
Dinndorf P, Feig S, et al. Outcomes in CCG-2961, a
children’s oncology group phase 3 trial for untreated
pediatric acute myeloid leukemia: a report from the
children’s oncology group. Blood. 2008; 111: 104453.
Kardos G, Zwaan CM, Kaspers GJ, de-Graaf SS, de
Bont ES, Postma A, et al. Treatment strategy and
results in children treated on three Dutch Childhood
Oncology Group acute myeloid leukemia trials.
Leukemia. 2005; 19: 2063-71.
Entz-Werle N SS, van der Werff ten Bosch, Bertrand
Y, Benoit Y, Margueritte G, et al. Results of 58872 and
58921 trials in acute myelobalstic leukemia and relative value of chemotherapy vs allogenic bone marrow transplantation in first complete remissione: the
EORTC Children leukemia Group report. Leukemia.
2005; 19: 2072-81.
Perel Y, Auvrignon A, Leblanc T, Vannier JP, Michel
G, Nelken B, et al. Impact of addition of maintenance therapy to intensive induction and consolidation
chemotherapy for childhood acute myeloblastic leukemia: results of a prospective randomized trial, LAME
89/91. Leucamie Aique Myeloide Enfant. J Clin Oncol.
2002; 20: 2774-82.
Lie SO AJ, Cluasen N, Forestier E, Hasle H, Hovi L
et al. Treatment strtification based on initial in vivo
response in acute myeloid leukemia in children with
out Down syndrome: results of NOPHO AML trials.
Br J Haematol. 2003; 122: 217-25.
Becton D, Dahl GV, Ravindranath Y, Chang MN,
Behm FG, Raimondi SC, et al. Randomized use of
cyclosporin A (CsA) to modulate P-glycoprotein in
children with AML in remission: Pediatric Oncology
Group Study 9421. Blood. 2006; 107: 1315-24.
Dluzniewska A BW, Amata J, Balcerska A, Chybicka
A, Kowalczyk J, et al. Twenty years of polish experience with three consecutive protocols for treatment
of childhood acute myelogeneous leukemia.
Leukemia. 2005; 19: 2117-24.
Rubnitz JE, Crews KR, Pounds S, Yang S, Campana
D, Gandhi VV, et al. Combination of cladribine and
cytarabine is effective for childhood acute myeloid leukemia: results of the St Jude AML97 trial. Leukemia.
2009; 23: 1410-6.
Tomizawa D TK, Kinoshita A, Hanada R, Kigasawa
H, Tsukimoto I et al. Repetitive cycles of high-dose
cytarabine are effective for childhood acute myeloid
leukemia: long-term outcome of the children with AML
treated on two consecutive trials of Tokyo children’s
cancer study group. Pediatric Blood Cancer. 2007; 49:
127-32.
95