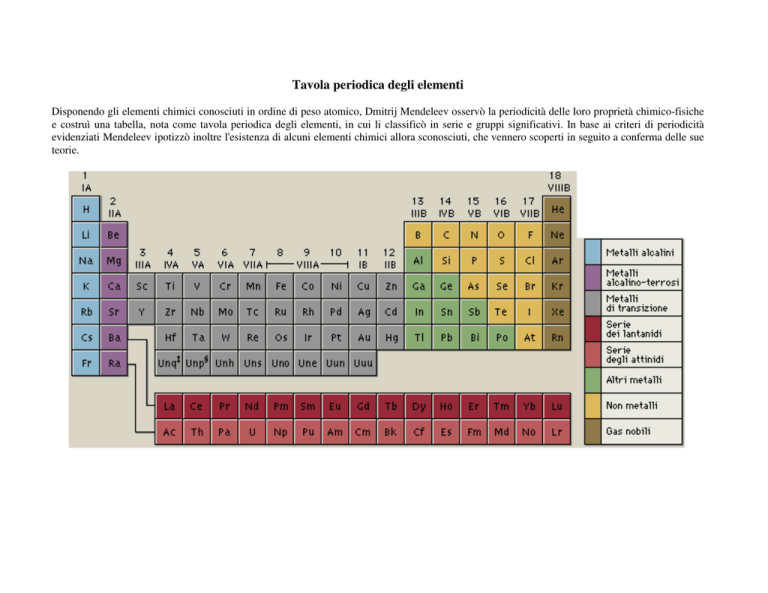
Tavola periodica degli elementi
Disponendo gli elementi chimici conosciuti in ordine di peso atomico, Dmitrij Mendeleev osservò la periodicità delle loro proprietà chimico-fisiche
e costruì una tabella, nota come tavola periodica degli elementi, in cui li classificò in serie e gruppi significativi. In base ai criteri di periodicità
evidenziati Mendeleev ipotizzò inoltre l'esistenza di alcuni elementi chimici allora sconosciuti, che vennero scoperti in seguito a conferma delle sue
teorie.
ALLUMINIO
Elemento metallico di simbolo Al e numero atomico 13, appartenente al gruppo IIIB (o 13) della
tavola periodica. L'elemento fu isolato per la prima volta nel 1825 dal chimico danese Oersted.
Nel corso dei vent'anni successivi le ricerche condotte dal chimico tedesco Wöhler, permisero di
misurarne la densità relativa, ponendo in evidenza la particolare leggerezza del metallo. Nel 1854
il francese Deville, ottenne alluminio riducendo cloruro di alluminio con sodio.
PROPRIETÀ
L'alluminio è un metallo leggero e argenteo, di peso atomico 26,9815; fonde a 660 C, bolle a
2467 C e ha densità relativa 2,7. Dal punto di vista chimico è estremamente reattivo, possiede
elevata elettropositività ed è quindi un forte agente riducente. A contatto con l'aria, si ricopre
rapidamente di un velo di ossido trasparente e molto resistente, che protegge la superficie
dall'effetto di agenti corrosivi e dalla formazione di ruggine. Riduce vari composti metallici allo
stato fondamentale, e questa proprietà è sfruttata in alcuni processi industriali tra i quali, ad
esempio, il processo Thermit per la saldatura del ferro: riscaldando la termite, una miscela di
ossido di ferro e alluminio in polvere, l'alluminio rimuove rapidamente l'ossigeno dal ferro e
quest'ultimo fonde per effetto del calore sviluppato dalla reazione.
Tra i più importanti composti dell'alluminio sono da citare l'ossido, noto come allumina,
l'idrossido, un precipitato bianco che manifesta proprietà anfotere (cioè si comporta sia come gli
acidi, sia come le basi), il solfato, detto anche allume, e alcune miscele di composti di zolfo.
Molte gemme, quali ad esempio il rubino e lo zaffiro, sono costituite principalmente da ossido di
alluminio allo stato cristallino. Il cloruro anidro, infine, è utilizzato nell'industria petrolchimica.
DIFFUSIONE
L'alluminio è il più abbondante costituente metallico delle rocce terrestri; si ritrova generalmente
come silicato, sia solo sia mescolato con altri metalli come il sodio, il potassio, il ferro, il calcio e
il magnesio, ma mai allo stato libero. Il processo di estrazione dai silicati è tuttavia complesso ed
estremamente costoso, pertanto la bauxite, un ossido di alluminio idrato e impuro, rappresenta la
più importante fonte commerciale del metallo e dei suoi composti.
Nel 1886 lo statunitense Hall e il francese Héroult scoprirono, indipendentemente l'uno dall'altro,
che l'ossido di alluminio, o allumina, si scioglie facilmente nella criolite fusa (Na3AlF6) e può
quindi essere decomposto per via elettrolitica nel metallo grezzo fuso. Il processo Hall-Héroult
costituisce tuttora il metodo principale usato per la produzione di alluminio, sebbene nuovi metodi
siano ancora oggetto di ricerca. La purezza del prodotto è stata incrementata fino a ottenere
alluminio puro al 99,5%; il metallo può essere poi ulteriormente raffinato fino al 99,99%.
USI
L'alluminio è un metallo particolarmente leggero, di costo modesto, duttile e malleabile, e con
buone caratteristiche di resistenza alla corrosione. Per questo motivo è utilizzato nell'industria
meccanica, aeronautica, e automobilistica, per la fabbricazione di parti di aerei, di vagoni
ferroviari e di veicoli a motore. Inoltre presenta notevole resistenza alla corrosione per effetto
dell'acqua salata e trova quindi impiego anche nell'industria navale, per la produzione di scafi per
le barche e altri mezzi acquatici. L'elevata conducibilità termica rende l'alluminio un materiale
adatto alla fabbricazione di utensili da cucina, e ne permette l'impiego nei motori a combustione
interna. Caratterizzato da buona conducibilità elettrica, esso viene spesso utilizzato in sostituzione
del rame nella trasmissione di elevati voltaggi a lunghe distanze. Conduttori in alluminio,
estremamente leggeri, sono oggi usati per trasmettere tensioni di oltre 700.000 volt.
L'alluminio sta diventando sempre più importante anche dal punto di vista architettonico, sia per
scopi industriali sia ornamentali. Intelaiature di alluminio, finestre e fogli sono eccellenti isolanti.
Il metallo viene utilizzato nei reattori nucleari a bassa temperatura perché, nonostante i limiti di
impiego dovuti al basso punto di fusione, presenta capacità di assorbire neutroni. Inoltre acquista
maggiore resistenza, pur mantenendo la medesima durezza in seguito a raffreddamento, e per
questo motivo è usato negli impianti criogenici. Fogli di alluminio spessi 0,018 cm, ormai diffusi
in tutte le case, vengono utilizzati per conservare cibo e altre sostanze. Grazie alla leggerezza, alla
facilità di plasmatura e alla compatibilità con cibi e bevande, l'alluminio viene largamente
impiegato nella fabbricazione di contenitori, imballaggi e lattine. Il riciclaggio di questi
contenitori è estremamente importante per la conservazione delle risorse. Importante è pure l'uso
di alluminio sotto forma di leghe che presentano migliori caratteristiche meccaniche rispetto al
metallo puro. Leghe particolari vengono usate per le corazze dei carri armati e di altri mezzi di
trasporto militari.
PRODUZIONE
La produzione mondiale di alluminio per usi industriali è cresciuta sensibilmente nel corso degli
ultimi anni. Nel 1886 era inferiore a 45 kg; cent'anni dopo, nel 1989, raggiungeva 18 milioni di
tonnellate. Le ricerche mirate allo sviluppo di metodi di estrazione dai silicati potrebbero
comunque determinare una crescita ulteriore della produzione e un aumento dei possibili impieghi
commerciali e industriali del metallo.
ARGENTO
Elemento metallico bianco e lucente di simbolo Ag e numero atomico 47, appartenente agli
elementi di transizione della tavola periodica. Noto fin dall'antichità, era utilizzato da alcuni
popoli per la fabbricazione di oggetti ornamentali e di monete. Gli alchimisti chiamarono l'argento
Luna o Diana, in onore della dea della Luna, e gli attribuirono il simbolo della Luna crescente.
PROPRIETÀ
L'argento è un ottimo conduttore di elettricità e, fatta eccezione per l'oro, è più duttile e malleabile
di qualsiasi altro metallo. Ha durezza compresa tra 2,5 e 2,7, ed è quindi più duro dell'oro, ma più
tenero del rame. Fonde a circa 962 °C, bolle a circa 2212 °C, ha densità relativa 10,5 e peso
atomico 107,868.
Per quanto riguarda il comportamento chimico, l'argento presenta scarsa reattività; è insolubile
negli acidi diluiti e nelle basi, ma si scioglie facilmente in acido nitrico o solforico concentrati; a
temperatura ambiente non reagisce con l'ossigeno e con l'acqua. Non si ossida se esposto all'aria
ma viene facilmente attaccato dallo zolfo e dai solfuri presenti in piccole quantità nell'atmosfera;
il caratteristico annerimento è dovuto alla formazione di solfuro di argento sulla superficie del
metallo. Il solfuro di argento nero (AG2S) è uno dei sali meno solubili in soluzione acquosa e
questa proprietà viene sfruttata per separare gli ioni argento da altri ioni positivi.
DIFFUSIONE
L'argento è relativamente abbondante in natura ma si trova spesso combinato con altri elementi e
quasi mai allo stato puro: i giacimenti più ricchi sono in Perù e in Norvegia, dove le miniere
vengono sfruttate da secoli. Si trova spesso insieme all'oro e può essere recuperato in quantità
considerevoli durante l'estrazione e lavorazione di questo metallo. Combinato con altri elementi,
in particolare con lo zolfo, è presente in varie rocce e in numerosi minerali. Tra i più importanti
minerali di argento possono essere citati la cerargirite (detta anche argento cloruro o più spesso
luna cornea), la pirargirite, la silvanite e l'argentite. Il metallo può inoltre essere ottenuto come
sottoprodotto della lavorazione di minerali di piombo, di rame e di zinco. Quasi tutto l'argento
prodotto in Europa deriva dalla lavorazione del solfuro di piombo, o galena, tuttavia la maggior
parte dell'argento viene estratta in Messico, Perù, Canada, Stati Uniti e Australia.
METALLURGIA
Nel processo di estrazione, i minerali d'argento vengono portati ad alte temperature in opportune
fornaci in modo da trasformare i solfuri in solfati; da questi composti l'argento metallico viene
prelevato per precipitazione chimica. Numerosi processi metallurgici vengono utilizzati per
estrarre l'argento dai minerali argentiferi del piombo, dello zinco e del rame. Nel processo di
amalgamazione, ad esempio, ai minerali triturati viene aggiunto un piccolo quantitativo di
mercurio liquido, che forma con l'argento un particolare tipo di amalgama; questo materiale viene
separato dai residui quindi distillato in modo da fornire, al termine del processo, argento puro. Nei
metodi di lisciviazione, l'argento viene sciolto in una soluzione di un sale (di solito cianuro di
sodio), quindi viene fatto precipitare portando la soluzione in contatto con zinco o alluminio
metallici. Per ciò che riguarda il processo Parker, utilizzato per separare l'argento dal rame, vedi la
voce piombo. L'argento impuro prodotto per via metallurgica viene raffinato per mezzo di metodi
elettrolitici oppure per coppellazione, un processo mediante il quale le eventuali impurezze
vengono rimosse per vaporizzazione o assorbimento.
USI
Molto noto è l'uso dell'argento in gioielleria, nella produzione di stoviglie, di vasellame, e nel
conio di monete. L'argento più pregiato, utilizzato in generale per l'argenteria, è costituito al
92,5% da metallo puro e dal 7,5% da rame. Per le applicazioni nel settore industriale vengono
invece utilizzate più spesso leghe di argento che presentano buone proprietà meccaniche di
durezza e resistenza all'usura. L'argento trovava vasti impieghi nella produzione di specchi o nella
fabbricazione di coperture per lastre di vetro, ma in questi campi è ormai stato quasi
completamente sostituito dall'alluminio. Attualmente grandi quantità del metallo vengono
utilizzate nella produzione di componenti elettronici o di circuiti elettrici. Inoltre, soluzioni diluite
di nitrato di argento (AgNO3) e di altri composti insolubili, come il potassio, vengono usate in
medicina come antisettici e battericidi. I sali di alogenuri di argento, cioè bromuro, cloruro e
ioduro di argento, che si scuriscono se esposti alla luce, vengono utilizzati nella preparazione delle
emulsioni per le pellicole fotografiche. Questi sali sono solubili in sodio trisolfato, che è il
composto normalmente usato nel processo di fissaggio fotografico.
BERILLIO
Elemento metallico, grigio, fragile, di simbolo Be e numero atomico 4. Fu scoperto nel 1798 dal
chimico francese Vauquelin e isolato nel 1828 da Wöhler, e indipendentemente da Bussy.
Inizialmente chiamato glucino, con allusione al suo sapore dolciastro, prese poi nome dal suo
principale minerale, il berillo, un silicato di alluminio e berillio.
Il berillio, che appartiene ai metalli alcalino-terrosi, è piuttosto raro sulla superficie terrestre. Ha
peso atomico 9,012, fonde a circa 1277°C, bolle a 2970°C, e ha densità relativa 1,85. Esposto
all'aria, si ricopre di uno strato molto sottile di ossido che conferisce all'elemento la caratteristica
di graffiare i metalli. I suoi composti sono generalmente bianchi, ma incolori in soluzione, e
mostrano dal punto di vista chimico proprietà simili a quelle dei composti dell'alluminio,
elemento dal quale è quindi difficilmente separabile.
Le leghe contenenti berillio sono estremamente leggere, hanno buone proprietà termiche,
meccaniche e di resistenza alla corrosione: per questo motivo vengono impiegate nella tecnologia
spaziale e nella fabbricazione di parti di aerei supersonici; per alcuni usi sono invece sfruttate le
proprietà elettriche del materiale.
Essendo trasparente ai raggi X, il berillio trova impiego nei tubi a raggi X; inoltre la naturale
tendenza a rallentare e catturare neutroni lo rende eccellente come moderatore nei reattori nucleari
per la produzione di energia nucleare.
Sebbene i prodotti del berillio siano assolutamente innocui, i vapori e le polveri rilasciati durante
la produzione sono estremamente tossici ed è necessaria molta attenzione per evitare di respirarne
anche piccolissime quantità: le persone che lavorano a contatto con gli ossidi di berillio usano
infatti particolari dispositivi di protezione. Il berillio è utilizzato nella fabbricazione di strumenti e
apparecchi come computer, laser e televisori.
CALCIO
Elemento metallico argenteo, estremamente reattivo, di simbolo Ca e numero atomico 20;
appartiene al gruppo 2 (o IIA) della tavola periodica ed è pertanto tra i metalli alcalino-terrosi. Fu
isolato nel 1808 dal chimico britannico Davy per mezzo di metodi elettrolitici.
PROPRIETÀ E DIFFUSIONE
Il calcio ha sei isotopi stabili e molti isotopi radioattivi. È duttile, malleabile, e ingiallisce
rapidamente se esposto all'aria. Fonde a 830 °C, bolle a 1480 °C , ha densità relativa 1,54 e peso
atomico 40,08.
Piuttosto comune sulla superficie terrestre, si trova sempre combinato con altri elementi. È
presente in molti composti di importanza industriale e commerciale, come il carbonato di calcio
(CaCO3), che costituisce la calcite, il marmo e il calcare; il solfato di calcio (CaSO4) che si trova
nell'alabastro e nel gesso; il fluoruro di calcio (CaF2) presente nella fluorite; il fosfato di calcio
(Ca3(PO4)2) che si trova nei fosfati delle rocce e in molti silicati. A temperature relativamente
basse e in aria secca, il calcio non viene attaccato dall'ossigeno, ma se scaldato reagisce
vigorosamente con gli alogeni, l'ossigeno, lo zolfo, il fosforo, l'idrogeno e l'azoto. Reagisce
violentemente anche con l'acqua, formando l'idrossido Ca(OH)2 e liberando idrogeno.
USI
Il metallo si ottiene principalmente per elettrolisi del cloruro di calcio fuso, ma il processo è
piuttosto costoso. In passato poco usato nell'industria, trova ora ampio impiego come deossidante
per rame, nickel e acciaio. Inoltre le leghe piombo-calcio, con caratteristiche migliori rispetto alle
leghe di piombo e antimonio, sono utilizzate per realizzare i cuscinetti a sfera, nella fabbricazione
delle batterie e come coperture per i cavi di piombo. Il calcio è presente allo stato combinato nella
calce (idrossido di calcio), nel cemento e nella malta (come idrossido di calcio o come silicato). È
inoltre un importante costituente dei denti e delle ossa (come idrossofosfato di calcio), e si trova
in molti fluidi corporei.
CARBONIO
Elemento chimico di simbolo C e numero atomico 6, appartenente al gruppo IVB (o 14) della
tavola periodica. È il costituente fondamentale di tutti i composti organici, biologici e non, e
riveste quindi un ruolo molto importante nella vita degli organismi viventi.
PROPRIETÀ
Il carbonio ha peso atomico 12,01115 ed esiste in natura in tre forme caratterizzate da diversa
struttura cristallina: il diamante, in cui ogni atomo è legato ad altri quattro atomi formando un
reticolo con struttura tetraedrica; la grafite, in cui gli atomi sono disposti in modo da formare degli
esagoni affiancati su piani orizzontali; e il carbonio amorfo, caratterizzato da un basso grado di
cristallinità. Queste forme, che si differenziano in molte proprietà fisiche, hanno punti di fusione
estremamente alti e, a temperatura ambiente, sono insolubili in tutti i solventi.
Una quarta forma di carbonio naturale è costituita da una intera classe di fullereni, il più famoso
dei quali è il buckminsterfullerene.
Il carbonio ha la proprietà unica di combinarsi con se stesso per formare catene di atomi e anelli
estremamente complessi. Per questo motivo esiste un numero idealmente infinito di suoi
composti, tra cui i più comuni sono quelli che contengono carbonio e idrogeno. I primi composti
di carbonio furono identificati in organismi viventi all'inizio del XIX secolo, e da allora lo studio
del carbonio costituisce l'importante ramo della chimica noto come chimica organica.
Il carbonio è poco reattivo a temperatura ambiente, ma a temperature elevate reagisce facilmente
con molti metalli per formare i carburi, e con l'ossigeno per formare il monossido di carbonio
(CO) e il diossido di carbonio, noto anche come anidride carbonica (CO2). Forma inoltre composti
con la maggior parte degli elementi non metallici, sebbene alcuni di questi composti, ad esempio
il tetracloruro di carbonio (CCl4) debbano essere prodotti indirettamente. Il coke, una forma di
carbonio amorfo, è usato per rimuovere l'ossigeno dai minerali formati da ossidi metallici per
ottenere il metallo puro.
DIFFUSIONE
Sebbene rappresenti solo lo 0,025% della crosta terrestre, il carbonio è piuttosto diffuso in natura,
in particolare sotto forma di carbonati. Il diossido di carbonio è un importante costituente
dell'atmosfera ed è la fonte di carbonio più importante per gli organismi viventi. Nel processo di
fotosintesi, le piante trasformano diossido di carbonio in composti organici complessi, che
vengono successivamente utilizzati da altri organismi.
Allo stato amorfo il carbonio si trova, in vari gradi di purezza, nel carbone, nel coke, nel nero di
gas e nel nerofumo. Il nero di gas è prodotto bruciando idrocarburi liquidi come il kerosene in
difetto d'aria, e raccogliendo il fumo in una camera separata; per lungo tempo è stato usato come
pigmento nero negli inchiostri e nelle vernici, ma attualmente è stato sostituito dal nerofumo,
composto da particelle più sottili e ottenuto dalla combustione incompleta del gas naturale. Il
nerofumo è utilizzato come stucco e come rinforzante nell'industria della gomma.
APPLICAZIONI SCIENTIFICHE
Oltre alle numerose applicazioni industriali, il carbonio ha importanza anche nel settore
scientifico. Nel 1961 l'isotopo più comune, il carbonio-12, fu scelto per sostituire l'ossigeno-16
come standard per i pesi atomici.
Gli isotopi di peso atomico 13 e 14 sono largamente usati come traccianti isotopici nella ricerca
biochimica. Il carbonio-14, noto anche come radiocarbonio, è un isotopo radioattivo che viene
prodotto in continuazione nell'atmosfera per cattura dei neutroni della radiazione cosmica da parte
dei nuclei di azoto; è incorporato in tutti gli organismi viventi e quando questi muoiono, il
contenuto di carbonio-14 decresce, con tempo di dimezzamento di circa 5760 anni. L'analisi del
rapporto tra carbonio-12 e 14 presente in un organismo rappresenta la base del cosiddetto metodo
di datazione al radiocarbonio, che permette la stima dell'età dei fossili e di altri materiali organici.
COBALTO
Elemento metallico di colore bianco-argenteo, con spiccate proprietà magnetiche, di simbolo Co e
numero atomico 27; appartiene agli elementi di transizione della tavola periodica.
Fu scoperto nel 1735 dal chimico svedese Brandt. A temperatura ambiente è un metallo poco
resistente e scarsamente duttile, ma la duttilità aumenta a temperature elevate. Fonde a circa 1495
°C, bolle a circa 2870 °C, ha densità relativa 8,9 e peso atomico 58,933. Tra i numerosi isotopi
conosciuti, il più importante è il cobalto 60, un isotopo radioattivo, che decade con emissione di
raggi gamma, e ha tempo di dimezzamento di circa 5,7 anni. Esso trova applicazioni in vari settori
dell'industria ed è usato nelle terapie mediche radioisotopiche, in particolare per la cura dei
tumori.
Il cobalto è piuttosto raro nella crosta terrestre; si trova sotto forma di arseniuro, CoAs2, con il
nome di smaltite; di solfoarseniuro (CoAsS), detto cobalto grigio o cobaltite; di arseniato di
cobalto idrato (Co(AsO4)2 · 8H2O), noto come eritrite o fior di cobalto. Viene estratto
principalmente da minerali di cobaltite o dai residui, chiamati "speiss", ottenuti dalla fusione di
arseniuri di nichel, rame e piombo. Il Canada e gli stati centroafricani della Repubblica
democratica del Congo e dello Zambia ne sono i tre maggiori produttori.
La più importante applicazione del cobalto è nella fabbricazione di leghe particolarmente
resistenti al calore (chiamate superleghe), che vengono usate nel settore industriale e nella
produzione di motori per aerei. Una lega con l'acciaio, nota come acciaio al cobalto, è usata per
realizzare magneti permanenti. Il carboloy, una lega di cobalto e carburo di tungsteno, e la stellite,
una lega con il cromo, sono materiali caratterizzati da elevata durezza impiegati per tagliare e
ridurre in fogli sottili l'acciaio. Il cobalto è anche usato come pigmento per ceramica, come
essiccativo per vernici e come catalizzatore.
CROMO
Elemento di transizione della tavola periodica di simbolo Cr e numero atomico 24.
PROPRIETÀ E FONTI
Il cromo puro è di colore grigio lucente, ha densità relativa 7,19 e peso atomico 51,996; fonde a
1875 °C e bolle a 2672 °C. È stato scoperto nel 1797 dal chimico francese Louis-Nicolas
Vauquelin, che gli attribuì il nome cromo (dal greco chroma, "colore") alludendo alla grande
varietà di colori assunti dai suoi composti.
Il cromo può sostituire l'alluminio o il ferro in molti minerali, conferendo loro particolari
colorazioni, come si verifica nel caso di diverse gemme. È presente in natura nella crosta terrestre
e, in piccole quantità, in organismi vegetali e animali. Pochi minerali del cromo sono sfruttabili;
tra questi il più importante è la cromite, di formula FeCr2O4. Nei suoi composti il cromo manifesta
principalmente numeri di ossidazione +2, +3 e +6. L'ossido, di formula Cr2O3, è impiegato come
pigmento verde mentre il dicromato di potassio K2Cr2O7, è un solido rosso-arancio solubile in
acqua che, mescolato con la gelatina, permette di ottenere superfici fotosensibili usate nei processi
fotografici. I cromati sono solitamente gialli; il più noto è il cromato di piombo (PbCrO4), un
solido insolubile usato come pigmento sia puro (giallo cromo) che in miscela con il blu di Prussia.
USI
In campo metallurgico il cromo viene usato come componente di molte leghe di ferro, nichel o
cobalto alle quali conferisce elevata durezza; negli acciai inossidabili, ad esempio, è presente in
concentrazione del 10%. Nell'industria automobilistica è impiegato nella produzione di superfici
cromate dure, resistenti alla corrosione ed estremamente lucide. L'alto punto di fusione, il ridotto
coefficiente di espansione termica e l'elevata stabilità strutturale consentono inoltre un largo
utilizzo della cromite come materiale refrattario. È pure importante l'uso dei composti del cromo
in conceria e in tintoria, in particolare nella produzione di pigmenti.
FERRO
Elemento di transizione della tavola periodica di simbolo Fe e numero atomico 26.
A causa della sua duttilità, era utilizzato sia a scopo decorativo sia nella produzione di armi e
utensili già in età preistorica; il più antico reperto rinvenuto, un gruppo di grani di ferro ossidato
trovati in Egitto, risale infatti al 4000 a.C. Durante l'età del Ferro, nel I millennio a.C., le tecniche
di lavorazione divennero sempre più raffinate e questo metallo sostituì quasi completamente il
bronzo, segnando l'inizio della moderna metallurgia.
PROPRIETÀ
Il ferro puro ha durezza compresa tra 4 e 5, è di colore argenteo, duttile e malleabile. A
temperatura ambiente e, in generale a temperature inferiori a 768 °C, esso si magnetizza in
presenza di campi magnetici anche poco intensi, manifestando caratteristiche ferromagnetiche.
Fonde a 1536 °C, bolle a 3000 °C, ha densità relativa 7,86 e peso atomico 55,847.
Il metallo esiste in tre forme allotropiche, diverse per la disposizione degli atomi nel reticolo
cristallino: ferro a (stabile a temperature inferiori di 906 °C), ferro g (stabile tra 906 °C e 1401 °C)
e ferro d (stabile a temperature superiori a 1401 °C). Le differenti proprietà fisiche e chimiche
delle tre forme giocano un importante ruolo nella metallurgia di questo materiale.
Il ferro è un elemento reattivo: reagisce con gli alogeni (fluoro, cloro, bromo, iodio e astato), con
lo zolfo, il fosforo, il carbonio e il silicio; brucia in atmosfera di ossigeno formando il tetrossido di
triferro (ossido ferroso ferrico) Fe3O4. Se esposto all'aria umida, esso si corrode e si ricopre di un
ossido ferrico idrato rosso-bruno, comunemente detto ruggine, la cui formazione è dovuta a un
processo elettrochimico: in presenza di acqua, che fornisce il mezzo elettrolitico, si stabilisce una
debole corrente per cui il ferro metallico si decompone e si trasforma in ruggine reagendo con
l'ossigeno atmosferico. La reazione è accelerata dalla presenza di ruggine depositata in precedenza
sulla superficie.
A contatto con molti acidi diluiti, il ferro passa in soluzione liberando idrogeno; non reagisce,
invece, con l'acido nitrico concentrato, a causa dell'insorgere di un fenomeno detto passività: il
metallo si ricopre di uno strato di ossido che lo protegge dall'attacco degli acidi.
FONTI
Il ferro è il quarto elemento, in ordine di abbondanza, sulla superficie terrestre, dopo ossigeno,
silicio e alluminio; i suoi composti sono molto diffusi e, in lega con il nichel, è il costituente
principale di alcuni meteoriti e del nucleo centrale della Terra. A causa della elevata reattività con
l'ossigeno si rinviene allo stato elementare o nativo solo in piccole quantità e in poche regioni, tra
le quali la Groenlandia e l'Irlanda. Solo alcuni minerali del ferro costituiscono giacimenti
sfruttabili industrialmente: l'ematite, la goethite, la magnetite, la siderite e la limonite. La pirite è
utilizzata prevalentemente nella produzione dell'acido solforico. Piccole quantità di composti di
ferro sono presenti nelle acque, nelle piante e in quasi tutti gli alimenti; esso è inoltre un
componente essenziale negli organismi animali perché presente nella molecola dell'emoglobina.
USI E PRODUZIONE
Le caratteristiche fisiche e chimiche del ferro possono essere sensibilmente migliorate mediante
aggiunta di atomi di carbonio e di altri elementi in lega; queste procedure, utili anche per
eliminare le impurità invariabilmente presenti nel ferro commerciale, sono impiegate nella
produzione di ghisa e acciaio, che costituiscono le principali applicazioni industriali di questo
metallo. Allo stato puro, preparato per elettrolisi di soluzioni di solfato ferroso, ha uso limitato
alla produzione di lamiera zincata e di elettromagneti.
Composti di ferro sono contenuti in medicinali usati come tonici e nel trattamento dell'anemia,
quando la quantità di emoglobina o il numero di globuli rossi nel sangue sono inferiori alla norma.
COMPOSTI
Il ferro forma composti in cui presenta stato di ossidazione +2 (composti ferrosi) e +3 (composti
ferrici). Il più importante composto del ferro bivalente è il solfato FeSO4, detto anche vetriolo
verde, un sale verde chiaro che cristallizza con sette molecole di acqua di idratazione. Si ottiene in
grandi quantità come sottoprodotto del decapaggio del ferro e viene usato come mordente in
tintoria, come tonico in medicina e nell'industria degli inchiostri e dei pigmenti.
L'ossido di ferro (III), una polvere amorfa rosso-bruna, si ottiene dal trattamento dei sali di ferro
(III) con una base o dall'ossidazione della pirite. Viene usato quale pigmento (rosso ferro o rosso
veneziano), come polvere abrasiva lucidante e come mezzo magnetizzabile nei nastri e nei dischi
magnetici. Il cloruro di ferro (III), un composto cristallino verde scuro che si ottiene per
riscaldamento del ferro con il cloro, viene usato in medicina in soluzione alcolica con il nome di
tintura di ferro.
Gli ioni ferro (II) e ferro (III) formano con lo ione cianuro dei complessi molto stabili.
L'esacianoferrato (II) di ferro (III) (ferrocianuro ferrico) Fe4[Fe(CN)6]3, un solido amorfo blu scuro
formato dalla reazione dell'esacianoferrato (II) di potassio con un sale di ferro (III), è noto con il
nome di blu di Prussia e viene usato come pigmento e come azzurrante per correggere
l'ingiallimento dei tessuti dovuto alle tracce di sali ferrosi presenti nell'acqua. L'esacianoferrato
(III) di potassio (ferricianuro di potassio o prussiato rosso) K3[Fe(CN)6] viene usato nella
produzione della carta per cianografia mentre l'esacianoferrato (III) di potasssio e ferro (II)
KFe[Fe(CN)6] è un pigmento noto con il nome di azzurro di Turnbull. Le reazioni fisico-chimiche
tra il ferro e il carbonio sono alla base del processo di formazione delle ghise e degli acciai.
MAGNESIO
Elemento metallico bianco-argenteo, poco reattivo, di simbolo Mg e numero atomico 12;
appartiene al gruppo IIA (o 2) della tavola periodica, ed è quindi tra i metalli alcalino-terrosi.
PROPRIETÀ E DIFFUSIONE
Il metallo, isolato per la prima volta dal chimico britannico Davy nel 1808, è ottenuto
principalmente dall'elettrolisi del cloruro fuso. È malleabile e duttile se viene scaldato; a
temperatura ambiente non viene attaccato dall'ossigeno, dall'acqua o dagli alcali, ma reagisce
facilmente con gli acidi. Se scaldato a 800 °C, reagisce con l'ossigeno ed emette una luce brillante.
Fonde a 650 °C, bolle a circa 1107 °C, ha densità relativa 1,74 e peso atomico 24,312.
Relativamente abbondante sulla crosta terrestre, si trova in natura combinato ad altri elementi, in
particolare nei minerali carnallite, dolomite e magnesite; in molti silicati nelle rocce; come sale,
ad esempio cloruro di magnesio, negli oceani e nei laghi salati. È uno dei principali costituenti dei
tessuti delle piante e degli animali.
USI
Il magnesio forma composti bivalenti, fra i quali il carbonato di magnesio (MgCO3), che si
produce per reazione fra un sale di magnesio e il carbonato di sodio e viene usato come materiale
refrattario e isolante; il cloruro di magnesio (MgCl2·6H2O), preparato facendo reagire carbonato o
ossido di magnesio con acido cloridrico e impiegato nei tessuti di lana e cotone, nell'industria
della carta, nella produzione di cemento e ceramiche; il citrato di magnesio (Mg3(C6H5O7)2·4H2O),
ottenuto per reazione fra carbonato di magnesio e acido citrico e utilizzato nella produzione di
medicinali o bevande effervescenti; l'idrossido di magnesio (Mg(OH)2), formato dalla reazione fra
sali di magnesio e idrossido di sodio, usato in medicina come lassativo ("latte di magnesia") e
nella raffinazione dello zucchero; il solfato di magnesio (MgSO4·7H2O), meglio conosciuto come
sale di Epsom; l'ossido di magnesio (MgO), detto magnesia, preparato bruciando il magnesio in
corrente di ossigeno o riscaldando il carbonato di magnesio, usato come materiale refrattario e
isolante, nell'industria dei cosmetici e della carta e come lassativo debole e antiacido.
Le leghe di magnesio e rame, o alluminio, estremamente leggere ma caratterizzate da elevata
resistenza a trazione, sono utilizzate per fabbricare parti di aeroplani, arti artificiali, strumenti
ottici e sci. Il metallo puro è usato nelle polveri per i flash fotografici, nelle bombe incendiarie, nei
razzi di segnalazione e come deossidante nella fusione dei metalli.
MANGANESE
Elemento di transizione della tavola periodica di simbolo Mn e numero atomico 25. È un metallo
di colore bianco argenteo usato principalmente nella produzione di leghe.
PROPRIETÀ E FONTI
Il manganese fu scoperto nel 1774 dal chimico svedese Karl Wilhelm Scheele e isolato nello
stesso anno da Johan Gottlieb Gahn. Se esposto all'aria si ossida in superficie, in aria umida
arrugginisce, e viene facilmente sciolto dagli acidi diluiti. Fonde a 1245 °C, bolle a circa 2150 °C,
ha densità relativa 7,2 e peso atomico 54,94.
Il manganese puro si ottiene per combustione della pirolusite (diossido di manganese) con polvere
di alluminio o per elettrolisi del solfato. Non si rinviene allo stato elementare, tranne che nelle
meteoriti, ma è contenuto in diversi minerali, come la pirolusite che rappresenta la principale
fonte di questo metallo, la rodocrosite (carbonato di manganese), la manganite e la franklinite.
USI
Il manganese trova impiego come componente di leghe ferrose, ottenute trattando la pirolusite in
altoforno con minerali di ferro e carbone. Aggiunto in piccole quantità all'acciaio serve come
disossidante; in maggiori quantità conferisce a questo materiale durezza, resistenza all'usura e al
calore. Le casseforti ad esempio sono costruite con acciaio contenente circa il 12% di manganese
(acciaio Hadfield). Tra le leghe non ferrose sono importanti il bronzo di manganese (composto da
manganese, rame, stagno e zinco), che resiste alla corrosione dell'acqua marina e viene usato nelle
eliche delle imbarcazioni, e la manganina (contenente manganese, rame e nichel), impiegata nella
costruzione di strumenti di misura molto accurati poiché la sua conduttività elettrica non varia
apprezzabilmente con la temperatura. Il manganese forma composti in cui presenta numero
d'ossidazione +2, +3, +4, +6 e +7. Il diossido di manganese MnO2, sintetizzato per
decomposizione termica del nitrato Mn(NO3)2, è sfruttato come depolarizzante nelle pile a secco,
come colorante per vetro e ceramica, e come ossidante nella preparazione del cloro e dello iodio.
Il solfato di manganese (II) MnSO4, un solido cristallino rosa ottenuto per trattamento del diossido
con acido solforico, trova impiego nella tintura del cotone. Il permanganato di potassio KMnO4,
usato come ossidante e disinfettante, è un composto cristallino di colore viola intenso preparato
per ossidazione chimica o elettrochimica di composti del manganese.
MERCURIO
Elemento metallico, di simbolo Hg e numero atomico 80; è uno degli elementi di transizione della
tavola periodica. Un tempo noto come "argento liquido", fu distinto come elemento dal chimico
francese Lavoisier, nel corso delle sue analisi sulla composizione dell'aria.
PROPRIETÀ E DIFFUSIONE
A temperatura ambiente è un liquido splendente, di colore argenteo, leggermente volatile.
Solidifica se sottoposto a pressione di 7640 atmosfere, valore usato come standard nella misura di
altissime pressioni; in condizioni standard di pressione invece solidifica a -39°C, bolle a 357°C;
ha densità relativa 13,5 e peso atomico 200,59. Si scioglie nell'acido nitrico o solforico
concentrato ma è resistente agli alcali. Elemento piuttosto raro in natura, si trova sia in forma pura
sia combinato con argento, ma soprattutto sotto forma di solfuro nel minerale cinabro da cui si
estrae per arrostimento in corrente d'aria e successiva condensazione del gas prodotto.
USI
Poiché ha coefficiente di dilatazione termica praticamente costante, cioè subisce perlopiù la stessa
variazione di volume per ogni grado di temperatura, il mercurio viene usato nella costruzione dei
termometri. È anche utilizzato in altri apparecchi scientifici, come le pompe a vuoto, i barometri e
gli interruttori. Le lampade a vapori di mercurio trovano impiego come fonte di raggi ultravioletti
per uso domestico e per sterilizzare l'acqua; i vapori di mercurio sono inoltre usati nei bollitori di
alcuni motori a reazione. Il mercurio si combina con tutti i metalli più comuni, a eccezione di
ferro e platino, per formare leghe dette amalgama. Un metodo di estrazione dell'oro e dell'argento
si basa sulla loro combinazione con mercurio, che viene poi rimosso mediante distillazione. Il
mercurio forma composti monovalenti e bivalenti, tra i quali importanti sono il solfuro di
mercurio (II), noto antisettico; il cloruro di mercurio (I), o calomelano, usato negli elettrodi; il
cloruro di mercurio (II), estremamente corrosivo; alcuni medicinali, come ad esempio il
mercurocromo.
AVVELENAMENTO DA MERCURIO
Il mercurio è altamente tossico, sia in forma di vapore sia come sale solubile. L'avvelenamento
cronico da mercurio, che insorge quando piccole quantità dei suoi sali liposolubili, in particolare il
metilmercurio, vengono ingerite per lunghi periodi, causa danni irreversibili al cervello, al fegato
e ai reni. Attualmente è posta molta attenzione allo scarico non controllato del metallo
nell'ambiente poiché, a causa dell'aumento dell'inquinamento delle acque, sono state ritrovate
quantità significative di mercurio in alcune specie di pesci.
MOLIBDENO
Elemento metallico di simbolo Mo e numero atomico 42, avente proprietà simili a quelle del
cromo; è uno degli elementi di transizione della tavola periodica. Scoperto nel 1778 dal chimico
svedese Scheele, il molibdeno è un metallo di colore bianco-argenteo, resistente, ma malleabile. Si
scioglie in acido nitrico e in acqua regia; in condizioni normali, non reagisce con l'aria, ma si
incendia a temperature superiori ai 600 °C, formando l'ossido. Fonde a circa 2610 °C, bolle a
5560 °C, ha densità relativa 10,2 e peso atomico 95,94. In natura non si trova allo stato puro, ma
in alcuni minerali, fra i quali i più importanti sono la molibdenite e la wulfenite; è inoltre presente
in tracce nel terreno. Trova applicazione soprattutto come costituente di leghe speciali molto
resistenti, in grado di resistere a temperature e pressioni elevate; si tratta di ottimi materiali
strutturali, utilizzati nella costruzione di parti di aerei e automobili. I fili di molibdeno si usano nei
tubi per la produzione di fasci elettronici, mentre il solfuro trova impiego come lubrificante
solido.
NICHEL
Elemento metallico bianco-argenteo di simbolo Ni e numero atomico 28, appartenente agli
elementi di transizione della tavola periodica. Il nichel venne usato a lungo per produrre le leghe
rame-nichel usate nel conio delle monete, ma non fu riconosciuto come sostanza elementare fino
al 1751, quando il chimico svedese Axel Frederic Cronstedt lo isolò dal minerale niccolite.
PROPRIETÀ
Il nichel è un metallo duro, duttile, malleabile e lucidabile; fonde a 1455 °C, bolle a 2950 °C, ha
densità relativa 8,9 e peso atomico 58,71. A temperature inferiori ai 345 °C presenta spiccate
caratteristiche magnetiche. Esiste in cinque forme isotopiche stabili. Il nichel metallico non è
molto attivo dal punto di vista chimico; è solubile in acido nitrico diluito e si passiva (cioè diventa
non reattivo) in acido nitrico concentrato; non reagisce con gli alcali.
DIFFUSIONE
Il nichel si ritrova in forma elementare soltanto nelle meteoriti ma, combinato con altri elementi, è
piuttosto diffuso sulla crosta terrestre in minerali come la garnierite, la millerite, la niccolite, la
pentlandite e la pirrotite.
I minerali di nichel contengono generalmente delle impurità, in modo particolare di rame. I
minerali solfurici, come la pentlandite e la pirrotite nichelifera, vengono generalmente fusi in un
altoforno e trasportati in forma di lingotti di solfuro di rame e nichel alle raffinerie, dove il nichel
viene estratto per mezzo di vari metodi. Nei processi di raffinazione elettrochimica, il nichel si
ottiene in forma metallica con un elevato grado di purezza, per deposizione del rame impiegando
un voltaggio diverso e una soluzione elettrolitica adeguata. Nel processo Mond, il rame viene
separato per dissoluzione in acido solforico diluito, mentre il residuo di nichel viene ridotto a
nichel metallico impuro. Facendo passare monossido di carbonio sul nichel impuro, si forma il
nichel carbonile (Ni(CO)4), un gas volatile che si decompone se scaldato alla temperatura di
200°C, depositando nichel metallico puro.
USI E PRODUZIONE
Il nichel viene utilizzato per formare rivestimenti protettivi e ornamentali per i metalli, in
particolare per ferro e acciaio, che sono particolarmente sensibili alla corrosione. Lo strato di
nichel è depositato sulla superficie degli oggetti per elettrolisi. Viene usato anche come
catalizzatore in vari processi, tra cui il più importante è l'idrogenazione degli oli.
L'impiego più importante, tuttavia, si ha sotto forma di leghe. L'acciaio al nichel, che contiene dal
2 al 4% del metallo, è usato per fabbricare parti di automobili come i semiassi, l'albero motore, il
cambio, le valvole, macchinari di vario tipo e anche corazze. Alcune delle leghe più importanti
contenenti nichel sono l'argento tedesco, l'Invar, il metallo Monel, il nichel-cromo e il Permalloy.
Le monete usate abitualmente sono di solito realizzate con una lega composta dal 25% di nichel e
dal 75% di rame. Il nichel è inoltre uno dei componenti principali delle batterie al nichel-cadmio.
La maggior parte del nichel viene estratto in Canada, in particolare nella regione del Québec dove
nel 1957 fu scoperto un ricchissimo deposito. Cuba, i paesi dell'ex Unione Sovietica, la Cina e
l'Australia restano comunque importanti produttori.
COMPOSTI
Il nichel forma principalmente composti bivalenti, sebbene esistano esempi di composti con grado
di ossidazione da -1 a +4. La maggior parte dei sali di nichel, come il cloruro (NiCl2), il solfato
(NiSO4) e il nitrato (Ni(NO3)2), sono di colore verde e blu, e si trovano in forma idrata. Il solfato
di nichel ammonio (NiSO4 · (NH4)2SO4 · 6H2O) è usato nelle soluzioni elettrolitiche. I composti di
nichel si identificano aggiungendo un reagente organico, la dimetilglossima, che forma un
precipitato a fiocchi rossi.
ORO
Elemento metallico di simbolo Au e numero atomico 79, appartenente alla famiglia degli elementi
di transizione della tavola periodica.
PROPRIETÀ
L'oro puro ha colore giallo brillante ed è il più duttile e malleabile dei metalli: può essere ridotto
in lastre dello spessore di 0,0001 mm e tirato in fili lunghi e molto sottili (29 g d'oro possono
essere trasformati in un filo lungo 100 km). Ha durezza compresa tra 2,5 e 3 ed è quindi uno dei
metalli più teneri; è un ottimo conduttore di calore e di elettricità. L'oro finemente suddiviso è una
polvere nera, che in sospensione colloidale conferisce alla soluzione un colore variabile tra il
rosso rubino e il porpora. Dal punto di vista chimico è un metallo poco reattivo: non viene
attaccato dall'aria, dall'umidità e dal calore, ma si scioglie in soluzioni contenenti cloruri, bromuri
e alcuni ioduri, in miscele ossidanti, in cianuri alcalini e in acqua regia, una miscela di acido
cloridrico e nitrico. I suoi più importanti composti sono i cloruri e i cianuri. Fonde a 1064 °C,
bolle a 2808 °C, ha densità, relativa 19,3 e peso atomico 196,967.
L'ORO IN NATURA
Pur essendo piuttosto raro in natura, l'oro si trova omogeneamente distribuito sulla crosta terrestre,
in genere nelle rocce quarzifere e nei depositi alluvionali, allo stato nativo o in lega con l'argento.
Insieme al tellurio e all'argento è un costituente di alcuni minerali come la calaverite e la silvanite.
È presente col mercurio nell'amalgama d'oro e in piccole quantità nella pirite; in tracce si ritrova
anche nella galena. È inoltre contenuto nell'acqua marina in concentrazioni comprese tra 5 e 250
parti su 1000 in peso d'acqua. Complessivamente la quantità d'oro nelle acque dei mari è
valutabile attorno ai 9 miliardi di tonnellate, tuttavia i costi delle operazioni di recupero sono
estremamente elevati.
USI
L'oro era conosciuto e apprezzato fin dai tempi antichi, non solo per la bellezza e per la resistenza
alla corrosione, ma anche per la facilità di estrazione e lavorazione rispetto a qualunque altro
metallo. Dall'antichità è usato come moneta e in gioielleria, dapprima allo stato nativo, poi in lega
con altri metalli che gli conferiscono la durezza necessaria; il contenuto in oro di una lega viene
espresso in carati.
L'oro in fogli viene usato per la doratura e per le iscrizioni; la porpora di Cassio, una soluzione
colloidale d'oro finemente diviso e idrossido di stagno, formata per reazione del cloruro d'oro con
il cloruro di stagno, è invece utilizzata per colorare il vetro. L'acido tetracloroaurico trova impiego
in fotografia, mentre il dicianoaurato di potassio è utilizzato per la doratura elettrolitica. L'oro è
usato anche in odontoiatria mentre i suoi radioisotopi sono impiegati nelle ricerche biologiche e
nella diagnosi dei tumori.
ESTRAZIONE DELL'ORO
Per estrarre l'oro dai fiumi si utilizzano draghe dotate di una serie di pale che raschiano il fondo,
riversando il contenuto in un apposito vaglio. Il materiale recuperato è fatto ruotare e lavato con
acqua, in modo che la sabbia aurifera passi attraverso i fori del vaglio e si depositi su tavole
oscillanti. Questo metodo può essere usato anche nei letti asciutti dei fiumi, purché vi sia acqua
nel sottosuolo: viene scavato un pozzo e la draga naviga sull'acqua che viene pompata dal pozzo
nel letto del fiume.
Il processo di estrazione dell'oro dalle rocce si basa sulla formazione di un amalgama con il
mercurio (processo di amalgama), seguita da cianurazione; alcuni minerali, soprattutto quelli
contenenti oro e tellurio, devono essere calcinati.
La forma più rara in cui l'oro può essere rinvenuto è la pepita; la più grande pepita mai trovata, la
Welcome Stranger, di massa 71 kg è stata scoperta casualmente poco sotto la superficie del
terreno a Victoria, in Australia, nel 1869.
PRODUZIONE DELL'ORO
L'oro era usato già al tempo delle antiche popolazioni del Mediterraneo, che lo ricavavano dalle
sabbie alluvionali e dalla ghiaia. Lo stesso metodo veniva usato anche in India, in Asia centrale e
nelle regioni del Mediterraneo occidentale. Con l'evolversi delle tecniche estrattive, già nei primi
anni dell'era cristiana vennero sfruttati i primi filoni auriferi; ulteriori progressi nell'estrazione e
nella produzione dell'oro vennero compiuti a partire dal Medioevo.
Attualmente i principali paesi produttori d'oro sono Sudafrica, Stati Uniti, Russia, Australia,
Canada, Cina e Brasile.
PLATINO
Elemento metallico molto raro, di simbolo Pt e numero atomico 78; appartiene al gruppo 10 (o
VIIIA) della tavola periodica ed è pertanto tra gli elementi di transizione.
È il più importante del gruppo dei platinoidi, che comprende inoltre rutenio, rodio, palladio,
osmio e iridio. Questi elementi venivano usati nelle leghe già ai tempi dell'antica Grecia e dei
romani, ma sono citati nella letteratura europea solo a partire dal XVI secolo. Solo all'inizio del
XIX secolo venne fatta una distinzione tra il platino e gli altri platinoidi.
PROPRIETÀ E FONTI
Il platino è un metallo grigio di durezza 4,3; ha punto di fusione molto alto, è duttile e malleabile,
si dilata poco per riscaldamento ed è caratterizzato da elevata resistenza elettrica. È relativamente
inerte chimicamente e resiste agli attacchi dell'aria, dell'acqua, degli acidi e dei normali reagenti;
si scioglie lentamente in acqua regia formando acido esacloroplatinico (VI) H2PtCl6, è attaccato
dagli alogeni e reagisce per riscaldamento con l'idrossido, il nitrato e il cianuro di sodio. Fonde a
1772 °C, bolle a 3827 °C, ha densità relativa 21,45 e peso atomico 195,08.
In natura il platino si ritrova allo stato nativo, ma è presente anche in alcuni minerali poco diffusi,
tra i quali la sperrylite, la copperite e la braggite. Sono state rinvenute sfere di metallo di massa di
circa 9 kg.
USI
La scarsa reattività chimica e l'alto punto di fusione rendono il platino particolarmente adatto per
la fabbricazione di strumenti di laboratorio come crogiuoli, pinze, imbuti e capsule. Di solito
viene addizionato con piccole quantità di iridio che conferiscono al metallo migliori caratteristiche
di durezza e resistenza. Viene utilizzato anche per realizzare contatti elettrici e negli strumenti per
misure di temperature elevate; finemente suddiviso (spugna o nero di platino), è usato come
catalizzatore nell'industria chimica. Considerevoli quantità di platino trovano inoltre impiego in
gioielleria, spesso in lega con l'oro, e in odontoiatria.
POTASSIO
Elemento metallico, morbido e reattivo, di simbolo K (dal latino kalium, "alcalino"), e numero
atomico 19; appartiene al gruppo IA (o 1) della tavola periodica, ed è pertanto un metallo alcalino.
PROPRIETÀ E DIFFUSIONE
Il potassio, scoperto nel 1807 dal chimico britannico Davy, ha colore bianco-argenteo, durezza 0,5
e può essere tagliato con un semplice coltello. Esiste in tre forme isotopiche naturali, con massa
39, 40 e 41. Il potassio 40 è radioattivo e ha vita media di 1,28 miliardi di anni mentre l'isotopo
più abbondante è il potassio 39; sono inoltre stati preparati diversi isotopi artificiali. Il potassio
fonde a circa 63 °C, bolle a circa 760 °C, ha densità relativa 0,86 e peso atomico 39,102.
Il potassio metallico è preparato per elettrolisi dell'idrossido fuso o di una miscela di cloruro e
fluoruro di potassio. Il metallo si ossida non appena viene esposto all'aria e reagisce violentemente
con l'acqua, producendo idrossido di potassio e idrogeno gassoso. Siccome l'idrogeno prodotto
brucia spontaneamente, il potassio viene sempre mantenuto in liquidi come la paraffina, con la
quale non reagisce.
Si trova in grosse quantità in vari minerali come la carnallite, i feldspati, il salnitro e la silvite; è
un costituente dei tessuti di piante e animali, e un ottimo fertilizzante.
USI
Il potassio metallico è usato nelle cellule fotoelettriche. Forma composti simili a quelli del sodio,
con numero di ossidazione ±1. Tra i più importanti troviamo il bromuro di potassio (KBr), un
solido bianco formato dalla reazione fra idrossido di potassio e bromo, usato in fotografia, nelle
incisioni, in litografia e in medicina come sedativo. Il cromato di potassio (K2CrO4), di colore
giallo, e il bicromato di potassio (K2Cr2O7), un solido cristallino rosso, sono potenti ossidanti
utilizzati nella fabbricazione di fiammiferi, fuochi artificiali, coloranti tessili e nella colorazione
della pelle. Lo ioduro di potassio (KI), un composto bianco molto solubile in acqua, è usato in
fotografia per preparare emulsioni gelatinose e in medicina per il trattamento dei reumatismi o
contro l'iperattività della tiroide.
Il nitrato di potassio (KNO3), un solido bianco preparato dalla cristallizzazione frazionata delle
soluzioni di nitrato sodico e cloruro di potassio, si trova nei fiammiferi, negli esplosivi, nei fuochi
artificiali e nella carne salmistrata; è presente in natura nel salnitro. Il permanganato (VII) di
potassio, KMnO4, di colore viola, è usato come disinfettante e germicida, e come agente ossidante
in molte reazioni chimiche. Il solfato di potassio (K2SO4), un solido cristallino bianco, è un
importante fertilizzante, utile anche nella preparazione del solfato di potassio-alluminio, o allume.
Il potassio idrogenotartrato, noto come cremore di tartaro, è un solido bianco usato nelle polveri
lievitanti e in medicina.
Il carbonato di potassio (K2CO3), di colore bianco, viene ottenuto dalle ceneri del legno o di altre
parti delle piante, oppure facendo reagire idrossido di potassio con biossido di carbonio; trova
impiego nella fabbricazione dei vetri e dei saponi.
Il termine potassa indicava originariamente il carbonato di potassio, ma è ora applicato a vari
composti di potassio. Il clorato di potassio (KClO3), detto clorato di potassa, un composto
cristallino bianco, è preparato dall'elettrolisi delle soluzioni di cloruro di potassio; è un forte
agente ossidante ed è utilizzato nei fiammiferi, nei fuochi artificiali, negli esplosivi e come
disinfettante. Il cloruro di potassio (KCl), anch'esso di colore bianco e comunemente detto cloruro
di potassa, è un costituente dei sali minerali di potassio, dai quali è ottenuto per sublimazione; è
un importante fertilizzante ma viene anche usato per preparare altri composti.
L'idrossido di potassio, detto potassa caustica, un solido bianco sciolto dall'umidità dell'aria, è
preparato dall'elettrolisi di cloruro di potassio o dalla reazione fra carbonato di potassio e
idrossido di calcio; è impiegato per la produzione di sapone ed è anche un importante reagente
chimico. Si dissolve in una quantità d'acqua minore del suo peso, liberando calore e formando una
soluzione fortemente alcalina.
RADIO
Elemento metallico radioattivo, argenteo, di simbolo Ra e numero atomico 88; appartiene al
gruppo IIA (o 2) della tavola periodica, ed è pertanto tra i metalli alcalino-terrosi. Fu scoperto nel
minerale pechblenda dai chimici francesi Marie e Pierre Curie nel 1898, nel corso degli
esperimenti sulla radioattività.
PROPRIETÀ E DIFFUSIONE
Il radio 226 fonde a circa 700 °C e ha densità relativa 5,5. Si ossida immediatamente per
esposizione all'aria e viene utilizzato sotto forma di cloruro o bromuro e mai allo stato metallico.
È un prodotto della disintegrazione radioattiva dell'uranio, ed è presente in tutti i giacimenti di
minerali di uranio dai quali viene estratto utilizzando un composto del bario che ha funzione di
"portatore". Poiché le proprietà chimiche del radio sono simili a quelle del bario, le due sostanze
sono separate insieme dagli altri componenti del minerale in forma di solfati, poi convertiti in
carbonati o solfuri, e disciolti in acido cloridrico; il radio viene infine separato dal bario attraverso
cristallizzazioni successive delle soluzioni di cloruri.
Fra gli isotopi del radio, con masse variabili fra 206 e 232, il più abbondante e il più stabile ha
massa 226 e si forma dalla disintegrazione radioattiva dell'isotopo del torio con massa 230, il
quarto elemento della serie di decadimento che comincia dall'uranio 238. La vita media del radio
226 è 1620 anni; esso decade con emissione di particelle alfa, liberando il gas radon.
USI
La sovraesposizione alle radiazioni di radio ha effetti dannosi sulle cellule degli organismi;
tuttavia poiché le cellule tumorali sono molto più sensibili alle radiazioni delle cellule normali, la
radioterapia è utilizzata nella cura di alcuni tipi di cancro, ponendo particolare attenzione
all'intensità e alla direzione delle radiazioni. Piccole quantità di radio erano un tempo utilizzate
nella produzione di vernici luminescenti, che venivano applicate a oggetti come ad esempio le
lancette degli orologi o le maniglie delle porte, per renderli visibili nell'oscurità
RAME
Elemento metallico marrone-rosso, di simbolo Cu e numero atomico 29; appartiene agli elementi
di transizione della tavola periodica. Conosciuto fin dalla preistoria, il rame è stato probabilmente
il primo metallo utilizzato per costruire armi, utensili e attrezzi rudimentali. Oggetti di rame sono
stati trovati tra i resti di molte civiltà antiche, ad esempio in Egitto, in Asia, in Europa e in Grecia;
i romani, che lo chiamarono cyprum, lo utilizzavano anche per la realizzazione di strumenti adibiti
alle pratiche religiose.
PROPRIETÀ E USI
Il rame fonde a circa 1083 °C, bolle a circa 2595 °C, ha densità relativa 8,9 e peso atomico
63,546. È caratterizzato da elevata conducibilità termica ed elettrica, buona resistenza alla
corrosione, malleabilità, duttilità, ma anche bellezza, e trova quindi moltissime applicazioni.
Viene utilizzato prevalentemente per condutture elettriche. Sottili fili conduttori estremamente
resistenti sono impiegati sia come cavi esterni sia per gli impianti elettrici domestici, in lampade e
dispositivi come generatori, relè, elettromagneti e strumenti per telecomunicazioni.
È sempre stato usato per fabbricare monete ma anche utensili da cucina, contenitori e oggetti
ornamentali, e un tempo era utilizzato per rivestire il fondo delle navi di legno per prevenire le
falle. Può essere facilmente galvanizzato, sia da solo sia come base per altri metalli.
Il trattamento metallurgico prevede diverse fasi. I solfuri, tra i più importanti minerali che
contengono rame, vengono frantumati e concentrati tramite flottazione, quindi fusi in un forno a
riverbero, dove si produce rame metallico grezzo, con grado di purezza del 98% circa. Questo
materiale viene ulteriormente purificato per elettrolisi, fino a ottenere un prodotto puro al 99,9%.
Il rame puro è molto morbido e per essere lavorato deve essere indurito; al contrario le leghe di
rame, sono dure e resistenti, hanno elevata resistenza elettrica e di conseguenza non possono
essere utilizzate come materiale conduttore. Le più importanti leghe sono l'ottone, una lega di
zinco, e il bronzo, una lega di stagno; comunque il rame viene anche utilizzato in lega con oro,
argento e nichel, ed è un importante costituente di leghe come il metallo Monel, il metallo per
proiettili e l'argento tedesco.
Il rame forma due serie di composti chimici: i composti rameosi nei quali presenta stato di
ossidazione +1, e quelli rameici in cui ha stato di ossidazione +2. I primi vengono ossidati
facilmente a rameici, anche per semplice esposizione all'aria, e hanno poca importanza dal punto
di vista industriale; i composti rameici invece sono stabili. Alcune soluzioni di rame sciolgono la
cellulosa e per questo motivo vengono utilizzate nei processi di produzione del rayon. Il rame è
inoltre un costituente di diversi pigmenti, insetticidi e fungicidi, anche se spesso viene sostituito
da composti organici.
ABBONDANZA
Relativamente diffuso in natura anche allo stato elementare, il rame si trova spesso combinato ad
altri metalli, come oro, argento, bismuto e piombo; è presente in piccole quantità in diversi tipi di
rocce, in particolare nelle lave basaltiche. Le fonti principali di rame sono la calcopirite e la
bornite, solfati misti di rame e ferro. Importanti sono pure la calcosina e la covellite, solfati di
rame, diffusi in diverse regioni di Stati Uniti e Inghilterra. L'azzurite, un carbonato basico, si trova
in Francia e Australia mentre la malachite, anch'esso un carbonato, è diffusa nella regione degli
Urali. La tetraedrite, un solfoantimonuro di rame e altri metalli, e la crisocolla, un silicato, sono
pure molto diffusi. Elevate quantità di cuprite, un ossido, si trovano a Cuba mentre l'atacamite, un
cloruro basico, è presente soprattutto in Perù. I giacimenti più importanti dal punto di vista
industriale sono in Cile.
PRODUZIONE DEL RAME
La bassa concentrazione di rame nei minerali da cui viene estratto impone diversi stadi di
lavorazione. I minerali vengono frantumati e macinati prima di essere introdotti nella camera di
flottazione, dove il rame si separa dal resto dei frammenti, che precipitano. La polvere arricchita
di rame passa nel forno a riverbero dove buona parte delle impurità viene rimossa sotto forma di
gas. Si ottiene una miscela di rame e ferro, detta metallina, sopra la quale galleggiano delle scorie
che vengono eliminate, mentre il resto della fusione raggiunge un convertitore. Il rame fuso viene
colato in stampi e ulteriormente purificato per elettrolisi prima di essere usato per produrre
utensili o cavi elettrici.
SILICIO
Elemento metallico di simbolo Si e numero atomico 14, appartenente al gruppo 14 (o IVB) della
tavola periodica. È stato isolato dai suoi composti nel 1823 dal chimico svedese Berzelius.
PROPRIETÀ E FONTI
Il silicio elementare si presenta sotto forma di una polvere amorfa marrone o in cristalli grigi. Si
ottiene per riscaldamento della silice SiO2 (diossido di silicio) con un agente riducente, come
carbonio o magnesio, in fornace elettrica. Il silicio cristallino ha durezza 7, fonde a 1410 °C, bolle
a 2355 °C, ha densità relativa 2,33 e peso atomico 28,086.
Non viene attaccato dall'acido nitrico, cloridrico o solforico, ma è solubile in acido fluoridrico; si
scioglie anche nella soda (idrossido di sodio), formando silicato di sodio e idrogeno gassoso. Alle
normali temperature il silicio non viene intaccato per esposizione all'aria; alle alte temperature
invece reagisce con l'ossigeno formando la silice, inerte, e con l'azoto e il cloro, formando
rispettivamente nitruro di silicio Si3N4 e tetracloruro di silicio SiCl4.
Molto abbondante nella crosta terrestre, il silicio non è presente in natura allo stato elementare ma
solo come diossido o come silicato. I minerali contenenti silicio rappresentano il 40% di tutti i
minerali e il 90% dei minerali costituenti le rocce laviche. Il diossido di silicio esiste in tre forme
cristalline diverse: il quarzo, di cui esistono molte varietà, la cristobalite e la tridimite. I silicati di
alluminio, calcio e magnesio sono invece i componenti principali dell'argilla, del suolo e delle
rocce, sotto forma di feldspati, anfiboli, pirosseni, miche, zeoliti, e pietre preziose e semipreziose
come olivina, granato, zircone, topazio, e tormalina.
USI
Il silicio viene usato in lega con l'acciaio e viene impiegato come disossidante nella lavorazione di
quest'ultimo materiale.
È un semiconduttore: a temperatura ambiente è caratterizzato da una resistenza elettrica compresa
tra quella dei metalli e quella degli isolanti, che può essere modificata mediante l'aggiunta di
piccole quantità di impurezze (processo di drogaggio). Data la sua abbondanza in natura e la
possibilità di controllare le sue proprietà elettriche, il silicio trova importanti impieghi
nell'industria elettronica per la produzione di transistor e di circuiti integrati.
La silice e i silicati sono usati nella produzione del vetro, della ceramica, degli smalti, del cemento
e della porcellana. La silice fusa, ottenuta fondendo il quarzo o idrolizzando il tetracloruro di
silicio, ha basso coefficiente di espansione ed elevata resistenza agli agenti chimici. Il gel di silice,
una sostanza amorfa, incolore e porosa, è ottenuto sottraendo parte dell'acqua contenuta in un
polimero gelatinoso di acido silicico SiO2H2O, formato per aggiunta di acido cloridrico a una
soluzione di silicato di sodio. Il gel di silice assorbe acqua e altre sostanze, perciò è usato come
disidratante e decolorante.
Il silicato di sodio Na2SiO3 è un solido amorfo, incolore, solubile in acqua, che fonde a 1088 °C.
Viene ottenuto per fusione della silice con carbonato di sodio o per riscaldamento della sabbia con
soda concentrata ad alte pressioni. La soluzione acquosa di silicato di sodio è detta vetro solubile e
viene usata per conservare le uova, al posto della colla nella fabbricazione di scatole e altri
contenitori, come collante per gemme artificiali, nei saponi e nei detersivi e come materiale
ignifugo. Un importante composto di silicio e carbonio è il carborundum, che trova impiego come
abrasivo.
Il monossido di silicio SiO, l'unico composto noto in cui il silicio presenti numero d'ossidazione 2,
viene usato per creare degli strati protettivi su altri materiali, che protegge ossidandosi a diossido
SiO2.
SODIO
Elemento metallico di colore argenteo, estremamente reattivo, di simbolo Na e numero atomico
11; appartiene al gruppo IA (o 1) della tavola periodica, ed è quindi tra i metalli alcalini. Fu
scoperto nel 1807 dal chimico britannico Davy.
PROPRIETÀ E DIFFUSIONE
Il sodio metallico è estremamente morbido e può essere facilmente tagliato con un semplice
coltello. Si ossida immediatamente per esposizione all'aria e reagisce violentemente con l'acqua,
formando idrossido di sodio e liberando idrogeno. Fonde a circa 98 °C, bolle a 892 °C, ha densità
relativa 0,97 e peso atomico 22,9898.
Il sodio non esiste in natura allo stato elementare ma si trova nelle acque salate sotto forma di
cloruro di sodio, NaCl o, meno spesso, di carbonato, Na2CO3, e di solfato, Na2SO4. Viene
preparato industrialmente tramite decomposizione elettrolitica di cloruro di sodio fuso. È uno dei
costituenti principali dei tessuti delle piante e degli animali.
USI
Il sodio si utilizza nella produzione del piombo tetraetile e come refrigerante nei reattori nucleari.
Tra i composti più importanti troviamo il cloruro di sodio, comunemente noto come sale, il
carbonato di sodio, e il sodio bicarbonato, detto comunemente bicarbonato. L'idrossido di sodio,
noto come soda caustica, trova impiego nella produzione di sapone, rayon, carta, nella
raffinazione degli oli e nelle industrie tessili e della gomma. Il tetraborato di sodio è comunemente
detto borace. Il fluoruro di sodio, NaF, è usato come antisettico, come veleno per topi e scarafaggi,
e nelle ceramiche; il nitrato di sodio, noto come salnitro, è usato come fertilizzante; il perossido,
Na2O2, è un agente sbiancante e ossidante; il tiosolfato di sodio, Na2S2O3 · 5H 2O, è usato in
fotografia come fissante.
TITANIO
Elemento di transizione della tavola periodica di simbolo Ti e numero atomico 22; è un metallo di
colore argenteo, usato principalmente nella produzione di leghe leggere e resistenti. Fu
individuato come costituente del rutilo dal chimico tedesco Klaproth nel 1795, ma venne isolato
soltanto cinque anni dopo.
PROPRIETÀ E FONTI
È molto resistente alla corrosione e non viene intaccato né dall'acqua né dall'acido nitrico; è
tuttavia solubile nell'acido solforico e nell'acido cloridrico concentrati ma soprattutto nell'acido
fluoridrico che rappresenta il suo migliore solvente. La presenza di impurezze, anche in piccola
quantità, rende il metallo fragile e non lavorabile; al contrario, il titanio puro è invece molto
resistente, duttile e malleabile. Fonde a circa 1660 °C, bolle a 3260 °C, ha densità relativa 4,51 e
peso atomico 47,90.
Il titanio presenta numero d'ossidazione +2, +3 e +4, come ad esempio nei tre cloruri TiCl2, Ti2Cl3
e TiCl4. È relativamente abbondante nella crosta terrestre; tuttavia non viene rinvenuto allo stato
elementare ma sotto forma ossidata nei minerali ilmenite (FeO · TiO2), rutilo (TiO2) e titanite
(CaO · TiO2 · SiO2).
Il diossido di titanio, TiO2, si ottiene dal trattamento del minerale ridotto in polvere con carbonato
di potassio e acido fluoridrico acquoso, in modo da formare l'esafluorotitanato (IV) di potassio
K2[TiF6], un sale che può essere facilmente separato dalle scorie perché solubile in acqua in
opportune condizioni di temperatura. L'aggiunta di ammoniaca alla soluzione determina la
precipitazione di un ossido ammoniacale che, per calcinazione in un crogiuolo di platino, rigenera
il diossido. Il metallo puro si ottiene dal tetracloruro di titanio, un liquido volatile e facilmente
purificabile ricavato dal diossido per reazione con il cloro; il cloruro viene ridotto con magnesio,
in atmosfera d'argon, a metallo spugnoso, che viene fuso e conservato in lingotti. Il complicato
metodo di preparazione del titanio puro lo rende molto costoso, benché i suoi minerali siano
piuttosto diffusi.
USI
Il titanio è molto usato come componente delle leghe metalliche; ad esempio la lega di titanio,
alluminio e vanadio trova applicazioni nell'industria aerospaziale, nella produzione di pareti
tagliafiamma, rivestimenti esterni, componenti dei carrelli d'atterraggio, tubazioni idrauliche e
supporti dei motori. Il titanio viene anche usato nella costruzione dei missili e delle capsule
spaziali. Importanti materiali sono poi la lega madre ferro-carbonio-titanio, ottenuta dalla
riduzione dell'ilmenite con il coke in una fornace elettrica, e il cuprotitanio e il manganotitanio,
prodotti per riduzione del rutilo in presenza rispettivamente di rame o di manganese.
La relativa inerzia del titanio lo rende adatto a sostituire ossa e cartilagini; inoltre viene anche
usato per gli scambiatori di calore degli impianti di desalinizzazione. In metallurgia le leghe di
titanio vengono impiegate come disossidanti e denitrificanti, data l'affinità di questo elemento per
l'ossigeno e l'azoto. L'ossido di titanio è un pigmento bianco (bianco di titanio) usato nella
produzione di vernici, materie plastiche, tessuti, carta e gomma.
URANIO
Elemento metallico radioattivo, di simbolo U, e numero atomico 92, usato come combustibile nei
reattori nucleari. L'uranio appartiene alla serie degli attinidi della tavola periodica. Fu scoperto nel
1789 dal chimico tedesco Klaproth, in un campione di pechblenda, e prese nome dal pianeta
Urano. Fu isolato allo stato metallico nel 1841. Le proprietà radioattive dell'uranio vennero
scoperte nel 1896 dal fisico francese Becquerel durante l'analisi di un'immagine ottenuta, grazie
all'azione dei sali fluorescenti di solfato di uranile di potassio, su una lastra fotografica coperta da
un sottile strato di sostanza fotoassorbente. Gli studi sulla radioattività che seguirono
l'esperimento di Becquerel portarono alla scoperta del radio e alla definizione di nuovi e
fondamentali concetti sulla struttura atomica.
PROPRIETÀ
L'uranio fonde a circa 1132 °C, bolle a 3818 °C, ha densità relativa 19,05 alla temperatura di
25 °C, e peso atomico 238,029. Esiste in tre diverse forme cristalline: in una forma stabile a
temperatura ambiente; alla temperatura di 668 °C, in una forma modificata caratterizzata da
densità leggermente minore e da cristalli tetragonali, duri e fragili; a 774 °C raggiunge la forma
cubica a corpo centrato, facilmente lavorabile e plastica, resa stabile mediante l'aggiunta di piccole
quantità di molibdeno. L'uranio è solubile nell'acido cloridrico e nell'acido nitrico, ma insolubile
negli alcali; reagisce con gli acidi minerali e con le soluzioni dei sali di mercurio, argento, rame,
stagno, platino e oro, "spostando" l'idrogeno. Se polverizzato, brucia all'aria fra i 150 °C e i
175 °C, e alla temperatura di 1000 °C si combina con l'azoto formando un nitruro di colore giallo.
L'uranio presenta stato di ossidazione 3, 4, 5 e 6; tra i composti esavalenti, più stabili, si trovano il
triossido di uranile (UO3) e il cloruro di uranile (UO2Cl2). Il tetracloruro di uranio (UCl4) e il
biossido (UO2), sono esempi di composti tetrapositivi, o uranosi. I composti di uranio sono
generalmente instabili e, se esposti all'aria per lungo tempo, ritornano allo stato esapositivo. I sali
di uranio, come il cloruro, si decompongono in presenza di luce forte e sostanze organiche.
DIFFUSIONE
In natura l'uranio non si trova allo stato libero ma solo sotto forma di ossido o sale complesso in
minerali come la pechblenda e la carnotite. L'uranio puro è formato per più del 99% dall'isotopo
uranio 238, meno dell'1% dall'isotopo fissile uranio 235 e da tracce di uranio 234, prodotto dal
decadimento radioattivo dell'uranio 238. Tra gli isotopi prodotti artificialmente vi sono l'uranio
233, l'uranio 237 e l'uranio 239. Si conoscono anche isotopi con massa variabile fra 222 e 242.
ESTRAZIONE
Il metodo classico di estrazione dell'uranio prevede che la pechblenda venga triturata e mescolata
con acido solforico e nitrico. L'uranio si scioglie e forma il solfato di uranile (UO2SO4), mentre il
radio e gli altri metalli del minerale vengono precipitati come solfati. Aggiungendo idrossido di
sodio, si precipita il diuranato di sodio (Na2U2O7 · 6H2O), noto anche come ossido giallo di uranio.
Per ottenere l'uranio dalla carnotite, il minerale viene finemente polverizzato e mescolato con soda
e potassa calde per sciogliere l'uranio, il radio e il vanadio. Dopo aver eliminato le sabbie inutili, il
composto viene trattato con acido solforico e cloruro di bario. Una soluzione caustica e alcalina
aggiunta al liquido precipita l'uranio e il radio in forma concentrata. Questi metodi classici di
estrazione dell'uranio dai suoi minerali sono stati sostituiti da procedure più rapide e
tecnologicamente perfezionate che prevedono l'impiego di solventi, lo scambio ionico, e diverse
tecniche che sfruttano la volatilità.
USI
Dopo la scoperta della fissione nucleare, l'uranio divenne un metallo di importanza strategica,
utilizzato principalmente per la produzione di energia nei reattori nucleari, ma anche nelle armi
nucleari. Durante le tre conferenze internazionali per gli usi pacifici dell'energia nucleare tenute a
Ginevra nel 1955, 1958 e 1964, si discussero le applicazioni pacifiche di questa fonte energetica.
Il potenziale dell'uranio come fonte di energia divenne evidente nel 1954 con il varo del primo
sottomarino nucleare, il Nautilus. Gli impianti tradizionali, per produrre 60.000 kW di elettricità,
consumano 18 milioni di kg di carbone al mese, mentre un impianto nucleare usa solo 7 kg di
uranio. Tuttavia, problemi di scarsità di uranio, sicurezza degli impianti e accumulo dei rifiuti
radioattivi di uranio e plutonio hanno impedito la totale conversione degli impianti tradizionali in
impianti nucleari.
I minerali di uranio sono presenti in tutto il mondo; in particolari depositi di pechblenda, il
minerale più ricco di uranio, si trovano principalmente in Canada, Repubblica democratica del
Congo e Stati Uniti. La maggior parte dell'uranio degli Stati Uniti deriva dalla carnotite presente
in Colorado, Utah, New Mexico, Arizona e Wyoming. Un minerale detto coffinite, scoperto nel
1955 in Colorado, contiene fino al 61% di uranio. Depositi di coffinite si trovano in Wyoming e
Arizona e in molti altri paesi. Risorse energetiche mondiali.
VANADIO
Elemento di transizione della tavola periodica, di simbolo V e numero atomico 23. Scoperto
intorno al 1800, fu inizialmente scambiato per una forma particolare di cromo e solo in un
secondo tempo classificato come nuovo elemento.
PROPRIETÀ E DIFFUSIONE
È un metallo grigio-argenteo, duro ma duttile; se lucidato, diventa molto brillante. Fonde a 1890
°C, bolle a circa 3000 °C, ha densità relativa 6,07 e peso atomico 50,94. È solubile in acido nitrico
e solforico, ma non in acido cloridrico e in soluzioni diluite di idrossido di sodio o di alcol. Tra i
suoi composti, sono importanti il pentossido di vanadio, V2O5, un ossido di colore rosso ruggine;
il pentasolfuro di vanadio, V2S5; il dicloruro e il tricloruro di vanadio, VCI2 e VCI3, e l'acido
metavanadico, HVO3.
In natura non si trova allo stato puro, ma è diffuso in minerali come la vanadinite, la carnotite e la
patronite, in cui è combinato con diversi metalli. I principali produttori di vanadio sono Stati
Uniti, Russia e Sud Africa.
USI
La durezza e l'elevata resistenza a trazione che caratterizzano questo elemento lo rendono
utilizzabile in numerose leghe, come la lega ferro-vanadio, usata come additivo nella produzione
di acciai con elevata resistenza all'usura, e le leghe nickel-vanadio e cromo-vanadio. Gli acciai al
cromo-vanadio sono utilizzati per produrre molle a elica cilindrica, meccanismi di trasmissione e
altri componenti dei motori. Le leghe titanio-vanadio sono usate nelle coperture dei missili, negli
alloggiamenti dei motori a propulsione e in componenti dei reattori nucleari. Come catalizzatore,
sostituisce il platino nella produzione di acido solforico; viene inoltre utilizzato nelle soluzioni per
lo sviluppo di pellicole fotografiche, come agente riducente e come essiccante per vari tipi di
vernici.
WOLFRAMIO
Elemento metallico di simbolo W e numero atomico 74, detto anche tungsteno. Appartiene agli
elementi di transizione della tavola periodica, ed è l'elemento con il più alto punto di fusione.
Fu scoperto dal chimico svedese Carl Wilhelm Scheele nel 1781. Allo stato puro, il wolframio ha
colore argenteo ed è duttile, ma si ottiene in genere nella sua forma grezza, di colore grigio, dura e
fragile. È insolubile in acqua e in alcol, leggermente solubile in ammoniaca e acido nitrico, e
perfettamente solubile in idrossido di potassio concentrato e caldo. Fonde a 3410 °C, bolle a circa
5927 °C, ha densità relativa 19,5 e peso atomico 183,85.
Il tungsteno non si trova mai allo stato libero in natura, ma sempre combinato con altri metalli, in
particolare nei minerali scheelite e wolframite, che ne sono fonti importanti. I giacimenti in Corea
del Sud, Portogallo, Austria e Australia forniscono più della metà del fabbisogno mondiale.
Durante il processo di estrazione, i minerali vengono fusi con carbonato di sodio per ottenere
wolframato di sodio, Na2WO4, che viene quindi trattato con acqua calda e acido cloridrico. L'acido
wolframico, H2WO4, che risulta da questa reazione, viene lavato e seccato fino a ottenere l'ossido
WO3, poi ridotto con idrogeno, in una fornace elettrica. La polvere prodotta viene scaldata in
stampi in atmosfera di idrogeno, e forgiata in barre che vengono pressate ad alta temperatura e
rese compatte e duttili.
Il tungsteno viene principalmente usato nei filamenti delle lampade a incandescenza, nei cavi dei
forni elettrici e per la produzione di leghe durissime, in particolare con il ferro. Trova impiego
anche nella produzione di candele per motori, di contatti elettrici, e come bersaglio per i tubi a
raggi X.
ZINCO
Elemento metallico di colore bianco-bluastro, di simbolo Zn e numero atomico 30; è uno degli
elementi di transizione della tavola periodica.
PROPRIETÀ E DIFFUSIONE
Lo zinco puro è un metallo cristallino, insolubile in acqua e solubile in alcol, in acidi e in sostanze
alcaline. È inerte all'aria secca, ma all'aria umida si ossida e si ricopre di uno strato di carbonato
che lo protegge dalla corrosione. Fonde a 420 °C, bolle a circa 907 °C, ha densità relativa 7,14 e
peso atomico 65,38.
In natura non si trova mai allo stato puro, ma sotto forma di ossido, ZnO; di silicato,
Zn4[(OH)2Si2O7]·H2O (calamina o emimorfite); di carbonato, ZnCO3 (smithsonite); di ossido
misto di ferro e zinco, ZnFe2O4 (franklinite) e di solfuro, ZnS (blenda o sfalerite). I minerali usati
più comunemente per l'estrazione dello zinco sono la smithsonite e la sfalerite.
Il primo passaggio del processo metallurgico di estrazione consiste nella trasformazione dei
minerali in ossido di zinco tramite calcinazione. Gli ossidi ottenuti vengono poi ridotti dal carbone
in una fornace elettrica; lo zinco viene raccolto liquido, scaldato fino all'ebollizione e distillato in
storte di refrattario. Lo zinco ottenuto per distillazione contiene impurezze di ferro, arsenico,
cadmio e piombo e viene definito zinco termico. In alternativa, i minerali calcinati vengono
trattati con acido solforico. Si ottiene una soluzione di solfato di zinco che, purificata da tutti gli
altri metalli, viene elettrolizzata. Lo zinco elettrolitico è puro al 99,99% e presenta proprietà molto
ricercate.
USI
Lo zinco metallico è usato come rivestimento protettivo (galvanizzazione) per ferro e acciaio, è un
costituente di molte leghe, ad esempio dell'ottone (rame-zinco), e viene usato come piastra per le
celle elettrochimiche. L'ossido di zinco, noto come zinco bianco, trova impiego come pigmento e
nell'industria dei cosmetici. Il cloruro è utilizzato per proteggere il legno e come fondente; il
solfuro è usato in dispositivi che sfruttano fenomeni di elettroluminescenza, di fotoconduttività e
di semiconduttività, come i rivestimenti fluorescenti e i tubi catodici collegati allo schermo
televisivo.
ZOLFO
Elemento non metallico, di colore giallo, insapore e inodore, di simbolo S e numero atomico 16.
Appartiene al gruppo VIB o 16 della tavola periodica e ha peso atomico 32,064. Conosciuto fin
dalla preistoria e ampiamente utilizzato dagli alchimisti, lo zolfo fu individuato come elemento
dal chimico francese Lavoisier durante le sue ricerche sui processi di combustione.
PROPRIETÀ
Lo zolfo è insolubile in acqua, ma solubile in alcuni solventi organici e in particolare nel solfuro
di carbonio. Se portato alla temperatura di fusione, diventa un liquido color paglierino che si
scurisce progressivamente man mano che gli si fornisce calore. Quando lo zolfo fuso viene
raffreddato lentamente, le sue proprietà fisiche variano in relazione alla temperatura, alla
pressione e al tipo di solidificazione, dando luogo a diverse forme allotropiche.
L'elemento esiste allo stato liquido nelle modificazioni Sl e Sµ , e in alcune varietà solide, delle
quali le più comuni sono quelle che cristallizzano nel sistema rombico e monoclino. La varietà più
stabile è lo zolfo rombico, un solido cristallino giallo che a temperatura ambiente (circa 20 °C) ha
densità relativa 2,06. Lo zolfo rombico è leggermente solubile in alcol, etere e oli, e molto
solubile in solfuro di carbonio. A temperature comprese tra 94,5 °C e 120 °C è stabile la forma
monoclina, che si presenta in cristalli allungati e trasparenti. Quando lo zolfo rombico viene
sciolto a 115,21 °C, forma un liquido giallo pallido identificato come Sl, che diventa scuro e
vischioso a 160 °C, trasformandosi nella modificazione Sµ . Se lo zolfo viene portato al punto di
ebollizione, circa 444,6 °C, e rapidamente versato in acqua fredda, solidifica senza avere il tempo
richiesto dal processo di cristallizzazione, formando una sostanza vischiosa, elastica, nota come
zolfo amorfo o elastico, e costituita per la maggior parte da zolfo Sµ sopraraffreddato.
Lo zolfo presenta stato di ossidazione due, quattro e sei; si combina con l'idrogeno e con alcuni
metalli per formare i solfuri, fra i quali il più comune è il solfuro di idrogeno, H2S, un gas
incolore, velenoso, con odore pungente e fastidioso. Lo zolfo reagisce anche con il cloro in
diverse proporzioni producendo il cloruro, S2Cl2, e il dicloruro, SCl2. Se bruciato all'aria, si
combina con l'ossigeno formando biossido di zolfo, SO2, un gas incolore dal caratteristico odore
soffocante. In aria umida si ossida lentamente ad acido solforico ed è un costituente fondamentale
di altri acidi, come l'acido tiosolforico, H2S2O3, e l'acido solforoso, H2SO3. Quest'ultimo ha due
atomi di idrogeno che possono essere sostituiti per formare i solfiti acidi e normali. I solfuri acidi,
o bisolfiti, di metalli alcalini come il bisolfito di sodio, NaHSO3, producono soluzioni acide
mentre i solfiti normali, come il solfito di sodio, Na2SO3, e il solfito di potassio, K2SO3, danno
soluzioni debolmente alcaline.
Il biossido di zolfo viene liberato nell'atmosfera durante la combustione di combustibili fossili,
come il gas naturale, il petrolio e il carbone, e costituisce uno dei più pericolosi inquinanti. La
concentrazione di biossido di zolfo nell'aria può variare fra 0,01 a molte parti per milione, ed è
responsabile dell'invecchiamento di palazzi e monumenti, del fenomeno delle piogge acide, e
dell'insorgere di varie malattie umane. Vedi Inquinamento atmosferico.
DIFFUSIONE
Lo zolfo è il sedicesimo, in ordine di abbondanza, fra gli elementi della crosta terrestre ed è
presente in natura in forme e stati diversi. Si trova combinato in solfuri metallici, come il solfuro
di piombo o galena, PbS; la zincoblenda, ZnS (Vedi Sfalerite); la pirite di rame, (Cu,Fe)S2; il
cinabro, HgS; la stibnite, Sb2S3; e la pirite FeS2. È anche presente sotto forma di solfato come la
barite (o baritina), BaSO4, la celestina, SrSO4 e il gesso, CaSO4·2H2O. Si trova nelle molecole di
alcune sostanze organiche come la senape, le uova, i capelli, le proteine e l'aglio. Allo stato libero
è spesso mescolato al gesso e alla pietra pomice nelle zone vulcaniche dell'Islanda, del Messico e
del Giappone. Importanti giacimenti si trovano in Italia: in Romagna, nelle Marche, ma soprattutto
in Sicilia, dov'è presente, accompagnato da diversi minerali, in strati alternati a calcare. Vasti
depositi sotterranei si trovano negli Stati Uniti, in Louisiana e Texas. Lo zolfo libero può formarsi
durante l'invecchiamento della pirite o anche dai depositi dalle acque sulfuree ossidate
dall'atmosfera.
ESTRAZIONE
Esistono vari metodi di estrazione dello zolfo. In Sicilia, le rocce contenenti zolfo vengono
accatastate su un terreno scosceso e accese; lo zolfo liquido, ottenuto in seguito all'aumento di
temperatura, scorre in una serie di stampi di legno, dove solidifica, producendo il cosiddetto zolfo
laminare che può essere ulteriormente purificato tramite distillazione, inviando il vapore in una
camera in muratura dove condensa sotto forma di polvere finissima nota come "fiori di zolfo".
Nelle zone dove i depositi di zolfo sono situati a notevole profondità, come in Louisiana e in
Texas, il metodo di estrazione più diffuso fu messo a punto nel 1891 dal chimico statunitense
Herman Frasch. Nel processo Frasch tre tubi concentrici, il più largo dei quali ha diametro di circa
20 cm, vengono introdotti nel terreno fino a raggiungere il giacimento; nel tubo esterno viene
immessa acqua alla pressione di 18 atm e alla temperatura di 170° C, che fa fondere lo zolfo con
cui viene a contatto, mentre nella tubazione centrale viene iniettata aria alla pressione di 35 atm
che provoca la risalita della massa fusa attraverso l'intercapedine centrale. Lo zolfo viene quindi
immesso in barili di legno dove solidifica, separandosi dall'acqua in eccesso. Il prodotto ottenuto è
puro al 99,5%. Lo zolfo si ottiene anche dalla distillazione della pirite, ma in questo caso contiene
spesso tracce di arsenico.
USI
Lo zolfo è utilizzato principalmente nella produzione di acido solforico, solfiti, solfati e biossido
di zolfo. In medicina, esso ha acquisito importanza come componente dei sulfamidici e come
ingrediente in saponi o creme curative di alcune malattie della pelle. Viene impiegato anche nella
produzione di fiammiferi, gomma vulcanizzata, coloranti e polvere pirica. Mescolato con calce e
polverizzato, viene usato come fungicida per le piante. Un suo sale, il tiosolfato di sodio,
Na2S2O3·5H2O, generalmente chiamato iposolfito, è usato come fissante in fotografia. Combinato
con vari minerali inerti, forma cementi speciali usati per ancorare oggetti metallici, quali catene o
rotaie, a rocce e costruzioni. L'acido solforico, uno dei prodotti chimici più usati, è utilizzato nella
preparazione di alcune sostanze importanti dal punto di vista industriale e commerciale, come ad
esempio l'acido fosforico.












