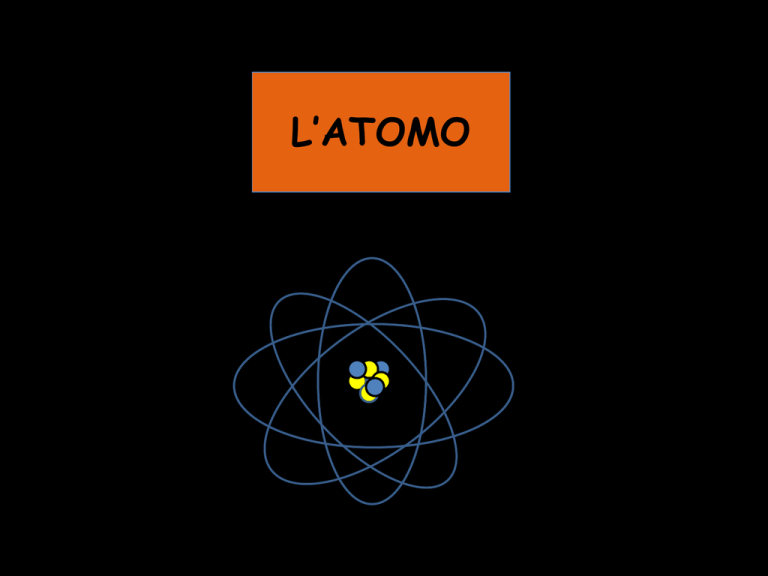
L’ATOMO
Negli ultimi anni dell’Ottocento gli scienziati
capiscono che gli atomi sono formati da:
neutroni
protoni
elettroni
Neutroni e protoni si trovano nel nucleo
Gli elettroni ruotano intorno al nucleo
Neutroni
Protoni
Elettroni
Neutroni: non hanno carica elettrica
Protoni: hanno carica elettrica positiva (+)
Elettroni: hanno carica elettrica negativa (-)
Due cariche di segno opposto si attraggono
Due cariche dello stesso segno si respingono
Un atomo è elettricamente neutro:
il numero dei suoi protoni è uguale al numero dei
suoi elettroni.
Questo numero si chiama numero atomico (Z)
Numero atomico dell’idrogeno è 1:
ogni atomo di idrogeno ha 1 protone e 1 elettrone
Numero atomico dell’elio è 2:
Ogni suoi atomo ha 2 protoni e 2 elettroni
La carica elettrica di una atomo è zero:
Z (H) =1
+1 -1 = 0
Z (He) =2
+2 –2 =0
Le proprietà chimiche di un elemento,
quindi la sua capacità di reagire con altre
sostanze dipende dal suo numero atomico
Gli elettroni ruotano intorno al nucleo
all’interno di gusci concentrici (come se
fossero gli strati di una cipolla…)
Ogni guscio elettronico può contenere un
numero massimo di elettroni:
1
Il primo guscio
elettronico può
contenere al massimo 2
elettroni
2
1
Il secondo guscio
elettronico può
contenere al massimo
8 elettroni
3
2
1
Il terzo guscio
elettronico può
contenere al massimo
8 elettroni
E così via …
Gli elettroni del guscio più interno sono
quelli più attratti dalla carica positiva del
nucleo.
1
Gli elettroni riempiono i gusci elettronici
partendo da quello più interno.
1
Esempio:
L’idrogeno (H) ha numero atomico 1 (Z=1)
Il suo unico elettrone occupa il guscio più interno
1
Esempio:
Il litio (Li) ha numero atomico Z=3
- 2 elettroni riempiono il guscio più interno;
- 1 elettrone si trova nel secondo guscio
2
1
Esempio:
Il berillio (Be) ha numero atomico Z=4
- 2 elettroni riempiono il guscio più interno;
- 2 elettroni si trovano nel secondo guscio
2
1
Esempio:
Il sodio (Na) ha numero atomico Z=11
- 2 elettroni riempiono il guscio più interno;
- 8 elettroni riempiono il secondo guscio;
- 1 elettrone si trova nel terzo guscio.
- un elettrone si trova nel terzo guscio
3
2
1
Esempio:
Il magnesio (Mg) ha numero atomico Z=12
-2 elettroni riempiono il guscio più interno;
- 8 elettrone riempiono il secondo guscio
- 2 elettroni si trovano nel terzo guscio.
3
2
1
Ogni atomo cerca di riempire il suo guscio
elettronico più esterno.
In questo modo diventa più stabile
Gli atomi si legano tra loro e formano
molecole, per riempire i loro gusci elettronici
più esterni
I GAS nobili non si legano con gli altri
elementi …
Infatti i loro gusci elettronici più esterni
sono completi
Es. L’elio (He) ha numero atomico 2 (Z=2)
i suoi due elettroni riempiono il primo
guscio elettronico
1
Es. Il neon (Ne) ha numero atomico Z=10
- due elettroni riempiono il primo guscio
- otto elettroni riempiono il secondo guscio
2
1
Es. L’argon (Ar) ha numero atomico Z=18
- due elettroni riempiono il primo guscio
- otto elettroni riempiono il secondo guscio
- otto elettroni riempiono il terzo gruppo
3
2
1
Le proprietà chimiche di un elemento
dipendono dal numero di elettroni presenti
nel guscio più esterno dei suoi atomi
Gli atomi si legano tra loro e formano
molecole, per riempire i loro gusci
elettronici più esterni!!
Gli atomi che hanno completato il loro guscio
elettronico più esterno diventano stabili.
Nella tavola periodica gli elementi che
appartengono allo stesso gruppo hanno
lo stesso numero di elettroni nel loro
guscio più esterno
Elementi del gruppo I:
Hanno 1 solo elettrone nel guscio più esterno
Idrogeno (H)
Z=1
Elementi del gruppo I:
hanno 1 solo elettrone nel guscio più esterno
Litio (Li)
Z=3
Elementi del gruppo I:
hanno 1 solo elettrone nel guscio più esterno
Sodio (Na)
Z= 11
Elementi del gruppo I:
hanno 1 solo elettrone nel guscio più esterno
Potassio (K)
Z = 19
Elementi del gruppo II:
hanno 2 elettroni nel guscio più esterno
Berillio (Be)
Z=4
Elementi del gruppo II:
hanno 2 elettroni nel guscio più esterno
Magnesio (Mg)
Z = 12
Elementi del gruppo II:
hanno 2 elettroni nel guscio più esterno
Calcio (Ca)
Z = 20
Elementi del gruppo VI:
hanno 6 elettroni nel guscio più esterno
Ossigeno (O)
Z=8
Tutti gli elementi chimici di uno stesso
gruppo hanno lo stesso numero di elettroni
nel guscio elettronico più esterno.
Le proprietà chimiche di un elemento sono
determinate dal numero degli elettroni
presenti nel guscio più esterno dei suoi atomi
Gli elementi che appartengono allo stesso gruppo
nella tavola periodica hanno proprietà chimiche
simili perché hanno lo stesso numero di elettroni
nel loro guscio elettronico più esterno