caricato da
common.user19707
Modifica Lipidica delle Proteine: Presentazione di Biochimica

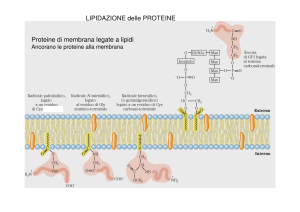
LIPIDAZIONE delle PROTEINE Proteine di membrana legate a lipidi Ancorano le proteine alla membrana Modello per interazioni proteina-membrana e proteina-proteina mediate da lipidi TIPI DI MODIFICAZIONE: 1. N-Miristoilazione Enzima responsabile, N-miristoil transferasi, trasferisce acido miristico su Gly N-term. 2. Prenilazione a. Farnesilazione (~ 20%) b. Geranil-Geranilazione (~ 80%) I. Trasferimento enzimatico di 15 C o 20 C su Cys in prossimità del C-term e formazione di legame tioetere (-XXXCAAX) S CH2 II. Rimozione proteolitica degli aa a valle di Cys (-AAX) III. Carbossimetilazione della Cys C-term IV. Non obbligatoria: palmitoilazione di una Cys a monte 3. Palmitoilazione: trasferimento di acido palmitico in residuodi Cys con formazione di legame tioestere 4. Ancoraggio a Glicofosfolipidi (GPI) N-Miristoilazione co-traduzionale Enzima responsabile, N-miristoil transferasi, trasferisce acido miristico su Gly N-term. Esempi: molte proteine virali: p55gag di HIV, p60v-src, Giα G0α, citocromo b5 reduttasi, subunità catalitica di PKA, ARF COP Estroflessione e vescicolazione: ARF, 1. Reclutamento proteine del COATOMERO, 2. attivazione PLD Fusione di vescicole: NSF (N-etilmaleimide sensitive factor) SNAP Rab Prenilazione Farnesilazione (~ 20%) Geranil-Geranilazione (~ 80%) Farnesil transferasi Esempi: subunità γ delle prot. G eterotrimeriche, Rab, Ras, Lamìna nucleare Cys A Rab ha seq consenso diversa: A -Cys-A-CysCOOH, entrambe prenilate X C=O O- Proteolisi Metilazione Cys C=O OCH3 Segnali che dirigono il tipo di prenilazione Farnesilazione o Geranil-Geranilazione Biosintesi e associazione a membrana delle subunità delle proteine G Fasi del processamento del C-terminale di p21H-ras 2 modifiche: 180 186 180 186 186 180 186 Prenilazione Palmitoilazione 180 Farnesilazione della cisteina 186 (tioetere) Rimozione proteolitica di 3 AA al C-term. 180 186 180 186 Carbossimetilazione al C-term. 180 186 180 186 Palmitato Palmitoilazione delle cisteine a monte (tioestere) Bad Caspasi 9 FARNESIL TRANSFERASI (FT) • Gli organismi eucarioti contengono tre proteine isoprenil-transferasi: FT, GGT I, GGT II • La FT è un eterodimero, costituito da una subunità regolatoria (α), comune anche con la GGT I, ed una subunità catalitica (β) • L’aggiunta del gruppo farnesilico è necessaria per l’opportuna localizzazione delle proteine a livello della membrana cellulare • Numerose proteine subiscono questo processo, tra cui H-, K-, N-Ras, lamìna nucleare. La FT riceve particolare attenzione da quando si è scoperto il suo ruolo nel farnesilare la proteina Ras, un oncoproteina coinvolta in un altissima percentuale di tumori. OSSERVAZIONI I primi studi indicarono che l’attività trasformante di Ras poteva essere completamente abolita in vitro, sostituendo il residuo di cisteina del motivo -CAAX, ad esempio con una serina Ipotesi: Bloccando la farnesilazione si potevano ottenere risultati positivi nella prevenzione e nella terapia di pazienti affetti da forme di cancro causate da Ras SVILUPPO TUMORALE • L’eliminazione della FT non permette di prevenire lo sviluppo di tumori causati dall’oncogene K-Ras o di rallentarne la progressione, in quanto la proteina K-Ras viene facilmente cross-prenilata • Anche per i tumori causati da H-Ras non è possibile prevenirne lo sviluppo abolendo la FT, però si osserva una riduzione della progressione tumorale e quindi un benefico effetto terapeutico. H-Ras non può essere cross-prenilata Risultati: 1. Inibendo la FT, in alcuni casi si osserva il rallentamento della progressione tumorale E’ possibile utilizzare inibitori della farnesil transferasi (FTI) per la cura di pazienti affetti da alcune forme di cancro. Effetto del trattamento con FTI (inibitori della farnesil transferasi) nell’isoprenilazione di H-Ras e K-Ras e RhoB K-Ras-F viene rimossa ma rimpiazzata da K-Ras-GG, K-Ras continua a funzionare perchè ben localizzata. RhoB-GG si accumula al posto di RhoB-F ma per ragioni non chiare questo evento è associato con la perdita di localizzazione negli endosomi. Quindi il trattamento con FTI fa perdere di funzionalità a RhoB. L’isoprenilazione come bersaglio molecolare per strategie anti-tumorali Due armi nel meccanismo antineoplastico Effetti di perdita e acquisizione di funzioni S-Palmitoilazione: trasferimento di acido palmitico (16 C) ad un residuo di Cys con formazione di legame tioestere Palmitoilazione è reversibile Enzimi: PAT e aciltioesterasi In proteine doppiamente lipidate (miristico o isoprene + palmitico) rende più stabile l’associazione con la membrane C=O S Proteina Modula la stabilità di alcune proteine, indicando il corretto folding della proteina (SNARE nel Golgi, quando palmitoilate non sono riconosciute da Ub ligasi) In altri casi regola la degradazione delle proteine Ruolo proposto per la palmitoilazione dinamica delle proteine Precursore della proteina ad ancora GPI e struttura dell’ancora a. b. c. c Proteine ad ancora GPI sono inserite nel foglietto esterno della membrana cellulare attraverso la loro porzione glicolipidica, mentre l’ectodominio è rivolto verso lo spazio extracellulare. Proteine GPI sono sintetizzate come un precursore contenente un sequenza segnale amminoterminale, che l’indirizza al lume dell’ER, e una sequenza segnale al C-terminale che dirige l’ancoraggio della GPI. Il core conservato consiste di una fosfoetanolammina in un legame ammidico al C-terminale della proteina, tre residui di mannosio, una glucosammina e il fosfatidilinositolo. (Da Mayor and Riezman, Nature, 2004). Proteine GPI cytosol Membrane extracell A B PrPSc PrPSc replication and aggregation PrPSc PrPC normal signal neurotoxic signal death replication and aggregation PrPSc PrPC no clinical desease Proteine attaccate a livello della membrana esclusivamente attraverso ancoraggio di Glicosilfosfatidilinositolo Acetilcolinesterasi Fosfatasi alcalina 5’ Nucleotidasi Lipoproteina lipasi VSG di Trypanosoma Antigene Thy-1 Proteina prionica scrapie Antigeni maggiori di superficie del Toxoplasma gondii …. Attacco di alcuni tipi di proteine alla membrana plasmatica tramite lipidi legati covalentemente Thy-1 protein Protein p60v-src Protein p21ras Thy-1 (THYmocyte differentiation antigen 1)