caricato da
alexiamascia
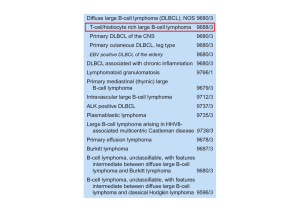
Linee Guida Linfomi 2016: Diagnosi, Trattamento e Follow-up

Linee guida LINFOMI Edizione 2016 LINEE GUIDA LINFOMI Coordinatore Massimo Federico Oncologia Medica – Università degli Studi di Modena e Reggio Emilia-Centro Oncol. Modenese - Modena Medicina Diagnostica, Clinica e di Sanità Pubblica - Università degli Studi di Modena e Reggio Emilia - Modena Segretario Stefano Luminari Estensori Monica Balzarotti UO Ematologia - Istituto Humanitas - Rozzano MI Antonino Carbone Anatomia Patologica - Centro di Riferimento Oncologico IRCCS Istituto Nazionale Tumori - Aviano Luca Castagna Terapia Cellulare - Isituto Humanitas - Rozzano MI Graziella Pinotti UO Oncologia Medica - A. O. Circolo-Fond. Macchi - Varese Umberto Ricardi Dipartimento di Oncologia - Università di Torino Michele Spina Lucilla Tedeschi Revisori Augusto Federici Stefano Molica Divisione di Oncologia Medica A - Centro di Riferimento oncologico Aviano PN UOS Dipartimentale Ematologia, UO Oncologia A. O. S. Carlo Borromeo - Milano SIE Immunoematologia e Medicina Trasfusionale - Ospedale Luigi Sacco - Milano Oncologia Medica - A.O. A. Pugliese - Catanzaro 2 LINEE GUIDA LINFOMI Indice 1. 2. 3. 4. 5. 6. 7. Parte generale ...................................................................................................................... 9 1.1 Epidemiologia dei linfomi.............................................................................................. 9 1.2 La diagnosi istopatologica.............................................................................................. 9 Linfomi diffusi a grandi cellule B ...................................................................................... 13 2.1 Epidemiologia.............................................................................................................. 13 2.2 Classificazione istopatologica e Diagnosi Multidimensionale ....................................... 13 2.3 Stadiazione clinica ....................................................................................................... 14 2.4 Suddivisione in gruppi prognostici ............................................................................... 15 2.5 Trattamento dei DLBCL .............................................................................................. 16 2.6 Trattamento del paziente anziano ................................................................................. 23 2.7 Definizione dei criteri di risposta ................................................................................. 25 2.8 Follow-up .................................................................................................................... 26 Linfomi follicolari ............................................................................................................. 32 3.1 Epidemiologia.............................................................................................................. 32 3.2 Inquadramento diagnostico .......................................................................................... 32 3.3 Trattamento del linfoma follicolare .............................................................................. 35 3.4 Valutazione della risposta ai trattamenti ....................................................................... 43 3.5 Follow-up .................................................................................................................... 44 3.6 Figure .......................................................................................................................... 46 Linfomi di Hodgkin ........................................................................................................... 51 4.1 Epidemiologia.............................................................................................................. 51 4.2 Diagnosi ...................................................................................................................... 51 4.3 Classificazione istopatologica ...................................................................................... 52 4.4 Stadiazione .................................................................................................................. 54 4.5 Indagini diagnostiche ................................................................................................... 55 4.6 Trattamento del linfoma di Hodgkin ............................................................................ 56 4.7 Valutazione della risposta ai trattamenti - Ruolo della PETinterim e PET finale ........... 64 4.8 Follow-up .................................................................................................................... 64 4.9 Hodgkin e gravidanza .................................................................................................. 66 4.10 Figure ........................................................................................................................ 67 Pazienti con infezione da HIV ........................................................................................... 71 5.1 HIV e linfoma di Hodgkin ........................................................................................... 71 5.2 HIV e linfoma non Hodgkin......................................................................................... 71 5.3 Terapia di salvataggio .................................................................................................. 72 Raccomandazioni prodotte con metodologia GRADE ........................................................ 73 Bibliografia ....................................................................................................................... 75 Allegato: Tabelle GRADE evidence profile 3 LINEE GUIDA LINFOMI Abbreviazioni aaIPI ABC ABVD ADCC B2M BEAC BEACOPP BEAM BL B-LLC BMI CLL/SLL CHOP CMV COP CS CT CTX CVP DLBCL DHAP DFS EBV ECG EFS EMA EORTC ESHAP FC FDG FF2F FFP FFS FFTF FN FND GBC GHSG GVHD Hb HBV HBC HCT-CI HDC/HDT HIV HPF IAP ICE IEV IFN IGEV IPI IPS ISH LCA LDH LF Indice Prognostico Internazionale aggiustato per età Activated B-cell like doxorubicina, bleomicina, vinblastina, dacarbazina citotossicità anticorpo mediata β2 microglobulina carmustina, etoposide, citarabina, ciclofosfamide bleomicina, etoposide, doxorubicina, ciclofosfamide, vincristina, procarbazina, prednisone carmustina, etoposide, citarabina, melphalan Linfoma di Burkitt leucemia linfatica cronica a cellule B coinvolgimento midollare Leucemia Linfatica cronica/ Linfoma a piccoli linfociti ciclofosfamide, doxorubicina, vincristina, prednisone citomegalovirus ciclofosfamide, vincristina, prednisone stadio clinico chemioterapia ciclofosfamide ciclofosfamide, vincristina, prednisone Linfomi diffusi a grandi cellule B desametasone, cisplatino, Ara-C, prednisone tempo libero da malattia Virus Epstein-Barr elettrocardiogramma sopravvivenza libera da eventi antigene di membrana epiteliale European Organisation for Research and Treatment of Cancer etoposide, metilprednisolone, Ara-C, cisplatino, prednisone fludarabina, ciclofosfamide [18F] fluorodesossiglucosio tempo libero da secondo fallimento tempo libero da progressione sopravvivenza libera da fallimento tempo libero da fallimento del trattamento fludarabina, mitoxantrone fludarabina, mitoxantrone, desametasone Germinal centre B-cell like German Hodgkin Study Group Graft-versus-host disease emoglobina virus epatite B virus epatite C hematopoietic cell tranplantation-comorbidity index chemioterapia ad alte dosi/ Terapia ad alte dosi sindrome da immunodeficienza acquisita High power field Accademia Internazionale di Patologia ifosfamide, carboplatino, etoposide ifosfamide, epirubicina, vepesid interferone ifosfamide, gemcitabina, vinorelbina Indice Prognostico Internazionale Score Prognostico Internazionale Ibridazione in situ antigene comune leucocitario Lattato deidrogenasi Linfoma follicolare 4 LINEE GUIDA LINFOMI LH LNH LoDLIN LPL MAC MCL MDC MINE MOPP MS MZL NRM ORL OS PBL PCR PEL PET PFS PG PS QOL RC RP R-CHOP R-CVP R-CODOX-M/IVAC REAL R-FCM R-FM R-FND RFS R-HyperCVAD RIC R-IF, RT-IF RIT R-MCP RMN RT SCT sIPI SPD STANFORD V TAC, TC TB TBI TRM UNL VEBEP VES WHO Linfoma di Hodgkin Linfoma non Hodgkin Longest diameter of the largest involved node Linfoma linfoplasmacitico CONDIZIONAMENTO mieloablativo Linfoma mantellare Mezzo di contrasto Mitoxantrone, Ifosfamide, Etoposide Mecloretamina, vincristina, procarbazina, prednisone Malattia stabile Linfoma marginale Mortalità non correlata a ricaduta Otorinolaringoiatra Sopravvivenza globale Linfoma plasmablastico Reazione polimerasica a catena Effusione linfoma tosa primaria Tomoscintigrafia globale corporeaad emissione di positroni Sopravvivenza libera da progressione Progressione Performance status Qualità della vita Remissione completa Remissione parziale Rituximab, ciclofosfamide, doxorubicina, vincristina e prednisone Rituximab, ciclofosfamide, vincristina, prednisone Rituximab, ciclofosfamide, vincristina, doxorubicina, metotrexate, ifosfamide, etoposide, citarabina Revised European-American Lymphoma Rituximab, fludarabina, ciclofosfamide, mitoxantrone Rituximab, fludarabina, mitoxantrone Rituximab, fludarabina, mitoxantrone, desametasone Tempo libero da recidiva Rituximab, ciclofosfamide, vincristina, doxorubicina, desametasone Condizionamento ad intensità ridotta Radioterapia Involved Field Radioimmunoterapia Rituximab, mitoxantrone, clorambucile, prednisolone Risonanza magnetica nucleare Radioterapia Trapianto cellule staminali IPI alla recidiva o progressione Somma dei prodotti dei diametri Mecloretamina, doxorubicina, vinblastina, vincristina, bleomicina, etoposide, prednisone Tomografia (assiale) computerizzata Tumor burden Irradiazione total body Mortalità correlata al trattamento Limite normale superiore Vinorelbina, endoxan, bleomicina, epirubicina, prednisone Velocità di eritrosedimentazione World Health Organization 5 LINEE GUIDA LINFOMI Come leggere le raccomandazioni * Le raccomandazioni cliniche fondamentali vengono presentate in tabelle e vengono corredate dalla qualità delle evidenze a supporto e dalla forza della raccomandazione Nel caso in cui la qualità delle evidenze è stata valutata con metodologia SIGN (Scottish Intercollegiate Guidelines Network) la riga d’intestazione della tabella è verde, mentre è in arancione nel caso di applicazione del metodo GRADE (v. capitolo specifico alla fine di ogni linea guida). Qualità dell’evidenza SIGN (1) Raccomandazione clinica (3) Forza della raccomandazione clinica (2) B Nel paziente oncologico in fase avanzata di malattia, con dolore di diversa etiologia, la somministrazione di FANS e paracetamolo dovrebbe essere effettuata per periodi limitati e con attenzione ai possibili effetti collaterali. Positiva debole (1) Qualità dell’evidenza SIGN: PRECEDE LA RACCOMANDAZIONE Nell’approccio SIGN, la qualità delle evidenze a sostegno della raccomandazione veniva valutata tenendo conto sia del disegno dello studio sia di come esso era stato condotto: il Livello di Evidenza veniva riportato nel testo a lato della descrizione dei soli studi ritenuti rilevanti a sostegno o contro uno specifico intervento. Livelli di Evidenza SIGN 1 Revisioni sistematiche e meta-analisi di RCT o singoli RCT 1 ++ Rischio di bias molto basso. 1+ Rischio di bias basso. 1Rischio di Bias elevato -> i risultati dello studio non sono affidabili. Revisioni sistematiche e meta-analisi di studi epidemiologici di caso/controllo o di coorte o 2 singoli studi di caso/controllo o di coorte. Rischio di bias molto basso, probabilità molto bassa di fattori confondenti, elevata probabilità 2 ++ di relazione causale tra intervento e effetto. Rischio di bias basso, bassa probabilità presenza fattori di confondimento, moderata probabilità 2+ di relazione causale tra intervento e effetto. Rischio di Bias elevato -> i risultati dello studio non sono affidabili, esiste un elevato rischio che 2la relazione intervento/effetto non sia causale. 3 Disegni di studio non analitici come report di casi e serie di casi. 4 Expert opinion. La Qualità Globale delle Evidenze SIGN veniva quindi riportata con lettere (A, B, C ,D) che sintetizzavano il disegno dei singoli studi, unitamente all’indicazione sulla diretta applicabilità delle evidenze e alla eventuale estrapolazione delle stesse dalla casistica globale. Ogni lettera indicava la “fiducia” nell’intero corpo delle evidenze valutate a sostegno della raccomandazione; NON riflettevano l’importanza clinica della stessa e NON erano sinonimo della forza della raccomandazione clinica. 6 LINEE GUIDA LINFOMI Qualità Globale delle Evidenze SIGN Almeno una meta-analisi o revisione sistematica o RCT valutato 1++ e direttamente applicabile alla popolazione target oppure A Il corpo delle evidenze disponibili consiste principalmente in studi valutati 1+ direttamente applicabili alla popolazione target e con risultati coerenti per direzione e dimensione dell’effetto Il corpo delle evidenze include studi valutati 2++ con risultati applicabili direttamente alla popolazione target e con risultati coerenti per direzione e dimensione dell’effetto. B Evidenze estrapolate da studi valutati 1++ o 1+ C Il corpo delle evidenze include studi valutati 2+ con risultati applicabili direttamente alla popolazione target e con risultati coerenti per direzione e dimensione dell’effetto. Evidenze estrapolate da studi valutati 2++ Evidenze di livello 3 o 4 D Evidenze estrapolate da studi valutati 2+ Dal 2016 le LG AIOM hanno abbandonato il SIGN in quanto quest’ultimo ha deciso di integrare il GRADE come metodo per la sola valutazione della qualità delle evidenze suddivisa in quattro livelli: MOLTO BASSA, BASSA, MODERATA, ALTA*. Per raccomandazioni prodotte dal 2016, infatti, la tabella delle raccomandazioni subisce delle leggere modifiche e si avvicina a quella derivante da tutto il processo formale GRADE. Qualità Globale delle evidenze ALTA Forza della raccomandazione clinica Raccomandazione I pazienti con tumore pN+ oppure sottoposti a intervento resettivo senza adeguata linfoadenectomia (<D2) o anche R1 devono essere sottoposti a radiochemioterapia adiuvante (68,73) Positiva forte (2) LA FORZA DELLA RACCOMANDAZIONE CLINICA La forza della raccomandazione clinica viene graduata in base all’importanza clinica, su 4 livelli: Forza della raccomandazione clinica Positiva Forte Positiva Debole Terminologia Significato “Nei pazienti con (criteri di selezione) l’intervento xxx dovrebbe essere preso inconsiderazione come opzione terapeutica di prima intenzione” “Nei pazienti con (criteri di selezione) l’intervento xxx può essere preso in considerazione come opzione terapeutica di prima intenzione, in alternativa a yyy” L’intervento in esame dovrebbe essere considerato come prima opzione terapeutica (evidenza che i benefici sono prevalenti sui danni) L’intervento in esame può essere considerato come opzione di prima intenzione, consapevoli dell’esistenza di alternative ugualmente proponibili (incertezza riguardo alla prevalenza dei benefici sui danni) 7 LINEE GUIDA LINFOMI Forza della raccomandazione clinica Terminologia Negativa Debole “Nei pazienti con (criteri di selezione) l’intervento xxx non dovrebbe essere preso in considerazione come opzione terapeutica di prima intenzione, in alternativa a yyy” L’intervento in esame non dovrebbe essere considerato come opzione di prima intenzione; esso potrebbe comunque essere suscettibile di impiego in casi altamente selezionati e previa completa condivisione con il paziente (incertezza riguardo alla prevalenza dei danni sui benefici) Negativa Forte “Nei pazienti con (criteri di selezione) l’intervento xxx non deve essere preso inconsiderazione come opzione terapeutica di prima intenzione” L’intervento in esame non deve essere in alcun caso preso in considerazione (evidenza che i danni sono prevalenti sui benefici) Significato (3) LA RACCOMANDAZIONE CLINICA Deve esprimere l’importanza clinica di un intervento/procedura. Dovrebbe essere formulata sulla base del P.I.C.O.* del quesito (popolazione, intervento, confronto, outcome). In alcuni casi può contenere delle specifiche per i sottogruppi, indicate con il simbolo √. * La descrizione complete delle metodologie applicate alle LG AIOM e la modalità di formulazione del quesito clinico sono reperibili sul sito www.aiom.it SIGN= Scottish Intercollagiate Guidelines Network GRADE= Grading of Recommendations Assessment, Development and Evaluation Le informazioni complete relative al processo GRADE sono riportate nel capitolo successivo a quello delle FIGURE. 8 LINEE GUIDA LINFOMI 1. Parte generale 1.1 Epidemiologia dei linfomi I Linfomi maligni rappresentano il quinto tipo di tumore per frequenza nel mondo occidentale, con una incidenza pari a circa 19-20 casi per 100.000 abitanti. L’incidenza dei linfomi è ampiamente influenzata da fattori geografici, razziali e temporali ed è superiore nei paesi industrializzati, nei soggetti di sesso maschile e di razza bianca. Dopo una fase epidemica che nei paesi occidentali ha portato ad un incremento dei casi di linfoma del 50% circa dagli anni ‘70 agli anni ’90, numerosi studi concordano sul fatto che l’incidenza delle malattie linfoproliferative si sia attualmente stabilizzata o registri solo incrementi minori. Le cause del notevole incremento del passato sono sicuramente da ascrivere al miglioramento diagnostico, e, almeno in alcune realtà, alla pandemia di infezione da HIV registrata negli anni ’80. In Italia si stima che ogni anno vengano diagnosticati circa 16.000 nuovi casi di linfoma con un incremento annuo pari all’ 1,3% [1]. Recentemente anche gli studi epidemiologici sulle malattie linfoproliferative stanno acquisendo la filosofia dei sistemi classificativi REAL/WHO che considerano i linfomi come un insieme di entità clinico-biologiche distinte. L’effetto è che anche dal punto di vista epidemiologico è stata documentata ampia variabilità tra i diversi tipi di linfoma. Accanto ai linfomi follicolari e ai linfomi a grandi cellule, per i quali è descritto un incremento di incidenza di circa 1,5%, è infatti riportata una riduzione dei casi di CLL del 2% circa [2]. Nonostante i soggetti di razza bianca registrino incidenza superiore per la maggior parte dei linfomi, altre malattie linfoproliferative come i linfomi a cellule T sono più frequenti nella razza nera. Nei soggetti di razza asiatica infine si registrano meno casi di CLL/SLL e di linfoma di Hodgkin [2]. 1.2 La diagnosi istopatologica La biopsia linfonodale è da considerarsi il “gold standard” nella diagnosi di linfoma. La diagnosi di linfoma infatti, è usualmente posta su sezioni istologiche ottenute da campioni linfonodali escissi chirurgicamente. Quando non si apprezzano linfonodi superficiali patologici, l’agobiopsia con ago grosso (Tru-cut) eco/TAC guidata è un’alternativa valida alla chirurgia diagnostica. Il campione bioptico è utilizzabile per un’ampia gamma di indagini, dalla istopatologia convenzionale, agli accertamenti immunoistochimici, agli studi di citometria a flusso e di genetica molecolare. A differenza dell’aspirazione con ago sottile (fine-needle), l’agobiopsia con ago grosso (Tru-cut) eco/TAC guidata ha il vantaggio di fornire un campione istologico anziché uno striscio citologico. La procedura con agobiopsia eco/TAC guidata è anche un metodo efficace per accertare ripresa di malattia o progressione di malattia in pazienti con diagnosi di linfoma già stabilita in precedenza [3]. Una corretta diagnostica dei linfomi maligni è fondata sull’appropriato trattamento del tessuto da esaminare, sull’istituzione di una refertazione standardizzata, sull’applicazione di principi classificativi moderni e sulle definizioni di requisiti minimi. 1.2.1 Trattamento dei campioni bioptici tissutali da esaminare Linee guida molto precise per il trattamento dei vari tessuti interessati da un linfoma sono state fornite dal Gruppo Italiano di Ematopatologia (GIE) [4] e sono reperibili sul sito della Società Italiana di Anatomia Patologica e Citodiagnostica/Divisione Italiana dell’International Academy of Pathology (SIAPEC/IAP) all’indirizzo www.siapec.it [5]. In linea di principio, si consiglia l’invio immediato a fresco del campione bioptico al Patologo, affinché quest’ultimo possa procedere alla criopreservazione di una parte di questo ed all’ottimale trattamento del restante. 9 LINEE GUIDA LINFOMI 1.2.2 Istituzione di una refertazione standardizzata Standardizzare la refertazione è il mezzo ottimale per assicurare che il referto patologico diagnostico includa le informazioni necessarie per il trattamento del paziente, l’accertamento di fattori prognostici e predittivi, il grading, lo staging, l’analisi degli outcome e i codici di registrazione tumorale [6]. Le informazioni minime da includere nel referto diagnostico finale sono: A. le principali e pertinenti informazioni clinico-anamnestiche; B. la descrizione macroscopica; C. le seguenti informazioni diagnostiche: 1. Tipo istologico. L’Associazione Italiana di Oncologia Medica raccomanda l’uso della WHO Classification of Tumors of the Hematopoietic and Lymphoid Tissues [7]. L’assegnazione di varianti morfologiche o cliniche é considerata opzionale per molti scopi clinici. Se viene utilizzata una classificazione alternativa, questa deve essere specificata nella diagnosi. 2. Studi speciali ad es. immunoistochimica, studi di genetica molecolare, virologici e citogenetici; la diagnosi o il commento dovrà contenere una frase che riguarda questi studi e le loro implicazioni diagnostiche. 1.2.3. Principi diagnostico-classificativi I linfomi corrispondono a diverse distinte entità patologiche, la cui diagnosi richiede la conoscenza dei seguenti fattori: - Morfologici; - Profili fenotipici; - Caratteristiche molecolari e citogenetica; - Informazioni cliniche. Tale assunto è stato fatto proprio dalla WHO, che lo ha codificato in due edizioni successive della “WHO Classification of Tumours of the Haematopoietic and Lymphoid Tissues”, delle quali la più recente é divenuta disponibile fra la fine del 2008 e l’inizio del 2009 [7]. “Neoplasia in situ” è un concetto ben consolidato nei tumori epiteliali. Solitamente questo è il primo step nel processo di accumulo di eventi genetici e molecolari che portano allo sviluppo e alla progressione del tumore. Negli ultimi anni, il concetto “neoplasia in situ” è stato trasferito anche nell’ambito dei linfomi. La Classificazione WHO del 2008 ha collocato il tema delle lesioni in situ tra i primi eventi nell'evoluzione della neoplasia linfoide [7]. In queste lesioni le cellule neoplastiche sono localizzate "nella sede" che è occupata dalla controparte normale della cellula tumorale, senza invasione delle strutture circostanti. I linfomi in situ sono stati riconosciuti sia per il linfoma follicolare che per il linfoma mantellare [7]. Per i linfomi HIV-associati si può fare riferimento al recente lavoro di Carbone e Colleghi [8]. I linfomi più comuni che insorgono in presenza di immunosoppressione associata ad HIV includono oggi il linfoma di Burkitt (BL) e il linfoma B diffuso a grandi cellule (DLBCL). È interessante notare, tuttavia, che linfomi che insorgono specificamente nei pazienti HIV positivi comprendono l’effusione linfomatosa primaria (PEL) (Linfoma delle cavità sierose) e la sua variante solida, il linfoma KSHV-associato correlato con la malattia di Castleman, e il linfoma plasmablastico (PBL), del cavo orale. La frequenza dei vari sottotipi di linfomi HIV-associati è la seguente: 50% per il DLBCL, 40% per il BL, e 10% per tutti gli altri sottotipi. Tra questi ultimi, sia il PEL che il PBL rappresentano il 3% ciascuno. 10 LINEE GUIDA LINFOMI 1.2.4. Nuovi principi di classificazione (ancora da sottoporre a verifica clinica) Recenti progressi nella comprensione dei meccanismi immunogenetici e nella conoscenza delle alterazioni genetico molecolari delle neoplasie ematopoietiche e in particolare linfoidi hanno consentito un approccio su base patogenetica della loro classificazione. Molti linfomi sono considerati distinte entità dal momento che hanno profili immunofenotipici caratteristici e alterazioni genetiche note e pertanto possono essere identificati attraverso tecniche di laboratorio disponibili diffusamente. La revisione 2016 della Classificazione WHO [9], originariamente pubblicata nel 2008, 1) meglio definisce alcune categorie (per esempio, le neoplasie follicolari o mantellari in situ, i linfomi diffusi a grandi cellule, il linfoma di Hodgkin a predominanza linfocitaria); 2) conferma e riconosce categorie che nella versione del 2008 erano state definite “provvisorie” (per esempio, il linfoma a cellule B, non classificabile, con aspetti intermedi fra il linfoma diffuso a grandi cellule e il linfoma di Hodgkin classico); 3) introduce nuove entità provvisorie (per esempio, il linfoma a grandi cellule B con riarrangiamento di IRF4/MUM1, il linfoma di Burkitt con aberrazione dell’11q – privo di riarrangiamento di MYC). Di seguito menzioneremo in breve soltanto le modifiche principali concernenti il linfoma follicolare, il linfoma diffuso a grandi cellule B, i linfomi a cellule B ad alto grado ed il linfoma di Hodgkin. Linfoma follicolare: viene dato il nuovo nome di “neoplasia follicolare in situ” al già chiamato linfoma follicolare in situ, perché il nuovo termine meglio riflette il basso rischio di progressione al linfoma franco. Vengono riconosciute come entità distinte il “linfoma follicolare di tipo duodenale”, una forma localizzata con basso rischio di disseminazione, ed il “linfoma follicolare di tipo pediatrico” una proliferazione clonale localizzata con prognosi eccellente, in bambini e giovani adulti. Linfoma diffuso a grandi cellule: recenti studi di next generation sequencing hanno dimostrato un profilo di alterazioni rappresentate differenzialmente nei due sottotipi germinal center B-cell like (GCB) (alterazione in EZH2, traslocazione di BCL2, mutazione in GNA13) e non GCB, chiamato activated B cell (ABC) (mutazioni in MYD88, CD79A, CARD11, TNFAIPA3 attivanti i pathways BCR e NFKB). Pertanto, si conferma la suddivisione dei linfomi diffusi a grandi cellule, NAS nei due gruppi GCB e non GCB (ABC). Tale distinzione, che può essere affidabilmente riconosciuta attraverso un algoritmo immunoistochimico, può influenzare la terapia. Nei linfomi diffusi a grandi cellule, NAS la coespressione di MYC e BCL2 (double expressor lymphoma) è considerato un nuovo marcatore prognostico. Il termine linfoma diffuso a grandi cellule, NAS EBV+ sostituisce il termine linfoma diffuso a grandi cellule dell’anziano, dal momento che tale linfoma può presentarsi in pazienti più giovani. Linfomi a cellule B ad alto grado: una nuova categoria è introdotta per designare i linfomi a cellule B ad alto grado con espressione di “double” o “triple hit”. La nuova categoria viene definita come linfoma a cellule B ad alto grado con traslocazione di MYC e di BLC2 e/o BCL6. Accanto a questa nuova categoria è presente un’altra categoria di linfoma a cellule B ad alto grado, NAS cioè mancante delle traslocazioni di MYC e di BLC2 e BCL6, che include linfomi a cellule B, a grandi cellule con morfologia blastoide e sostitutisce la categoria WHO 2008 del linfoma a cellule B non classificabile con aspetti intermedi fra il linfoma diffuso a grandi cellule ed il linfoma di Burkitt. Linfoma di Hodgkin: nel linfoma di Hodgkin a predominanza linfocitaria nodulare vengono riconosciute le varianti di pattern di crescita che includono anche la quantità delle cellule tumorali (rare vs numerose) e la loro distribuzione dominante (in sede intranodulare vs extranodulare). Le varianti devono essere riportate nel referto diagnostico, in quanto sono associate a differenti connotazioni cliniche. Viene ribadito che il linfoma di Hodgkin classico “lymphocyte rich” presenta aspetti intermedi fra il linfoma di Hodgkin a predominanza linfocitaria ed altri sottotipi del linfoma di Hodgkin classico, in termini di fenotipo della cellula tumorale e di background. La revisione 2016 della Classificazione WHO pubblicata nel 2008, tratta anche di altre entità linfomatose a cellule T e neoplasie istiocitiche/dendriche che non sono oggetto di considerazione delle presenti linee guida. 11 LINEE GUIDA LINFOMI 1.2.5. Requisiti minimi Requisiti minimi in immunoistochimica Si raccomanda di usare un algoritmo fenotipico basato sugli anticorpi inclusi nel panello rappresentato nella Figura a. Tale pannello offre un aiuto cruciale nel riconoscimento diagnostico e nella classificazione precisa della maggior parte dei linfomi a cellule B. Si ricorda tuttavia che non sono rari i casi in cui si osservano eccezioni ai fenotipi standard [10]. Figura a. Algoritmo immunofenotipico per la classificazione delle principali neoplasie linfoidi a cellule B mature Requisiti minimi in studi di genetica molecolare Si raccomanda di ottenere informazioni diagnostiche sulla clonalità dell’infiltrato linfoide (B o T cellulare) attraverso: Lo studio dell’espressione delle catene leggere K/λ mediante ISH (quando appropriato); Lo studio dei riarrangiamenti dei geni che codificano per le immunoglobuline e/o il T-cell receptor mediante PCR. Requisiti minimi in studi virologici Occorre almeno poter disporre di: Definizione dell’infezione da Epstein-Barr virus mediante ISH; Definizione dell’infezione da HHV8 mediante immunoistochimica. Requisiti minimi in studi citogenetici Allo stato attuale non previsti; è obbligatorio servirsi di un laboratorio di riferimento. 12 LINEE GUIDA LINFOMI 2. Linfomi diffusi a grandi cellule B 2.1 Epidemiologia I linfomi diffusi a grandi cellule B (DLBCL) rappresentano il sottogruppo più frequente di linfoma non Hodgkin (LNH) pari a circa il 30% di tutti i LNH. Dai dati del registro tumori di Modena [1] relativi al periodo 1997-2003, per i DLBCL risulta un’incidenza standardizzata per età pari a 4.8 casi/100.000 persone/anno (dati registro tumori 2000-2003, www.registro-tumori.it). 2.2 Classificazione istopatologica e Diagnosi Multidimensionale Nell’ambito dei casi che rispondono ai criteri diagnostici dei DLBCL, mancano aspetti patologici utili a stratificare ulteriormente i pazienti al fine di predire la prognosi, la risposta alla terapia, e in futuro la scelta stessa del trattamento. Recentemente, grazie allo studio dei profili di espressione genica, sono stati descritti tre principali sottotipi di DLBCL definiti “GCB”, “ABC” e “Mediastinici” sulla base delle analogie con un’ipotetica cellule d’origine, che presentano una diversa prognosi [11]. Il gruppo di pazienti con GCB DLBCL ha una sopravvivenza analoga al sottotipo “mediastinco” e significativamente migliore rispetto al gruppo ABC (OS 60% VS 35%, p < 0.0001) [12]. Uno studio del gruppo di Rosenwald ha registrato una più alta percentuale del sottotipo ABC nei pazienti di età superiore ai 60 anni [11]. Questo dato è stato confermato da uno studio retrospettivo condotto da Mareschal et al su 131 pazienti di età superiore ai 50 anni (età media alla diagnosi di 68 anni) riportando un significativo aumento del sottotipo ABC all’aumentare dell’età [13]. Simili risultati sono stati ottenuti dall’analisi dei dati dello studio di Lenz [14]. Sono stati fatti numerosi tentativi per replicare con tecnica immunistochimica la suddivisione dei DBLCL in base alla cellula d’origine ottenuta con lo studio di espressione genica ma i risultati sono stati insoddisfacenti. Ad oggi non esistono raccomandazioni per utilizzare il sottotipo DLBCL nella pratica clinica. Nell’ambito dei DLBCL vanno inoltre aggiunte le forme “non classificabili” con caratteristiche intermedie tra DLBCL e linfomi di Burkitt (BL), o B-UNC/BL/DLBCL. Queste forme hanno tipicamente un cariotipo complesso mostrando la doppia traslocazione bcl2 e C-MYC. Questi casi sono denoiminati “double hit”, e presentano dal punto di vista clinico una prognosi significativamente più infausta rispetto agli altri DLBCL. Classificazione WHO [7]: VARIANTI Varianti morfologiche comuni • Centroblastico • Immunoblastico • Anaplastico Varianti morfologiche rare SOTTOGRUPPI Sottogruppi molecolari • Germinal centre B-cell-like (GBC) • Activated B-cell like (ABC) Mediastinal DLBCL • Inclassificabili DLBCL- Burkitt o “double hit” Sottogruppi immunoistochimici • CD5-positive DLBCL • Germinal centre B-cell-like (GBC) • Non-germinal centre B-cell-like (non-GBC) 13 LINEE GUIDA LINFOMI SOTTOTIPI/ENTITA’ Linfoma a grandi cellule B ricco in istiociti e cellule T Linfoma diffuso a grandi cellule B primitivo del sistema nervoso centrale Linfoma diffuso a grandi cellule B primitivo cutaneo, leg type Linfoma diffuso a grandi cellule B dell’anziano EBV positivo Altri linfomi a grandi cellule B • Linfoma a grandi cellule B primitivo del mediastino (timico) • Linfoma a grandi cellule B intravascolare • Linfoma diffuso a grandi cellule B associato a infiammazione cronica • Granulomatosi linfomatoide • Linfoma a grandi cellule B ALK-positivo • Linfoma plasmablastico • Linfoma a grandi cellule B in soggetti con malattia di Castleman multicentrica associata a infezione KSHV • Linfoma delle cavità sierose (Primary effusion Lymphoma) CASI BORDERLINE Linfoma a cellule B, non classificabile, con caratteristiche intermedie tra linfoma diffuso a grandi cellule B e linfoma di Burkitt, o “double hit” . Il linfoma di Burkitt a istologia intermedia o i DLBCL CD10+ con un indice di proliferazione >90% con o senza caratteristiche simili al linfoma di Burkitt possono essere considerati per trattamenti più aggressivi come per il BURK-A. Per questi casi sarebbe appropriatao valutare i riarrangiamenti di BCL2, BCL6 e MYC. Linfoma a cellule B, non classificabile, con caratteristiche intermedie tra linfoma diffuso a grandi cellule B e linfoma di Hodgkin classico, o “gray zone lymphoma” DIAGNOSI MULTIDIMENSIONALE • Adeguata immunofenotipizzazione per stabilire la diagnosi • IHC panel: CD20, CD3, CD5, CD10,CD45, BCL2, BCL6, Ki67, IRF4/MUM1 oppure • Analisi dei marker cellulari di superficie mediante citometria a flusso: Kappa/Lamba, CD45, CD3, CD5, CD19, CD10, CD20 UTILE IN DETERMINATE CIRCOSTANZE • Studi immunoistochimici addizionali per stabilire il sottotipo di linfoma • IHC panel: CCND1, Kappa/Lambda, CD138, EBER-ISH, ALK, HHV8 • Analisi molecolari per ricercare riarrangiamenti genici dei recettori degli antigeni; riarrangiamenti CCND1, BCL2, BCL6, MYC mediante FISH o IHC • Citogenetica o FISH: t(14;18); t(8;14). 2.3 Stadiazione clinica La valutazione pre-trattamento di un paziente con nuova diagnosi di DLBCL prevede le indagini elencate nella Tabella 1, che permettono l’identificazione dello stadio di malattia come definito dalla classificazione di Ann Arbor/Cotswold [15]. 14 LINEE GUIDA LINFOMI Tabella 1. Indagini pre-trattamento per un paziente con nuova diagnosi di DLBCL (segue) * v paragrafo 2.4 ESAME Anamnesi ed esame obiettivo INDICAZIONE NOTE Obbligatori Emocromo e chimica clinica inclusi LDH Obbligatori e sierodiagnosi per HBV, HCV, HIV Biopsia osteomidollare monolaterale Obbligatoria dalla cresta iliaca posteriore Rx torace standard in 2 proiezioni Obbligatoria TC collo torace addome-pelvi con MDC Obbligatoria PET total body Altamente raccomandata Valutazione ORL Altamente raccomandata ECG + visita cardiologica Obbligatori Ecocardiogramma o MUGA scan per valutazione della frazione di eiezione Obbligatorio TC/RMN cerebrale, scintigrafia scheletrica, ecografia testicolare, studio radiologico e/o endoscopico del tratto gastroenterico Situazioni particolari In base alla sede di insorgenza Obbligatorio in situazioni particolari Presentazioni a rischio di diffusione meningea: SNC, testicolo, regioni paravertebrali/vertebrali, seni paranasali, palato duro, midollo osseo, IPI intermedio-alto o alto rischio* con LDH elevate e localizzazione in due o più sedi extranodali Esame citologico chimico-fisico del liquido cefalo-rachidiano RMN in caso di intolleranza/ controindicazione al MDC A tutti i pazienti giovani in età fertile devono essere resi noti i rischi di infertilità connessi alla chemioterapia e la necessità di evitare una gravidanza nel periodo del trattamento e almeno nei due anni successivi. Devono essere quindi proposti l’assunzione di estroprogestinico oppure la criopreservazione di tessuto ovarico/ovociti e, rispettivamente, la criopreservazione del liquido seminale. 2.4 Suddivisione in gruppi prognostici I DLBCL vengono suddivisi in gruppi prognostici in base all’Indice Prognostico Internazionale (IPI) [16] e all’ IPI “aggiustato per età” (age-adjusted IPI, aa IPI). I fattori che contribuiscono al calcolo dell’IPI sono: Età > 60 anni, LDH sieriche > UNL, Performance status > 2, Stadio Ann Arbor III-IV, Coinvolgimento > 1 sede extranodale. 15 LINEE GUIDA LINFOMI I fattori di rischio invece per il calcolo dell’aaIPI sono: LDH sierica > UNL, Performance status > 2, Stadio Ann Arbor III-IV. Le tabelle seguenti (Tabella 2; Tabella 3) illustrano la suddivisione in gruppi prognostici e le relative probabilità di RFS e OS in base all’IPI e all’aaIPI. Tabella 2. Indice Prognostico Internazionale Gruppo di rischio N fattori %RFS 5 anni % OS 5 anni BASSO 0-1 70 73 BASSO-INTERMEDIO 2 50 51 ALTO-INTERMEDIO 3 49 43 ALTO 4-5 40 26 Tabella 3. IPI aggiustato per età (aaIPI) , per pazienti di età < 60 anni Gruppo di rischio N fattori %RFS 5 anni % OS 5 anni BASSO 0-1 73 77 INTERMEDIO 2 66 51 ALTO 3 22 30 2.5 Trattamento dei DLBCL 2.5.1 Scelta del regime R-CHOP Il paziente con linfoma diffuso a grandi cellule B deve essere avviato a una chemioterapia contenente antracicline e associata a rituximab. Lo studio randomizzato del gruppo francese GELA [17] (Livello di evidenza 1++) ha confrontato 8 cicli CHOP e 8 cicli CHOP + rituximab (R-CHOP) in 399 pazienti di età compresa tra 60 e 80 anni. A 10 anni di follow-up, l’aggiunta di rituximab allo schema R-CHOP ha migliorato la sopravvivenza libera da progressione e la sopravvivenza globale del 6%, e la sopravvivenza libera da malattia per i pazienti con remissione completa del 22%. Analoghe le conclusioni del gruppo della Mayo Clinic [18] (Livello di evidenza 1++), in cui l’aggiunta del rituximab, somministrato simultaneamente o successivamente a CHOP, ha conferito un vantaggio in termini di sopravvivenza libera da progressione del 30% circa a due anni. Nell’analisi di popolazione effettuata dai ricercatori della British Columbia Cancer Agency sono stati confrontati i risultati terapeutici di 140 pazienti con DLBCL in stadio avanzato trattati con CHOP nei 18 mesi precedenti l’introduzione del rituximab nella pratica clinica e 152 trattati con R-CHOP nei primi 18 mesi dopo l’introduzione. Si è evidenziato un incremento della sopravvivenza globale dal 53% al 77% e della sopravvivenza libera da progressione dal 52% al 71%. Il vantaggio dell’aggiunta di rituximab è stato indipendente dall’età < o > 60 anni [19] (Livello di evidenza 2++). Nello studio randomizzato MinT (Mabthera International trial) [20] (Livello di evidenza 1++), 823 pazienti di età < 61 anni con DLBCL a basso rischio (IPI 0-1) hanno ricevuto 6 cicli CHOP (o CHOP-like o regimi di III generazione) versus i medesimi regimi con l’aggiunta di rituximab. Quest’ultima ha determinato un incremento della EFS del 18% (74 vs 56%) e della OS del 10% (90% vs 80%) a sei anni di follow up. Il gruppo tedesco [21] (Livello di evidenza 1++) ha confrontato, in pazienti anziani tra 61 e 80 anni, il trattamento con CHOP somministrato ogni 14 giorni (CHOP 14) con R-CHOP sempre somministrato ogni 14 giorni (R-CHOP 14) per sei vs otto cicli. 16 LINEE GUIDA LINFOMI L’aggiunta di rituximab a 6 cicli di CHOP 14 ha determinato un incremento di EFS del 19.3 % (66.5 vs 47.2%) e di OS del 10.4% (78.1% vs 67.1%) rispetto alla sola chemioterapia. Nel primo decennio del nuovo millennio diversi gruppi hanno proposto la terapia dose-dense con R-CHOP ogni 14 giorni. Più recentemente due studi randomizzati uno francese e uno inglese hanno riportato i dati di confronto fra R-CHOP 21 con il dose-dense R-CHOP 14 senza trovare alcuna differenza significative tra le due schedule in termini di PFS, OS e EFS. Si è confermata invece una maggiore tossicità midollare con neutropenia di grado 3 o 4 nel braccio dose-dense che ha richiesto un maggiore utilizzo di G-CSF [22, 23]. In conclusione, in base agli studi randomizzati disponibili è possibile concludere che lo schema di riferimento per il paziente anziano con DLBCL è rappresentato dall’ immunochemioterapia R-CHOP somministrata per 6 cicli con intervallo interciclo di tre settimane seguita da 2 dosi aggiuntive di rituximab. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica A Il regime R-CHOP dovrebbe essere utilizzato in tutti i pazienti con DLBCL indipendentemente dal gruppo di rischio [17, 18, 20, 21]. Positiva forte 2.5.2 Stadi localizzati (I-II) favorevoli (IPI 0, non bulky) (Very favorable MiNT) Due studi randomizzati hanno dimostrato una maggior efficacia terapeutica della chemio-radioterapia rispetto alla sola chemioterapia. Nello studio SWOG [24] la sopravvivenza libera da progressione e la sopravvivenza globale sono risultate significativamente migliori nei pazienti trattati con 3 CHOP seguiti da radioterapia tipo involved fields con dosi di 36 Gy, rispetto ai pazienti trattati con sola chemioterapia (8 CHOP), pur in presenza di una progressiva riduzione di tale differenza ad una successiva e più recente analisi [25]. Nello studio ECOG [26] 172 pazienti in remissione completa dopo 8 cicli CHOP sono stati randomizzati tra radioterapia involved fields con dosi di 30 Gy e sola osservazione, con sopravvivenze libere da malattia a 6 anni rispettivamente pari al 73% e 56% (p=0.05). La reale necessità di radioterapia al termine di un programma chemioterapico viene posta in discussione dai risultati di due studi randomizzati francesi, condotti rispettivamente su pazienti giovani (chemioterapia intensiva ACVBP) [27] e su pazienti anziani (4 cicli CHOP) [28], capaci di dimostrare analoghi risultati terapeutici indipendentemente dall’aggiunta della radioterapia; questa risulta anzi in una sopravvivenza globale inferiore per i pazienti anziani (> 69 anni), in relazione ad un possibile contributo di morbidità iatrogena (involved fields 40 Gy); nei giovani, devono viceversa essere segnalati i possibili problemi di tossicità tardiva (secondi tumori) di una chemioterapia dose-dense quale lo schema ACVBP. Lo scenario attuale si è ulteriormente modificato in seguito all’aggiunta del rituximab alla chemioterapia anche negli stadi localizzati. E’ sicuramente corretto pensare a opzioni terapeutiche personalizzate definite sulla base del calcolo degli score prognostici: IPI [16] e IPI modificato per gli stadi iniziali. Quest’ultimo si differenzia dall’IPI generale solo per il fatto che lo stadio II è considerato un fattore prognostico sfavorevole rispetto allo stadio I [29, 30]. I pazienti in stadio localizzato (I e II1) e a buona prognosi (IPI 0), in assenza di malattia bulky (very favorable MinT) hanno come standard terapeutico di riferimento una breve chemioimmunoterapia (3-4 cicli), con regimi contenenti antracicline (R-CHOP o R-CHOP like), seguita da una radioterapia di consolidamento con dosi di 30 Gy [31]. Infatti in uno studio inglese su 460 pazienti, che randomizzava 45 vs 30 Gy, non si rilevano differenze in termini di incidenza di remissioni complete e durata di risposta (Livello di evidenza 1++). L’eventuale omissione della radioterapia nei pazienti in remissione completa, documentata anche mediante ristadiazione funzionale (PET), non è attualmente da considerarsi convenzionale al di fuori di uno studio clinico controllato, sottolineando peraltro come l’eventuale alternativa ad una radioterapia di consolidamento debba prevedere un numero di cicli totale di chemioterapia decisamente maggiore a quello di una strategia combinata (6 cicli versus 3-4 cicli). 17 LINEE GUIDA LINFOMI Va ancora ricordato che da una parte la maggior parte degli studi randomizzati relativi al ruolo della radioterapia appartengono all’era “pre-rituximab”, ma dall’altra non vi sono ancora molti dati riguardo l’omissione della radioterapia dopo R-CHOP [32]. Oltre al già citato studio di Lowry et al, un lavoro retrospettivo dell’MDACC relativo a 469 pazienti affetti da DLCL (190 dei quali in stadio iniziale) e trattati con R-CHOP ± radioterapia, ha dimostrato il ruolo protettivo della radioterapia di consolidamento (eseguita in 142 pazienti) sia in termini di PFS che di OS [33]. Qualità dell’evidenza SIGN B Raccomandazione clinica Nei pazienti in stadio localizzato I e II e con IPI 0 in assenza di malattia bulky possono essere somministrati 3-4 cicli di chemioimmunoterapia (R-CHOP 21) seguiti da radioterapia IF con dosi di 30 Gy, se le localizzazioni di malattia risultano includibili in volumi radioterapici ragionevoli (stadi I e II1) [31]. Forza della raccomandazione clinica Positiva forte √ In alternativa, secondo la presentazione clinica, può essere utilizzato un ciclo completo di chemioimmunoterapia RCHOP 21 per 6 cicli senza radioterapia. 2.5.3 Stadi avanzati favorevoli (III-IV, IPI 1) e stadi iniziali sfavorevoli (bulky e/o IPI 1) Il trattamento standard dei pazienti in stadio III-IV oppure I-II sfavorevole (bulky e/o incremento LDH e/o compromissione del PS) è rappresentato da 6-8 cicli di chemio-immunoterapia secondo schema RCHOP/CHOP-like [34] (Livello di evidenza 1++) che attualmente è il regime terapeutico con il miglior rapporto costo-beneficio (vedi studio MinT paragrafo 2.5.1). Il vantaggio di R-CHOP rispetto a CHOP si mantiene anche quando il rituximab è associato allo schema CHOP eseguito ad intervalli ridotti (RCHOP14) nel paziente anziano [21, 35]. Il gruppo francese GELA ha randomizzato 379 pazienti con aaIPI pari a 1 a ricevere R-CHOP oppure trattamento intensificato con R-ACVBP e successiva intensificazione e ha osservato un vantaggio per il gruppo trattato con terapia intensificata in termini sia di EFS che di PFS che di OS [36]. Tuttavia, due grandi studi randomizzati, uno francese e uno inglese, concludono che una volta inserito il rituximab la superiorità della terapia dose dense (R-CHOP 14) rispetto allo standard (R-CHOP 21) non è confermata [22, 23]. Nel paziente in stadio localizzato sfavorevole la chemioimmunoterapia R-CHOP è seguita dalla radioterapia IF sulle sedi originali di malattia, con dosi totali di 30 Gy in frazionamento convenzionale [24-26, 32] (Livello di evidenza 1++). L’eventuale omissione della radioterapia in base alla risposta PET non è attualmente da considerasi convenzionale al di fuori di uno studio clinico controllato [37]. In assenza di studi clinici randomizzati ben disegnati a valutare il reale contributo terapeutico nella malattia avanzata, il ruolo della radioterapia quale consolidamento post-chemioterapia è attualmente discusso ed appare limitato, in assenza di dati certi che ne possano sostenere un impiego routinario. In casi selezionati di persistenza localizzata di malattia, la radioterapia potrebbe avere un ruolo importante nell’eventuale conversione in RC: le dosi consigliate sono di 36-40 Gy, in frazionamento convenzionale, da somministrare a circa 4 settimane dalla fine del programma chemioterapico su volumi che tengano conto della presentazione iniziale, della risposta alla chemioterapia e del residuo di malattia valutabile all’imaging morfologico e/o funzionale. Per quanto riguarda il consolidamento della risposta (RC al termine della chemioimmunoterapia), nei pazienti con linfoma in stadio localizzato, rimane ancora da chiarire il reale contributo dell’irradiazione delle lesioni inizialmente bulky (diametro massimo compreso tra 5 e 10 cm). In un’analisi “esplorativa” sugli 823 pazienti trattati nel protocollo MinT, il gruppo tedesco conclude che il rituximab riduce il rischio di recidiva legato alle dimensioni massime della massa tumorale, ma non lo annulla: qualsiasi cut-off dimensionale 18 LINEE GUIDA LINFOMI compreso tra 5 e 10 cm di diametro massimo della massa tumorale separa due catorie prognosticamente differenti; per convenzione, e in considerazione dei dati storici, viene confermato il limite dei 10 cm [38]; al riguardo, l’indicazione al trattamento radioterapico è spesso condizionata nel singolo caso da valutazioni relative al rapporto rischio-beneficio (sede, età, pattern di risposta) (Livello di evidenza 2++). Nell’era PET, recenti segnalazioni suggeriscono l’indicazione a irradiare le singole regioni con captazione residua indipendentemente dall’estensione bulky all’esordio: si tratta tuttavia di valutazioni retrospettive [39]. Le dosi consigliate sono di 30-36 Gy, in frazionamento convenzionale, da somministrare a 4 settimane circa dal termine della chemioterapia sulla presentazione iniziale bulky, tenendo però conto della risposta ed aggiungendo adeguati margini. Qualità dell’evidenza SIGN A B Raccomandazione clinica I pazienti in stadio avanzato favorevole (II-IV, IPI 1) e in stadio localizzato sfavorevole (stadio I-II con malattia bulky e/o con IPI 1) dovrebbero essere trattati con 6-8 cicli di chemioimmunoterapia (R-CHOP) [34]. In presenza di malattia Bulky alla diagnosi, alla fine della chemioterapia può essere somministrata radioterapia IF sulla sede Bulky in origine, con dosi totali di 30 Gy in frazionamento convenzionale [24-26, 32]. Forza della raccomandazione clinica Positiva forte Positiva debole* * La forza della raccomandazione non può essere forte perché negli studi disponibili non è mai stata utilizzata una valutazione della risposta con PET. 2.5.4 Stadi avanzati sfavorevoli (aaIPI>2) nel paziente di età < 65 anni Il trattamento standard dei pazienti in stadio III-IV oppure I-II sfavorevole (bulky e/o incremento LDH e/o compromissione del PS) è rappresentato da 6-8 cicli di chemio-immunoterapia secondo schema RCHOP/CHOP-like [34] (studio Mint vedi paragrafo 2.5.1) (Livello di evidenza 1++). Per questo gruppo di pazienti, la cui prognosi rimane ancora grave, sono in corso trials clinici di confronto tra regimi dose-dense, tipo R-CHOP14, e terapia ad alte dosi (high-dose chemotherapy, HDC) con supporto di cellule staminali autologhe. In letteratura sono presenti diversi studi randomizzati che hanno confrontato l’impiego della HDC in pazienti considerati a cattiva prognosi sulla base della presenza di alcuni fattori prognostici ed in alcuni studi con una post-hoc riclassificazione secondo IPI [40-55]. I risultati sono nel complesso contrastanti con alcuni studi che hanno definito un vantaggio per l’uno o l’altro approccio terapeutico. Tali differenze sono dovute ai diversi criteri di inclusione utilizzati e alle varie linee chemioterapiche di induzione somministrate, sia in termini di dosi che di numero totale di cicli. Due metanalisi hanno valutato l’impatto della HDC con supporto di cellule staminali autologhe [56, 57]. Dall’analisi di Strehl et al. [56] (11 studi randomizzati - 2228 pazienti), la mortalità globale non è risultata significativamente differente tra i pazienti trattati con HDC o chemioterapia convenzionale; tuttavia quando si è suddivisa la popolazione in sottogruppi (18 sottogruppi considerati), la HDC è risultata migliorare la sopravvivenza nella popolazione considerata se: i) il drop-out nel braccio HDC era inferiore al 25% [40, 42, 47, 48, 51], ii) i pazienti con IPI intermedio-alto e alto ricevevano una terapia di induzione completa prima della HDC [41, 46], iii) veniva applicata la terapia ad alte dosi sequenziale [48, 51]. In seguito tuttavia lo studio Mistral, pubblicato nel 2006 [58], non ha dimostrato un vantaggio della terapia ad alte dosi sequenziale rispetto alla terapia convenzionale. Nella metanalisi di Greb et al. [57, 59] (15 studi randomizzati - 2758 pazienti) la HDC non portava a un miglioramento della OS; suddividendo però i pazienti in gruppi in base all’IPI, la HDC sembrava aumentare la sopravvivenza di quelli ad alto rischio. Al contrario, la EFS non è risultata differente nei due gruppi di rischio. 19 LINEE GUIDA LINFOMI Infine, in uno studio di farmaco-economia effettuato sui dati generati da uno studio randomizzato [47], è stato dimostrato che in pazienti a rischio intermedio-alto secondo l’IPI, la HDC rappresenta una terapia migliore in termine di costo-efficacia rispetto alla terapia convenzionale [60]. In conclusione nel paziente giovane con aaIPI 2-3 la HDC è da considerarsi un’opzione adeguata a discrezione dei curanti, anche se è auspicabile l’arruolamento in protocolli prospettici randomizzati. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica A I pazienti in stadio avanzato sfavorevole (aaIPI 2-3 ) di età <65 anni dovrebbero essere trattati con 6-8 cicli di chemioimmunoterapia (R-CHOP) [34]. Positiva forte 2.5.5 Pazienti non in remissione completa al termine della terapia di prima linea In questi casi la non RC va considerata, di fatto, come un fallimento della terapia di prima linea e i pazienti vanno pertanto avviati al trattamento di salvataggio. Fanno eccezione i casi con RP caratterizzata da focale residuo di malattia alla PET. In una valutazione retrospettiva del gruppo canadese di 196 pazienti trattati con 6 cicli R-CHOP e radioterapia sui residui PET irradiabili, i casi irradiati hanno mostrato una FFP a 3 anni sovrapponibile a quella di pazienti in remissione completa (PET negativa) dopo R-CHOP [61]. Pertanto nei casi con residuo PET unico e irradiabile al termine della chemioimmunoterapia R-CHOP potrebbe essere indicata la radioterapia. 2.5.6 Terapia di salvataggio I pazienti con malattia in recidiva o refrattaria alla prima linea vanno avviati a una chemioterapia di salvataggio seguita, se la malattia si dimostra chemiosensibile, da HDC con supporto cellulare autologo [62] (Livello di evidenza 1++). Lo studio PARMA, fase III randomizzato pubblicato nel 1995, riguarda 215 pazienti con linfoma aggressivo recidivato o refrattario, avviati a terapia di seconda linea. I 109 casi con risposta parziale o completa dopi due cicli DHAP, sono stati assegnati a due ulteirori cicli DHAP oppure a consolidamento ad alte dosi con supporto di cellule staminali. EFS e OS a 5 anni sono risultate significativamente superiori per i pazienti del gruppo “alte dosi” (EFS 46 vs12%, p 0,001; OS 53 vs 32, p 0.038). I risultati della sequenza CT di salvataggio-HDC sono stati stigmatizzati dallo studio randomizzato CORAL [63], in cui per tutti i pazienti inclusi la OS e la PFS a 3 anni sono rispettivamente 49% e 37%. In questo studio si conclude anche che non vi è differenza nell’uso dei diversi schemi di induzione RDHAP o RICE prima del consolidamento ad alte dosi. I fattori prognostici fondamentali nei pazienti con DLBCL recidivato-refrattario sono 1) la chemioresistenza alla terapia di prima linea e la durata della risposta alla terapia di prima [63, 64] 2) la risposta alla terapia di salvataggio [64, 65] 3) l’IPI alla recidiva o progressione [64, 66-70] 4) il precedente trattamento con rituximab [63, 71, 72] 5) lo stato della malattia al momento del trapianto, valutato tramite PET [73-81]. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica A Il paziente con linfoma recidivato/refrattario responsivo alla terapia di salvataggio dovrebbe essere avviato al trattamento ad alte dosi [62]. Positiva forte 20 LINEE GUIDA LINFOMI 2.5.7 Condizionamento: ruolo del rituximab e della radioimmunoterapia Gli schemi utilizzati nei programmi di HDC sono variabili, senza che un condizionamento si sia dimostrato superiore ad altri principalmente per la mancanza di studi randomizzati, tranne uno di confronto tra BEAM e BEAC con un vantaggio di EFS e OS per BEAM. Per quanto riguarda gli schemi di condizionamento, l’associazione BEAM rimane ancora il riferimento pur in assenza di studi randomizzati. Diversi studi hanno riportato risultati sovrapponibili e tossicità accettabile con schemi analoghi come FEAM (con fotemustina) e BEAM (con bendamustina). Nella tabella 4 sono riportati i principali studi in cui si confrontano i vari schemi di condizionamento e nella tabella 5, i dati ottenuti in studi utilizzando schemi alternativi al BEAM. É da notare che un solo studio ha preso in considerazione solo pazienti con DLBCL [82-94]. Tabella 4. Studi retrospettivi in cui BEAM é stato confrontato con altri regimi di condizionamento Autore Salar 2001 Jantunen 2003 Wang 2004 Puig 2006 Jo 2008 Zaucha 2008 Liu 2010 Kim 2011 N Istologia Schema OS PFS TRM 365 DLBCL CyTBI vs ≈30% ≈30% 14% BEAM vs BEAC vs CBV BEAM vs BEAC BEAM vs CEB BEAM vs CBV BEAM vs BEAC BEAM vs BuMelTT BEAM vs CyTBI-E BEAM vs BuCyE ≈60% ≈50% 7% 65% vs 55% 84% vs 60% / 55% 9% vs 3% 72% vs 58% / 0 vs 11% 63% vs 32% 50% vs 65% 63% vs 53% 40% vs 40% 62% vs 28% 28% vs 50% 50% vs 50% 45% vs 40% Schema OS PFS TRM CyTBI-E vs BuMelTT ivBuCyE (vs osBuCyE) CyTBI-E vs BuMelTT 44% 42% 32% 34% 16% 21% 58% vs 28% 17% 3% vs 28% 54% vs 63% 50% vs 50% 8% vs 4% 36 vs 36 20 vs 52 38 vs 75 28 vs 69 48 vs 59 46 vs 27 43 vs 22 Varie Varie Varie Varie Varie Varie Varie 7% vs 25% 7% vs 7% 0 vs 10% 2% vs 7% 4% vs 9% Tabella 5. Risultati ottenuti con schemi alternativi al BEAM. Autore N Istologia 351 Varie Aggarwal 2006 31 vs 18 LNH Liu 2010 26 vs 47 Varie Musso 2010 84 Varie FEAM / / 2.4% Carella 2010 81 Varie TEAM / 85% 1% Visani 2011 43 Varie BeEAM 90% 70% 0 Gutierrez Delgado 2001 Tuttavia, in assenza di studi controllati, il regime BEAM rimane ancora lo schema di condizionamento di riferimento prima della reinfusione delle cellule staminali autologhe. 21 LINEE GUIDA LINFOMI Oggi è da considerarsi obsoleto un regime di condizionamento contenente TBI [95]. Di conseguenza, gli schemi utilizzati comprendono diverse combinazioni di farmaci, principalmente alchilanti, antimetaboliti e inibitori delle topoisomerasi, che risultano ben tollerati con una tossicità prevalentemente mucosa [96]. L’aggiunta di rituximab a dosi e con tempi di somministrazione variabili ha permesso di migliorare i risultati clinici. Khouri et al [97] hanno confrontato i risultati ottenuti associando al BEAM il rituximab durante la mobilizzazione, il condizionamento e anche dopo HDC. Con questo schema, rispetto a quanto osservato in un gruppo senza rituximab, la DFS era 67% vs 43% e la OS era 80% vs 53%, in favore dello schema con rituximab. Va tuttavia sottolineato che queste considerazioni sono state pubblicate in epoca precedente all’uso sistematico del rituximab in prima e seconda linea, e pertanto potrebbe risultare oggi annullata la differenza nell’uso di rituximab nella fase “pericondizionamento”. Infine anche i radioimmunoconiugati (RIT), quali l’90Yittrio Ibritumomab (Zevalin) e il 131I Tositumomab (Bexxar), iniziano ad essere integrati nel condizionamento prima della reinfusione delle cellule staminali autologhe. Il razionale per l’uso dei RIT è nella supposta efficacia della radioterapia nell’eradicare le cellule linfomatose, senza aumentare il danno su tessuti sani. In generale, finora sono stati pubblicati solo studi di fase I e II che possono essere suddivisi in funzione della dose di RIT e della associazione o meno con chemioterapici ed includendo popolazioni di pazienti con differenti istologie. I risultati sono promettenti in termini di PFS e OS con tossicità moderata [98-101]. Si tratta di studi eterogenei per selezione dei pazienti, dosaggio e schedula di somministrazione di RIT, pertanto difficilmente paragonabili tra loro con conseguente difficoltà a trarne conclusioni solide. Pertanto l’aggiunta dei radioimmunoconiugati ai regimi di condizionamento è da considerarsi solo nell’ambito di studi clinici controllati. 2.5.8 Trapianto allogenico Il ruolo del trapianto allogenico nella strategia terapeutica del DLBCL deve essere ancora definita. La tendenza attuale è di sottoporre pazienti avanzati, possibilmente chemiosensibili, spesso ricaduti dopo HDC con supporto autologo o con recidiva dopo diverse linee di terapia, al trapianto allogenico preceduto da un condizionamento di intensità ridotta (reduced intensity regimen, RIC), al fine di diminuire la TRM, per poter sfruttare l’effetto “graft versus lymphoma”. In vari studi sono riportati i risultati ottenuti in pazienti con linfoma aggressivo, tra cui il DLBCL, utilizzando un condizionamento mieloablativo (myeloablative conditioning, MAC) [102-108]. Nei trial in cui il trapianto allogenico è stato confrontato con l’autologo [102, 104, 109], la OS è risultata al meglio identica e molto spesso inferiore a causa della elevata TRM. Ma ciò che è importante sottolineare è la dimostrazione della esistenza di un effetto immunologico contro le cellule di linfoma, testimoniato dalla frequenza di ricadute post-allo inferiore rispetto a quanto osservato dopo HDC. Da circa un decennio una serie di studi hanno riportato che l’uso di RIC riduce la TRM, permettendo un più ampio utilizzo del trapianto allogenico. Dodici sono stati gli studi più significativi condotti sul trapianto allogenico con condizionamento RIC [110121]. Il confronto con gli studi precedenti è difficile soprattutto per la differenza delle caratteristiche generali (di solito i pazienti sottoposti a RIC hanno un’età maggiore con un numero significativo di comorbidità) e specifiche legate alla malattia (più linee di terapia, ricadute dopo autologo). Nonostante questi limiti, la TRM è nella maggior parte dei casi ridotta ed in alcune serie la sopravvivenza è particolarmente significativa. Il valore prognostico della presenza di comorbidità è stato sottolineato da alcuni studi del Fred Hutchinson Cancer Research Center [122]. Questo score definito HCT-CI (hematopoietic cell transplantationcomorbidity index), permette di individuare almeno 3 gruppi di pazienti con un rischio di mortalità trapiantologica significativamente differente. Lo stesso score è stato successivamente adattato ai pazienti con linfoma e leucemia linfatica cronica [121] e da questa analisi è risultato che i pazienti con uno score di 0 hanno la stessa TRM qualunque sia il tipo di condizionamento, RIC o MAC. Al contrario, per valori superiori, i regimi MAC sono gravati da una TRM crescente e da una riduzione della OS. Lo stesso score è stato anche valutato in pazienti con linfoma che hanno ricevuto solo RIC. Nello studio italiano, l’analisi effettuata in pazienti con linfoma e mieloma, tutti condizionati con RIC, ha validato lo score di Sorror, che ha permesso di suddividere i pazienti in 3 gruppi (HCT-CI 0, 1-2, >3) con TRM, PFS e OS significativamente differenti [123]. 22 LINEE GUIDA LINFOMI La casistica americana, con un numero più basso di pazienti ma trattati in modo uniforme, conferma l’influenza dell’HCT-CI solo sulla TRM con modalità di segregazione differente (HCT-CI 0-2 vs >3) [120]. Altri studi hanno recentemente analizzato i risultati ottenuti con il trapianto allogenico nei pazienti con DLBCL. La qualità metodologica di questi studi è limitata in quanto si tratta in ogni caso di studi retrospettivi, da registro e con diversi bias di selezione [124, 125]. In entrambi gli studi, circa il 30% dei pazienti riceveva un condizionamento mieloablativo, che era gravato da una maggiore NMR nello studio EBMT, mentre non risultava avere un peso prognostico nello studio italiano, in cui la NMR era influenzata solo dal tipo di donatore (alternativo vs HLA identico). In uno studio del registro americano (CIBMTR), Lazarus et al. [126] sono stati confrontati i risultati ottenuti in pazienti con DLBCL con la HDC o con un trapianto allogenico da donatore familiare HLA identico preceduto da un condizionamento mieloablativo. Le 2 coorti di pazienti presentano caratteristiche differenti, con una maggiore presenza di fattori prognostici negativi nel gruppo allogenico. I risultati sono stati che la TRM è più alta dopo allogenico durante il primo anno di follow up (41 % vs 12%), per poi essere simile, mentre l’incidenza di ricaduta a 1, 3 e 5 anni (33% vs 30%, 37% vs 33%, 40% vs 33%, rispettivamente) non differisce statisticamente, e la PFS (56% vs 29%, 47% vs 24%, 43% vs 22%) e OS (66% vs 33%, 53% vs 26%, 49% vs 22%) risultano essere migliori nel gruppo HDC. In conclusione il trapianto allogenico può avere un ruolo nella strategia terapeutica del DLBCL recidivato/refrattario, ma comunque sempre e solo nell’ambito di uno studio clinico. 2.5.9 Terapia per i pazienti non candidabili a trapianto autologo di cellule staminali I pazienti ricaduti dopo trapianto autologo di cellule staminali o non candidabili a tale procedura hanno una prognosi infausta a breve termine. Ad oggi non esistono evidenze sufficenti per formulare raccomandazioni per la scelta terapeutica di questa fase della malattia pertanto la definizione del programma terapeutico deve essere basata sulla valutazione del singolo paziente optando se disponibile per l’arruolamento in uno studio clinico controllato. 2.6 Trattamento del paziente anziano Il linfoma diffuso a grandi cellule B rappresenta il sottotipo più comune di LNH nella popolazione anziana. Benché l’età costituisca di per sé un fattore prognostico negativo, oltre il 50% degli anziani che possono essere sottoposti a chemioterapia curativa, ha la prospettiva di guarire dal linfoma. Nelle decadi passate, studi clinici prospettici nel sottogruppo degli anziani hanno mostrato ottimi risultati terapeutici anche in questa popolazione di difficile gestione e cura. Per il paziente anziano in buone condizioni generali sono applicabili le evidenze precedentemente descritte che identificano nella terapia RCHOP lo schema di riferimento. Il problema maggiore nella trattazione del linfoma a grandi cellule dell’anziano è rappresentato dalla scelta del trattamento nei casi in cui al linfoma si aggiunge la presenza di copatologie, di situazioni di inabilità o ridotta funzione che condizionano in maniera significativa la scelta terapeutica [127]. Questi pazienti non sono rappresentati negli studi randomizzati precedentemente menzionati e ad essi non possono essere direttamente applicate le raccomandazioni fatte per il paziente senza comorbidità. In assenza di studi randomizzati condotti specificatamente per la popolazione dei pazienti anziani o fragili i livelli di evidenza sono molto bassi e si basano su scelte empiriche condivisibili e sui risultati di studi di fase II. In questo contesto un primo obbiettivo è quello di rendere oggettiva la valutazione del paziente. In un modello semplificato della valutazione geriatrica l’età ha rappresentato e attualmente rappresenta ancora un criterio decisionale fondamentale. L’utilizzo dell’età tuttavia richiede un consenso sulla definizione del paziente anziano da sottoporre a trattamento alternativo rispetto allo standard che è difficile da indentificare per soggetti di età inferiore a 80 anni. 23 LINEE GUIDA LINFOMI Accettando l’età di 80 anni come definizione empirica del soggetto anziano la letteratura offre alcune evidenze, da studi non randomizzati, per formulare raccomandazioni. Tra gli studi disponibili il gruppo GELA ha pubblicato i risultati di uno trial multicentrico valutando l’efficacia terapeutica e la tossicità dello schema R-mini CHOP che prevedeva l’utilizzo di dosi inferiori di CHOP e dosi convenzionali di Rituximab in 149 pazienti affetti da DLBCL di età superiore agli 80 anni. Dopo un follow up medio di 20 mesi la OS e la PFS a 2 anni sono risultate rispettivamente pari a 59% e 47% [128] (Livello di evidenza 3). Nei pazienti anziani e nei cardiopatici può essere inoltre consigliata la sostituzione della doxorubicina liposomiale dello schema CHOP con la forma liposomiale non pegilata, schema R-COMP riducendo la tossicità del trattamento senza modificarne l’efficacia come mostrato dallo studio eur018 condotto su 75 anziani con una PFS a 3 anni del 69% [129-131] (Livello di evidenza 3). Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica D Il regime R-mini CHOP può essere considerato un regime standard nei pazienti anziani (>80 anni) con DLBCL[128]. Positiva debole D Il regime R-COMP può essere utilizzato nei pazienti anziani o nei soggetti fragili o nei soggetti cardiopatici indipendentemente dal gruppo di rischio [129-131]. Positiva debole Il complesso profilo medico dell’anziano deve tuttavia tenere conto di numerose variabili quali la presenza di comorbilità, l’assunzione di farmaci concomitanti, la ridotta riserva midollare, la compromissione dello stato cognitivo e psico-emotivo che richiedono un approccio interdisciplinare e multidimensionale geriatrico e oncologico. A tal fine è sicuramente utile valutare il paziente tramite strumenti di Valutazione Geriatria Multidimensionale (VGM) quali strumenti di screening in grado di individuare almeno tre categorie funzionali di pazienti: - Paziente fit, funzionalmente indipendente e privo di comorbilità elegibile ad un trattamento con intento curativo di tipo standard - Paziente unfit, con riserve d’organo tali da imporre riduzione di dose dei farmaci o l’utilizzo di farmaci a basso profilo di tossicità - Paziente fragile, con importanti limitazioni funzionali e/o comorbidità, candidato a ricevere terapia a finalità palliativa La VGM prevede l’utilizzo di scale di misura quali la determinazione del performance status (karnofsky o ECOG), dello stato funzionale secondo la scala Activities of daily living (ADL), la presenza di comorbilità secondo la scala Cumulative Illness Rating Scale (CIRS-G) oltre al criterio cronologico e alla presenza di almeno una sindrome geriatrica valutata tramite il MMSE. L’utilizzo della valutazione geriatrica multidimensionale, all’interno di studi prospettici, quale strumento per definire in maniera standardizzata la categoria di rischio di ogni paziente, potrebbe oggi rappresentare un buon approccio nell’ambito di un piano di cura personalizzato. Interessante è lo studio del trattamento pre-phase al fine di ridurre le possibili tossicità correlate alla chemioterapia. L’utilizzo di prednisone nei 7 giorni precedenti l’inizio del trattamento, da solo o con 1 mg di vincristina potrebbe essere considerato per i pazienti di tutte le età ma soprattutto negli anziani più fragili. Si è apprezzata infatti una riduzione della tossicità midollare e del numero di casi di sindrome da lisi tumorale nei pazienti trattati con R-CHOP [21]. È necessario però valutare i rischi e i benefici di un trattamento corticosteroideo in pazienti anziani che molto spesso presentano comorbilità come il diabete. Nonostante l’aumento di sopravvivenza nei pazienti anziani dovuto alla possibilità di ricevere trattamenti chemioimmunoterapici a dosi piene o adattate all’età con uguale efficacia, circa il 30-40% dei pazienti affetti da DLBCL andrà in corso a recidiva di malattia o presenterà malattia refrattaria. La maggior parte delle recidive si verificano nei primi due anni dal trattamento iniziale. 24 LINEE GUIDA LINFOMI In molti dei pazienti anziani che recidivano l’obiettivo del trattamento non ha più intento curativo ma ha come finalità il controllo della malattia con la palliazione dei sintomi e la conservazione di una qualità di vita soddisfacenti. I dati a disposizione concernenti un trattamento con HDT/supporto di cellule staminali autologhe sono concordi nel definire che gli anziani in ottime condizioni generali possano avere chance di risposta e tossicità molto simili a quelle dei pazienti più giovani e che non è l’età anagrafica ma le co-morbidità e le vulnerabilità “nascoste” di molti anziani a influire negativamente sui risultati clinici di un approccio ad alte dosi. Per i pazienti non candidabili a terapia ad alte dosi di salvataggio, inclusi i pazienti di età > a 70 anni, i potenziali trattamenti comprendono terapia con agente singolo, la scelta di un trattamento palliativo e l’inclusione all’interno di trial clinici controllati. Sono ben tollerati inoltre regimi di combinazione che includono R-gemox [132], la bendamustina con o senza rituximab[133] e CVP +/- rituximab. Un ruolo importante inoltre sembra essere svolto dalla lenalidomide nei pazienti del sottogruppo non GBC con o senza rituximab [134]. La definizione del programma terapeutico deve essere basata sulla valutazione del singolo paziente optando se disponibile per l’arruolamento in uno studio clinico controllato. 2.7 Definizione dei criteri di risposta La risposta è definita sulla base di criteri validati a livello internazionale (Cheson 2007). Per la definizione della risposta devono essere utilizzati esami radiologici quali TC e PET (o PET-TC) ed esami istologici. La risposta al trattamento può essere definita (Tabella 6). Remissione Completa (RC): scomparsa di ogni sede di malattia e di tutti i sintomi ad essa legati. Sono considerati in RC i pazienti con PET positiva all’esordio (o che non hanno eseguito la PET, ma con linfoma PET avido) e che ottengono una PET negativa al termine della terapia, indipendentemente dalle masse linfonodali residue alla TC. Remissione Parziale (RP): riduzione volumetrica delle adenopatie superiore al 50% in assenza di incremento di altre sedi di malattia o di comparsa di nuove lesioni. I noduli epatici e splenici devono ridursi di almeno il 50%. E’ ammessa positività alla PET al termine della terapia solo se sulle sedi iniziali di malattia non incrementate. Malattia stabile (MS): mancanza dei criteri per RC o RP o di progressione. Positività alla PET delle sedi iniziali di malattia senza comparsa di nuove lesioni. Progressione (PG): un aumento superiore al 50% delle dimensioni delle lesioni linfomatose presenti all’inizio del trattamento e/o comparsa di nuove localizzazioni. Comparsa di nuove lesioni alla PET. Tabella 6. Criteri per la definizione della risposta al trattamento. Risposta Definizione Masse linfonodali Milza fegato Midollo Osseo RC Completa scomparsa della malattia Linfomi FDG-avidi o PET positivi prima della terapia; masse di qualsiasi dimensione con PET negativa Non palpabili, scomparsa di tutti i noduli Assenza di infiltrato alla ripetizione della biopsia, se non determinabile dalla morfologia, immunoistochimica deve essere negativa RP Riduzione della malattia misurabile e nessuna nuova sede Riduzione ≥ 50% nel SPD delle 6 masse nodali più grandi, nessun aumento dimensionale di altre masse Linfomi FDG-avidi o PET positivi prima della terapia; positiva in 1 o più sedi iniziali Diminuzione ≥ 50% della SPD dei noduli (per masse singole diametro trasverso maggiore); nessun incremento di dimensione di milza e fegato Irrilevante se positivo prima della terapia; deve essere specificato il tipo cellulare 25 LINEE GUIDA LINFOMI Risposta Definizione Masse linfonodali Milza fegato MS Fallimento nell’ottenere RC, RP, PG PG Comparsa di qualsiasi nuova lesione e aumento ≥ 50% delle lesioni preesistenti Linfomi FDG-avidi o PET positivi prima della terapia; PET positiva nelle sedi iniziali di malattia, non nuove sedi alla TAC o PET Comparsa di nuova/e lesione/i > 1.5 cm, incremento ≥ 50% della SPD di più di una massa linfonodale, o incremento ≥ 50% del diametro maggiore di un linfonodo noto > 1 cm. Lesioni PET positive nei linfomi FDG avidi, o PET positiva prima della terapia Incremento > 50% della SPD basale di qualsiasi lesione iniziale Midollo Osseo Nuovo coinvolgimento o recidiva 2.8 Follow-up Le recidive dei linfomi a grandi cellule B sono passibili di trattamenti di seconda linea con buone percentuali di remissione dopo terapia di salvataggio (58%). Non ci sono studi prospettici randomizzati che dimostrino che l’uso sistematico di esami radiologici, nei pazienti in remissione completa ed in assenza di sintomi specifici migliori la sopravvivenza. La maggior parte delle recidive viene diagnosticata per la presenza di sintomi e/o per alterazione degli esami di laboratorio. I dati disponibili a favore dell’utilizzo routinario della TC non sono conclusivi ma è comunque prassi diffusa sia nei centri nordamericani sia europei eseguire esami radiologici periodici (TC e/o PET) nei programmi di follow-up. In uno studio del 2003 su 117 pazienti in remissione completa solo il 5.7% dei ricaduti è stato individuato con una TC ( eseguita a 3 e 12 mesi dal termine della chemioterapia) in assenza di altri sintomi specifici, mentre nell’86% dei casi la recidiva era riscontrata in seguito alla comparsa di segni e/o sintomi [135]. In uno studio nel quale il follow-up dei pazienti comprendeva l’uso periodico della TC (ogni 6 mesi per i primi 2 anni) una diagnosi precoce di recidiva riscontrata mediante imaging non hanno mostrato un vantaggio nell’outcome dei pazienti [136]. I dati di un recente studio retrospettivo multicentrico condotto su pazienti con NHL aggressivi e HL dimostrano, nei paziente affetti da linfimi diffusi a grandi cellule B, che nel 41% dei casi la recidiva è riconosciuta per la comparsa di sintomi e per anomalie agli esami di laboratorio e solo nel 26% dei casi la TC aveva anticipato la diagnosi di recidiva con un modesto beneficio sulla sopravvivenza a scapito di un elevato numero di indagini radiologiche eseguite [137]. Non vi è indicazione all’utilizzo della PET al di fuori di uno studio clinico controllato [138, 139] (Livello di evidenza 3). Sulla scorta di questi dati, i pazienti con DLBCL in remissione completa dopo terapia di prima o anche seconda linea devono essere seguiti: • routine ematochimici, LDH ed esame clinico ogni 3 mesi per i primi 2 anni, poi ogni 6 mesi per i 3 anni successivi, poi annualmente (NCCN Practice Guidelines in Oncology: Diffuse large B-cell Lymphoma. 2014; version 2) (Livello di evidenza 4). • la TC può essere eseguita a 6,12 e 24 mesi dal termine del trattamento [140] (Livello di evidenza 3). Nel caso sussista un dubbio clinico e/o radiologico di ricaduta di malattia è raccomandata la biopsia diagnostica. 26 LINEE GUIDA LINFOMI Tabella 7. Procedure durante il follow up Procedura Raccomandazione Esame clinico Anamnesi ed esame obiettivo ogni 3 mesi nei primi due anni, poi ogni 6 mesi nei successivi 3 anni, poi annualmente (NCCN 2014). ogni 3 mesi nei primi due anni, poi ogni 6 mesi nei successivi 3 anni (NCCN 2014). A 6-12 e 24 mesi dal temine del trattamento (linee guida ESMO 2012). Esami ematici (routine+LDH) TC collo-toraceaddome completo con mdc Procedure non raccomandate In assenza di indicazioni cliniche i seguenti esami sono “sconsigliati”: TC-PET con fdG [138, 139]. 27 Qualità dell’evidenza SIGN D Forza della Raccomandazione Positiva debole D Positiva debole D Positiva debole D Positiva Forte 28 In alcune circostanze:CCND1, kappa/lambda, CD138. EBER-ISH, HHV8 , ALK In alcune circostanze: ricerca t (8;14) o t (14;18) su tessuto mediante FISH o PCR. Conferma istologica di Linfoma diffuso a grandi cellule Requisiti di appropriatezza - Biopsia linfonodale o di tessuto extranodale . - Pannello IHC completo con CD20,CD3, CD5, CD10, CD45, BCL2, BCL6, Ki67, IRF4/MUM1 Diagnosi di Linfoma diffuso a grandi cellule o Linfoma Follicolare grado 3b STADIAZIONE Esami raccomandati - Esame fisico - Performance Status - Sintomi B - Emocromo completo con formula - LDH - panel metabolico e dosaggio immunoglobuline - TC collo , torace, addome con mezzo di contrasto - Sierologia per HIV, HBV e HCV - Biopsia osteomidollare - Ecocardiogramma, ECG, visita cardiologica - PET-TC scan (altamente raccomandata) - In casi selezionati: EGDS, visita ORL, esame del liquido cefalorachidiano - Valutazione riproduttiva per i soggetti di età < 40 anni Figura 1 DLBCL: Diagnosi e stadiazione aa IPI 2-3 età < 65 anni STADIO I- II bulky aa IPI 0 STADIO III-IV aa IPI 1 STADIO I-II aaIPI 0 Favorevole (non bulky) LINEE GUIDA LINFOMI 2.9 Figure 29 STADIO III-IV aa IPI 2-3 ≤65 anni STADIO I- II bulky aa IPI 0 STADIO III-IV aa IPI 1 STADIO I-II aaIPI 0 Favorevole (non bulky) 6-8 R-CHOP (ev. RT su aree limitate in RP) o Arruolamento in trial clinici 6-8 R-CHOP +/- RT-IF (30-36 Gy) (ev. bulky negli stadi III-IV) 3-4 R-CHOP+ RT-IF (36 Gy) (opzione di prima scelta) o 6 R-CHOP +/-RT-IF(30-36 Gy) Figura 2 DLBCL: Terapia iniziale Valutazione risposta LINEE GUIDA LINFOMI Valutazione risposta: -Anamnesi ed esame obiettivo -Esami ematochimici -Biopsia osteomidollare monolaterale se positiva pre-terapia -RX torace -TC collo, torace , addome -PET o PET/TC PR,RN, PG RC 30 Vedi “terapia di salvataggio” FOLLOW-UP -Visita periodica (ogni 3 -4 mesi per 2 anni, poi ogni 6 mesi fino a 5 anni, poi annualmente) -Esami ematochimici completi (ogni 3 -4 mesi per 2 anni, poi ogni 6 mesi fino a 5 anni, poi annualmente) ; funzione tiroidea se RT su collo -Biopsia osteomidollare monolaterale se positiva pre-terapia -RX torace (annualmente dopo i primi 5 anni se a rischio per ca polmone) -TC collo, torace , addome (ogni 6 mesi per 2 anni poi annualmente) -Valutazione cardiovascolare, respiratoria, psicosociale, riproduttiva (annuale) Figura 3 DLBCL : Valutazione della risposta LINEE GUIDA LINFOMI 31 Non candidabili HDC * DHAP, ESHAP, ICE, IEV, MINE, miniBEAM Accertamento istologico possibilmente su linfonodo intero Candidabili HDC Valutazione risposta CT*+/-R o studio clinico CT* +/-R Figura 4 DLBCL : Terapia di salvataggio Valutazione risposta Se non remissione CT di terza linea o trial clinico o trapianto allogenico Se RC o RP terapia ad alte dosi LINEE GUIDA LINFOMI LINEE GUIDA LINFOMI 3. Linfomi follicolari 3.1 Epidemiologia Il Linfoma Follicolare (LF) rappresenta circa il 10-20% di tutti i linfomi, con un’incidenza di 4-5 nuovi casi ogni 100.000 persone l’anno [2]. Questo tipo di linfoma presenta un’incidenza più elevata in Europa Occidentale e in U.S.A rispetto ai paesi dell’Est Europa, Asia e alle nazioni in via di sviluppo. In Italia la frequenza dei linfomi follicolari è di poco superiore al 10% circa, inferiore a quanto riportato per le casistiche statunitensi, e il tasso standardizzato di incidenza annua è pari a 2 casi/100.000 abitanti [1]. Dopo un incremento significativo di incidenza registrato nelle ultime decadi, osservazioni più recenti sembrano essere a favore di un trend temporale di incidenza senza significative variazioni [141]. Il LF è una neoplasia dell’età medio-avanzata, con una lieve prevalenza nelle donne (M/F, 1:1,7); l’età media alla diagnosi è di poco superiore ai 50 anni, ed è leggermente inferiore rispetto a quella osservata per altri linfomi indolenti. Meno del 10% dei pazienti ha un’età inferiore a 30 anni al momento della diagnosi. Ad oggi i dati di mortalità e prevalenza sono riferiti a tutti i Linfomi e mancano dettagli sui LF e sugli altri istotipi. Per quanto riguarda i fattori di rischio, un recente studio [142] ha messo in evidenza l’influenza di alcune variabili come l'altezza, l'uso di tinture permanenti per capelli, la variante allelica del polimorfismo I143V del gene MGMT, e il fenotipo NAT2 acetilatore. Inoltre, in uno studio che ha valutato il ruolo dell’esposizione ai pesticidi nella patogenesi dei LNH, è stata messa in evidenza la correlazione tra esposizione professionale a dieldrina, atrazina e fungicidi e lo sviluppo di linfomi positivi alla traslocazione t(14;18) [143]. 3.2 Inquadramento diagnostico 3.2.1 Diagnosi e stadiazione La diagnosi di LF deve essere eseguita mediante esame istologico di tessuto rappresentativo di malattia. In presenza di adenopatie si deve sempre procedere a biopsia escissionale del linfonodo. In assenza di adenopatie una diagnosi di compatibilità/probabilità può essere eseguita mediante esame istologico di biopsia osteomidollare; in questi casi la disponibilità di marcatori diagnostici aggiuntivi, coma la ricerca della traslocazione t (14;18), possono contribuire a migliorare l’accuratezza diagnostica. Altre procedure diagnostiche, quali analisi citofluorimetrica di sospensione cellulare di sangue midollare o periferico, non consentono di definire una diagnosi di certezza, ma solo di porre un sospetto diagnostico. I criteri per formulare la diagnosi di LF sono quelli definiti dalla terza edizione della Classificazione WHO delle neoplasie emopoietiche [144]. In ogni caso la diagnosi istologica o citologica deve essere supportata da una valutazione immunoistochimica o immunocitochimica (Tabella 8). Tabella 8. Immunofenotipizzazione per definire la diagnosi Adeguata Immunofenotipizzazione per definire la diagnosi IHC panel CD20, CD3, CD5, CD10, BCL22, BCL6, CCND1, CD21, CD23 Analisi marker cellular di superficie mediante Kappa/Lambda, CD19, CD20, CD5, CD23, CD10 citometria a flusso Utili in determinate circostanze Analisi molecolari Riarrangiamenti genici dei recettori degli antigeni, riarrangiamento BCL2 Citogenetica o FISH t(14;18); t (8;14) o varianti IHC panel Ki673 32 LINEE GUIDA LINFOMI 1 Immunofenotipo tipico: CD10+, BCL2+, CD23+/-, CD43-, CD5-, CD20+, CCND1-, BCL6+. Rari casi di LF possono essere CD10- or BCL2-. 2 Nei pazienti giovani BCL2 negativi con malattia localizzata, deve essere considerata l’entità del LF pediatrico. 3 Ci sono report che mostrano che la frazione di proliferazione di Ki67 > 30% può essere associata con un comportamento clinico più aggressivo ma non c’è evidenza che questo aspetto debba guidare le decisioni terapeutiche. Sebbene patologi esperti affermino di poter riconoscere il LF situ sulla base delle modeste alterazioni morfologiche, una diagnosi patologica precisa di LF situ richiede il riconoscimento delle seguenti caratteristiche istologiche ed immunoistochimiche: 1) una architettura d’insieme conservata del linfonodo; 2) la presenza di follicoli trasformati, che di solito sono dispersi; 3) l’individuazione immunoistologica di cellule B del centro germinativo che mostrano colorazione fortemente positiva per BCL2 e CD10 [7]. Le cellule B del centro germinativo BCL2+ e CD10+ sono anche positive per gli altri marcatori delle cellule B, tra cui CD20 e BCL6, ma sono negative per IgD. Le cellule B BCL2 + e CD10 + mostrano un indice proliferativo basso e sono assenti al di fuori dei follicoli. La colorazione del BCL2 è più intensa rispetto alle cellule del mantello o alle cellule T reattive. Alla diagnosi di LF deve essere aggiunta l’informazione sul grading istologico, determinato in base al numero di centroblasti (Tabella 9) e quella sulla presenza di aree a crescita diffusa. Inoltre, mentre nella classificazione WHO 2001 era opzionale stratificare i linfomi follicolari G3 in accordo alla presenza o assenza di centrociti residui (3A versus 3B), nella classificazione 2008 è considerato obbligatorio. L’identificazione di pazienti con LF di grado 3b o dei soggetti con aree di linfoma diffuso a grandi cellule costituiscono attualmente un criterio patologico per trattare il paziente come DLBCL (Tabella 10). Tabella 9. Grading linfomi follicolari [145] Grado Definizione Grado 1-2 0-15 centroblasti per hpf 1 0-5 centroblasti per hpf 2 6-15 centroblasti per hpf Grado 3 >15 centroblasti per hpf 3 Presenti centrociti 3B Aree diffuse di centroblasti Tabella 10. Pattern linfomi follicolari Pattern riportato Proporzione follicolare Follicolare >75% Follicolare e diffuso 25-75% Focolai di LF <25% Diffuso 0% Aree diffuse che contengono >15 centroblasti per hpf sono riportate come DLBCL con linfoma follicolare (Grado 1-2, Grado 3A o Grado 3B). La ricerca della traslocazione t(14;18) che caratterizza il LF può essere eseguita su tessuto linfonodale o su campione di sangue midollare e/o periferico mediante tecniche FISH o PCR. Nella valutazione dell’esito della ricerca della traslocazione t(14;18) è necessario tenere sempre conto della possibilità di falsi negativi (assenza di malattia nel tessuto esaminato, mancata amplificazione della regione traslocata) o di falsi positivi (presenza di soggetti sani con traslocazione t(14;18). Le procedure di stadiazione sono comuni a quelle previste per le altre malattie linfoproliferative (Tabella 11). 33 LINEE GUIDA LINFOMI Tabella 11. Procedure di stadiazione per la diagnosi di linfoma follicolare ESAME INDICAZIONE Anamnesi ed esame obiettivo Emocromo e chimica clinica inclusi LDH e virologia per HBV, HCV, HIV Biopsia osteomidollare monolaterale dalla cresta iliaca posteriore Obbligatori Obbligatori Obbligatoria Rx torace standard in 2 proiezioni Obbligatoria TC collo torace addome-pelvi con mezzo di contrasto Obbligatoria PET total body Trial clinico Valutazione ORL Consigliata ECG + visita cardiologia Obbligatori Ecocardiogramma o MUGA scan per valutazione della frazione di eiezione TC/RMN cerebrale, scintigrafia scheletrica, studio radiologico e/o endoscopico del tratto gastroenterico interessato. Esame citologico chimico-fisico del liquido cefalo-rachidiano Biologia molecolare su sangue midollare o sangue periferico: ricerca traslocazione (14;18) NOTE RMN in caso di intolleranza/ controindicazione al MDC Altamente raccomandata Situazioni particolari In base alla sede di insorgenza Trial clinico Il LF è attualmente considerato una neoplasia “avida” per la captazione del glucosio radiomarcato e vi sono dati sull’utilità nella fase di stadiazione e sul ruolo prognostico nella valutazione della risposta al trattamento iniziale [146-148]. L’esecuzione di FDG-PET al momento della stadiazione aumenta la capacità di indentificare localizzazioni di malattia. Il migliore potere discriminante della PET rispetto alla TAC è particolarmente utile e potrebbe acquisire un risvolto clinico rilevante per confermare il sospetto radiologico di una malattia localizzata [149]. A tutti i pazienti giovani in età fertile devono essere resi noti i rischi di infertilità connessi alla chemioterapia e la necessità di evitare una gravidanza nel periodo del trattamento e almeno nei due anni successivi. Devono essere quindi proposti l’assunzione di estroprogestinico e, rispettivamente, la criopreservazione del liquido seminale. 3.2.2 Fattori prognostici L’estensione della malattia è considerata uno dei più importanti fattori prognostici per i pazienti con LF; può essere misurata sia in maniera diretta mediante la stadiazione di Ann Arbor, sia in modo indiretto attraverso surrogati quali il “tumor burden”, la malattia “bulky”, la presenza di interessamento midollare o l’alterazione di parametri di laboratorio indirettamente collegati alla quantità di malattia. Per identificare meglio i pazienti con diversa probabilità di morte, recidiva o di progressione di malattia e per meglio definire la più opportuna strategia terapeutica sono stati sviluppati diversi indici prognostici per i LF. L’indice FLIPI è il modello attualmente più utilizzato per valutare la prognosi dei pazienti con LF [150]. Il principale limite del FLIPI è tuttavia rappresentato dal fatto che i pazienti analizzati non sono stati trattati con rituximab. Molto recentemente è stato pubblicato il nuovo indice FLIPI2, sviluppato come evoluzione del FLIPI, che apporta alcune novità rispetto al precedente tra le quali l’utilizzo di una raccolta prospettica di dati, l’inclusione di pazienti trattati con rituximab e la scelta della PFS come endpoint di sopravvivenza [151]. 34 LINEE GUIDA LINFOMI 3.3 Trattamento del linfoma follicolare 3.3.1 Strategia terapeutica generale Le opzioni terapeutiche per il LF sono ancora oggetto di controversie e vanno dal semplice regime osservazionale (watch and wait), fino al trapianto di cellule staminali emopoietiche. Le opzioni intermedie comprendono l’utilizzo di regimi monochemioterapici, in genere con alchilanti, di polichemioterapia o di radioterapia. Da circa 10 anni il trattamento dei pazienti con LF è stato “rivoluzionato” dall’introduzione degli anticorpi monoclonali anti CD20 ed in particolare dal rituximab che, sia in monoterapia che in combinazione con chemioterapia, rappresenta oggi la base dei trattamenti per il LF. Gli anticorpi monoclonali sono utilizzati in forma libera ma anche nella forma di radioimmunocomposti. La strategia terapeutica per i LF deve tenere conto della natura indolente della malattia e del rischio di recidive che rende quasi certo il ricorso nel tempo a ulteriori linee di terapia. La corretta pianificazione del programma terapeutico complessivo si può tradurre in un buon controllo della malattia nel tempo che, associato all’età medio-alta della maggior parte dei pazienti con LF, può risultare in una significativa diminuzione dell’effetto negativo della malattia sull’aspettativa di vita. La scelta terapeutica per i pazienti con LF dipende dall’estensione della malattia e dalle condizioni del paziente. Fanno eccezione i casi classificati come grado 3b e quelli con aree di grandi cellule che dovrebbero essere trattati seguendo le linee guida dei linfomi a grandi cellule B. Di seguito vengono passate in rassegna le diverse opzioni terapeutiche oggi disponibili per il trattamento dei pazienti con LF. 3.3.2 Watch & wait L’astensione dal trattamento è un’opzione che deve essere valutata in ogni paziente al momento della diagnosi e che può essere considerata in alcuni casi al momento della recidiva. La scelta di non trattare è ragionevole per i pazienti che presentano malattia a basso rischio ed è in genere valutata sulla base della presenza/assenza di sintomi o segni di malattia. Ad oggi sono disponibili i risultati di uno studio randomizzato che tuttavia presenta problemi di trasferibilità dei risultati per l’inclusione di pazienti classificati con il sistema della WF, e trattati nel braccio di controllo con un trattamento con clorambucile non proponibile ai nostri giorni [152] (Livello di evidenza 1+). Sono oggi disponibili i risultati di uno studio randomizzato che ha confrontato in 379 pazienti con linfoma follicolare in stadio avanzato e con basso tumor burden l’osservazione vs la monoterapia con rituximab [153]. Questo studio ha dimostrato come il trattamento con rituximab è in grado di ridurre in maniera significativa il rischio di progressione di malattia rispetto alla sola osservazione. L’arruolamento di un notevole numero di pazienti, il disegno randomizzato e l’utilizzo di criteri diagnostici moderni consentono di associare ai risultati dello studio un livello di evidenza molto elevato (Livello di evidenza 1++). Tali risultati non sono tuttavia immediatamente trasferibili alla pratica clinica poiché ad oggi non sono ancora visibili gli effetti del trattamento immediato sull’overall survival. Inoltre esiste un problema metodologico sulla definizione di efficacia di un trattamento attivo rispetto all’osservazione. Secondo alcuni autori il confronto tra osservazione e terapia attiva dovrebbe essere più correttamente misurato valutando l’efficacia della seconda linea di terapia piuttosto che della prima per il quale esiste sempre uno sbilanciamento di intervento a favore della terapia attiva (FF2TF). Questo tipo di analisi è stato utilizzato in uno studio prospettico recentemente pubblicato che ha dimostrato come la scelta per un periodo di W&W o di terapia immediata non influenzi l’efficacia delle terapie successive [154]. In base a quanto sopra riportato la sola osservazione è da considerarsi ancora un’opzione valida anche nell’era del rituximab I criteri per escludere l’indicazione ad un trattamento immediato sono diversi. Le linee guida NCCN (National Comprehensive Cancer Network) includono l’assenza di sintomi sistemici o di compromissione di organi vitali, la stabilità della malattia e l’assenza di citopenie secondarie al linfoma e di malattia bulky. Altri criteri da valutare sono la mancanza di valori aumentati di LDH e di VES e l’assenza di interessamento di organi extranodali. In Italia sono disponibili le raccomandazioni SIE [155]. Da ultimo ma non meno importante la proposta di un programma di W&W deve sempre considerare anche le aspettative del paziente e deve essere discussa nel corso della visita iniziale. 35 LINEE GUIDA LINFOMI Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica B Il trattamento può essere evitato nei pazienti asintomatici o privi di fattori di rischio [152]. Positiva debole A In caso di terapia immediata l’uso del rituximab in monoterapia rappresenta lo standard di cura [153]. Positiva forte 3.3.3 Terapia di prima linea: malattia localizzata Sia nel paziente giovane che in quello anziano quando il LF si presenta in stadio I-II a basso rischio (FLIPI 0-1) l’opzione di prima scelta è il trattamento radioterapico. I pazienti con linfoma follicolare in stadio I e II, sottoposti a trattamento radioterapico con dosi pari a 30-36 Gy in 15-20 frazioni giornaliere, mostrano dei tassi di controllo locale di malattia superiori al 95% con tossicità modesta tenendo presente le più frequenti sedi di coinvolgimento linfonodale (stazioni superficiali laterocervicali, ascellari, inguino-crurali) [156-168]. Come emerso da una revisione sistematica del 2003 con la RT è possibile guarire un percentuale di pazienti compresa tra il 30 e il 50% [169] (Livello di evidenza 1+). Relativamente alla dose un recente studio randomizzato inglese ha dimostrato nei linfomi indolenti (per la maggior parte linfomi follicolari) analoga efficacia terapeutica di 24 Gy in 12 frazioni rispetto ai tradizionali 40-45 Gy in 20-23 frazioni. La dose standard nei linfomi follicolari può pertanto oggi essere considerata pari a 24 Gy in frazionamento convenzionale [31] (Livello di evidenza 1++). Il recente studio inglese FoRT, non ancora pubblicato, che confrontava nei linfomi follicolari localizzati trattati con sola radioterapia 24 Gy in 12 frazioni versus 4 Gy in 2 frazioni, ha dimostrato recentemente che la dose di radioterapia standard nei linfomi follicolari deve continuare ad essere rappresentata dai 24 Gy, pur in presenza di ottimi tassi di risposte maggiori con dosi di soli 4 Gy. Sei trials prospettici randomizzati [170-175] hanno mostrato come l’aggiunta della chemioterapia ad un trattamento radioterapico di prima linea non aumenti la sopravvivenza globale; tuttavia solo uno studio ha selettivamente arruolato e analizzato pazienti affetti da linfomi non-Hodgkin indolenti. (Livello di evidenza 1-). Dall’analisi di questi studi non può scaturire una raccomandazione poiché sono studi datati e il cui arruolamento era basato su sistemi classificativi e metodologie diagnostiche non attuali e pertanto certamente affetti da bias. Studi di fase II dall’MD Anderson Center [176-179] hanno riportato tassi di sopravvivenza libera da recidiva pari al 76% a 5 anni nei pazienti sottoposti a chemioterapia secondo schema COP/CHOP-like e radioterapia “involved fields” (con tassi pari al 50-55% a 5 anni nei pazienti sottoposti a sola radioterapia). I pazienti con malattia in stadio limitato (I-II) ma con un elevato “tumor burden” e/o un rischio elevato (FLIPI >2) sono considerati ad alto rischio di recidiva dopo sola radioterapia [166, 168, 179], e in tale sottogruppo la maturità delle evidenze disponibili, anche se prodotte da studi osservazionali o da studi di fase II, è sufficiente per consigliare un programma di chemioimmunoterapia (3-4 cicli) seguita da radioterapia “involved fields” (Livello di evidenza 3). Un approccio innovativo nel trattamento di pazienti in stadio localizzato con basso “tumor burden” potrebbe essere l’associazione di immunoterapia (Rituximab) e radioterapia, ma al momento non vi sono studi randomizzati che confrontino la radioterapia esclusiva con il trattamento combinato immuno-radioterapico [180]. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica B Nei pazienti in stadio I-II con malattia localizzata, basso tumor burden l’opzione di prima scelta è il trattamento radioterapico involved field con dose di 24 Gy in 12 frazioni [169]. Positiva forte 36 LINEE GUIDA LINFOMI Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica A La dose standard nei LF dovrebbe essere considerata pari a 24 Gy in frazionamento convenzionale [31]. Positiva forte 3.3.4 Terapia di prima linea: malattia avanzata La chemioterapia sistemica rappresenta il “core” del trattamento per i pazienti con LF quando la malattia si presenta in fase sintomatica ed in stadio avanzato. Fino ad oggi sono stati testati numerosi agenti citostatici, sia come agenti singoli che in combinazione. La classe di farmaci che riveste il ruolo più importante è rappresentata dagli agenti alchilanti. Quale agente singolo il clorambucile ha rappresentato per molti anni il trattamento di riferimento [152] ed attualmente può essere ancora considerato nei pazienti anziani. Altro agente alchilante è rappresentato dalla ciclofosfamide utilizzata come agente singolo ma soprattutto come parte del regime polichemioterapico CVP che ha per lungo tempo rappresentato il trattamento standard. Oltre agli agenti alchilanti almeno altre due classi di farmaci sono stati ampiamente utilizzati nel LF e sono le antracicline e gli analoghi delle purine. Le antracicline sono state e sono attualmente utilizzate nell’ambito di combinazioni chemioterapiche e prevalentemente negli schemi CHOP o CHOP-like. Per quanto riguarda gli analoghi delle purine, il principio attivo che ha trovato il maggiore spazio nel trattamento dei LF è la fludarabina [181-183] che tuttavia è associato ad elevata immunosoppressione ed il suo utilizzo determina un rischio aumentato di infezioni opportunistiche e di fallimento delle procedure di mobilizzazione; in alcuni studi infine l’utilizzo di fludarabina è stato associato ad aumento del rischio di sviluppare leucemie secondarie. Oggi il trattamento chemio-immunoterapico è lo standard per la terapia dei pazienti con LF. L’aggiunta del rituximab a qualsiasi regime chemioterapico consente di migliorarne i risultati in termini di overall response rate, durata della risposta, PFS e OS [184-186]. La riduzione del rischio di morte con l’aggiunta del rituximab alla chemioterapia è stata confermata anche da una meta-analisi [187] (Livello di evidenza 1++). Per cercare di rispondere al quesito su quale regime di chemioterapia debba essere preferito tra le varie opzioni disponibili la Fondazione Italiana Linfomi (FIL) ha condotto lo studio randomizzato FOLL05 che confrontava un trattamento standard R-CVP, con R-CHOP e R-FM, nella terapia di prima linea in pazienti adulti con FL in stadio II-IV. Lo studio è stato recentemente completato e i risultati su 534 pazienti arruolati hanno mostrato che R-CVP è associato a un Time to Treatment Failure (TTF) a 3 anni inferiore (47%) rispetto a R-FM (60%) e a R-CHOP (57%) e che quest'ultimo aveva un profilo di tossicità migliore rispetto a R-FM. Sulla base dei risultati dello studio FOLL05, R-CHOP può essere quindi definito come il trattamento standard per il FL in fase avanzata [188] (Livello di evidenza 1++). Recentemente sono stai pubblicati i risultati di due studi randomizzati che hanno confrontato la chemioimunoterapia convenzionale con R-CHOP o R-CVP con la combinazone di rituximab e Bendamustina. Il primo studio del gruppo tedesco Stil prevedeva un confronto randomizzato tra R-CHOP ed R-Bendamustina in pazienti con linfoma indolente tra cui LF, linfomi linfocitici, linfomi mantellari e linfomi marginali. Lo studio, con un follow up mediano di 45 mesi, ha dimostrato che l’utilizzo di R-Bendamustina determina una riduzione del rischio di progressione (HR= 0.58) rispetto ad R-CHOP, mantenendo simile la percentuale di risposta ma riducendo in maniera significativa il rischio di tossicità ematologica e non (neutropenia grado III-IV, alopecia, neuropatia periferica, stomatite). I risultati complessivi di efficacia dello studio sono stati replicati nel sottogruppo dei pazienti con LF (N=279; 54% della casistica) e consentono di concludere che l’utilizzo di bendamustina può essere raccomandato come valida alternativa a CHOP [189] (Livello di evidenza 1+). Pur trattandosi di uno studio randomizzato il trial è potenzialmente affetto da bias: il disegno originale di non inferiorità non consentirebbe di trarre conclusioni sulla superiorità di un regime sull’altro. Inoltre lo studio è stato condotto con analisi per protocollo e non come intention to treat. Infine i risultati dello studio sui pazienti con LF sono frutto di una sottoanalisi dello studio complessivo. 37 LINEE GUIDA LINFOMI Il secondo studio noto con il nome BRIGHT ha confrontato un trattamento con R-CHOP o R-CVP con la combinazione R-Bendamustina in pazienti con linfoma indolente o linfoma mantellare non precedentemente trattato utilizzando un disegno di fase III randomizzato e condotto con l’obbiettivo di verificare la non inferiorità dei 2 schemi di terapia in termini di risposta completa. Lo studio ha arruolato 447 pazienti, di cui 297 con LF e ha dimostrato la non inferiorità dei due trattamenti per l’endopoint primario (CR del 31% vs 25% nel braccio R-CHOP/CVP e R-B) confermando il dato di minore tossicità associata a R-B (neutropenia severa con R-B 39% dei casi vs 57% con R-CHOP: p< 0.0001) già osservato nello studio STIL. I risultati di non inferiorità sul tasso di risposta sono stati confermati anche sul sottogruppo di LF e confermano che R-B può essere utilizzato come alternativa a R-CHOP [190] (Livello di evidenza 1+). Il farmaco rituximab può essere utilizzato in ogni tipo di paziente. Gli unici pazienti che necessitano di una più attenta valutazione del rapporto rischio-beneficio sono i soggetti con epatite B asintomatica (HbSaG +) o occulta (anticore +). Sono infatti descritti casi di riattivazione di epatite B, anche fatali, nei soggetti HBV + per i quali esiste la possibilità di prescrivere profilassi con lamivudina e limitare così il rischio di riattivazione virale in corso di trattamento con rituximab. Ad oggi non vi sono dati che consentano di definire una linea di comportamento per il trattamento con anticorpo monoclonale dei pazienti con infezione da HCV. Oltre all’utilizzo in combinazione con la chemioterapia il rituximab è stato anche utilizzato come terapia di mantenimento dopo l’ottenimento di una risposta iniziale soddisfacente [191]. Recentemente sono stati pubblicati i risultati finali dello studio PRIMA, in cui veniva valutata l’efficacia in termini di PFS di un trattamento di mantenimento di due anni con rituximab, somministrato ogni 8 settimane, nei pazienti con elevato TB responsivi a un trattamento immunochemioterapico di prima linea. Dopo un follow-up mediano di 36 mesi, i paziente sottoposti a terapia di mantenimento presentavano un rischio di progressione del 50% più basso rispetto ai pazienti non trattati. La somministrazione di rituximab per due anni (375mg/m2 ogni 2 mesi) dopo risposta a chemioimmunoterapia iniziale può attualmente essere raccomandata con il massimo livello di evidenza scientifica e rappresenta una valida opzione terapeutica dopo terapia di prima linea [192] (Livello di evidenza 1++). Per il trattamento iniziale dei pazienti con LF, negli ultimi anni sono state valutate alcune alternative alla chemioimmunterapia convenzionale che consistono nell’utilizzo della sola immunoterapia, nell’uso di anticorpi diversi dal rituximab o nella somministrazione di terapia ad alte dosi. Qualità dell’evidenza SIGN A A B A Raccomandazione clinica Il trattamento chemio-immunoterapico dovrebbe essere lo standard per la terapia dei pazienti con LF [187]. R-CHOP è il regime standard per il trattamento iniziale dei pazienti con LF [188]. R-bendamustina può essere considerata una valida alternativa al trattamento R-CHOP per i pazienti per cui il profilo di tossicità di R-CHOP rappresenta un rischio eccessivo [189, 190]. Il trattamento di mantenimento con rituximab per 2 anni (375mg/m2 ogni 2 mesi) dovrebbe essere somministrato nei pazienti con LF responsivi a chemioimmunoterapia iniziale [192]. Forza della raccomandazione clinica Positiva forte Positiva forte Positiva forte Positiva forte Ruolo della radioterapia nella malattia avanzata Nel trattamento della malattia avanzata, non vi sono evidenze a sostegno di un ruolo della radioterapia in tale setting, anche limitatamente ad un eventuale contributo come consolidamento post-chemioterapia su eventuali localizzazioni bulky [193, 194]. In un contesto di finalità palliativa citoriduttiva, potrebbero essere utilizzate schedule radioterapiche con dosi ridotte (4 Gy in 2 frazioni), che hanno dimostrato ottimi profili terapeutici ed elevati tassi di risposte maggiori in tali situazioni oncologiche [195]. 38 LINEE GUIDA LINFOMI Radioimmunoterapia Anche se finora il rituximab rappresenta il principale anticorpo monoclonale utilizzato nella pratica clinica, esistono altre molecole di derivazione diretta dal rituximab o altri anticorpi monoclonali che sono in diverse fasi di sviluppo clinico e che potranno rappresentare ulteriori opzioni terapeutiche per il trattamento del LF. Tra queste i radioimmunoconiugati, gli anticorpi anti-CD20 umanizzati e gli anticorpi diretti contro bersagli diversi dal CD20. I radioimmunocomposti per il trattamento dei LF sono attualmente 2: un primo farmaco coniugato con iodio131 (tositumomab; non disponibile in Italia), un secondo coniugato con ittrio90 (ibritumomab). Quando utilizzato in monoterapia per pazienti con LF avanzato 131I-tositumomab è risultato associato al 95% di risposte con una PFS a 5 anni pari al 59% [196]; in combinazione con CHOP ha determinato invece risposte nel 91% dei casi con una OS e una PFS a 5 anni rispettivamente pari al 87% e al 67% [197]. Sulla base dei risultati di uno studio randomizzato condotto su 414 pazienti con LF in stadio avanzato vi è inoltre evidenza per l’uso della RIT di consolidamento dopo ottenimento di risposta completa o parziale alla chemioterapia CHOP iniziale. In questo setting di pazienti l’uso della RIT migliora la PFS rispetto alla sola osservazione (PFS media 35.5 vs 13.3 mesi; p<0.001) e permette di aumentare il tasso di conversione da risposta parziale dopo l’induzione a risposta completa dopo RIT (77%) [198] (Livello di evidenza 1++). Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica La radioimmunoterapia può essere somministrata come consolidamento dopo chemioterapia per il trattamento iniziale dei pazienti con LF avanzato. B √L’evidenza di questa raccomandazione si basa sui risultati di uno studio randomizzato in cui la terapia di prima linea non prevedeva l’utilizzo di rituximab. Attualmente non sono ancora stati pubblicati i risultati dello studio randomizzato che confronta l’efficacia di Zevalin vs osservazione dopo RCHOP. Positiva debole Terapie alte dosi prima linea Diversi studi prospettici e retrospettivi, tutti condotti in epoca pre-rituximab, hanno valutato il ruolo della HDC nei linfomi follicolari in prima linea evidenziando che la procedura era ben tollerata e che la OS sembrava migliore rispetto a pazienti trattati in modo convenzionale [199-206]. Sono stati successivamente condotti quattro studi randomizzati [207-211] che hanno confrontato l’uso della HDC con supporto di cellule staminali autologhe con un trattamento convenzionale in pazienti con LF in prima linea, dai quali è emerso che la PFS o EFS è migliore nel gruppo di pazienti che hanno ricevuto la HDC, anche se non sono state evidenziate differenze nella OS. In due studi [208-210], in cui il FLIPI era derivato in modo retrospettivo, la HDC si era dimostrata statisticamente superiore solo in termini di PFS nei pazienti ad alto rischio (score ≥3). Tuttavia questo dato è stato completamente sovvertito nell’analisi a lungo termine (mediana di follow-up 9 anni) dello studio del GOELAMS [209], in cui la HDC migliorava la PFS nel sottogruppo con 0 fattori (low risk). Tra gli studi randomizzati disponibili, lo studio GITMO/IIL [211] si differenzia dagli altri poiché sono stati arruolati solo pazienti considerati ad alto rischio (secondo IPI e/o score IIL), sono state confrontate una strategia terapeutica convenzionale + rituximab con un trattamento ad alte dosi seguito da infusione di cellule staminali autologhe e associato a Rituximab ed infine, per una parte dei pazienti in RC, è stato effettuato lo studio della malattia minima residua a livello midollare mediante PCR (polymerase chain reaction). I risultati dello studio hanno mostrato una migliore PFS per i pazienti trattati con terapia ad alte dosi senza tuttavia nessuna differenza in termini di sopravvivenza tra i due trattamenti (Livello di evidenza 1++). 39 LINEE GUIDA LINFOMI Inoltre è stata confermata l’importanza dell’ottenimento della remissione completa molecolare, in quanto i pazienti PCR- hanno mostrato una PFS statisticamente migliore rispetto ai pazienti con PCR+. E’ stato inoltre evidenziato che la PFS non era diversa se la RC molecolare era raggiunta dopo HDS o terapia convenzionale. Sulla base dei dati disponibili il panel di esperti concorda sulla mancanza di indicazione all’utilizzo di terapie ad alte dosi in prima linea nei pazienti con LF. Tale procedura, se prevista, deve essere utilizzata solo nell’ambito di trial clinici. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica A Nei pazienti con LF la terapia ad alte dosi non deve essere utilizzata per il trattamento di prima linea [211]. Negativa forte 3.3.5 Terapia di seconda linea e di salvataggio Di solito i pazienti con LF rispondono bene alla terapia di prima linea, ma sono soggetti a recidive con elevata frequenza. La scelta del trattamento di seconda o ulteriore linea di terapia deve essere fatta valutando gli stessi parametri considerati per la terapia di prima linea (estensione di malattia, età e comorbidità) e aggiungendo alla valutazione il tipo di trattamento iniziale e la durata della risposta. Anche nella terapia di salvataggio lo standard di cura è rappresentato dalla somministrazione di chemio-immunoterapia. Ai trattamenti convenzionali si aggiungono in questa fase altre possibilità che includono il ricorso a regimi ad alte dosi con supporto di cellule staminali autologhe e l’utilizzo di farmaci innovativi. Nella scelta del trattamento di salvataggio si deve preferire uno schema che non comporti resistenza crociata con il regime usato in precedenza. Anche nella terapia di seconda linea è raccomandato l’aggiunta di rituximab alla chemioterapia. Tra i farmaci oggi disponibili per il trattamento del LF, una molecola che sta acquistando sempre maggiore importanza è la bendamustina. Utilizzato come agente singolo in pazienti pretrattati e refrattari al rituximab è stato in grado di determinare risposte nel 82% dei pazienti [212]. Utilizzato in associazione con rituximab ha consentito di ottenere risposte nel 96% dei LF recidivati [213]. Al momento della recidiva i pazienti possono essere anche trattati con RIT, sia come agente singolo sia come consolidamento di un programma di chemioterapia. La RIT è in grado di migliorare i tassi e la durata della risposta rispetto al trattamento con rituximab [214] (Livello di evidenza 1++). Complessivamente le risposte globali ottenute con la RIT in monoterapia, per il trattamento dei pazienti in recidiva, vanno dal 70 al 97%, con una durata mediana della risposta pari a circa 2 anni. Il trattamento radioimmunoterapico è associato a maggiore efficacia nei pazienti con un numero limitato di precedenti linee di terapia, che presentano un numero limitato di stazioni linfonodali coinvolte e assenza di malattia Bulky. La RIT non sembra aumentare il rischio di sindromi mielodisplastiche o di leucemie mieloidi acute anche se i pazienti trattati con questa metodica sono ancora pochi per trarre conclusioni definitive. Unica controindicazione assoluta alla somministrazione di RIT è rappresentata dalla presenza di infiltrato midollare superiore al 25% [214-217]. Nei pazienti responsivi alla terapia di salvataggio due studi randomizzati hanno dimostrato che l’utilizzo di un trattamento di mantenimento con rituximab è in grado di prolungare la sopravvivenza libera da progressione rispetto alla sola osservazione (Livello di evidenza 1++) [218], [219]. 40 LINEE GUIDA LINFOMI Qualità dell’evidenza SIGN Forza della raccomandazione clinica Raccomandazione clinica Al momento della recidiva i pazienti possono essere trattati con RIT come agente singolo o come consolidamento di un programma di chemioterapia [214]. B √ L’evidenza su cui si basa questa raccomandazione è limitata dal fatto che l’unico studio randomizzato che dimostra un vantaggio di RIT utilizza come braccio di controllo una monoterapia con rituximab che non è attualmente riconosciuta come standard di trattamento nei pazienti con LF recidivato o refrattario. Positiva debole L’efficacia della terapia di mantenimento nei pazienti con LF che rispondono a terapia di salvataggio è stata recentemente confermata da una metanalisi che ha stimato in una riduzione del 42% l’effetto sul rischio di morte per i pazienti con LF in recidiva o refrattario [191]*. Qualità Globale delle evidenze GRADE Raccomandazione clinica Forza della raccomandazione clinica Nei pazienti responsivi alla terapia di salvataggio deve essere utilizzato un trattamento di mantenimento con rituximab 1 dose ogni 2-3 mesi per 2 anni Moderata * La valutazione complessiva della qualità delle evidenze ad oggi disponibili circa “l’efficacia di un trattamento di mantenimento”, la valutazione del rapporto tra i benefici ed i rischi correlati e la formulazione della raccomandazione relativa al quesito posto, sono state analizzate secondo metodologia GRADE (vedere capitolo 6). Positiva forte Chemioterapia ad alte dosi con supporto di cellule staminali autologhe in seconda linea I pazienti di età inferiore a 65 anni, con recidiva estesa o precoce dopo un trattamento di prima linea con antracicline o fludarabina possono essere presi in considerazione per una terapia ad alte dosi e trapianto autologo di cellule staminali emopoietiche (SCT). La possibilità di dover ricorrere a un trattamento ad alte dosi deve essere presa in considerazione nei pazienti più giovani e nei soggetti potenzialmente eleggibili andrebbero evitati trattamenti associati a severa mieolosoppressione. In questo setting di pazienti sono disponibili in letteratura sia studi retrospettivi, sia prospettici [201, 203, 220-229]. Nell’unico studio randomizzato [230] dopo una mediana di follow-up di 69 mesi, la PFS e la OS a 5 anni erano significativamente migliori per i pazienti nel braccio HDC (PFS 50-58% vs 12%; OS 70% vs 45%), senza tuttavia differenza se il supporto cellulare era o meno sottoposto a purging [230]. Come confermato anche da una recente metanalisi [231] è possibile concludere che l’utilizzo di terapia ad alte dosi nei pazienti con LF recidivato è in grado di migliorare la PFS e la OS (Livello di evidenza 1++). Questi risultati tuttavia sono sicuramente applicabili ai pazienti non precedentemente trattati con rituximab ma non possono essere completamente trasferiti ai pazienti che recidivano dopo un trattamento ICT. A tal proposito, il GELA/GOELAMS ha recentemente riportato che la HDC rimane un trattamento efficace anche per i pazienti esposti o meno al rituximab. Per i pazienti che non ricevono il rituximab in prima linea la OS e EFS a 3 anni sono superiori per chi viene avviato alla HDC (92% vs 60% e 72% vs 31%, rispettivamente). Per i pazienti che hanno ricevuto il rituximab in prima linea, il vantaggio della HDC rimane significativo per la OS e la EFS (92% vs 65% e 75% vs 49%, rispettivamente) [232]. 41 LINEE GUIDA LINFOMI In conclusione per i pazienti recidivati dopo ICT l’indicazione ad un trattamento ad alte dosi è raccomandata in caso di recidiva precoce (entro i 12 mesi). Sono necessari studi randomizzati che valutino l’utilizzo di terapia ad alte dosi in paziente recidivati dopo ICT. Un problema comune nell’ambito della HDC dei LF è la necessità e la modalità (ex vivo o in vivo) del purging del supporto cellulare. Per quanto riguarda la prima domanda sulla necessità del purging, studi non randomizzati hanno costantemente riportato una minor frequenza di ricadute e una migliore sopravvivenza quando il purging veniva praticato e soprattutto quest’ultimo permetteva di ottenere un prodotto cellulare senza contaminazione da parte di cellule linfomatose (di solito valutata in PCR) [211, 228, 233]. La seconda domanda riguarda la migliore modalità di purging. Le tecniche di purging ex vivo si sono dimostrate tutte efficaci, anche se la selezione positiva delle cellule CD34+ è per lo meno dal punto di vista pratico, la più facile da effettuare in quanto il sistema per la selezione è automatizzato e facilmente riproducibile, sebbene con un certo costo. Il purging ex vivo, basato sulla selezione negativa delle cellule, non linfomatose con l’ausilio di anticorpi anti B, risulta essere molto meno standardizzata e più complessa, perciò è stata abbandonata nella pratica clinica. Il purging in vivo ha assunto un peso maggiore dall’avvento del rituximab. A tal proposito è stata ben documentata l’efficacia della decontaminazione del prodotto cellulare (periferico) con l’uso in peri-raccolta di questo anticorpo, rendendone l’applicazione estremamente facile e ripetibile in ogni centro [234]. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica La chemioterapia ad alte dosi con supporto di cellule staminali autologhe può essere utilizzata nei pazienti con malattia in recidiva dopo terapia di prima linea [231]. B √ L’evidenza su cui si basa questa raccomandazione è frutto di studi randomizzati e di una metanalisi condotta su pazienti recidivati dopo sola chemioterapia. Ad oggi non sono disponibili risultati di studi randomizzati che valutano l’efficacia della terapia ad alte dosi dopo immunochemioterapia. Positiva debole Condizionamento Per l’uso del rituximab negli schemi di condizionamento e dei radioimmunoconiugati si può fare riferimento a quanto descritto nella sezione relativa ai linfomi diffusi a grandi cellule. Trapianto allogenico L’interesse del trapianto allogenico nella strategia terapeutica del LF è legato ad alcune caratteristiche quali il quasi costante interessamento midollare, soprattutto nelle fasi più avanzate, con la conseguente contaminazione del supporto cellulare, l’evolutività lenta che rende possibile l’approccio immunoterapico e la presenza di specificità antigeniche suscettibili per la reattività linfocitaria allogenica. Recentemente, uno studio inglese ha provato l’effetto immunologico in pazienti con LF avanzato che ricevevano un condizionamento con BEAM seguito da cellule staminali autologhe o allogeniche. Il gruppo BEAM-allo, nonostante il maggior numero di terapie precedenti, presentava un rischio di recidiva inferiore ma con una maggiore TRM [235]. Tuttavia, l’apparente “cronicità” del LF, l’età spesso avanzata, e soprattutto la TRM elevata con il condizionamento mieloablativo non hanno permesso un utilizzo ampio del trapianto allogenico. D’altra parte, nei primi studi era comunque evidente una frequenza di recidiva bassa rispetto a quanto osservato dopo le HDC, dimostrando così l’esistenza di un effetto “graft versus lymphoma”. La situazione è cambiata con l’utilizzo del trapianto preceduto da RIC che ha permesso di ridurre significativamente la tossicità. 42 LINEE GUIDA LINFOMI Dai risultati degli studi disponibili sul trapianto allogenico mieloablativo nel LF emerge che questa tipologia di trattamento consente di ottenere una OS (51%-78%) e una PFS (41%-78%) paragonabili a quanto riportato per popolazioni di pazienti simili dopo HDC con supporto autologo. Considerando la bassa incidenza di ricadute dopo allogenico, questo risultato è l’effetto di una TRM ancora troppo elevata, circa 30%, che rappresenta il vero limite di questo approccio. La conseguenza pratica di questi dati è che il trapianto allogenico MAC è sempre meno utilizzato nella pratica clinica. Una ben più ampia letteratura è stata prodotta per il trapianto allogenico preceduto da vari condizionamenti di intensità ridotta [110, 113, 116, 119, 235-241]. Come per altre patologie la riduzione della mortalità trapiantologica conseguente all’uso di condizionamenti di intensità ridotta, avrebbe dovuto permettere un miglioramento della sopravvivenza. In effetti, in diversi lavori viene evidenziato che la prognosi dei pazienti con LF è particolarmente buona dopo trapianto allogenico, rispetto agli altri istotipi [116, 119]. Resta comunque sempre da definire il timing del trapianto allogenico preceduto da RIC durante la storia del LF. Come per altri istotipi, due indicazioni per candidare un paziente per un trapianto allogenico sono: malattia in ricaduta dopo HDC, malattia refrattaria a due o più linee di terapia comprendenti il rituximab. In entrambe queste situazioni, lo stato di malattia pre-allo dovrebbe essere quello di una malattia chemiosensibile. Nell’analisi dei dati delle serie di pazienti allotrapiantati, deve essere sempre considerato un bias di selezione dei pazienti in senso peggiorativo. Questo è particolarmente evidente quando il condizionamento è di intensità ridotta, perché di solito i pazienti hanno ricevuto un numero elevato di linee di terapia, dimostrandone la chemioresistenza. Il ruolo del trapianto allogenico nella terapia del LF è stata valutata di recente in alcuni studi. Il primo studio inglese in cui 82 pazienti con LF sono stati allotrapiantati con un condizionamento di intensità ridotta e una T deplezione ex vivo con CAMPATH, seguito da un trapianto da donatore familiare o volontario. Sebbene i criteri di inclusione non siano molto chiari, i risultati sono piuttosto interessanti in quanto OS, PFS e NRM a 4 anni sono 80%, 76% e 8%, rispettivamente. L’outcome è inoltre significativamente differente per i pazienti trapiantati con un donatore familiare rispetto al donatore volontario. In questo studio, l’infusione dei linfociti del donatore fa parte della strategia terapeutica [242]. Il gruppo spagnolo GELTAMO ha pubblicato i dati di 2 studi prospettici in cui 37 pazienti con LF ricaduto o refrattario hanno ricevuto un trapianto allogenico RIC con un donatore HLA identico. Anche in questo caso i risultati sono interessanti con una OS, DFS e NRM a 4 anni del 54%, 57%, e 37%. I dati di sopravvivenza sono differenti, anche se non significativi per la DFS, in rapporto allo stato di malattia apre-allo [243]. Infine, uno studio prospettico canadese ha valutato i risultati di una sequenza HDC-allo in 27 pazienti in prima ricaduta, se trasformati o refrattari o in progressione entro 18 mesi dall’ultima terapia, o in seconda ricaduta. Questi pazienti ricevono quindi una HDC, secondo schema BEAM o BEAC, seguita entro 3-4 mesi dal trapianto allogenico RIC e dalla infusione di cellule staminali periferiche da un donatore familiare HLA identico. L’outcome dei pazienti è estremamente positivo, in quanto la OS e la PFS a 3 anni è 96% con NRM di 4% [244]. In conclusione il panel concorda che il trapianto allogenico può essere considerato, ma solo nell’ambito di sperimentazioni cliniche controllate, in pazienti giovani con LF in recidiva/progressione dopo HDC o in pazienti in recidiva o progressione dopo almeno 2 linee di chemioimmunoterapia. In ogni caso il trattamento allogenico dovrebbe essere somministrato in presenza di malattia chemiosensibile e utilizzando regimi di condizionamento ad intensità ridotta. 3.4 Valutazione della risposta ai trattamenti Ogni paziente con LF a cui viene somministrata una terapia deve essere sottoposto ad accertamenti al termine del trattamento per la valutazione della risposta. Gli esami devono includere esame clinico, esami di laboratorio e TC con MDC. Devono inoltre essere ripetuti tutti gli altri esami che documentavano la presenza di malattia all’esordio. Questo vale ad esempio per la biopsia ossea o per indagini radiologiche di specifici distretti, indagini endoscopiche o visite specialistiche. La valutazione della risposta al trattamento dovrebbe essere eseguita dopo circa un mese dalla fine della terapia. 43 LINEE GUIDA LINFOMI Il tipo di risposta inoltre deve essere codificato secondo quanto indicato dai criteri internazionali recentemente aggiornati e pubblicati (Tabella 6) [245]. Recentemente sono stati resi noti i risultati di 2 studi retrospettivi e di uno studio prospettico che hanno valutato il ruolo della PET nella valutazione della risposta ai trattamenti iniziali. Gli studi hanno dimostrato che i trattamenti convenzionali determinano la negativizzazione della PET nel 75% circa dei pazienti e che i pazienti con PET negativa hanno una PFS significativamente superiore ai pazienti con residuo PET positivo. Questi dati rappresentano la base per lo sviluppo, in studi clinici, di strategie terapeutiche adattate alla risposta [146-148]. 3.5 Follow-up A differenza dei linfomi aggressivi i pazienti non vengono guariti dai trattamenti standard per cui si ritiene necessario un utilizzo più sistematico delle indagini strumentali e una più lunga durata del follow-up al fine di individuare le recidive/progressioni di malattia che nella maggior parte dei casi sono asintomatiche e/o tardive. Esistono pochi dati sul ruolo della sorveglianza radiologica in questi pazienti. In uno studio retrospettivo pazienti in remissione completa erano valutati periodicamente con esame clinico, ematochimici e TC. Globalmente la recidiva è stata riscontrata con imaging nel 4% dei casi [246]. In un più recente studio prospettico è stato valutato il ruolo della PET nel follow-up di pazienti affetti da linfomi non-Hodgkin. Nel gruppo di pazienti con linfomi indolenti ( n:78) la PET ha identificato la recidiva nel 10% dei pazienti a 6 mesi, 12% a 12 mesi, 9% a 18 e 24 mesi,8% a 36 mesi, 6% a 48. Dei 48 pazienti con ricaduta PET positiva 38 erano stati identificati con la TC e 30 erano stati identificati per la comparsa di sintomi [138]. Sulla scora di questi dati si raccomanda di eseguire (NCCN Practice Guidelines in Oncology: Follicular Lymphoma. 2014; version 2): • Una visita completa ogni 3-6 mesi per 5 anni, quindi annualmente (Livello di evidenza 4). • Gli esami di laboratorio (emocromo, LDH, β2-microglobulina, routine) ogni 3-6 mesi per 5 anni, quindi annualmente (Livello di evidenza 4). • Per quanto riguarda gli esami radiologici è opportuno eseguire una TC total body, ogni 6 mesi nei primi due anni e successivamente ogni 12 mesi (Livello di evidenza 4). Ad oggi non esistono dati a sostegno dell’utilizzo della PET nel follow-up dei pazienti con LF [138]. Durante il follow-up è importante riconoscere la trasformazione in linfomi ad alto grado (3 % all’anno per i primi 15 anni) [247]. Bisogna considerare la probabilità di tale evento in caso di aumento LDH, marcato aumento di volume di una singola stazione linfonodale o di una sede extranodale e/o la comparsa di sintomi B (NCCN Practice Guidelines in Oncology: Follicular Lymphoma. 2014; version 2). In queste situazioni l’utilizzo della PET-TC potrebbe essere dirimente, indispensabile comunque la conferma istologica [248] (Livello di evidenza 3). Nonostante alcuni studi abbiano documentato il ruolo prognostico favorevole del raggiungimento di uno stato di remissione molecolare, definito come la scomparsa dopo il trattamento di un marcatore molecolare (t(14;18) o riarrangiamento delle Ig) dal sangue midollare o periferico dimostrata con tecniche ad elevata sensibilità (PCR), lo studio della malattia minima residua al termine del trattamento e nel corso del follow-up non può attualmente essere proposto se non all’interno di uno studio clinico controllato. 44 LINEE GUIDA LINFOMI Tabella 12. Procedure durante il follow up Qualità dell’evidenza SIGN D Forza della Raccomandazione Procedura Raccomandazione Esame clinico Anamnesi ed esame obiettivo ogni 3-6 mesi nei primi cinque anni, poi annualmente (NCCN 2014). Esami ematici (routine+LDH) Ogni 3-6 mesi nei primi 5 anni, poi annualmente (NCCN 2014). D Positiva debole TC collotorace-addome completo Ogni 6 mesi dal temine del trattamento per i primi 2 anni, poi annualmente (NCCN 2014). D Positiva debole Procedure non raccomandate In assenza di indicazioni cliniche i seguenti esami sono “sconsigliati”: -TC-PET con fdG, salvo nei casi di sospetta trasformazione in linfoma aggressivo [248]. -remissione molecolare D Positiva forte 45 Positiva debole 46 Diagnosi di Linfoma Follicolare grado 3b * Evitare FNAB nella fase diagnostica - Utile in certe circostanze FISH per t(14;18) su tessuto oppure PCR su DNA estratto da tessuto neoplastico paraffinato o congelato. - PET-TC scan - Ricerca t(14;18) e/o riarrangiamento Ig su sangue midollare e/o periferico. -Ecocardiogramma Esami utili in casi selezionati: - Pannello IHC completo con CD20,CD79, CD10, BCL2, BCL6, Ki67, CD23. - TC collo , torace, addome con mezzo di contrasto - Sierologia per HIV, HBV e HCV - Biopsia osteomidollare Grado 1,2,3a -LDH e beta2 microglobulina - panel metabolico e dosaggio immunoglobuline - Biopsia linfonodale o di tessuto extranodale *; Conferma istologica di Linfoma Follicolare Requisiti di appropriatezza Diagnosi di Linfoma Follicolare - Sintomi B - Emocromo completo con formula - Esame fisico - Performance Status STADIAZIONE Esami raccomandati Figura 1 LF : Diagnosi e stadiazione VEDI LG DLBCL STADIO III-IV STADIO II STADIO I LINEE GUIDA LINFOMI 3.6 Figure 47 Indicazioni per terapia: - Presenza di malattia attiva (secondo SIE/SIES) - Disponibilità studio clinico No Si Osservazione Immunochemioterapia+/ - RT-IF(per stadi I-II)* o studio clinico *Terapie di prima linea: R-CHOP, R-Bendamustina, R-CVP, R-FM Stadio IIIIV FLIPI alto Stadio I-II FLIPI basso IF-RT 25-30 Gy (prima scelta) o osservazione Monitoraggio attivo con - Visita con esami di laboratorio ogni 3-6 mesi -TC semestrale per i primi 2 anni poi annuale Figura 2 LF : Terapia iniziale Vedi “Gestione follow-up” Vedi “Valutazione risposta” Vedi “Gestione follow-up” LINEE GUIDA LINFOMI -Biopsia osteomidollare (se positiva all’esordio) -Esami di laboratorio Valutazione risposta: -TC RN, PG RC, RP -Mantenimento con Rituximab per 2 anni -Radioimmunoterapia Si No Indicazione al trattamento Recidiva/PG 48 Si No Figura 3 LF : Valutazione della risposta Vedi “Terapia di salvataggio” Vedi “Gestione follow-up” Vedi “Gestione follow-up” LINEE GUIDA LINFOMI Visita periodica -Emocromo completo con formula ogni 3-6 mesi -TC collo, torace, addome, pelvi con mezzo di contrasto ogni 6 mesi per i primi due anni poi annualmente Se PG Paziente pretrattato Paziente era in osservazione Figura 4 LF : Gestione follow-up Vedi “terapia di salvataggio” Vedi “terapia iniziale” LINEE GUIDA LINFOMI 49 50 Valutazione età e durata della risposta alla prima linea ASCT* Immunochemioterapia Radioimmunoterapia Studio clinico *Raccomandato nel paziente giovane o anziano fit come prima linea di salvataggio. E’ raccomandata la conferma istologica per escludere la trasformazione in Linfoma aggressivo. Restaging completo. Recidiva/Progressione con indicazione al trattamento. Figura 5 LF : Terapia di salvataggio Valutazione risposta LINEE GUIDA LINFOMI LINEE GUIDA LINFOMI 4. Linfomi di Hodgkin 4.1 Epidemiologia Il linfoma di Hodgkin (LH) è una patologia relativamente rara che colpisce il sistema linfatico prevalentemente i giovani adulti. Nel periodo 1998-2002 l’incidenza in Italia è stata di circa 3 casi su 100.000 abitanti (3.7 per gli uomini e 3 per le donne), rappresentando lo 0,5% di tutti i tumori diagnosticati e lo 0,2% del totale dei decessi in entrambi i sessi. Dalle stime degli ultimi anni si registra un aumento statisticamente significativo nel sesso femminile, mentre per quanto riguarda la mortalità il trend è stabile nei due sessi. Fino agli anni ’60 la sopravvivenza a 5 anni era al di sotto del 10%. Con l’avvento della chemioterapia di combinazione negli anni ’70 le prospettive di raggiungere una remissione completa e una lunga sopravvivenza sono aumentate in modo significativo. Attualmente i registri sia Americani (SEER), sia Europei (EUROCARE 4), sia Italiani (AIRTUM) riportano una sopravvivenza a 5 anni di oltre l’80%. Secondo il documento congiunto AIOM-AIRTUM del 2011, per i pazienti sopravvissuti dopo 1, 3 e 5 anni dalla diagnosi, la percentuale di sopravvivenza aumenta rispettivamente a 87, 92 e 96 %. In Italia i livelli medi si allineano a quelli della media europea [249-252]. La curva di insorgenza del LH presenta due picchi di età: il primo nella terza decade e il secondo dopo la quinta. Dati più recenti mostrerebbero la scomparsa del secondo picco dovuta ad un'erronea attribuzione di linfomi non-HG a grandi cellule al sottogruppo istologico a deplezione linfocitaria. Nella fascia di età compresa tra 0-44 anni i LH rappresentano il 5,8% dei tumori nei maschi e il 3,6% delle femmine. E' stato postulato che il virus di Epstein-Barr (EBV) abbia un ruolo nella patogenesi del LH, il virus viene identificato in una certa percentuale di casi (circa il 50% nei paesi industrializzati e 90% nei paesi in via di sviluppo). I miglioramenti ottenuti nella cura di questi pazienti sono dovuti principalmente ai progressi della chemioterapia, della radioterapia e ad un più razionale utilizzo della combinazione di entrambe. Tuttavia nelle ultime due decadi è stato evidenziato e quantificato il rischio di tossicità tardive correlate al trattamento, soprattutto in termini di secondi tumori e tossicità cardiaca; la principale causa di morte nei primi 10-15 anni è dovuta al LH, mentre dalla seconda decade in avanti la prima causa è dovuta a secondi tumori e a sequele cardiache [253-257]. Ciò ha indirizzato verso programmi terapeutici che mantengano, o possibilmente aumentino, le percentuali di guarigione, minimizzando il rischio di tossicità a lungo termine in particolare negli stadi iniziali. Nella programmazione terapeutica è importante considerare che le morti per Hodgkin sono più frequenti nei primi dieci anni post terapia, mentre dalla seconda decade la causa principale è determinata da secondi tumori e da patologie cardiache. 4.2 Diagnosi Le caratteristiche principali per un sospetto diagnostico sono: giovane adulto con adenopatia di solito non dolente, prevalentemente a livello delle regioni cervicali, con accompagnamento in una certa percentuale di alcuni segni e sintomi quali febbre, perdita di peso consistente (>10 Kg nei 6 mesi precedenti), sudorazioni profuse notturne, prurito generalizzato, fatigue. A questo quadro standard possono mancare o aggiungersi altre caratteristiche di sedi o sintomi anche in relazione all’istotipo. 51 LINEE GUIDA LINFOMI La diagnosi deve essere fatta su biopsia escissionale di un linfonodo ogni volta sia possibile e comunque essa deve comprendere una quantità di tessuto sufficiente per l’analisi dei requisiti minimi immunoistochimici adeguati per rispondere al quesito diagnostico. E’ quindi da evitare una citologia con ago sottile. 4.3 Classificazione istopatologica Attualmente è in uso la classificazione WHO, derivata dalla classificazione REAL, che divide i linfomi di Hodgkin in due varianti distinte: il LH nodulare a predominanza linfocitaria e il LH classico [7]. Tale distinzione è importante poiché le due entità differiscono per quadro e comportamento clinico, per composizione cellulare e, importante ai fini diagnostici, per la morfologia, per l’immunoistochimica e per il mantenimento o meno dell’espressione genica B-cellulare. Il LH classico comprende 4 sottotipi istologici: sclerosi nodulare, cellularità mista, deplezione linfocitaria e ricco in linfociti. Classificazione istologica del LH sec. WHO 2008 Linfoma di Hodgkin nodulare a predominanza linfocitaria Linfoma di Hodgkin classico - Linfoma di Hodgkin classico sclerosi nodulare - Linfoma di Hodgkin classico ricco in linfociti - Linfoma di Hodgkin classico a cellularità mista - Linfoma di Hodgkin classico a deplezione linfocitaria Questi sottotipi, a loro volta, differiscono per sito di coinvolgimento, caratteristiche cliniche, composizione cellulare, presenza o meno di fibrosi e presenza o meno d’infezione da virus di Epstein Barr. I requisiti minimi immunoistochimici per la diagnosi sono: CD3, CD15, CD20, CD30, CD45. La variante nodulare a predominanza linfocitaria è: CD15-, CD20+, CD30-, CD45+. La variante classica è: CD15+, CD20-, CD30+, CD45-. Si segnala che la variante nodulare a predominanza linfocitaria e il sottotipo ricco in linfociti, pur possedendo caratteristiche immunofenotipiche differenti, presentano buona risposta clinica e outcome alle terapie standard sovrapponibile [258]. La Tabella 13 [10] presenta un pannello anticorpale di base per valutare casi potenzialmente diagnosticabili come LH. Tale pannello è sufficiente nella maggior parte dei casi per porre diagnosi corretta di LH. Occorre ricordare che possono ricorrere fenotipi atipici, come per esempio quelli che comportano l’assenza dell’espressione di CD15. Inoltre, non tutti gli ematopatologi sono convinti che l’immunoreazione per CD45 sia utile come le altre. E’ importante anche essere consapevoli che alcuni casi saranno classificati come linfomi della zona grigia con caratteristiche intermedie fra un linfoma non Hodgkin diffuso a grandi cellule B ed un LH. 52 LINEE GUIDA LINFOMI Tabella13. Pannello anticorpale di base del Linfoma di Hodgkin Fenotipo cellule neoplastiche Reattività normale LH nodulare a Antigene ematopoietica/linf LH classico predominanza oide linfocitaria CD 20 Cellule B, alcune Negativo in molti casi; in Positivo cellule T alcuni casi positivo, di solito associato ad un subset di cellule di Reed-Stenberg LNH B In molti casi positivo CD 3 Cellule T, cellule NK Solo raramente positivo Negativo Negativo CD 15 Granulociti, alcuni istiociti, alcune cellule epiteliali e carcinomi, cellule infettate da CMV Cellule linfoidi attivate Positivo in molti casi (85%) Negativo Negativo in molti casi Positivo Di solito negativo LCA Leucociti Negativo Di solito negativo; occasionalmente positivo; possono risultare positive alcune cellule non neoplastiche Positivo EMA Alcune plasmacellule Solo raramente positivo Alcune cellule positive Di solito negativo CD 30 Di solito positivo LCA antigene comune dei leucociti; EMA, antigene di membrana epiteliale. Nel modello di LH nodulare a predominanza linfocitaria originariamente descritto da Fan e colleghi come "pattern A", le cellule della predominanza linfocitaria (LP) risiedono nel classico nodulo neoplastico, mentre tali cellule fuori del nodulo sono rare (pattern inizialmente invasivo / early invasive NLPHL pattern). Durante la progressione della malattia, le cellule LP aumentano di numero e si estendono anche al di fuori dei noduli neoplastici e infiltrano lo spazio perinodulare (pattern invasivo/frankly invasive NLPHL pattern). È importante sottolineare che la presenza di numerose cellule LP al di fuori dei noduli caratterizza il pattern di crescita francamente invasivo [259]. Questo pattern può indicare l’inizio di una progression verso un pattern diffuso e quindi predire la progressione verso un linfoma diffuso (DLBCL). 53 LINEE GUIDA LINFOMI 4.4 Stadiazione A tutt’oggi la classificazione in stadi si basa sul sistema di Ann Arbor/Cotswolds che definisce 4 (I-IV) stadi di malattia, a loro volta definiti dalla lettera A o B a seconda della presenza o meno dei sintomi sistemici in precedenza elencati [15] (Tabella 14). Si definisce inoltre malattia bulky mediastinica la presentazione di malattia in cui il rapporto tra massa mediastinica e diametro toracico sia maggiore di un terzo, o vi sia una massa linfonodale in altra sede > 10 cm nel diametro maggiore. Gli stadi iniziali a loro volta vengono suddivisi in favorevoli o sfavorevoli a seconda della presenza o meno di fattori di rischio, con alcune differenze tra i principali gruppi europei e americani; mentre negli stadi avanzati è stato formulato uno score prognostico internazionale (IPS) a seconda della presenza o meno di età >45 anni, sesso maschile, stadio IV, Hb< 10,5 g/dL, albumina<4 g/dL, leucociti >15 x 10/L, linfociti< 0,6 x10/L. La presenza di uno o più di questi parametri determina un impatto negativo sul FFP a 5 anni e può determinare una scelta terapeutica più aggressiva [260] (Tabella 15; Tabella 16). Tabella 14. Stadiazione Ann Arbor/Cotswolds STADIO I SEDI INTERESSATE Unica regione linfonodale (I) o singola sede extralinfatica (IE). II Due o più regioni linfonodali dallo stesso lato del diaframma (II) o estensione locale extralinfatica e una o più regioni dallo stesso lato del diaframma (IIE). III Regioni linfonodali in entrambi i lati del diaframma (III), accompagnate o meno da un’estensione locale extralinfatica (IIIE). IV Diffuso coinvolgimento di una o più sedi extralinfatiche. A Assenza di sintomi sistemici. B Presenza di almeno uno dei seguenti sintomi: • Perdita di peso >10% del peso abituale negli ultimi 6 mesi • Febbre ricorrente >38° • Sudorazioni notturne inspiegabili. E’ importante sottolineare che i sintomi correlati ad una prognosi peggiore sono la perdita di peso e la febbre. Le sudorazioni notturne da sole non influenzano negativamente la prognosi e il prurito, non più considerato tra i criteri di Ann Arbor come sintomo B, acquisisce importanza di sintomo sistemico qualora sia ricorrente, generalizzato e altrimenti inspiegabile. Bulky Singola massa delle dimensioni ≥10 cm nel diametro maggiore o massa mediastinica >1/3 del diametro trasverso misurato a livello di D5-D6 su Rx standard. 54 LINEE GUIDA LINFOMI Tabella 15. Confronto fattori di rischio, stadi iniziali favorevoli e sfavorevoli GHSG EORTC FATTORI DI RISCHIO a) bulky mediastino b) Malattia extranodale c) VES ≥ 50 senza sintomi B o ≥30 con sintomi B d) ≥ 3 sedi linfonodali FAVOREVOLI CS I-II CS I-II (sopradiafram.) senza fattori di rischio senza fattori di rischio SFAVOREVOLI CS I o CS IIA con ≥1 fattore di rischio CS IIB con c) o d) ma senza a) e b) NCIC/ECOG a) bulky mediastino a) istologia (no LP/NS) b) età ≥50 anni b) età ≥ 40 anni c) VES ≥ 50 senza sintomi c) VES ≥ 50 B o ≥ 30 con sintomi B d) ≥ 4 sedi linfonodali d) ≥ 4 sedi linfonodali CS I-II (sopradiaframmatico) con ≥1 fattore di rischio NCCN a) bulky mediastino b) VES>50 c) >3 sedi linfonodali d) sintomi B CS I-II CS I-II senza fattori di rischio senza fattori di rischio CS I-II con ≥ 1 fattore di rischio CS I-II con ≥ 1 fattore di rischio Tabella 16. International Prognostic System N° Età>45 anni; sesso maschile;stadio IV; Hb <10,5 g/dL, albumina <4 g/dL, leucociti >15 x 10 /L, linfociti <0,6 x 10 /L FFP a 5 anni (%) 0 84 1 77 2 67 3 60 4 51 >5 42 Fattori prognostici 4.5 Indagini diagnostiche La tipologia e il numero degli esami diagnostici necessari per valutare la reale estensione della malattia ha avuto nelle ultime tre decadi una notevole evoluzione. Il passaggio da una strategia terapeutica prevalentemente basata sulla radioterapia ad una comprensiva di chemioterapia in maniera sempre più ampia ha portato all’abbandono di indagini invasive quali la laparotomia con splenectomia (gravata da una percentuale di morbilità del 10% e mortalità dello 0.5% e con possibilità di sviluppare leucemie secondarie) o la linfografia pedidia. Attualmente lo staging clinico nel LH comprende: anamnesi con attenta valutazione dei sintomi eventualmente presenti, esame obiettivo, esami di laboratorio inclusivi di VES, LDH, albumina, valutazione della funzionalità renale, epatica e tiroidea, test di gravidanza per le donne in età fertile e consulto per programmi di preservazione della fertilità (criopreservazione del seme maschile o di oociti o tessuto ovarico nelle femmine), con prescrizione di estro progestinici, ovaropessi in caso vi sia in programma una RT pelvica. 55 LINEE GUIDA LINFOMI Importante la valutazione delle eventuali comorbidità mediante la ricerca di sierologia positiva per HBV, HCV e HIV, lo studio della funzionalità cardiaca con ecocardiogramma e la valutazione della frazione di eiezione. Per i pazienti trattati con bleomicina è consigliabile eseguire prove di funzionalità respiratoria con spirometria. Le attuali indagini radiologiche comprendono Rx standard, con misurazione del rapporto tra massa mediastinica e diametro toracico in antero-posteriore a livello del passaggio D5-D6 (definizione di bulky se rapporto > 0,33), TC collo, torace, addome, PET o PET-TC. Per quanto attiene la biopsia osteomidollare, la positività nel LH è circa il 5%. Per tale motivo questa procedura diagnostica è da eseguire solo nei pazienti ritenuti a maggior rischio di interessamento midollare, i pazienti in stadio avanzato o quelli in stadio localizzato con fattori prognostici sfavorevoli. 4.5.1 TC, PET, PET-TC diagnostica La TC collo torace e addome completo è attualmente l’indagine standard nella valutazione iniziale, monitoraggio della risposta ai trattamenti e nella valutazione finale dopo completamento del programma terapeutico. Limiti di questa tecnica d’imaging sono: informazioni sulle dimensioni, ma non sulle funzioni cellulari, incapacità a rilevare lesioni piccole < al centimetro. La PET (tomografia a emissione di positroni con fluorodesossiglucosio) e la PET/TC sono un’utile integrazione alla TC standard con aumento significativo della sensibilità e della specificità diagnostica [261, 262]. Attualmente uno studio di imaging funzionale con PET o PET-TC è altamente raccomandata in fase diagnostica stadiativa. Tra le due metodiche è da preferire l’esecuzione della PET-TC. 4.6 Trattamento del linfoma di Hodgkin 4.6.1 Terapia stadi iniziali La RT esclusiva a grandi campi estesi è stata per molte decadi il trattamento standard del LH classico in stadio iniziale [263]. Il ruolo della radioterapia ha subito un progressivo ridimensionamento per le seguenti evidenze: • Maggior numero di recidive negli stadi precoci dopo trattamento con la sola radioterapia, con teorica necessità di stadiazione patologica (laparosplenectomia); • Il presunto incremento a distanza di neoplasie secondarie in territorio irradiato. Sono stati recentemente pubblicati i risutati finali di uno studio randomizzato canadese che aveva confrontato un trattamento con ABVD vs radioterapia a campi estesi in pazienti con LH in stadio localizzato. Lo studio ha arruolato 405 pazienti e dopo un follow-up medio di 12 anni ha dimostrato la superiorità del trattamento chemioterapico rispetto alla RT esclusiva per un incremento dei decessi per cause diverse dal linfoma nei pazienti trattati con RT [264] (Livello di evidenza 1++). Tale dato è certamente importante, soprattutto nel sottolineare come possibile endpoint clinico futuro un parametro quale la sopravvivenza globale, ma è fortemente limitato dal fatto che la strategia terapeutica impiegata (STNI, con o senza ABVD) rappresenti una strategia terapeutica obsoleta, non più utilizzata da molti anni nella pratica clinica, e nella quale una radioterapia a campi estesi e per di più associata alla chemioterapia gioca un ruolo importante nell’eccesso di mortalità. L’ABVD rimane lo schema polichemioterapico di riferimento da utilizzare nei pazienti con LH in stadio iniziale [265-270]. Una strategia combinata di CT+RT è considerata lo standard sia delle forme favorevoli che sfavorevoli (criteri EORTC, GHSG). Il trattamento standard dei pazienti con malattia in stadio limitato è generalmente identificato nella somministrazione di 4 cicli ABVD seguiti da radioterapia di tipo IF-RT [268]. 56 LINEE GUIDA LINFOMI Nel tentativo di ridurre la tossicità a lungo termine potenzialmente correlata alla RT (secondi tumori, tossicità cardiaca), diversi studi hanno valutato il ruolo della sola CT nel trattamento degli stadi iniziali [271274]. Al momento attuale i dati sull’efficacia della sola CT rispetto alla combinazione CT+RT non sono conclusivi e non permettono di consigliare tale modalità al di fuori di studi clinici, evidenziando anzi un peggior outcome clinico nei pazienti trattati con sola chemioterapia rispetto a quelli trattati in modalità combinata, per lo meno in termini di sopravvivenza libera da progressione. Altri studi hanno messo a confronto la sola radioterapia con trattamenti combinati e hanno dimostrato la superiorità di quest’ultima modalità sia per il sottogruppo favorevole che sfavorevole [264, 266]. Il gruppo EORTC ha pubblicato nel 2007 i risultati dello studio H8 su 1538 pazienti con LH in stadio localizzato dimostrando come un breve trattamento chemioterapico seguito da IF-RT era superiore alla sola radioterapia a campi estesi (STNI) nel sottogruppo di pazienti a prognosi favorevole e consentiva di ottenere risultati analoghi ad un trattamento prolungato di chemioterapia (6 cicli) seguito da IFRT o ad un consolidamento con radioterapia STNI [266]. Nelle forme favorevoli (secondo i criteri del GHSG) un recente studio randomizzato del gruppo tedesco su 1370 pazienti ha paragonato il trattamento standard (4 cicli di ABVD + 30 Gy RT-IF) a trattamenti ridotti sia nei cicli di chemioterapia che nelle dosi di radioterapia dimostrando che 2 cicli di ABVD seguiti da 20 Gy di RT-IF sono parimenti efficaci in termini di time to treatment failure e sopravvivenza globale ma meno tossici rispetto al trattamento standard [275] (Livello di evidenza 1++). Recentemente i gruppi EORTC/FIL/LYSA hanno pubblicato i risultati della prima interim dello studio H10 in cui veniva utilizzata una valutazione precoce della risposta con PET in pazienti con LH in stadio localizzato nel tentativo di eliminare la radioterapia dopo 3 cicli di ABVD nei pazienti con evidenza di risposta precoce. Lo studio ha concluso che la radioterapia non può essere omessa dal trattamento dei pazienti con LH in stadio localizzato in virtù di un numero inferiore di progressioni di malattia osservato tra i pazienti trattati con modalità combinata rispetto a quelli trattati con sola chemioterapia [276] (Livello di evidenza 1++). Nelle forme svaforevoli il gruppo GHSG è giunto alle medesime conclusioni del gruppo EORTC confermando lo standard di 4 cicli ABVD seguiti da IFRT 30Gy [267] (Livello di evidenza 1++). Nell studio HD11gli autori tedeschi hanno paragonato con un disegno fattoriale 2x2 la terapia con 4 cicli ABVD verso 4 cicli di BEACOPP e una radioterapia IF standard con 30Gy vs 20Gy. I risultati su 1395 pazienti hanno dimostrato che il BEACOPP seguito da RT (20 o 30 Gy) non era superiore a 4 cicli di ABVD + 30 Gy RT-IF, mentre ABVD seguito da 20 Gy RT-IF era inferiore in termini di controllo della malattia [267]. Successivamente lo stesso gruppo, nel tentativo di migliorare l’outcome di tali pazienti, ha paragonato i 4 cicli di ABVD + 30 Gy RT-IF con 2 cicli di BEACOPP escalated seguiti da 2 cicli di ABVD + 30 Gy RT-IF dimostrando su 1528 pazienti che il regime 2+2 è superiore in termini di freedom from treatment failure ma significativamente più tossico rispetto allo standard. Rimangono da valutare i dati sulla tossicità a lungo termine [277]. Il concetto di IF, che ha totalmente sostituito lo storico approccio cosiddetto “extended fields” (Mantellina, Y rovesciata) garantendo minor tossicità a parità di tassi di cura, fa riferimento all’irradiazione delle sole sedi linfonodali interessate all’esordio, con l’inclusione, generalmente, della stazione linfonodale contigua non interessata; in questo senso l’IF è più correttamente definibile come “regional field”. Pur con questa estensione all’immediata regione non clinicamente coinvolta, la RT-IF comporta certamente una significativa riduzione dei volumi irradiati rispetto ai campi estesi classici, con notevole risparmio dei tessuti sani. Una più recente evoluzione, ancora del tutto sperimentale, del concetto di involved field è rappresentata dall’approccio “involved nodal” RT, che comporta un’ulteriore riduzione dei campi di radioterapia, fino ad arrivare all’irradiazione dei soli linfonodi interessati all’esordio, e non della regione linfonodale coinvolta. Tale riduzione dei campi di RT è attualmente in fase di sperimentazione. In attesa della conclusione degli studi clinici internazionali, pur in presenza di studi retrospettivi [278] che ne giustificherebbero la sicurezza clinica, il trattamento radioterapico involved nodal non deve essere utilizzato nella normale pratica clinica, continuando a considerare il trattamento IF lo standard radioterapico. 57 LINEE GUIDA LINFOMI Una nuova generazione di studi clinici sta attualmente utilizzando la valutazione precoce della risposta mediante imaging funzionale (interim-PET) per identificare eventuali pazienti in cui sia possibile de-escalare il trattamento mediante l’omissione della radioterapia. Nell’attesa di conoscere i risultati di tali studi prospettici, bisogna comunque sottolineare le numerose criticità relative all’interpretazione della interimPET (criteri non univoci) ed alla ovvia necessità che l’omissione della radioterapia debba essere bilanciata da una chemioterapia con maggior numero di cicli (a fronte di una prevedibile modesta tossicità di una radioterapia involved fields e a dosi ridotte rispetto ai dati storici della radioterapia a campi estesi e dosi elevate). Si ritiene quindi che il trattamento standard degli stadi iniziali sia: Pazienti in stadio iniziale a prognosi favorevole: 3-4 cicli di ABVD + RT-IF (30Gy) (2 cicli ABVD + 20 Gy se criteri GHSG); Pazienti in stadio iniziale a prognosi sfavorevole secondo i criteri sia del GHSG che dell’EORTC: 4 cicli di ABVD + RT-IF (30Gy). Alla raccomandazione di un utilizzo combinato chemio-radioterapico potrebbero fare eccezione i pazienti con LH a predominanza linfocitaria in stadi precoci, per i quali è segnalata l’ottima efficacia in termini di PFS e OS del solo trattamento radioterapico IF [279]. Qualità dell’evidenza SIGN A A A A Raccomandazione clinica I pazienti affetti da LH in stadio localizzato dovrebbero essere trattati con approccio combinato chemio radioterapico (breve chemioterapia seguita da radioterapia limitata) [264, 266] . I pazienti con LH in stadio localizzato a prognosi sfavorevole dovrebbero essere trattati con 4 cicli della combinazione ABVD seguiti dalla soministrazione di 30Gy di RT con modalità IF [267]. I pazienti con LH in stadio localizzato a prognosi favorevole dovrebbero essere trattati con 3-4 cicli della combinazione ABVD seguiti dalla soministrazione di 30Gy di RT con modalità IF [268, 276]. I pazienti con malattia localizzata favorevole secondo criteri GHSG possono essere trattati con 2 cicli ABVD seguiti da RTIF 20 Gy [275]. Forza della raccomandazione clinica Positiva forte Positiva forte Positiva forte Positiva forte 4.6.2 Terapia stadi avanzati Il primo schema chemioterapico utilizzato per la cura della malattia avanzata è stato il MOPP che permetteva di raggiungere la remissione di malattia in circa la metà dei pazienti [280, 281]. Successivamente alla valutazione dei dati di efficacia dell’ABVD, diversi studi randomizzati hanno dimostrato la superiorità di quest’ultimo schema rispetto al MOPP [282, 283]. Nella terapia della malattia avanzata l’utilizzo della sola chemioterapia, purchè somministrata per un numero adeguato di cicli è superiore al trattamento combinato come documentato da una metanalisi pubblicata dal gruppo tedesco [284] (Livello di evidenza 1++). Per quanto riguarda la scelta del trattamento chemioterapico, diversi studi hanno valutato l’efficacia di schemi alternati o ibridi MOPP/ABVD, dimostrando che l’ABVD è superiore alla MOPP e paragonabile agli schemi ibridi o alternati ma con una tossicità inferiore [285-291]*. 58 LINEE GUIDA LINFOMI Qualità Globale delle evidenze GRADE Raccomandazione clinica Forza della raccomandazione clinica L’ABVD è superiore alla MOPP ed equivalente agli schemi ibridi o alternati ma meno tossico e deve essere considerato lo schema standard”. Molto bassa * La valutazione complessiva della qualità delle evidenze ad oggi disponibili circa “l’efficacia della somministrazione di ABVD rispetto ad un altro schema terapeutico BEACOPP”, la valutazione del rapporto tra i benefici ed i rischi correlati e la formulazione della raccomandazione relativa al quesito posto, sono state analizzate secondo metodologia GRADE (vedere capitolo 6). Positiva forte Due studi randomizzati del GELA e dell’EORTC hanno confermato che l’utilizzo sistematico della radioterapia, condotta dopo 6-8 cicli di chemioterapia, con la tecnica IF su tutte le sedi inizialmente coinvolte, non migliora i risultati ed è perciò da evitare nei pazienti in risposta completa al termine del trattamento chemioterapico, evidenziando per contro un ruolo positivo della RT nei pazienti in RP al termine del trattamento chemioterapico [292, 293]. Anche i risultati dello studio tedesco HD12, sembrano suggerire la possibilità di evitare questo tipo di irradiazione [294]. In questo studio tuttavia un’elevata percentuale di pazienti con lesione bulky alla diagnosi e randomizzata a non ricevere la radioterapia, ha prudenzialmente ricevuto la radioterapia. La valutazione delle evidenze per formulare una raccomandazione sull’uso della radioterapia di consolidamento in pazienti con malattia avanzata deve oggi necessariamente confrontarsi con l’utilizzo della PET nella valutazione della risposta. I recenti risultati dello studio tedesco HD15 [295] sembrerebbero confermare la possibilità di ridurre l’intensità della chemioterapia e di omettere la radioterapia di consolidamento nei pazienti PET negativi al termine del programma chemioterapico, evidenziando un valore predittivo negativo della PET del 94%. Lo stesso studio tedesco HD15, che prevedeva la RT in presenza di residui morfologici > 2.5 cm di diametro positivi alla PET finale (da eseguire solo in presenza di residui morfologici di dimensioni superiori al cut-off di 2.5 cm), ha anche dimostrato l’ottimo contributo terapeutico della radioterapia in tale particolare scenario. In caso di risposta parziale alla chemioterapia (BEACOPP) ma con residui linfonodali di diametro inferiore ai 2,5 cm la RT può essere omessa. Analogamente, la RT puo’ essere omessa in caso di residui di diametro > 2.5 cm purchè PET negativi (Livello di evidenza 1++). Gli studi che valutano il ruolo della RT dopo ABVD e che utilizzano le PET per la valutazione della risposta sono attualmente in corso. Più controversa è la necessità di irradiare o meno le aree bulky all’esordio. Ad oggi non esistono studi che abbiano valutato il ruolo della radioterapia in soggetti con malattia avanzata e localizzazione bulky. In base alle evidenze disponibili la decisione sulla somministrazione di IF-RT in pazienti con malattia bulky dovrebbe essere basata sulla risposta al trattamento chemioterapico, analogamente ai pazienti senza malattia bulky. La recente valorizzazione del ruolo prognostico della negatività PET dopo 2 soli cicli di chemioterapia suggerisce l’utilità di una modulazione del trattamento sulla base della PET precoce ma questa strategia dovrebbe per il momento essere limitata a studi clinici controllati. Rimane da definire il ruolo del BEACOPP che non ha ancora dimostrato una chiara superiorità nei confronti dell’ABVD, anche se alcune recenti pubblicazioni sembrano dimostrare un vantaggio per questo schema nei confronti dell’ABVD o degli schemi ibridi, seppur con una significativa maggiore tossicità [296-300]. In particolare in una recente metanalisi il gruppo tedesco ha analizzato gli studi pubblicati di confronto tra ABVD e BEACOP concludendo come lo schema BEACOPP sia associato ad un vantaggio in termini di sopravvivenza rispetto a ABVD stimando una riduzione del rischio di morte pari al 9% [301]. 59 LINEE GUIDA LINFOMI Non ha nessun ruolo al momento un’intensificazione precoce nei pazienti a prognosi sfavorevole. Infatti, uno studio condotto dall’EBMT, recentemente aggiornato nel follow-up, ha dimostrato che dopo 4 cicli di ABVD non esiste alcuna differenza tra continuare lo stesso schema o intensificare con HDC [302, 303]. Quindi la HDC frontline non è indicata in pazienti responsivi alla chemioterapia convenzionale (Livello di evidenza 1++). L’evidenza degli studi analizzati è solo minimanete indebolità dal fatto che nello studio randomizzato citato i criteri di inclusione che definiscono ad i pazienti ad alto rischio non sono stati validati in modo prospettico, e non sono stati utilizzati in maniera del tutto omogenea tra i centri. Qualità dell’evidenza SIGN A B A Raccomandazione clinica I pazienti con LH in stadio avanzato dovrebbero essere trattati con un programma di 6-8 cicli di chemioterapia [284]. In caso di risposta parziale alla chemioterapia ma con residui linfonodali di diametro inferiore ai 2,5 cm la RT può essere omessa. Analogamente, la RT puo’ essere omessa in caso di residui di diametro > 2.5 cm purchè PET negativi. L’evidenza su cui si basa questa raccomandazione deriva da una sperimentazione su pazienti trattati solamente con chemioterapia BEACOPP e non con ABVD [295]. I pazienti con LH ad alto rischio responsivi al trattamento iniziale non devono essere trattati con un consolidamento con HDC [302, 303] . Forza della raccomandazione clinica Positiva forte Negativa debole Negativa forte 4.6.3 Terapia di salvataggio Esiste una frazione di pazienti che non rispondono alla chemioterapia di prima linea, definiti come refrattari (progressione durante il trattamento o recidiva entro 3 mesi dalla fine della terapia di prima linea) o che ricadono dopo aver ottenuto la remissione completa. Due studi randomizzati e una serie di studi retrospettivi o prospettici hanno valutato i risultati ottenuti in pazienti con malattia refrattaria o in recidiva, che hanno raggiunto una risposta almeno parziale dopo la terapia di salvataggio. Il primo studio randomizzato è quello del BNLI [304] che ha randomizzato 40 pazienti dopo una terapia di induzione comune con miniBEAM, a proseguire con la stessa terapia oppure a ricevere una HDC con BEAM. Lo studio ha dimostrato che la EFS e la DFS sono significativamente migliori nel braccio HDC. Il secondo studio [305] conferma che dopo una terapia di salvataggio efficace (dexa-BEAM), che permette di ottenere una remissione parziale o completa, la HDC migliora in modo significativo la FFTF a 3 anni mentre non si evidenzia una differenza significativa per la OS, probabilmente per un effetto cross-over. Tutti gli studi non randomizzati confermano che circa il 60% dei pazienti con malattia chemiosensibile rimane libero da ricaduta dopo HDC; inoltre la mortalità trapiantologica è bassa (meno del 5% negli studi più recenti con condizionamento TBI-free). Alcuni pazienti potrebbero non essere avviati alla terapia ad alte dosi ma trattati con la chemioterapia convenzionale, se recidivano in modo limitato (stadio I/II), se sono stati trattati con la sola radioterapia in prima linea e se non presentano fattori prognostici aggiuntivi [306]. In alcuni studi sono stati evidenziati diversi fattori prognostici nei pazienti con malattia chemiosensibile al salvataggio che influenzano i risultati dopo HDC e che potrebbero guidare la strategia terapeutica in modo più razionale. Tra i fattori prognostici la sensibilità alla terapia di salvataggio rimane il più forte in termini di sopravvivenza. A tale proposito uno studio francese [307] ha riportato i risultati ottenuti modificando la terapia tra 3 gruppi di pazienti definiti sulla base di uno score prognostico precedentemente costruito dallo stesso gruppo [308]. In questo studio il gruppo a prognosi peggiore era quello composto dai pazienti refrattari alla terapia di prima linea, un secondo gruppo era quello dei pazienti ricaduti con ≥ 2 fattori di rischio ed il terzo gruppo era quello di pazienti ricaduti senza fattori prognostici. I primi due gruppi hanno ricevuto una doppia HDC mentre il terzo una singola HDC. In questo modo, la FF2F (freedom from 2nd 60 LINEE GUIDA LINFOMI failure) e la OS a 5 anni sono risultati 46% e 57% nei pazienti refrattari, 53% e 52% nel gruppo con ≥ 2 fattori di rischio e 85% e 73% nel gruppo con 0-1 fattori. Josting et al. hanno recentemente pubblicato i risultati di uno studio randomizzato in cui lo schema classico di CT di salvataggio con HDC secondo schema BEAM è stato confrontato ad uno schema intensivo sequenziale. I risultati ottenuti nei 2 bracci di trattamento non sono differenti in termini di freedom from treatment failure (FFTF, 71% vs 65%), OS (87% vs 80%), e PFS (72% vs 67%). Di rilievo in questo studio è anche la validazione dello score prognostico, basato sulla presenza di anemia, stadio IV e ricaduta precoce o multipla, precedentemente descritto [309]. Uno studio recente del Memorial Sloan Kettering ha valutato, dopo un follow-up di circa 11 anni, la qualità della vita e l’incidenza di seconde neoplasie in un gruppo di 218 pazienti con LH trattati con HDC. Si è evidenziato che la maggior parte dei pazienti decede a causa del linfoma, e che la probabilità di morte non associata al linfoma è di 8% a 10 anni e 17% a 20 anni. L’incidenza cumulativa di sviluppare una seconda neoplasia (che sopravviene dopo una mediana di 9 anni dal trapianto) aumenta progressivamente nel tempo (2% a 5 anni, 5% a 10 anni, 15% a 15 anni), con un rischio di 6 volte più alto rispetto alla popolazione generale. Anche se i valori medi riportati nei questionari di QOL (quality of life) non sono differenti rispetto alla popolazione generale, i pazienti trapiantati presentano più frequentemente problemi cognitivi e sociali [310]. La HDC con supporto cellulare autologo periferico deve essere proposta a pazienti con recidiva precoce e tardiva [304, 305] (Livello di evidenza 1++). Pazienti in recidiva, trattati inizialmente con la sola radioterapia, senza altri fattori prognostici negativi, possono ricevere chemioterapia convenzionale. In questi casi il trattamento sistemico deve essere seguito da RT-IF, se possibile. In caso di recidiva localizzata (stadio I-II) dopo trattamento convenzionale, può essere presa in considerazione la somministrazione di radioterapia come modalità esclusiva di terapia di salvataggio [311] (Livello di evidenza 3). Pazienti con malattia refrattaria, definita come progressione durante la chemioterapia di prima linea, o recidivati entro 3 mesi dalla fine della stessa rappresentano il gruppo a prognosi peggiore con una sopravvivenza media di circa 30% dopo HDC. Anche tra i pazienti refrattari è possibile identificare dei sottogruppi con prognosi differente. Infatti, è interessante analizzare in dettaglio lo studio del gruppo tedesco [312] che ha valutato 206 pazienti refrattari. Di questi, 74% era stato trattato con CT, il 23% con RT e per il 6% non era stato possibile alcun trattamento. La risposta globale dopo CT era risultata 43% e dopo RT 66%. Solo il 33% dei pazienti era stato sottoposto a HDC. La maggior parte non aveva potuto ricevere trattamento ad alte dosi a causa della progressione rapida della malattia o per le complicanze dopo la terapia di salvataggio. Globalmente la FF2F a 5 anni e la OS sono risultate pari al 17% e al 26% mentre nei pazienti trapiantati al 31% e al 43% rispettivamente. Dall’analisi multivariata 3 fattori prognostici sono risultati predittivi della sopravvivenza: età (cut-off 50 anni), Karnofski performance status (cut-off 90%) e ottenimento di una risposta dopo la prima linea. Di particolare interesse si è rivelato l’uso della RT che ha permesso di ottenere una FF2F e OS di 26% e 57% quando applicata a pazienti con malattia localizzata (stadio I/II). Quest’ultimo risultato è stato anche riportato da altri autori [313, 314], soprattutto in assenza di alcuni fattori quali sintomi B e malattia extranodale. Una nota particolare è che, a differenza dei pazienti ricaduti, solo 2 studi hanno evidenziato la valenza prognostica della chemiosensibilità pre-HDC [315, 316]. Smith et al. hanno pubblicato i dati di 214 pazienti refrattari e la EFS e OS sono stati 45% e 55% a 6 anni. In un’analisi multivariata sono stati identificati 2 fattori che influenzano l’outcome: la presenza di malattia extranodale e bulky (diametro > 5cm). La EFS e OS con 0, 1 o 2 fattori è stata 65% e 81%, 47% e 55%, 24% e 27%, rispettivamente [317]. In base ai risultati degli studi descritti, pur in mancanza di trial randomizzati la HDC con supporto cellulare autologo periferico è indicata nei pazienti con malattia refrattaria [312] (Livello di evidenza 3). Uno dei problemi nell’interpretazione dei risultati della terapia convenzionale e della HDC è legato alla persistenza di masse residue individuate con la TC, soprattutto quando era presente una malattia bulky. L’uso di studi funzionali quali la scintigrafia con Gallio, e più recentemente la FDG-PET, hanno permesso di valutare al meglio la risposta dopo terapia, tanto che quest’ultima tecnica diagnostica è ormai integrata nei criteri di risposta. Nel caso specifico della HDC, il contributo della FDG-PET sembra essere importante. 61 LINEE GUIDA LINFOMI Il ruolo prognostico della risposta preHDC valutata con FDG-PET è confermato da numerosi studi retrospettivi o prospettici [73, 318-322]. L’interesse principale della FDG-PET pre-HDC resta quello di poter identificare pazienti con prognosi infausta che potrebbero quindi beneficiare di terapie alternative prima di procedere con HDC o nella fase post trapiantologica. Non ci sono attualmente indicazioni relative alla modifica della strategia terapeutica nel paziente candidato ad HDC. Questi pazienti dovrebbero essere inclusi in studi clinici controllati. Recentemente sono stati pubblicati i risultati di uno studio di fase II che utilizza il farmaco Brentuximab Vedotin in monoterapia nel trattamento dei pazienti con malattia recidiva/refrattaria dopo ASCT o nei pazienti non eleggibili al trapinto autologo. I risultati dimostrano una notevole attività del trattamento in una fase della malattia in cui mancano adeguate alternative terapeutiche. Sono in corso numerosi studi in cui il Brentuximab Vedotin viene associato ai trattamenti convenzionali [323] (Livello di evidenza 3). L’uso del trapianto allogenico nel LH è iniziato negli anni ’80, con l’utilizzo di MAC, in pazienti con malattia attiva e trattati con diverse linee di CT e RT [104, 324-327]. La conseguenza di queste variabili è stata un’elevata TRM e un’elevata percentuale di ricadute o progressioni, che hanno completamente “cancellato” un eventuale effetto graft versus Hodgkin. Due studi hanno confrontato il trapianto allogenico con l’HDC senza poter dimostrare una superiorità dell’allotrapianto dovuta alla presenza dell’effetto immunologico. Tuttavia, nello studio di Akpek, quando l’analisi veniva ristretta ai pazienti con malattia sensibile pre-trapianto, la OS, la PFS e il rischio di ricaduta a 10 anni risultavano tendenzialmente migliori dopo allo (OS 63% vs 44%, PFS 44% vs 33%, ricadute 34% vs 51%, rispettivamente). Infine Sureda et al. [328] ha pubblicato uno studio caso controllo in cui sono stati confrontati pazienti con LH che hanno ricevuto un trapianto previo MAC o RIC. Questo studio conferma la minore incidenza di mortalità non dovuta alla ricaduta (non relapse mortality, NRM) nel RIC (NRM a 1 anno 23% vs 43%) con un vantaggio sulla sopravvivenza (OS a 5 anni 28% vs 22%). Anche in questo studio è evidente che la malattia refrattaria al momento dell’allotrapianto è un fattore predittivo della sopravvivenza, così come è evidente l’effetto protettivo della GvHD nella sua forma cronica. Tuttavia, il rischio di ricaduta è maggiore dopo RIC. Attualmente sono stati riportati numerosi studi [116, 119, 329-333] in cui il trapianto allogenico è stato effettuato dopo RIC e attraverso i quali si è osservato che: La maggior parte dei pazienti inclusi è ricaduta dopo HDC o ha ricevuto diverse linee di CT (da 2 a 5); La TRM si é ridotta in modo considerevole rispetto al condizionamento MAC, pur sottoponendo al trapianto allogenico pazienti in ricaduta dopo HDC; Lo stato di malattia pre-allo (chemiosensibile vs malattia refrattaria) si conferma come il fattore prognostico più forte anche in questo setting di pazienti, per la sopravvivenza, la ricaduta e per la TRM, in associazione ad altri fattori quali il performance status, l’età ed il numero di linee di CT > 3; La presenza di graft versus host disease si correla, in molti ma non tutti gli studi, con una riduzione della incidenza di ricadute post-allo; La sopravvivenza dei pazienti in ricaduta post-HDC è superiore per i pazienti allotrapiantati rispetto ai non trapiantati; La OS e PFS sono piuttosto riproducibili nei vari studi essendo intorno al 50-60% e al 25-30%, rispettivamente. Alcuni lavori hanno confermato o prodotto nuove informazioni per quanto riguarda il trapianto. Il GITMO ha confermato in uno studio retrospettivo i dati di 2 studi di minori dimensioni, con un’analisi donor vs no donor. In questo studio, i pazienti ricaduti dopo HDC, che hanno un donatore e che ricevono un trapianto allogenico hanno una OS e PFS statisticamente superiori rispetto al gruppo senza donatore [334]. In uno studio prospettico di fase 2 congiunto EBMT/GELTAMO, 92 pazienti con HL refrattari, sono stati sottoposti ad un trapianto allogenico da donatore identico utilizzando lo stesso regime RIC. La PFS a 4 anni per i pazienti trapiantati (78) è stata di 24%, mentre la OS di 43%, confermando i dati di tanti studi retrospettivi. La presenza di GVHD cronica riduce l’incidenza di ricadute e la NRM a 1 anno è di 15% [335]. Due studi hanno valutato il significato della valutazione della risposta PET prima e dopo il trapianto allogenico, con risultati discordanti. In uno studio italiano, con una casistica che comprende anche i LNH, la 62 LINEE GUIDA LINFOMI PET positiva prima del trapianto mantiene una valenza prognostica significativa e la OS e PFS a 3 anni è risultata essere 76% e 73% vs 33% e 31%, nei pazienti PET negative e PET positivi, rispettivamente [336]. In uno studio inglese, invece, in pazienti con LH e LNH, mentre la valutazione PET pre-allo non identifica una popolazione di pazienti con un rischio di ricaduta maggiore e minore sopravvivenza, la valutata posttrapianto con PET e successivo trattamento al momento della positivizzazione o aumento della captazione con DLI, ha permesso di ottenere una PET negativa in 13/14 pazienti. Un limite importante di questo studio che pochi pazienti sono stati biopsiati per provare la recidiva istologicamente [337]. Infine, Peggs et al. hanno riporato i dati di 76 pazienti, e tra questi 46 ricevono le DLI. Gli autori confermano l’esistenza di un effetto allogenico contro il LH in quanto i pazienti che ricevono le DLI perché con chimerismo misto ma senza malattia, hanno una incidenza di recidiva di solo 5%, confrontato con i pazienti sempre senza malattia ama con chimerismo completo che non ricevono le DLI, la cui incidenza di recidiva è del 43%. Inoltre per i pazienti in recidiva, la percentuale di remissione completa è ottenuta nel 79% dei pazienti [338]. Lo stato di malattia pre-allo è sempre un elemento prognostico deciso per l’outcome dei pazienti. Tuttavia, con le terapie “convenzionali” le probabilità di ottenere una riduzione di malattia significativa è limitata, anche per la ridotta tolleranza agli schemi di polichemioterapia. Di recente, la situazione è cambiata con l’uso del brentuximab vedotin, un anticorpo anti-CD30 coniugato con un veleno del fuso (auristatina E). L’anticorpo, dopo legame con il CD30, viene internalizzato e l’auristatina rilasciata con induzione della morte cellulare. In uno studio di fase 1, Younes et al. ha identificato la dose massima tollerata del brentuximab vedotin (1.8 mg/kg ogni 3 settimane) in una coorte di pazienti mista, ma prevalentemente con linfoma di Hodgkin. In un successivo studio di fase 2, in pazienti unicamente con LH, recidivati o refrattari dopo un ciclo di chemioterapia ad alte dosi, il brentuximab vedotin ha ottenuto una risposta globale del 75% (remissione completa 34%). La mediana della PFS è stata di 5.6 mesi e per i pazienti che ottengono la remissione completa di 20 mesi. Il farmaco è ben tollerato con una tossicità prevalentemente neurologica periferica sensitiva (42%). Questi dati indicano che, quando disponibile, il brentuximab vedotin induce una eccellente citoriduzione con una ridotta tossicità d’organo, permettendo così di avviare più pazienti al trapianto allogenico con una malattia chemio sensibile [323, 339]. Il trapianto allogenico è indicato nei pazienti in recidiva dopo HDC e con malattia chemiosensibile (valutata con FDG-PET) [335] (Livello di evidenza 3). Il condizionamento al di fuori di uno studio clinico dovrebbe essere di tipo RIC e non mieloablativo. Questi pazienti dovrebbero essere inclusi in studi clinici controllati. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica A La HDC con supporto cellulare autologo periferico dovrebbe essere proposta a pazienti con recidiva precoce e tardiva [304, 305]. Positiva forte D Pazienti con recidiva limitata (stadio I/II), senza altri fattori prognostici sfavorevoli, possono essere trattati con RT-IF [311]. D La HDC con supporto cellulare autologo periferico dovrebbe essere proposta a pazienti con malattia refrattaria [312]. Positiva forte D Il trapianto allogenico dovrebbe essere proposto ai pazienti in recidiva dopo HDC e con malattia chemio sensibile [335]. Positiva debole D I pazienti con malattia in recidiva o refrattaria dopo trapianto autologo o non candidabili al trapianto autologo possono essere trattati con Brentuxima Vedotin [323]. 63 Positiva debole Positiva forte LINEE GUIDA LINFOMI 4.7 Valutazione della risposta ai trattamenti - Ruolo della PETinterim e PET finale Al termine del trattamento i pazienti devono essere sottoposti a ristadiazione completa con controllo di tutti i siti iniziali di malattia. La TC è l’esame radiologico più importante nella valutazione della risposta, oltre all’esame fisico e al controllo di parametri alterati all’inizio della malattia. La PET2 (interim-PET) ha mostrato un ottimo valore predittivo negativo in pazienti in stadio iniziale, con PFS del 95% sia dopo completamento della terapia con sola chemioterapia o con radioterapia [340-343]. Negli stadi iniziali non tutti gli autori danno a questi risultati la stessa interpretazione poiché dipende dalla politica terapeutica di ciascun centro: utilizzo di chemioterapia x 2 cicli e poi radioterapia (la valutazione PET intermedia in questo caso ha meno senso), oppure definizione del proseguo del programma terapeutico a seconda del risultato della PET interim (se negativa, circa 80% ulteriori 2 cicli di ABV, se positiva, circa il 20% aggiunta della radioterapia). Questa differenza nei programmi terapeutici e quindi del posizionamento e interpretazione dei dati PET è in corso di valutazione in studi controllati volti a verificare, tramite i risultati della PETinterim, l’eventuale costo in termini di PFS a fronte della rinuncia alla radioterapia. Inoltre non c’è completo consenso attorno all’utilità della valutazione PETinterim in stadi iniziali non bulky [344]. Per alcuni solo la PET alla fine del trattamento è altamente predittiva per PFS e OS, indipendentemente dai risultati della PET intermedia, mentre altri confermano la forte predittività negativa sia in stadi iniziali sia in stadi avanzati. Da queste considerazioni si deduce che l’interim PET al di fuori di trials clinici non può ancora essere raccomandata. Negli stadi avanzati è unanime il riscontro di un favorevole impatto prognostico nei pazienti con PET interim negativa rispetto a quelli con persistente positività, eliminando l’impatto dei fattori prognostici di base. Questo ha portato al disegno di studi che prevedono un’intensificazione del trattamento sulla base dell’esito PET2 [295]. E’ stato però sottolineato anche che da un lato i pazienti con PET2 positiva dopo 2 cicli di terapia standard hanno senza dubbio una probabilità maggiore di ricadere, ma che dall’altro una parte di pazienti con PET2 positiva possono raggiungere una remissione stabile pur proseguendo con lo stesso regime chemioterapico. Prima di risultati clinici definitivi di alta evidenza non è raccomandato, al di fuori di trials clinici, modificare il programma terapeutico sulla base della interim PET dato l’alto rischio di tossicità a breve e lungo termine senza un sicuro vantaggio nell’outcome dei pazienti. Al termine del programma terapeutico la FDG-PET è raccomandata per la valutazione della risposta terapeutica con una sensibilità e una specificità rispettivamente dell’84% e 90% nell’evidenziare zone di tumore residuo. E’ opportuno valutare il corretto timing di esecuzione poiché possono persistere stati infiammatori post-radioterapia determinanti falsi positivi. In alcuni casi è indicata, laddove possibile, una biopsia delle sedi con persistente positività. Per tale motivo è consigliabile eseguire il controllo PET dopo 2-3 settimane dalla fine della chemioterapia e 8-12 settimane dopo la fine della radioterapia [345]. La ridefinizione dei criteri di risposta formulata da Cheson nel 2007 include la PET come esame fondamentale per la valutazione della risposta in una patologia dove frequentemente si osservano masse residue [245]. 4.8 Follow-up Il razionale su cui si basare l’utilizzo di un follow-up programmato è che le recidive di linfoma di Hodgkin possono essere trattate con terapia di salvataggio con buona probabilità di ottenimento di una nuova remissione completa di malattia ( 80%) duratura nel tempo. Nella maggior parte dei casi la recidiva viene riconosciuta per la presenza di sintomi e/o segni clinico-laboratoristici, inoltre non ci sono studi randomizzati che dimostrino che un’anticipazione strumentale della diagnosi di recidiva possa impattare favorevolmente sulla prognosi. Dati di un recente studio retrospettivo dimostrano che nel 44% dei casi le ricadute sono riscontrate dalla presenza di sintomi e/o anomalie di laboratorio [137]. Altro fattore importante è il riconoscimento delle sequele tardive dei trattamenti, in particolar modo secondi tumori e danni cardiovascolari (NCCN Practice Guidelines in Oncology: Hodgkin's disease/Lymphoma. 2014; version 2; PDQ NCI: Hodgkin lymphoma. last modified 5-2009). 64 LINEE GUIDA LINFOMI Sulla scorta di questi dati si può raccomandare (NCCN Practice Guidelines in Oncology: Hodgkin's disease/Lymphoma. 2014; version 2): • Controllo completo della biochimica (con VES) e visita ogni tre mesi per i primi 2 anni poi ogni 6 mesi fino al 5° anno, e successivamente ogni anno (Livello di evidenza 4); • TC total body ogni 6-12 mesi per i primi 2 anni dal termine del trattamento (Livello di evidenza 3) La PET non viene raccomandata nel follow-up per l’aumentata possibilità di falsi positivi [345] (Livello di evidenza 3). Ipotiroidismo, secondi tumori (solidi ed ematologici), malattie cardiovascolari e problematiche di fertilità sono i più importanti effetti a lungo termine dei trattamenti, pertanto per i pazienti in remissione completa al termine dei trattamenti , specie se comprensivi di radioterapia, è mandatorio un controllo clinico continuativo delle tossicità tardive. Va sottolineato che la letteratura disponibile consiste in studi retrospettivi eseguiti negli ultimi 20-30 anni con programmi terapeutici comprensivi di regimi chemioterapici più tossici e dosi maggiori di radioterapia. In base ai dati a nostra disposizione si può raccomandare, dopo 5 anni dal termine del trattamento (NCCN Practice Guidelines in Oncology: Hodgkin's disease/Lymphoma. 2014; version 2): • Monitoraggio annuale della funzione tiroidea se eseguita RT su collo (Livello di evidenza 3); • Monitoraggio mammografia annuale e/o risonanza magnetica nelle donne giovani dopo 8-10 anni dal trattamento radiante al torace o ai linfonodi ascellari o dall’età di 25-30 anni (Livello di evidenza 3); • Monitoraggio annuale della pressione arteriosa e funzione cardiovascolare e correzione dei fattori di rischio (Livello di evidenza 3); • Monitoraggio con imaging toracico nei pazienti ad alto rischio per neoplasia polmonare (sottoposti a RT toracica e/o a chemioterapia con alchilanti, presenza di fattori di rischio) (Livello di evidenza 3) • monitoraggio capacità riproduttiva, problematiche psicosociali (Livello di evidenza 3). Tabella 17. Procedure durante il follow up Procedura Raccomandazione Esame clinico TC collo-toraceaddome completo Anamnesi ed esame obiettivo ogni 3 mesi nei primi due anni, ogni 6 mesi nei successivi 3 anni, poi annualmente (NCCN 2014). Ogni 3 mesi nei primi due anni, poi ogni 6 mesi nei successivi 3 anni, poi annualmente (NCCN 2014). Ogni 6-12 mesi dal temine del trattamento per i primi 2 anni (NCCN 2014). TSH Esami ematici (routine+VES) Qualità dell’evidenza SIGN D Forza della Raccomandazione Positiva debole D Positiva debole D Positiva debole Annualmente se RT sul collo (NCCN 2014). D Positiva forte Mammografia Annualmente se RT a livello del torace e/o linfonodi ascellari (NCCN 2014). D Positiva forte Altre indagini consigliate Monitoraggio annuale della pressione arteriosa e funzione cardiovascolare e correzione dei fattori di rischio. D Positiva forte D Positiva forte Monitoraggio capacità riproduttiva, problematiche psicosociali. Monitoraggio con imaging toracico per pazienti ad alto rischio di sviluppare neoplasia polmonari (NCCN 2014). Procedure non raccomandate In assenza di indicazioni cliniche i seguenti esami sono “sconsigliati”: TC-PET con fdG [345]. 65 LINEE GUIDA LINFOMI 4.9 Hodgkin e gravidanza E’ sembrato opportuno in queste linee guida accennare al problema dell’Hodgkin e gravidanza poiché la popolazione affetta da questa patologia si trova ampiamente in età fertile. Fermo restando che la stadiazione deve essere il più possibile completa, utilizzando esami che non espongano a radiazioni, e che la terapia deve essere personalizzata tenendo in considerazione i desideri della madre, la severità e la velocità di accrescimento della malattia e lo stadio di gravidanza, si possono fare alcune considerazioni sulla terapia nella prima metà della gravidanza e in particolare nel primo trimestre e la terapia nella seconda fase della gravidanza [346]. Nel primo trimestre, se la malattia non è velocemente progressiva e ha localizzazioni esclusivamente al di sopra del diaframma, può essere preso in considerazione sia un controllo serrato e un’induzione precoce della gravidanza, sia una radioterapia [347]. Non ci sono dati di malformazioni congenite con questa seconda opzione, ma il rischio di sequele tardive non può essere trascurato, per cui, in casi selezionati e non particolarmente aggressivi, può essere considerato per primo uno stretto follow up [348]. Più difficile la scelta terapeutica in questa fase della gravidanza se la malattia appare molto aggressiva. Il compito dell’oncoematologo è quello di illustrare la necessità di un trattamento, le possibili sequele sul bambino e affiancare la paziente in una scelta difficile, ma strettamente personale. Nella seconda metà della gravidanza l’opzione principale sembra essere ancora il monitoraggio stretto in caso di malattia a lento accrescimento, o, in caso di malattia sintomatica, un trattamento chemioterapico con singolo agente (ad es. vinblastina) o con terapia di combinazione (ABVD) [349, 350] che in recenti pubblicazioni non ha mostrato sequele nel nascituro [351]. Si ritiene indispensabile affiancare alle pazienti, oltre un’equipe ginecologica e pediatrica di eccellenza, anche un supporto psicologico per tutto il periodo pre e post-parto. 66 Diagnosi -Biopsia escissionale di un linfonodo intero -Immunoistochimica (vedi capitolo dedicato) 67 In casi selezionati: -Consulto per programmi di preservazione fertilità -Criopreservazione liquido seminale /ovociti -Prove di funzionalità respiratoria -Test di gravidanza (donne fertili) -Rx torace standard(2 proiezioni) -PET/ PET-TC -Ecocardiogramma con frazione di eiezione Esami diagnostici e/o altamente raccomandati: -Esame fisico -Performance status -Sintomi B -Emocromo completo con formula -LDH -panel metabolico e dosaggio immunoglobuline -TC collo,torace,addome con mezzo di contrasto -Sierologia per HIV, HBV e HCV -Biopsia osteomidollare in pazienti con sintomi B e stadio III-IV Diagnosi di LH predominanza linfocitaria Diagnosi di LH classico Figura 1 LH - Diagnosi e stadiazione Stadi IIB-III-IV Stadi I-IIA sfavorevoli (vedi criteri GHSG, EORTC) Stadi I-IIA favorevoli (vedi criteri GHSG, EORTC) LINEE GUIDA LINFOMI 4.10 Figure 68 Stadi IIB- III-IV Stadi I-IIA sfavorevoli (vedi criteri GHSG, EORTC) 6 ABVD + RT-IF su bulky* 4 x ABVD + RT-IF (30 Gy) EORTC: 3xABVD + RT-IF (30 Gy) GHSG: 2x ABVD + RT-IF (20 Gy) Linfoma Hodgkin predominanza linfocitaria Stadi avanzati Stadi localizzati (I-II) ABVD+/- RT-IF ABVD +/-Rituximab +/- RT-IF RT-IF esclusiva (prima scelta) ABVD +/- Rituximab +/- RT-IF *considerare RT anche in situazioni di "ottima" RP (ad esempio positività focali alla PET al termine della chemioterapia; aree a lenta risposta morfologica) Linfoma Hodgkin classico Stadi I-IIA favorevoli (vedi criteri GHSG, EORTC) Figura 2 LH – Terapia iniziale Valutazione risposta Valutazione risposta LINEE GUIDA LINFOMI 69 -Biopsia osteomidollare monolaterale se positiva pre-terapia -RX torace -TC collo, torace , addome o PET-TC -Valutazione cardiovascolare, respiratoria, psicosociale, riproduttiva Valutazione risposta: -Anamnesi ed esame obiettivo -Esami ematochimici PR,RN, PG RC Vedi “terapia di salvataggio” Follow-up: -Visita periodica (ogni 3 mesi per 2 anni) -Esami ematochimici con VES e funzione tiroidea se RT su collo (ogni 6 mesi fino a 5 anni poi annualmente) -RX torace (annualmente dopo i primi 5 anni se a rischio per ca polmone) -TC collo, torace , addome (ogni 6 mesi per 2 anni poi annualmente) -Valutazione cardiovascolare, respiratoria, psicosociale, riproduttiva(annuale) Se applicabile: mammografia, risonanza magnetica e visita senologica (dopo 10 anni dalla terapia o dai 40 anni) Figura 3 LH - Valutazione della risposta e follow-up LINEE GUIDA LINFOMI Se chemioterapia in prima linea Se IF-RT esclusiva in prima linea 70 Malattia avanzata Malattia localizzata HDC+ASCT (prima scelta) o chemioterapia RT-IF o chemioterapia +/- RT-IF Chemioterapia Figura 4 LH – Terapia di salvataggio Valutazione risposta Valutazione risposta LINEE GUIDA LINFOMI LINEE GUIDA LINFOMI 5. Pazienti con infezione da HIV 5.1 HIV e linfoma di Hodgkin L’introduzione della terapia antiretrovirale altamente efficace (HAART) dal 1997, ha completamente cambiato la prognosi dei pazienti con infezione da HIV. Dal punto di vista epidemiologico si è assistito ad un calo significativo dei LNH e del sarcoma di Kaposi e ad un aumento dei casi di LH [352-354]. In questo setting di pazienti la malattia è quasi sempre EBV correlata e oltre il 70% dei pazienti si presenta in stadio avanzato con malattia extranodale in oltre la metà dei casi, soprattutto midollo osseo, milza e fegato [355, 356]. Non esistono a oggi studi randomizzati, ma solo studi di fase II o valutazioni retrospettive. Tutti gli studi pubblicati prima dell’introduzione dell’HAART hanno dimostrato che i pazienti con LH e infezione da HIV rispondono poco ai trattamenti chemioterapici (circa 50% di risposte obiettive), hanno un’elevata percentuale di recidive (oltre il 25%) e la sopravvivenza mediana si attesta intorno ai 12-18 mesi [357-359]. Dopo l’introduzione dell’HAART sono stati pubblicati diversi studi prospettici che hanno utilizzato regimi standard impiegati nella popolazione HIV negativa quali lo STANFORD V, il BEACOPP baseline, il VEBEP e l’ABVD. In questo momento l’ABVD può essere considerato lo schema di riferimento con una strategia per stadi simile a quella dei pazienti HIV negativi [360-363] (Livello di evidenza 3). Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica I pazienti HIV+ con LH devono essere trattati con ABVD somministrato con gli stessi dosaggi e le stesse tempistiche dei pazienti HIV negativi [360-363]. D √ E’ stato condotto un solo studio di fase II. Tutti gli schemi riportati hanno mostrato più o meno pari efficacia e tossicità e per estrapolazione dalla popolazione HIV negativa si preferisce/raccomanda l’ABVD. Positiva Forte 5.2 HIV e linfoma non Hodgkin L’incidenza di LNH associato all’infezione da HIV è aumentata sin dall’inizio dell’epidemia di HIV e, prima dell’introduzione dell’HAART, i LNH rappresentavano la seconda neoplasia più frequentemente associata all’HIV dopo il sarcoma di Kaposi. L’introduzione dell’HAART ha portato a una significativa diminuzione dell’incidenza del linfoma primitivo cerebrale, e recentemente anche dei LNH sistemici, a presentazioni cliniche che si avvicinano sempre più a quelle della popolazione generale, con una significativa riduzione dell’incidenza di sedi extranodali come le meningi ed il midollo osseo, e a un significativo miglioramento della sopravvivenza dei pazienti con LNH ed infezione da HIV [353, 364]. Gli studi clinici effettuati prima dell’introduzione dell’HAART hanno portato alla conclusione che il CHOP poteva essere considerata la terapia standard in questi pazienti [365, 366]. L’introduzione dell’HAART è coincisa con quella del rituximab per cui nel corso degli ultimi 10 anni diversi studi hanno testato la fattibilità e l’efficacia dell’associazione immunochemioterapica. Le conclusioni degli studi permettono di affermare che lo schema R-CHOP può essere considerato lo schema di riferimento in questi pazienti (Livello di evidenza 2++). Una certa cautela deve essere osservata nei pazienti con CD4<50/dl per l’eventuale aumento del rischio infettivo [367-371]. Il linfoma di Burkitt, che rappresenta circa un quarto dei LNH diagnosticati nei pazienti con infezione da HIV, fino a qualche anno fa era trattato con schemi simili a quelli per i linfomi diffusi a grandi cellule. Diversi studi hanno dimostrato che la prognosi dei pazienti con Burkitt rimane severa e i miglioramenti ottenuti con l’HAART non riguardano questo sottotipo di linfoma [372, 373]. 71 LINEE GUIDA LINFOMI Poiché parecchie serie hanno dimostrato la fattibilità e l’efficacia di schemi chemioterapici aggressivi nei pazienti HIV+ con Burkitt [374, 375], tali schemi (es. R-CODOX-M/IVAC, Stanford per Burkitt, RHyperCVAD) devono essere considerati lo standard anche in questi pazienti (Livello di evidenza 2++). Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica B I pazienti con LNH ed HIV positivi devono essere trattati con R-CHOP [366-370]. Positiva Forte B I pazienti HIV+ con Burkitt devono ricevere schemi chemioterapici aggressivi come R-CODOX-M/IVAC, Stanford per Burkitt, R-HyperCVAD [374, 375]. Positiva Forte 5.3 Terapia di salvataggio Per quanto riguarda la possibilità di eseguire una chemioterapia ad alte dosi con reinfusione di cellule staminali da periferico come terapia di salvataggio dei pazienti recidivati o refrattari, tutti i dati disponibili dimostrano la fattibilità della procedura con un’efficacia e una tossicità pari a quella della popolazione HIVnegativa [376-379]; pertanto tale approccio può essere considerato lo standard nei pazienti con malattia in remissione parziale o con malattia recidivata o refrattaria a una prima linea (Livello di evidenza 2++). Rimane da valutare il ruolo di un consolidamento con alte dosi di chemioterapia e reinfusione di cellule staminali in pazienti in remissione completa da LNH ad alto rischio di recidiva. Qualità dell’evidenza SIGN Raccomandazione clinica Forza della raccomandazione clinica B Pazienti con LNH HIV positivi recidivati o refrattari devono essere trattati con alte dosi di chemioterapia e re infusione di cellule staminali da periferico [376-379]. Positiva Forte 72 LINEE GUIDA LINFOMI 6. Raccomandazioni prodotte con metodologia GRADE QUESITO 1: Nei pazienti affetti da linfoma follicolare è raccomandabile la somministrazione di una terapia di mantenimento? RACCOMANDAZIONE: Nei pazienti affetti da linfoma follicolare la terapia di mantenimento deve essere effettuata. I pazienti per i quali è massimo il bilancio tra beneficio e danno sono quelli con malattia recidiva/refrattaria. Forza della raccomandazione: POSITIVA FORTE Motivazioni/Commenti al bilancio Beneficio/Danno: La valutazione del bilancio beneficio/danno è a favore di un trattamento di mantenimento. I vantaggi maggiori sono presenti quando il mantenimento è somministrato dopo terapia di seconda linea. Sono stati valutati tre studi: una meta-analisi (6 RCTs) e due RCTs successivi. Si evidenzia un netto vantaggio in termini di PFS sia nella meta-analisi di Vidal sia nello studio di Salles (tot pz ca. 2000). Nella meta-analisi (ca. 1000 pz) si evidenzia anche un vantaggio in termini di Overall survival. Gli effetti collaterali considerati rilevanti dal panel sono stati: infezioni grado III/IV e neutropenia. Entrambi significativamente associati al trattamento. Votazione forza raccomandazione Votazione bilancio Beneficio/Danno Positiva Positiva Negativa Negativa Favorevole Incerto Sfavorevole forte debole debole forte 6 2 5 3 Implicazioni per le ricerche future: Gli studi futuri dovranno fornire aggiornamenti con follow-up prolungato sull’effetto della terapia di mantenimento sulla OS. Inoltre dovranno essere identificati fattori predittivi di efficacia della terapia di mantenimento, attualmente non noti. Qualità delle Evidenze La qualità delle evidenze è stata giudicata MODERATA per le seguenti motivazioni: in 4 dei 6 studi inclusi nella meta-analisi di Vidal non sono stati descritti i metodi utilizzati per la generazione delle liste di allocazione e per l’allocation concealment. Nessuno dei trials era in cieco (blinding of outcome assessors). L’analisi Intention-to-treat è stata eseguita in due studi (Hainsworth 2005; van Oers 2006).Il tasso di dropouts era meno del 10% in quattro studi (Forstpointner 2006; Ghielmini 2004; Hainsworth 2005; van Oers 2006). Quattro studi sono stati pubblicati in riviste peer-reviewed come full text e uno come abstract (Hochster 2005; Hochster 2007). Gli autori di uno studio (Hainsworth 2005) dichiaravano un conflitto di interesse. Alcuni studi hanno ricevuto co-finanziamenti dall’industria farmaceutica (Ghielmini 2004; Hainsworth 2005; van Oers 2006). Inoltre, tre studi sono stati interrotti prima per beneficio come pianificato. L’interruzione precoce degli studi potrebbe esporre al rischio di non rilevare alcuni effetti collaterali. Lo studio di Salles e quello di Martinelli riportano risultati non significativi e imprecisi per l’OS. Qualità globale delle evidenze: MODERATA Questa raccomandazione è stata prodotta con metodo GRADE. In appendice online: quesito clinico all’origine della raccomandazione, votazione della criticità degli outcome, tabella GRADE completa e caratteristiche del panel. 73 LINEE GUIDA LINFOMI QUESITO 2: Nei pazienti affetti da linfoma di Hodgkin è raccomandabile la terapia con ABVD vs BEACOPP? RACCOMANDAZIONE: Nei pazienti affetti da linfoma di Hodgkin deve essere effettuata la terapia con ABVD rispetto alla terapia con BEACOPP. Forza della raccomandazione: POSITIVA FORTE Motivazioni/Commenti al bilancio Beneficio/Danno: Gli studi analizzati hanno dimostrato che il regime ABVD è meno efficace rispetto a BEACOPP in termini di PFS ma è associato ad un minor rischio di infezioni di alto grado. L’assenza di differenze tra i due regimi in termini di OS, nonostante la qualità dell’evidenza su questo output non sia elevata, ha determinato una maggiore propensione tra i membri del panel a favore di ABVD. Sono disponibili informazioni parziali relative a outcome come la fertilità e le morti legate al trattamento, mentre sono totalmente assenti i dati sulla cardiotossicità. Inoltre, solo due dei quattro studi inclusi nella meta-analisi di Bauer riportano i dati relativi ai tumori secondari. Votazione forza raccomandazione Votazione bilancio Beneficio/Danno Positiva Positiva Negativa Negativa Favorevole Incerto Sfavorevole forte debole debole forte 6 2 5 3 Implicazioni per le ricerche future: Considerando l’ottima efficacia dei trattamenti oggi disponibili per la cura dei pazienti con Linfoma di Hodgkin, la ricerca clinica su questa patologia si dovrà progressivamente spostare da una valutazione puramente “quantitativa” della cura ad una analisi più “Qualitativa” identificando gli aspetti di tossicità soprattutto tardiva come endpoint primari. In questo modo potrà essere fornita una risposta di “qualità” accettabile ai quesiti identificati come “critici” dal panel di esperti. Qualità delle Evidenze La qualità globale delle evidenze è risultata MOLTO BASSA per i seguenti motivi: Nella meta-analisi di Bauer vengono inclusi anche due abstract. La mediana di follow-up varia da studio a studio. Follow-ups più lunghi e l’inclusione dello studio EORTC 20012 avrebbero comportato una più precisa stima dell’effetto per l’OS. La definizione di Progression of disease risulta essere diversa nei vari studi inclusi e queste diverse definizioni comportano una stima imprecisa dell’effetto. Solo studio riporta i risultati relativi alla mortalità correlata al trattamento. Gli autori sospettano che anche gli altri studi abbiano valutato questo evento avverso ma abbiano deciso di non riportare il dato. Lo stesso vale per l’outcome infertilità. Emerge una eterogeneità rilevante (I2 > 80%) nella meta-analisi dei tre studi che riportano il numero di infezioni di grado 3/4. Dato che la maggior parte degli studi aveva un follow-up mediano inferiore ai 10 anni, non ci si può attendere dati a lungo termine sui tumori secondari. Qualità globale delle evidenze: MOLTO BASSA Questa raccomandazione è stata prodotta con metodo GRADE. In appendice online: quesito clinico all’origine della raccomandazione, votazione della criticità degli outcome, tabella GRADE completa e caratteristiche del panel. 74 LINEE GUIDA LINFOMI 7. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. Bibliografia Luminari S, Cesaretti M, Rashid I et al. Incidence, clinical characteristics and survival of malignant lymphomas: a population-based study from a cancer registry in northern Italy. Hematol Oncol 2007; 25: 189-197. Morton LM, Wang SS, Devesa SS et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992-2001. Blood 2006; 107: 265-276. Carbone A, Ferlito A, Devaney KO, Rinaldo A. Ultrasound-guided core-needle biopsy: is it effective in the diagnosis of suspected lymphomas presenting in the head and neck? J Surg Oncol 2008; 98: 4-5. Paulli M, Artusi T, Baroni CD et al. [The Haemolymphopathology Italian Group (H.I.G.): an essential resource for the new technical and organization problems troubling modern haemolymphopathology diagnostics]. Pathologica 2006; 98: 37-40. Pileri ASE. Linee guida GIE : Trattamento del campione bioptico. In Edition. Jaffe ES, Banks PM, Nathwani B et al. Recommendations for the reporting of lymphoid neoplasms: a report from the Association of Directors of Anatomic and Surgical Pathology. Mod Pathol 2004; 17: 131-135. Swerdlow SHC, E.; Harris, N.L.; Jaffe, E.S.; Pileri, S.A.; Stein, H.; Thiele, J.; Vardiman, J.W. WHO Classification of Tumors of Haematopoietic and Lymphoid Tissues. In Edition 4th. Lyon: IARC Press 2008. Carbone A, Cesarman E, Spina M et al. HIV-associated lymphomas and gamma-herpesviruses. Blood 2009; 113: 1213-1224. Swerdlow SH, Campo E, Pileri SA et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016; 127: 2375-2390. Garcia CF, Swerdlow SH. Best practices in contemporary diagnostic immunohistochemistry: panel approach to hematolymphoid proliferations. Arch Pathol Lab Med 2009; 133: 756-765. Rosenwald A, Staudt LM. Gene expression profiling of diffuse large B-cell lymphoma. Leuk Lymphoma 2003; 44 Suppl 3: S41-47. Rimsza LM, Leblanc ML, Unger JM et al. Gene expression predicts overall survival in paraffin-embedded tissues of diffuse large B-cell lymphoma treated with R-CHOP. Blood 2008; 112: 3425-3433. Mareschal S, Lanic H, Ruminy P et al. The proportion of activated B-cell like subtype among de novo diffuse large B-cell lymphoma increases with age. Haematologica 2011; 96: 1888-1890. Lenz G, Wright GW, Emre NC et al. Molecular subtypes of diffuse large B-cell lymphoma arise by distinct genetic pathways. Proc Natl Acad Sci U S A 2008; 105: 13520-13525. Lister TA, Crowther D, Sutcliffe SB et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 1989; 7: 1630-1636. A predictive model for aggressive non-Hodgkin's lymphoma. The International Non-Hodgkin's Lymphoma Prognostic Factors Project. N Engl J Med 1993; 329: 987-994. Coiffier B, Thieblemont C, Van Den Neste E et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d'Etudes des Lymphomes de l'Adulte. Blood 2010; 116: 2040-2045. Habermann TM, Weller EA, Morrison VA et al. Rituximab-CHOP versus CHOP alone or with maintenance rituximab in older patients with diffuse large B-cell lymphoma. J Clin Oncol 2006; 24: 3121-3127. Sehn LH, Donaldson J, Chhanabhai M et al. Introduction of combined CHOP plus rituximab therapy dramatically improved outcome of diffuse large B-cell lymphoma in British Columbia. J Clin Oncol 2005; 23: 5027-5033. Pfreundschuh M, Kuhnt E, Trumper L et al. CHOP-like chemotherapy with or without rituximab in young patients with good-prognosis diffuse large-B-cell lymphoma: 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group. Lancet Oncol 2011; 12: 1013-1022. Pfreundschuh M, Schubert J, Ziepert M et al. Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomised controlled trial (RICOVER60). Lancet Oncol 2008; 9: 105-116. Delarue R, Tilly H, Salles G et al. R-CHOP14 Compared to R-CHOP21 in Elderly Patients with Diffuse Large BCell Lymphoma: Results of the Interim Analysis of the LNH03-6B GELA Study. Blood 2009; 114: 169-169. Cunningham D, Smith P, Mouncey P et al. R-CHOP14 versus R-CHOP21: Result of a randomized phase III trial for the treatment of patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma. J Clin Oncol 2011; 29:(suppl; abstr 8000) Miller TP, Dahlberg S, Cassady JR et al. Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate- and high-grade non-Hodgkin's lymphoma. N Engl J Med 1998; 339: 21-26. Miller TP, Leblanc M, Spier C et al. CHOP alone compared to CHOP plus radiotherapy foe early stage aggressive non-Hodgkin's lymphomas: Update of the Southwest Oncology Group (SWOG) randomized trial. Blood 2001; 98: 724a-725a. 75 LINEE GUIDA LINFOMI 26. Horning SJ, Weller E, Kim K et al. Chemotherapy with or without radiotherapy in limited-stage diffuse aggressive non-Hodgkin's lymphoma: Eastern Cooperative Oncology Group study 1484. J Clin Oncol 2004; 22: 3032-3038. 27. Reyes F, Lepage E, Ganem G et al. ACVBP versus CHOP plus radiotherapy for localized aggressive lymphoma. N Engl J Med 2005; 352: 1197-1205. 28. Bonnet C, Fillet G, Mounier N et al. CHOP alone compared with CHOP plus radiotherapy for localized aggressive lymphoma in elderly patients: a study by the Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 2007; 25: 787-792. 29. Miller TP. The limits of limited stage lymphoma. J Clin Oncol 2004; 22: 2982-2984. 30. Shenkier TN, Voss N, Fairey R et al. Brief chemotherapy and involved-region irradiation for limited-stage diffuse large-cell lymphoma: an 18-year experience from the British Columbia Cancer Agency. J Clin Oncol 2002; 20: 197-204. 31. Lowry L, Smith P, Qian W et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiother Oncol 2011; 100: 86-92. 32. Persky DO, Unger JM, Spier CM et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014. J Clin Oncol 2008; 26: 2258-2263. 33. Phan J, Mazloom A, Jeffrey Medeiros L et al. Benefit of consolidative radiation therapy in patients with diffuse large B-cell lymphoma treated with R-CHOP chemotherapy. J Clin Oncol 2010; 28: 4170-4176. 34. Pfreundschuh M, Trumper L, Osterborg A et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006; 7: 379-391. 35. Coiffier B, Lepage E, Briere J et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 2002; 346: 235-242. 36. Recher C, Coiffier B, Haioun C et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): an open-label randomised phase 3 trial. Lancet 2011; 378: 1858-1867. 37. Sehn LH, Savage KJ, Hoskins P et al. Limited-stage diffuse, large B-cell lymphoma (DLBCL) patients with a negative pet scan following three cycles of R-CHOP can be effectively treated with abbreviated chemoimmunotherapy alone. Blood 2007; 110: 242a-242a. 38. Pfreundschuh M, Ho AD, Cavallin-Stahl E et al. Prognostic significance of maximum tumour (bulk) diameter in young patients with good-prognosis diffuse large-B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: an exploratory analysis of the MabThera International Trial Group (MInT) study. Lancet Oncol 2008; 9: 435-444. 39. Sehn LH, Hoskins P, Klasa R et al. FDG-PET Scan Guided Consolidative Radiation Therapy Optimizes Outcome In Patients with Advanced-Stage Diffuse Large B-Cell Lymphoma (DLBCL) with Residual Abnormalities on CT Scan Following R-CHOP. Blood 2010; 116: 372-372. 40. Verdonck LF, van Putten WL, Hagenbeek A et al. Comparison of CHOP chemotherapy with autologous bone marrow transplantation for slowly responding patients with aggressive non-Hodgkin's lymphoma. N Engl J Med 1995; 332: 1045-1051. 41. Santini G, Salvagno L, Leoni P et al. VACOP-B versus VACOP-B plus autologous bone marrow transplantation for advanced diffuse non-Hodgkin's lymphoma: results of a prospective randomized trial by the non-Hodgkin's Lymphoma Cooperative Study Group. J Clin Oncol 1998; 16: 2796-2802. 42. Martelli M, Vignetti M, Zinzani PL et al. High-dose chemotherapy followed by autologous bone marrow transplantation versus dexamethasone, cisplatin, and cytarabine in aggressive non-Hodgkin's lymphoma with partial response to front-line chemotherapy: a prospective randomized italian multicenter study. J Clin Oncol 1996; 14: 534-542. 43. Martelli M, Gherlinzoni F, De Renzo A et al. Early autologous stem-cell transplantation versus conventional chemotherapy as front-line therapy in high-risk, aggressive non-Hodgkin's lymphoma: an Italian multicenter randomized trial. J Clin Oncol 2003; 21: 1255-1262. 44. Gisselbrecht C, Lepage E, Molina T et al. Shortened first-line high-dose chemotherapy for patients with poorprognosis aggressive lymphoma. J Clin Oncol 2002; 20: 2472-2479. 45. Haioun C, Lepage E, Gisselbrecht C et al. Comparison of autologous bone marrow transplantation with sequential chemotherapy for intermediate-grade and high-grade non-Hodgkin's lymphoma in first complete remission: a study of 464 patients. Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 1994; 12: 2543-2551. 46. Haioun C, Lepage E, Gisselbrecht C et al. Survival benefit of high-dose therapy in poor-risk aggressive nonHodgkin's lymphoma: final analysis of the prospective LNH87-2 protocol--a groupe d'Etude des lymphomes de l'Adulte study. J Clin Oncol 2000; 18: 3025-3030. 47. Milpied N, Deconinck E, Gaillard F et al. Initial treatment of aggressive lymphoma with high-dose chemotherapy and autologous stem-cell support. N Engl J Med 2004; 350: 1287-1295. 76 LINEE GUIDA LINFOMI 48. Vitolo U, Liberati AM, Cabras MG et al. High dose sequential chemotherapy with autologous transplantation versus dose-dense chemotherapy MegaCEOP as first line treatment in poor-prognosis diffuse large cell lymphoma: an "Intergruppo Italiano Linfomi" randomized trial. Haematologica 2005; 90: 793-801. 49. Kaiser U, Uebelacker I, Abel U et al. Randomized study to evaluate the use of high-dose therapy as part of primary treatment for "aggressive" lymphoma. J Clin Oncol 2002; 20: 4413-4419. 50. Kluin-Nelemans HC, Zagonel V, Anastasopoulou A et al. Standard chemotherapy with or without high-dose chemotherapy for aggressive non-Hodgkin's lymphoma: randomized phase III EORTC study. J Natl Cancer Inst 2001; 93: 22-30. 51. Gianni AM, Bregni M, Siena S et al. High-dose chemotherapy and autologous bone marrow transplantation compared with MACOP-B in aggressive B-cell lymphoma. N Engl J Med 1997; 336: 1290-1297. 52. Vitolo U, Chiappella A, Brusamolino E et al. A Randomized Multicentre Phase Iii Study for First Line Treatment of Young Patients with High Risk (Aaipi 2-3) Diffuse Large B-Cell Lymphoma (Dlbcl): Rituximab (R) Plus DoseDense Chemotherapy Chop14/Megachop14 with or without Intensified High-Dose Chemotherapy (Hdc) and Autologous Stem Cell Transplantation (Asct). Results of Dlcl04 Trial of Italian Lymphoma Foundation (Fil). Annals of Oncology 2011; 22: 106-106. 53. Schmitz N, Nickelsen M, Ziepert M et al. Conventional Chemoimmunotherapy (R-Choep-14) or High-Dose Therapy (R-Mega-Choep) for Young, High-Risk Patients with Aggressive B-Cell Lymphoma: Final Results of the Randomized Mega-Choep-Trial of the German High-Grade Non-Hodgkin Lymphoma Study Group (Dshnhl). Annals of Oncology 2011; 22: 106-107. 54. Stiff PJ, Unger JM, Cook J et al. Randomized phase III U.S./Canadian intergroup trial (SWOG S9704) comparing CHOP ± R for eight cycles to CHOP ± R for six cycles followed by autotransplant for patients with highintermediate (H-Int) or high IPI grade diffuse aggressive non-Hodgkin lymphoma (NHL). Print this page J Clin Oncol 2011; 29 (suppl; abstr 8001). 55. Le Gouill S, Milpied N, Lamy T et al. First-line rituximab (R) high-dose therapy (R-HDT) versus R-CHOP14 for young adults with diffuse large B-cell lymphoma: Preliminary results of the GOELAMS 075 prospective multicenter randomized trial. J Clin Oncol 2011; 29(suppl; abstr 8003). 56. Strehl J, Mey U, Glasmacher A et al. High-dose chemotherapy followed by autologous stem cell transplantation as first-line therapy in aggressive non-Hodgkin's lymphoma: a meta-analysis. Haematologica 2003; 88: 1304-1315. 57. Greb A, Bohlius J, Trelle S et al. High-dose chemotherapy with autologous stem cell support in first-line treatment of aggressive non-Hodgkin lymphoma - results of a comprehensive meta-analysis. Cancer Treat Rev 2007; 33: 338-346. 58. Betticher DC, Martinelli G, Radford JA et al. Sequential high dose chemotherapy as initial treatment for aggressive sub-types of non-Hodgkin lymphoma: results of the international randomized phase III trial (MISTRAL). Ann Oncol 2006; 17: 1546-1552. 59. Intragumtornchai T, Prayoonwiwat W, Numbenjapon T et al. CHOP versus CHOP plus ESHAP and high-dose therapy with autologous peripheral blood progenitor cell transplantation for high-intermediate-risk and high-risk aggressive non-Hodgkin's lymphoma. Clin Lymphoma 2000; 1: 219-225. 60. Fagnoni P, Milpied N, Limat S et al. Cost effectiveness of high-dose chemotherapy with autologous stem cell support as initial treatment of aggressive non-Hodgkin's lymphoma. Pharmacoeconomics 2009; 27: 55-68. 61. Sehn L, Klasa R, Shenkier Tea. Long-term experience with PET-guided consolidative radiation therapy (XRT) in patients with advanced stage diffuse large B-cell lymphoma (DLBCL) treated with R-CHOP. Hematological Oncology 2013; 31(S1):137 (abstract 123). 62. Philip T, Guglielmi C, Hagenbeek A et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin's lymphoma. N Engl J Med 1995; 333: 15401545. 63. Gisselbrecht C, Glass B, Mounier N et al. Salvage regimens with autologous transplantation for relapsed large Bcell lymphoma in the rituximab era. J Clin Oncol 2010; 28: 4184-4190. 64. Schutt P, Passon J, Ebeling P et al. Ifosfamide, etoposide, cytarabine, and dexamethasone as salvage treatment followed by high-dose cyclophosphamide, melphalan, and etoposide with autologous peripheral blood stem cell transplantation for relapsed or refractory lymphomas. Eur J Haematol 2007; 78: 93-101. 65. Ardeshna KM, Kakouros N, Qian W et al. Conventional second-line salvage chemotherapy regimens are not warranted in patients with malignant lymphomas who have progressive disease after first-line salvage therapy regimens. Br J Haematol 2005; 130: 363-372. 66. Hamlin PA, Zelenetz AD, Kewalramani T et al. Age-adjusted International Prognostic Index predicts autologous stem cell transplantation outcome for patients with relapsed or primary refractory diffuse large B-cell lymphoma. Blood 2003; 102: 1989-1996. 67. Blay J, Gomez F, Sebban C et al. The International Prognostic Index correlates to survival in patients with aggressive lymphoma in relapse: analysis of the PARMA trial. Parma Group. Blood 1998; 92: 3562-3568. 77 LINEE GUIDA LINFOMI 68. Guglielmi C, Gomez F, Philip T et al. Time to relapse has prognostic value in patients with aggressive lymphoma enrolled onto the Parma trial. J Clin Oncol 1998; 16: 3264-3269. 69. Lerner RE, Thomas W, Defor TE et al. The International Prognostic Index assessed at relapse predicts outcomes of autologous transplantation for diffuse large-cell non-Hodgkin's lymphoma in second complete or partial remission. Biol Blood Marrow Transplant 2007; 13: 486-492. 70. Costa LJ, Micallef IN, Inwards DJ et al. Time of relapse after initial therapy significantly adds to the prognostic value of the IPI-R in patients with relapsed DLBCL undergoing autologous stem cell transplantation. Bone Marrow Transplant 2008; 41: 715-720. 71. Vellenga E, van Putten WL, van 't Veer MB et al. Rituximab improves the treatment results of DHAP-VIM-DHAP and ASCT in relapsed/progressive aggressive CD20+ NHL: a prospective randomized HOVON trial. Blood 2008; 111: 537-543. 72. Martin A, Conde E, Arnan M et al. R-ESHAP as salvage therapy for patients with relapsed or refractory diffuse large B-cell lymphoma: the influence of prior exposure to rituximab on outcome. A GEL/TAMO study. Haematologica 2008; 93: 1829-1836. 73. Schot BW, Zijlstra JM, Sluiter WJ et al. Early FDG-PET assessment in combination with clinical risk scores determines prognosis in recurring lymphoma. Blood 2007; 109: 486-491. 74. Cremerius U, Fabry U, Wildberger JE et al. Pre-transplant positron emission tomography (PET) using fluorine-18fluoro-deoxyglucose (FDG) predicts outcome in patients treated with high-dose chemotherapy and autologous stem cell transplantation for non-Hodgkin's lymphoma. Bone Marrow Transplant 2002; 30: 103-111. 75. Filmont JE, Gisselbrecht C, Cuenca X et al. The impact of pre- and post-transplantation positron emission tomography using 18-fluorodeoxyglucose on poor-prognosis lymphoma patients undergoing autologous stem cell transplantation. Cancer 2007; 110: 1361-1369. 76. Svoboda J, Andreadis C, Elstrom R et al. Prognostic value of FDG-PET scan imaging in lymphoma patients undergoing autologous stem cell transplantation. Bone Marrow Transplant 2006; 38: 211-216. 77. Becherer A, Mitterbauer M, Jaeger U et al. Positron emission tomography with [18F]2-fluoro-D-2-deoxyglucose (FDG-PET) predicts relapse of malignant lymphoma after high-dose therapy with stem cell transplantation. Leukemia 2002; 16: 260-267. 78. Spaepen K, Stroobants S, Dupont P et al. Prognostic value of pretransplantation positron emission tomography using fluorine 18-fluorodeoxyglucose in patients with aggressive lymphoma treated with high-dose chemotherapy and stem cell transplantation. Blood 2003; 102: 53-59. 79. Escobar IG, Alonso PT, Barrigon DC et al. Prognostic impact of pre-transplantation computed tomography and 67gallium scanning in chemosensitive diffuse large B cell lymphoma patients undergoing hematopoietic stem-cell transplantation. Ann Nucl Med 2008; 22: 251-260. 80. Derenzini E, Musuraca G, Fanti S et al. Pretransplantation positron emission tomography scan is the main predictor of autologous stem cell transplantation outcome in aggressive B-cell non-Hodgkin lymphoma. Cancer 2008; 113: 2496-2503. 81. Hoppe BS, Moskowitz CH, Zhang Z et al. The role of FDG-PET imaging and involved field radiotherapy in relapsed or refractory diffuse large B-cell lymphoma. Bone Marrow Transplant 2009; 43: 941-948. 82. Shipp MA, Abeloff MD, Antman KH et al. International Consensus Conference on High-Dose Therapy with Hematopoietic Stem Cell Transplantation in Aggressive Non-Hodgkin's Lymphomas: report of the jury. J Clin Oncol 1999; 17: 423-429. 83. Jo JC, Kang BW, Jang G et al. BEAC or BEAM high-dose chemotherapy followed by autologous stem cell transplantation in non-Hodgkin's lymphoma patients: comparative analysis of efficacy and toxicity. Ann Hematol 2008; 87: 43-48. 84. Gutierrez-Delgado F, Maloney DG, Press OW et al. Autologous stem cell transplantation for non-Hodgkin's lymphoma: comparison of radiation-based and chemotherapy-only preparative regimens. Bone Marrow Transplant 2001; 28: 455-461. 85. Visani G, Malerba L, Stefani PM et al. BeEAM (bendamustine, etoposide, cytarabine, melphalan) before autologous stem cell transplantation is safe and effective for resistant/relapsed lymphoma patients. Blood 2011; 118: 3419-3425. 86. Aggarwal C, Gupta S, Vaughan WP et al. Improved outcomes in intermediate- and high-risk aggressive nonHodgkin lymphoma after autologous hematopoietic stem cell transplantation substituting intravenous for oral busulfan in a busulfan, cyclophosphamide, and etoposide preparative regimen. Biol Blood Marrow Transplant 2006; 12: 770-777. 87. Liu HW, Seftel MD, Rubinger M et al. Total body irradiation compared with BEAM: Long-term outcomes of peripheral blood autologous stem cell transplantation for non-Hodgkin's lymphoma. Int J Radiat Oncol Biol Phys 2010; 78: 513-520. 78 LINEE GUIDA LINFOMI 88. Musso M, Scalone R, Marcacci G et al. Fotemustine plus etoposide, cytarabine and melphalan (FEAM) as a new conditioning regimen for lymphoma patients undergoing auto-SCT: a multicenter feasibility study. Bone Marrow Transplant 2010; 45: 1147-1153. 89. Salar A, Sierra J, Gandarillas M et al. Autologous stem cell transplantation for clinically aggressive non-Hodgkin's lymphoma: the role of preparative regimens. Bone Marrow Transplant 2001; 27: 405-412. 90. Jantunen E, Kuittinen T, Nousiainen T. BEAC or BEAM for high-dose therapy in patients with non-Hodgkin's lymphoma? A single centre analysis on toxicity and efficacy. Leuk Lymphoma 2003; 44: 1151-1158. 91. Wang EH, Chen YA, Corringham S et al. High-dose CEB vs BEAM with autologous stem cell transplant in lymphoma. Bone Marrow Transplant 2004; 34: 581-587. 92. Puig N, de la Rubia J, Remigia MJ et al. Morbidity and transplant-related mortality of CBV and BEAM preparative regimens for patients with lymphoid malignancies undergoing autologous stem-cell transplantation. Leuk Lymphoma 2006; 47: 1488-1494. 93. Zaucha R, Gooley T, Holmberg L et al. High-dose chemotherapy with BEAM or Busulphan/Melphalan and Thiotepa followed by hematopoietic cell transplantation in malignant lymphoma. Leuk Lymphoma 2008; 49: 1899-1906. 94. Kim JE, Lee DH, Yoo C et al. BEAM or BuCyE high-dose chemotherapy followed by autologous stem cell transplantation in non-Hodgkin's lymphoma patients: a single center comparative analysis of efficacy and toxicity. Leuk Res 2011; 35: 183-187. 95. Friedberg JW, Neuberg D, Stone RM et al. Outcome in patients with myelodysplastic syndrome after autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 1999; 17: 3128-3135. 96. Fernandez HF, Escalon MP, Pereira D, Lazarus HM. Autotransplant conditioning regimens for aggressive lymphoma: are we on the right road? Bone Marrow Transplant 2007; 40: 505-513. 97. Khouri IF, Saliba RM, Hosing C et al. Concurrent administration of high-dose rituximab before and after autologous stem-cell transplantation for relapsed aggressive B-cell non-Hodgkin's lymphomas. J Clin Oncol 2005; 23: 2240-2247. 98. Gisselbrecht C, Bethge W, Duarte RF et al. Current status and future perspectives for yttrium-90 ((90)Y)ibritumomab tiuxetan in stem cell transplantation for non-Hodgkin's lymphoma. Bone Marrow Transplant 2007; 40: 1007-1017. 99. Krishnan A, Nademanee A, Fung HC et al. Phase II trial of a transplantation regimen of yttrium-90 ibritumomab tiuxetan and high-dose chemotherapy in patients with non-Hodgkin's lymphoma. J Clin Oncol 2008; 26: 90-95. 100. Winter JN, Inwards DJ, Spies S et al. Yttrium-90 ibritumomab tiuxetan doses calculated to deliver up to 15 Gy to critical organs may be safely combined with high-dose BEAM and autologous transplantation in relapsed or refractory B-cell non-Hodgkin's lymphoma. J Clin Oncol 2009; 27: 1653-1659. 101. Devizzi L, Guidetti A, Tarella C et al. High-dose yttrium-90-ibritumomab tiuxetan with tandem stem-cell reinfusion: an outpatient preparative regimen for autologous hematopoietic cell transplantation. J Clin Oncol 2008; 26: 5175-5182. 102. Ratanatharathorn V, Uberti J, Karanes C et al. Prospective comparative trial of autologous versus allogeneic bone marrow transplantation in patients with non-Hodgkin's lymphoma. Blood 1994; 84: 1050-1055. 103. Dhedin N, Giraudier S, Gaulard P et al. Allogeneic bone marrow transplantation in aggressive non-Hodgkin's lymphoma (excluding Burkitt and lymphoblastic lymphoma): a series of 73 patients from the SFGM database. Societ Francaise de Greffe de Moelle. Br J Haematol 1999; 107: 154-161. 104. Peniket AJ, Ruiz de Elvira MC, Taghipour G et al. An EBMT registry matched study of allogeneic stem cell transplants for lymphoma: allogeneic transplantation is associated with a lower relapse rate but a higher procedure-related mortality rate than autologous transplantation. Bone Marrow Transplant 2003; 31: 667-678. 105. Freytes CO, Loberiza FR, Rizzo JD et al. Myeloablative allogeneic hematopoietic stem cell transplantation in patients who experience relapse after autologous stem cell transplantation for lymphoma: a report of the International Bone Marrow Transplant Registry. Blood 2004; 104: 3797-3803. 106. Doocey RT, Toze CL, Connors JM et al. Allogeneic haematopoietic stem-cell transplantation for relapsed and refractory aggressive histology non-Hodgkin lymphoma. Br J Haematol 2005; 131: 223-230. 107. Aksentijevich I, Jones RJ, Ambinder RF et al. Clinical outcome following autologous and allogeneic blood and marrow transplantation for relapsed diffuse large-cell non-Hodgkin's lymphoma. Biol Blood Marrow Transplant 2006; 12: 965-972. 108. Kim SW, Tanimoto TE, Hirabayashi N et al. Myeloablative allogeneic hematopoietic stem cell transplantation for non-Hodgkin lymphoma: a nationwide survey in Japan. Blood 2006; 108: 382-389. 109. Chopra R, Goldstone AH, Pearce R et al. Autologous versus allogeneic bone marrow transplantation for nonHodgkin's lymphoma: a case-controlled analysis of the European Bone Marrow Transplant Group Registry data. J Clin Oncol 1992; 10: 1690-1695. 79 LINEE GUIDA LINFOMI 110. Robinson SP, Goldstone AH, Mackinnon S et al. Chemoresistant or aggressive lymphoma predicts for a poor outcome following reduced-intensity allogeneic progenitor cell transplantation: an analysis from the Lymphoma Working Party of the European Group for Blood and Bone Marrow Transplantation. Blood 2002; 100: 4310-4316. 111. Branson K, Chopra R, Kottaridis PD et al. Role of nonmyeloablative allogeneic stem-cell transplantation after failure of autologous transplantation in patients with lymphoproliferative malignancies. J Clin Oncol 2002; 20: 4022-4031. 112. Escalon MP, Champlin RE, Saliba RM et al. Nonmyeloablative allogeneic hematopoietic transplantation: a promising salvage therapy for patients with non-Hodgkin's lymphoma whose disease has failed a prior autologous transplantation. J Clin Oncol 2004; 22: 2419-2423. 113. Morris E, Thomson K, Craddock C et al. Outcomes after alemtuzumab-containing reduced-intensity allogeneic transplantation regimen for relapsed and refractory non-Hodgkin lymphoma. Blood 2004; 104: 3865-3871. 114. Kusumi E, Kami M, Kanda Y et al. Reduced-intensity hematopoietic stem-cell transplantation for malignant lymphoma: a retrospective survey of 112 adult patients in Japan. Bone Marrow Transplant 2005; 36: 205-213. 115. Dean RM, Fowler DH, Wilson WH et al. Efficacy of reduced-intensity allogeneic stem cell transplantation in chemotherapy-refractory non-hodgkin lymphoma. Biol Blood Marrow Transplant 2005; 11: 593-599. 116. Corradini P, Dodero A, Farina L et al. Allogeneic stem cell transplantation following reduced-intensity conditioning can induce durable clinical and molecular remissions in relapsed lymphomas: pre-transplant disease status and histotype heavily influence outcome. Leukemia 2007; 21: 2316-2323. 117. Rezvani AR, Norasetthada L, Gooley T et al. Non-myeloablative allogeneic haematopoietic cell transplantation for relapsed diffuse large B-cell lymphoma: a multicentre experience. Br J Haematol 2008; 143: 395-403. 118. Thomson KJ, Morris EC, Bloor A et al. Favorable long-term survival after reduced-intensity allogeneic transplantation for multiple-relapse aggressive non-Hodgkin's lymphoma. J Clin Oncol 2009; 27: 426-432. 119. Armand P, Kim HT, Ho VT et al. Allogeneic transplantation with reduced-intensity conditioning for Hodgkin and non-Hodgkin lymphoma: importance of histology for outcome. Biol Blood Marrow Transplant 2008; 14: 418-425. 120. Pollack SM, Steinberg SM, Odom J et al. Assessment of the hematopoietic cell transplantation comorbidity index in non-Hodgkin lymphoma patients receiving reduced-intensity allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2009; 15: 223-230. 121. Sorror ML, Storer BE, Maloney DG et al. Outcomes after allogeneic hematopoietic cell transplantation with nonmyeloablative or myeloablative conditioning regimens for treatment of lymphoma and chronic lymphocytic leukemia. Blood 2008; 111: 446-452. 122. Sorror ML, Maris MB, Storb R et al. Hematopoietic cell transplantation (HCT)-specific comorbidity index: a new tool for risk assessment before allogeneic HCT. Blood 2005; 106: 2912-2919. 123. Farina L, Bruno B, Patriarca F et al. The hematopoietic cell transplantation comorbidity index (HCT-CI) predicts clinical outcomes in lymphoma and myeloma patients after reduced-intensity or non-myeloablative allogeneic stem cell transplantation. Leukemia 2009; 23: 1131-1138. 124. van Kampen RJ, Canals C, Schouten HC et al. Allogeneic stem-cell transplantation as salvage therapy for patients with diffuse large B-cell non-Hodgkin's lymphoma relapsing after an autologous stem-cell transplantation: an analysis of the European Group for Blood and Marrow Transplantation Registry. J Clin Oncol 2011; 29: 13421348. 125. Rigacci L, Puccini B, Dodero A et al. Allogeneic hematopoietic stem cell transplantation in patients with diffuse large B cell lymphoma relapsed after autologous stem cell transplantation: A GITMO study. Ann Hematol 2012; 91: 931-939. 126. Lazarus HM, Zhang MJ, Carreras J et al. A comparison of HLA-identical sibling allogeneic versus autologous transplantation for diffuse large B cell lymphoma: a report from the CIBMTR. Biol Blood Marrow Transplant 2010; 16: 35-45. 127. van de Schans SA, Wymenga AN, van Spronsen DJ et al. Two sides of the medallion: poor treatment tolerance but better survival by standard chemotherapy in elderly patients with advanced-stage diffuse large B-cell lymphoma. Ann Oncol 2012; 23: 1280-1286. 128. Peyrade F, Jardin F, Thieblemont C et al. Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2011; 12: 460-468. 129. Luminari S, Montanini A, Caballero D et al. Nonpegylated liposomal doxorubicin (MyocetTM) combination (RCOMP) chemotherapy in elderly patients with diffuse large B-cell lymphoma (DLBCL): results from the phase II EUR018 trial. Ann Oncol 2010; 21: 1492-1499. 130. Rigacci L, Mappa S, Nassi L et al. Liposome-encapsulated doxorubicin in combination with cyclophosphamide, vincristine, prednisone and rituximab in patients with lymphoma and concurrent cardiac diseases or pre-treated with anthracyclines. Hematol Oncol 2007; 25: 198-203. 131. Visani G, Ferrara F, Alesiani F et al. R-COMP 21 for frail elderly patients with aggressive B-cell non-Hodgkin lymphoma: a pilot study. Leuk Lymphoma 2008; 49: 1081-1086. 80 LINEE GUIDA LINFOMI 132. El Gnaoui T, Dupuis J, Belhadj K et al. Rituximab, gemcitabine and oxaliplatin: an effective salvage regimen for patients with relapsed or refractory B-cell lymphoma not candidates for high-dose therapy. Ann Oncol 2007; 18: 1363-1368. 133. Weidmann E, Kim SZ, Rost A et al. Bendamustine is effective in relapsed or refractory aggressive non-Hodgkin's lymphoma. Ann Oncol 2002; 13: 1285-1289. 134. Zinzani PL, Pellegrini C, Gandolfi L et al. Combination of lenalidomide and rituximab in elderly patients with relapsed or refractory diffuse large B-cell lymphoma: a phase 2 trial. Clin Lymphoma Myeloma Leuk 2011; 11: 462-466. 135. Guppy AE, Tebbutt NC, Norman A, Cunningham D. The role of surveillance CT scans in patients with diffuse large B-cell non-Hodgkin's lymphoma. Leuk Lymphoma 2003; 44: 123-125. 136. Liedtke M, Hamlin PA, Moskowitz CH, Zelenetz AD. Surveillance imaging during remission identifies a group of patients with more favorable aggressive NHL at time of relapse: a retrospective analysis of a uniformly-treated patient population. Ann Oncol 2006; 17: 909-913. 137. El-Galaly TC, Mylam KJ, Bogsted M et al. Role of routine imaging in detecting recurrent lymphoma: A review of 258 patients with relapsed aggressive non-Hodgkin and Hodgkin lymphoma. Am J Hematol 2014; 89: 575-580. 138. Zinzani PL, Stefoni V, Tani M et al. Role of [18F]fluorodeoxyglucose positron emission tomography scan in the follow-up of lymphoma. J Clin Oncol 2009; 27: 1781-1787. 139. Avivi I, Zilberlicht A, Dann EJ et al. Strikingly high false positivity of surveillance FDG-PET/CT scanning among patients with diffuse large cell lymphoma in the rituximab era. Am J Hematol 2013; 88: 400-405. 140. Tilly H, Vitolo U, Walewski J et al. Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 Suppl 7: vii78-82. 141. Anderson JR, Armitage JO, Weisenburger DD. Epidemiology of the non-Hodgkin's lymphomas: distributions of the major subtypes differ by geographic locations. Non-Hodgkin's Lymphoma Classification Project. Ann Oncol 1998; 9: 717-720. 142. Morton LM, Wang SS, Cozen W et al. Etiologic heterogeneity among non-Hodgkin lymphoma subtypes. Blood 2008; 112: 5150-5160. 143. Vose JM, Chiu BC, Cheson BD et al. Update on epidemiology and therapeutics for non-Hodgkin's lymphoma. Hematology Am Soc Hematol Educ Program 2002; 241-262. 144. Jaffe ES, Harris NL, Stein H, Isaacson PG. Classification of lymphoid neoplasms: the microscope as a tool for disease discovery. Blood 2008; 112: 4384-4399. 145. Berard CW, Greene MH, Jaffe ES et al. NIH conference. A multidisciplinary approach to non-hodgkin's lymphomas. Ann Intern Med 1981; 94: 218-235. 146. Dupuis J, Meignan M, Julian A et al. Significant Prognostic Impact of [18F]Fluorodeoxyglucose-PET Scan Performed During and At the End of Treatment with R-CHOP in High-Tumor Mass Follicular Lymphoma Patients: A GELA-GOELAMS Study. Blood 2011; 118: 400-401. 147. Trotman J, Fournier M, Lamy T et al. Positron Emission Tomography-Computed Tomography (PET-CT) After Induction Therapy Is Highly Predictive of Patient Outcome in Follicular Lymphoma: Analysis of PET-CT in a Subset of PRIMA Trial Participants. Journal of Clinical Oncology 2011; 29: 3194-3200. 148. Luminari S, Biasoli I, Versari A et al. The prognostic role of post-induction FDG-PET in patients with follicular lymphoma: a subset analysis from the FOLL05 trial of the Fondazione Italiana Linfomi (FIL). Ann Oncol 2014; 25: 442-447. 149. Luminari S, Biasoli I, Arcaini L et al. The use of FDG-PET in the initial staging of 142 patients with follicular lymphoma: a retrospective study from the FOLL05 randomized trial of the Fondazione Italiana Linfomi. Ann Oncol 2013. 150. Solal-Celigny P, Roy P, Colombat P et al. Follicular lymphoma international prognostic index. Blood 2004; 104: 1258-1265. 151. Federico M, Bellei M, Marcheselli L et al. Follicular Lymphoma International Prognostic Index 2: A New Prognostic Index for Follicular Lymphoma Developed by the International Follicular Lymphoma Prognostic Factor Project. J Clin Oncol 2009. 152. Ardeshna KM, Smith P, Norton A et al. Long-term effect of a watch and wait policy versus immediate systemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma: a randomised controlled trial. Lancet 2003; 362: 516-522. 153. Ardeshna KM, Qian W, Smith P et al. Rituximab versus a watch-and-wait approach in patients with advancedstage, asymptomatic, non-bulky follicular lymphoma: an open-label randomised phase 3 trial. Lancet Oncol 2014; 15: 424-435. 154. Solal-Celigny P, Bellei M, Marcheselli L et al. Watchful Waiting in Low-Tumor Burden Follicular Lymphoma in the Rituximab Era: Results of an F2-Study Database. Journal of Clinical Oncology 2012; 30: 3848-3853. 81 LINEE GUIDA LINFOMI 155. Barosi G, Carella A, Lazzarino M et al. Management of nodal indolent (non marginal-zone) non-Hodgkin's lymphomas: practice guidelines from the Italian Society of Hematology, Italian Society of Experimental Hematology and Italian Group for Bone Marrow Transplantation. Haematologica 2005; 90: 1236-1257. 156. Petersen PM, Gospodarowicz M, Tsang R et al. Long-term outcome in stage I and II follicular lymphoma following treatment with involved field radiation therapy alone. Journal of Clinical Oncology 2004; 22: 563s-563s. 157. Peters MV, Bush RS, Brown TC, Reid J. The place of radiotherapy in the control of non-Hodgkin's lymphomata. Br J Cancer Suppl 1975; 2: 386-401. 158. Chen MG, Prosnitz LR, Gonzalez-Serva A, Fischer DB. Results of radiotherapy in control of stage I and II nonHodgkin's lymphoma. Cancer 1979; 43: 1245-1254. 159. Gospodarowicz MK, Bush RS, Brown TC, Chua T. Prognostic factors in nodular lymphomas: a multivariate analysis based on the Princess Margaret Hospital experience. Int J Radiat Oncol Biol Phys 1984; 10: 489-497. 160. Gomez GA, Barcos M, Krishnamsetty RM et al. Treatment of early--stages I and II--nodular, poorly differentiated lymphocytic lymphoma. Am J Clin Oncol 1986; 9: 40-44. 161. Lawrence TS, Urba WJ, Steinberg SM et al. Retrospective analysis of stage I and II indolent lymphomas at the National Cancer Institute. Int J Radiat Oncol Biol Phys 1988; 14: 417-424. 162. Soubeyran P, Eghbali H, Bonichon F et al. Localized follicular lymphomas: prognosis and survival of stages I and II in a retrospective series of 103 patients. Radiother Oncol 1988; 13: 91-98. 163. Richards MA, Gregory WM, Hall PA et al. Management of localized non-Hodgkin's lymphoma: the experience at St. Bartholomew's Hospital 1972-1985. Hematol Oncol 1989; 7: 1-18. 164. Epelbaum R, Kuten A, Coachman NM et al. Stage I-II low grade non-Hodgkin's lymphoma: prognostic factors and treatment results. Strahlenther Onkol 1992; 168: 66-72. 165. Vaughan Hudson B, Vaughan Hudson G, MacLennan KA et al. Clinical stage 1 non-Hodgkin's lymphoma: longterm follow-up of patients treated by the British National Lymphoma Investigation with radiotherapy alone as initial therapy. Br J Cancer 1994; 69: 1088-1093. 166. Mac Manus MP, Hoppe RT. Is radiotherapy curative for stage I and II low-grade follicular lymphoma? Results of a long-term follow-up study of patients treated at Stanford University. J Clin Oncol 1996; 14: 1282-1290. 167. Kamath SS, Marcus RB, Jr., Lynch JW, Mendenhall NP. The impact of radiotherapy dose and other treatmentrelated and clinical factors on in-field control in stage I and II non-Hodgkin's lymphoma. Int J Radiat Oncol Biol Phys 1999; 44: 563-568. 168. Wilder RB, Jones D, Tucker SL et al. Long-term results with radiotherapy for Stage I-II follicular lymphomas. Int J Radiat Oncol Biol Phys 2001; 51: 1219-1227. 169. Gustavsson A, Osterman B, Cavallin-Stahl E. A systematic overview of radiation therapy effects in non-Hodgkin's lymphoma. Acta Oncol 2003; 42: 605-619. 170. Landberg TG, Hakansson LG, Moller TR et al. CVP-remission-maintenance in stage I or II non-Hodgkin's lymphomas: preliminary results of a randomized study. Cancer 1979; 44: 831-838. 171. Yahalom J, Varsos G, Fuks Z et al. Adjuvant cyclophosphamide, doxorubicin, vincristine, and prednisone chemotherapy after radiation therapy in stage I low-grade and intermediate-grade non-Hodgkin lymphoma. Results of a prospective randomized study. Cancer 1993; 71: 2342-2350. 172. Nissen NI, Ersboll J, Hansen HS et al. A randomized study of radiotherapy versus radiotherapy plus chemotherapy in stage I-II non-Hodgkin's lymphomas. Cancer 1983; 52: 1-7. 173. Carde P, Burgers JM, van Glabbeke M et al. Combined radiotherapy-chemotherapy for early stages non-Hodgkin's lymphoma: the 1975-1980 EORTC controlled lymphoma trial. Radiother Oncol 1984; 2: 301-312. 174. Monfardini S, Banfi A, Bonadonna G et al. Improved five year survival after combined radiotherapychemotherapy for stage I-II non-Hodgkin's lymphoma. Int J Radiat Oncol Biol Phys 1980; 6: 125-134. 175. Kelsey SM, Newland AC, Hudson GV, Jelliffe AM. A British National Lymphoma Investigation randomised trial of single agent chlorambucil plus radiotherapy versus radiotherapy alone in low grade, localised non-Hodgkins lymphoma. Med Oncol 1994; 11: 19-25. 176. McLaughlin P, Fuller LM, Velasquez WS et al. Stage I-II follicular lymphoma. Treatment results for 76 patients. Cancer 1986; 58: 1596-1602. 177. McLaughlin P, Fuller L, Redman J et al. Stage I-II low-grade lymphomas: a prospective trial of combination chemotherapy and radiotherapy. Ann Oncol 1991; 2 Suppl 2: 137-140. 178. Besa PC, McLaughlin PW, Cox JD, Fuller LM. Long term assessment of patterns of treatment failure and survival in patients with stage I or II follicular lymphoma. Cancer 1995; 75: 2361-2367. 179. Seymour JF, Pro B, Fuller LM et al. Long-term follow-up of a prospective study of combined modality therapy for stage I-II indolent non-Hodgkin's lymphoma. J Clin Oncol 2003; 21: 2115-2122. 180. Ghielmini M, Schmitz SF, Cogliatti SB et al. Prolonged treatment with rituximab in patients with follicular lymphoma significantly increases event-free survival and response duration compared with the standard weekly x 4 schedule. Blood 2004; 103: 4416-4423. 82 LINEE GUIDA LINFOMI 181. Solal-Celigny P, Brice P, Brousse N et al. Phase II trial of fludarabine monophosphate as first-line treatment in patients with advanced follicular lymphoma: a multicenter study by the Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 1996; 14: 514-519. 182. Coiffier B, Neidhardt-Berard EM, Tilly H et al. Fludarabine alone compared to CHVP plus interferon in elderly patients with follicular lymphoma and adverse prognostic parameters: a GELA study. Groupe d'Etudes des Lymphomes de l'Adulte. Ann Oncol 1999; 10: 1191-1197. 183. Hagenbeek A, Eghbali H, Monfardini S et al. Phase III intergroup study of fludarabine phosphate compared with cyclophosphamide, vincristine, and prednisone chemotherapy in newly diagnosed patients with stage III and IV low-grade malignant Non-Hodgkin's lymphoma. J Clin Oncol 2006; 24: 1590-1596. 184. Marcus R, Imrie K, Solal-Celigny P et al. Phase III study of R-CVP compared with cyclophosphamide, vincristine, and prednisone alone in patients with previously untreated advanced follicular lymphoma. J Clin Oncol 2008; 26: 4579-4586. 185. Herold M, Haas A, Srock S et al. Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: an East German Study Group Hematology and Oncology Study. J Clin Oncol 2007; 25: 1986-1992. 186. Hiddemann W, Kneba M, Dreyling M et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2005; 106: 3725-3732. 187. Schulz H, Bohlius JF, Trelle S et al. Immunochemotherapy with rituximab and overall survival in patients with indolent or mantle cell lymphoma: a systematic review and meta-analysis. J Natl Cancer Inst 2007; 99: 706-714. 188. Federico M, Luminari S, Dondi A et al. R-CVP versus R-CHOP versus R-FM for the initial treatment of patients with advanced-stage follicular lymphoma: results of the FOLL05 trial conducted by the Fondazione Italiana Linfomi. J Clin Oncol 2013; 31: 1506-1513. 189. Rummel MJ, Niederle N, Maschmeyer G et al. Bendamustine plus rituximab versus CHOP plus rituximab as firstline treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381: 1203-1210. 190. Flinn IW, van der Jagt R, Kahl BS et al. Randomized trial of bendamustine-rituximab or R-CHOP/R-CVP in firstline treatment of indolent NHL or MCL: the BRIGHT study. Blood 2014; 123: 2944-2952. 191. Vidal L, Gafter-Gvili A, Leibovici L et al. Rituximab maintenance for the treatment of patients with follicular lymphoma: systematic review and meta-analysis of randomized trials. J Natl Cancer Inst 2009; 101: 248-255. 192. Salles G, Seymour JF, Offner F et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet 2011; 377: 42-51. 193. Ha CS, Kong JS, McLaughlin P et al. Stage III follicular lymphoma: long-term follow-up and patterns of failure. Int J Radiat Oncol Biol Phys 2003; 57: 748-754. 194. Ha CS CF, Lee MS, Tucker SL, McLaughlin P, Rodriguez MA et al. A prospective randomized study to compare the molecular response rates between central lymphatic irradiation (CLI) and intensive alternating triple chemotherapy (ATT) in the treatment of stage I-III follicular Lymphoma. Int J Radiat Oncol Biol Phys 2003; 57:S211-2. 195. Hoskin PJ, Kirkwood AA, Popova B et al. 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma (FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol 2014; 15: 457-463. 196. Kaminski MS, Tuck M, Estes J et al. 131I-tositumomab therapy as initial treatment for follicular lymphoma. N Engl J Med 2005; 352: 441-449. 197. Press OW, Unger JM, Braziel RM et al. Phase II trial of CHOP chemotherapy followed by tositumomab/iodine I131 tositumomab for previously untreated follicular non-Hodgkin's lymphoma: five-year follow-up of Southwest Oncology Group Protocol S9911. J Clin Oncol 2006; 24: 4143-4149. 198. Morschhauser F, Radford J, Van Hoof A et al. Phase III trial of consolidation therapy with yttrium-90ibritumomab tiuxetan compared with no additional therapy after first remission in advanced follicular lymphoma. J Clin Oncol 2008; 26: 5156-5164. 199. Freedman AS, Gribben JG, Neuberg D et al. High-dose therapy and autologous bone marrow transplantation in patients with follicular lymphoma during first remission. Blood 1996; 88: 2780-2786. 200. Colombat P, Cornillet P, Deconinck E et al. Value of autologous stem cell transplantation with purged bone marrow as first-line therapy for follicular lymphoma with high tumor burden: a GOELAMS phase II study. Bone Marrow Transplant 2000; 26: 971-977. 201. Voso MT, Martin S, Hohaus S et al. Prognostic factors for the clinical outcome of patients with follicular lymphoma following high-dose therapy and peripheral blood stem cell transplantation (PBSCT). Bone Marrow Transplant 2000; 25: 957-964. 83 LINEE GUIDA LINFOMI 202. Tarella C, Caracciolo D, Corradini P et al. Long-term follow-up of advanced-stage low-grade lymphoma patients treated upfront with high-dose sequential chemotherapy and autograft. Leukemia 2000; 14: 740-747. 203. Seyfarth B, Kuse R, Sonnen R et al. Autologous stem cell transplantation for follicular lymphoma: no benefit for early transplant? Ann Hematol 2001; 80: 398-405. 204. Horning SJ, Negrin RS, Hoppe RT et al. High-dose therapy and autologous bone marrow transplantation for follicular lymphoma in first complete or partial remission: results of a phase II clinical trial. Blood 2001; 97: 404409. 205. Corradini P, Ladetto M, Zallio F et al. Long-term follow-up of indolent lymphoma patients treated with high-dose sequential chemotherapy and autografting: evidence that durable molecular and clinical remission frequently can be attained only in follicular subtypes. J Clin Oncol 2004; 22: 1460-1468. 206. Brown JR, Feng Y, Gribben JG et al. Long-term survival after autologous bone marrow transplantation for follicular lymphoma in first remission. Biol Blood Marrow Transplant 2007; 13: 1057-1065. 207. Lenz G, Dreyling M, Schiegnitz E et al. Myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission prolongs progression-free survival in follicular lymphoma: results of a prospective, randomized trial of the German Low-Grade Lymphoma Study Group. Blood 2004; 104: 2667-2674. 208. Deconinck E, Foussard C, Milpied N et al. High-dose therapy followed by autologous purged stem-cell transplantation and doxorubicin-based chemotherapy in patients with advanced follicular lymphoma: a randomized multicenter study by GOELAMS. Blood 2005; 105: 3817-3823. 209. Gyan E, Foussard C, Bertrand P et al. High-dose therapy followed by autologous purged stem cell transplantation and doxorubicin-based chemotherapy in patients with advanced follicular lymphoma: a randomized multicenter study by the GOELAMS with final results after a median follow-up of 9 years. Blood 2009; 113: 995-1001. 210. Sebban C, Mounier N, Brousse N et al. Standard chemotherapy with interferon compared with CHOP followed by high-dose therapy with autologous stem cell transplantation in untreated patients with advanced follicular lymphoma: the GELF-94 randomized study from the Groupe d'Etude des Lymphomes de l'Adulte (GELA). Blood 2006; 108: 2540-2544. 211. Ladetto M, De Marco F, Benedetti F et al. Prospective, multicenter randomized GITMO/IIL trial comparing intensive (R-HDS) versus conventional (CHOP-R) chemoimmunotherapy in high-risk follicular lymphoma at diagnosis: the superior disease control of R-HDS does not translate into an overall survival advantage. Blood 2008; 111: 4004-4013. 212. Friedberg JW, Cohen P, Chen L et al. Bendamustine in patients with rituximab-refractory indolent and transformed non-Hodgkin's lymphoma: results from a phase II multicenter, single-agent study. J Clin Oncol 2008; 26: 204-210. 213. Rummel MJ, Al-Batran SE, Kim SZ et al. Bendamustine plus rituximab is effective and has a favorable toxicity profile in the treatment of mantle cell and low-grade non-Hodgkin's lymphoma. J Clin Oncol 2005; 23: 3383-3389. 214. Witzig TE, Gordon LI, Cabanillas F et al. Randomized controlled trial of yttrium-90-labeled ibritumomab tiuxetan radioimmunotherapy versus rituximab immunotherapy for patients with relapsed or refractory low-grade, follicular, or transformed B-cell non-Hodgkin's lymphoma. J Clin Oncol 2002; 20: 2453-2463. 215. Witzig TE, White CA, Gordon LI et al. Safety of yttrium-90 ibritumomab tiuxetan radioimmunotherapy for relapsed low-grade, follicular, or transformed non-hodgkin's lymphoma. J Clin Oncol 2003; 21: 1263-1270. 216. Horning SJ, Younes A, Jain V et al. Efficacy and safety of tositumomab and iodine-131 tositumomab (Bexxar) in B-cell lymphoma, progressive after rituximab. J Clin Oncol 2005; 23: 712-719. 217. Vose JM, Wahl RL, Saleh M et al. Multicenter phase II study of iodine-131 tositumomab for chemotherapyrelapsed/refractory low-grade and transformed low-grade B-cell non-Hodgkin's lymphomas. J Clin Oncol 2000; 18: 1316-1323. 218. van Oers MH, Klasa R, Marcus RE et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood 2006; 108: 3295-3301. 219. Forstpointner R, Unterhalt M, Dreyling M et al. Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas: Results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 2006; 108: 4003-4008. 220. Freedman AS, Ritz J, Neuberg D et al. Autologous bone marrow transplantation in 69 patients with a history of low-grade B-cell non-Hodgkin's lymphoma. Blood 1991; 77: 2524-2529. 221. Colombat P, Donadio D, Fouillard L et al. Value of autologous bone marrow transplantation in follicular lymphoma: a France Autogreffe retrospective study of 42 patients. Bone Marrow Transplant 1994; 13: 157-162. 222. Bastion Y, Brice P, Haioun C et al. Intensive therapy with peripheral blood progenitor cell transplantation in 60 patients with poor-prognosis follicular lymphoma. Blood 1995; 86: 3257-3262. 84 LINEE GUIDA LINFOMI 223. Weaver CH, Schwartzberg L, Rhinehart S et al. High-dose chemotherapy with BUCY or BEAC and unpurged peripheral blood stem cell infusion in patients with low-grade non-Hodgkin's lymphoma. Bone Marrow Transplant 1998; 21: 383-389. 224. Freedman AS, Neuberg D, Mauch P et al. Long-term follow-up of autologous bone marrow transplantation in patients with relapsed follicular lymphoma. Blood 1999; 94: 3325-3333. 225. Apostolidis J, Gupta RK, Grenzelias D et al. High-dose therapy with autologous bone marrow support as consolidation of remission in follicular lymphoma: long-term clinical and molecular follow-up. J Clin Oncol 2000; 18: 527-536. 226. Berglund A, Enblad G, Carlson K et al. Long-term follow-up of autologous stem-cell transplantation for follicular and transformed follicular lymphoma. Eur J Haematol 2000; 65: 17-22. 227. Brice P, Simon D, Bouabdallah R et al. High-dose therapy with autologous stem-cell transplantation (ASCT) after first progression prolonged survival of follicular lymphoma patients included in the prospective GELF 86 protocol. Ann Oncol 2000; 11: 1585-1590. 228. van Besien K, Loberiza FR, Jr., Bajorunaite R et al. Comparison of autologous and allogeneic hematopoietic stem cell transplantation for follicular lymphoma. Blood 2003; 102: 3521-3529. 229. Rohatiner AZ, Nadler L, Davies AJ et al. Myeloablative therapy with autologous bone marrow transplantation for follicular lymphoma at the time of second or subsequent remission: long-term follow-up. J Clin Oncol 2007; 25: 2554-2559. 230. Schouten HC, Qian W, Kvaloy S et al. High-dose therapy improves progression-free survival and survival in relapsed follicular non-Hodgkin's lymphoma: results from the randomized European CUP trial. J Clin Oncol 2003; 21: 3918-3927. 231. Schaaf M, Reiser M, Borchmann P et al. High-dose therapy with autologous stem cell transplantation versus chemotherapy or immuno-chemotherapy for follicular lymphoma in adults. Cochrane Database Syst Rev 2012; 1: CD007678. 232. Le Gouill S, De Guibert S, Planche L et al. Impact of the use of autologous stem cell transplantation at first relapse both in naive and previously rituximab exposed follicular lymphoma patients treated in the GELA/GOELAMS FL2000 study. Haematologica 2011; 96: 1128-1135. 233. Gribben JG, Freedman AS, Neuberg D et al. Immunologic purging of marrow assessed by PCR before autologous bone marrow transplantation for B-cell lymphoma. N Engl J Med 1991; 325: 1525-1533. 234. Magni M, Di Nicola M, Devizzi L et al. Successful in vivo purging of CD34-containing peripheral blood harvests in mantle cell and indolent lymphoma: evidence for a role of both chemotherapy and rituximab infusion. Blood 2000; 96: 864-869. 235. Ingram W, Devereux S, Das-Gupta EP et al. Outcome of BEAM-autologous and BEAM-alemtuzumab allogeneic transplantation in relapsed advanced stage follicular lymphoma. Br J Haematol 2008; 141: 235-243. 236. Faulkner RD, Craddock C, Byrne JL et al. BEAM-alemtuzumab reduced-intensity allogeneic stem cell transplantation for lymphoproliferative diseases: GVHD, toxicity, and survival in 65 patients. Blood 2004; 103: 428-434. 237. Maris MB, Storb R. Allogeneic hematopoietic cell transplantation as consolidation immunotherapy of cancer after autologous transplantation. Acta Haematol 2005; 114: 221-229. 238. Vigouroux S, Michallet M, Porcher R et al. Long-term outcomes after reduced-intensity conditioning allogeneic stem cell transplantation for low-grade lymphoma: a survey by the French Society of Bone Marrow Graft Transplantation and Cellular Therapy (SFGM-TC). Haematologica 2007; 92: 627-634. 239. Rezvani AR, Storer B, Maris M et al. Nonmyeloablative allogeneic hematopoietic cell transplantation in relapsed, refractory, and transformed indolent non-Hodgkin's lymphoma. J Clin Oncol 2008; 26: 211-217. 240. Khouri IF, McLaughlin P, Saliba RM et al. Eight-year experience with allogeneic stem cell transplantation for relapsed follicular lymphoma after nonmyeloablative conditioning with fludarabine, cyclophosphamide, and rituximab. Blood 2008; 111: 5530-5536. 241. Hari P, Carreras J, Zhang MJ et al. Allogeneic transplants in follicular lymphoma: higher risk of disease progression after reduced-intensity compared to myeloablative conditioning. Biol Blood Marrow Transplant 2008; 14: 236-245. 242. Thomson KJ, Morris EC, Milligan D et al. T-cell-depleted reduced-intensity transplantation followed by donor leukocyte infusions to promote graft-versus-lymphoma activity results in excellent long-term survival in patients with multiply relapsed follicular lymphoma. J Clin Oncol 2010; 28: 3695-3700. 243. Pinana JL, Martino R, Gayoso J et al. Reduced intensity conditioning HLA identical sibling donor allogeneic stem cell transplantation for patients with follicular lymphoma: long-term follow-up from two prospective multicenter trials. Haematologica 2010; 95: 1176-1182. 244. Cohen S, Kiss T, Lachance S et al. Tandem autologous-allogeneic nonmyeloablative sibling transplantation in relapsed follicular lymphoma leads to impressive progression-free survival with minimal toxicity. Biol Blood Marrow Transplant 2012; 18: 951-957. 85 LINEE GUIDA LINFOMI 245. Cheson BD, Pfistner B, Juweid ME et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25: 579-586. 246. Oh YK, Ha CS, Samuels BI et al. Stages I-III follicular lymphoma: role of CT of the abdomen and pelvis in follow-up studies. Radiology 1999; 210: 483-486. 247. Al-Tourah AJ, Gill KK, Chhanabhai M et al. Population-based analysis of incidence and outcome of transformed non-Hodgkin's lymphoma. J Clin Oncol 2008; 26: 5165-5169. 248. Noy A, Schoder H, Gonen M et al. The majority of transformed lymphomas have high standardized uptake values (SUVs) on positron emission tomography (PET) scanning similar to diffuse large B-cell lymphoma (DLBCL). Ann Oncol 2009; 20: 508-512. 249. Italian cancer figures--report 2006: 1. Incidence, mortality and estimates. Epidemiol Prev 2006; 30: 8-10, 12-28, 30-101 passim. 250. Verdecchia A, Francisci S, Brenner H et al. Recent cancer survival in Europe: a 2000-02 period analysis of EUROCARE-4 data. Lancet Oncol 2007; 8: 784-796. 251. Brenner H, Gondos A, Pulte D. Ongoing improvement in long-term survival of patients with Hodgkin disease at all ages and recent catch-up of older patients. Blood 2008; 111: 2977-2983. 252. Bosetti C, Levi F, Ferlay J et al. The recent decline in mortality from Hodgkin lymphomas in central and eastern Europe. Ann Oncol 2009; 20: 767-774. 253. Aleman BM, van den Belt-Dusebout AW, Klokman WJ et al. Long-term cause-specific mortality of patients treated for Hodgkin's disease. J Clin Oncol 2003; 21: 3431-3439. 254. Dores GM, Metayer C, Curtis RE et al. Second malignant neoplasms among long-term survivors of Hodgkin's disease: a population-based evaluation over 25 years. J Clin Oncol 2002; 20: 3484-3494. 255. Behringer K, Josting A, Schiller P et al. Solid tumors in patients treated for Hodgkin's disease: a report from the German Hodgkin Lymphoma Study Group. Ann Oncol 2004; 15: 1079-1085. 256. Swerdlow AJ, Higgins CD, Smith P et al. Myocardial infarction mortality risk after treatment for Hodgkin disease: a collaborative British cohort study. J Natl Cancer Inst 2007; 99: 206-214. 257. De Bruin ML, Dorresteijn LD, van't Veer MB et al. Increased risk of stroke and transient ischemic attack in 5-year survivors of Hodgkin lymphoma. J Natl Cancer Inst 2009; 101: 928-937. 258. Diehl V, Sextro M, Franklin J et al. Clinical presentation, course, and prognostic factors in lymphocytepredominant Hodgkin's disease and lymphocyte-rich classical Hodgkin's disease: report from the European Task Force on Lymphoma Project on Lymphocyte-Predominant Hodgkin's Disease. J Clin Oncol 1999; 17: 776-783. 259. Carbone A, Spina M, Gloghini A et al. Nodular lymphocyte predominant Hodgkin lymphoma with non-invasive or early invasive growth pattern suggests an early step of the disease with a highly favorable outcome. Am J Hematol 2013; 88: 161-162. 260. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin's disease. International Prognostic Factors Project on Advanced Hodgkin's Disease. N Engl J Med 1998; 339: 1506-1514. 261. Seam P, Juweid ME, Cheson BD. The role of FDG-PET scans in patients with lymphoma. Blood 2007; 110: 35073516. 262. Evans WC, Gilmore D, English J. The role of PET and PET/CT in managing the care of lymphoma patients. J Nucl Med Technol 2011; 39: 190-194. 263. Armitage JO. Early-stage Hodgkin's lymphoma. N Engl J Med 2010; 363: 653-662. 264. Meyer RM, Gospodarowicz MK, Connors JM et al. ABVD alone versus radiation-based therapy in limited-stage Hodgkin's lymphoma. N Engl J Med 2012; 366: 399-408. 265. Noordijk EM, Carde P, Dupouy N et al. Combined-modality therapy for clinical stage I or II Hodgkin's lymphoma: long-term results of the European Organisation for Research and Treatment of Cancer H7 randomized controlled trials. J Clin Oncol 2006; 24: 3128-3135. 266. Ferme C, Eghbali H, Meerwaldt JH et al. Chemotherapy plus involved-field radiation in early-stage Hodgkin's disease. N Engl J Med 2007; 357: 1916-1927. 267. Eich HT, Diehl V, Gorgen H et al. Intensified chemotherapy and dose-reduced involved-field radiotherapy in patients with early unfavorable Hodgkin's lymphoma: final analysis of the German Hodgkin Study Group HD11 trial. J Clin Oncol 2010; 28: 4199-4206. 268. Bonadonna G, Bonfante V, Viviani S et al. ABVD plus subtotal nodal versus involved-field radiotherapy in earlystage Hodgkin's disease: long-term results. J Clin Oncol 2004; 22: 2835-2841. 269. Engert A, Pluetschow A, Eich HT et al. Combined modality treatment of two or four cycles of ABVD followed by involved field radiotherapy in the treatment of patients with early stage Hodgkin's lymphoma: Update interim analysis of the randomised HD10 study of the German Hodgkin study group (GHSG). Blood 2005; 106: 750a750a. 270. Ferme C, Divine M, Vranovsky A et al. Four ABVD and involved-field radiotherapy in unfavorable supradiaphragmatic clinical stages (CS) I-II Hodgkin's lymphoma (HL): Preliminary results of the EORTC-GELA H9-U trial. Blood 2005; 106: 240a-240a. 86 LINEE GUIDA LINFOMI 271. Rueda Dominguez A, Marquez A, Guma J et al. Treatment of stage I and II Hodgkin's lymphoma with ABVD chemotherapy: results after 7 years of a prospective study. Ann Oncol 2004; 15: 1798-1804. 272. Straus DJ, Portlock CS, Qin J et al. Results of a prospective randomized clinical trial of doxorubicin, bleomycin, vinblastine, and dacarbazine (ABVD) followed by radiation therapy (RT) versus ABVD alone for stages I, II, and IIIA nonbulky Hodgkin disease. Blood 2004; 104: 3483-3489. 273. Meyer RM, Gospodarowicz MK, Connors JM et al. Randomized comparison of ABVD chemotherapy with a strategy that includes radiation therapy in patients with limited-stage Hodgkin's lymphoma: National Cancer Institute of Canada Clinical Trials Group and the Eastern Cooperative Oncology Group. J Clin Oncol 2005; 23: 4634-4642. 274. Eghbali H, Brice P, Creemers GY et al. Comparison of three radiation dose levels after EBVP regimen in favorable supradiaphragmatic clinical stages (CS) I-II Hodgkin's lymphoma (HL): Preliminary results of the EORTC-GELA H9-F trial. Blood 2005; 106: 240a-240a. 275. Engert A, Plutschow A, Eich HT et al. Reduced treatment intensity in patients with early-stage Hodgkin's lymphoma. N Engl J Med 2010; 363: 640-652. 276. Raemaekers JM, Andre MP, Federico M et al. Omitting radiotherapy in early positron emission tomographynegative stage I/II Hodgkin lymphoma is associated with an increased risk of early relapse: Clinical results of the preplanned interim analysis of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol 2014; 32: 1188-1194. 277. von Tresckow B, Pluetschow A, Fuchs M et al. Dose-Intensification in Early Unfavorable Hodgkin's Lymphoma: Final Analysis of the German Hodgkin Study Group HD14 Trial. J Clin Oncol 2012; 30(9): 907-913. 278. Campbell BA, Voss N, Pickles T et al. Involved-nodal radiation therapy as a component of combination therapy for limited-stage Hodgkin's lymphoma: a question of field size. J Clin Oncol 2008; 26: 5170-5174. 279. Chen RC, Chin MS, Ng AK et al. Early-stage, lymphocyte-predominant Hodgkin's lymphoma: patient outcomes from a large, single-institution series with long follow-up. J Clin Oncol 2010; 28: 136-141. 280. DeVita VT, Jr., Simon RM, Hubbard SM et al. Curability of advanced Hodgkin's disease with chemotherapy. Long-term follow-up of MOPP-treated patients at the National Cancer Institute. Ann Intern Med 1980; 92: 587595. 281. Longo DL, Young RC, Wesley M et al. Twenty years of MOPP therapy for Hodgkin's disease. J Clin Oncol 1986; 4: 1295-1306. 282. Santoro A, Bonadonna G, Valagussa P et al. Long-term results of combined chemotherapy-radiotherapy approach in Hodgkin's disease: superiority of ABVD plus radiotherapy versus MOPP plus radiotherapy. J Clin Oncol 1987; 5: 27-37. 283. Bonadonna G, Valagussa P, Santoro A. Alternating non-cross-resistant combination chemotherapy or MOPP in stage IV Hodgkin's disease. A report of 8-year results. Ann Intern Med 1986; 104: 739-746. 284. Loeffler M, Brosteanu O, Hasenclever D et al. Meta-analysis of chemotherapy versus combined modality treatment trials in Hodgkin's disease. International Database on Hodgkin's Disease Overview Study Group. J Clin Oncol 1998; 16: 818-829. 285. Somers R, Carde P, Henry-Amar M et al. A randomized study in stage IIIB and IV Hodgkin's disease comparing eight courses of MOPP versus an alteration of MOPP with ABVD: a European Organization for Research and Treatment of Cancer Lymphoma Cooperative Group and Groupe Pierre-et-Marie-Curie controlled clinical trial. J Clin Oncol 1994; 12: 279-287. 286. Viviani S, Bonadonna G, Santoro A et al. Alternating versus hybrid MOPP and ABVD combinations in advanced Hodgkin's disease: ten-year results. J Clin Oncol 1996; 14: 1421-1430. 287. Connors JM, Klimo P, Adams G et al. Treatment of advanced Hodgkin's disease with chemotherapy--comparison of MOPP/ABV hybrid regimen with alternating courses of MOPP and ABVD: a report from the National Cancer Institute of Canada clinical trials group. J Clin Oncol 1997; 15: 1638-1645. 288. Canellos GP, Anderson JR, Propert KJ et al. Chemotherapy of advanced Hodgkin's disease with MOPP, ABVD, or MOPP alternating with ABVD. N Engl J Med 1992; 327: 1478-1484. 289. Duggan DB, Petroni GR, Johnson JL et al. Randomized comparison of ABVD and MOPP/ABV hybrid for the treatment of advanced Hodgkin's disease: report of an intergroup trial. J Clin Oncol 2003; 21: 607-614. 290. Gobbi PG, Levis A, Chisesi T et al. ABVD versus modified stanford V versus MOPPEBVCAD with optional and limited radiotherapy in intermediate- and advanced-stage Hodgkin's lymphoma: final results of a multicenter randomized trial by the Intergruppo Italiano Linfomi. J Clin Oncol 2005; 23: 9198-9207. 291. Johnson PW, Radford JA, Cullen MH et al. Comparison of ABVD and alternating or hybrid multidrug regimens for the treatment of advanced Hodgkin's lymphoma: results of the United Kingdom Lymphoma Group LY09 Trial (ISRCTN97144519). J Clin Oncol 2005; 23: 9208-9218. 292. Aleman BM, Raemaekers JM, Tirelli U et al. Involved-field radiotherapy for advanced Hodgkin's lymphoma. N Engl J Med 2003; 348: 2396-2406. 87 LINEE GUIDA LINFOMI 293. Ferme C, Mounier N, Casasnovas O et al. Long-term results and competing risk analysis of the H89 trial in patients with advanced-stage Hodgkin lymphoma: a study by the Groupe d'Etude des Lymphomes de l'Adulte (GELA). Blood 2006; 107: 4636-4642. 294. Eich HT, Gossmann A, Engert A et al. A Contribution to solve the problem of the need for consolidative radiotherapy after intensive chemotherapy in advanced stages of Hodgkin's lymphoma--analysis of a quality control program initiated by the radiotherapy reference center of the German Hodgkin Study Group (GHSG). Int J Radiat Oncol Biol Phys 2007; 69: 1187-1192. 295. Engert A, Haverkamp H, Kobe C et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin's lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet 2012; 379: 1791-1799. 296. Diehl V, Franklin J, Pfreundschuh M et al. Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin's disease. N Engl J Med 2003; 348: 2386-2395. 297. Engert A, Diehl V, Franklin J et al. Escalated-Dose BEACOPP in the Treatment of Patients With Advanced-Stage Hodgkin's Lymphoma: 10 Years of Follow-Up of the GHSG HD9 Study. J Clin Oncol 2009. 298. Federico M, Luminari S, Iannitto E et al. ABVD compared with BEACOPP compared with CEC for the initial treatment of patients with advanced Hodgkin's lymphoma: results from the HD2000 Gruppo Italiano per lo Studio dei Linfomi Trial. J Clin Oncol 2009; 27: 805-811. 299. Viviani S, Zinzani PL, Rambaldi A et al. ABVD versus BEACOPP for Hodgkin's lymphoma when high-dose salvage is planned. N Engl J Med 2011; 365: 203-212. 300. Carde P, Karrasch M, Fortpied C et al. ABVD (8 cycles) versus BEACOPP (4 escalated cycles => 4 baseline) in stage III-IV high-risk Hodgkin lymphoma (HL): First results of EORTC 20012 Intergroup randomized phase III clinical trial. J Clin Oncol 2012; 30 (suppl; abstr 8002) 301. Borchmann P. Early intensification treatment approach in advanced-stage Hodgkin lymphoma. Hematol Oncol Clin North Am 2014; 28: 65-74. 302. Federico M, Bellei M, Brice P et al. High-dose therapy and autologous stem-cell transplantation versus conventional therapy for patients with advanced Hodgkin's lymphoma responding to front-line therapy. J Clin Oncol 2003; 21: 2320-2325. 303. Carella AM, Bellei M, Brice P et al. High-dose therapy and autologous stem cell transplantation versus conventional therapy for patients with advanced Hodgkin's lymphoma responding to front-line therapy: long-term results. Haematologica 2009; 94: 146-148. 304. Linch DC, Winfield D, Goldstone AH et al. Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin's disease: results of a BNLI randomised trial. Lancet 1993; 341: 1051-1054. 305. Schmitz N, Pfistner B, Sextro M et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin's disease: a randomised trial. Lancet 2002; 359: 2065-2071. 306. Ruffer JU, Ballova V, Glossmann J et al. BEACOPP and COPP/ABVD as salvage treatment after primary extended field radiation therapy of early stage Hodgkins disease - results of the German Hodgkin Study Group. Leuk Lymphoma 2005; 46: 1561-1567. 307. Morschhauser F, Brice P, Ferme C et al. Risk-adapted salvage treatment with single or tandem autologous stemcell transplantation for first relapse/refractory Hodgkin's lymphoma: results of the prospective multicenter H96 trial by the GELA/SFGM study group. J Clin Oncol 2008; 26: 5980-5987. 308. Brice P, Bouabdallah R, Moreau P et al. Prognostic factors for survival after high-dose therapy and autologous stem cell transplantation for patients with relapsing Hodgkin's disease: analysis of 280 patients from the French registry. Societe Francaise de Greffe de Moelle. Bone Marrow Transplant 1997; 20: 21-26. 309. Josting A, Muller H, Borchmann P et al. Dose intensity of chemotherapy in patients with relapsed Hodgkin's lymphoma. J Clin Oncol 2010; 28: 5074-5080. 310. Goodman KA, Riedel E, Serrano V et al. Long-term effects of high-dose chemotherapy and radiation for relapsed and refractory Hodgkin's lymphoma. J Clin Oncol 2008; 26: 5240-5247. 311. Josting A, Nogova L, Franklin J et al. Salvage radiotherapy in patients with relapsed and refractory Hodgkin's lymphoma: a retrospective analysis from the German Hodgkin Lymphoma Study Group. J Clin Oncol 2005; 23: 1522-1529. 312. Josting A, Rueffer U, Franklin J et al. Prognostic factors and treatment outcome in primary progressive Hodgkin lymphoma: a report from the German Hodgkin Lymphoma Study Group. Blood 2000; 96: 1280-1286. 313. Wirth A, Corry J, Laidlaw C et al. Salvage radiotherapy for Hodgkin's disease following chemotherapy failure. Int J Radiat Oncol Biol Phys 1997; 39: 599-607. 314. Campbell B, Wirth A, Milner A et al. Long-term follow-up of salvage radiotherapy in Hodgkin's lymphoma after chemotherapy failure. Int J Radiat Oncol Biol Phys 2005; 63: 1538-1545. 88 LINEE GUIDA LINFOMI 315. Andre M, Henry-Amar M, Pico JL et al. Comparison of high-dose therapy and autologous stem-cell transplantation with conventional therapy for Hodgkin's disease induction failure: a case-control study. Societe Francaise de Greffe de Moelle. J Clin Oncol 1999; 17: 222-229. 316. Tarella C, Cuttica A, Vitolo U et al. High-dose sequential chemotherapy and peripheral blood progenitor cell autografting in patients with refractory and/or recurrent Hodgkin lymphoma: a multicenter study of the intergruppo Italiano Linfomi showing prolonged disease free survival in patients treated at first recurrence. Cancer 2003; 97: 2748-2759. 317. Smith SD, Moskowitz CH, Dean R et al. Autologous stem cell transplant for early relapsed/refractory Hodgkin lymphoma: results from two transplant centres. Br J Haematol 2011; 153: 358-363. 318. Castagna L, Bramanti S, Balzarotti M et al. Predictive value of early 18F-fluorodeoxyglucose positron emission tomography (FDG-PET) during salvage chemotherapy in relapsing/refractory Hodgkin lymphoma (HL) treated with high-dose chemotherapy. Br J Haematol 2009; 145: 369-372. 319. Moskowitz CH, Yahalom J, Zelenetz AD et al. High-dose chemo-radiotherapy for relapsed or refractory Hodgkin lymphoma and the significance of pre-transplant functional imaging. Br J Haematol 2010; 148: 890-897. 320. Moskowitz AJ, Yahalom J, Kewalramani T et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Blood 2010; 116: 4934-4937. 321. Moskowitz CH, Matasar MJ, Zelenetz AD et al. Normalization of pre-ASCT, FDG-PET imaging with second-line, non-cross-resistant, chemotherapy programs improves event-free survival in patients with Hodgkin lymphoma. Blood 2012; 119: 1665-1670. 322. Smeltzer JP, Cashen AF, Zhang Q et al. Prognostic significance of FDG-PET in relapsed or refractory classical Hodgkin lymphoma treated with standard salvage chemotherapy and autologous stem cell transplantation. Biol Blood Marrow Transplant 2011; 17: 1646-1652. 323. Younes A, Gopal AK, Smith SE et al. Results of a Pivotal Phase II Study of Brentuximab Vedotin for Patients With Relapsed or Refractory Hodgkin's Lymphoma. J Clin Oncol 2012; 30: 2183-2189. 324. Anderson JE, Litzow MR, Appelbaum FR et al. Allogeneic, syngeneic, and autologous marrow transplantation for Hodgkin's disease: the 21-year Seattle experience. J Clin Oncol 1993; 11: 2342-2350. 325. Gajewski JL, Phillips GL, Sobocinski KA et al. Bone marrow transplants from HLA-identical siblings in advanced Hodgkin's disease. J Clin Oncol 1996; 14: 572-578. 326. Milpied N, Fielding AK, Pearce RM et al. Allogeneic bone marrow transplant is not better than autologous transplant for patients with relapsed Hodgkin's disease. European Group for Blood and Bone Marrow Transplantation. J Clin Oncol 1996; 14: 1291-1296. 327. Akpek G, Ambinder RF, Piantadosi S et al. Long-term results of blood and marrow transplantation for Hodgkin's lymphoma. J Clin Oncol 2001; 19: 4314-4321. 328. Sureda A, Robinson S, Canals C et al. Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin's lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26: 455-462. 329. Peggs KS, Hunter A, Chopra R et al. Clinical evidence of a graft-versus-Hodgkin's-lymphoma effect after reduced-intensity allogeneic transplantation. Lancet 2005; 365: 1934-1941. 330. Peggs KS, Sureda A, Qian W et al. Reduced-intensity conditioning for allogeneic haematopoietic stem cell transplantation in relapsed and refractory Hodgkin lymphoma: impact of alemtuzumab and donor lymphocyte infusions on long-term outcomes. Br J Haematol 2007; 139: 70-80. 331. Alvarez I, Sureda A, Caballero MD et al. Nonmyeloablative stem cell transplantation is an effective therapy for refractory or relapsed hodgkin lymphoma: results of a spanish prospective cooperative protocol. Biol Blood Marrow Transplant 2006; 12: 172-183. 332. Todisco E, Castagna L, Sarina B et al. Reduced-intensity allogeneic transplantation in patients with refractory or progressive Hodgkin's disease after high-dose chemotherapy and autologous stem cell infusion. Eur J Haematol 2007; 78: 322-329. 333. Robinson SP, Sureda A, Canals C et al. Reduced intensity conditioning allogeneic stem cell transplantation for Hodgkin's lymphoma: identification of prognostic factors predicting outcome. Haematologica 2009; 94: 230-238. 334. Sarina B, Castagna L, Farina L et al. Allogeneic transplantation improves the overall and progression-free survival of Hodgkin lymphoma patients relapsing after autologous transplantation: a retrospective study based on the time of HLA typing and donor availability. Blood 2010; 115: 3671-3677. 335. Sureda A, Canals C, Arranz R et al. Allogeneic stem cell transplantation after reduced intensity conditioning in patients with relapsed or refractory Hodgkin's lymphoma. Results of the HDR-ALLO study - a prospective clinical trial by the Grupo Espanol de Linfomas/Trasplante de Medula Osea (GEL/TAMO) and the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Haematologica 2012; 97: 310-317. 336. Dodero A, Crocchiolo R, Patriarca F et al. Pretransplantation [18-F]fluorodeoxyglucose positron emission tomography scan predicts outcome in patients with recurrent Hodgkin lymphoma or aggressive non-Hodgkin 89 LINEE GUIDA LINFOMI 337. 338. 339. 340. 341. 342. 343. 344. 345. 346. 347. 348. 349. 350. 351. 352. 353. 354. 355. 356. 357. 358. 359. 360. 361. lymphoma undergoing reduced-intensity conditioning followed by allogeneic stem cell transplantation. Cancer 2010; 116: 5001-5011. Lambert JR, Bomanji JB, Peggs KS et al. Prognostic role of PET scanning before and after reduced-intensity allogeneic stem cell transplantation for lymphoma. Blood 2010; 115: 2763-2768. Peggs KS, Kayani I, Edwards N et al. Donor lymphocyte infusions modulate relapse risk in mixed chimeras and induce durable salvage in relapsed patients after T-cell-depleted allogeneic transplantation for Hodgkin's lymphoma. J Clin Oncol 2011; 29: 971-978. Younes A, Bartlett NL, Leonard JP et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med 2010; 363: 1812-1821. Hutchings M, Loft A, Hansen M et al. FDG-PET after two cycles of chemotherapy predicts treatment failure and progression-free survival in Hodgkin lymphoma. Blood 2006; 107: 52-59. Gallamini A, Hutchings M, Rigacci L et al. Early interim 2-[18F]fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin's lymphoma: a report from a joint Italian-Danish study. J Clin Oncol 2007; 25: 3746-3752. Connors JM. Positron emission tomography in the management of Hodgkin lymphoma. Hematology Am Soc Hematol Educ Program 2011; 2011: 317-322. Zinzani PL, Rigacci L, Stefoni V et al. Early interim 18F-FDG PET in Hodgkin's lymphoma: evaluation on 304 patients. Eur J Nucl Med Mol Imaging 2012; 39: 4-12. Barnes JA, LaCasce AS, Zukotynski K et al. End-of-treatment but not interim PET scan predicts outcome in nonbulky limited-stage Hodgkin's lymphoma. Ann Oncol 2011; 22: 910-915. El-Galaly TC, Mylam KJ, Brown P et al. Positron emission tomography/computed tomography surveillance in patients with Hodgkin lymphoma in first remission has a low positive predictive value and high costs. Haematologica 2012; 97: 931-936. Bachanova V, Connors JM. How is Hodgkin lymphoma in pregnancy best treated? ASH evidence-based review 2008. Hematology Am Soc Hematol Educ Program 2008; 33-34. Greskovich JF, Jr., Macklis RM. Radiation therapy in pregnancy: risk calculation and risk minimization. Semin Oncol 2000; 27: 633-645. Lishner M. Cancer in pregnancy. Ann Oncol 2003; 14 Suppl 3: iii31-36. Cardonick E, Iacobucci A. Use of chemotherapy during human pregnancy. Lancet Oncol 2004; 5: 283-291. Iriyama N, Horikoshi A, Tanaka T et al. Successful treatment of Hodgkin lymphoma in second trimester of pregnancy: feasibility of ABVD regimen. Int J Hematol 2011; 94: 104-107. Sagan D, Semczuk A, Lampka E. Combination chemotherapy for Hodgkin's lymphoma during pregnancy: favorable outcome for mother and child. J Obstet Gynaecol Res 2010; 36: 882-886. Biggar RJ, Jaffe ES, Goedert JJ et al. Hodgkin lymphoma and immunodeficiency in persons with HIV/AIDS. Blood 2006; 108: 3786-3791. Engels EA, Biggar RJ, Hall HI et al. Cancer risk in people infected with human immunodeficiency virus in the United States. Int J Cancer 2008; 123: 187-194. Clifford GM, Rickenbach M, Lise M et al. Hodgkin lymphoma in the Swiss HIV Cohort Study. Blood 2009; 113: 5737-5742. Tirelli U, Errante D, Dolcetti R et al. Hodgkin's disease and human immunodeficiency virus infection: clinicopathologic and virologic features of 114 patients from the Italian Cooperative Group on AIDS and Tumors. J Clin Oncol 1995; 13: 1758-1767. Carbone A, Gloghini A, Serraino D, Spina M. HIV-associated Hodgkin lymphoma. Curr Opin HIV AIDS 2009; 4: 3-10. Errante D, Tirelli U, Gastaldi R et al. Combined antineoplastic and antiretroviral therapy for patients with Hodgkin's disease and human immunodeficiency virus infection. A prospective study of 17 patients. The Italian Cooperative Group on AIDS and Tumors (GICAT). Cancer 1994; 73: 437-444. Errante D, Gabarre J, Ridolfo AL et al. Hodgkin's disease in 35 patients with HIV infection: an experience with epirubicin, bleomycin, vinblastine and prednisone chemotherapy in combination with antiretroviral therapy and primary use of G-CSF. Ann Oncol 1999; 10: 189-195. Levine AM, Li P, Cheung T et al. Chemotherapy consisting of doxorubicin, bleomycin, vinblastine, and dacarbazine with granulocyte-colony-stimulating factor in HIV-infected patients with newly diagnosed Hodgkin's disease: a prospective, multi-institutional AIDS clinical trials group study (ACTG 149). J Acquir Immune Defic Syndr 2000; 24: 444-450. Spina M, Gabarre J, Rossi G et al. Stanford V regimen and concomitant HAART in 59 patients with Hodgkin disease and HIV infection. Blood 2002; 100: 1984-1988. Hartmann P, Rehwald U, Salzberger B et al. BEACOPP therapeutic regimen for patients with Hodgkin's disease and HIV infection. Ann Oncol 2003; 14: 1562-1569. 90 LINEE GUIDA LINFOMI 362. Xicoy B, Ribera JM, Miralles P et al. Results of treatment with doxorubicin, bleomycin, vinblastine and dacarbazine and highly active antiretroviral therapy in advanced stage, human immunodeficiency virus-related Hodgkin's lymphoma. Haematologica 2007; 92: 191-198. 363. Spina M, Rossi G, Antinori A et al. VEBEP regimen and highly active antiretroviral therapy (HAART) in patients (PTS) with HD and HIV infection (HD-HIV). Annals of Oncology 2008; 19: 152-152. 364. Vaccher E, Spina M, Talamini R et al. Improvement of systemic human immunodeficiency virus-related nonHodgkin lymphoma outcome in the era of highly active antiretroviral therapy. Clin Infect Dis 2003; 37: 15561564. 365. Kaplan LD, Straus DJ, Testa MA et al. Low-dose compared with standard-dose m-BACOD chemotherapy for non-Hodgkin's lymphoma associated with human immunodeficiency virus infection. National Institute of Allergy and Infectious Diseases AIDS Clinical Trials Group. N Engl J Med 1997; 336: 1641-1648. 366. Mounier N, Spina M, Gabarre J et al. AIDS-related non-Hodgkin lymphoma: final analysis of 485 patients treated with risk-adapted intensive chemotherapy. Blood 2006; 107: 3832-3840. 367. Spina M, Jaeger U, Sparano JA et al. Rituximab plus infusional cyclophosphamide, doxorubicin, and etoposide in HIV-associated non-Hodgkin lymphoma: pooled results from 3 phase 2 trials. Blood 2005; 105: 1891-1897. 368. Kaplan LD, Lee JY, Ambinder RF et al. Rituximab does not improve clinical outcome in a randomized phase 3 trial of CHOP with or without rituximab in patients with HIV-associated non-Hodgkin lymphoma: AIDSMalignancies Consortium Trial 010. Blood 2005; 106: 1538-1543. 369. Boue F, Gabarre J, Gisselbrecht C et al. Phase II trial of CHOP plus rituximab in patients with HIV-associated non-Hodgkin's lymphoma. J Clin Oncol 2006; 24: 4123-4128. 370. Ribera JM, Oriol A, Morgades M et al. Safety and efficacy of cyclophosphamide, adriamycin, vincristine, prednisone and rituximab in patients with human immunodeficiency virus-associated diffuse large B-cell lymphoma: results of a phase II trial. Br J Haematol 2008; 140: 411-419. 371. Levine A, Lee J, Kaplan L et al. Efficacy and toxicity of concurrent rituximab plus infusional EPOCH in HIVassociated lymphoma: AIDS Malignancy Consortium Trial 034. J Clin Oncol 2008; 26(15S): 460s, abs. 8527. 372. Lim ST, Karim R, Nathwani BN et al. AIDS-related Burkitt's lymphoma versus diffuse large-cell lymphoma in the pre-highly active antiretroviral therapy (HAART) and HAART eras: significant differences in survival with standard chemotherapy. J Clin Oncol 2005; 23: 4430-4438. 373. Spina M, Simonelli C, Talamini R, Tirelli U. Patients with HIV with Burkitt's lymphoma have a worse outcome than those with diffuse large-cell lymphoma also in the highly active antiretroviral therapy era. J Clin Oncol 2005; 23: 8132-8133; author reply 8133-8134. 374. Wang ES, Straus DJ, Teruya-Feldstein J et al. Intensive chemotherapy with cyclophosphamide, doxorubicin, highdose methotrexate/ifosfamide, etoposide, and high-dose cytarabine (CODOX-M/IVAC) for human immunodeficiency virus-associated Burkitt lymphoma. Cancer 2003; 98: 1196-1205. 375. Oriol A, Ribera JM, Bergua J et al. High-dose chemotherapy and immunotherapy in adult Burkitt lymphoma: comparison of results in human immunodeficiency virus-infected and noninfected patients. Cancer 2008; 113: 117-125. 376. Re A, Cattaneo C, Michieli M et al. High-dose therapy and autologous peripheral-blood stem-cell transplantation as salvage treatment for HIV-associated lymphoma in patients receiving highly active antiretroviral therapy. J Clin Oncol 2003; 21: 4423-4427. 377. Balsalobre P, Diez-Martin JL, Re A et al. Autologous stem-cell transplantation in patients with HIV-related lymphoma. J Clin Oncol 2009; 27: 2192-2198. 378. Diez-Martin JL, Balsalobre P, Re A et al. Comparable survival between HIV+ and HIV- non-Hodgkin and Hodgkin lymphoma patients undergoing autologous peripheral blood stem cell transplantation. Blood 2009; 113: 6011-6014. 379. Re A, Michieli M, Casari S et al. High-dose therapy and autologous peripheral blood stem cell transplantation as salvage treatment for AIDS-related lymphoma: long-term results of the Italian Cooperative Group on AIDS and Tumors (GICAT) study with analysis of prognostic factors. Blood 2009; 114: 1306-1313. 91 Allegato: Tabelle GRADE evidence profile LINEE GUIDA LINFOMI Author(s): MC MM Date: 2012-06-18 Question: Nei pazienti affetti da linfoma follicolare è raccomandabile la somministrazione di una terapia di mantenimento? Bibliography: Vidal L, J Natl Cancer Inst 2009;101: 248 – 255; Martinelli G, J Clin Oncol(2010), 28:4480-4484; Salles G, Lancet (2010); 377:42–51 Valutazione della qualità Numero di pazienti Effetto Qualità Numero di studi Disegno Terapia di mantenimento Assenza di terapia di mantenimento Relativo (95% CI) Nessuna 73/492 (14.8%) 121/492 (24.6%) HR 0.60 (0.45 a 0.79) 90 in meno per 1000 ⊕⊕⊕Ο (da 46 in meno a 127 CRITICA MODERATA in meno) 5 Nessuna 23/73 (31.5%) 36/78 (46.2%) HR 0.63 (0.37 a 1.06) 139 in meno per 1000 ⊕⊕⊕Ο (da 257 in meno a 20 CRITICA MODERATA in più) 6 26/505 (5.1%) 30/513 (5.8%) HR 0.87 (0.51 a 1.47) 7 in meno per 1000 (da ⊕⊕⊕Ο CRITICA 28 in meno a 26 in più) MODERATA 104/227 (45.8%) 197/227 (86.8%) HR 0.53 (0.42 a 0.66) 210 in meno per 1000 ⊕⊕⊕Ο (da 131 in meno a 295 CRITICA MODERATA in meno) 135/505 (26.7%) 221/513 (43.1%) HR 0.55 (0.44 a 0.68) 164 in meno per 1000 (da 112 in meno a 211 in meno) 20/320 (6.3%) 7/327 (2.1%) RR 2.90 (1.24 a 6.76) 41 in più per 1000 (da ⊕⊕⊕Ο CRITICA 5 in più a 123 in più) MODERATA Risk of bias Inconsistency Indirectness Imprecision Altre considerazioni Importanza Assoluto Overall survival (Vidal) 6 Studi clinici randomizzati 1,2 Importante Non 3 importante Non importante Non importante Non importante Importante Non importante Non importante Importante Nessuna Non importante Non importante Non importante Nessuna 4 Overall survival (Martinelli) (follow-up mediana 3 anni) 1 Studi clinici randomizzati Non importante Non importante Overall survival (Salles) (follow-up mediana 36 mesi) 1 Studi clinici randomizzati Non importante Progression-free survival (Vidal) 3 Studi clinici randomizzati 1,2 Importante 4 Progression-free survival (Salles) (follow-up mediana 36 mesi; valutato con: NCI Sponsored International Working Group) 1 Studi clinici randomizzati Non 7 importante Non importante Non importante Non importante Nessuna Non importante Non importante Non importante Nessuna ⊕⊕⊕⊕ ALTA CRITICA Infezioni di grado III/IV (Vidal) 3 Studi clinici randomizzati 2 Importante 4 93 LINEE GUIDA LINFOMI Valutazione della qualità Numero di studi Disegno Numero di pazienti Risk of bias Inconsistency Indirectness Imprecision Altre considerazioni Terapia di mantenimento Assenza di terapia di mantenimento Effetto Relativo (95% CI) Assoluto Qualità Importanza 8 Infezioni di grado III/IV (Salles) (follow-up mediana 36 mesi; valutato con: Common Terminology Criteria for Adverse Events ) 1 Studi clinici randomizzati Non importante Non importante Non importante Non importante Nessuna 197/501 (39.3%) 123/508 (24.2%) RR 1.62 (1.35 a 1.96) 150 in più per 1000 (da 85 in più a 232 in più) ⊕⊕⊕⊕ ALTA CRITICA Non importante Non importante Nessuna 18/501 (3.6%) 5/508 (0.98%) RR 3.6 (1.35 a 9.58) 26 in più per 1000 (da 3 in più a 84 in più) ⊕⊕⊕⊕ ALTA CRITICA Neutropenia (Salles) (follow-up mediana 36 mesi) 1 Studi clinici randomizzati Non importante Non importante 1 La generazione della lista di randomizzazione è stata considerata adeguata in due studi (Forstpointner 2006; Hainsworth 2005). Per gli altri studi non sono stati descritti i metodi utilizzati per la generazione delle liste di allocazione e quindi sono stati considerati di moderata qualità. La gestione delle liste di allocazione è stata considerata adeguata in tre studi (Forstpointner 2006;Hainsworth 2005;Ghielmini 2004) negli altri non è stata descritta. Nessuno dei trials era in cieco (blinding of outcome assessors). L’analisi Intention-to-treat (dove tutti I pazienti randomizzati sono inclusi nella valutazione dell’outcome primario) è stata eseguita in due studi (Hainsworth 2005; van Oers 2006).Il tasso di dropouts era meno del 10% in quattro studi (Forstpointner 2006; Ghielmini 2004; Hainsworth 2005; van Oers 2006). Quattro studi sono stati pubblicati in riviste peer-reviewed come full text e uno come abstract (Hochster 2005; Hochster 2007). Tutti gli studi tranne uno (Hochster 2005; Hochster 2007) riportano l’approvazione da parte del comitato etico ed il consenso informato ottenuto e firmato dai pazienti. Gli autori di uno studio (Hainsworth 2005) dichiaravano un conflitto di interesse. Alcuni studi hanno ricevuto co-finanziamenti dall’industria farmaceutica (Ghielmini 2004; Hainsworth 2005; van Oers 2006). 2 Tre studi, come pianificato in fase di disegno di studio, sono stati interrotti precocemente per beneficio. L’interruzione precoce degli studi potrebbe esporre al rischio di non rilevare alcuni effetti collaterali 3 Hainsworth 2005 prevedeva la somministrazione di rituximab in entrambi I bracci ma con differenti strategie di somministrazione. 4 Il funnel plot non suggerisce la presenza di publication bias. 5 L’intervallo di confidenza al 95% include il non effetto e il limite inferiore dell’intervallo supera la differenza clinicamente importante (MID) 6 L’intervallo di confidenza al 95% include il non effetto e sia il limite inferiore sia il limite superiore dell’intervallo superano la differenza clinicamente importante (MID) 7 I valutatori degli outcomes non erano in cieco rispetto al trattamento assunto dal paziente 8 Sono state considerate anche infezioni di grado II 94 LINEE GUIDA LINFOMI Author(s): MC Date: 2012-06-26 Question: Nei pazienti affetti da linfoma di Hodgkin è raccomandabile la terapia con ABVD vs BEACOPP? Bibliography: Bauer K (2011) Cochrane review ; Behringer K, Annals of Oncology (2012); doi:10.1093/annonc/mdr575; Scholz M, Annals of Oncology (2011);22: 681–688 Valutazione della qualità Numero di studi Disegno Numero di pazienti Risk of bias Inconsistency Indirectness Imprecision Altre BEACOPP ABVD considerazioni Effetto Relativo (95% CI) Qualità Importanza ⊕⊕ΟΟ BASSA CRITICA Assoluto Overall survival 4 Studi clinici randomizzati 1 Importante Non importante Non importante importante Nessuna 72/1323 (5.4%) Non importante Non importante Non 3 importante Nessuna 152/1323 286/1260 HR 0.53 (0.44 a 99 in meno per 1000 (da 75 in ⊕⊕⊕Ο (11.5%) (22.7%) 0.64) meno a 120 in meno) MODERATA 668/719 (92.9%) 2 91/1260 HR 0.80 (0.59 a 14 in meno per 1000 (da 29 in (7.2%) 1.09) meno a 6 in più) Progression free survival 4 Studi clinici randomizzati 1 Importante CRITICA Tasso di risposta oggettiva (valutato con : Tasso di risposta completa) 3 Studi clinici randomizzati Importante Non importante Non importante Non importante Nessuna Non importante Non importante Non importante Molto 5 importante reporting bias 4 437/526 RR 1.11 (1.06 a 91 in più per 1000 (da 50 in (83.1%) 1.16) più a 133 in più) ⊕⊕⊕Ο IMPORTANTE MODERATA Morti correlate al farmaco 1 Studi clinici randomizzati 6 2/98 (2%) 0/99 (0%) RR 5.05 (0.25 a 103.87) - - - - - ⊕ΟΟΟ MOLTO BASSA CRITICA Cardiotossicità Nessuna evidenza disponibile Infezioni di grado III-IV 0 3 Studi clinici randomizzati Nessuna 7 Importante 8 Importante Non importante Non importante Non importante Importante 175/1369 38/1178 RR 3.67 (2.57 a 86 in più per 1000 (da 51 in (12.8%) (3.2%) 5.24) più a 137 in più) Nessuna CRITICA ⊕⊕ΟΟ BASSA CRITICA ⊕⊕ΟΟ BASSA IMPORTANTE Fertilità (Bauer) (valutata con: amenorrea secondaria) 1 Studi clinici randomizzati Non importante Non importante 9 reporting bias 95 10 38/74 (51.4%) 12/32 RR 1.37 (0.38 a 139 in più per 1000 (da 233 in (37.5%) 2.26) meno a 472 in più) LINEE GUIDA LINFOMI Valutazione della qualità Numero di pazienti Effetto Qualità Numero di Disegno Risk of bias Inconsistency Indirectness Imprecision studi Fertilità (Behringer) (valutata con: gravidanze dopo terapie) 1 Studi clinici randomizzati 11 Importante Non importante Non importante Non importante Altre BEACOPP ABVD considerazioni Relativo (95% CI) Importanza Assoluto Nessuna 32/126 (25.4%) 20/137 RR 1.67 (1.01 a 98 in più per 1000 (da 1 in più ⊕⊕⊕Ο IMPORTANTE (14.6%) 2.75) a 255 in più) MODERATA Nessuna 45/1369 (3.3%) 35/1178 RR 0.95 (0.61 a 1 in meno per 1000 (da 12 in (3%) 1.48) meno a 14 in più) Tumori secondari 3 Studi clinici randomizzati 4 Importante Non importante 12 Importante 13 Importante 1 ⊕ΟΟΟ MOLTO BASSA IMPORTANTE Due studi sono in full text, gli altri due sono abstract. La mediana di follow-up varia da studio a studio. Follow-ups più lunghi e l’inclusione dello studio EORTC 20012 trial avrebbero comportato una più precisa stima dell’effetto. Questa incertezza causa un abbassamento della qualità. 3 La definizione di Progression of disease risulta essere diversa per studio. Queste diverse definizioni comportano una stima imprecisa dell’effetto e quindi un abbassamento della qualità. 4 Solo uno studio è pubblicato in full-text 5 Uno dei quattro studi riporta I risultati relativi alla mortalità correlata al trattamento. L’inclusione di ulteriori studi avrebbe comportato una più precisa stima dell’effetto. Questa incertezza causa un abbassamento della qualità. 6 Uno dei quattro studi riporta I risultati relativi alla mortalità correlata al trattamento. Si sospetta che anche gli altri studi abbiano valutato questo evento avverso ma abbiano deciso di non riportare il dato. 7 Tre studi sono stati inclusi. Due di questi sono in full text mentre il più grande è un abstract. 8 2 Eterogeneità: I =80% 9 Solo 106 pazienti dello studio HD9 sono stati analizzati per l’infertilità. L’inclusione di ulteriori studi avrebbe comportato una più precisa stima dell’effetto. Questa incertezza causa un abbassamento della qualità. 10 Si sospetta che anche gli altri studi abbiano valutato questo evento avverso ma abbiano deciso di non riportare il dato. 11 Viene effettuata solo l’analisi per-protocol. 12 Solo due dei quattro studi riportano i dati relativi ai tumori secondari. Inoltre, dato che la maggior parte degli studi aveva un follow-up mediano inferiore ai 10 anni, non ci si può attendere dati a lungo termine sui tumori secondari 13 L’inclusione di ulteriori studi e I risultati di follow-ups più lunghi avrebbero comportato una più precisa stima dell’effetto. Questa incertezza causa un abbassamento della qualità. 2 96