GLI ENZIMI
CHE COSA SONO?
Sono delle proteine
altamente
specializzate con
attività catalitica,
accelerano le reazioni
chimiche rimanendo
inalterati al termine
della reazione stessa.
CLASSIFICAZIONE
O.T.I.L.Is. Lig
NOMENCLATURA
Numero di classificazione
formato: (ECX.Y.Z.W)
(esempio:EC 1.1.1.1)
“EC”: EnzymeCommission
X: Classe
Y: Sottoclasse
Z: Sotto-sottoclasse
W: numero individuale
Catalisi chimica e catalisi enzimatica
gli enzimi catalizzano specifiche reazioni chimiche attraverso
meccanismi di per sé molto simili a quelli operanti nella normale
catalisi chimica
il meccanismo catalitico di un enzima è sempre una
combinazione di più meccanismi elementari di catalisi
chimica
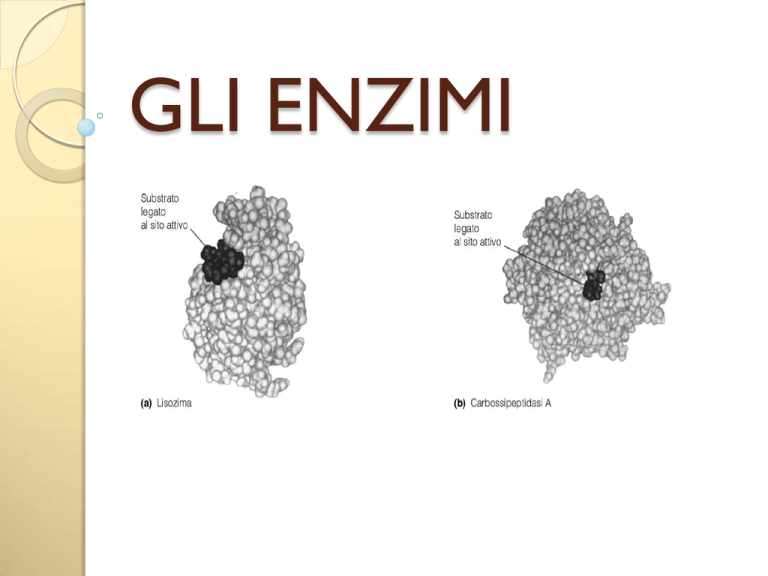
il processo catalitico di un enzima interessa principalmente una
porzione della molecola della proteina enzimatica, detta sito
attivo
nel sito attivo sono presenti vari gruppi funzionali, detti gruppi
catalitici, disposti e orientati in modo opportuno per
legare i substrati e promuovere la loro trasformazione nei
prodotti
l’interazione tra enzima e substrato avviene a
livello di un infossamento, una tasca o una cavità,
definiti sito attivo "
PROPRIETA’
EFFICIENTI
ALTAMENTE SPECIFICI
MODULABILI
AGISCONO in condizioni FISIOLOGICHE
SPECIFICITA’
Diversamente dai catalizzatori
inorganici, gli enzimi sono
altamente specifici sia verso il
substrato sul quale agiscono, sia
verso il tipo di reazione che
catalizzano.
La maggior parte di enzimi agisce su
di un unico substrato o su un
numero molto limitato di composti.
Modello CHIAVE-serratura
Complementarità fra sito attivo dell’ enzima e il
substrato e nessun cambio conformazionale dovuto al
legame del substrato
ADATTAMENTO INDOTTO
il sito attivo più che essere complementare al
substrato, è complementare allo stato di
transizione
La proteina enzimatica senza il suo cofattore è detto apoenzima, mentre la
sua forma completa e cataliticamente attiva è detta oloenzima.
I cofattori possono essere suddivisi in due gruppi:
possono essere ioni inorganici (Fe, Mg, Mn, Zn, Mo etc.) o molecole
organiche (coenzimi) che possono essere: legati debolmente alla
proteina o legati saldamente alla proteina (gruppo prostetico)
Esempi di coenzimi
CATALISI ENZIMATICA
Gli Enzimi catalizzano tutte le reazioni che avvengono
nell’ambiente cellulare dove le condizioni di temperatura e
concentrazione esistenti comporterebbero tempi di reazione
molto lunghi.
FASI dell’ AZIONE CATALITICA
ATTIVITA’ ENZIMATICA
Unità enzimatica (UI) : quantità di enzima
capace di trasformare una mmole di S in
un minuto a 25 °C nelle condizioni ottimali
del saggio.
Un KATAL : quantità di enzima capace di
trasformare una mole di S in
un secondo a 25 °C nelle condizioni
ottimali del saggio.
Numero di turnover ed
efficienza catalitica
Si definisce la costante catalitica
numero di turnover:
numero di molecole di substrato
convertite in prodotto per molecola
di enzima per unità di tempo
quando l’enzima è saturato con il
substrato
Fattori che influenzano attività
enzimatica
Temperatura
pH
Concentrazione
del substrato
Concentrazione dell’enzima
EFFETTO DELLA TEMPERATURA
La velocità delle reazioni
enzimatiche
varia
col
crescere della temperatura
secondo il grafico a
campana riportato.
Si può osservare che,
inizialmente, la velocità
cresce al crescere della
temperatura, raggiunge un
massimo in corrispondenza
di una certa temperatura
definita ottimale, si riduce,
in seguito, per effetto della
denaturazione dell’enzima.
Dipendenza dal pH
Effetto della concentrazione del
substrato
curva di saturazione del
substrato :
[S] bassa ⇒
v proporzionale ad [S]
[S] alta ⇒v indipendente
da [S] ⇒effetto di
saturazione
ogni molecola di enzima
ha il sito di legame
occupato da S
EQUAZIONE DI MICHAELIS –MENTEN
A basse concentrazioni di substrato,
v = Vmax [S] / Km + [S]
cioè,
la
velocità
è
direttamente
proporzionale alla concentrazione del
substrato.
Ad alte concentrazioni di substrato,
quando [S] è molto più grande di Km, Km
diventa trascurabile e si ha
v = Vmax,
cioè, la velocità è la massima,
indipendentemente dalla concentrazione
del substrato.
COSTANTE DI Michaelis-Menten
Km corrisponde alla concentrazione di S alla quale la
velocità è = Vmax/2
se Km è bassa, in ogni istante è necessaria una bassa
concentrazione di substrato per saturare metà delle
molecole di enzima e questo è segno di alta affinità
dell’enzima per il substrato
se Km è alta, occorre una più alta concentrazione di
substrato per saturare metà delle molecole di enzima in
ogni istante e questo vuol dire che l’enzima presenta
bassa affinità per il substrato.
Il valore di Km è indipendente dalla concentrazione
dell'enzima e dalla concentrazione del substrato.
Enzimi multimerici regolatori:
Cooperatività tra subunità ed effetto allosterico
in alcuni casi il legame di uno, o più, effettori
induce variazioni conformazionali che fanno
variare l’attività di un enzima"
Gli effettori possono essere attivatori o inibitori"
gli enzimi modulati dal proprio substrato sono
definiti omotropici; presentano il solo sito attivo
gli enzimi modulati da effettori diversi dal
proprio substrato sono definiti eterotropici;
presentano il sito attivo e uno, o più, siti
regolatori o allosterici nella stessa subunità o in
subunità diverse"
Allosterismo
COMPARAZIONE TRA CURVE DI ATTIVITÀ DI
UN ENZIMA NORMALE E UN ENZIMA
ALLOSTERICO
la
cinetica sigmoide riflette la presenza
di interazioni cooperative tra subunità"
la variazione di struttura di una subunità
dà luogo a variazioni nelle altre"
Il controllo per modificazione
covalente: la fosforilazione
induce cambiamenti strutturali reversibili"
attivatori oppure inibitori"
Modificazioni covalenti irreversibili:
Proteolisi (zimogeni)
L’attivazione proteolitica del chimotripsinogeno
Inibizione enzimatica
Gli inibitori enzimatici interagiscono
reversibilmente
o irreversibilmente con un enzima
Tra i reversibili, si distinguono:
• inibitori competitivi
• inibitori non competitivi
INIBIZIONE COMPETITIVA
INIBIZIONE NON COMPETITIVA
INIBIZIONE REVERSIBILE
COMPETITIVA
L’inibitore possiede una struttura molto simile a
quella del substrato la similitudine porta il
substrato e l’inibitore a competere per lo stesso
sito attivo dell’enzima. L’esito della competizione
dipende dalla concentrazione delle due molecole
che si contendono il sito attivo
Può essere completamente rimossa
aumentando
notevolmente
la
concentrazione di substrato
NON COMPETITIVA
L’inibitore si lega all’enzima in una zona diversa
da quella del sito attivo dando luogo al
complesso EI inattivo. Il legame dell’inibitore
deforma la conformazione spaziale dell’enzima
ed il suo sito catalitico pur potendosi legare al
substrato risulta inattivo.
L’aumento della [S] aumenta la
probabilità che sia S a legarsi all’enzima
invece dell’inibitore. Alti valori di [S]
possono annullare l’effetto di I.
La Vmax rimane invariata (infatti a
concentrazione elevata di substrato
tutta l’inibizione viene rimossa) mentre
la Km aumenta.
L’inibitore ed il substrato si legano a siti
diversi dell’enzima e il legame di I non
influenza il legame di S
A qualsiasi concentrazione di substrato
la velocità di reazione in presenza di
inibitore è sempre minore che in sua
assenza. Quindi la Vmax diminuisce
mentre la Km rimane costante.
ISOZIMI: lattato deidrogenasi