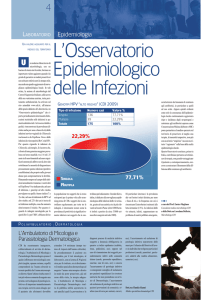
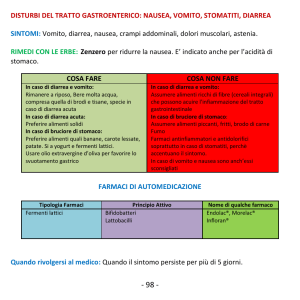
Editoriale N.2
Diagnosi clinica e di laboratorio dell’infezione da
Clostridium Difficile
Dr. Sergio Brunati
Specialista in Medicina Interna
Specialista in Gastroenterologia
L’infezione da Clostridium difficile (CDI) è tipicamente acquisita
durante il ricovero in una struttura sanitaria, ma sono in rapido aumento
epidemiologico anche manifestazioni endogene o acquisite in comunità.
E’ necessario considerare la CDI in ogni paziente che durante il ricovero
presenta diarrea da più di 3 giorni, febbre o dolore addominale.
Una diagnosi tempestiva e accurata delle CDI è di primaria
importanza, non solo per una pronta guarigione del paziente, ma anche
per un miglioramento nella prevenzione di eventuali fenomeni recidivanti
e/o di contaminazione. Il Laboratorio di Microbiologia offre un panel di
test che hanno oramai raggiunto elevati livelli di affidabilità e
costituiscono indispensabile supporto al sospetto clinico.
Diagnosi clinica
L’infezione
da
Clostridium
difficile presenta uno spettro di
manifestazioni cliniche molto
differenziato che va dalla
Colonizzazione asintomatica, alla
Diarrea semplice post-antibiotica,
sino
alla
Colite
pseudo
membranosa.
La Colonizzazione asintomatica
è la condizione più frequente e
colpisce circa i 2/3 dei pazienti
che acquisiscono il batterio. E’
riportata nel 3% degli adulti sani
(Svezia 2% - Giappone 15%) e
nel 15-70% dei bambini con età
inferiore ai 2 anni. Il tasso di
portatori aumenta con l’età ed è
del 16-35% tra i pazienti
ospedalizzati. Nell’adulto tale
stato dura sino a 2-3 anni, con
ceppi tossinogeni < 1%. Dopo
questo periodo la malattia
persiste nelle feci nel 10-40% dei
pazienti. Nel bambino i ceppi
tossinogeni sono il 5-63%
(assenza di recettori per le
tossine?) e scendono al 3% dopo
il
2°
anno:
i
portatori
asintomatici possono divenire
clinicamente sintomatici dopo
esposizione a specifici fattori di
rischio che portano all’eccessiva
crescita del germe.
La Diarrea semplice postantibiotica compare solitamente
dopo 4-8 settimane dalla terapia
antibiotica e si presenta con una
diarrea variabile, da moderata a
profusa, accompagnata sovente
da muco e raramente da sangue,
in assenza di segni generali. Essa
rappresenta il 10-25% delle
infezioni e si risolve nel 25% dei
casi con la sospensione della
terapia
antibiotica.
Alla
colonscopia la mucosa si
presenta normale o con erosioni,
ma senza pseudomembrane.
La Colite Pseudomembranosa ha
un esordio brutale ed è una
patologia importante e grave. Si
presenta con una diarrea profusa,
superiore alle 7 scariche /giorno,
con febbre nel 75% dei casi e
dolore addominale nel 70%. Essa
provoca rapidamente una forte
disidratazione. Gli esami di
laboratorio si presentano nel 40%
dei casi con:
iperleucocitosi (>15.000
definisce
una forma
severa, > 25.000 si
associa ad aumentata
mortalità),
ipoalbuminemia (< 2,5
gr/dl),
creatininemia
leucociti nelle feci nel
50% dei casi.
All’endoscopia si rileva la
presenza di pseudomembrane
(forme severe 85%) che sono
diagnostiche.
Ove non visualizzate all’esame
endoscopico, tali formazioni
possono
essere
evidenziate
all’esame istologico.
La Rx addome diretto può
risultare negativa (36%), mentre
la CT è spesso indicativa (78%
nelle severe) ma non deve essere
utilizzata per formulare o
escludere una diagnosi, vista la
scarsa specificità e sensibilità.
Spesso le immagini non sono
peraltro
necessariamente
correlate alla gravità della
malattia. Da qualche tempo si è
iniziato ad utilizzare l’ecografia
delle anse intestinali, ma il
risultato è strettamente correlato
all’abilità dell’operatore che
esegue il test.
Indicatori
di
severità
dell’infezione in questi pazienti
sono:
1. distensione addominale
2. dolore
3. ascite
4. instabilità emodinamica
5. alterato stato di coscienza.
Da sottolineare come le forme
morbose manifestate in una
gravidanza si siano dimostrate
molto severe; i casi si sono per lo
più verificati in periodo postpartum e in pazienti che si erano
esposte a trattamento antibiotico
durante il parto o comunque nel
mese
precedente
le
manifestazioni cliniche.
In rapporto alla sintomatologia
clinica possiamo suddividere le
CDI in forma:
Lieve: diarrea (< 10 scariche
die), febbre
Moderata: febbre, nausea,
disidratazione,
anoressia,
diarrea importante, dolore e
distensione
addominale,
leucocitosi
(< 15.000),
ipoalbuminemia,
colite
pseudomembranosa
Grave: T > 38,5OC, diarrea
grave
(possibile ileo
paralitico), torpore, dolore
addominale,
leucocitosi
grave (>15.000), irritazione
peritoneale, ipoalbuminemia,
colite pseudomembranosa.
Fra le complicanze dell’infezione
da Clostridium difficile possiamo
ricordare: megacolon tossico,
perforazione/peritonite , shock
settico.
Si deve ricordare peraltro che,
per quanto il battere sia elettivo
per
patologie
intestinali,
occasionalmente è stato implicato
in patologie extra-intestinali:
infezioni superficiali di ferite,
gangrena
gassosa,
ascessi,
pleuriti, peritoniti, empiemi,
setticemie.
Dal 2002 sono state segnalate
alcune epidemie di malattia da
CD con maggiori livelli di
gravità e mortalità. È stato
identificato, sia in America che
in Europa, un nuovo ceppo
(ceppo BI/NAP1/027), con una
variante nel gene della tossina,
che provoca una maggiore
produzione della stessa (16 volte
> rispetto agli altri ceppi per
quanto riguarda la tossina A, 23
volte > per quanto riguarda la
tossina B, con produzione di una
terza tossina detta “binaria” il cui
ruolo
non
è
sicuramente
determinato)
e
aumentata
sporulazione. La sintomatologia
iniziale
si
presenta
più
frequentemente in pazienti in
comunità o ospedalizzati (a
domicilio: 21% NAP vs 78%
non-NAP; in altre strutture: 46%
NAP vs 54% non-NAP).
E’
inoltre
fondamentale,
nell’inquadramento del malato,
identificare l’eventuale presenza
di fattori di rischio correlati allo
sviluppo della malattia e della
sua prognosi:
1. terapia antibiotica (rischio
maggiore
clindamicina,
cefalosporine di 2° e 3° gen.,
fluorochinolonici)
2. età avanzata (in uno studio
sulla
frequenza
della
mortalità a 30 giorni, su 1430
pazienti si è evidenziato che
l’ 85% dei casi aveva una età
> 65 anni)
3. degenza
prolungata
in
ambiente ospedaliero o in
comunità
4. severe comorbilità
5. immunodepressione
6. trapianto d’organi
7. chirurgia digestiva
8. malattia
infiammatoria
cronica intestinale (IBD).
9. Una concomitante diagnosi
di IBD e CDI associata a
diarrea risulta predittiva di un
aumentato
rischio
di
ospedalizzazione e di una
aumentata
mortalità.
I
pazienti
con
IBD,
specialmente quelli con
rettocolite ulcerosa, hanno
maggior rischio di acquisire
la CDI. In questi pazienti
l’infezione da CD risulta
addirittura raddoppiata tra il
1998 ed il 2004, mentre la
mortalità
intraospedaliera
risulta triplicata. Inoltre, vi è
un aumento importante della
durata della degenza fino al
40-60%.
10. nutrizione per sondino naso
gastrico o gastrostomia
11. farmaci antisecretori gastrici
(il rischio di recidiva
aumenta di oltre 4 volte nei
pazienti trattati con farmaci
inibitori
della
pompa
protonica)
12. precedente episodio di CDI.
Nei malati ospedalizzati bisogna
considerare, in caso di CDI, un
probabile aumento della durata
della degenza (da 5 a 21 giorni,
fino a 36 giorni nei malati con età
> 75 anni).
L’impatto economico delle CDI è
pertanto significativo: secondo
dati dell’European CDC, in
Inghilterra le infezioni da CD
comportano una spesa indotta di
€ 5.000-15.000 per caso; se si
riporta tale dato sull’intera
popolazione europea, si arriva a
stimare che la CDI provochi ai
sistemi sanitari europei un
potenziale costo aggiuntivo di 3
miliardi di € per anno, dato da
ritenere in crescita per i prossimi
decenni.
Negli USA il costo attribuibile
per un paziente con CDI è stato
stimato intorno ai $ 2.470- 3.669
per episodio; il costo attribuibile
per paziente nei sei mesi dopo la
diagnosi varia da $ 5.042 a 7.179.
La spesa degli ospedali USA per
il trattamento di CDI è stata così
stimata intorno ai 3,2 miliardi di
dollari/anno.
Le recidive / ricadute avvengono
in media entro un mese dal
termine della terapia antibiotica
(è possibile anche più tardi), con
frequenza del 15-30%.
Sono più frequenti (fino al 65%)
in soggetti con precedenti episodi
(descritte fino a 10 recidive).
Le recidive si registrano per il
20% dopo il primo episodio, per
il 40% dopo il secondo e per il
60% dopo più di due episodi.
Diagnosi di
laboratorio
Il Clostridium difficile è un
batterio
sporigeno
Grampositivo, anaerobico, che si
diffonde per via oro-fecale. I
ceppi patogeni producono due
tossine, A (enterotossica) e B
(enterotossica e citotossica), che
sono responsabili della malattia.
Il test che comunemente
viene richiesto in un paziente con
diarrea è l’esame colturale delle
feci, che in questo caso risulta
però non indicato (eventualmente
una seconda scelta per un
laboratorio
che
volesse
approfondire
una
eventuale
diagnosi).
Questo
perché
l’esame colturale standard ricerca
i più comuni patogeni che si
acquisiscono per via alimentare,
quindi la salmonella, la shigella e
il campylobacter, oltre ad altri
patogeni, di meno frequente
riscontro,
tutti
legati
a
tossinfezioni alimentari o a
infezioni acquisite per via
orofaringea. La coltura è un test
che richiede un tempo di risposta
che va da 48 a 72 ore. Inoltre
l’isolamento in coltura del
batterio con specifico test non è
sufficiente per la diagnosi, in
quanto solo i ceppi in grado di
produrre le tossine sono in grado
di causare la malattia. Per tale
motivo
sarebbe
necessario
verificare la natura tossinogenica
del ceppo isolato, e il test di
Riferimento (test di citotossicità
su feci) richiede fino a cinque
giorni per la refertazione.
La diarrea, specie in un
paziente anziano e/o che presenta
i fattori di rischio specifici, può
essere dovuta con discreta
probabilità all’infezione da CD.
In tali casi il test indicato è quello
per la ricerca diretta della tossina
o dei germi che sintetizzano la
tossina. Si tratta di un test molto
più rapido rispetto alla coltura.
La richiesta tempestiva di tale
test (riservandosi eventualmente
di chiedere poi quelli legati a
patogeni più comuni), permette
di risparmiare tempo prezioso, in
quanto in grado di fornire una
risposta nel giro di poche ore.
Riassumendo:
Quando richiedere i test per CDI
1. Diarrea
come sintomo
principale
insorta 2-3 giorni da
ospedalizzazione
insorta a casa da
oltre 3 giorni, senza
identificazione di un
patogeno
2. Diarrea e precedente terapia
antibiotica
3. Diarrea e appartenenza ad un
gruppo a rischio (vedi
diagnosi clinica)
4. Diarrea
e
frequente
esposizione a C. difficile
Ospedalizzato o in
comunità (possibile
contagio da altri
malati
o
ospiti,
personale sanitario,
arredo)
Personale sanitario.
Come prelevare i campioni di
feci e conservare i
reperti
biologici
Esistono alcune prescrizioni
per la corretta raccolta e invio del
campione (diarrea e non feci
formate):
raccolta con palettino in
dotazione o attraverso un
tampone floccato, in questo
caso sia perirettale che rettale
(importante che il tampone
presenti tracce di materiale
fecale)
contenitori di sicurezza (con
tappo a vite, non sterili)
invio entro due ore dalla
raccolta,
conservazione in frigorifero a
4oC per un massimo di 3
giorni.
Quali sono i test diagnostici per CD
Test
Coltura per CD
Sensibilità Specificità Disponibilità Costo
Bassa
Moderata
Limitata
Utilizzo
Non ha uso diagnostico; solo i
microorganismi tossinogenici
provocano malattia
$ 5-10
Metodo di riferimento
Toxigenic
culture
Alta
Alta
Limitata
$ 10-30
Valore epidemiologico
Limitato uso diagnostico
Metodo di riferimento
CCNA
Alta
Alta
Limitata
$ 15-25
Limitato uso diagnostico
GDH
Alta
Bassa
Ampia
$ 5-15
Test diagnostico di screening; da
confermare
Toxin EIA test
Bassa
Alta
Ampia
$ 5-15
Deve individuare tossine A + B;
bassa sensibilità
NAATs
Alta
Alta
Ampia
$ 20-50
Da utilizzare solo in fase acuta di
malattia; da considerare rischio di
possibili falsi positivi
Tabella 1. Modificata da CM Surawicz et al. Am J Gastroenterol 2013; 108: 478-498
Stool culture Terreno
selettivo CCFA (cicloserina,
cefoxitina,,fruttosio, agar), il
più sensibile. Non specifico;
non sa distinguere tra ceppi
tossigeni e ceppi non
tossigeni e richiede sia tempo
per la risposta (48-72 ore) sia
personale
esperto
nelle
colture anaerobiche
Cell Culture Neutralization
Assay (CCNA) rileva la
presenza di citotossina B+
del CD. E’ metodo colturale
innovativo basato sull’effetto
citopatico provocato dalla
tossina su colture di cellule
umane / di mammifero,
invertito dall’aggiunta di
antitossina. Sensibile e
specifico, presenta alcuni
svantaggi: incubazione lenta
(di solito 48 ore), variabilità
dovuta alle linee cellulari
selezionate per il test,
parametri procedurali critici
che richiedono notevole
esperienza e grande cura,
variabilità
procedurale
significativa da laboratorio a
laboratorio
Toxigenic Culture (Culture
and CCNA) viene
effettuata la coltura di CD su
cui viene poi testata la
presenza di tossina con una
procedura simile al test
precedente, di cui ha le stesse
limitazioni,
pur
avendo
uguale elevata sensibilità e
specificità. Pur essendo test
gold
standard,
molti
laboratori non eseguono
CCNA o Toxigenic culture a
causa
del
tempo
di
incubazione,
delle
competenze tecniche e del
tempo
necessario
alla
effettuazione del test, e per la
necessità di mantenere linee
cellulari per questi test
Toxin EIA test (Enzyme
Immunoassay ) Utilizza
una
reazione
immunoenzimatica
per
rilevare le tossine prodotte
dai batteri. E’ un test
semplice, economico, che
non richiede apparecchiature
costose e offre un tempo di
risposta rapido (1 ora). La
Letteratura
ha
però
evidenziato
limiti
nella
diagnostica basata su questo
test: i test EIA, quando
utilizzati come stand-alone
per la diagnosi di CDI, hanno
effettivamente
dimostrato
una alta specificità (92100%), ma hanno un valore
predittivo positivo molto
variabile (49-100), un alto
valore predittivo negativo
(94-100), una sensibilità
diversificata a seconda dei
diversi lavori pubblicati (3298,7%). E’ pertanto un test
con una elevata variabilità di
risultati in letteratura e con
opinioni conflittuali sul suo
impiego come unico test
Glutamate dehydrogenase
enzyme
immunoassay
(GDH)
Rilevano la
presenza
dell’enzima
glutammato
deidrogenasi
prodotto da CD. GDH è però
prodotta anche da altri
batteri. Ha buona sensibilità
(92%), migliore che negli
EIA test indirizzati alla
tossina, ma bassa specificità
(89%),
basso
valore
predittivo positivo (57,7%),
alto
valore
predittivo
negativo. Utilizzabile come
test di screening. I risultati
positivi devono essere testati
con un toxin test per
confermare la presenza della
tossina del CD. Vi sono
anche EIA tests che testano
contemporaneamente
sia
GDH che le tossine in un
singolo campione . Hanno il
vantaggio di un basso costo,
elevata
rapidità,
buona
sensibilità, ma sono limitati
da una ugualmente bassa
specificità alle tossine. L’uso
di algoritmi diagnostici che
utilizzano il GDH come
primo gradino del processo
diagnostico non ha avuto
grande diffusione.
Nucleic acid amplification
tests (NAAT) / Real-time
polymerase chain reaction
molecular based (PCR Or
LAMP) Test molecolare
per la ricerca del genoma del
CD. I test in commercio
rilevano la presenza di forme
tossinogene di CD. E’
sensibile e specifico, ma
nella forma classica richiede
attrezzature speciali che
devono essere acquistate per
eseguire estrazioni e / o
amplificazioni. E’attualmente
disponibile
una
nuova
tecnologia
molecolare
(LAMP) che utilizza un
sistema di amplificazione
genica
(Loop
Mediated
Isothermal Amplification),
che rileva e amplifica una
regione di DNA patogeno
comune a tutti i ceppi che
producono tossine di CD.
Questa tecnologia elimina la
necessità
di
costose
apparecchiature. Il test è
molto rapido e viene
effettuato in 1-3 ore. Le più
recenti Linee Guida, come
quelle rilasciate dall’ASM
(American
Society
for
Microbiology) nel 2009 e
quelle del 2013 pubblicate
dalla
Association
for
Professionals in Infection
Control and Epidemiology,
USA, indicano la biologia
molecolare (NAAT) come
valida
alternativa
alla
diagnostica tradizionale: la
rilevazione di un ceppo
tossinogenico (presenza del
gene per le tossine), in
combinazione
con
le
indicazioni
cliniche
di
infezione
da C.difficile,
consente di avere una
diagnosi di laboratorio in
tempi molto rapidi e con
sensibilità e specificità che
superano il 95%.
Bibliografia essenziale:
1) Carroll KC. Anaerobe 2011;
17: 170-174.
2) Clinical practice guidelines for
Clostridium difficile infection in
adults: 2010 update by the
Society
for
Healthcare
Epidemiology
of
America
(SHEA) and the infectious
diseases society of America
(IDSA). Infect Control Hosp
Epidemiol 2010; 31: 431-455.
3) Guide
to
Preventing
Clostridium difficile Infections;
2013 update by Association for
Professionals
in
Infection
Control and Epidemiology, Inc.
(APIC)
4) Eastwood K et al. J Clin
Microbiol 2009; 47: 3211-3217
5) Sloan LM et al. J Clin Microbiol
2008; 46: 1996-2001