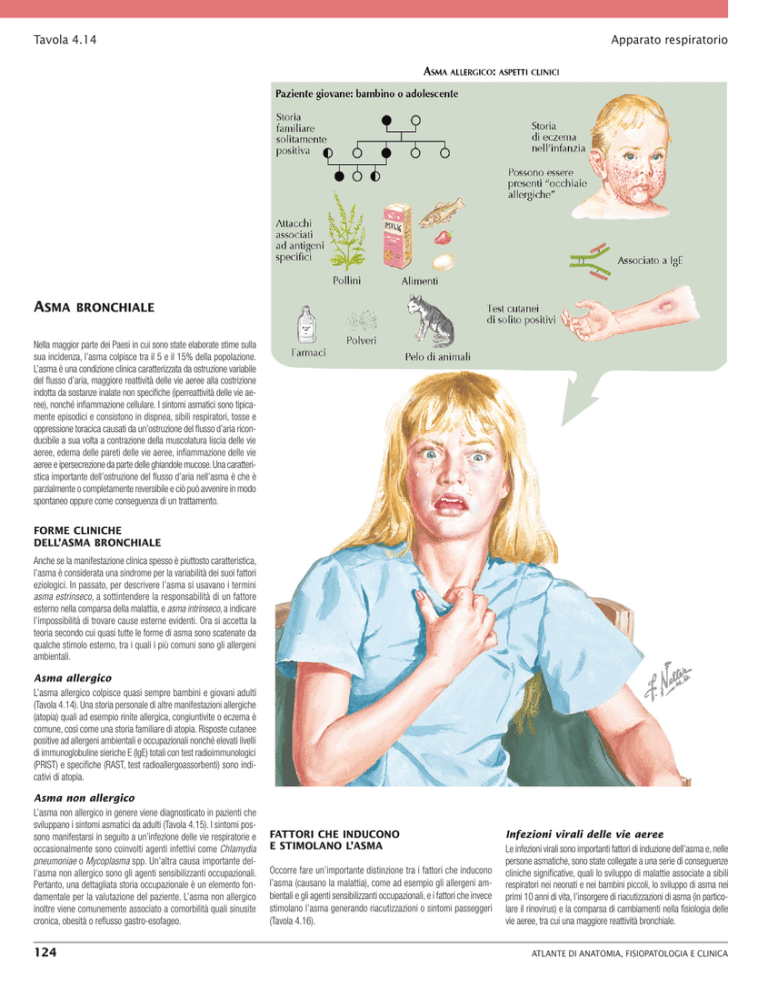
Tavola 4.14Apparato respiratorio
Asma
bronchiale
Nella maggior parte dei Paesi in cui sono state elaborate stime sulla
sua incidenza, l’asma colpisce tra il 5 e il 15% della popolazione.
L’asma è una condizione clinica caratterizzata da ostruzione variabile
del flusso d’aria, maggiore reattività delle vie aeree alla costrizione
indotta da sostanze inalate non specifiche (iperreattività delle vie aeree), nonché infiammazione cellulare. I sintomi asmatici sono tipicamente episodici e consistono in dispnea, sibili respiratori, tosse e
oppressione toracica causati da un’ostruzione del flusso d’aria riconducibile a sua volta a contrazione della muscolatura liscia delle vie
aeree, edema delle pareti delle vie aeree, infiammazione delle vie
aeree e ipersecrezione da parte delle ghiandole mucose. Una caratteristica importante dell’ostruzione del flusso d’aria nell’asma è che è
parzialmente o completamente reversibile e ciò può avvenire in modo
spontaneo oppure come conseguenza di un trattamento. Forme cliniche
dell’asma bronchiale
Anche se la manifestazione clinica spesso è piuttosto caratteristica,
l’asma è considerata una sindrome per la variabilità dei suoi fattori
eziologici. In passato, per descrivere l’asma si usavano i termini
asma estrinseco, a sottintendere la responsabilità di un fattore
esterno nella comparsa della malattia, e asma intrinseco, a indicare
l’impossibilità di trovare cause esterne evidenti. Ora si accetta la
teoria secondo cui quasi tutte le forme di asma sono scatenate da
qualche stimolo esterno, tra i quali i più comuni sono gli allergeni
ambientali.
Asma allergico
L’asma allergico colpisce quasi sempre bambini e giovani adulti
(Tavola 4.14). Una storia personale di altre manifestazioni allergiche
(atopia) quali ad esempio rinite allergica, congiuntivite o eczema è
comune, così come una storia familiare di atopia. Risposte cutanee
positive ad allergeni ambientali e occupazionali nonché elevati livelli
di immunoglobuline sieriche E (IgE) totali con test radioimmunologici
(PRIST) e specifiche (RAST, test radioallergoassorbenti) sono indicativi di atopia.
Asma non allergico
L’asma non allergico in genere viene diagnosticato in pazienti che
sviluppano i sintomi asmatici da adulti (Tavola 4.15). I sintomi possono manifestarsi in seguito a un’infezione delle vie respiratorie e
occasionalmente sono coinvolti agenti infettivi come Chlamydia
pneumoniae o Mycoplasma spp. Un’altra causa importante dell’asma non allergico sono gli agenti sensibilizzanti occupazionali.
Pertanto, una dettagliata storia occupazionale è un elemento fondamentale per la valutazione del paziente. L’asma non allergico
inoltre viene comunemente associato a comorbilità quali sinusite
cronica, obesità o reflusso gastro-esofageo. 124
Fattori che inducono
e stimolano l’asma
Occorre fare un’importante distinzione tra i fattori che inducono
l’asma (causano la malattia), come ad esempio gli allergeni ambientali e gli agenti sensibilizzanti occupazionali, e i fattori che invece
stimolano l’asma generando riacutizzazioni o sintomi passeggeri
(Tavola 4.16). Infezioni virali delle vie aeree
Le infezioni virali sono importanti fattori di induzione dell’asma e, nelle
persone asmatiche, sono state collegate a una serie di conseguenze
cliniche significative, quali lo sviluppo di malattie associate a sibili
respiratori nei neonati e nei bambini piccoli, lo sviluppo di asma nei
primi 10 anni di vita, l’insorgere di riacutizzazioni di asma (in particolare il rinovirus) e la comparsa di cambiamenti nella fisiologia delle
vie aeree, tra cui una maggiore reattività bronchiale.
Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.15
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
Allergeni ambientali
È risaputo che gli allergeni inducono l’asma e al tempo stesso ne
stimolano la sintomatologia. In effetti, alcune persone asmatiche
manifestano solo sintomi stagionali quando sono esposte agli allergeni. I pazienti sensibili agli allergeni possono sviluppare una
broncocostrizione acuta entro 10-15 minuti dall’inalazione degli
allergeni che in genere si risolve nel giro di un paio d’ore (risposta
asmatica precoce); tuttavia, nell’arco delle 3-6 ore successive il
fenomeno può ripresentarsi (risposta asmatica tardiva) con una
broncocostrizione grave che si sviluppa più lentamente ed è associata a dispnea. La risposta tardiva è causata dall’afflusso sempre
maggiore nelle vie aeree di cellule infiammatorie, in particolare
basofili, neutrofili ed eosinofili. In genere, la broncocostrizione si
risolve entro 24 ore, ma la maggiore reattività delle vie aeree non
scompare e può persistere per più di una settimana.
Agenti sensibilizzanti occupazionali
L’asma occupazionale è una forma comune di esordio dell’asma in
età adulta. Sono stati individuati più di 200 agenti negli ambienti di
lavoro, tra cui allergeni quali pelo di animali, farina di grano, psillio
ed enzimi che provocano un restringimento delle vie aeree attraverso risposte mediate da IgE, e sostanze chimiche (spesso a basso
peso molecolare, ad esempio il diisocianato di toluene) responsabili
di indurre l’asma attraverso meccanismi non mediati da IgE. Le
esposizioni e le inalazioni accidentali sul posto di lavoro costituiscono un fattore di rischio importante per le manifestazioni iniziali
di asma. Quando un soggetto sensibile inala agenti sensibilizzanti
chimici in laboratorio, spesso può verificarsi una prima risposta
asmatica simile a quella indotta da un allergene, alla quale può fare
seguito una risposta asmatica tardiva. Le risposte infiammatorie
delle vie aeree causate da agenti sensibilizzanti occupazionali non
sembrano essere molto diverse da quelle indotte da altri fattori,
come gli allergeni ambientali.
Atlante di Anatomia, Fisiopatologia e Clinica
Sforzo fisico
Lo sforzo fisico è uno dei fattori più frequentemente coinvolti nello
sviluppo di asma. Dopo avere compiuto un’attività fisica si assiste
all’insorgere di una broncocostrizione che raggiunge il suo picco
10-20 minuti dopo la fine dello sforzo e che tende a risolversi
entro un’ora. Molto difficilmente la broncocostrizione insorgerà
nel corso dell’attività: essa è infatti causata dal raffreddamento e
dalla secchezza delle vie aeree perché i grandi quantitativi di aria
inalata durante lo sforzo fisico sono condizionati alla temperatura
corporea e sono alla saturazione. Persone asmatiche che inalano
aria molto fredda e secca possono manifestare sintomi simili.
Inalando b2-agonisti 20 minuti prima di iniziare l’attività si riesce,
nella maggior parte dei casi, a prevenire le broncocostrizioni indotte da sforzi fisici.
125
Tavola 4.16Apparato respiratorio
Asma
bronchiale (Seguito)
Sostanze inquinanti dell’aria
Diverse sostanze inquinanti dell’aria stimolano l’asma quali, ad
esempio, il biossido di azoto (NO2), il biossido di zolfo (SO2), l’ozono
e le particelle inalate con un diametro inferiore a 10 mm (PM10).
Odori forti come profumi, gas di scarico delle automobili e fumo
passivo rappresentano altre sostanze ambientali irritanti che possono stimolare i sintomi asmatici.
Sensibilità all’acido acetilsalicilico
Nel 5% circa degli individui asmatici è stata individuata la cosiddetta
triade di Samter, ossia una triade caratterizzata da sensibilità all’acido acetilsalicilico, asma e poliposi nasale (anche se la poliposi
nasale non è sempre presente negli asmatici sensibili all’acido
acetilsalicilico). I sintomi dell’asma compaiono entro 20 minuti
dall’assunzione dell’acido acetilsalicilico e possono essere molto
gravi e alle volte addirittura potenzialmente letali. Questa sensibilità
esiste verso tutti i farmaci che inibiscono la ciclossigenasi (COX-1)
e talvolta anche verso la tartrazina. L’uso di paracetamolo e inibitori
della COX-2 risulta invece essere sicuro nella maggior parte dei
soggetti asmatici sensibili all’acido acetilsalicilico.
Presentazione clinica
Sintomi e reperti clinici
I sintomi e i segni dell’asma variano da episodi lievi e isolati di dispnea, sibili respiratori e tosse molto intermittenti, che in genere si
manifestano dopo l’esposizione a un agente scatenante e sono
seguiti da significativa remissione, a sintomi cronici continui di
gravità variabile. Nello stesso paziente i sintomi possono manifestarsi in forma lieve, moderata o grave e persino i soggetti con una
forma di asma lieve e intermittente possono andare incontro a gravi
e pericolose riacutizzazioni, esperienze che possono essere terribili,
soprattutto per quei pazienti che ne conoscono la natura potenzialmente progressiva.
I sintomi di una riacutizzazione asmatica, che nella maggior parte
dei casi si sviluppano in modo graduale, possono talvolta manifestarsi all’improvviso e sono quasi sempre preceduti da infezioni virali
delle vie aeree superiori. Molti pazienti avvertono una sensazione di
costrizione toracica retrosternale ed è possibile, all’auscultazione,
evidenziare un sibilo espiratorio e spesso anche inspiratorio, associato a gradi variabili di dispnea. Può inoltre comparire tosse
secca o produttiva con espettorato purulento.
Nei casi di riacutizzazioni asmatiche gravi, il paziente preferisce
rimanere seduto con la schiena diritta; l’evidente dilatazione delle
narici e l’impiego dei muscoli respiratori accessori sono il segno di
126
un lavoro respiratorio più intenso. In genere, l’ansia e l’apprensione
sono correlate all’intensità della riacutizzazione. Paura, ostruzione
delle vie aeree o variazioni della PaO2 e del pH di sangue e tessuti
possono determinare tachipnea. Ipertensione e tachicardia sono
entrambe manifestazioni di un maggiore rilascio di catecolamine,
anche se una frequenza del polso superiore a 110-130 battiti/minuto può indicare un’importante ipossiemia (PaO2 <60 mmHg) e
la gravità dell’episodio. Il polso paradosso (≥10 mmHg) accompa-
gna l’iperinflazione polmonare che si verifica quando il volume
espiratorio forzato in un secondo (VEMS) in genere è inferiore al
30% del normale atteso. In presenza di ipossiemia grave e ipercapnia con acidosi respiratoria il paziente è solitamente cianotico, affaticato, confuso e agitato. Un esame toracico rivela un tono iperfonetico alla percussione, un diaframma basso e altri sintomi di
iperinflazione. L’espirazione è prolungata. Il paziente mostra un sibilo
inspiratorio ed espiratorio generalizzato. Con un’ostruzione di basso
Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.17
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
grado, il sibilo respiratorio può essere fievole o persino assente ma
una respirazione rapida e profonda potrebbe accentuarlo. Quando
il flusso d’aria è molto ridotto, il torace può diventare paradossalmente silenzioso. Questo fenomeno non certo piacevole può essere
indotto o aggravato inavvertitamente dalla somministrazione di ipnotici, tranquillanti o sedativi che rallentano la respirazione. Nel
momento in cui il flusso d’aria si riduce a tal punto da rendere silenzioso il torace, la tosse diventa inefficace e si assiste al sopraggiungere di un’insufficienza ventilatoria, circostanza che richiede un intervento immediato e intensivo.
Diagnosi dell’asma
Formulare una diagnosi corretta non appena si presentano i primi
sintomi è molto importante, perché l’asma è una malattia che
accompagna la maggior parte dei pazienti per tutta la vita. In
molti casi, purtroppo, i pazienti vengono sottoposti a trattamenti
inadeguati. Nessun sintomo dell’asma è patognomonico e la
massima secondo cui “non tutto ciò che sibila è asma” serve solo
a ricordare che sibilo, tosse, costrizione toracica e dispnea sono
sintomi anche di altre malattie respiratorie o cardiache. La diagnosi di asma deve basarsi sui sintomi caratteristicamente associati a un’ostruzione variabile del flusso d’aria o all’iperreattività
delle vie aeree.
Il modo migliore per misurare un’ostruzione variabile del flusso
d’aria è usare la spirometria con una curva flusso-volume e dimostrare un VEMS e un rapporto tra VEMS e capacità vitale forzata
(CVF) ridotti ma suscettibili di miglioramento dopo l’inalazione di
b2-agonisti (Tavola 4.17). Un miglioramento del VEMS superiore al
12%, associato a una variazione minima di 200 mL, è in genere
accettato come prova di un’ostruzione reversibile del flusso d’aria.
Nelle strutture in cui la spirometria non è disponibile è possibile
valutare la variabilità nelle misurazioni del picco di flusso espiratorio
(PEF) sia per la formulazione di una diagnosi di asma sia per il
monitoraggio. Anche un miglioramento di oltre il 20% (o >60 L/
minuto) dopo l’inalazione di un b2-agonista o una variazione diurna
del PEF superiore al 20%, dopo due settimane di misurazioni,
confermano un’ostruzione variabile del flusso d’aria. Iperreattività delle vie aeree
Nei pazienti con sintomi compatibili con l’asma ma con una funzionalità polmonare normale, misurare la reattività delle vie aeree a
stimoli diretti (ad es. inalazione di metacolina e istamina) oppure a
stimoli indiretti (ad es. inalazione di mannitolo o sforzi fisici) può
aiutare a diagnosticare l’asma (Tavola 4.17). Le misurazioni della
Atlante di Anatomia, Fisiopatologia e Clinica
reattività delle vie aeree riflettono la “sensibilità” di queste ultime a
fattori che possono causare i sintomi dell’asma. In genere i risultati
dei test sono espressi come concentrazione (o dose) dell’agonista
in grado di indurre una determinata riduzione del VEMS. Questi
esami nonostante siano utili per diagnosticare l’asma, hanno tuttavia
una specificità limitata. Ciò significa che un risultato negativo del
test può essere utile per escludere una diagnosi di asma persistente
in un paziente non sottoposto a un trattamento a base di glucocorticoidi per via inalatoria, ma un risultato positivo del test non sempre
significa che il paziente soffre di asma. Infatti, l’iperreattività delle
vie aeree è stata descritta anche in pazienti affetti da rinite allergica
e in pazienti con limitazione del flusso d’aria causata da condizioni
diverse dall’asma, quali la fibrosi cistica, le bronchiectasie e la
broncopneumopatia cronica ostruttiva (BPCO).
127
Tavola 4.18Apparato respiratorio
Asma
bronchiale (Seguito)
Indagini da considerare
per la formulazione
di una diagnosi
Radiografia
Lo scopo principale della radiografia è escludere la presenza di altre
patologie e stabilire se il paziente è affetto da polmonite, atelectasia,
pneumotorace, pneumomediastino o bronchiectasie. In caso di
asma lieve, la radiografia toracica non mostra alcuna anomalia. Con
un’ostruzione grave, però, appare ben visibile una caratteristica
ipertrasparenza reversibile del polmone, con allargamento degli
spazi intercostali, abbassamento del diaframma e una maggiore
quantità di aria retrosternale. A differenza dell’enfisema polmonare,
dove la ramificazione vascolare è attenuata e distorta, nell’asma il
calibro dei vasi e la distribuzione vascolare in genere non sono
alterati. L’atelectasia focale, una complicanza dell’asma, è causata da un
tappo di muco. Nei bambini si può osservare persino il collasso
completo di un lobo. Le ombre atelectasiche possono essere temporanee per via dello spostamento del tappo di muco da una zona
all’altra del polmone. Questi quadri si risolvono quando l’espettorato
viene mobilizzato.
La radiografia è utile anche per valutare la coesistenza di sinusite.
Se si sospetta un reflusso gastro-esofageo, posssono essere indicate delle radiografie seriate del tratto gastrointestinale superiore.
Se si sospetta che emboli polmonari simulino un asma potrebbero
essere necessari uno studio scintigrafico di ventilazione-perfusione
del polmone o un’angiografia con TC.
Espettorato
L’espettorato spontaneo così come quello indotto possono essere
utili per confermare la diagnosi di asma e definire il trattamento
(Tavola 4.18). L’espettorato prodotto spontaneamente può essere
mucoide, purulento o una miscela di entrambi. È importante ricordare che l’espettorato purulento non sempre indica la presenza di
un’infezione batterica nei pazienti asmatici.
Le spirali di Curschmann, prodotti bronchiolari sottili a forma di
spirale presenti nell’espettorato e lunghi anche diversi centimetri,
sono fortemente indicativi di asma. Spesso si rilevano anche cellule
128
epiteliali bronchiali cilindriche ciliate, presenti nelle forme gravi di
asma in ammassi definiti corpi di Creola.
In genere, le riacutizzazioni dell’asma sono associate a un aumento del numero di cellule eosinofile o neutrofile nell’espettorato.
Nell’asma, pertanto, l’espettorato può mostrare una maggiore
concentrazione sia di eosinofili sia di neutrofili. Gli infiltrati cellulari
possono essere in prevalenza eosinofili o neutrofili o, talvolta, pauci-
granulocitici. Un’eosinofilia nell’espettorato è importante perché
indica una cura inadeguata a base di corticosteroidi per via inalatoria
oppure una scarsa osservanza di tale trattamento.
Test cutanei
Nei soggetti asmatici è fondamentale determinare la presenza di
atopia, in particolare se gli allergeni ambientali costituiscono un
Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.19
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
importante fattore scatenante dei sintomi asmatici. Tra i test cutanei
è usato prevalentemente il test allergometrico cutaneo (prick test)
che si esegue depositando una goccia di una soluzione contenente
l’allergene in esame sulla pelle dell’avambraccio. Si punge quindi
con una lancetta, attraverso la goccia, la pelle, in modo da far penetrare l’allergene. Di preferenza, i test cutanei vengono eseguiti
praticando una puntura con estratti acquosi di antigeni comuni, ad
esempio muffe, pollini, funghi, polveri domestiche, piume, alimenti
o peli di animali (Tavola 4.19). Se sono presenti anticorpi che
sensibilizzano la pelle agli antigeni si sviluppa, entro 15-30 minuti,
una reazione con ponfo e arrossamento; un test di controllo con
una soluzione salina non dovrebbe mostrare alcuna reazione oppure
solo una minima reazione. In condizioni ottimali, la storia clinica e la reattività dermica forniranno risultati convergenti. Esistono tuttavia pazienti con storie
cliniche positive ma risultati negativi al test cutaneo. In altri soggetti,
invece, la presenza di un’anamnesi negativa e risultati positivi del
test cutaneo sono indice di una reattività immunologica clinicamente
insignificante.
Test ematici
I test ematici in genere sono di scarso valore per la diagnosi dell’asma, tuttavia i test radioallergoassorbenti (RAST) sono utilizzati
per individuare la presenza di allergie ad allergeni specifici. La conta
degli eosinofili nel sangue può risultare aumentata nei pazienti
asmatici ma è priva di sensibilità e di specificità diagnostica.
Ossido di azoto esalato
Nel corretto contesto clinico, livelli elevati di ossido di azoto nell’espirato (eNO) possono indicare un’infiammazione eosinofila associata ad asma; tuttavia ci sono ancora dubbi sull’utilità clinica di
questo test.
Diagnosi differenziale
Nella Tavola 4.20 sono illustrate le malattie che vanno considerate
ai fini di una diagnosi differenziale. Oltre a queste, le patologie che
possono essere erroneamente diagnosticate come asma nel bambino includono: rino-sinusite cronica, reflusso gastro-esofageo, fibrosi cistica, displasia bronco-polmonare, malformazione congenita
responsabile del restringimento delle vie aeree intratoraciche,
aspirazione di corpi estranei, sindrome della discinesia ciliare primaria, immunodeficienza e malattia cardiaca congenita. Nei pazienti
adulti, ai disturbi polmonari menzionati nella Tavola 4.20 si aggiungono: fibrosi cistica, pneumoconiosi e vasculite sistemica con interessamento polmonare. Atlante di Anatomia, Fisiopatologia e Clinica
Anomalie fisiologiche
nell’asma
Spirometria e funzione ventilatoria
nell’asma
Nell’asma, il primo disturbo fisiologico è un’ostruzione del flusso
d’aria che risulta più marcata nell’espirazione. Tale ostruzione ha
una gravità variabile, può interessare siti diversi e per definizione è
in una certa misura reversibile. Questo impedimento del flusso d’aria
è dovuto a varie forme di contrazione della muscolatura liscia, a
infiammazione, edema e ipersecrezione mucosa. Inoltre, bassi volumi polmonari con un collasso degli spazi aerei terminali possono
aggravare l’ostruzione. Nelle vie aeree più grandi, i rigidi anelli di
cartilagine aiutano a mantenere la pervietà. In quelle periferiche,
invece, la resistenza all’azione della muscolatura liscia è scarsa per
via della poca cartilagine presente e la loro pervietà è influenzata
129
Tavola 4.20Apparato respiratorio
Asma
bronchiale (Seguito)
dal volume polmonare in quanto esse sono circondate e parzialmente sostenute dal parenchima polmonare.
Nelle fasi precoci di un attacco asmatico o nei casi lievi, l’ostruzione non è estesa ma la resistenza delle vie aeree aumenta in
misura significativa con il progredire dell’asma. Sebbene aumenti
anche la resistenza inspiratoria, l’anomalia è più accentuata durante
l’espirazione perché le vie aeree si restringono o si chiudono mentre
il polmone si svuota. A questo punto, un ulteriore sforzo espiratorio
non produce alcun aumento nella portata del flusso espiratorio e
rischia persino di intensificare il collasso delle vie aeree.
I muscoli respiratori sono costretti a produrre un’espansione toracica
maggiore a causa delle resistenze meccaniche. Ancor più importante
è il fatto che la retrazione elastica dei polmoni non è sufficiente per
un’espirazione “passiva”. Di conseguenza, i muscoli respiratori devono
assumere un ruolo attivo nell’espirazione. Se l’ostruzione è grave, si
verifica un intrappolamento d’aria con un aumento del volume residuo
(VR) e della capacità funzionale residua (CFR).
L’ostruzione delle vie aeree non è uniforme e pertanto determina
una distribuzione ineguale dei gas negli alveoli. Tale fenomeno,
insieme ad altri stimoli, porta all’insorgenza di tachipnea e a un ciclo
respiratorio conseguentemente ridotto, nonostante l’ostruzione
bronchiale richieda un tempo respiratorio più lungo per una ventilazione adeguata. Mentre l’attacco asmatico è in corso, è impossibile
conciliare queste richieste contrastanti.
La gravità dell’ostruzione è testimoniata dalle misurazioni spirometriche dei volumi espiratori e dei flussi. Durante un attacco acuto,
il VEMS, la CVF e la capacità inspiratoria (CI) sono tutti ridotti.
Le vie aeree periferiche hanno un’area trasversale totale proporzionatamente grande, ragione per cui la loro resistenza contribuisce
in genere alla resistenza complessiva delle vie aeree solo nella
misura del 20%. Di conseguenza, un’ostruzione estesa in queste
vie aeree più piccole potrebbe anche non essere rilevata se il medico
si basa solo sui dati clinici. La riduzione della CVF e del VEMS mostra
una buona correlazione con il calo della PaO2, mentre la ritenzione
di anidride carbonica non si verifica finché il VEMS è pari a 1 L circa
o al 25% del predetto.
Con il progredire dell’ostruzione l’espirazione si fa sempre più
prolungata. Si verificano aumenti del VR e della CFR (Tavola 4.39),
variazioni di volume che possono rappresentare una risposta fisiologica da parte del paziente perché respirare a volumi polmonari
130
più alti previene la chiusura delle piccole vie aeree. L’effetto generale
di questi eventi è un’iperinflazione alveolare che tende ad aumentare
ulteriormente il diametro delle vie aeree esercitando una forza laterale maggiore sulle loro pareti. Questa iperinflazione può preservare in parte lo scambio gassoso, tuttavia è svantaggiosa perché
richiede molto più lavoro, che si traduce in un maggiore consumo
di O2. Inoltre, un simile stato compromette la CI e la capacità vitale
(CV). Sempre per effetto di tale processo, possono anche comparire
sintomi di dispnea e affaticamento. L’efficacia della tosse ne risulta
infine compromessa perché la velocità del flusso d’aria attraverso
le vie aeree è sensibilmente ridotta.
In seguito a un’ostruzione non omogenea delle vie aeree nell’asma, la distribuzione dell’aria inspirata alle unità respiratorie
terminali non è uniforme all’interno del polmone. Alveoli ipoventilati
perché alimentati da vie aeree ostruite si alternano ad alveoli normali
o iperventilati; quindi, la gravità dell’asma è direttamente collegata
Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.21
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
al rapporto tra i gruppi alveolari scarsamente ventilati e quelli ben
ventilati. L’ipossiemia arteriosa, che nell’asma è il principale difetto
degli scambi gassosi, è dovuta a questa non omogeneità del rapporto V̇a /Q̇c (Tavola 4.21). A mano a mano che il numero di unità
alveolari con un basso rapporto V̇a/Q̇ c aumenta (in seguito all’avanzamento dell’ostruzione), anche il grado di ipossiemia arteriosa si
intensifica. Il rapporto V̇a/Q̇c si altera ulteriormente se qualche via
aerea è del tutto ostruita. L’effetto dello shunt intrapolmonare destro-sinistro si traduce in un’ipossiemia arteriosa. Quando il numero delle unità alveolo-capillari con rapporto V̇a/Q̇c
normale rimane elevato rispetto al numero di quelle con rapporto
V̇a/Q̇ c basso il processo di eliminazione dell’anidride carbonica non
è compromesso. Con il progredire dell’ostruzione delle vie aeree,
tuttavia, gli alveoli ipoventilati si fanno sempre più numerosi. In
contemporanea si verifica un aumento corrispondente nel lavoro,
nella velocità e nella profondità di respirazione. Una simile risposta
inizialmente minimizza l’aumento dello spazio morto fisiologico ma
è destinata a diventare inadeguata e alla fine la ventilazione alveolare non riuscirà più a soddisfare le esigenze metaboliche dell’organismo. A questo punto si verificherà una ritenzione di anidride
carbonica insieme a una maggiore ipossiemia, uno stato di insufficienza ventilatoria che in genere si manifesta quando il VEMS è
inferiore al 25% del predetto.
Patogenesi dell’asma
Genetica
Fattori genetici e ambientali interagiscono in modo complesso per
produrre suscettibilità ed espressione dell’asma. Diversi geni presenti sul cromosoma 5q31-33 possono contribuire in maniera
importante allo sviluppo o alla progressione dell’infiammazione
associata ad asma e atopia, incluse le citochine interleuchina-3
(IL-3), IL-4, IL-5, IL-9, IL-12, IL-13 e il fattore stimolante la crescita
delle colonie di granulociti-macrofagi (GM-CSF), e molti altri geni
possono ricoprire un ruolo nello sviluppo dell’asma o nella sua
patogenesi, inclusi il recettore per i corticosteroidi e il recettore
b2-adrenergico. Il cromosoma 5q32 contiene il gene per il b2adrenocettore, altamente polimorfo, e sono state scoperte alcune
varianti di questo gene capaci di alterare il meccanismo di funzionamento e risposta del recettore ai b-agonisti.
Altre regioni cromosomiche collegate allo sviluppo di allergia o
asma includono il cromosoma 11q, che contiene il gene per la
Atlante di Anatomia, Fisiopatologia e Clinica
catena b del recettore per IgE ad alta affinità (FcεRIb). Anche il
cromosoma 12 include svariati geni candidati, tra cui l’interferone-g
(IFN-g), il fattore delle cellule staminali (SCF), l’IGF-1 e la forma
costitutiva della NO-sintasi (cNOS). Significativa è l’associazione tra
l’asma e il gene ADAM 33 (una disintegrina e metalloproteinasi 33)
presente sul cromosoma 20p13. Le proteine ADAM sono enzimi
proteolitici legati alla membrana. L’espressione di ADAM 33 limitata
alle cellule mesenchimali e la sua stretta associazione con l’iperreattività delle vie aeree lasciano supporre un suo coinvolgimento nelle
attività della muscolatura liscia delle vie aeree o in eventi correlati
al loro rimodellamento.
Infiammazione cellulare
Un’infiammazione persistente delle vie aeree è considerata l’aspetto
caratteristico dell’asma grave, lieve e persino di quello asintomatico.
Gli altri elementi distintivi comprendono l’infiltrazione delle vie aeree
a opera di cellule infiammatorie, l’ipertrofia della muscolatura liscia
delle vie aeree e l’ispessimento della lamina reticolare appena al di
sotto della membrana basale (Tavola 4.22). Una caratteristica importante dell’infiltrazione infiammatoria delle
vie aeree nell’asma è la sua natura multicellulare: benché si noti una
prevalenza di eosinofili, sono infatti presenti anche neutrofili, linfociti
e altre cellule in percentuali variabili. A differenza dei neutrofili, degli
131
Tavola 4.22Apparato respiratorio
Asma
bronchiale (Seguito)
eosinofili e dei linfociti T, che sono cellule circolanti, i mastociti risiedono nelle vie aeree. Un’evidenza istologica di degranulazione dei
mastociti e vacuolizzazione degli eosinofili rivela l’attivazione delle
cellule infiammatorie. I mastociti mucosi non aumentano, ma nei
pazienti asmatici mostrano segni di secrezione granulare. Esami
autoptici hanno evidenziato una riduzione apparente del numero di
mastociti nei bronchi asmatici così come nel parenchima polmonare,
il che confermerebbe la degranulazione dei mastociti piuttosto che
un’effettiva riduzione del loro numero.
Si ritiene che gli eosinofili siano le cellule predominanti e più
caratteristiche dell’asma, come osservato mediante lavaggio bronco-alveolare (BAL) e studi bioptici dei bronchi. L’epitelio bronchiale
mostra infiltrazione eosinofila, evidente sia nelle grandi sia nelle
piccole vie aeree, con una maggiore intensità nelle vie prossimali
nei casi di asma grave acuto. Alcuni studi tuttavia rivelano l’assenza
pressoché totale di eosinofili nell’asma grave o letale, suggerendo
così una certa eterogeneità in questo processo. I macrofagi alveolari
sono le cellule più comuni nei polmoni umani, sia in soggetti normali
sia in pazienti asmatici e, una volta attivati, secernono un’ampia
gamma di mediatori. I linfociti sono molto importanti per lo sviluppo
dell’asma e la loro attività nelle vie aeree di individui asmatici è
correlata alla gravità della malattia. La funzione e il contributo dei
linfociti nell’asma sono multifattoriali e dipendono dalla loro capacità
di secernere citochine. Le cellule T attivate sono fonte di citochine
Th2 (ad es. IL-4 e IL-13), in grado di indurre la cellula B attivata a
produrre IgE e accrescere l’espressione delle molecole di adesione
cellulare, in particolare la molecola-1 di adesione cellulare vascolare
(VCAM-1) e la IL-5, fondamentale per lo sviluppo e la sopravvivenza
degli eosinofili nei tessuti.
Anomalie immunologiche
L’asma allergico e altre malattie allergiche come la rinite allergica
e l’anafilassi si sviluppano in seguito alla sensibilizzazione ad allergeni ambientali e alle successive risposte immuno-mediate quando
si entra in contatto con gli allergeni. Tali reazioni allergiche avvengono in organi bersaglio specifici come, ad esempio, i polmoni,
l’apparato gastrointestinale o la cute. Questi processi immunologici
132
che portano alle reazioni allergiche rappresentano lo stato patologico
definito clinicamente “atopia”. La sequenza immunologica consiste
in una fase di sensibilizzazione seguita da una reazione allo stimolo
che produce poi la corrispondente sindrome clinica (Tavola 4.23). La sensibilizzazione a un allergene avviene quando si incontra
per la prima volta un allergene altrimenti innocuo. Le cellule specializzate nella presentazione dell’antigene (APC) come i monociti,
i macrofagi e le cellule dendritiche immature catturano l’antigene
e lo degradano in peptidi immunogenici corti. I frammenti antigenici
scissi vengono presentati alle cellule T helper (Th) CD4+ naïve su
molecole MHC di classe II. In funzione di una moltitudine di fattori,
in particolare il microambiente delle citochine, queste cellule T
helper naïve vengono poi indirizzate a linfociti Th1 o Th2. I linfociti
Th1 secernono prevalentemente IL-2, IFN-g e il fattore di necrosi
tumorale TNF-b per indurre una risposta immunitaria cellulare. Al
contrario, i linfociti Th2 secernono le citochine IL-4, IL-5, IL-9 e
Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.23
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
IL-13 per indurre una risposta immunitaria umorale; in particolare,
la classe delle cellule B comincia a produrre immunoglobuline E
(IgE) specifiche per l’antigene. Nell’asma allergico esiste uno squilibrio tra linfociti Th1 e Th2 con uno spostamento dell’immunità da
un profilo Th1 verso un profilo Th2. Per questo motivo, l’asma allergico spesso viene definito anche come un disturbo Th2-mediato
con una risposta immunitaria persistente agli allergeni inalati deviata
verso Th2 (Tavola 4.23).
L’IgE è una g-l-glicoproteina e nei soggetti normali è l’anticorpo
meno abbondante, con una concentrazione sierica pari a 150 ng/mL
rispetto ai 10 mg/mL dell’IgG. Nelle persone “atopiche”, tuttavia, le
concentrazioni di IgE in circolazione possono superare di oltre
10 volte il livello normale. I livelli di IgE aumentano anche in pazienti
con parassitosi e con sindrome da iper-IgE. L’aumento della concentrazione sierica non è necessariamente un segnale specifico dell’entità o della gravità di un’allergia. Le molecole dell’IgE si legano
alla superficie dei mastociti o di altre cellule come i basofili. I mastociti che contengono IgE sono distribuiti nella mucosa delle vie
aeree superiori e inferiori e nei tessuti connettivi perivascolari del
polmone.
Una volta avvenuta la sensibilizzazione a un allergene, una nuova
esposizione del paziente a quello stesso allergene può provocare
una reazione allergica acuta, conosciuta anche come reazione da
ipersensibilità immediata (Tavola 4.23). A contatto con l’antigene
specifico, i mastociti sensibilizzati all’IgE secernono mediatori preformati e mediatori sintetizzati ex novo, tra cui istamina, cisteinil
leucotrieni, chinine, prostaglandine, trombossani e fattore di attivazione delle piastrine. I mastociti sono inoltre fonte di citochine
proinfiammatorie. Ogni molecola di antigene deve congiungere
almeno due delle molecole di IgE legate alla superficie della cellula.
Seguono una contrazione della muscolatura liscia delle vie aeree,
vasocostrizione e ipersecrezione di muco insieme a una risposta
infiammatoria caratterizzata da maggiore permeabilità capillare e
infiltrazione cellulare con eosinofili e neutrofili, che producono così
i sintomi dell’asma.
Modificazioni patologiche
nell’asma
Le prime informazioni sulla patologia asmatica sono state raccolte
attraverso esami autoptici su persone decedute per asma o sulle
Atlante di Anatomia, Fisiopatologia e Clinica
vie aeree di pazienti asmatici morti per altre cause o sottoposti a
resezioni polmonari. Tutti i dati a disposizione indicavano modificazioni patologiche simili ma di gravità variabile e fornivano indicazioni
per individuare le cause e le conseguenze delle reazioni infiammatorie nelle vie aeree (Tavola 4.24). I caratteristici tappi mucosi possono causare un’ostruzione nelle
vie aeree dei soggetti asmatici, portando a un’alterazione del
rapporto ventilazione-perfusione, e contribuire così ­all’ipossiemia.
I tappi mucosi sono composti da muco, proteine sieriche, cellule
infiammatorie e frammenti cellulari che includono cellule epiteliali
desquamate e macrofagi spesso disposti secondo uno schema a
spirale (spirali di Curschmann). La produzione eccessiva di muco
negli episodi letali di asma è riconducibile all’ipertrofia e all’iperplasia delle ghiandole sottomucose. Il muco contiene anche elevate
quantità di acidi nucleici, glicoproteine e albumina che lo rendono
ancora più viscoso. Questa reologia mucosa ­alterata, accompagnata
133
Tavola 4.24Apparato respiratorio
Asma
bronchiale (Seguito)
dalla perdita di epitelio ciliato, pregiudica la clearance mucociliare.
Nell’asma, le pareti delle vie aeree si ispessiscono in misura crescente in funzione della gravità della malattia. Rispetto a quanto osservato nei soggetti non asmatici, lo spessore delle pareti delle vie
aeree aumenta dal 50 al 300% nei pazienti con una forma letale di
asma e dal 10 al 100% in pazienti con una forma non letale di asma.
L’aumento di spessore è determinato da un incremento della maggior
parte dei compartimenti tissutali, tra cui muscolatura liscia, epitelio,
sottomucosa, avventizia e ghiandole mucose. L’edema infiammatorio
coinvolge l’intera via aerea, in particolare lo strato sottomucoso con
ipertrofia e iperplasia marcate delle ghiandole sottomucose e iperplasia delle cellule caliciformi. L’iperplasia e l’ipertrofia delle cellule
caliciformi sono associate alla perdita di cellule epiteliali. Si osserva
inoltre un’iperplasia dello strato muscolare e una vasodilatazione
microvascolare negli strati avventizi delle vie aeree. Studi morfometrici
hanno inoltre dimostrato che la lamina propria bronchiale dei soggetti
asmatici ha un numero superiore di vasi che occupano un’area
percentualmente più grande rispetto ai soggetti non asmatici e in
alcune circostanze ciò è correlato alla gravità della malattia.
Trattamento a lungo termine
dell’asma
Le linee guida relative al trattamento dell’asma sono molto coerenti
nell’individuarne obiettivi e finalità. Il trattamento serve a (1) ridurre
al minimo o eliminare i sintomi dell’asma, (2) ottenere la migliore
funzionalità polmonare possibile, (3) prevenire le riacutizzazioni
dell’asma, (4) perseguire gli obiettivi appena elencati usando il minor
numero possibile di farmaci, (5) limitare il più possibile gli effetti
negativi a lungo e breve termine e, infine, (6) informare il paziente in
modo adeguato sulla malattia e sugli scopi della cura. Un altro
obiettivo importante consiste nel prevenire il declino della funzionalità
polmonare e lo sviluppo di ostruzioni fisse delle vie aeree, eventi che si
manifestano in alcuni pazienti asmatici. Oltre agli obiettivi e alle finalità, le linee guida descrivono cosa si intende con l’espressione
controllo dell’asma. Il controllo dell’asma ovviamente comprende gli
obiettivi appena elencati ma si prefigge anche di ridurre il ricorso ai
farmaci salvavita, come i b2-agonisti per via inalatoria, a meno di
una somministrazione giornaliera, ridurre al minimo la variabilità dei
flussi che è tipica dell’asma e consentire lo svolgimento delle normali
attività quotidiane. Raggiungere questo livello di controllo dell’asma
dovrebbe essere lo scopo sin dalla primissima visita del paziente dal
medico curante. Il trattamento farmacologico dei pazienti asmatici
134
deve essere preso in considerazione solo nel contesto di un programma di formazione sulla malattia in cui si insegni a evitare i fattori
che inducono l’asma (Tavola 4.25). Asma lieve persistente
La somministrazione di bassi dosaggi di corticosteroidi per via
inalatoria (ICS) spesso è in grado di offrire il controllo ideale del-
l’asma e ridurre il rischio di gravi riacutizzazioni sia nei bambini sia
negli adulti con asma lieve persistente, e dovrebbe essere la cura
preferenziale. Gli ICS sono i farmaci antinfiammatori più efficaci per
il trattamento di tale condizione. Nella Tavola 4.26 sono illustrati i
meccanismi di azione dei vari rimedi per l’asma. Non esistono prove
convincenti del fatto che l’uso regolare di una terapia combinata di
ICS e b2-agonisti a lunga durata d’azione (LABA) per via inalatoria
Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.25
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
offra benefici aggiuntivi. Un altro trattamento possibile è costituito
dagli antagonisti dei recettori dei leucotrieni (LTRA), che però sono
meno efficaci degli ICS somministrati a basse dosi. Per qualsiasi
forma di terapia sussistono differenze interindividuali e intraindividuali anche significative nelle risposte e lo stesso discorso vale per
il trattamento con ICS e LTRA negli adulti e nei bambini. Generalmente gli ICS forniscono risultati migliori degli LTRA in quasi tutti i
pazienti asmatici. Alcuni soggetti possono mostrare una risposta
maggiore agli LTRA, ma al momento è impossibile identificare in
modo accurato questi responder sulla base delle loro caratteristiche
cliniche, fisiologiche o farmaco-genomiche. Il rischio di effetti collaterali è un altro problema che bisogna
valutare quando si decide di sottoporre i pazienti affetti da asma
lieve a un trattamento con ICS. Gli ICS non vengono metabolizzati
a livello polmonare e ogni molecola di ICS somministrata nei polmoni
viene poi assorbita nella circolazione sistemica. Tutti gli studi condotti su pazienti con asma lieve persistente hanno utilizzato ICS a
bassi dosaggi (dosi massime: 400 mg/die) e sono parecchi i dati
disponibili che provano la sicurezza di queste basse dosi negli adulti,
anche se somministrate per lungo tempo. Nei bambini, tuttavia, è
stato dimostrato un sensibile rallentamento nella velocità di crescita
con bassi dosaggi di ICS, sebbene sia improbabile che ciò possa
influire sull’altezza finale di questi pazienti visto che l’unico studio
che ha monitorato i bambini trattati con ICS fino al raggiungimento della loro altezza massima non ha rilevato alcun effetto
dannoso nemmeno con dosi giornaliere moderate di ICS.
Asma moderato persistente
I pazienti affetti da asma moderato persistente soffrono di una
forma d’asma che non si riesce a controllare efficacemente con
bassi dosaggi di ICS. Per questi soggetti, le linee guida sul trattamento dell’asma consigliano come opzione preferita la terapia
combinata con ICS e un LABA poiché è stato dimostrato che, rispetto a un trattamento con soli ICS, nell’asma moderato persistente questo tipo di cura migliora anche tutti gli indicatori del
controllo asmatico. È importante sottolineare che i maggiori benefici
associati alla terapia combinata con ICS e LABA nell’asma moderato persistente sono stati dimostrati soprattutto negli adulti
asmatici. La terapia di combinazione ICS + LABA (ad es. beclometasone dipropionato + formoterolo, budesonide + formoterolo,
fluticasone propionato + salmeterolo) è indicata nel trattamento
regolare dell’asma quando l’uso di un prodotto di associazione
(corticosteroide per via inalatoria e LABA) è appropriato: pazienti
non adeguatamente controllati con corticosteroidi per via inalatoria
e b2-agonisti per via inalatoria a breve durata d’azione usati al bisogno oppure pazienti che sono già adeguatamente controllati sia
con corticosteroidi per via inalatoria sia con b2-agonisti a lunga
durata d’azione. La terapia di combinazione ICS + LABA non è
indicata per il trattamento degli attacchi acuti e per il trattamento
iniziale dell’asma. Se un paziente dovesse avere bisogno di una
Atlante di Anatomia, Fisiopatologia e Clinica
combinazione di dosi diverse da quelle disponibili con l’associazione fissa, si devono prescrivere le dosi appropriate di b2-agonisti
e/o corticosteroidi in inalatori separati.
Diversi studi hanno messo a confronto il beneficio clinico che si
ottiene in pazienti adulti e bambini con asma moderato persistente
quando agli ICS si aggiungono anche gli LTRA. Rispetto a una terapia
a base di soli ICS, l’aggiunta di LTRA agli ICS può migliorare in
misura limitata il controllo dell’asma, tuttavia non si può consigliare
questa strategia come sostituto all’aumento della dose di ICS.
Inoltre, gli LTRA si sono dimostrati meno efficaci dei LABA quando
combinati con gli ICS. Anche la teofillina in dosi ridotte è stata valutata come terapia addizionale agli ICS, ma il beneficio ottenuto è
meno significativo di quello dei LABA. Un’altra possibile opzione
terapeutica per i pazienti con asma moderato è l’omalizumab, un
anticorpo monoclonale umanizzato ricombinante che agisce contro
l’IgE. Questo anticorpo dell’IgE forma complessi con l’IgE libera,
135
Tavola 4.26Apparato respiratorio
Asma
bronchiale (Seguito)
bloccando così l’interazione tra l’IgE stessa e le cellule effettrici e
riducendo le concentrazioni sieriche dell’IgE libera. A differenza del
placebo, in pazienti cui vengono somministrate dosi da moderate
ad alte di ICS, omalizumab riduce le riacutizzazioni asmatiche e
consente una piccola ma statisticamente significativa riduzione della
dose di ICS. Questo trattamento non è stato messo a confronto con
terapie addizionali comprovate come i LABA, molto meno costose.
L’omalizumab è indicato,come terapia aggiuntiva, per la cura dell’asma allergico grave persistente e non è indicato per il trattamento
delle riacutizzazioni asmatiche acute, broncospasmo acuto o stato
asmatico. La terapia con omalizumab può durare al massimo
12 mesi in regime controllato e registrato e deve essere iniziata da
medici specialisti esperti nella diagnosi e nel trattamento di asma
grave.
Asma grave persistente
I pazienti con asma grave sono quelli che non rispondono in maniera
adeguata nemmeno ad alti dosaggi di ICS e ai LABA. Questo gruppo
consuma le risorse sanitarie destinate alla patologia asmatica in
misura sproporzionata. Dal punto di vista fisiologico, mostrano spesso
intrappolamento d’aria, collasso delle vie aeree e un elevato grado
di iperreattività bronchiale. Si tratta di soggetti con sintomi giornalieri,
riacutizzazioni frequenti, limitazione delle attività fisiche e frequenti
sintomi di asma notturno. Quasi sempre i pazienti con asma difficilmente trattabile sono persone adulte con comorbilità importanti, tra
cui grave rino-sinusite, reflusso gastro-esofageo, obesità e disturbi
ansiogeni. Nel tentativo di pervenire a un controllo dell’asma, questi
soggetti devono spesso ricorrere a corticosteroidi orali oltre ad alte
dosi di ICS e all’uso di b2-agonisti a lunga durata d’azione
Trattamento delle riacutizzazioni
asmatiche gravi
Gli episodi di asma grave acuto (riacutizzazioni asmatiche) sono
caratterizzati da aumento progressivo del respiro corto, tosse, sibilo
respiratorio e costrizione toracica oppure una combinazione di questi
sintomi e sono caratterizzati da un’ostruzione delle vie aeree quantificabile misurando il PEF o il VEMS. Queste misurazioni sono indicatori della gravità dell’ostruzione più affidabili rispetto al grado dei
sintomi. Le riacutizzazioni gravi sono potenzialmente letali e la loro
cura richiede una supervisione molto attenta: alla loro insorgenza,
i pazienti dovrebbero rivolgersi subito al proprio medico curante
136
oppure recarsi nell’ospedale più vicino in grado di offrire un trattamento di emergenza ai soggetti con asma acuto. Un attento monitoraggio obiettivo della risposta alla terapia è fondamentale.
Tra le più importanti terapie per le riacutizzazioni asmatiche gravi
vi è la somministrazione ripetuta di b2-agonisti a breve durata
d’azione per via inalatoria, assunti in 2-4 inalazioni ogni 20 minuti
per la prima ora (Tavola 4.27). Trascorsa la prima ora, la dose di
b2-agonisti necessaria dipende dalla gravità della riacutizzazione e
dalla risposta ai b2-agonisti precedentemente somministrati per via
inalatoria. Una combinazione di b2-agonista (salbutamolo) per via
inalatoria e anticolinergico (ipratropio bromuro) potrebbe produrre
una broncodilatazione migliore rispetto ai due farmaci assunti singolarmente. L’ossigeno andrebbe somministrato attraverso una
cannula nasale o una maschera e titolato rispetto alla pulsossimetria
in modo da mantenere una saturazione soddisfacente dell’ossigeno
pari o superiore al 90% (≥95% nei bambini). Atlante di Anatomia, Fisiopatologia e Clinica
Tavola 4.27
Asma
Malattie e anatomia patologica
bronchiale (Seguito)
I glucocorticoidi sistemici accelerano la risoluzione delle riacutizzazioni e dovrebbero essere adoperati in tutte le forme di riacutizzazioni tranne quelle più lievi, soprattutto se la terapia iniziale a base
di b2-agonisti a breve durata d’azione per via inalatoria non aiuta a
ottenere un miglioramento duraturo. In genere i glucocorticoidi orali
hanno un’efficacia pari a quelli somministrati per via endovenosa.
Gli scopi della terapia sono alleviare l’ostruzione delle vie aeree e
l’ipossiemia il più velocemente possibile e pianificare la prevenzione
di future recidive. Durante le riacutizzazioni asmatiche bisogna assolutamente evitare la sedazione per via dell’effetto depressivo sulla
respirazione prodotto dagli ansiolitici e dai farmaci ipnotici.
I pazienti che rischiano seriamente di morire a causa dell’asma
devono cercare urgentemente assistenza sanitaria appena ha inizio
la riacutizzazione. Rientrano in questo gruppo i pazienti con una
storia precedente di asma quasi letale che abbia richiesto intubazione e ventilazione meccanica, i pazienti con storia di ricovero
ospedaliero o visita d’urgenza per asma nell’anno precedente, quelli
che usano oppure hanno smesso di recente di usare glucocorticosteroidi orali, i soggetti con un’iperdipendenza da b2-agonisti a
breve durata d’azione per via inalatoria, con una storia di malattia
psichiatrica o problemi psico-sociali e quelli con una storia di
mancata compliance al piano terapeutico per l’asma.
La risposta al trattamento può richiedere tempo e i pazienti devono essere monitorati con attenzione attraverso misurazioni cliniche
e oggettive. Un trattamento sostenuto deve continuare fino a quando
le misurazioni relative alla funzionalità polmonare non tornano al
loro precedente migliore livello o fino a quando non si verifica un
assestamento nella risposta ai b2-agonisti per via inalatoria; a
questo punto si può decidere se prescrivere il ricovero o autorizzare
la dimissione. I pazienti che possono essere dimessi tranquillamente
sono quelli che rispondono entro le prime due ore, un lasso di tempo
sufficiente per prendere una decisione riguardo alla loro destinazione. In genere, i pazienti con un VEMS pretrattamento o un picco
di flusso espiratorio (PEF) <25% del predetto o quelli con un vems
post-trattamento o un PEF <40% del predetto devono essere generalmente ricoverati in ospedale. Spesso, i soggetti con una funzionalità polmonare post-trattamento compresa tra il 40 e il 60%
del predetto possono essere dimessi dal reparto di pronto soccorso
purché nelle vicinanze di casa ci sia l’opportunità di un follow-up
adeguato e la loro compliance al trattamento sia garantita.
Atlante di Anatomia, Fisiopatologia e Clinica
Ai pazienti dimessi dal reparto di pronto soccorso deve essere
prescritta una cura con glucocorticosteroidi orali di almeno sette
giorni per gli adulti e più breve (3-5 giorni) per i bambini, associata
a terapia broncodilatatrice. Il broncodilatatore può essere utilizzato
al bisogno, tenendo conto del miglioramento sintomatico e oggettivo. I pazienti devono iniziare o continuare la terapia con glucocorticosteroidi per via inalatoria. Bisognerà inoltre esaminare in-
sieme al paziente la tecnica giusta per l’utilizzo dell’inalatore e
del misuratore del picco di flusso per monitorare la terapia domiciliare. Occorre individuare i fattori che hanno precipitato la riacutizzazione, nonché definire le strategie per evitarne future recidive. Infine, si deve valutare la risposta del paziente alla riacutizzazione, preparare un piano d’intervento per l’asma e fornire una
guida scritta.
137