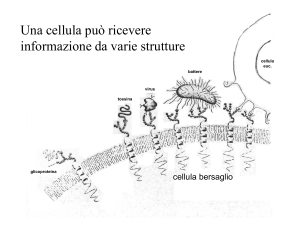
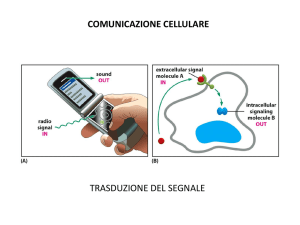
Nessuna cellula vive isolata. Una complessa rete di comunicazione tra cellule regola crescita, maturazione,
differenziamento, metabolismo, omeostasi di cellule che compongono tessuti ed organi. Le cellule bersaglio sono a
volte cellule che producono altri ormoni. I recettori ormonali svolgono un ruolo essenziale nel mediare l'azione degli
ormoni. L'azione degli ormoni é determinata da differenti meccanismi intracellulari. Gran parte del controllo della
secrezione di ormoni dipende da meccanismi a feedback. Esiste una stretta relazione tra l'attività del sistema nervoso
centrale e la secrezione di ormoni. La fluorescenza citoplasmatica mostra il passaggio di un'onda di concentrazione
elevata di calcio (Ca) attraverso un campo di astrociti. Quando colture confluenti di astrociti ippocampali sono
stimolate dal neurotrasmettitore glutammato, ne risulta tra l'altro un aumento delCa libero citoplasmatico, aumento che
ha andamento oscillatorio; infatti può prendere la forma di onde di incremento di Ca che si propagano tra le cellule a
20 m/s. I cambiamenti della concentrazione di Ca, misurati con l'indicatore di fluorescenza fluo-3, sono campionati a
intervalli di 4 s. Le aree che superano un determinato valore-soglia di incremento in un dato tempo assumono un dato
colore convenzionalf!, che si sovrappone all'immagine data dalla fluorescenza citoplasmatica di base. Ogni
campionamento di 4 s corrisponde a un colore diverso, codificato in una sequenza temporale. Si può osservare un'onda
che origina dall'area viola a sinistra del centro, si allarga verso il centro del campo in un'area azzurra e poi si irradia
verso l'alto attraverso archi verdi, giallo, arancio e rosso. (Per gentileconcessione di Steohen Smith.)
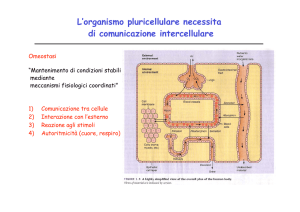
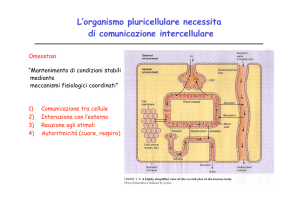
Relazioni tra sistema nervoso e sistema endocrino :1) entrambi sono dei sistemi di segnalazione; 2) operano
secondo uno schema stimolo-risposta; 3) trasmettono segnali in alcuni casi precisi e localizzati in altri grossolani e
disomogenei; 4) entrambi i sistemi sono cruciali affinché cellule altamente differenziate, tessuti e vari organi che
costituiscono l'organismo possano funzionare in maniera coordinata.
1
2
3
4
5
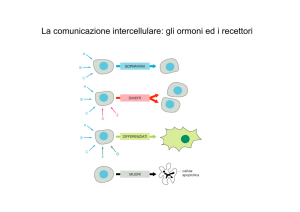
La > parte delle molecole che inducono cambiamenti rapidi dell’attività cellulare sono idrosolubili e si legano a
recettori localizzati a livello della membrana plasmatica. Altre molecole segnale alterano principalmente le modalità di
espressione genica e sono generalmente liposolubili; esse inducono risposte più lente e più durature rispetto a quelle
indotte da segnali idrosolubili. Uno degli esempi più noti di questa classe sono gli ormoni steroidei.
I recettori proteici si trovano sulla superficie, nel citosol, nel nucleo delle cellule bersaglio. Esse sono dotate di un
sito di legame ad alta affinità per un ormone, neurotrasmettitore, etc. Quando si ha il legame ligando-recettore si avvia
una serie di reazioni che altera il funzionamento della cellula. Una cellula può avere più tipi di recettori; tipi di cellule
diverse possono avere diversi recettori per lo stesso ligando che suscita risposte diverse; lo stesso recettore può essere
presente in tipi di cellule diverse suscitando risposte diverse (es. recettori per acetilcolina su muscolo scheletrico e
cellule miocardiche).
In alcune cellule diversi complessi ormono-recettore inducono una risposta cellulare analoga. Es. in epatociti il
glucagone e adrenalina legandosi ai propri recettori inducono degradazione di glicogeno e rilascio di glucosio nel
sangue.
L’unica funzione del ligando è quella di legarsi al recettore in quanto non viene metabolizzato per formare prodotti
utili, non è intermedio di attività cellulari e non ha proprietà enzimatiche. Le cellule bersaglio spesso modificano o
degradano il ligando e così facendo modificano o pongono fine alla risposta. Si possono classificare gli ormoni in 3
ampie categorie: 1) piccole molecole lipofile che diffondono attraverso la membrana plasmatica e interagiscono con
recettori presenti nel citosol e nel nucleo; 2) molecole idrofiliche che si legano a recettori sulla superficie cellulare; 3)
molecole lipofile che si legano a recettori della membrana plasmatica.
La > parte degli ormoni lipofilici interagisce con recettori citosolici o nucleari e altera l’espressione genica. I
rappresentanti più importanti che interagiscono con recettori intracellulari sono: steroidi; tiroxina e acido retinoico.
6
7
8
Le prostaglandine sono sostanze lipidiche, prodotte nella > parte dell’organismo che si legano a recettori
posti sulla superficie della cellula. Contengono un anello di ciclo-pentano e sono sintetizzate a partire
dall’acido arachidonico (ac grasso 20 atomi di carbonio). Esistono almeno 16 diverse prostaglandine
appartenenti a 9 classi chimiche diverse denominate PGA, PGB, …., PGL. Sono sintetizzate e secrete di
continuo e rapidamente degradate. Fungono da segnali paracrini. Mediano risposta di altri ormoni. Es:
aggregazione piastrine e adesione; ruolo fondamentale nella coagulazione del sangue. Aspirina altri
agenti ne inibiscono la sintesi. Contrazione della muscolatura liscia etc..
9
10
11
12
13
14
15
16
17
18
19
20
Risposte che durano secondi o minuti sono tipiche di ormoni peptidici o di catecolamine. Le cellule secretorie sono
dotate di depositi. Ormoni peptidici come insulina e adrenocorticotropo sono secreti come peptidi più lunghi scisse poi
da proteasi specifiche. Gli ormoni peptidici sopravvivono nel sangue solo pochi minuti o secondi prima di essere
degradati da proteasi ematiche o tissutali. Le catecolamine vengono inattivate o internalizzate da cellule specifiche.
Effetti su enzimi specifici sono anch’essi abbastanza brevi. L’ormone tireostimolante determina endocitosi della
tireoglobulina e sua proteolisi a tiroxina. Gli steroidi derivano dal colesterolo. Le cellule che producono steroidi hanno
riserve sufficienti solo per poche ore.
Sintesi, liberazione e degradazione degli ormoni sono soggetti a regolazione. I livelli ormonali sono regolati da
complessi circuiti di feedback. Ad esempio i livelli di estrogeni e progesterone nel sangue della femmina dei
mammiferi. L'ormone ipofisario FSH induce il follicolo ovarico che si sta sviluppando a crescere e a secernere
estrogeni, che stimolano la crescita dell'endometrio uterino. Gli estrogeni agiscono anche sull'ipotalamo per inibire la
secrezione del fattore di rilascio del FSH(FSHRH) e direttamente sull'adenoipofisi per ridurre la secrezione di FSH,
abbassando cosi la produzione di estrogeni (feedback negativo). Con l'avvicinarsi del follicolo alla maturazione,
diminuisce la produzione di FSH. L'ipotalamo libera l'ormone di rilascio dell'ormone luteinizzante (LHRH). Esso
induce l'adenoipofisi a secernere LH, che porta a completamento la maturazione del follicolo e dell'oocita.ll follicolo
maturo libera l'oocita nell'ovidotto e viene trasformato in una ghiandola endocrina temporanea, il corpo luteo. Sotto la
continua stimolazione del LH, il corpo luteo produce progesterone che, a sua volta, determina l'ulteriore accrescimento
della parete uterina, preparandola a ricevere un embrione. Se si verificano la fecondazione e l'impianto, i tessuti
placentali producono la gonadotropina corionica, (CG), un ormone peptidico la cui struttura e funzione sono simili a
quelle del LH. La gonadotropina corionica impedisce che il corpo luteo degeneri; in particolare, mantiene la sintesi
continua di progesterone (feed-back positivo). Il progesterone, a sua volta, mantiene le cellule dell'endometrio, che
riveste la cavità uterina, e si forma un buon sistema di irrorazione sanguigna per nutrire l'embrione impiantato.
21
22
23
24
Dopo aver attraversato la membrana plasmatica gli steroidi interagiscono con i recettori proteici situati
nel nucleo o nel citosol e vanno così a formare complessi che si accumulano nel nucleo; qui si legano a
sequenze di DNA specifiche con funzione di regolazione e fanno aumentare o diminuire il tasso di
trascrizione dei geni adiacenti. Tali complessi possono anche influire sulla stabilità di specifici mRNA.
Sono efficaci per tempi relativamente lunghi (ore o giorni). Spesso influenzano la crescita o il
differenziamento di tessuti specifici.
Ormoni proteici e catecolammine interagiscono con recettori di superficie. Questa categoria comprende
grandi polipeptidi, come l’insulina, il GH ed il glucagone e le catecolamine. Gli effetti di tali ormoni sono
di solito immediati e di durata molto breve: i tempi di reazione della cellula sono dell’ordine dei
millisecondi o al massimo di pochi secondi. In genere questi recettori si avvalgono di messaggeri
intracellulari come l’AMPc ed il calcio che sono i maggiori rappresentanti.
Gli effetti di fattori di crescita che inducono variazioni dell’espressione genica in pochi minuti si
protraggono per giorni e sono necessari per la crescita ed il differenziamento cellulare.
25
26
Gli ormoni steroidei liposolubili attraversano la membrana e diffondono nel citoplasma dove si legano ai
recettori specifici ed insieme entrano nel nucleo. Esperimenti fatti con anticorpi, hanno dimostrato che
inizialmente il recettore è localizzato nel citoplasma dove fa parte di un aggregato proteico con l’inibitore
(heat shock protein). Dopo il legame con l’ormone, il recettore si trova essenzialmente nel nucleo. La
formazione del fattore di trascrizione attivo richiede quindi il legame con l’ormone che determina la
rimozione dell’inibitore del complesso proteico-inibitore con la esposizione del sito che lega il DNA. Il
primo recettore per il quale si ottenne un elevato grado di purificazione era specifico per i
glucocorticoidi. Con le tecniche di genetica molecolare è stato possibile ottenere i cloni per
glucocorticoidi, ormone tiroideo, vitamina D, acido retinoico Con microscopio elettronico è stato
evidenziato il legame dei complessi recettore-ormone che si legano in più siti in regioni da qualche
centinaio di nucleotidi a monte del segnale di inizio della sintesi del RNA. Il confronto tra le sequenze
dei recettori dimostra che questi appartengono ad 1 superfamiglia che ha 1 dominio ammino-terminale
variabile tra 100-500 aacidi, non conservato tra i vari recettori; 1 nucleo centrale di circa 68 aacidi
altamente conservato (più del 40% di identità di sequenza tra i recettori diversi). In questa regione
centrale ve ne è 1 ricca in aacidi basici ed 1 ricca in cisteina, costituendo un dominio a dita di zinco. Il
dominio che lega le molecole di effettore è all’estremità carbossi-terminale. I vari recettori per gli ormoni
steroidei non sono presenti uniformemente in varie cellule. I recettori per l’ormone tiroideo che sono
almeno 2 non sono rappresentati nella stessa misura nelle diverse cellule.
27
Una volta entrato nel nucleo il complesso ormone recettore si lega al DNA. Si conoscono i siti di legame
al DNA caratteristici per tutti i principali recettori degli ormoni steroidei (Elementi di risposta) che sono
lunghi 15 basi circa e presentano una simmetria a diade (costituiti da tratti ripetuti e invertiti imperfetti
suggerendo che i recettori potrebbero legarsi sotto forma di dimeri a tali siti. Esperimenti di footprint con
la DNAasi hanno dimostrato che i complessi recettore -ormone glucocorticoide si legano a 4-6 siti di di
DNA di un frammento di 1,2 kb del genoma del virus di un tumore mammario di topo (MMTV), la cui
trascrizione aumenta in presenza di glucocorticoidi. Il legame avviene ad una distanza di 84-305
nucleotidi a monte del segnale di inizio per la sintesi del RNA.
Il legame tra il recettore ed il DNA avviene tramite delle regioni a dita di zinco, possedute dai rrecettori
degli ormoni steroidei e tiroidei e da dozzine di altre proteine di regolazione che sono caratterizzate dalla
ripetizione di 9 domini che contengono cisteine e istidine ad intervalli regolari. La proteina purificata è
associata allo zinco, che è necessario alla sua attività. Nella struttura ripiegata dotata di dita di zinco i
domini che si ripetono formano anse in maniera che 1 ione zinco sia legato tra una coppia di cisteina e 1
coppia di istidine. Nelle anse troviamo in posizioni quasi costanti, 1 residuo di fenilalanina (F) o di
tirosina (y) e 1 residuo di leucina (L) che sono necessari al legame con il DNA. I pallini neri indicano le
catene laterali che con maggior probabilità sono impegnate in legami con il DNA.
28
I recettori steroidei regolano la velocità della trascrizione genica. Le sequenze geniche che fungono da stampo per la
trascrizione comprendono due regioni: 1 codificante e 1 regolatrice. La regione regolatrice è posta a monte di quella
codificante. La regione regolatrice a sua volta comprende 2 diversi tipi di controllo. Il primo o elemento prossimale è
detto regione del promotore. In molti geni questo elemento è una sequenza di otto coppie di basi, detta TATA-box
poiché ricca di adenina e timina ed è circondata da guanina e citosina (G e C), localizzata circa 30 coppie di basi a
monte rispetto al punto di inizio della trascrizione. La TATA box ha la funzione di far assumere al RNA-polimerasi
l’esatta posizione dalla quale deve partire la trascrizione; negli eucarioti l’RNA polimerasi si lega alle proteine del
TATA-box.
Il secondo elemento di controllo o distale è rappresentato dalla zona del DNA detta regione dell’intensificatore
localizzato ad una distanza variabile di poche centinaia di coppie di basi sino a 100 kilobasi dall’elemento promotore.
Gli elementi dell’intensificatore 7-20 paia di basi sono detti elementi di risposta. L’elemento di risposta a AMPc
(CRE) consiste dalla sequenza ACGTCA e riconosce proteine leganti (CREB) attivate da processi di fosforilazione
controllati da protein-chinasi AMPc-dipendente. L’elemento di risposta al siero o estere del forbolo (SRE o PRE) ha
sequenza TGACTCAG. Elemento di risposta ai glicocorticoidi (GRE) riconosce il recettore proteico di tali ormoni.
Affinchè gli ormoni possano esercitare il loro effetto è indispensabile che gli elementi regolatori si leghino con le
proteine del promotore (fattori del TATA-box ) si leghino con l’intensificatore. Poiché le regioni del promotore e
dell’intensificatore sono molto distanti è stato ipotizzato che le sequenze del DNA si ripieghino ad ansa in modo da
che le proteine regolatrici legate all’intensificatore si leghino a quelle prossimali del promotore. Fattori di trascrizione
come ad esempio il recettore degli ormoni steroidei posseggono: una regione di legame con il DNA (dita di zinco); una
regione attivatrice con carattere acido che entra in contatto con i fattori di trascrizione; una o più regioni di legame per i
ligandi o siti di fosforilazione necessari per attivare i fattori di trascrizione. La maggior parte delle regioni di legame
con il DNA appartengono a 1 di queste 3 famiglie: 1) Proteine elica-giro-elica costituite da catene polipeptidiche che
contengono almeno due tratti con struttura ad alfa-elica; 2) Proteine a dita di zinco; 3) Proteine anfipatiche ad elica:
comprendono 2 tipi di sottostrutture, proteine elica-ansa-elica e proteine a cerniera di leucina. Queste 3 classi di
proteine regolatrici della trascrizione formano dimeri che possono legarsi tra loro o con il DNA. E’ possibile la
formazione di eterodimeri le quali possono legarsi a sequenze diverse di DNA regolando in tal modo l’attività di geni
bersaglio diversi in molteplici combinazioni. Un numero limitato di proteine regolatrici è in grado di esercitare un
numero molto elevato di interazioni regolatrici sul processo di trascrizione
29
Molti recettori di superficie il legame con il ligando attiva un’enzima che genera un incremento di breve
durata nella concentrazione del secondo messaggero intracellulare. Tra i secondi messaggeri si
annoverano AMP 3’, 5’ ciclico (cAMP), il GMP 3’, 5’ ciclico (cGMP), 1,2-diacilglicerolo, inositolo 1,4,5trifosfato (IP3) ed il Ca2+.
Un primo caso è un’attivazione indotta dal ligando di una proteina G e generazione di un secondo
messaggero. Il legame del ligando attiva una proteina G che si lega, attivandolo, a un enzima, che genera
un secondo messaggero intracellulare specifico.
La guanilato ciclasi è attivata direttamente dal legame con il ligando senza l’intervento di una proteina G.
Questo, legandosi, attiva la sintesi nel citosol del secondo messaggero GMP 3',5‘ ciclico a partire da
GTP. L’elevata concentrazione intracellulare di 1 o più di questi II messaggeri determina rapida
alterazione dell’attività di 1 o più enzimi o altre proteine. La rimozione o degradazione del ligando riduce
il livello del secondo messagero e pone fine alla risposta metabolica. Recettori per insulina (B) agiscono
direttamente fosforilando proteine substrato e in tal modo modificandone l’attività. La loro attività
protein- chinasi è attivate dal legame recettore-ligando. Altri recettori sono fosfatasi proteiche di residui
tirosinici la cui attivazione è indotta ancora una volta dal ligando. Ciò porta alla rimozione di residuo
fosforico legato a una tiroxina di una proteina substrato. (A) Recettori canale ionici attivati dal calcio. Il
ligando induce nel recettore, associandosi a esso, una variazione conformazionale, che apre nella proteina
stessa un canale ionico specifico. Ne consegue un flusso di ioni, che altera la differenza di potenziale
elettrico tra i due lati della membrana. Tali recettori-canale si trovano in particolare nel sistema nervoso.
Una menzione particolare meritano le prostaglandine che pur essendo lipofiliche si legano a recettori di
superficie.
30
Schema generale delle vie di secondo messaggero. Finora sono state identificate soltanto alcune delle vie attraverso
le quali può aver luogo la trasduzione dei segnali.Le tre vie rappresentate nella figura comportano una serie di passaggi
analoghi (a sinistra). I neurotrasmettitori entrano in contatto con moletole recettrici della membrana plasmatica ed
attivano una famiglia di proteine trasduttrici strettamente imparentate fra loro e capaci di attivare enzimi che fungono
da effettori primari. Questi enzimi danno origine alla formazione di un secondo messaggero, che può attivare un
effettore secondario o agire direttamente su proteine bersaglio (regolatrici). La prima delle vie rappresentate dà origine
al secondo messaggero AMPc che viene prodotto dall'adenilil-ciclasi attivata da una proteina-G (il nome dipende dal
fatto che queste proteine sono attive soltanto in presenza di guanosin trifosfato (GTP). La proteina-G rappresentata
viene detta G, in quanto stimola la ciclasi. Alcuni recettori attivano un'altra proteina, GI, che inibisce la ciclasi. La
seconda via è attivata da un recettore muscarinico per l' ACh ed impiega un'altra proteina-G (G) per attivare la
fosfolipasi C (PLC). L'enzima dà origine a una coppia di secondi messaggeri, il DAG e l'IP 3. L'IP 3 a sua volta,
mobilizza Ca2+ dai depositi intracellulari. Il DAG attiva la protein-chinasi C (PKC). Il terzo principale sistema
rappresentato attiva una cascata di reazioni enzimatiche che modificano l'acido arachidonico attraverso la fosfolipasi
A2 (PLA2). Tre importanti enzimi che si formano in questa cascata di reazioni sono: la 5- e la 12-lipossigenasi e la
ciclossigenasi.
Struttura dei recettori accoppiati a proteine G. La struttura dei recettori accoppiati a proteine G è caratterizzata
dalla presenza di sette segmenti di catena polipeptidica che attraversano la membrana a tutto spessore. La struttura del
recettore 1-adrenergico è analoga a quella del recettore 2-adrenergico, del recettore muscarinico per l' ACh e della
rodopsina. Una caratteristica strutturale importante di questi recettori è rappresentata dal sito di legame per l’ormone
che è localizzato sulla superficie extracellulare della cellula, appena ricoperto dalla matrice lipidica della membrana
(nell'esempio, il sito è rappresentato dal residuo 113 di un aspartato). La parte del recetto re colorata in marrone è
quella con cui prende rapporto la proteina-G. I due residui di serina, raffigurati in nero indicano i siti dove avviene la
fosforilazione. (Modificata, da Frielle e collaboratori, 1989.)
31
AMP ciclico E' stato per la prima volta identificato come mediatore intracellulare dell'azione ormonale
nel 1959. I recettori beta-adrenergici per l’adrenalina agiscono tramite AMPc. Esistono agonisti
(isoprotenerolo) che imitano la funzione ormonale ed altre sostanze gli antagonisti (propanololo;
practololo) che si legano al recettore senza attivare le funzioni svolte dagli ormoni. Esistono diversi tipi
di recettore beta-adrenergico. Nell’uomo I recettori 1 delle cellule miocardiche aumentano il ritmo
cardiaco e contrattilità. I recettori 2 delle cellule della muscolatura liscia dei bronchi mediano la
distenzione cellulare. L’AMPciclico è prodotto dall’adenilato ciclasi, un’enzima legato alla membrana
con il sito di legame per l’ATP rivolto all’esterno. Il sito di legame tra recettore ed ormone è localizzato
sulla faccia esterna. La proteina G si trova legata sulla faccia citoplasmatica è l’agente di comunicazione
tre recettore e adenilato ciclasi. Il livello di AMPc è di solito controllato dall’attivazione dell’adenilato
ciclasi, viene anche regolato dalla sua degradazione ad opera della cAMP fosfodiesterasi che pone fine
agli effetti della stimolazione ormonale. Molte cAMP fosfodiesterasi sono attivate da aumenti del calcio
citosolico il quale si lega alla calmodulina ed il complesso calcio-calmodulina si lega a sua volta alla
cAMP fosfodiesterasi attivandola e di conseguenza aumentando l’idrolisi di cAMP.
32
La proteina GS lega il GTP in maniera non covalente ma efficacemente. GS è composta tra 3 catene polipeptidiche alfa,
beta, gamma con P.M. 42.000, 35.000, 10000 Da. Fino ad oggi sono stati identificati almeno 20 differenti geni che
codificano la sintesi della sub-unità alfa; 4 la sub-unità beta e 7 quella gamma. La specificità della proteina G trimerica
è determinata principalmente dalla sua sub-unità alfa. La sub-unità alfa lega GTP e GDP e si lega sia al recettore che
all’adenilato ciclasi che non interagiscono direttamente tra loro.
L'attivazione dell'adenilato ciclasi è operata dal legame di un ormone al suo recettore. Il tratto di membrana cellulare
disegnato contiene due proteine transmembrana, un recettore proteico per un ormone (R ) , l'adenilato ciclasi (C) e, sul
versante citosolico, la proteina di trasduzione Gs . Allo stato di riposo, GS., subunità di Gs, è associata a GDP. Quando
un ormone si lega a esso, R subisce una variazione conformazionale (fase 1). R, allo stato attivato, si lega a Gs (fase 2).
Questo attiva GS che rilascia GDP e lega GTP; il che causa la dissociazione della subunità GS,. dalle subunità G,
(fase 3). La subunità GS,.libera si lega a C, attivandola, in modo che essa inizi a catalizzare la formazione di cAMP a
partire da ATP (fase 4); questo passaggio può comportare una variazione conformazionale di G. Ache il GTP viene
idrolizzato a GDP, reazione che con ogni probabilità è catalizzata dalla stessa GS. GS perde la capacità di attivare C
(fase 5) e C e GS e G, si riassociano. In seguito, l'ormone si dissocia dal recettore e il recettore torna allo stato di
riposo. In una cellula non stimolata la > parte delle molecole GS contiene GDP.
La proteina G si associa in maniera ciclica a GTP e a GDP; tale associazione è accoppiata all'attivazione e
all'inattivazione dell'adenilato ciclasi che è di conseguenza di breve durata (pochi secondi). Si ritiene che la subunità
GS stessa catalizzi l'idrolisi del GTP a GDP. Le interazioni complesse tra recettore, proteina G e adenilato ciclasi
hanno un ruolo importante nell’amplificare il segnale poiché un singolo complesso recettore-ormone può convertire
sino a 100 complessi GS GDP G,Ognuno di questi complessi attiva 1 singola adenilato ciclasi. Diverse proteine G
mediano l'attivazione e l'inibizione dell'adenilato ciclasi. Numerosi complessi ormone-recettore si legano a una
proteina stimolante GS determinando la sostituzione del GDP precedentemente legato con GTP e la dissociazione della
subunità GS GTP, che va a legarsi con I'adenilato ciclasi e ad attivarla. Altri complessi ormone-recettore si legano a
una proteina G diversa, con funzione inibente, Gi , costituita anch'essa da una subunità che lega il GDP o il GTP e
dalla subunità G, . In qualche modo, la proteina inibente Gi viene modificata, dopo di che lega l’adenilato ciclasi e la
inibisce. Nei due tipi di proteine G, stimolanti e inibenti, le subunità G, sono uguali, mentre le subunità G e i
recettori differiscono. La conferma del ciclo del GTP venne dallo studio dei meccanismi d’azione di alcune tossine
batteriche. In particolare la funzione della tossina colerica fu la prima ad essere chiarita. Tale tossina consiste in 2
catene,1 delle quali è un’enzima il quale catalizza l’addizzione covalente di un gruppo ADP-ribosio alla sub-unità alfa
della GS. Questa sub-unità modificata irreversibilmente puà attivare l’adenilato ciclasi ma non può idrolizzare il GTP,
restando costantemente attiva e di conseguenza attivando permanentemente l’adenilato ciclasi. Nelle cellule intestinali
l’incremento di AMPc nel citosol è di circa 100 volte. La tossina della pertosse aggiunge ADP-ribosio alla sub-unità
alfa della Gi. In tal caso Gi non è in grado di inattivare l’adenilato ciclasi
33
Oltre alle proteine G eterotrimeriche che come detto intervengono in una serie di vie di trasduzione del
segnale, le più conosciute sono riportate nella tabella riportata nel lucido, esistono proteine G
monomeriche a basso PM = 20.000-35.000 dalton. I ruoli più importanti prevedono allungamento catene
polipeptidiche nella sintesi proteica, proliferazione e differenziazione cellulare e loro trasformazione
neoplastica, controllo del citoscheletro actinico e suoi legami con la matrice extracellulare, il trasporto
delle vescicole e secrezione tramite esocitosi. Hanno un ciclo di attivazione e disattivazione simile a
quello riportato per le proteine G eterotrimeriche; in questo caso però intervengono proteine regolatrici
che non sono attive nel caso delle proteine G eterotrimeriche. In figura è illustrato il ciclo di attività di
una proteina G monomerica di tipo Ras. Altre proteine G monomeriche hanno cicli simili. L' attivazione
della Ras è stimolata da una GNRP (proteina che libera nucleotidi guaninici), che promuove il legame di
GTP e la liberazione di GDP e, pertanto, l'attivazione della proteina G monomerica. L 'inattivazione della
Ras è, invece, promossa da una GAP (proteina attivatrice della GTPasi), che stimola l'idrolisi del GTP
legato. Di conseguenza l’attivazione e l’inattivazione delle proteine G monomeriche sono controllate da
segnali che a loro volta influenzano l’attività di GNRP e GAP piuttosto che effetti sulla proteina G
monomerica.
34
35
In assenza di AMPc la protein chinasi dipendente dall’AMPc è costituita da 4 sub-unità: 2 regolatrici e 2 catalitiche. In
presenza di livelli micromolari di AMPc ogni sub-unità R lega 2 AMPc, questo legame determina variazione
conformazionale delle R tale da diminuire l’affinità per le sub-unità C. In figura è riportata l’ attivazione della proteina
chinasi dipendente dall' AM Pc. Le due subunità regolatrici (subunità R) del complesso R2C2 sono legate da due ponti
disolfuro. Il legame di due molecole di AMPc a ogni subunità R provoca la flessione di ogni subunità R nella regione
cerniera e la liberazione delle due subunità catalitiche (C). (Elaborato da Taylor S: J Biol Chem 264:8443, 1989.)
La famiglia delle proteine chinasi. Nonostante differenze tra le varie protein chinasi, tutte possiedono un nucleo
catalitico comune (regione colorata) che contiene sia i domini dell' ATP e del legame del peptide sia il sito attivo nel
quale si verifica il trasferimento del fosforo. I residui conservati sono stati allineati sulla lisina 72 (pallini in colore),
l'aspartato 184 (quadrati in colore) e le regioni ricche di glicina (rettangoli in colore) della subunità catalitica della
proteina chinasi dipendente dall’AM Pc. Le regioni tratteggiate in colore sono importanti per la regolazione. I siti di
legame covalente con l' acido miristico, un acido grasso che contribuisce alI' ancoraggio della proteina chinasi alla
membrana plasmatica, sono indicati da m. (Modificata da Taylor S et al: Annu Rev Cell Biol 8:429. 1992. )
Recentemente è stata determinata la struttura cristallografica della sub-unità catalitica della protein chinasi dipendente
da AMPc; da tale studio si è evinto che il nucleo catalitico conservato è costituito da 2 lobi, 1 grande che contiene il
sito di legame del peptide ed 1 piccolo che contiene il sito di legame all’ATP anomalo. Molte protein chinasi
contengono una regione regolatrice definita domino del pseudosubstrato, la cui sequenza aacidica assomiglia a quella
del sito di fosforilazione dei substrati proteici. Il dominio del pseudosubstrato si lega al sito attivo della protein chinasi
ed impedisce la fosforilazione. L’attivazione delle protein chinasi può richiedere la fosforilazione o modificazione
allosterica covalente (legame con AMPc per esempio)
36
Ad esempio, la protein chinasi A determina la fosforilazione e la conseguente attivazione di una glicogeno fosforilasi
chinasi, che fosforila la glicogeno fosforilasi che a sua volta degrada il glicogeno in glucosio 1-fosfato. Il cAMP
controlla la degradazione e la sintesi di glicogeno nel fegato e nelle cellule muscolari. (a) L'aumento del livello di
cAMP determina un incremento nel livello di glucosio, attivando ladegradazione del glicogeno e inibendo la sintesi di
glicogeno. La forma attiva della proteina chinasi cAMP-dipendente fosfori là la glicogeno sintetasi, riducendo la sua
attività. La chinasi fosfori la anche la glicogeno fosforilasi chinasi, attivando la sua capacità di fosforilare e di attivare
la glicogeno fosforilasi, I'enzima che degrada il glicogeno a glucosio 1-fosfato. La proteina chinasi cAMP-dipendente
fosforila anche un inibitore della fosfoproteina fosfatasi, attivandolo. Di conseguenza, i gruppi fosforici aggiunti agli
altri enzimi non vengono rimossi. (b) La diminuzione del livello di cAMP fa diminuire la concentrazione di glucosio
1-fosfato, inibendo la degradazione del glicogeno e attivando la sua sintesi. Questo risultato viene ottenuto tramite
I'attiv~ionedella fosfoproteina fosfatasi; il gruppo fosforico viene rimosso dall'inibitore che, di conseguenza, viene
inattivato. La fosfatasi attiva rimuove quindi i residui fosforici dalla glicogeno fosforilasi chinasi e dalla glicogeno
fosforilasi, inibendo la degradazione del glicogeno. La rimozione del gruppo fosforico dalla glicogeno sintetasi,
invece, attiva I'enzima e determina, di conseguenza, la sintesi di glicogeno.
La proteina fosfatasi I é responsabile della defosforilazione di molte proteine fosforilate dalla proteina chinasi A, tra
cui CREB; La sua attività é soppressa nelle cellule muscolari stimolate da adrenalina dalla proteina inibitrice della
fosfatasi. Figura 19.23 l'inibizione della fosfoproteina fosfatasi da parte del cAMP. la fosfoproteina fosfatasi è
enzimaticamente attiva a meno che una proteina inibitrice non sia legata a essa. l'inibitore deve essere fosforilato dalla
proteina chinasi cAMP-dipendente per potersi legate alla fosfoproteina fosfatasi e inibirla. In tal modo, la.fosfatasi è
inattiva inpresenza di un atto livello di cAMPe attiva solo quando il livello di cAMP è basso. (Da P. Cohen, 1982,
Nature, 296, p. 613.)
37
La cascata ha diversi vantaggi: 1) essa consente di regolare un intero gruppo di reazioni catalizzate enzimaticamente
sulla base del livello di un’unica specie, l’AMPc; essa consente inoltre di invertire rapidamente gli effetti quando il
livello di cAMP cala. Inoltre la cascata di eventi consente una notevole amplificazione del segnale inizialmente debole.
Ad esempio la concentrazione ematica di epinefrina può essere estremamente bassa 10 -10 M e tale stimolo genera in
cellula una concentrazione di cAMP superiore a 10 -6 M.
38
Molti ormoni si legano a recettori di superficie e determinano l’innalzamento del calcio citosolico tramite
la fuoriuscita dagli store intracellulari (reticolo endoplasmatico o altre vescicole). Agli inizi degli anni 80
quando si dimostrò che l’aumento del calcio citosolico è preceduto dall’idrolisi di un fosfolipide di
membrana, il fosfatidilinositolo 4,5-difosfato in risposta ai segnali cellulari. Questo fosfolipide appartiene
ad una famiglia di inositolo fosfolipidi, con inositolo fosforilato (con 1 o 2 fosfati). Sebbene tutti e tre gli
inositolo fosfolipidi possono essere degradati in risposta al segnale, la demolizione critica è quella del
PIP2, anche se è il meno abbondante costituendo il 10% di tutti gli inositolo fosfolipidi e meno dell’1% di
tutti i fosfolipidi. L’idrolisi di questo fosfolipide operata dalla fosfolipasi C porta a 2 prodotti: 1,2 diacilglicerolo che resta nella membrana e l’inositolo 1,4,5 trifosfato (IP 3) idrosolubile. Una proteina G
accoppia i recettori ormonali con la fosfolipasi C; il trattamento con la tossina della pertosse inattiva G
e abolisce l’attivazione della fosfolipasi C. L’IP3 diffonde nel citosol, si lega a suoi recettori sul reticolo
endoplasmico e promuove il rilascio del calcio. Il diacil-glicerolo rimane nella membrana e aiuta ad
attivare la protein chinasi C. Vi sono tre classi di fosfolipasi C (, , ) la classe beta viene attivata da
recettori legati a proteine G. La classe gamma viene invece attivata da una seconda classe di recettori
tirosin chinasici che attivano la via di segnalazione dell’inositolo fosfolipide senza una proteina G
intermediaria.
Dopo un secondo dall sua formazione l’IP 3 viene idrolizzato a inositolo 1,4-difosfato, molecola che non
determina rilascio di altri ioni calcio. In pochi minuti gli store vengono esauriti ed il mantenimento di
elevati livelli di calcio citosolico richiede l’ingresso dall’ambiente extracellulare. Nelle cellule
pancreatico tale ingresso è mediato dall’inositolo 1,3,4,5 tetrafosfato (IP 4) derivante dalla fosforilazione
di IP3
39
40
La concentrazione di calcio liberi nel citosol è mantenuta al di sotto degli 0.2 M. Le PMCA ed il
controtrasporto Na-Ca (Ca-ATPasi del plasmalemma) pompano fuori il calcio dalla cellula. Le serca
pompano il calcio nel reticolo endoplasmico o in altre vescicole, nei mitocondri; proteine legano il calcio.
Le vie di entrata del calcio in cellula in risposta a segnali cellulari sono i canali specifici o tramite
l’inositolo trifosfato il cui legami a recettori specifici del reticolo endoplasmico determina l’apertura di
altri canali per il calcio. Un aumento anche modesto del calcio dell’ordine anche di 1 micromole scatena
risposte cellulari. Ad esempio nelle cellule secernenti come quelle beta del pancreas, un aumento
modesto della concentrazione degli ioni calcio citosolici induce esocitosi delle vescicole di secrezione e
liberazione di insulina. Nelle cellule muscolari ed epatiche un aumento di calcio determina in quelle
muscolari un la contrazione ed in entrambi i tipi cellulari la degradazione del glicogeno a glucosio-1fosfato. Ad esempio nelle uova di riccio di mare un segnale prodotto dagli spermatozoi determina entrata
di calcio e formazione della membrana di fecondazione.
41
La concentrazione citosolica di Ca2+ può esser monitorata in continuo sfruttando la fluorescenza dei
complessi Ca2+-fura-2. Aggiunto al mezzo di coltura, l'estere lipofilo del fura-2 (a sinistra) diffonde
attraverso la membrana plasmatica e viene idrolizzato a fura-2 dalle esterasi del citosol. Il fura-2, di
carattere non lipofilo (a destra) non può attraversare le membrane cellulari e resta nel citosol. In assenza
di Ca2+ , il fura-2 non è fluorescente e la fluorescenza dei complessi Ca2+-fura-2 è proporzionale alla
concentrazione di ioni Ca2+ del citosol.
Variazioni nella concentrazione locale di ioni Ca2+ in un uovo di riccio di mare dopo la fecondazione. Il
Ca2+ cellulare è stato monitorato per mezzo della fluorescenza del fura-2, attraverso un microscopio ; a
fini grafici, le concentrazioni di Ca2+ sono espresse secondo una scala graduata di colori (a destra) in
micromoli di Ca2+. La concentrazione di Ca2+ aumenta inizialmente nel punto in cui lo spermatozoo è
entrato (la parte in basso a sinistra della cellula) e si innalza, diffondendosi come un'onda. In un tempo
successivo, la concentrazione di Ca2+ diventa elevata e uniforme in tutta la cellula, poi decade
uniformemente allo stato di riposo. (Da R.Y. Tsien e M. Poenie, 1986, TIBS, 11, pp. 450-455; per gentile
concessione di j. Alderton, M.Poenie, R.A. Steinhardt e R.Y. Tsien)
42
La calmodulina, proteina citosolica di 149 aacidi con quattro siti di legame per il calcio, forna il
complesso Ca2+ /calmodulina, un importante regolatore intracellulare. (A) Sequenza amrninoacidica
del sito di legame per il calcio situato all'estremità C-terrninale della calmodulina. Ogni sito di
legame contiene residui di aspartato, glutammato ed asparagina (mostrati in colore) le cui catene
laterali stabiliscono legami ionici con uno ione Ca2+, formando un'ansa nello scheletro della
proteina. Gli altri siti di legame contengono anche residui di treonina e di serina, e gli atomi di
ossigeno presenti nelle catene laterali di questi amminoacidi si associano allo ione calcio. (B)
Modello di una molecola di calmodulina a cui sono legati quattro ioni calcio (sfere grigie). (C)
Rappresentazione schematica della variazione conformazionale indotta dal legame del calcio alla
calmodulina. Quando tutti e quattro i siti di legame per il calcio sono occupati, la calmodulina
subisce un cambiamento della struttura terziaria. Il risultante complesso Ca2+/calmodulina può
legarsi a numerose proteine bersaglio, regolandone l'attività. [Parte B cortesemente concessa da Y.S.
Babu e W.J. Cook]
La calmodulina è strettamente correlata alla troponina delle cellule muscolari scheletriche;
1) fra i bersagli regolati dal complesso Ca2+-calmodulina vi sono vari enzimi e proteine di trasporto
come la Ca2+-ATPasi che espelle calcio dalla cellula;
2) la > parte degli effetti é però mediata da protein-chinasi dipendenti dal complesso calcio-calmodulina;
43
Le prime chinasi CaM scoperte sono quelle della catena leggera della miosina (muscolatura liscia) e la
fosforilasi chinasi che attiva demolizione del glicogeno. Alcune protein chinasi calcio-calmodulina come,
la chinasi della catena leggera della miosina e la fosforilasi chinasi agiscono su di un solo substrato
proteico mentre altre chinasi sono moltifunzionali. Nel muscolo liscio l’aumento di calcio citosolico
stimola l’attività della chinasi della catena leggera di miosina, la conseguente fosforilazione delle catene
leggere regolatrici permette di effettuare la contrazione.
La protein chinasi calcio-calmodulina dipendente di tipo II, tra le più abbondanti proteine del sistema
nervoso centrale (sino al 2%) delle proteine totali, riveste un ruolo essenziale nei meccanismi attrraverso
cui l’aumento di calcio nel terminale nervoso produce la liberazione di neurotrasmettitore per esocitosi. Il
suo principale substrato è la sinapsina I che si lega alle vescicole sinaptiche impedendo loro di
partecipare all’esocitosi sino a chè la fosforilazione ne determina il distacco dalle vescicole e la
conseguente esocitosi.
Nelle cellule muscolari, la stimolazione nervosa porta alla liberazione di ioni calcio dal reticolo
sarcoplasmatico, che determina contrazione e tramite il complesso calcio-calmodulina la degradazione di
glicogeno in glucosio 1-fosfato, fornendo il carburante necessario alla contrazione muscolare. Vi è un
interazione tra il segnale inviato tramite calcio-calmodulina e la protein chinasi A (AMP ciclico
dipendente) mediata dalla glicogeno fosforilasi chinasi
44
La chinasi CaM II é un esempio di chinasi CaM multifunzionale. Nel tessuto nervoso, dove è abbondante
attivando la tirosina idrossilasi favorisce la risintesi delle catecolammine; l'ingresso di calcio attraverso i
canali voltaggio-dipendenti, promuove sia la liberazione di neurotrasmettitore che la risintesi tramite la
chinasi CaM II
L'attivazione della chinasi CaM II può servire da traccia di memoria di un precedente impulso di Ca 2+ a
causa della proprietà di autofosforilazione.
L’enzima è un complesso proteico di 12 sub-unità (, , , )2 espresse in proporzioni diverse in tipi
cellulari diversi. La sub-unità alfa espressa solo nel cervello è rappresentata in figura. Il legame calciocamodulina altera la conformazione, inverte l’interazione domino inibitore – catalitico, consentendo al
dominio catalitico di fosforilare il dominio inibitore delle altre sub-unità del congresso, oltre ad altre
proteine della cellula. L’autofosforilazione del complesso enzimatico (per fosforilazione reciproca delle
sue sub-unità) prolunga l’attività dell’enzima in 2 modi: 1) intrappola la calcio/calmodulina legata in
modo che questa non si dissoci dal complesso enzimatico finchè il calcio ritorna a livelli basali per
almeno 10 secondi; 2) converte l’enzima ad una forma indipendente da calcio così che la chinasi rimane
attiva anche dopo che la calcio-calmodulina si è dissociata. L’attività continua fino a che il processo di
autofosforilazione non viene sopraffatto da una proteina fosfatasi.
45
Un esempio classico é la fosforilasi chinasi del muscolo scheletrico che può essere attivata sia dal
complesso calcio-calmodulina che dalla protein chinasi A ( e quindi dall'AMPc)
A) Il calcio attiva sia la contrazione muscolare e libera le risorse enegetiche necessarie (glucosio da
glicogeno) sia:
1) attivando la fosforilasi chinasi
2) inibendo la glicogeno sintasi (mediante fosforilazione da parte della chinasi CaM);
B) fosforilazione della fosforilasi chinasi ad opera della protein chinasi A, attivata da AMPc a sua volta
indotto da adrenalina, preparano la cellula muscolare ad una accresciuta domanda di energia,
sensibilizzando la fosforilasi chinasi a basse concentrazioni di calcio.
La fosforilasi chinasi di muscolo di mammifero è costituita da 4 sub-unità. La sub-unità ha attività
catalitica dell’enzima attivo; le sub-unità e quella (cioè la calmodulina) mediano la
regolazione dell’enzima da parte rispettivamente dell’AMPc e del calcio. Il complesso enzimatico
effettico contiene quattro copie di ciascuna sub-unità.
46
Il diacilglicerolo derivato dall’idrolisi del fosfatidil-inositolo può dare origine all’acido arachidonico usato come
precursore degli eicosenoidi oppure attivare la protein chinasi C. Esitono 4 classi di eicosanoidi: prostaglandine,
prostacicline, tromboxani e leucotrieni, tutti sono prodotti in prevalenza dall’acido arachidonico. Tranne i leucotrieni
tutti gli altri sono dipendenti dalla cicloossigenasi; la sintesi di leucotrieni richiede la presenza dell’enzima
lipoossigenasi. Gli eicosanoidi hanno un ruolo importante nelo dolore, nella febbre e nell’infiammazione. Ormoni
come il cortisone inibiscono l’attività della fosfolipasi nel primo passaggio della via di sintesi degli eicosenoidi e sono
usati largamente per curare malattie infiammatorie non infettive. Sostanze non steroidee come aspirina e ibuprofene
bloccano il primo passaggio di ossidazione catalizzato dalle cicloossigenasi Questa chinasi allo stato inattivo è
solubile nel citosol; il legame con il calcio ne causa il legame con la faccia citoplasmatica della membrana dove può
essere attivata dal diacil-glicerolo. Quindi, calcio e diacilglicerolo, originati dalla via di segnalazione del fosfatidilinositolo, interagiscono tra loro. L’attivazione delle protein chinasi C in cellule diverse determina un’ampia gamma di
risposte cellulari. Nel fegato uno dei bersagli della PKC è la glicogeno sintetasi, inattivata dalla fosforilazione mediata
da PKC. L’attivazione di PKC quindi da una parte inibisce la sintesi di glicogeno (inibendo la glicogeno sintetasi);
l’aumento del calcio citosolico derivato dalla presenza di IP3 stimola l’attivazione della glicogeno fosforilasi. Ciò
dimostra che molteplici secondi messaggeri si coordinino per ottenere un’unica risposta cellulare. Alcune sostanze
dette promotori tumorali,come gli esteri del forbolo, attivano notevolmente e specificamente la proteina chinasi C e ciò
fa ritenere che l’attivazione della PKC sia un evento chiave nella proliferazione cellulare. Tra i substrati della protein
chinasi C vi sono i recettori di superficie di molti ormoni della crescita, come fattore di crescita dell’epidermide (EGF).
La fosforilazione del recettore per EGF da parte della PKC ne determina una diminuzione di affinità per EGF e quindi
un’inibizione dello stimolo di crescita. La produzione eccessiva di PKC in fibroblasti normali fa sì che le cellule non
necessitano di crescere aderenti alla matrice extracellulare. La PKC può attivare trascrizione di geni specifici tramite
due vie: 1) cascata di fosforilazioni che porta alla fosforilazione della Map-chinasi che a sua volta fosforila la proteine
regolatrice dei geni Elk-1. Elk-1 è legato alla sequenza del DNA (elemento di risposta al siero, SRE) in associazione ad
un’altra proteina che lega il DNA (fattore di risposta al siero. SRF). 2) fosforilazione di Ik-B che rilascia la proteina
regolatrice dei geni NF-kB che può migrare nel nucleo e attivare la trascrizione di geni specifici.
47
Recettori guanilico ciclasi
Utilizzati dai peptidi natriuretici atriali, i quali determinano stimolazione del rene ad eliminare acqua e
sali e rilassamento dei vasi sanguigni. I recettori guanilico ciclasi mediano il loro effetto, producendo
direttamente GMPc che si lega ad una protein chinasi G, attivandola, che fosforila proteine specifiche a
livello dei residui di serina e treonina.
48
Vi sono al momento 8 sottofamiglie di recettori tirosina chinasici. Il domino tirosina chinasi è in alcune
famiglie interrotto da una regione inserita della chinasi. Le prime 2 sottoclassi (I e II) possiedono domini
extracellulari con sequenze ripetute ricche di cisteina, mentre I domini extracellulari delle altre sottoclassi
hanno regioni simili alle immunoglobuline (anelli). La regione intracellulare, l’inserto chinasico a
lunghezza variabile, sono I siti di regolazione. Il legame di una proteina induce dimerizzazione e
autofosforilazione dei recettori che in tal modo si attivano. I recettori per l'insulina sono già in forma
tetramerica e di conseguenza il legame dell'ormone al suo sito provoca interazione allosterica fra le due
metà del recettore che induce l'autofosfilazione del recettore, che si attiva e i suoi domini catalitici
fosforilano una proteina chiamata IRS-1 (substrato 1 del recettore dell'insulina). Le protein chinasi
specifiche per la tirosina svolgono un ruolo fondamentale nella trasformazione cellulare. Le proteine G
monomeriche di tipo RAS sono coinvolte nella mediazione degli effetti che ligandi mitogeni inducono
sulla proliferazione cellulare. L’attivazione delle RAS si traduce nella trascrizione di alcuni geni cruciali
nei processi di crescita cellulare. Ad esempio è coinvolta la cascata delle map chinasi. Esistono
interazioni tra la via della PKC e le vie tirosin-chinasiche, l’isoforma gamma della fosfolipasi C è attivata
da proteine di tipo RAS
49
Il recettore tirosin chinasico per la PDGF contiene 5 siti di autofosforilazione in tirosina, 3 nell’inserto
della chinasi e 2 nella coda carbossiterminale a cui si legano le 3 proteine segnale mostrate a sinistra. Vi
è un sito di legame per la fosfolipasi C che determina l’attivazione di tale enzima e la stimolazione della
via di trasduzione degli inositoli fosfolipidi. Nelle tre proteine segnale sono presenti dei domini SH2
(rosso) e SH3 (blu), la sui struttura tridimensionale è stata determinata tramite cristallografia a raggi X. Il
domino SH2 è un modulo compatto che può essere inserito in qualsiasi proteina. Ed ha la funzione di
riconoscere specificamente le fosfotirosine; vi è anche un sito di legame di una catena laterale di un
aminoacido specifico (es. isoleucina) che può determinare la specificità del legame della proteina al
recettore fosforilato.
50
Le proteine Ras sono GTPasi monomeriche e possono essere regolata da proteine che attivano la GTPAsi
(GAP) che tende a inibirle o da proteine rilascianti GDP le GNRP he tendono ad attivare Ras. Le proteine
che attivano la GTPasi (GAP) inattivano Ras stimolandolo a idrolizzare il GTP legato. Quelle che
rilasciano GDP (GNRP) attivano Ras stimolandolo a rilasciare il GDP; dato che la concentrazione di
GTP nel citosol è 10 volte > di quella del GDP, Ras tenderà a legare GTP una volta che si è liberato del
GTP. Due GAP che regolano Ras (Ras GAP) sono state caratterizzate nelle cellule dei mammiferi e sono
la p120GAP e la neurofibromina (codificata da un gene che subisce una mutazione nella malattia genetica
umana neurofibromatosi) Entrambe sono ubiquitarie anche se l’una o l’altra sembrano predominare a
seconda del tipo di cellula, nel mantenere la > parte delle proteine Ras ( 95%) in uno stato inattivo con
GDP legato.
51
Le MAP-chinasi attivate possono migrare nel nucleo e fosforilare ElK-1 attivandolo alla trascrizione del
gene fos ; MAP può fosforilare la proteina Jun che si combina con la proteina fos a formare la proteina
regolatrice AP-1 che può attivare numerosi altri geni; anche la chinasi C può fosforilare Jun o attivare
MAP chinasi chinasi chinasi.
Nella via attivata da recettori tirosin chinasici tramite Ras, la MAP-chinasi chinasi chinasi è spesso una
serina/treonina chiamata Raf , che si pensa essere attivata dal legame di Ras attivato. Nella via attivata da
recettori legati a proteine G tramite la chinasi C, la MAP-chinasi chinasi può essere sia Raf che una
serina/treonina chinasi diversa. Una cascata simile di fosforilazioni serina/treonina che coinvolge
proteine correlate strutturalmente e funzionalmente opera in modo da integrare e amplificare i segnali
provenienti da diversi stimoli extracellulari. I recettori tirosin chinasici possono anche attivare una via di
segnalazione al nucleo più diretta, fosforilando, e quindi attivando, proteine regolatrici dei geni che
contengono domini SH2.
52
I recettori associati a tirosin chinasi comprendono recettori per l'ormone della crescita e prolattina;
funzionano tramite tirosina chinasi associate che fosforilano varie proteine bersaglio quando il recettore
lega il suo ligando Le chinasi coinvolte con questi recettori sono: SRC e JANUS.
Nel caso dell’ ormone della crescita inaspettatamente il ligando monomerico è in grado di legare insieme
I suoi recettori, ciò richiede che due recettori identici siano in grado di distinguere parti diverse
dell’ormone. La dimerizzazione indotta dal ligando porta insieme I domini citoplasmatici dei due
recettori transmembrana a singolo passaggio. Ciò a sua volta attiva le tirosin chinasi non recettoriali
(SRC e JANUS). Oltre ai recettori per l'ormone della crescita (GH anche i recettori per la prolattina e
alcuni altri ligandi non possiedono attività tirosina chinasica intrinseca. Il recettore per l'ormone della
crescita si dimerizza in seguito al legame di GH, lega una o più tirosina chinasi di tipo JAK che fosforila
se stessa e il recettore. Le tirosina chinasi di tipo STAT si legano al complesso e vengono quindi
fosforilate. La forma fosforilata di STAT si dissocia sotto forma di dirneri, che vengono
successivamente trasportati al nucleo, dove determinano la fosforilazione di fondamentali fattori di
trascrizione. JAK, chinasi specifiche per la tirosina di tipo Janus; STAT, trasduttori del segnale e
attivatori della trascrizione.
53
54
55
56
Pathway di segnalazione che porta all’attivazione di fattori di trascrizione e
modulazione dell’espressione genica che segue il legame ad alcuni recettori
legati a proteine Gs e recettori tirosin-kinasici. In questi casi la stimolazione
recettoriale consente l’attivazione di protein kinasi che traslocano nel nucleo e
qui fosforilano e attivano fattori di trascrizione come il CREB, il TCF e SRF.
Come risultato viene stimolata la trascrizione di geni controllati dagli elementi
di regolazione del DNA (CRE e SRE) riconosciuti da questi fattori di
trascrizione. Il CREB fosforilato stimola la trascrizione tramite la sua
associazione con il coattivatore CPB/P300.
57
58
Pathway di segnalazione che porta all’attivazione di fattori di trascrizione e
modulazione dell’espressione genica che segue il legame ad alcuni recettori
legati a proteine Gs e recettori tirosin-kinasici. In questi casi la stimolazione
recettoriale consente l’attivazione di protein kinasi che traslocano nel nucleo e
qui fosforilano e attivano fattori di trascrizione come il CREB, il TCF e SRF.
Come risultato viene stimolata la trascrizione di geni controllati dagli elementi
di regolazione del DNA (CRE e SRE) riconosciuti da questi fattori di
trascrizione. Il CREB fosforilato stimola la trascrizione tramite la sua
associazione con il coattivatore CPB/P300.
59
60