EuroBrain Vol. 5, N. 1 – Giugno 2004
La percezione del dolore e
della temperatura
LA PERCEZIONE DEL DOLORE
E DELLA TEMPERATURA
1 L’UTILITÀ DEL DOLORE
1 I DIFFERENTI TIPI DI
NOCICETTORI
2 PER QUALE RAGIONE
IL DOLORE È AMPLIFICATO
IN CASO DI FERITA
2 DAL PEPERONCINO
AI TERMORECETTORI
3 L’ILLUSIONE DELLA
GRIGLIA TERMICA
3 LA SENSAZIONE DI
FRESCHEZZA DEL MENTOLO
4 COME DISTINGUERE
IL FREDDO INOFFENSIVO
DA QUELLO NOCIVO?
5 LA SITUAZIONE DIVENTA
PIÙ COMPLESSA
L’UTILITÀ DEL DOLORE
Gli organismi viventi devono poter reagire
rapidamente agli stimoli provenienti dal
mondo esterno e ai cambiamenti interni.
La funzione principale del dolore acuto
è quella di informare l’organismo sulle
aggressioni interne o esterne che subisce.
L’uomo possiede dei recettori particolari
(i nocicettori) costituiti da terminazioni
nervose che hanno il ruolo di informare
preventivamente l’organismo su eventuali
attacchi. Essi sono distribuiti in tutto il
corpo (pelle, muscoli, articolazioni, viscere)
ad eccezione del cervello, che è invece
protetto da membrane estremamente sensibili, le meningi.
La nocicezione può essere considerata un
senso, come la visione o l’olfatto, ma contrariamente agli altri sensi essa fa intervenire un largo spettro di meccanismi di
transduzione. Sono infatti innumerevoli e
diversi fra loro i segnali del mondo esterno
che devono essere captati dalle vie del
dolore. I nocicettori hanno la particolare
caratteristica di essere sensibili sia a stimoli fisici, come ad esempio un’intensa
pressione o a delle temperature nocive
per l’organismo, sia a stimoli chimici,
come certe sostanze pericolose. I diversi
meccanismi di transduzione permettono
di trasformare questi diversi segnali in
impulsi bioelettrici che giungono fino al
cervello. L’attività dei nocicettori e di conseguenza la sensazione dolorosa, deve
essere percepita coscientemente solo in
caso di lesione, l’organismo deve poter
differenziare gli stimoli che rappresentano
un pericolo da quelli inoffensivi, come una
carezza o il calore di un raggio di sole.
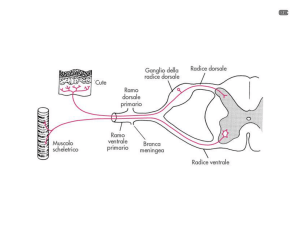
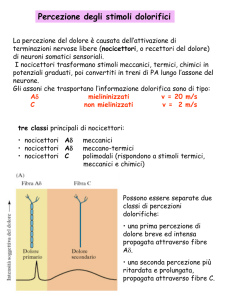
I DIFFERENTI TIPI DI NOCICETTORI
Lo spettro degli stimoli dolorosi che percepiamo è vasto, di conseguenza esistono
differenti tipi di nocicettori. Essi si distinguono sulla base della loro localizzazione
(viscere o pelle, muscoli o articolazioni) e
sul tipo di stimolo doloroso che li attiva.
Nella pelle, le fibre sensoriali responsabili
della nocicezione si suddividono in funzione di due parametri cruciali che determinano la velocità di conduzione del
segnale elettrico: il diametro della fibra
CONTACT
The European Dana Alliance for the Brain
Centre de Neurosciences Psychiatriques
Dép. Universitaire de Psychiatrie – CHUV
Site de Cery
CH-1008 Prilly / Lausanne
Tel.: +41 21 643 6948
Fax: +41 21 643 6950
[email protected]
www.unil.ch / edab
The European Dana Alliance for the Brain
165 Queen’s Gate
London SW7 5HE, UK
Tel.: +44 20 7019 4911
Fax: +44 20 7019 4919
[email protected]
www.edab.net
The European Dana Alliance for the Brain is an alliance of 140 eminent scientists that promotes the
importance of brain research.
1
EuroBrain Vol. 5, N. 1 – Giugno 2004
La percezione del dolore
nervosa e lo spessore della mielina che
l’avvolge. I nocicettori sono le terminazioni libere delle fibre sensoriali di piccolo
diametro, da debolmente mielinizzate, fino
a non mielinizzate, che si suddividono in
fibre Aδ e C. Le fibre C che segnalano
al cervello un dolore persistente, sordo,
hanno un diametro più piccolo e una velocità di conduzione più bassa (meno di
2 m/sec), le fibre Aδ sono un po’ più rapide
(fino a 30 m/sec) e conducono la sensazione di dolore intenso generata da uno
stimolo acuto. Paragonate alle informazioni che provengono da altri neuroni del
tatto, la cui velocità di trasmissione può
raggiungere 100 m/sec, le informazioni
legate al dolore si spostano più lentamente. Come per tutte le fibre sensoriali,
l’informazione che arriva dai nocicettori
non è inviata direttamente al cervello,
ma lo raggiunge per tappe successive: le
fibre passano infatti dapprima attraverso
un primo relè a livello del midollo spinale,
poi un secondo a livello del talamo, una
specie di centro di ridistribuzione e di analisi delle fibre sensoriali, per arrivare in
differenti zone della corteccia cerebrale
dove il dolore è interpretato coscientemente dall’organismo.
lese. Si osserva inoltre una risposta più
vivace dei neuroni del midollo spinale, che
contribuisce ad aumentare l’ipersensibilità
locale dell’organismo.
La ricerca medica s’interessa da vicino ai
meccanismi molecolari responsabili dell’attività dei nocicettori, per poterli manipolare a fini terapeutici. Il fatto che i nocicettori siano polimodali, cioè attivabili da
stimoli di natura differente, complica il
lavoro dei ricercatori e costituisce un problema cruciale per le cure palliative. Gli
anestetici locali inibiscono globalmente
tutti i tipi di recettori sensoriali, e se è vero
che un anestetico allevia il dolore, esso
blocca completamente l’informazione sensoriale periferica esponendo l’organismo
ad ogni sorta di pericolo. Attualmente i
ricercatori studiano la possibilità di dissociare i meccanismi molecolari che attivano
i nocicettori in caso di ustione da quelli
attivati da una pressione intensa o da
sostanze chimiche nocive, così da intervenire in modo selettivo.
DAL PEPERONCINO AI TERMORECETTORI
Nell’ambito della ricerca sui termo-nocicettori, un primo passo decisivo è stato
realizzato nel 1997 da David Julius e i suoi
collaboratori. Intrigati dalla sensazione
di bruciore che si percepisce quando si
mangia del cibo piccante, i ricercatori
si sono domandati se la capsaicina, la
molecola responsabile dell’aggressione
chimica percepita dai nocicettori, aveva
la capacità di attivare lo stesso tipo di
recettore che risponde agli stimoli caldi.
I ricercatori hanno identificato il tipo di
recettore che lega la capsaicina, il recettore vanilloide (VR1), di cui hanno verificato l’attivazione anche dalle alte temperature***. Questo recettore, fa parte
della più vasta famiglia dei canali ionici
chiamati TRP (transient receptor potential), ed è quindi stato ribattezzato TRPV.
PER QUALE RAGIONE IL DOLORE
È AMPLIFICATO IN CASO DI FERITA
Quando il tessuto di un organismo si ferisce, le proprietà dei nocicettori sono
modificate. La zona d’infiammazione diventa
ipersensibile e gli stimoli normalmente
inoffensivi sono percepiti come un’aggressione dolorosa; tale fenomeno è conosciuto come iperestesia. Questo spiega
perché quando si applica anche solo
una compressa tiepida sulla piaga di un
paziente, essa può scatenare un dolore
acuto. L’abbassamento della soglia d’attivazione dei nocicettori è modulato dalle
sostanze chimiche liberate dalle cellule
2
EuroBrain Vol. 5, N. 1 – Giugno 2004
e della temperatura
L’ILLUSIONE DELLA GRIGLIA TERMICA
Nel 1986, un fisiologo danese, T. Thunberg, ha evidenziato una curiosa illusione tattile legata alla termorecezione: quando il palmo della mano entra
in contatto con una griglia formata da barre tiepide e fredde poste in alternanza, si percepisce una sensazione di bruciore, che non si avverte se le
barre sono presentate ad un’unica e identica temperatura, sia fredda che
tiepida. Questo fenomeno è stato spiegato solo di recente da alcuni ricercatori che hanno osservato come l’organismo distingue difficilmente tra uno
stimolo di bruciore e uno stimolo inferiore a 15°C, entrambi sono percepiti
come una bruciatura. Nei due casi sono le medesime fibre nocicettive ad
essere attivate, che si attivano anche quando la griglia bimodale entra in
contatto con la mano, da cui il dolore anche se le temperature sono innocue
per l’organismo. In effetti, sono messi in azione tre tipi di cellule: i termorecettori attivati dalle barre tiepide, quelli messi in azione dalle barre fredde
e i nocicettori che provocano il dolore. Tutte queste informazioni sono
integrate a livello del midollo spinale e poi inviate al cervello. Quando la
temperatura della griglia presenta una sola temperatura e non pericolosa
per l’organismo, è attivato un solo tipo di termorecettore, apparentemente
questo inibisce o maschera l’attività dei nocicettori a livello del midollo
spinale. Al contrario se si toccano contemporaneamente degli oggetti tiepidi
e altri freddi, l’attivazione dei due tipi di termorecettori, è interpretata come
una situazione pericolosa dai neuroni del midollo spinale. L’attività dei nocicettori cessa di essere inibita, diventa percepibile ed assume la forma di
un’illusione di ustione.
I ricercatori hanno notato che il meccanismo di transduzione attivato dalla capsaicina è identico a quello messo in gioco
dalle alte temperature: i canali TRPV1
associati alla membrana in presenza di
capsaicina o di alte temperature si aprono
e lasciano penetrare una corrente che
depolarizza il neurone, questo genera un
segnale elettrico che si propaga fino al
cervello. I recettori TRPV1 funzionano
come una sorta di termometro molecolare,
attivando il nocicettore quando lo stimolo
termico oltrepassa i 43°C.
I nocicettori provvisti di recettori TRPV1
rappresentano più della metà di tutti i
nocicettori e sono sensibili alla capsaicina
e a degli stimoli moderatamente caldi.
Quando la temperatura oltrepassa i 52°C,
si attiva una popolazione supplementare
di nocicettori: questa seconda classe di
recettori contrariamente ai TRPV1, reagisce unicamente alle temperature elevate
e non alla capsaicina. Inizialmente chiamati vanilloid receptor-like (VRL-1), hanno
una struttura molto simile a quella dei
TRPV1 e appartengono alla medesima
famiglia di canali, la differenza principale
è che non sono attivati dalla capsaicina.
***Per dimostrare quest’ipotesi i ricercatori hanno
modificato il gene che codifica per la VR1 così da
ottenere dei topi che non esprimono il recettore
corrispondente. Essi hanno costatato che i topi
erano sensibili a delle temperature di oltre 50°C,
ma insensibili a temperature inferiori che nel topo
normale provocano una risposta. Questo lascia
supporre l’esistenza di un altro tipo di nocicettore
sensibile alle temperature più elevate.
3
Questi recettori sono stati in seguito denominati canali TRPV2.
LA SENSAZIONE DI FRESCHEZZA DEL
MENTOLO
I risultati ottenuti con il peperoncino
hanno incoraggiato i ricercatori ad adattare il loro metodo per identificare i recettori specifici al freddo. La sensazione di
freschezza di una caramella al mentolo è
familiare a tutti; nel 2002 Julius e il suo
gruppo hanno dimostrato che i recettori
attivati dal mentolo erano gli stessi messi
in gioco da una temperatura inferiore a
15°C. I ricercatori li hanno dapprima denominati recettori al freddo e al mentolo
(CMR1), poiché questi recettori appartengono alla famiglia dei canali TRP, sono
EuroBrain Vol. 5, N. 1 – Giugno 2004
stati in seguito battezzati recettori TRPM8.
Una temperatura di 15° C è la soglia
approssimativa per attivare le vie del
dolore che corrispondono alle basse temperature. Questo limite è più soggettivo
rispetto agli stimoli caldi, infatti tutti qualificano come bollente una doccia di oltre
47°C, mentre molte persone non fanno
fatica a sopportare l’acqua a 15°C. Fisiologicamente parlando, questa differenza si
spiega dal fatto che tutte le cellule provviste del recettore VR1 sono attivate quando
la temperatura oltrepassa i 43°C, mentre
la soglia d’attivazione delle cellule provviste di recettori TRPM8 è più variabile e
si situa tra gli 8°C e i 30°C. Vista la gran
variabilità diventa difficile distinguere tra
queste fibre i termorecettori che reagi-
scono a degli stimoli inoffensivi per l’organismo, dai nocicettori che devono proteggerli da un freddo dannoso. Inoltre solo
una piccola proporzione delle fibre Aδ e C
è provvista di recettori TRPM8, mentre un
gran numero di queste fibre è attivato
quando la temperatura scende sotto lo
zero. Questa osservazione suggerisce
l’esistenza di un meccanismo di transduzione specifico per le temperature molto
fredde. Recentemente è stato scoperto
nei neuroni nocicettori un nuovo canale
recettore chiamato ANKTM1 che reagisce apparentemente a delle temperature
pericolosamente basse per l’organismo.
La sensazione di bruciore che si percepisce toccando dei ghiaccioli potrebbe
essere consecutiva al fatto che il freddo
4
estremo attiva questo tipo di canali nei
neuroni nocicettori.
COME DISTINGUERE IL FREDDO
INOFFENSIVO DA QUELLO NOCIVO?
Circa la metà dei neuroni termorecettori
provvisti di TRPM8 sono dotati del TRPV1;
questa strana scoperta dimostra che un
numero non trascurabile di termorecettori
è attivato sia dal caldo che dal freddo.
È noto che l’attivazione dei nocicettori si
traduce, indipendente dalla natura dello
stimolo (capsaicina, caldo, freddo), con
una sensazione dolorosa. Allo stesso modo,
ogni eccitazione dei recettori al freddo
inoffensivo evoca una sensazione di freschezza, indipendentemente dallo stimolo
utilizzato. La questione posta attualmente
EuroBrain Vol. 2, N° 3 – décembre 2000
Carlos Belmonte
EuroBrain Vol. 5, N. 1 – Giugno 2004
dai ricercatori è la seguente: se le fibre
nocicettive e le fibre termosensibili sono
attivate sia da stimoli caldi sia freddi, per
quale ragione si percepisce il dolore in
un caso ma non nell’altro? La risposta è
probabilmente collegata ai differenti gradi
d’attivazione dei diversi neuroni: quando
si tocca un oggetto molto caldo, la frequenza dei segnali inviati dalle fibre nocicettive è più elevata rispetto a quando
sono attivate da un freddo nocivo. A
questo si aggiunge che molte fibre sensibili al freddo inoffensivo sono quiescenti;
tale modello d’attività è interpretato dal
cervello come una sensazione dolorosa.
Quando le variazioni di temperatura sono
leggere, solo le fibre sensibili al freddo
inoffensivo sono attivate, la sensazione
esperita è allora quella della freschezza.
In effetti, se la febbre provoca una sensazione di freddo è senza dubbio perché
eccita i recettori TRPV1 delle fibre sensibili al freddo. Un’altra pista emergente
rinforzata dal modello della griglia termica
(vedi riquadro), ha come base l’integrazione a livello del midollo spinale dei
segnali che provengono dai differenti tipi
di fibre sensoriali. Secondo quest’ipotesi
le fibre sensibili al freddo inoffensivo inibiscono l’azione dei nocicettori quando si
toccano degli oggetti freschi. Un’osservazione clinica convalida quest’ipotesi: in
caso di lesione delle fibre Aδ, solo i recettori polimodali di tipo C (muniti di due tipi
di recettori) sono capaci di trasmettere
l’informazione e il paziente percepisce
una viva sensazione di bruciatura quando
la sua pelle è messa in contatto con una
compressa fresca.
tori non corrisponda ad una temperatura
precisa, lascia supporre che il meccanismo di transduzione del freddo sia un
fenomeno più complesso della semplice
attivazione di un particolare recettore.
Belmonte, Viana e il loro gruppo di Alicante hanno mostrato nel 2002 che la
risposta dei recettori al freddo mette in
gioco una costellazione di canali ionici
la cui espressione, la densità e l’attivazione sono specifiche ai termorecettori al
freddo. Gli scienziati hanno messo in coltura dei neuroni sensoriali primari di topo
e studiando il profilo spazio-temporale
dei movimenti di calcio intracellulare
hanno potuto identificare i neuroni sensibili ad un abbassamento della temperatura. È noto, infatti, che quando i neuroni
emettono degli impulsi nervosi, i canali
permeabili al calcio si aprono e la concentrazione intracellulare di questo ione
aumenta. Viana e Belmonte hanno verificato che i neuroni sensibili al freddo fossero sensibili al mentolo, costatando che
quasi la metà delle cellule studiate rispondeva anche alla capsaicina. Essi hanno
notato inoltre che era possibile classificare i neuroni sensibili al freddo in due
categorie secondo l’intensità del freddo,
ciascuna delle quali aveva un largo spettro di temperature di attivazione.
Una volta identificate le fibre interessanti, i ricercatori hanno studiato con
dei metodi elettrofisiologici il segnale
prodotto dai neuroni all’abbassamento
della temperatura. Sono stati tracciati due
modelli. I neuroni sensibili a delle temperature moderatamente basse si depolarizzano rapidamente ed emettono una scarica di potenziali d’azione, alcuni tra loro,
il cui potenziale di membrana è oscillante,
generano delle scariche di potenziali
d’azione a ripetizione. La frequenza è
strettamente correlata con l’intensità e
la rapidità dell’abbassamento di temperatura. La tappa successiva consisteva nel
LA SITUAZIONE DIVENTA
PIÙ COMPLESSA
Anche se la scoperta dei recettori TRPM8
ha permesso di identificare una categoria
di neuroni sensoriali sensibili al freddo, il
fatto che la soglia di attivazione dei recet-
5
EuroBrain Vol. 5, N. 1 – Giugno 2004
confrontare queste risposte con quelle
dei neuroni insensibili al freddo e di identificare i canali ionici specifici unicamente ai neuroni sensibili al freddo.
Quando una cellula è a riposo, è permeabile al potassio: i canali potassici della
sua membrana sono aperti e gli ioni sono
liberi di spostarsi, seguendo i gradienti
fisicochimici, dall’interno verso l’esterno
della cellula e viceversa. Viana e Belmonte, hanno dimostrato che i neuroni
sensibili al freddo reagiscono alle basse
temperature chiudendo una parte dei
loro canali potassici, questo depolarizza
la cellula e la porta rapidamente a generare un segnale elettrico. Probabilmente
tale depolarizzazione si aggiunge a quella
generata dall’apertura dei TRPM8 sotto
l’effetto del freddo. A priori, tutte le fibre
sensoriali hanno dei canali potassici e
dovrebbero dunque rispondere al freddo.
Belmonte e Viana hanno scoperto che i
neuroni insensibili al freddo avevano oltre
ai normali canali potassici, un altro tipo
di canali denominati IKD, che dipendono
dal potenziale di membrana e sono poco
numerosi sui neuroni sensibili al freddo.
Questi canali IKD avrebbero la tendenza a
controbilanciare l’effetto depolarizzante
del freddo e opporsi in questo modo alle
conseguenze delle basse temperature.
Per confermare quest’ipotesi Belmonte
e Viana hanno avuto l’ingegnosa idea di
bloccare i canali IKD per impedire che la
corrente di potassio mantenesse il potenziale di membrana a livello di riposo con le
basse temperature. Come ci si attendeva,
i neuroni in precedenza insensibili al
freddo sono diventati sensibili. Questo
dimostra che il meccanismo di transduzione al freddo emerge dall’espressione
o, piuttosto, dalla non espressione dei
canali ionici della membrana dei neuroni
influenzata dal freddo. Viana e Belmonte
hanno anche ipotizzato che la temperatura legata alla soglia d’attivazione
della cellula potrebbe essere modulata
secondo la densità di questi due tipi di
canali della membrana. Resta ancora
molto da fare per chiarire i dettagli di
questo complesso meccanismo, la tappa
seguente consisterà nel determinare il
ruolo dei canali TRPM8, dei ANKTM1 e i
canali potassici non specifici nella sensibilità dei neuroni sensoriali che rilevano le
basse temperature inoffensive e nocive.
Editorial Board:
Pierre J. Magistretti, Chairman,
Colin Blakemore, Leslie Iversen,
Wolf Singer, Piergiorgio Strata,
Jacques Glowinski,
Norbert Herschkowitz
Production Manager:
Béatrice Roth
Contributing Editor:
Elaine Snell
A Dana Alliance for the Brain Inc
Newsletter prepared by EDAB,
the European subsidiary of DABI
Chairman
William Safire
Vice Chairmen
Colin Blakemore, PhD, ScD, FRS
Pierre J. Magistretti, MD, PhD
President
Edward F. Rover
Executive Committee
Carlos Belmonte, MD, PhD
Anders Björklund, MD, PhD
Joël Bockaert, PhD
Albert Gjedde, MD, FRSC
Sten Grillner, MD, PhD
Malgorzata Kossut, MSc, PhD
Richard Morris, DPhil, FRSE, FRS
Dominique Poulain, MD, DSc
Wolf Singer, MD, PhD
Piergiorgio Strata, MD, PhD
Eva Syková, MD, PhD, DSc
Dana Alliance
for Brain Initiatives (DABI) – US
Mélanie Aeschlimann, PhD
Losanna, CH
6
European Dana Alliance for the Brain Limited
Registered Office: 165 Queen Victoria Street,
London EC4V 4DD
Registered in England: 3532108