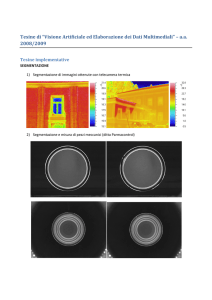
Università degli Studi di Napoli “Federico II”
Scuola Politecnica e delle Scienze di Base
Area Didattica di Scienze Matematiche Fisiche e
Naturali
Dipartimento di Ingegneria Elettrica e Tecnologie
dell'Informazione
Laurea Triennale in Informatica
Progettazione e sviluppo di un algoritmo
per la segmentazione di immagini MRI
basato sull’entropia
(Design and development of an algorithm for the
MRI images segmentation based on entropy)
Relatore:
Candidato:
Dott. Daniel Riccio
Ivan Giuseppe Larenza
Matricola N86/669
A.A. 2013/2014
Sommario
Introduzione………………………………………………………………………………………...
3
Capitolo 1: Un indagine sull’analisi di immagini mediche MRI per lo studio
del tumore al cervello…………………………………………………………………………..... 4
1.1 Tumore al cervello……………………………………………………………………………………….
4
1.2 Immagini di tumore al cervello………………………………………………………………….....
5
1.3 Analisi d’immagine dei tumori cerebrali………………………………………………………
7
1.4 Metodi e risultati…………………………………………………………………………………………
9
1.4.1 Metodi di valutazione e validazione……………………………………………………..
9
1.4.2 Immagini di segmentazione del tumore al cervello…………………………….....
10
1.4.3 Pre-elaborazione dell’immagine…………………………………………………………..
11
1.4.4 Caratteristiche estratte da un’immagine ai fini della segmentazione……..... 12
1.5 Algoritmi di segmentazione………………………………………………………………………….
13
1.5.1 Metodi region-based o edge-based……………………………………………………….
13
1.5.2 Classificazione e clustering…………………………………………………………………..
14
1.5.3 Classificazione e clustering con contrasto addizionale…………………………..
16
Capitolo 2: Tecniche per segmentazioni di immagini mediche…………………. 20
2.1Fuzzy clustering spaziale integrato con metodo level set per segmentazione
automatica di immagini mediche……………………………………………………………………....
20
2.1.2 Fuzzy clustering spaziale e segmentazione di immagini………………………… 22
2.1.3 Segmentazione level set……………………………………………………………………….
24
2.1.4 Una variazione all’ algoritmo fuzzy level set………………………………………....
26
2.1.5 Alcuni Risultati…………………………………………………………………………………….
30
2.2 Estrazione del glioma 3D completamente automatico in MRI multi-contrasto…
33
2.2.1 Metodo su simmetria sagittale……………………………………………………………... 34
2.2.2 Localizzazione del tumore…………………………………………………………………… 35
1
2.2.3 Estrazione del tumore…………………………………………………………………………
37
2.2.4 Risultati………………………………………………………………………………………………
37
Capitolo 3: L’entropia come strumento per clustering di oggetti…………….. 40
3.1 Le basi dell’analisi proposta…………………………………………………………………………
41
3.2 Utilizzo dell’entropia come strumento di selezione di oggetti rappresentativi
da un insieme più ampio di oggetti…………………………………………………………………….. 43
3.3 Definizione della misura di similarità tra pixel……………………………………………… 46
3.4 Processo di estrazione della massa tumorale da immagini MRI……………………… 53
Capitolo 4: Esperimenti e risultati…………………………………………………………. 55
4.1 Criterio di valutazione………………………………………………………………………………….
56
4.2 Risultati ottenuti dall’algoritmo di clustering basato sull’entropia………………….. 56
4.3 Confronto con l’algoritmo basato sulla simmetria………………………………………….
63
4.4 Confronto con l’algoritmo basato sul fuzzy clustering con metodi level set……… 64
Bibliografia…………………………………………………………………………………………… 65
Ringraziamenti……………………………………………………………………………………… 82
2
Introduzione
Questo lavoro di tesi si pone come obiettivo l’analisi delle potenzialità dell’entropia
come caratteristica per l’identificazione della presenza di massa tumorale in un
immagine medica e propone lo sviluppo di un algoritmo finalizzato alla localizzazione
del tumore nella regione del cervello tramite lo studio morfologico della massa
tumorale. Nello specifico, il caso di studio è orientato all’ambito della distinzione della
massa tumorale del cervello nei pazienti. Per tale motivo, il lavoro è stato condotto su
immagini mediche di risonanze magnetiche del cervello. L’entropia offre diversi
vantaggi rispetto ad altre tecniche di segmentazione di immagini mediche. Motivo per
cui si è deciso di studiare l’efficacia dell’entropia, in un contesto in cui le sue potenzialità
non sono state ancora completamente esplorate.
La tesi è strutturata nel seguente modo:
Il primo capitolo è dedicato alla descrizione dell’analisi e della segmentazione di
immagini mediche, in particolare, tali immagini, riguardano la risonanza magnetica
del cervello, al fine di introdurre l’ambito generale, in cui si colloca l’argomento
trattato.
Nel secondo capitolo vengono approfondite due delle tecniche presenti in letteratura
relative alla segmentazione di immagini mediche, la prima tecnica utilizza il fuzzy
clustering spaziale unito a metodi level set, la seconda, invece, sfrutta la simmetria del
cervello ai fini della segmentazione di immagini.
Il terzo capitolo descrive l’algoritmo di clustering proposto, che è basato sull’entropia
come possibile strumento per la segmentazione di immagini di risonanza magnetica
del cervello in pazienti con gliomi.
Infine il quarto capitolo presenta i risultati ottenuti dall’algoritmo di clustering basato
sull’entropia e li confronta con quelli forniti dagli algoritmi presentati nel secondo
capitolo.
3
Capitolo 1
Un indagine sull’analisi di immagini mediche
MRI per lo studio del tumore al cervello
1.1 Tumore al cervello:
Con una diffusione di meno dell’1 %, nella popolazione occidentale, il tumore al cervello
non è molto comune. tuttavia, questo è tra i cancri più mortali. Un recente studio
condotto negli US sul tasso di frequenza di tumori primari al cervello o al sistema
nervoso ha evidenziato che esso è di circa 25 per 100000 adulti con un’approssimazione
di un terzo dei tumori diventati maligni e i restanti benigni oppure con tendenza a
diventare maligni, Kohler et al [52].
La parola tumore deriva dal latino è significa crescita. Tutt’oggi, è frequentemente
associata a neoplasie, ed è causato da un proliferarsi incontrollato di cellule.
Il tumore al cervello può essere classificato a seconda dell’origine o al grado di
aggressività. Il tumore primario si presenta nel cervello, mentre tumori al cervello
metastatici spesso nascono da altre parti del corpo. Lo schema di classificazione più
ampiamente usato oggi è stato introdotto dalla Word Health Organization (WHO). Il
tumore al cervello si classifica in gradi I-IV con l’incremento dell’aggressività, Kleihues et
al [50].
I Gliomi sono i tumori al cervello primari più frequenti negli adulti e rappresentano il
70% dei tumori primari maligni al cervello per gli adulti. Essi si originano dalle cellule
gliali e possono essere classificati in quattro gradi WHO, dove i gradi più alti di glioma
sono il III e IV. I gradi I e II possono essere considerati tumori semi-maligni che portano
una prognosi migliore, mentre gradi di tumore III e IV sono tumori maligni che portano
quasi certamente ad una morte del soggetto. Il IV grado WHO dei gliomi è anche
chiamato glioblastoma multiforme (GBM), ed è fra i tumori maligni più comuni al
cervello negli esseri umani, esibendo una crescita molto rapida, Deimling [22].
4
Questi tumori sono infiltrativi e si diffondono quasi del tutto lungo i tratti delle fibre
della materia bianca, Giese et al [35], formando un contenitore anormale con un nocciolo
necrotico. Riguardo all’angiogenesi, la conoscenza attuale si basa sul fatto che i gliomi di
basso grado sono tumori moderatamente vascolarizzati, mentre i gliomi di alto grado
mostrano una prominente proliferazione microvascolare e aree di alta densità vascolare.
Il tempo medio di sopravvivenza per un soggetto con GBM è di circa un anno, Krex et al
[53]. Alcuni trattamenti opzionali per i gliomi includono l’intervento chirurgico, la
radioterapia o la chemioterapia, o una combinazione di questi.
I meningiomi sono le neoplasie più comuni intracraniche extra-assiali. Rappresentano il
15-20% delle neoplasie intracraniche. Ci sono neoplasie non-gliali che nascono da
cellule aracnoidee di meningi. Il trattamento di solito consiste nell’intervento chirurgico
e/o radioterapia, Greenberg et al [36].
Il tumore primario al cervello deve essere distinto dal tumore metastatico al cervello,
che nasce più frequentemente dal cancro al polmone, al seno, dal melanoma, dal rene o
dal colon e rappresenta approssimativamente il 40% delle neoplasie intercraniche.
1.2 Immagini di tumore al cervello
La tecnica standard per diagnosticare il tumore al cervello è la risonanza magnetica o
Magnetic Resonance Imaging (MRI), De Angelis, Wen et al [21,99]. La MRI è una tecnica
non invasiva che fornisce un buon contrasto dei tessuti molli ed è in larga parte
disponibile in cliniche e/o ospedali. Essa è usata in combinazione con altre modalità di
diagnostica per immagini, come la tomografia (CT), la tomografia ad emissione di
positroni (PET) e la risonanza magnetica spettroscopica (MRS), le quali forniscono una
più precisa informazione circa la morfologia e il metabolismo del tumore. In particolare
le immagini PET possono fornire utili informazioni aggiuntive, Chen [11].
La MRI rende possibile produrre marcatamente differenti tipi di contrasto del tessuto
variando l’eccitazione e tempi di ripetizione; questo la rende uno strumento molto
versatile per le immagini delle diverse strutture d’interesse. A causa della natura e
dell’aspetto del tumore al cervello, una sequenza di MRI non è sufficiente per
segmentare completamente il tumore includendo tutte le sottoregioni. Nella routine
5
clinica attuale, differenti sequenze di MRI sono impiegate per le diagnosi e le
delineazioni delle componenti del tumore. Questa sequenza include T1-pesato con
miglioramento del contrasto (T1c), , T2-pesato (T2) e T2-pesato con recupero inverso
di fluido-attenuato (T2flair). Va sottolineato, inoltre, che i parametri di acquisizione di
queste modalità non sono standardizzati. I pazienti con gliomi sono generalmente
esaminati mediante un protocollo d’immagine MR che segue la risposta valutata nelle
linea guida in neuro-oncologia (RANO) con una slice con spessore di <= 5 mm senza
spazi tra le slice, Pope and Hessel [73].
Per lo studio della volumetria vengono generati volumi 3D di immagini con alta
risoluzione, includendo almeno le immagini di T1-pesato con contrasto migliorato con
risoluzione isotropica. La Figura 1 mostra una slice assiale in quattro sequenze standard
per un paziente con glioma tra cui un disegno manuale della regione del tumore.
Figura 1: Una slice assiale di un’imagine MR di un paziente con glioma di alto grado. Da sinistra a destra:
immagine T1- pesato, immagine T1-pesato con miglioramento del contrasto,immagine T2-pesato, immagine T2FLAIR
pesato e segmentazione manuale di componenti del tumore in necrotico (giallo), attivo (verde), edema (viola). Le
regioni di necrosi e tumore attivo sono segmentati basandosi sull’immagine T1-pesato con miglioramento del
contrasto, mentre la regione dell’edema è segmentata basandosi sull’immagine T2FLAIR pesata.
T1-pesato è la sequenza usata più comunemente per l'analisi strutturale. Essa permette
anche una facile annotazione dei tessuti sani. Nell’immagine T1-pesato con
miglioramento del contrasto (gadolinium-DTPA), i bordi del tumore appaiono più
luminosi perché il mezzo di contrasto si accumula lì a causa della perturbazione della
barriere del sangue encefalico nella proliferazione della regione del tumore. In questa
sequenza, possono essere distinti facilmente il necrotico e la regione del tumore attivo.
In T2-pesato MRI, la regione dell’edema, che circonda il tumore appare luminoso. T2flair
è una sequenza speciale, che aiuta nella separazione della regione dell’edema dal fluido
cerebrospinale (CSF) perché il segnale d’acqua libero viene soppresso. La definizione
radiologica dei margini del tumore nel contesto clinico è spesso determinata
6
manualmente dal radiologo sulle immagini T2 e T1 post-gadolinium e con thresholding
su T2 iperintesa/T1 con contrasto migliorato per separare le lesioni dal circostante
tessuto sano. Le Misure cliniche di un tumore tradizionalmente includono il prodotto
dell’asse maggiore e minore (2D misura) o dei tre assi principali di un tumore (misura
3D).
Nonostante tutti i vantaggi che l’immagine non invasiva offre, va notato che una diagnosi
finale può essere fatta solo dopo una biopsia e un esame istologico. Deve anche essere
evidenziato che nei gliomi, a differenza dei tumori al cervello metastatici, il componente
rappresentabile tramite le immagini del tumore è solo una parte della completa
estensione del tumore. Questa componente e le informazioni fisiologiche del tumore
dipendono dalla distribuzione delle cellule tumorali e dalla modalità d’immagine, Kelly
et al, Tovi [46,87].
1.3 Analisi d’immagini dei tumori cerebrali
L’analisi delle immagini acquisite con metodi automatici o semiautomatici permettono
di interpretarne il contenuto. A causa dei molteplici dati, che sono al momento generati
nelle cliniche, non è possibile annotare manualmente e segmentare i dati in un tempo
ragionevole. Spesso, il dominio dell’analisi dell’immagine medica è diviso in
segmentazione e registrazione, cosi come diverse altre aree, quali il miglioramento, la
visualizzazione, la quantificazione e la modellazione. Per lo studio del tumore al cervello,
segmentazione, registrazione e modellazione sembrano essere più importanti e più
impegnativi.
La segmentazione di una immagine mira al partizionamento dell’immagine in diversi
segmenti, Pham et al [70].
Questi segmenti possono essere scelti secondo le strutture di interesse, i tipi di tessuti, e
le aree funzionali, etc. Balafar et al [5]. La registrazione dell’immagine mira ad allineare
2 diverse immagini in un comune spazio di riferimento. Questo è particolarmente
importante per allineare le immagini prese da diversi punti nel tempo durante gli studi
longitudinali,
per allineare immagini ottenute da diversi modalità per uno stesso
paziente, o per la morfometria cerebrale. Infine, la modellazione basata su immagini e
7
simulazione può aiutare nella comprensione della malattia, nella pianificazione del
trattamento e del processo decisionale.
Il principale uso dell’analisi delle immagini mediche MRI per lo studio del tumore al
cervello è usata nella diagnosi, nel monitoraggio del paziente e nella pianificazione del
trattamento, ma potrebbe anche essere utile nei test clinici. La segmentazione è cruciale
per il monitoraggio della crescita o restringimento del tumore in un paziente durante la
terapia e per valutare le misure del volume del tumore. Essa gioca anche un ruolo
importante nella pianificazione chirurgica o radioterapica, dove non solo il tumore deve
essere tracciato, ma anche le strutture sane circostanti sono di interesse. Nella corrente
pratica clinica, la segmentazione spesso è fatta ancora manualmente, il che richiede
molto tempo e e risulta tedioso per i radiologi, oltre ad essere anche di scarso uso per un
analisi quantitativa oggettiva.
Sebbene i gliomi di alto grado non sono i cancri più comuni, essi sono fra i più mortali.
Nuove terapie hanno migliorato le prognosi dei pazienti e nuove progettazioni di test
clinici hanno acquisito ulteriore importanza per approfondire il comportamento dei
gliomi a seguito di diversi regimi di trattamento. Risulta quindi dovuta una più accurata
descrizione dei cambiamenti fisiologici e della dimensione del tumore. Per molti anni, la
risposta al trattamento dei gliomi è stata valutata a partire da immagini MR e CT. È
disponibile un set di linee guida, solitamente riferito ai criteri Macdonald, Macdonald et
al [59], per monitorare la valutazione della risposta del tumore al trattamento. Questi
criteri includono i cambiamenti nella dimensione del tumore. In ogni caso, secondo
Clarke and Chang [13], questo approccio mostra diversi limiti importanti. Anche se il
criterio Macdonald rappresenta un importante step nella ricerca in neuro-oncologia, è
chiaro che la valutazione del solo miglioramento del
gadolinio non è adeguato a
caratterizzare la crescita del tumore o la sua risposta. Il gruppo di lavoro RANO ha
definito nuovi criteri per la progressione del tumore dipendenti dalle lesioni misurabili
o non misurabili in almeno due direzioni, Wen et al [99]. La valutazione automatica delle
dimensioni 3D dei gliomi rappresenterebbe un importante step in avanti per meglio
capire le dinamiche del tumore e la risposta al trattamento.
8
1.4 Metodi e risultati
1.4.1 Metodi di valutazione e validazione
La validazione e il confronto con lo stato dell’arte è cruciale per qualsiasi nuovo metodo
di sviluppo, ma prima di immergersi nella presentazione di diversi approcci, si discutono
brevemente le possibilità e le sfide per i metodi di valutazione e validazione nell’analisi
dell’immagine del tumore al cervello. Sarebbe ottimale confrontare alcuni metodi su casi
reali, poiché pur trattandosi di una grossa sfida in questo campo, non è impossibile. In
assenza di un ground truth ufficialmente riconosciuto, il corrente gold standard test per
la valutazione consiste nel confrontare i risultati con la segmentazione manuale di un
esperto, che tuttavia non è oggettiva. Un più soggettivo modo usato occasionalmente è
quello di sviluppare una segmentazione semi-automatica con un metodo diverso ben
accetto come un risultato intermedio, che è manualmente corretto da un esperto umano
dove necessario. Questo approccio manca ancora in oggettività, ma attenua il carico
dello specialista nel dover spendere una grande quantità di tempo per la segmentazione.
Un’altra possibilità per una prima valutazione da parte del medico è valutare il risultato
su un dataset sintetico includendo un ground truth. Sebbene i dati sintetici mancano di
importanti caratteristiche delle immagini reali, sono stati usati da molti gruppi di
ricercatori per valutare inizialmente entrambi i metodi di segmentazione e registrazione
su dataset corposi come BrainWeb phantoms, Cocosco et al [16]. Per lo studio del
tumore al cervello, in [75] Prastawa et al propongono un approccio simile per offrire
simulazioni multi sequenza di dati di immagini tumorali includendo un ground truth
oggettivo, che è basato sul BrainWeb phantom e combinato con un modello di crescita
del tumore ben definito e accettato.
Il modo più comune per valutare quantitativamente i risultati della segmentazione e la
registrazione è quello di calcolare la sovrapposizione con il ground truth. Spesso, è usato
il coefficiente di somiglianza Dice (DSC) o il coefficiente Jaccard [20]. Il loro range varia
da 0 a 1, dove 0 indica nessun sovrapposizione e 1 indica una perfetta sovrapposizione.
Altre possibilità per la valutazione della registrazione includono la definizione di punti
di riferimento manuale ed il calcolo dell’errore rispetto ai punti di riferimento o della
distanza superficiale. Per una valutazione di tipo prettamente qualitativo, è possibile far
riferimento ad una immagine a scacchiera o all’analisi visiva del contorno della
9
struttura. In Zou et al [104], si riscontrano tre diverse validazioni metriche: l’area sotto
la receiver operating characteristic curve(ROC), la mutua informazione (MI) e DSC per la
segmentazione probabilistica del tumore al cervello. Gli autori concludono che per una
valutazione globale della precisione, l’area sotto la curva ROC rappresenta la misura
migliore. Quando si ha interesse nella sensibilità alle variazioni delle dimensioni del
tumore, MI è la metrica da adottare, mentre
per la valutazione dell’allineamento
spaziale il migliore è il coefficiente Dice.
In assenza di un database di immagini di tumore al cervello corredato di un ground
truth, diffuso e riconosciuto nella comunità di specialisti e ricercatori, i ricercatori
verificano i loro algoritmi su un limitato numero di casi su dataset proprietari. Questo
rende difficile confrontare le prestazioni dei diversi metodi in modo oggettivo. Inoltre, a
causa delle diverse metriche utilizzate, la precisione e la velocità dei singoli metodi,
descritti nelle rispettive pubblicazioni, non possono essere confrontati direttamente.
Finora, il solo dataset disponibile, utilizzato allo scopo di un confronto generale, è stato
quello sintetico proposto da Prastawa et al [75]. Tuttavia, sono pochi i gruppi di ricerca
che lo hanno effettivamente utilizzato.
1.4.2 Immagini di segmentazione del tumore al cervello
La segmentazione di immagini del cervello affette da tumore è un compito impegnativo
per diverse ragioni. Primo, i gliomi di alto grado spesso esibiscono contorni non chiari e
irregolari caratterizzati da discontinuità. L’assorbimento del mezzo di contrasto e il
tempo per l’acquisizione di un immagine dopo l’iniezione del mezzo di contrasto
possono cambiare l’aspetto del tumore significativamente, per cui non c’è un accordo su
come la componente non rappresentabile del tumore dovrebbe essere gestita dagli
algoritmi di segmentazione. Inoltre, le sottoregioni del tumore possono essere separate
solo quando diverse modalità vengono combinate, il che richiede un’accurata
registrazione come lo step di pre-elaborazione. Infine, l’insieme di dati clinici sono
spesso acquisiti in modo altamente anisotropico, portando ad una risoluzione intra-slice
molta più elevata di quella inter-slice. A causa di effetti di volume parziale, questo causa
problemi per la segmentazione, per la registrazione e per il ricampionamento di diverse
modalità in un riferimento di spazio comune. Un diagramma che illustra meglio gli step
10
che compongono la pipeline della segmentazione nella maggior parte degli algoritmi è
mostrata in figura 2.
Figura 2: illustrazione dei principali step che su cui si basano gli algoritmi di segmentazione di immagini.
1.4.3 Pre-elaborazione dell’immagine
La maggior parte degli algoritmi si basano su qualche tipo di pre-elaborazione per la
preparazione dell’immagine e il miglioramento dell’immagine. L’image denoising è un
processo standard della pre-elaborazione per MRI. Fra i diversi approcci suggeriti, i più
popolari sono basati sul filtraggio anisotropico, Weickert [95]. In Diaz et al [25], vengono
analizzati diversi algoritmi di denoising definiti specificatamente per la segmentazione
del tumore al cervello. Gli autori concludono che, anche se il rumore nell’immagine viene
ridotto, molti algoritmi introducono artefatti che hanno un effetto negativo sulla
segmentazione. La normalizzazione dell’intensità è un compito molto critico per la MRI,
specialmente, quando si utilizzano metodi di classificazione per la segmentazione.
Inoltre, tale processo è più impegnativo per le immagini con tumore, che per immagini di
11
cervelli sani, a causa delle distorsioni causate dalla differenza di aspetto del tumore. In
Ekin et al [28], si sviluppa una tecnica di normalizzazione di intensità per MRI robusta e
funzionale anche nel caso di patologie. Alcuni approcci, come quello di Vovk et al [91] ,
sviluppano un campo preventivamente corretto, prima di applicare la segmentazione, in
modo da compensare gli effetti della disomogeneità del campo magnetico durante
l’acquisizione dell’immagine. Quando si opera su immagini multimodali, il preprocessing include sempre la registrazione di tutte le modalità in uno spazio di
riferimento comune. In molti casi, questo si ottiene usando un modello di
trasformazione lineare e adottando la mutua informazione (MI) come metrica di
similarità, Mang et al [61]. Il ricampionamento poi garantisce una corrispondenza voxelto-voxel fra le diverse modalità. La maggior parte degli approcci per la segmentazione
del tumore al cervello si basa su uno step skull-stripping, Fennema-Notetestine et al [30]
prima di eseguire la segmentazione vera e propria. Speier et al [86] recentemente hanno
presentato un metodo basato su skull-stripping per immagini con presenza di glioma,
che è in grado di gestire immagini contenenti cavità di resezione.
1.4.4 Le caratteristiche estratte da un’immagine ai fini della
segmentazione
Le caratteristiche usate per la segmentazione del tumore al cervello in gran parte
dipendono dal tipo di tumore e dal suo grado di sviluppo, perché diversi tipi di tumori e
di differente grado possono variare molto nell’aspetto(assorbimento di contrasto, forma,
regolarità, dislocazione etc). In aggiunta, la selezione delle caratteristiche dipende anche
dal sub-comparto del tumore, che deve essere segmentato. Le caratteristiche usate più
comunemente per la segmentazione del tumore al cervello è l’intensità dei toni di grigio
nell’immagine. Questo si basa sull’assunzione che diversi tessuti hanno diversi livelli di
grigio. Un altro tipo di caratteristica frequentemente usata è la consistenza locale delle
immagini, poiché si è osservato che diverse aree dei tumori esibiscono diversi schemi
strutturali. Le consistenze possono essere calcolate in base a diverse strategie,
Vaidyanathan [88].
Le caratteristiche di allineamento di base fanno uso della conoscenza spaziale
preliminare, che è spesso codificata con la registrazione di un atlante standard per le
12
immagini del paziente o facendo uso della simmetria tra l’emisfero destro e sinistro del
cervello. I gradienti di intensità o caratteristiche edge-based possono essere usate per
l’evoluzione verso un contorno del bordo del tumore.
A seconda dei dati disponibili, tutte queste caratteristiche possono sia essere calcolate
da una singola modalità di immagine, che da immagini acquisite in diverse modalità. I
ricercatori hanno anche combinato diverse caratteristiche estratte da più modalità al
fine di migliorare i risultati della segmentazione.
Per il compito dell’analisi dell’immagine del tumore al cervello, Shmidt et al [83] hanno
considerato diverse caratteristiche nella classificazione voxel-based, concludendo che
combinando strutture e caratteristiche di allineamento di base si consente un notevole
aumento di prestazioni. In [1] Ahmed et al studiano l’efficacia di diverse caratteristiche e
di strategie di fusione di caratteristiche per la segmentazione di tumori al cervello in
immagini pediatriche . Essi spiegano che nelle immagini multi-modali, le caratteristiche
strutturali offrono dei vantaggi rispetto all’intensità o alle caratteristiche date dalla
forma.
1.5 Algoritmi di Segmentazione
Sulla base di quanto detto nel precedente paragrafo, è possibile classificare gli algoritmi
di segmentazione secondo le caratteristiche che essi utilizzano. Sebbene, si faccia
prettamente una distinzione fra metodi region-based/edge-based, che per lo più
sfruttano modelli deformabili, e metodi di classificazioni o clustering, che fanno uso di
intensità voxel-wise e caratteristiche strutturali. Molti metodi addizionali introducono
dei vincoli per la regolarizzazione. Un altro gruppo di metodi è basato sulla
segmentazione atlas-based.
1.5.1 Metodi region-based o edge-based
I modelli deformabili fanno uso di caratteristiche di localizzazione locali o edge based di
immagini. In molti casi, si sviluppa un level set verso la frontiera del tumore ricercando
il più grande gradiente nell’immagine o sfruttando proprietà locali. Le caratteristiche
utilizzate dai singoli metodi sono riassunte nella tabella 1.
13
Tabella 1: alcuni dei metodi di segmentazioni per immagini di tumore al cervello, che usano metodi deformabili o
metodi region-based. Il testing è stato svolto su diversi dataset, mentre le celle vuote indicano che l’informazione non
è disponibile. Nella tabella, Dim sta per dimensionalità, S per supervisione, SA per metodi semiautomatici, FA per
metodi completamente automatici. La colonna Tipi descrive il tipo del tumore, che può essere: G- glioma, HGG- glioma
di grado elevato, LGG- glioma grado basso, M-meningioma, Met- tumore metastatico.
Autori
Modalità
Metodo
Accuratezza
Velocità
Dim
S
Edge-based
T1
Vettore di
0.6 (Tanimoto)
5s
2D
SA
2.5D
SA
G,M
3D
FA
G,M
FA
G,M
metodo
Tipo
flusso fluido
Wang et all
(2009)
Edge-based
T1,T1c,T2
metodo
Sachdeva et
al
Evoluzione
0.72-0.98
level set con
regione di
competizione
(2012)
Region-based T1,T1c
Modello di
0.85-0.93
metodo
istogramma
(Jaccard)
Ho et all
(2002)
10 min
adattato multi
spettro per
regione in
crescita
Region-based T1c
Connessione
>0.9 (similarità
metodo
fuzzy
index)
2.5 min
Harati et al
(2011)
1.5.2 Classificazione e clustering
La gran parte degli algoritmi di segmentazione proposti si basa sull’approccio di
classificazione o clustering. Questo è soprattutto dovuto al fatto che con questi metodi, i
dataset multi-modali possono essere gestiti facilmente perché possono operare su molti
14
vettori di caratteristiche a scelta. In molti casi, le caratteristiche che questi algoritmi
operano includono intensità voxel-wise e frequentemente anche strutture locali. L’idea
generale è di decidere per ogni singolo voxel a quale modello di classe di base esso
appartiene sulla base del vettore caratteristico. La classificazione richiede dati di
training per imparare un modello di classificazione, in base al quale nuove istanze
possono essere etichettate. Il clustering, d’altronde, lavora in modo non supervisionato
su insiemi di dati basandosi su alcuni criteri di similarità, Wang and Summers [92]. Il
clustering è stato introdotto nella comunità della segmentazione del tumore al cervello
da Shad et al [82] che hanno analizzato i modelli di struttura di diversi tessuti. Le
caratteristiche di ogni metodo sono riassunte in tabella 2.
Tabella 2: alcuni metodi di segmentazione per le immagini del tumore al cervello, che sfruttano la classificazione o
il clustering. Il testing è stato svolto su diversi dataset, mentre le celle vuote indicano che l’informazione non è
disponibile. Nella tabella, Dim sta per dimensionalità, S per supervisione, SA per metodi semiautomatici, FA per
metodi completamente automatici. La colonna Tipi descrive il tipo del tumore, che può essere: G- glioma, HGG- glioma
di grado elevato, LGG- glioma grado basso, M-meningioma, Met- tumore metastatico.
Autori
Modalità
Metodi
Schad et
T1, T2
Analisi
all(1993)
Accuratezza Velocità
Dim
S
2D
Tipo
HGG,
strutturale e
Met
clustering
Phillips et al
T1,T2, PD
Clustering
T1,T2,PD
Clustering
T1,T2,PD
Tecniche
HGG
(1995)
Vaidyanathan
2-5 minuti
2D
HGG,M
(1995)
Clark et al
(1998)
0.69-0.99 %
2D
FA HGG
0.53-0.91 %
2.5D
FA
0.73-0.98
3D
FA HGG
knowledgebased
Fletcher-Heath
T1,T2,PD
et all (2001)
Tecniche
knowledgebased e
clustering
Jensed ed Cai et
T1,T1c,T2,T2 Probabilistica
al (2007)
flair,DTI
segmentazione
di base su MRI
multi modali
15
Ruan et all
T1,T2,T2flair, Classificazione
(2007)
PD
Verma et
T1,T1c,T2,T2 Classificazione
all(2008)
flair,DTI
0.99
3D
FA
0.34-0.86
3D
FA HGG
0.78-0.86
3D
SA
3D
FA
3D
SA
3D
FA HGG
3D
FA G
SVM
tessuto multiparametrico
Jesen e
T1,T1c,T2,T2 Classificatore
Schmainda
flair,DTI
(2009)
HGG,M
diversi su MRI
multiparametriche
Ruan et all
T2,T2flair,PD Fusioni di
(2009)
5 min
immagini per
tumore al
cervello followup
Kanaly et all
T1,T1c
(2011)
Immagini
diverse per la
valutazione
volumetrica di
tumore
Zikic et all
T1,T1c,T2,T2 Foreste
(2012)
flair,DTI
0.7-0.9
2-3 min
decisioni per
segmentazione
di tessuto
specifico
Geremia et all
T1,T1c,T2,T2 Cellule tumorali 0.55-0.83
(2012)
flair
dense estimate
per la
segmentazione
discriminativa
1.5.3 Classificazione e clustering con contrasto addizionale
È stato osservato che semplici classificazioni voxel-wise o metodi di clustering non
fanno uso di tutte le informazioni contenute in un’immagine. Di conseguenza, ci sono
16
stati numerosi tentativi per usare informazioni addizionali al fine di migliorare
ulteriormente l’accuratezza della segmentazione aggiungendo vincoli supplementari,
che possono essere basati su qualche forma di regolarizzazione del neighborhood e di
predeterminazione della forma o di vincoli di localizzazione per il tumore. I vincoli di
neighborhood sono spesso imposti usando un campo aleatorio del metodo di
regolarizzazione, laddove i vincoli di forma sono gestiti da modelli deformabili. Gli
atlanti possono essere usati per restringere la locazione del tumore e anche per i modelli
di classificazione generativi. Essi sono stati utilizzati da un certo numero di metodi per
incorporare conoscenze spaziali in compiti di classificazione. Le caratteristiche dei
diversi metodi sono sintetizzate nella tabella 3:
Tabella 3: alcuni dei metodi di segmentazione per le immagini del tumore al cervello che sfruttano la
classificazione o il clustering. Il testing è stato svolto su diversi dataset, mentre le celle vuote indicano che
l’informazione non è disponibile. Nella tabella, Dim sta per dimensionalità, S per supervisione, SA per metodi
semiautomatici, FA per metodi completamente automatici. La colonna Tipi descrive il tipo del tumore, che può essere:
G- glioma, HGG- glioma di grado elevato, LGG- glioma grado basso, M-meningioma, Met- tumore metastatico.
Autori
Modalità
Metodi
Accuratezza
Velocità Dim
S
Tipo
3D
FA
LGG,M
3D
FA
G,M
3D
FA
3D
FA
G,M
3D
FA
G
Classificazione o clustering con vincolo globale basato su atlanti
Kaus et
T1
all(2001)
Classificazione
> 95%
adattiva template-
(accuratezza)
5-10 min
moderata
Moon et
T1,T1c,T2
all(2002)
Classificazione
> 0.8 (overlap
statistica con
ratio)
geometria
precedente
Prastawa et T1,T1c,T2
Modifica di atlanti
all (2003)
precedenti Subjec-
0.49-0.71(Jaccard)
specific
Prastawa et T2
Rilevamento di
0.59-0.89
all(2004)
derivazione
(Jaccard)
1.5 H
estrema
Menze et
all(2010)
T1,T1c,T2,
T2flair
Modello generativo 0.4-0.7 (Dice)
per segmentazione
multimodale
17
Weizman et T1,T2,
Classificazione e
al(2012)
successivo per
T2flair
0.69 (Dice)
20 min
3D
FA
G
3D
FA
G
3D
FA
HGG,M
0.5-0.75 (Jaccard)
3D
FA
G
0.58 (Jaccard)
3D
FA
G
3D
SA
G,M,
gliomi vie oculari
Classificazione o clustering con vincoli basati su modelli deformabili
Cobzas et
T1,T1c,T2
all (2007)
Segmentazione
0.16-0.76
variazionale con
(Jaccard)
caratteristiche set
alto dimensionale
Khotanlou
T1
Classificazione
0.92 (similarità
et all
fuzzy e modelli
index)
(2009)
deformabili
4.5 min
spazialmente
vincolate
Cobzas and T1c,T2flair
Level set con
Schmidt
incorporato CRF)
(2009)
Popuri et
T1,T1c,T2
all (2012)
Segmentazione
variazionale su una
serie di
caratteristiche
cluster
Hamamci et T1c
Tumor-cut
0.8-0.89 (Dice)
1 s -16min
all (2011)
Met
Classificazione o clustering con vincoli locali basati su regolarizzazione
neighborhood
Corso et all T1,T1c,T2,
Algoritmo graph-
(2007)
shift esteso
T2flair
0.87 (Jaccard)
1 min
3D
FA
HGG
< 1 min
3D
FA
HGG
2D
FA
G
Corso et all T1,T1c,T2,
Segmentazione da
0.62-0.69
(2008)
aggregazione
(Jaccard)
Lee et
T2flair
T1,T1c,T2
pesata
Pseudo CRFs
0.84-0.9 (Jaccard)
18
all(2008)
Wels et all
T1,T1c,T2
(2008)
Discriminante del
0.78 (Jaccard)
1-2 min
3D
FA
G
2 min
2.5D
SA
20-25 min
3D
FA
G
3D
SA
G,M,
modello con vincoli
di tagli grafico
Birkbeck et T1c,T2flair
Interattivi tagli
all (2009)
grafici
Nie et all
T1,T2,T2flair Spaziale precisione
(2009)
pesata gerarchica
0.72-0.76
(Jaccard)
MRF
Hamamci et T1contrasto
Segmentazione
all (2010)
automi cellulari
Hsieh et all T1,T2
Fuzzy clustering più 0.73
(2011)
region-growing
Bauer et
all(2011)
Zhu et al
(2012)
T1,T1c,T2,
0.74-0.87 (Dice)
Met
3D
FA
M
(%match)
Gerarchia SVM+CRF 0.77-0.84 (Dice)
< 2 min
3D
FA
G
EM+MRF+
4 min
3D
SA
HGG
T2flair
T1c,T2
post-processing
0.25-0.81
(Jaccard)
19
Capitolo 2
Tecniche per la segmentazione di immagini
mediche
Sebbene la letteratura riguardante le tecniche di segmentazione delle immagini sia
relativamente vasta, in questo capitolo si concentra l’attenzione su due principali
metodologie. La prima è una tecnica basata sul fuzzy clustering spaziale integrato con
metodi level set. La seconda è basata sulla simmetria utilizzata come strumento per
segmentare immagini MRI con presenza di masse tumorali.
2.1 Fuzzy clustering spaziale integrato con metodi level set
per la segmentazione automatica di immagini mediche
La segmentazione di immagini mediche computerizzata è un problema oneroso, a causa
di una scarsa risoluzione e di un contrasto debole. Inoltre, questo compito è spesso reso
difficile dalla presenza di rumori e artefatti, a causa di limitazioni strumentali, degli
algoritmi di ricostruzione e dei movimenti del paziente. Non esiste ancora un algoritmo
universale per la segmentazione di immagini mediche. I vantaggi degli algoritmi e i lati
negativi che essi hanno spesso variano a seconda del problema. Il risultato di molte
modalità di immagini mediche sono intensità di scala di grigio. Si consideri un’immagine
medica I(x,y), dove x(∈ [1,Nx]) e y(∈ [1,Ny]) sono indici spaziali, e il pixel i(x,y)
quantifica l’intensità corrispondente. La segmentazione delle immagine è la ricerca di un
set significativo di sottoclassi Sk, dove
S
k
I;
S k S j Ø;
(1)
(2)
20
Gli indici k e j variano nell’intervallo [1,K], dove K è il numero di sottoclassi. L’quazione
(1) impone che una segmentazione di immagine sia completa. Mentre L’equazione (2)
richiede la non sovrapposizione. Esistono 2 concetti consolidati nella segmentazione di
immagini: classificazione di pixel e tracking del confine variazionale, Pham et al [120]. Il
primo assume che i pixel in ogni sottoclasse hanno un’intensità quasi costante, che è
vera per le strutture anatomiche con proprietà fisiologiche similari, ma essi sono
suscettibili al rumore ambientale e alla disomogeneità di immagine. Al contrario, i
metodi che tracciano il confine variazionale fanno uso di entrambi, sia dell’intensità, che
dell’informazione spaziale. Pertanto, una sottoclasse deve essere omogenea e chiusa in
uno specifico limite variazionale. Quando ciò è applicato alla segmentazione di immagini
mediche, nessuno dei due è universalmente robusto a causa del rumore intrinseco e
della presenza di artefatti, Pham et al, Chan et al, Martin et al, Chuang et al, Cai et al [120124]. La maggior parte degli algoritmi di segmentazione nella pratica richiede l’operato
dei radiologi, con la loro esperienza e conoscenza, per configurare attentamente i
parametri della segmentazione al fine di massimizzare le performance. A causa della
complessità del problema posto dalla segmentazione di immagini mediche, molti sistemi
computerizzati funzionano in modo semiautomatico o interattivo, Levinski et al [125]; i
radiologi avviano la segmentazione, interrompendola quando necessario, e arrestando
l’algoritmo alla fine del processo. Ovviamente tale procedura è abbastanza soggettiva e
laboriosa. Di conseguenza, la facilità di manipolazione spesso determina l’accettazione di
un algoritmo di segmentazione nelle cliniche, Yushkevich et al, Ciannoglou et al, Li et al
[126-128]. I metodi level set, basati su interfacce dinamiche implicite ed equazioni
differenziali parziali (PDEs), hanno dimostrato di essere efficaci per la segmentazione di
immagini mediche, Li et al, Suri et al, Paragios [128-130]. In ogni caso, nello sviluppo di
questi metodi, i radiologi clinici e gli operatori sono spesso sopraffati dai requisiti
computazionali intensivi e dalla complessa configuraizone del controllo dei parametri,
Mitchell [131]. Sono stati proposti diversi sistemi intelligenti (ibridi) che usano il fuzzy
clustering per facilitare la segmentazione level set, Li et al, Suri et al, Paragios, Ho et al
[128,129,132,133]. Gli algoritmi effettuano il fuzzy clustering, basandosi sull’intensità
dei ipxel nell’ immagine, per la segmentazione iniziale e applicano metodi level set per il
raffinamento oggettivo e per il tracciamento del confine variazionale. Il lavoro sulla
segmentazione del tumore al fegato ha mostrato che, il fuzzy clustering, delineando
approssimativamente i confini del tumore, non solo diminuisce l’intervento manuale, ma
21
accelera anche l’ottimizzazione level set. In questa parte del capitolo, si descrive un
algoritmo fuzzy level set per la segmentazione di immagini mediche in modo
automatico. Rispetto al metodo descritto in Li et al [128], l’algoritmo è stato migliorato
significativamente in diversi aspetti. I il fuzzy clustering incorpora informazioni spaziali
durante l’ottimizzazione adattiva, poiché elimina le operazioni morfologiche intermedie.
In secondo luogo, il controllo dei parametri di segmentazione level set sono derivati
direttamente dai risultati del fuzzy clustering. Inoltre, propone una nuova strategia,
diretta dal fuzzy clustering, per regolarizzare lo sviluppo level set, che è diversa da altri
metodi presenti in letteratura. Infine, l’algoritmo è stato testato su immagini mediche
generali, per esempio, ultrasuoni, tomografia computerizzata (CT) e immagini di
risonanza magnetica (MRI).
2.1.2 Fuzzy clustering spaziale e segmentazione di immagini
Nel fuzzy clustering, il centroide e la media di ogni sottoclasse, sono stimati in modo da
minimizzare una funzione di costo predefinita. Il Fuzzy c-mean (FCM) è uno degli
algoritmi più popolari riguardo il fuzzy clustering, è stato ampiamente applicato nei
problemi medici, Chuang et al, Cai et al, Lei et al [123,124,134]. L’algoritmo classico FCM
deriva dall’algoritmo k-means.
In sintesi, l’algoritmo k-means cerca di assegnare N oggetti, in base ai loro attributi, in K
clusters (K<=N). Per la segmentazione di immagini mediche, N corrisponde al numero di
pixel NxNy nell’immagine. Il risultato desiderato include il centroide di ogni cluster e
l’assegnazione di N oggetti. Lo standard K-means clustering tenta di minimizzare la
seguente funzione di costo:
K
N
J || in vm || 2
m 1 n 1
.
(3)
Nella (3), n è il pixel specifico nell’immagine, m è il centroide dell’m-esimo cluster, e ||.||
è la norma euclidea. L’idea alla base di un algoritmo k-means è di massimizzare le
variazioni inter-cluster, e minimizzare quelle intra-cluster. Nel k-means clustering, ogni
oggetto è assegnato ad uno e un solo cluster. Al contrario, l’algoritmo FCM utilizza una
22
funzione di appartenenza mn per indicare il grado di appartenenza dell’n-esimo oggetto
all’m-esimo cluster, che è ragionevole nel caso della segmentazione di immagini
mediche, dato che i tessuti di solito non sono omogenei. La funzione di costo in un FCM è
simile all’equazione (3), e assume la forma:
N
C
l
J mn
|| in vm || 2 ;
(4)
n 1 m 1
Dove l (>1) è un parametro di controllo che fuzzifica la segmentazione risultante. Le
funzioni di appartenenza sono soggette ai seguenti vincoli:
C
m 1
mn
1; 0
mn 1;
N
n 1
mn
0.
(5)
La funzione di appartenenza mn e il centroide m sono aggiornati iterativamente
mn
|| in v m || 2 /(l 1)
C
|| in vk || 2 /(l 1)
;
(6)
k 1
N
vi
n 1
N
l
mn n
n 1
i
.
l
mn
(7)
L’algoritmo standard FCM ottimizza la funzione di costo quando i pixel vicini nei loro
centroidi ricevono un valore di appartenenza elevato, mentre quelli che sono lontani
ricevono un valore basso. Uno dei problemi dell’algoritmo FCM standard nella
segmentazione di immagini è l’assenza di informazione spaziale, Chuang et al, Cai et al,
Li et al [123,124,128]. Poiché il rumore nell’immagine e gli artefatti spesso riducono la
performance di una segmentazione FCM, risulta utile incorporare informazioni spaziali.
23
2.1.3 Segmentazione level set
A differenza di FCM che utilizza la classificazione dei pixel, i metodi level set utilizzano i
confini variazionali dinamici per una segmentazione di immagini, Sethian, Oscher and
Fedkiw [135,136]. L’idea di segmentare immagini mediante contorni attivi, è un
approccio ben noto in letteratura, Chan et al ,McInerney and Terzopoulos, Wu et al
[121,137,138]. Tuttavia, piuttosto della caratterizzazione parametrica di contorni attivi,
i metodi level set incorporano l’informazione spaziale in una funzione dipendente dal
tempo t,x,y). È poi possibile approssimare lo sviluppo di contorni attivi implicitamente
dal tracciamento dello zero level set (t)
(t , x, y ) 0 ( x, y ) è dentro (t )
(t , x, y ) 0 ( x, y ) è a (t )
(t , x, y ) 0 ( x, y ) è fuori (t )
(10)
La frontiera implicita può essere composto da un solo o da una serie di zero è contorni.
Il problema della segmentazione di immagini viene, quindi, trasformato come mostrato
nella seguente equazione:
S I.
(11)
k
Si osservi che l’inclusione della variabile t relativa al tempo conduce ad una funzione
level set dimensionalmente superiore, che incrementa il costo computazionale, ma che
presenta molti vantaggi pratici. Per esempio la frontiera può essere determinata
semplicemente mediante il controllo del valore della funzione level set che tiene conto
delle modifiche topologiche della frontiera implicita naturalmente. In particolare, lo
sviluppo di è totalemente determinato dall'equazione numerica del level set.
F | | 0
t
(0, x, y ) 0 ( x, y )
,
(12)
dove | | denota la direzione normale, 0(x,y) è il contorno iniziale e F rappresenta la
forza risultante, includendo la forza interna dall’interfaccia geometrica (e.g. curvatura
media, lunghezza del contorno e area) e la forza esterna dall’immagine gradiente e/o
24
momenti artificiali [20,21]. La forza di avanzamento F deve essere regolarizzata da una
funzione di indicazione a margine g in modo da fermare lo sviluppo level set vicino alla
soluzione ottimale.
g
1
,
1 | (G * I ) | 2
dove G * I rappresenta la convoluzione dell’immagine I con uno smoothing kenel
gaussiano G e
denota l’operazione di gradiente. La funzione g è vicina allo zero nei
contorni variazionali e positiva nelle parti rimanenti regioni. Una formulazione comune
per la segmentazione level set è data in Caselles et al[141], ed è:
v),
g | | (div
t
(14)
Dove div ( | |) approssima la curvatura media e è una ballon force. Uno degli
svantaggi più grandi nella segmentazione level set è il costo computazionale, poiché la
funzione level set converte il problema di segmentazione di immagine 2D in un
problema 3D. Esistono altri vincoli per stabilire lo sviluppo level set. Per esempio, il
passo temporale e lo spazio della griglia devono essere conformi alla condizione di
Courant-Friedreichs-Lewy (CFL), Sethian, Osher and Fedkiw [135,136], della funzione
level set la quale deve essere re-inizializzata periodicamente come una funzione di
distanza segnata, come mostrato nella (15)
( ) ( g , ),
t
(15)
dove il primo termine alla sinistra è una penalità temporanea di , ed è derivata
dalla funzione di distanza
.
|
|
( ) div
(16)
Il secondo termine g incorpora le informazioni dell’immagine gradiente:
25
vg ( ),
| |
( g , ) ( )div g
(17)
dove denota la funzione di Dirac. Le costanti e controllano i contributi
individuali di questi termini. In sostanza, il termine g attrae verso i confini
variazionali, il che lo rende simile ai metodi standard level set. Il termine di penalità
forza ad approcciare la reale funzione di distanza, che presenta diversi importanti
vantaggi. Primo, questo algoritmo elimina la costosa re-inizializzazione per le funzioni
di distanza. Secondo, esso può iniziare da un’arbitraria regione binaria, definita come:
C , 0 ( x, y ) 0
,
C , altrimenti
( x, y)
(18)
dove C è una costante. Infine, esso permette un largo lasso temporale , ma garantisce
ancora l’evoluzione stabile, mediante l’equazione
k 1 ( x, y) k ( x, y) [ ( k ) ( g , k )].
(19)
I modificatori portano ad un algoritmo level set rapido per la segmentazione di
immagini mediche. Il miglioramento della velocità lo rende più adatto per i test e per la
valutazione della segmentazione level set.
2.1.4 Una variazione all’algoritmo fuzzy level set
Sia l’algoritmo FCM, che i metodi level set rappresentano modelli general-purpose che
possono essere applicati a problemi di ogni dimensione. Tuttavia, se si restringe il
campo alla segmentazione di immagini mediche, è possibile ottenere un vantaggio in
specifiche circostanze per ottenere una migliore performance. Si introduce, quindi, una
variante dell’algoritmo fuzzy level set finalizzata alla segmentazione automatica di
immagini mediche. Esso inizia dal clustering fuzzy arricchito dalle informazioni spaziali,
i cui risultati sono utilizzati per avviare la segmentazione level set, stimare i controlli dei
parametri e regolarizzare l’evoluzione level set. Questa variante automatizza
l’inizializzazione e la configurazione dei parametri della segmentazione level set, usando
un clustering fuzzy integrato con informazioni spaziali. Esso sviluppa un FCM con una
26
restrizione spaziale per determinare l’approssimazione dei contorni di interesse in un
immagine medica. Beneficiando di una inizializzazione flessibile come mostrato
nell’equazione (18), il miglioramento della funzione level set può sfruttare i risultati
dell’FCM direttamente per lo sviluppo della frontiera. Si supponga che la componente di
interesse ottenuta come risultato da FCM sia Rk: {rk=nk, n= x Ny +y },
si può
inizializzare la funzione level set come segue:
0 ( x, y) 4 (0.5 Bk ),
(20)
dove è una costante regolarizzata della funzione di Dirac [136,142]. La funzione di
Dirac è allora definita nel seguente modo:
0,
( x) 1
2
| x |
x
1 cos , | x |
(21)
Bk è l’immagine binaria ottenuta da
Bk Rk b0 ,
(22)
dove b0(∈ ( 0,1)) è una soglia regolabile. Beneficando del fuzzy clustering spaziale, Bk
può in un certo senso approssimare la componente di interesse, che può essere
rettificata da b0. Ci sono diversi parametri di controllo associati con i metodi level set
(tabella 4), che sono importanti per la segmentazione di immagini mediche. Pertanto è
necessario configurarli nel modo giusto, e ciò varia purtroppo da caso a caso.
Attualmente ci sono semplicemente un paio di regole generali. Per esempio, e noto che
un elevato conduce ad un’immagine levigata, ma sacrifica il dettaglio nell’immagine.
Un ampio lasso temporale può accelerare l’evoluzione level set, ma introduce il rischio
di perdita del confine. Oltretutto è necessario sceglier un positivo se la iniziale è
fuori dalla componente d’interesse, e negativo viceversa nel caso contrario.
27
Tabella 4: I parametri di controllo della segmentazione level set.
Parametri
Significato
Controlla la diffusione della funzione di smoothing
Gaussiana
Controllo della resistenza del gradiente della
C
funzione iniziale level set
Regolatore per la funzione di Dirac ()
Coefficiente pesato del termine di penalità ()
Coefficiente della lunghezza del contorno per la
regolarizzazione smoothness
Balloon Force
Lasso temporale dell’evoluzione level set
Iterazione massima dell’evoluzione level set
In aggiunta, diverse regole empiriche sono state ricavate sperimentalmente, Sethian,
Osher and Fedkiw, Li et al [135,136,142]. Per esempio, il prodotto tra l’intervallo
temporale e il coefficiente di penalità ( x ) deve essere minore di 0.25 per uno
sviluppo stabile, e il parametro C deve essere maggiore di 2, mentre un valore troppo
alto di C rallenta l’evoluzione level set. Comunque c’è un rischio di confini poveri poco
definiti. Le linee guida generali, seppur utili, sono insufficienti a determinare la
configurazione ottimale per una specifica immagine medica. Ottenuta la funzione iniziale
level set dal fuzzy clustering spaziale in accordo all’equazione (20), è conveniente
stimare la lunghezza e l’area a partire da:
(0 )dxdy ,
(23)
1
28
H (0 )dxdy ,
(24)
1
dove le funzione Heaviside H() è:
1, 0 0
H (0 )
.
0, 0 0
(25)
Osserviamo che lo sviluppo level è veloce se il componente di interesse è largo. In questo
caso, il rapporto
/
(26)
è anch’esso elevato. È per tanto ragionevole assegnare l’intervallo temporale come
nell’algoritmo fuzzy level set utilizzato. Il coefficiente di penalità è impostato come:
0.2 / ,
(27)
dato che il loro prodotto ( x ) deve essere minore di 0.25 per avere uno sviluppo
stabile. La funzione level set iniziale ottenuta dal fuzzy clustering con l’equazione (20)
è approssimato dai confini originali.
Pertanto viene impostato un relativamente
conservativo
0.1
(28)
in modo da mantenere controllate le modifiche topologiche. La balloon force segue 2
regole nell’evoluzione del level set. In primo luogo, il suo segno determina la direzione di
avanzamento della funzione level set: positivo per il restringimento e negativo per
l’espansione. In secondo luogo, un elevato impone al level set una evoluzione più
rapida. Nell’algoritmo level set standard, il parametro di controllo è spesso impostato
come una costante globale. Tuttavia, esso è utile per rendere una funzione level set più
veloce nell’evoluzione, se è ancora lontana dai confini originali, mentre si può
rallentare una volta che si avvicina ai confini. Inoltre, la funzione level set deve alterare
la sua direzione automaticamente, mentre passa attraverso il confine di interesse.
29
L’inizializzazione della segmentazione FCM (come un indice quantitativo), è
particolarmente usata per regolarizzare l’evoluzione level set. La variante dell’algoritmo
fuzzy level set ottiene il grado di appartenenza di ogni pixel dell’immagine come la
distanza dalla componente di interesse Rk. per tirare o spingere la frontiera adattiva
dinamica verso l’oggetto d’interesse, si utilizza una balloon force maggiore
G( Rk ) 1 2Rk
(29)
La risultante della balloon force G(Rk) (∈ [-1,1]) è una matrice con forza variabile di
pulling o pushing in corrispondenza di ogni pixel dell’immagine. In altre parole, la
funzione level set è attrata verso l’oggetto di interesse a prescindere dalla sua posizione
iniziale. Inoltre, l’equazione evolutiva (Eq (17)) è trasformata in:
gG( Rk ) ( ).
|
|
( g , ) ( )div
(30)
Questa variante presenta diversi vantaggi pratici. La balloon force può essere derivata
direttamente dal fuzzy clustering spaziale. L’evoluzione level set è adattata alla distanza
dall’oggetto originale. Una volta approssimato il contorno dell’oggetto, la funzione level
set rallenta automaticamente l’evoluzione verso il basso e diventa totalmente
dipendente dal termine di smoothing. Dal momento che si è adottato un conservativo,
l’evoluzione level set si stabilizza automaticamente. Un beneficio aggiuntivo è la
flessibilità nello scegliere un numero di iterazioni relativamente grande per l’evoluzione
T per una segmentazione robusta. Senza tale miglioramento, l’operatore deve essere
attento che l’evoluzione level set eviti una segmentazione insufficiente o eccessiva,
Yushkevich et al[126].
2.1.5 Alcuni risultati
Gli esperimenti e la valutazione delle performance sono state effettuate su immagini
mediche di diverse modalità, che includono una immagine ad ultrasuoni dell’arteria
carotidea, Li et al [143], una scansione CT di un tumore al fegato, Li et al [128], e una
30
slice MRI del tessuto cerebrale, Pham et al [144]. LeFigure 3, 4 e 5 mostrano i risultati
ottenuti.
Figura 3: segmentazione fuzzy level set di un ecografia carotidea. Riga (a) Espande l’inizializzazione FCM, con
=0.1; =2; =-1; =2. Riga (b) Inizializzazione FCM limitata, con =0.1; =2; =1; =2. Riga (c) segmentazione level
set, con parametri da un FCM =0.067; =1.493; e =2.987, è una matrice prodotta da FCM rappresentante l’arteria;
colonna (d) inizializzazione FCM; colonna (e) dopo 100 iterazioni, colonna (f) dopo 200 iterazioni e colonna (g) dopo
300 iterazioni.
31
Figura 4: segmentazione level set di una CT del tessuto del fegato: (a)-(c) segmentazione del tumore; (d)-(f)
segmentazione del fegato; (a) e (d) espansione dopo l’inizializzazione con FCM, con =0.1; =2; =-1; =2. (b) e (e)
Inizializzazione vincolata con FCM, con =1; (c) segmentazione del tumore, con parametri da FCM =0.102; =0.987;
=1.965. G è il miglioramento della forza balloon; (f) segmentazione del fegato con parametri da un FCM =0.079;
=1.265; =2.531. G è il miglioramento della forza balloon; (g) inizializzazione FCM; (h) dopo 100 iterazioni; (i) dopo
200 iterazioni e (j) dopo 300 iterazioni.
32
Figura 5: segmentazione level set di una MRI del tessuto cerebrale: (a)-(c) WM; (d)-(f) GM; (a) e (d) inizializzazione
espansa, con =0.1; =2; =-1; =2; (b) e (e) inizializzazione vincolata, con =1; (c) segmentazione WM, con i
parametri da un FCM =0.162; =0.616; =1.231, G è una matrice WM FCM; (f) segmentazione GM, con parametri da
un FCM =0.348; =0.287; =0.575, G è una matrice GM FCM; (g) inizializzazione FCM; (h) dopo 100 iterazioni; (i)
dopo 200 iterazioni e (j) dopo 300 iterazioni.
2.2 Estrazione del glioma 3D completamente automatico in
MRI multi-contrasto
Questa tecnica si concentra, inizialmente, sulla segmentazione automatica del tumore al
cervello in Magnetic Resonance Images (MRI) e sull’estrazione dell’intera area
33
patologica affetta da tumore. Oggigiorno, la segmentazione del tumore al cervello è un
tema frequente nella ricerca. Molti metodi usati sono ancora semi-automatici, come il
Support Vector Machines (SVM) utilizzato in Mikulka et al [152]. Il seguente metodo
potrebbe contribuire ad eliminare la necessità del lavoro umano e potrebbe migliorare
l’efficienza del lavoro in ambito medico. Il risultato di questa analisi potrebbe portare
anche ad un contributo in grado di rivelare la presenza di aree patologiche nel cervello e
di visualizzare automaticamente le regioni di interesse per le visite mediche. Una
nozione usata in questa particolare tecnica, è la simmetria sagittale del cervello sano.
Questo approccio è anche usato in, Cap et al, Pedoia et al, Saha et al, Khotanlou et al
[146,154,156,149]. Aree che rompono questa simmetria sono, nella maggior parte dei
casi, un tumore o qualsiasi altro tipo di tessuto patologico. I metodi attuali spesso si
basano su T1-pesato con miglioramento del contrasto. Tuttavia essa è un’immagine che
si cerca di evitare, poiché per essere ottenuta richiede un agente chimico per il
miglioramento del contrasto (spesso il gadolinium) che deve essere iniettato nel sangue
del paziente, in modo che il liquido rompa la non invasività della risonanza magnetica.
La prima parte di questo metodo basato sulla simmetria sagittale del cervello sano, è la
localizzazione preliminare di queste aree patologiche, che può essere usato come uno
step iniziale nel processo automatico di segmentazione del tumore usando qualsiasi
contrasto MR o combinazione di più contrasti MR. Un’informazione aggiuntiva riguardo
l’opportunità di usare un particolare contrasto MR e il loro confronto può essere trovato
in Dvorak et al [147].
2.2.1 Metodo su simmetria sagittale
La principale idea dietro questa tecnica è quella di rilevare e localizzare un’anomalia in
un volume di cervello in 3D usando l’analisi di simmetria. La simmetria sagittale del
cervello sano è ampiamente conosciuta e utilizzata per la rilevazione di un’area
patologica.
L’input dell’intero processo è un volume di risonanza magnetica 3D contenente un
tumore. Il processo di rilevazione del tumore è costituito da diverse fasi. Il primo step è
l’estrazione del volume dall’intero cervello in seguito al taglio delle immagini. Ci sono
diversi metodi usati per l’estrazione di un volume del cervello 3D, tali metodi sono
34
descritti in Uher et al [157]. Da questo volume tagliato, è necessario individuare il piano
medio-sagittale, Liu et al [151] o Ruppert et al [155], per allineare correttamente la
testa. Nel volume allineato, le parti simmetriche sono ben collocate e poiché il processo
di rilevamento è basato su regione anziché essere basati su pixel, il metodo non
necessità di una perfetto allineamento del volume.
2.2.2 Localizzazione del tumore
All’inizio, il volume (ottenuto in ingresso) è diviso in due parti (metà destra e metà a
sinistra). Assumendo che la testa si stata allineata e il cranio sia approssimativamente
simmetrico, il piano simmetrico è parallelo al piano y-z e divide il volume del cervello
rilevato in due parti della stessa dimensione. L’algoritmo passa attraverso le due metà
simmetriche considerando un blocco cubico. La grandezza di tale blocco è calcolata
rispetto alla dimensione dell’immagine. Si osserva che la dimensione del passo è minore
della dimensione del blocco in modo da garantire la sovrapposizione di particolari aree.
Queste aree sono confrontate con le regioni opposte. L’istogramma normalizzato nello
stesso range è calcolato per entrambi i cubi, sinistro e destro, e sono confrontate con il
coefficiente di Bhattacharyya (BC), Bhattacharyya et al [145], che esprime la similarità di
due insiemi. Il BC è calcolato come segue:
n
BC l (i ) * r (i) ,
i 1
(31)
Dove n denota il numero di bins nell’istogramma, l e r denotano gli istogrammi, dei
blocchi nella metà sinistra e metà destra, rispettivamente. Il range di valori del BC è
[0,1], dove il valore più piccolo indica un’ampia differenza tra gli istogrammi.
L’asimmetria A, è definita, quindi, come A = 1 – BC.
Questa asimmetria è calcolata per tutti i blocchi. Poiché le regioni si sovrappongono
durante la computazione, quindi, successivamente l‘asimmetria media è calcolata per
ogni pixel. L’intero ciclo è ripetuto tre volte, ciascuna per una diversa risoluzione del
volume.
35
La risoluzione di ogni asse è iterativamente ridotta alla metà del valore precedente.
Questo approccio corrisponde all’analisi delle immagini multi-risoluzione descritto in
Kropatsch et al[150]. L’output di ogni ciclo è una mappa asimmetrica e il prodotto dei
valori corrisponde ad un particolare pixel creato nella nuova mappa asimmetrica multirisoluzione. L’esempio della mappa asimmetrica per il tumore multifocale è mostrata
nella figura 6.
Figura 6: Esempio di una mappa asimmetrica. La riga superiore mostra la slice T2 con massima asimmetria. La riga
inferiore mostra la mappa asimmetrica del volume T2-pesato della corrispondente slice.
Per l’estrazione della regione patologica lesa, è eseguito il thresholding della mappa
asimmetrica multi risoluzione 3D. La soglia è calcolata a partire dalla mappa
asimmetrica come il 30% della massima asimmetria. Questo valore è stato fissato
sperimentalmente e assicura che almeno una piccola regione sia estratta dall’immagine.
Dal tumore multifocale può apparire che il processo di rilevazione non è limitato ad una
sola regione ma a più regioni. Tutte le regioni create dalla soglia considerata vengono
analizzate, e come risultato, la collocazione del tumore multifocale in entrambe le metà
può essere correttamente rilevato in modo asimmetrico.
36
2.2.3 Estrazione del tumore
Per l’estrazione dell’area del tumore, si utilizza la maschera di entrambi i lati calcolata
nel precedente step, il che significa che la decisione di quali parti contiengono il tumore
non è ancora stata presa. Il processo di estrazione è basato sul metodo proposto in
Dvorak et al [148]. Gliomi ed edemi possono essere separati bene dalla materia grigia e
bianca usando il volume T2-pesato, dal momento che appaiono iperintense in questo
contrasto MR. Per estrarre queste aree patologiche, si utilizza, quindi, una soglia
adattiva.
La soglia è determinata a partire dai punti nella maschera di asimmetria usando la
tecnica proposta da Otsu in 1979 [153]. Poiché l’area lesa potrebbe estendersi oltre i
bordi dell’area di asimmetria, il processo di thresholding è applicato all’intero volume.
L’erosione morfologica e la dilatazione vengono applicate alla maschera risultante dal
processo di thresholding per levigare i confini e separare le regioni connettive da una
zona sottile. Tali regioni sono situate per lo più al di fuori della maschera di asimmetria
e, dunque, esse vengono eliminate.
Poiché il liquido cerebrospinale (CSF) appare iperintenso nell’immagine T2-pesato, si
considera il volume FLAIR, poiché in questo contrasto MR, il CSF produce un segnale
molto più debole rispetto alla sostanza bianca ed al tumore. Da qui, le aree con bassa
intensità rispetto all’intensità media (che è molto probabilmente l’intensità della
materia bianca) nel volume FLAIR vengono eliminati.
2.2.4 Risultati
Le immagini usate per la valutazione di questa tecnica sono ottenute dal dataset BRATS
che contiene immagini completamente anonime provenienti da diversi istituti: ETH di
Zurigo, Università di Berna, Università del Debrecen e l’università dell’Utah. Esso è
scaricabile al seguente sito: http://challenge.kitware.com/midal/folder/102 [115].
I risultati dell’estrazione sono valutati tramite il coefficiente Dice. Tali risultati sono
sintetizzati nella tabella 5.
Nonostante il massimo del FLAIR e della mappa di
asimmetria T2 fosse situato fuori il ground truth in 3 di 80 casi, non si sono verificate
37
intersezioni tra il ground truth e il risultato dell’estrazione automatico, tranne in 1 di
questi.
Tabella 5: alcuni risultati ottenuti dal metodo basato su simmetria sulle immagini del dataset BRATS riportate in
termini di coefficiente Dice (DC) .
Dati Reali
DC
Dati simulati
Alto grado
Basso grado
Alto grado
Basso grado
Globale
Medio
0.67 ± 0.22
0.78 ± 0.10
0.80 ± 0.10
0.72 ± 0.05
0.74 ± 0.14
Mediano
0.75
0.78
0.82
0.71
0.75
Il metodo non funzionerebbe per volumi altamente ruotati, tuttavia nonostante esso sia
basato su regioni piuttosto che su pixel, l’allineamento perfetto non è necessario.
Secondo Zijdenbos et al [158], il DC > 0.7 indica una similarità eccellente. Questa
dichiarazione è soddisfatta sia per il grado alto, che quello basso dei gliomi in entrambi i
dati, reali e simulati.
Un esempio di risultato di estrazione su un dato reale di un glioma di basso grado e di un
dato simulato di un alto grado di glioma multifocale sono mostrate in figura 7 e 8,
rispettivamente. Le slice con massima asimmetria sono mostrate in entrambe le figure.
Come può essere visto in figura 7, l’allineamento preciso della testa non è necessario.
38
Figura 7: Esempio di estrazione di un tumore in un volume da un dato reale di glioma di basso grado con il DC= 0.93.
La riga superiore ed inferiore mostra il ground truth e il risultato della segmentazione automatica, rispettivamente
Figura 8: esempio di rilevazione del tumore al cervello su un volume da un dato simulato con glioma di alto grado con
DC = 0.80. Le righe superiore ed inferiore mostrano il ground truth e il risultato della segmentazione automatica,
rispettivamente.
39
Capitolo 3
L’entropia come strumento per clustering di
oggetti
La recente letteratura nell’ambito dell’image processing fornisce diversi esempi di
problemi applicativi, la cui soluzione eredita schemi tipicamente formulati per la
modellazione di fenomeni fisici.
Un tipico esempio è dato dalla modellazione di sistemi che effettuano la cattura, la preelaborazione e l’estrazioni di caratteristiche da un’immagine, come la sorgente di un
segnale trasmesso su un canale affetto da rumore. In tal senso, il problema si riconduce
al misurare la quantità di informazione contenuta in un oggetto, mediante strumenti
quali la Probability of Random Correspondence (PRC). In Bhatnagar et al [107], gli autori
mostrano come tale misura sia un indicatore più affidabile delle misure di prestazione
comunemente usate, quali Equal Error Rate (EER) e Recevier Operating Curve (ROC),
poiché, diversamente da queste ultime, essa non dipende dalla dimensione dell’insieme
di oggetti cui il sistema viene valutato. Adler et al [105] ha studiato il problema in modo
molto approfondito e ha proposto l’entropia relativa come soluzione. L’entropia , in
ambito fisico, misura il grado di disordine in un sistema. Trasferendo tale concetto
all’ambito informatico, l’entropia misura il grado di informazione fornito da un
messaggio, o più in generale, da un insieme di oggetti, che popolano un insieme.
Quest’ultima definizione è stata introdotta da Shannon, il quale studiò l’entropia nel
contesto della trasmissione di informazioni su un canale. Misurare il grado di
informazione che deve essere preservato in un messaggio (o insieme), utilizzando
l’entropia di Shannon, richiede la conoscenza della frequenza con cui i simboli (o
oggetti) che lo compongono, si ripetono nel messaggio (o insieme); tale frequenza è
utilizzata come una misura di probabilità per ogni oggetto. Da un punto di vista formale,
quindi, l’entropia rappresenta una misura dell’incertezza che caratterizza una variabile
casuale. In particolare, essa è spesso adottata per misurare la distanza tra due diverse
40
distribuzioni di probabilità e, quindi, per misurare le informazioni che distinguono un
oggetto dagli oggetti restanti.
3.1 Le basi dell’analisi proposta
In linee generali, l’entropia di Shannon misura l’incertezza di una variabile casuale.
Cover et al [109]. Il modo più immediato per contestualizzare l’entropia nell’ambito
dell’analisi di immagini è di adottarla come stima del grado di casualità dei pixel
nell’immagine stessa. In questo caso, ogni pixel x in un’immagine I è considerato come
un simbolo in un alfabeto emesso da una sorgente S. In particolare, in caso di un’
immagine a scala di grigio, l’alfabeto è rappresentato da un set di interi a 8 bit dando
256 possibili diverse tonalità di grigio dal nero al bianco {0,…,255}. L’istogramma
dell’immagine rappresenta la tabella di frequenza di tutti i simboli (livelli di grigio), ed è
calcolato come h(x) = |{(i,j) : I(i,j) = x, 0 <= i <= altezza(I), 0<= j <= larghezza(I)}|, dove
|S| rappresenta la cardinalità di S. Una volta che i valori h(xk), k=1,…,255
nell’istogramma sono stati normalizzati nell’intervallo [0,1], e in base al numero totale
di pixel nell’immagine, ogni posizione nell’istogramma rappresenta la probabilità di
occorrenza p(xk) del simbolo xk in I, con k=0,…,255. L’entropia H(I) può essere quindi
definita nel seguente modo:
255
H ( I ) p( xk ) log 2 ( p( xk )),
(32)
k 0
Questa formulazione dell’entropia di un’immagine può essere sfruttata come una misura
di qualità generica, con tutti i relativi vantaggi e limitazioni. Essa esprime il contenuto
informativo della distribuzione dei toni di grigio nell’immagine. Tuttavia, essa non tiene
conto della correlazione spaziale dei toni di grigio e del fatto che l’immagine potrebbe
presentare dettagli irrilevanti che farebbero aumentare l’entropia. L’analisi di un
insieme di oggetti basata sull’entropia offre, in realtà, molti vantaggi, sebbene siano rari i
casi, in cui essa viene usata per valutare l’apporto di informazione fornito singolarmente
da ciascun oggetto all’interno di un insieme di oggetti. In questo caso, l’entropia è
utilizzata come strumento per la selezione di un sottoinsieme di oggetti dall’insieme
originario, cercando di garantire una elevata diversificazione degli oggetti selezionati e,
di conseguenza, una loro adeguata rappresentatività dell’insieme originario. L’equazione
41
espressa dalla (32) può essere rivista in modo da non considerare i singoli pixel
nell’immagine, ma più in generale la similarità fra gli oggetti di un dato insieme.
Al fine di chiarire la notazione, è importante formalizzare il contesto in cui tale
strumento teorico viene calato. Si consideri un algoritmo di clustering, il cui scopo è
quello di selezionare un sottoinsieme di oggetti rappresentativi Gk da un più ampio
insieme di oggetti G, sulla base di una misura d di similarità tra gli oggetti. L’insieme di
oggetti G è l’unione dei sottoinsiemi disgiunti di oggetti Gk (G = ⋃kGk , Gk⋂ Gh = ∅, ⩝ k ≠
h ) . Ogni Gk contiene tutti gli oggetti gi,k ∊ Gk con un livello di rappresentatività
confrontabile. In altri termini, oggetti simili e, quindi, con lo stesso potenziale di
rappresentatività sono raggruppati nello stesso sottoinsieme. La misura di similarità
associa uno scalare reale ad una coppia di oggetti. Essa è definita in modo tale che
confrontando un oggetto generico v con un oggetto gi,v nell’insieme di oggetti G, si
ottiene uno score di similarità si,v = d(v, gi,k). In altri termini, si,v è un valore reale
nell’intervallo [0,1]. Nel caso in cui d sia una misura di distanza, piuttosto che di
similarità, è sufficiente considerare il valore 1-si,v. Più in generale, le definizioni fornite
nel seguito sono indipendenti dalla misura di similarità (distanza) d utilizzata, purché
quest’ultima restituisca valori reali scalari per tutti gli oggetti di un insieme di oggetti. È
opportuno sottolineare che, in questo contesto, l’entropia non è utilizzata per assegnare
un nuovo oggetto v al suo corretto insieme di oggetti Gk, quanto piuttosto per misurare
la rappresentatività di Gk e come v altera tale proprietà. In questo contesto, lo score si,v
può essere interpretato come la probabilità che l’oggetto v si conformi all’oggetto gi,k,
ossia:
si , p( g i ,k ),
(33)
Affinché si,v rappresenti una probabilità, esso deve essere compreso nell’intervallo [0,1],
e la somma delle probabilità di tutti gli oggetti in Gk deve essere 1; pertanto , ogni si,v è
normalizzato rispetto alla somma Ʃi(si,v). Il concetto di entropia definito dalla (32) può
essere
applicato anche al caso della
distribuzione di probabilità ottenuta
dall’applicazione della (33) a un sottoinsieme di oggetti Gk rispetto ad un oggetto v,
come segue:
42
|Gk |
1
H (Gk , )
si, log( si, ),
log 2 (| Gk |) i 1
(34)
dove 1/log2(|Gk|) rappresenta un fattore di normalizzazione. Esso corrisponde al
massimo valore di entropia, che è ottenuto quando la (33) ha lo stesso valore per tutti gli
oggetti nell’insieme di oggetti Gk. Indipendentemente dalle dimensioni dell’insieme di
oggetti, il valore ottenuto è sempre compreso nell’intervallo [0,1], cosicché
risulti
sempre possibile confrontare i valori ottenuti per i diversi insiemi di oggetti. Si può,
quindi, introdurre una misura di entropia per l’insieme di oggetti Gk, che è calcolata
considerando a turno ogni oggetto di un insieme gj,k come oggetto generico di test v.
Dato Q l’insieme di coppie qi,j = (gi,k , gj,k) di elementi in Gk tali che si,j >0, l’entropia per un
insieme di oggetti è definita come segue:
H (Gk )
1
si, j log( si, j ),
log 2 (| Q |) qi, jQ
(35)
La formulazione data nella (35) permette di ottenere valori in un intervallo [0,1],
indipendentemente dalle dimensioni degli insiemi di oggetti. Il valore di H(Gk)
rappresenta una misura di eterogeneità per Gk.
3.2 Utilizzo dell’entropia come strumento di selezione di
oggetti rappresentativi da un insieme più ampio di oggetti
In molte applicazioni, un sistema automatico si trova nella condizione di dover lavorare
su un insieme di oggetti caratterizzati da una elevata ridondanza. Ne deriva che,
limitando l’esecuzione ai soli oggetti rappresentativi è possibile garantire un risultato
confrontabile per l’elaborazione, pur riducendo drasticamente il carico del sistema
stesso. Un esempio tipico è dato dall’elaborazione dei singoli fotogrammi di un video
nell’ambito della videosorveglianza. Un numero elevato di campioni d’input
(fotogrammi) viene acquisito costantemente e aggiunto ad un insieme di oggetti
(fotogrammi da elaborare). La manipolazione di tali oggetti può appesantire il
funzionamento del sistema, fino a compromettere completamente la sua utilità. In questi
43
contesti, si ricorre ad un criterio di selezione degli oggetti, cosicché molti oggetti
vengano scartati a priori, al fine di ridurre il peso computazionale del sistema. A questo
scopo, H(Gk) può rappresentare un valido strumento per selezionare un sottoinsieme di
oggetti rappresentativi da un insieme molto più grande. Dato l’insieme Gk è possibile
costruire una matrice di similarità Mk mediante un confronto tutti contro tutti, e da
quest’ultima calcolare il valore di H(Gk). In altri termini, la matrice Mk è calcolata
applicando la misura di similarità d per tutte le coppie di oggetti in Gk, i.e. Mk(i,j) = d(gi,k
,gj,k),⩝ gi,k ∊ Gk. Per ogni gi,k ∊ Gk, la matrice Mk è usata per calcolare il valore di H(Gk \
{gi,k}), ottenibile considerando gi,k come un nuovo oggetto v, non già contenuto in Gk. Il
campione gi,k che produce la variazione minima f(Gk,gi,k) = H(Gk) – H(Gk \ {gi,k}) viene
selezionato; la matrice Mk è aggiornata cancellando la riga e la colonna i-esima, e il
processo viene ripetuto, fin quando tutti gli elementi di Gk non siano stati selezionati. In
pratica, il primo selezionato rappresenta l’oggetto più rappresentativo, i.e., quello che
causa la minima variazione dell’entropia (rappresentatività). In questo modo, la
differenza minima di entropia tende all’aumento, come previsto. Comunque, dal punto
centrale, esso tende a nuovamente a diminuire a causa del numero molto inferiore di
campioni che sono coinvolti computazione nel calcolo. Empiricamente identifichiamo la
parabola come una semplice curva per approssimare questo comportamento con
sufficiente precisione. Lo psudo-codice dell’algoritmo di analisi dell’insieme di oggetti e
la funzione associata è mostrato di seguito:
PIVOTS ParseGallery(Gk)
p []
h 0
PIVOTS []
Mk ComputeDistanceMatrix(Gk)
while(p)
p FindPivot(Mk)
Mk (p,:) 0
Mk (:,p) 0
PIVOTS[h] p
h h + 1
end
Mk ComputeDistanceMatrix(Gk)
for i=1 |Gk|
for j=1 |Gk|
Mk (i, j) = si,j
end
end
p FindPivot(Mk)
44
if (i,j) Mk (i,j)0
Et entropy(Mk)
for h=1 | Mk |
Mtmp Mk
Mtmp(h,:) 0
Mtmp(:,h) 0
E(h) Et - entropy(Mtmp)
end
p argmin(E)
else
p []
end
E ComputeEntropy(Mk)
Q {(i,j) Mk(i,j)0}
E 0
qi,j=(i,j) Q
E E - Mk(i,j)log2(Mk(i,j))/log2(|Q|)
Questo approccio può essere considerato come un meccanismo per
ridurre
progressivamente la disomogeneità di una serie di campioni. La funzione basata
sull’entropia rappresenta una possibile scelta in questo senso, insieme ad altri criteri
come la deviazione standard. Tuttavia, sperimentalmente si è osservato che l’uso della
deviazione standard seleziona molti oggetti poco rappresentativi insieme a quelli
effettivamente utili. Gli esperimenti sulla selezione di oggetti rappresentativi basati sulla
deviazione standard piuttosto che dell’entropia, confermano che la specifica forma della
funzione f(Gk,gi,k) è tipica dell’entropia. Il trend step-like della funzione f è causato dalla
natura intrinseca della misura calcolata, la quale rappresenta quanto un oggetto sia
diverso da un dato insieme di oggetti. La funzione f seleziona l’oggetto che minimizza la
differenza tra l’entropia del set originale di oggetti e quello dello stesso insieme privo
dell’elemento selezionato. Chiaramente, se un oggetto molto simile a quello appena
selezionato è ancora nel set, esso sarà, con elevata probabilità, il prossimo ad essere
selezionato. In questo modo, la funzione f subisce una piccola variazione nella forma
(generalmente rimane abbastanza constante o in leggero calo). Non appena gli oggetti
fra loro simili finiscono (sono stati estratti tutti dall’insieme di origine), l’algoritmo
seleziona un nuovo campione sufficientemente diverso, che causa un picco in salita nel
grafico della funzione f. Dato che tale oggetto risulta molto diverso dal resto, degli
oggetti, eliminarlo dall’insieme genera una significativa variazione nell’entropia
dell’insieme.
Successivamente,
la funzione f assume nuovamente il suo trend
costante/decrescente, fino alla selezione di un altro oggetto sensibilmente diverso.
45
L’andamento parabolico è invece tipico di diverse funzioni ed è espresso anche dalla
deviazione standard. Questo è dettato dal fatto che il differenziale calcolato dalla
funzione f subisce una variazione iniziale maggiore, a causa della quantità numerosa di
oggetti nel processo di selezione, prima della stabilizzazione e poi dell’inversione del
trend quando il numero di oggetti ancora presenti nell’insieme di origine diventa molto
piccolo.
3.3 Definizione della misura di similarità tra pixel
Nello specifico contesto di questo lavoro di tesi, ossia la segmentazioni di immagini MRI
del distretto cerebrale con presenza di masse tumorali, si vuole calare l’uso dell’entropia
nell’ambito della quantizzazione dei toni di grigio in una immagine grayscale. In altri
termini, data una immagine in cui sono espressi tutti i 256 possibili livelli di grigio, si
vuole selezionare un sottoinsieme rappresentativo di questi, così da facilitare il
partizionamento dell’immagine in regioni. Le immagini utilizzate per la valutazione
dell’approccio proposto fanno parte del dataset scaricabili al seguente link:
http://challenge.kitware.com/midas/folder/102
[115].
Questo
dataset
mette
a
disposizione immagini T1,T2, FLAIR e post-Gadolinium T1. Tutti i volumi sono stati coregistrati rispetto all’immagine di contrasto T1 e interpolate a 1 mm di risoluzione
isotropo. Un esempio di tali immagini e riportato in Figura 9.
Figura 9: Immagini del volume BRATS_HG0001 della slice 95, partendo in alto da sinistra verso destra:
BRATS_HG0001_T1.mha, BRATS_HG0001_T1C.mha. In basso da sinistra verso destra: BRATS_HG0001_T2.mha,
BRATS_HG0001_FLAIR.mha
46
Un’immagine può essere definita come una funzione a 2 dimensioni f(x,y), dove x e y
sono le coordinate spaziali. L’ampiezza di f in ogni coppia di ordinate (x,y) è chiamata
intensità dell’immagine in quel punto e ogni punto rappresenta un pixel dell’immagine.
Nel caso di immagini con scala di grigio l’intensità del pixel è definita anche come tono di
grigio.
La metodologia descritta nel paragrafo precedente è fortemente incentrata sul concetto
di similarità e necessita di una misura di similarità s per confrontare gli oggetti
appartenenti ad un insieme. Nel caso specifico, l’insieme in esame è l’intervallo dei livelli
di grigio G={0, …, 255}, mentre gli oggetti sono i singoli toni di grigio giG (dove 0
rappresenta il colore nero, e 255 il colore bianco).
Il primo problema che si pone, quindi, è quello di trovare una adeguata misura di
similarità tra i toni di grigio. Questo aspetto è di fondamentale importanza, in quanto la
misura scelta influenza fortemente la forma della funzione f(Gk,gi,k) e, di conseguenza, il
risultato del processo di clustering.
In una prima ipotesi, si potrebbe considerare una misura di similarità s inversamente
proporzionale alla differenza in valore assoluto tra due diversi toni di grigio:
sg i , g j 1
gi g j
255
(36)
Tuttavia, una tale scelta si rivela del tutto inefficace dal punto di vista del risultato
ottenuto in termini di clustering. Infatti, l’algoritmo genera un unico insieme con
all’interno tutti gli oggetti di partenza. In altri termini, a partire da G restituisce G stesso.
La ragione principale risiede nel fatto che tale misura di similarità non tiene conto, in
alcun modo, della distribuzione dei toni di grigio all’interno dell’immagine. Infatti,
applicando la (36) ai due toni di grigio gi=0 e gj=255, si otterrebbe s(gi, gj )=0 per
qualsiasi immagine.
Si deduce, quindi, che la misura di similarità s deve dipendere dall’immagine. Questo può
essere ottenuto pesando ogni pixel con la probabilità che esso sia presente
nell’immagine in esame.
47
Figura 10: immagine di una risonanza magnetica del cervello (sinistra). Istogramma dei pixel e frequenza dei toni di
grigio della relativa immagine (destra)
Nell’istogramma h di una immagine I (es. Figura 10), sull’asse delle ascisse è indicata
l’intensità del pixel tono di grigio, mentre sull’asse delle ordinate è riportato il numero di
pixel nell’immagine con tale tono di grigio. La frequenza di un tono di grigio può variare,
quindi tra 0 ed il numero totale di pixel |I| nell’immagine I. Per trasformare h in una
distribuzione di probabilità, è sufficiente far sì che i valori in h varino tra 0 ed 1, e che la
loro somma sia pari ad 1. A tal scopo la distribuzione di probabilità P dei toni di grigio è
calcolata come:
Pi
hi
(37)
255
hk
k 0
Se si indica con p(gi) la probabilità che un tono di grigio gi sia presente nell’immagine I,
la (36) può essere riscritta come segue:
sg i , g j 1
pg i g i pg j g j
255
(38)
La formulazione data nella (38) non è scevra da anomalie. Un esempio molto chiaro è
fornito dal caso in cui uno dei due toni di grigio sia il nero. Si consideri il caso in cui
gi=255 e gj=0, con rispettive probabilità p(gi)=0 e p(gj)=0.5, la (38) fornisce come
similarità 1, per cui il nero ed il bianco finiscono nello stesso sottoinsieme di oggetti
rappresentativi.
48
Questo inconveniente è dato dal fatto di aver completamente eliminato il fattore che
teneva conto della radicale differenza fra due toni di grigio, a prescindere dalla
probabilità con cui essi si verifichino nell’immagine. Risulta necessario reintrodurre
questo termine nella formula, bilanciandone il peso rispetto alla differenza pesata. Al
fine di rendere bilanciato il contributo dei due termini, la differenza in valore assoluto
fra due pixel viene reinserita ma in scala logaritmica, ottenendo quindi la seguente:
sg i , g j 1 pg i g i pg j g j log g i g j 1
(39)
La costante +1 nell’argomento del logaritmo la permette di ovviare al caso in cui la
differenza in valore assoluto dei toni di grigio sia uguale a 0; in tal caso, infatti, il
logaritmo assumerebbe come valore -∞. La funzione è una funzione di
normalizzazione, che mappa i valori da un intervallo di partenza (-∞, ∞) in un intervallo
(0,1).
La misura di similarità definita nella (39), non tiene conto di un altro aspetto
fondamentale in un processo di clustering, ossia, la distribuzione degli oggetti in termini
spaziali. A questa lacuna è possibile ovviare introducendo nella (39) una misura della
sparsità dei pixel che assumono come valore un dato tono di grigio. Come misura di
sparsità è stata adottata la deviazione standard rispetto alle coordinate spaziali dei pixel.
Dato un tono di grigio gk, si considera l’insieme dei pixel Igi={(x,y) | I(x,y)= gi} e se ne
calcola il centroide, ossia il punto le cui coordinate (cx, cy,) scaturiscono dalla media sulle
ascisse e sulle ordinate di tutti i pixel appartenenti all’insieme Igi. La deviazione standard
è quindi calcolata come:
(I g )
i
x c y c
2
x
2
y
(40)
I gi
Poiché il confronto avviene fra due toni di grigio gi e gj, ciascuno dei quali caratterizzato
da una propria sparsità (Igi) e (Igj), il fattore che riassume l’indice di sparsità è dato
da:
Ig i , Ig j
min Ig i , Igj
.
max Ig i , Igj
(41)
49
La formula complessiva, quindi, che esprime la similarità fra due toni di grigio è data da:
sg i , g j 1 pg i g i pg j g j log g i g j 1 Ig i , Ig j
(42)
Applicando la misura di similarità s(gi, gj ) ai toni di grigio in un immagine, la funzione
f(Gk,gi,k) assume una andamento tipico mostrato nella Figura 11. I toni di grigio si
dispongono lungo una curva dalla tipica forma parabolica, con dei picchi e dei tratti
discendenti.
Figura 11: esempio di una curva prodotta dalla funzione entropia per una slice di una MRI del cervello.
Osservando la Figura 11 si può comprendere come toni di grigio con lo stesso grado di
rappresentatività tendono a disporsi lungo un tratto discendente della curva, mentre i
picchi possono essere considerati come l’inizio di un nuovo cluster. L’algoritmo di
clustering, quindi procede nel seguente modo:
a) crea il primo cluster e inserisci il primo elemento;
b) se l’elemento corrente è su un tratto discendente della curva, inseriscilo nel
cluster corrente, altrimenti crea un nuovo cluster e inserisci tale elemento.
50
c) Se l’elenco degli elementi da selezionare è non vuoto, torna al punto (b).
In Figura 12 è mostrato l’istogramma dell’immagine che si ottiene a partire da I quando i
toni di grigio in un cluster vengono sostituiti con il rappresentante del cluster.
Figura 12: istogramma dei pixel e frequenza dei toni di grigio di una immagine MRI del cervello dopo la
quantizzazione, effettuata tramite clustering dei toni di grigio.
Come si può osservare dalla Figura 12, in taluni casi, l’algoritmo produce una
oversegmentation, per cui ci sono cluster che potrebbero essere fusi insieme. Per questa
ragione è stata introdotta a valle del processo di clustering, una procedura di merging di
cluster considerati fra loro vicini.
Dato un cluster (rappresento da una stecca nell’istogramma), si verifica se sono presenti
altri cluster entro una determinata soglia, con i quali poter effettuare una fusione. Ad
esempio, dato un cluster il cui rappresentante è il tono di grigio gk, l’algoritmo cerca di
fonderlo con i cluster rappresentati da toni di grigio nell’intervallo [gk+1, gk+4], nel caso in
cui ciò avvenga per il tono di grigio gk+h, quest’ultimo diventa il punto di partenza per la
ricerca di altri cluster che possano essere fusi, controllando l’intervallo [gk+h+1, gk+h+4].
Quando due cluster rappresentati rispettivamente dai toni di grigio gi e gj vengono fusi,
tutti i toni di grigio nell’immagine rappresentati da gj vengono sostituiti con gi. La
procedura di merging termina quando non trova nessun cluster da poter fondere
ulteriormente.
51
Dopo la procedura di merging, l’istogramma mostrato in Figura 12 si modifica come
mostrato in Figura 13. La Figura 14 mostra il risultato (in falsi colori) prodotto
dall’algoritmo sull’immagine di esempio che è riportata in Figura 10.
Figura 13: istogramma dei pixel e frequenza dei toni di grigio di una immagine MRI del cervello dopo il processo di
merging di cluster vicini.
L’algoritmo di clustering proposto presenta diversi vantaggi:
- Con l’utilizzo dell’entropia non è necessario specificare in anticipo il numero dei
cluster (come accade in un normale algoritmo basato su tecniche fuzzy).
- Nel fuzzy clustering l’assegnazione degli elementi ai singoli cluster è fatta pixel per
pixel, mentre nel metodo basato sull’entropia essa è fatta sulla base dei toni di
grigio, che sono in numero fissato pari a 256. Al crescere della risoluzione
dell’mmagine, si ottiene un considerevole risparmio in termini di costo
computazionale.
52
Figura 14: risultati dell’algoritmo di clustering basato su entropia dell’immagine mostrata in figura 13.
3.4 Processo di estrazione della massa tumorale da immagini
MRI
Lo step successivo a quello della quantizzazione delle immagini MRI è rappresentato
dall’estrazione della massa tumorale. Dalla Figura 9, risulta evidente che la massa
tumorale è visibile nelle immagini di tipo T1C, T2 e FLAIR. Di conseguenza, in questa
fase si può escludere l’immagine T1, in quanto poco informativa. La massa tumorale è
composta da un nucleo, che nella maggior parte delle immagini MRI tende al colore
bianco, e dall’edema, che invece nella maggior parte delle immagini MRI tende ad un
colore grigio con tonalità più chiara rispetto alla massa del cervello sano. Nella fase di
estrazione della massa tumorale, l’algoritmo controlla se nell’immagine di partenza vi
sono pixel con tonalità di colore chiaro, in tal caso analizza i cluster corrispondenti
ottenuti al passo precedente: per ogni cluster controlla se esso è denso (i pixel con la
stessa tonalità nel cluster sono concentrati in uno spazio ristretto) oppure sparso (i pixel
con la stessa tonalità nel cluster sono distribuiti in uno spazio ampio). Dato che cluster
con la stessa tonalità di grigio possono essere lontani tra loro nell’immagine, si può far
ricorso alla varianza per determinare se un cluster è denso (varianza piccola) oppure
sparso (varianza alta). La ricerca del nucleo è effettuata analizzando le immagini FLAIR,
53
T1C e T2. In particolare, l’algoritmo effettua un prodotto pixel per pixel tra le immagini
FLAIR e T1C, il cui risultato è confrontato con una soglia. Allo stesso modo si procede
per le immagini FLAIR e T2. I risultati di questi due prodotti sono messi in and logico.
Per l’edema, si analizza l’immagine FLAIR, dalla quale si estraggono i toni di grigio
tendenti al bianco. Da tale insieme si eliminano tutti i pixel precedentemente classificati
come nucleo. La massa completa è data dall’unione del nucleo e dell’edema.
In Figura 15 è mostrato il ground truth di una slice (sinistra) e il risultato dell’algoritmo
per l’estrazione della massa tumorale (destra).
Figura 15: Immagine ground truth (sinistra) e il risultato ottenuto dopo l’applicazione dell’algoritmo (destra) della
slice 95 del volume BRATS_HG0001
54
Capitolo 4
Esperimenti e risultati
Ai fini della sperimentazione, è fondamentale individuare un dataset di volumi di MRI
che sia rappresentativo per la valutazione del problema e largamente condiviso, così da
rendere confrontabili i risultati ottenuti dalla tecnica proposta, con quelli di altri metodi
presenti in letteratura. In questo lavoro di tesi, si è deciso, quindi, di utilizzare volumi di
MRI messi
a
disposizione
dal
Kitware/MIDAS
scaricabili
al
seguente
link
http://challenge.kitware.com/midas/folder/102 [115].
Il dataset contiene immagini di risonanze magnetiche multi-contrasto scansionate da 30
pazienti con gliomi (sia di basso-grado, che di alto-grado,
entrambi con o senza
resezione). Inoltre, le immagini sono state annotate manualmente da esperti, fornendo
un ground truth (o golden standard) per tre diverse classi di target: core, edema e massa
completa. Per ogni paziente, sono disponibili immagini con diversi tipi di contrasto,
ossia T1, T2, FLAIR e post-Gadolinium T1. Tutti i volumi sono stati co-registrati rispetto
all’immagine di contrasto T1 e interpolati in modo isotropo a 1 mm di risoluzione. Al
contrario, le immagini non sono state co-registrate in modo da mettere i volumi di tutti i
pazienti in un unico spazio di riferimento.
Le scansioni MR cosi come la segmentazione di riferimento, sono distribuite nel formato
di file ITK e VTK-compatible MetalO . Pazienti con alto e basso grado di gliomi hanno file
chiamati "BRATS_HG" e "BRATS_LG", rispettivamente. Tutte le immagini sono
immagazzinate come interi positivi a 16-bit. Le segmentazioni manuali (nomi di file che
finiscono in "_truth.mha") hanno solo tre livelli di intensità: 1 per edema, 2 per tumore
attivo, e 0 per tutto il resto. Una dettagliata documentazione relativa al formato del file
MetalO è disponibile al riferimento http://www.itk.org/Wiki/MetaIO/Documentation
[116].
Il dataset contiene anche immagini in cui la massa tumorale è stata simulata per 25
tumori di grado alto e 25 di grado basso. Queste immagini simulate seguono fedelmente
le convenzioni usate per i dati reali, tranne il nome del file iniziano con “SimBRATS".
55
Maggiori dettagli sui metodi di simulazione sono disponibili al seguente riferimento
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2660387/ [118].
4.1 Criterio di valutazione
Il risultato della segmentazione ed estrazione della massa tumorale è valutato mediante
il coefficiente Dice (DC) [119]. Esso è comunemente utilizzato dalla comunità scientifica
a tale scopo ed è calcolato secondo la seguente equazione:
DC
2| A B |
,
| A| | B |
(41)
Dove A e B denotano il ground truth e il risultato ottenuto dal metodo in esame,
rispettivamente. Il range di valori del DC è [0,1] dove 1 indica una segmentazione
perfetta, mentre 0 rappresenta una segmentazione completamente errata.
4.2 Risultati ottenuti dall’algoritmo di clustering basato
sull’entropia
Dal dataset descritto nel paragrafo precedente, si riporta un caso di studio del primo
volume dell’insieme, ossia BRATS_HG0001. Da questo insieme composto dai volumi:
BRATS_HG0001_T1.mha;
BRATS_HG0001_T1C.mha;
BRATS_HG0001_T2.mha
e
BRATS_HG0001_FLAIR.mha, si esclude il ground truth che nel dataset è denominato
come BRATS_HG0001_truth.mha. Il caso di studio riportato per tale volume è relativo
alle slice: 95, 100 e 111. Si riportano le immagini originali nelle figure 16 (slice 95), 20
(slice 100) e 24 (slice 111).
Applicando l’algoritmo di clustering sulle immagine sopracitate, si ottiene una
distribuzione di clusters che è mostrata nelle figure 18 (slice 95), 22 (slice 100) e 26
(slice 111). Dopo l’esecuzione dell’algoritmo si ottengono come output le immagini
quantizzate come mostrato nelle figure 17 (slice 95), 21 (slice 100) e 25 (slice 111).
Applicando il processo di localizzazione della massa tumorale nelle immagini, si ottiene
il risultato, che viene poi confrontato con il ground truth. Nelle figure 19 (slice 95), 23
(slice 100) e 27 (slice 111) viene mostrato il groud truth (a sinistra delle figure) e il
risultato ottenuto dall’algoritmo (a destra delle figure) delle relative 3 slice del volume.
56
Misurando quantitativamente il risultato ottenuto tramite il coefficiente Dice (descritto
nel paragrafo precedente) si ottengono le rispettive misure che sono riportate nella
tabella 6.
Figura 16: Immagini della slice 95 del volume BRATS_HG0001. In alto da sinistra verso destra: T1, T1C. In basso da
sinistra verso destra: T2, FLAIR.
Figura 17: Risultati ottenuti dall’algoritmo nella quantizzazione della slice 95. In alto da sinistra verso destra:
T1, T1C. In basso da sinistra verso destra: T2, FLAIR.
57
Figura 18: Andamento della curva d’entropia per la slice 95 del volume BRATS_HG0001, partendo in alto da
sinistra verso destra: T1, T1C. In basso da sinistra verso destra: T2, FLAIR.
Figura 19: Immagine ground truth (sinistra) e il risultato ottenuto dopo l’applicazione dell’algoritmo (destra) della
slice 95 del volume BRATS_HG0001.
58
Figura 20: Immagini della slice 100 del volume BRATS_HG0001. In alto da sinistra verso destra: T1, T1C. In basso da
sinistra verso destra: T2, FLAIR.
Figura 21: Risultati ottenuti dall’algoritmo nella quantizzazione della slice 100. In alto da sinistra verso destra: T1,
T1C. In basso da sinistra verso destra: T2, FLAIR.
59
Figura 22: Andamento della curva d’entropia per la slice 100 del volume BRATS_HG0001, partendo in alto da sinistra
verso destra: T1, T1C. In basso da sinistra verso destra: T2, FLAIR.
Figura 23: Immagine di ground truth (sinistra) e il risultato ottenuto dopo l’applicazione dell’algoritmo (destra) alla
slice 100 del volume BRATS_HG0001.
60
Figura 24: Immagini della slice 111 del volume BRATS_HG0001. In alto da sinistra verso destra: T1, T1C. In basso da
sinistra verso destra: T2, FLAIR.
Figura 25: Risultati ottenuti dall’algoritmo nella quantizzazione della slice 111. In alto da sinistra verso destra: T1,
T1C. In basso da sinistra verso destra: T2, FLAIR.
61
Figura 26: Andamento della curva d’entropia per la slice 111 del volume BRATS_HG0001, partendo in alto da sinistra
verso destra: T1, T1C. In basso da sinistra verso destra: T2, FLAIR.
Figura 27: Immagine ground truth (sinistra) e il risultato ottenuto dopo l’applicazione dell’algoritmo (destra) per la
slice 111 del volume BRATS_HG0001.
62
Tabella 6: Misurazione con coefficiente Dice per le slice 95, 100 e 111 del volume BRATS_HG0001,
Core
Edema
Massa Completa
Slice 95
0.9624
0.8140
0.8863
Slice 100
0.9412
0.8226
0.8570
Slice 111
0
0.5376
0.6121
L’algoritmo è stato applicato a tutte le immagini di un volume e su tutti i volumi.
4.3 Confronto con algoritmo basato sulla simmetria
Di seguito, si riporta un confronto quantitativo dell’algoritmo basato sull’entropia con
l’algoritmo basato sulla simmetria (tabelle 7 e 8) con i risultati misurati tramite il
coefficiente Dice. I risultati sono espressi in termini di prestazioni medie su tutti i volumi
del dataset calcolando il valore medio ed il mediano delle precisioni medie ottenute su
tali volumi. Le immagini usate per entrambi gli algoritmi sono state estratte dallo stesso
dataset messo a disposizione dal Kitware/MIDAS.
Tabella 7: Risultati ottenuti sui dati reali del dataset.
Dati Reali
DC
Simmetrie
Entropia
Alto grado
Basso grado
Alto grado
Basso grado
Medio
0.67 ± 0.22
0.78 ± 0.10
0.68 ± 0.17
0.63 ± 0.17
Mediano
0.75
0.78
0.70
0.62
Tabella 8: Risultati ottenuti sui dati simulati del dataset.
Dati Simulati
DC
Simmetrie
Entropia
Alto grado
Basso grado
Alto grado
Basso grado
Medio
0.80 ± 0.10
0.72 ± 0.05
0.73 ± 0.18
0.71 ± 0.19
Mediano
0.82
0.71
0.72
0.71
63
4.4 Confronto con l’algoritmo basato sul fuzzy clustering con
metodi level set
Riprendendo l’immagine della slice 95 del volume BRATS_HG0001 (Figura 16) si può
vedere il risultato che si ottiene applicando l’algoritmo di fuzzy clustering, descritto nel
capitolo 2, rispetto all’immagine mostrata in Figura 16. Di seguito sono riportate le
immagini T1C, T2, FLAIR della Figura 16 con la relativa segmentazione ottenuta
mediante fuzzy clustering level set.
Figura 28: Esempio di risultato della segmentazione usando fuzzy clustering level set slice 95 del volume
BRATS_HG0001. Dall’alto verso il basso :FLAIR, T1C e T2.
64
Bibliografia
1. Ahmed S, Iftekharuddin K M and Vossough A 2011 Efficacy of texture, shape, and
intensity feature fusion for posterior-fossa tumor segmentation in MRI IEEE Trans.
Inform. Technol. Biomed. 15 206–13
2. Ambrosini R D,Wang P and O’DellW G 2010 Computer-aided detection of metastatic
brain tumors using automated three-dimensional template matching J. Magn. Reson.
Imaging 31 85–93
3. Angelini E D, Clatz O, Mandonnet E,Konukoglu E,Capelle L and DuffauH2007 Glioma
dynamics and computational models: a review of segmentation, registration, and in
silico growth algorithms and their clinical applications
Curr. Med. Imaging Rev. 3 262–76
4. Archip N, Jolesz F A and Warfield S K 2007a A validation framework for brain
tumor segmentation Acad. Radiol. 14 1242–51
5. BalafarM A, Ramli A R, SaripanM I and Mashohor S 2010 Review of brain MRI image
segmentation methods Artif. Intell. Rev. 33 261–74
6. Bankman I N 2008 Handbook of Medical Image Processing and Analysis 2nd edn
(New York: Academic)
7. Bauer S, Nolte L-P and Reyes M 2011a Fully automatic segmentation of brain tumor
images using support vector machine classification in combination with hierarchical
conditional random field regularization MICCAI: Int.
Conf. on Medical Image Computing and Computer Assisted Interventions (Lecture Notes
in Computer Science vol 6893) ed G Fichtinger, A Martel and T Peters (Berlin:
Springer) pp 354–61
65
8. Birkbeck N, Cobzas D, Jagersand M, Murtha A and Kesztyues T 2009 An interactive
graph cut method for brain tumor segmentation Workshop on Applications of
Computer Vision pp 1–7
9. Boykov Y and Funka-Lea G 2006 Graph cuts and efficient N-D image segmentation
Int. J. Comput. Vis. 70 109–31
10. Cai H, Verma R, Ou Y, Lee S-K, Melhem E and Davatzikos C 2007 Probabilistic
segmentation of brain tumors based on multi-modality magnetic resonance images
4th IEEE Int. Symp. on Biomedical Imaging: From Nano to Macro pp 600–3
11. Chen W 2007 Clinical applications of PET in brain tumors J. Nucl. Med. 48 1468–
81
12. ClarkM C, Hall L O, Goldgof D B, Velthuizen R, Murtagh F R and SilbigerM S 1998
Automatic tumor segmentation using knowledge-based techniques IEEE Trans. Med.
Imaging 17 187–201
13. Clarke J and Chang S 2009 Pseudoprogression and pseudoresponse: challenges in
brain tumor imaging Curr. Neurol. Neurosci. Rep. 9 241–6
14. Cobzas D, Birkbeck N, Schmidt M, Jagersand M and Murtha A 2007 3D variational
brain tumor segmentation using a high dimensional feature set IEEE 11th Int. Conf. on
Computer Vision pp 1–8
15. Cobzas D and Schmidt M 2009 Increased discrimination in level set methods with
embedded conditional random fields IEEE Conf. on Computer Vision and Pattern
Recognition pp 328–35
16. Cocosco C, Kollokian V, Kwan R and Evans A 1997 BrainWeb: online interface to a
3DMRI simulated brain database NeuroImage 5 425
66
17. Corso J J, Sharon E, Dube S, El-Saden S, Sinha U and Yuille A 2008 Efficient
multilevel brain tumor segmentation with integrated Bayesian model classification
IEEE Trans. Med. Imaging 27 629–40
18. Corso J J, Yuille A, Sicotte N L and Toga A 2007 Detection and segmentation of
pathological structures by the extended graph-shifts algorithm MICCAI: Int. Conf. on
Medical Image Computing and Computer-Assisted Intervention vol 10 (Berlin:
Springer) pp 985–93
19. Criminisi A, Shotton J and Konukoglu E 2011 Decision forests for classification,
regression, density estimation, manifold learning and semi-supervised learning
Technical Report MSR-TR-2011-114 Microsoft Research
20. Crum W R, Camara O and G Hill D L 2006 Generalized overlap measures for
evaluation and validation in medical image analysis IEEE Trans. Med. Imaging 25
1451–61
21. De Angelis L M 2001 Brain tumors N. Engl. J. Med. 344 114–23
22. Deimling A 2009 Gliomas (Recent Results in Cancer Research vol 171) (Berlin:
Springer)
23. Deimling A 2009 Gliomas (Recent Results in Cancer Research vol 171) (Berlin:
Springer)
24. Dempster A 1977 Maximum likelihood from incomplete data via the EM algorithm
J. R. Stat. Soc. 39 1–38
25. Diaz I, Boulanger P, Greiner R and Murtha A 2011 A critical review of the effects of
de-noising algorithms on MRI brain tumor segmentation Annu. Int. Conf. of the IEEE
Engineering in Medicine and Biology Society vol 2011 pp 3934–7
67
26. DrevelegasAand PapanikolaouN2011 Imaging modalities in brain tumors Imaging
of Brain Tumors with Histological Correlations ed A Drevelegas (Berlin: Springer) pp
13–34 chapter 2
27. Egger J,Kapur T, Fedorov A, Pieper S, Miller J V,VeeraraghavanH, Freisleben B,
GolbyA J, Nimsky C and Kikinis R 2013 GBM volumetry using the 3D slicer medical
image computing platform Sci. Rep. 3 1364
28. Ekin A 2011 Pathology-robust MR intensity normalization with global and local
constraints IEEEInt. Symp. On Biomedical Imaging: From Nano to Macro (Chicago) pp
333–6
29. Farjam R, Parmar H A, Noll D C, Tsien C I and Cao Y 2012 An approach for
computer-aided detection of brain metastases in post-Gd T1-W MRI Magn. Reson.
Imaging 30 824–36
30. Fennema-NotestineCet al 2006 Quantitative evaluation of automated skullstripping methods applied to contemporary and legacy images: effects of diagnosis,
bias correction, and slice location Hum. Brain Mapp. 27 99–113
31. Fletcher-Heath L M, Hall L O, Goldgof D B and Murtagh F R 2001 Automatic
segmentation of non-enhancing brain tumors in magnetic resonance images Artif.
Intell. Med. 21 43–63
32. Gao Y, Kikinis R, Bouix S, Shenton M and Tannenbaum A 2012 A 3D interactive
multi-object segmentation tool using local robust statistics driven active contours
Med. Image Anal. 16 1216–27
33. Garcìa-Lorenzo D, Francis S, Narayanan S, Arnold D L and Collins D L 2013 Review
of automatic segmentation methods of multiple sclerosis white matter lesions on
conventional magnetic resonance imaging Med. Image Anal. 17 1–18
68
34. Geremia E,Menze B H, PrastawaM,WeberM A, Criminisi A and Ayache N 2012
Brain tumor cell density estimation frommulti-modalMRimages based on a synthetic
tumor growthmodel MICCAIWorkshop on MedicalComputer Vision (Lecture Notes in
Computer Science) (Nice: Springer) pp 273–82
35. Giese A, Bjerkvig R, Berens M E and Westphal M 2003 Cost of migration: invasion
of malignant gliomas and implications for treatment J. Clin. Oncol. 21 1624–36
36. Greenberg H, Chandler W and Sandler H 1999 Brain Tumors (Oxford: Oxford
University Press)
37. Hamamci A, Kucuk N, Karaman K, Engin K and Unal G 2011 Tumor-cut:
segmentation of brain tumors on contrast enhanced MR images for radiosurgery
applications IEEE Trans. Med. Imaging 31 790–804
38. Hamamci A, Unal G, Kucuk N and Engin K 2010 Cellular automata segmentation of
brain tumors on post contrast MR images MICCAI: Int. Conf. on Medical Image
Computing and Computer-Assisted Intervention vol 13 pp 137–46
39. Harati V, Khayati R and Farzan A 2011 Fully automated tumor segmentation
based on improved fuzzy connectedness algorithm in brain MR images Comput. Biol.
Med. 41 483–92
40. Ho S, Bullitt E and Gerig G 2002 Level-set evolution with region competition:
automatic 3-D segmentation of brain tumors Proc. Int. Conf. on Pattern Recognition vol
1 pp 532–35
41. Hsieh T M, Liu Y-M, Liao C-C, Xiao F, Chiang I-J andWong J-M 2011 Automatic
segmentation of meningioma from non-contrasted brain MRI integrating fuzzy
clustering and region growing BMCMed. Inform. Decis.Mak. 11 54
42. Jensen T R and Schmainda K M 2009 Computer-aided detection of brain tumor
invasion using multiparametric MRI J. Magn. Reson. Imaging 30 481–9
69
43. Kanaly C W, Ding D, Mehta A I, Waller A F, Crocker I, Desjardins A, Reardon D A,
Friedman A H, Bigner D D and Sampson J H 2011 A novel method for volumetric MRI
response assessment of enhancing brain tumors PloS One 6 e16031
44. Kassner A and Thornhill R E 2010 Texture analysis: a review of neurologic MR
imaging applications Am. J. Neuroradiol. 31 809–16
45. Kaus M R, Warfield S K, Nabavi A, Black P M, Jolesz F A and Kikinis R 2001
Automated segmentation of MR images of brain tumors Radiology 218 586–91
46. Kelly P J, Daumas-Duport C, Kispert D B, Kall B a, Scheithauer B W and Illig J J 1987
Imaging-based stereotaxic serial biopsies in untreated intracranial glial neoplasms J.
Neurosurg. 66 865–74
47. Khotanlou H, Colliot O, Atif J and Bloch I 2009 3D brain tumor segmentation in
MRI using fuzzy classification, symmetry analysis and spatially constrained
deformable models Fuzzy Sets Syst. 160 1457–73
48. Kikinis R and Pieper S 2011 3D Slicer as a tool for interactive brain tumor
segmentation Annu. Int. Conf. of the IEEE Engineering in Medicine and Biology Society
vol 2011 pp 6982–4
49. Kindermann R and Snell J 1980 Markov Random Fields and Their Applications
(Providence, RI: American Mathematical Society)
50. Kleihues P, Burger P C and Scheithauer B W 1993 The new WHO classification of
brain tumours Brain Pathol. 3 255–68
51. Klein A et al 2009 Evaluation of 14 nonlinear deformation algorithms applied to
human brain MRI registration NeuroImage 46 786–802
70
52. Kohler B A, Ward E, McCarthy B J, Schymura M J, Ries L A G., Eheman C, Jemal A,
Anderson R N, Ajani U A and Edwards B K 2011 Annual report to the nation on the
status of cancer, 1975–2007, featuring tumors of the brain and other nervous system
J. Natl Cancer Inst. 103 714–36
53. Krex D et al 2007 Long-term survival with glioblastoma multiforme Brain J.
Neurol. 130 2596–606
54. Kumar S and Hebert M 2006 Discriminative Random Fields Int. J. Comput. Vis. 68
179–201
55. Lafferty J, McCallum A and Pereira F 2001 Conditional random fields: Probabilistic
models for segmenting and labeling sequence data Proc. 18th Int. Conf. on Machine
Learning pp 282–9
56. Lee C-H,Wang S, Murtha A, Brown M R G. and Greiner R 2008 Segmenting brain
tumors using pseudo-conditional random fields MICCAI: Int. Conf. on Medical Image
Computing and Computer-Assisted Intervention vol 11 pp 359–66
57. Lepetit V, Lagger P and Fua P 2005 Randomized trees for real-time keypoint
recognition IEEE Comput. Vis. Pattern Recognit. 2 775–81
58. Liang Z-P and Lauterbur P C 2000 Principles of Magnetic Resonance Imaging: A
Signal Processing Perspective (New York: Wiley)
59. Macdonald D R, Cascino T L, Schold S C and Cairncross J G 1990 Response criteria
for phase II studies of supratentorial malignant glioma J. Clin. Oncol. 8 1277–80
60. Maintz J and Viergever M A 1998 A survey of medical image registration Med.
Image Anal. 2 1–36
61. Mang A et al 2008 Consistency of parametric registration in serial MRI studies of
brain tumor progression Int. J. Comput. Assist. Radiol. Surg. 3 201–11
71
62. Mazzara G P, Velthuizen R P, Pearlman J L, Greenberg H M and Wagner H 2004
Brain tumor target volume determination for radiation treatment planning through
automated MRI segmentation Int. J. Radiat. Oncol.
Biol. Phys. 59 300–12
63. McInerney T and Terzopoulos D 1996 Deformable models in medical image
analysis: a survey Med. Image Anal. 1 91–108
64. Menze B H, Van Leemput K, Lashkari D, Weber M-A, Ayache N and Golland P 2010
A generative model for brain tumor segmentation in multi-modal images MICCAI:
Medical Image Computing and Computer-Assisted Intervention vol 13 pp 151–9
65. Moon N, Bullitt E, Van Leemput K and Gerig G 2002 Automatic brain tumor
segmentation MICCAI: Medical Image Computing and Computer-Assisted Intervention
(Lecture Notes in Computer Science vol 10) (Berlin: Springer) pp 372–9
66. Neal M L and Kerckhoffs R 2010 Current progress in patient-specific modeling
Briefings Bioinformatics 11 111–26
67. Nie J, Xue Z, Liu T, Young G S, Setayesh K, Guo L and Wong S T C 2009 Automated
brain tumor segmentation using spatial accuracy-weighted hidden Markov random
field Comput. Med. Imaging Graph. 33 431–41
68. Niethammer M, Hart G L, Pace D F, Vespa P M, Irimia A, van Horn J D and Aylward
S R 2011 Geometric metamorphosis MICCAI: Medical Image Computing and ComputerAssisted Interventions (Lecture Notes in Computer Science) ed G Fichtinger, A Martel
and T M Peters (Toronto: Springer) pp 639–46
69. Nyùl L G and Udupa J K 1999 On standardizing the MR image intensity scale Magn.
Reson. Med. 42 1072–81
72
70. Pham D, Xu C and Prince J 2000 Current methods in medical image segmentation
Annu. Rev. Biomed. Eng. 2 315–37
71. Phillips W E, Velthuizen R P, Phuphanich S, Hall L O, Clarke L P and Silbiger M L
1995 Application of fuzzy cmeans segmentation technique for tissue differentiation
inMR images of a hemorrhagic glioblastoma multiforme Magn. Reson. Imag. 13 277–
90
72. Plate K H and Risau W 1995 Angiogenesis in malignant gliomas Glia 15 339–47
73. Pope W B and Hessel C 2011 Response assessment in neuro-oncology criteria:
implementation challenges in multicenter neuro-oncology trials Am. J. Neuroradiol.
32 794–7
74. Popuri K, Cobzas D, Murtha A and J¨agersandM2012 3D variational brain tumor
segmentation using Dirichlet priors on a clustered feature set Int. J. Comput. Assist.
Radiol. Surg. 7 493–506
75. Prastawa M, Bullitt E and Gerig G 2009 Simulation of brain tumors in MR images
for evaluation of segmentation efficacy Med. Image Anal. 13 297–311
76. Prastawa M, Bullitt E, Ho S and Gerig G 2004 A brain tumor segmentation
framework based on outlier detection Med. Image Anal. 8 275–83
77. Prastawa M, Bullitt E, Moon N, Van Leemput K and Gerig G 2003 Automatic brain
tumor segmentation by subject specific modification of atlas priors Acad. Radiol. 10
1341–8
78. Rexilius J, Hahn H K, Klein J, Lentschig M G and Peitgen H O 2007 Multispectral
brain tumor segmentation based on histogram model adaptation Proc. SPIE 6514
65140V
73
79. Ruan S, Lebonvallet S, Merabet A and Constans J-M 2007 Tumor segmentation
from a multispectral MRI images by using support vector machine classification 4th
IEEE Int. Symp. on Biomedical Imaging: From Nano to Macro vol 2 pp 1236–9
80. Ruan S, Zhang N, Liao Q and Zhu Y 2011 Image fusion for following-up brain
tumor evolution Proc. IEEE Int. Symp. on Biomedical Imaging: From Nano to Macro
(Chicago) pp 281–4
81. Saha B N, Ray N, Greiner R, Murtha A and Zhang H 2011 Quick detection of brain
tumors and edemas: a bounding box method using symmetry Comput. Med. Imaging
Graph. 36 95–107
82. Schad L R, Bluml S and Zuna I 1993 MR tissue characterization of intracranial
tumors by means of texture analysis Magn. Reson. Imaging 11 889–96
83. Schmidt M, Levner I, Greiner R, Murtha A and Bistritz A 2005 Segmenting brain
tumors using alignment-based features IEEE 4th Int. Conf. on Machine Learning and
Applications pp 1–6
84. Schoelkopf B and Smola A 2002 Learning with Kernels: Support Vector Machines,
Regularization, Optimization, and Beyond (Cambridge, MA: MIT Press)
85. Shotton J, Fitzgibbon A, Cook M, Sharp T, Finocchio M, Moore R, Kipman A and
Blake A 2011 Real-time human pose recognition in parts from single depth images
IEEE Conf. on Computer Vision and Pattern Recognition pp 1297–304
86. Speier W, Iglesias J, El-Kara L, Tu Z and Arnold C 2011 Robust skull stripping of
clinical glioblastoma multiforme data MICCAI: Medical Image Computing and
Computer-Assisted Interventions (Lecture Notes in Computer Science vol 6893) ed G
Fichtinger, A Martel and T Peters (Toronto: Springer) pp 659–66
87. Tovi M 1993 MR imaging in cerebral gliomas analysis of tumour tissue
components Acta Radiol. Suppl. 384 1–24
74
88. Tuceryan M and Jain A 1998 Texture analysis Handbook of Pattern Recognition
and Computer Vision 2nd edn vol 304 ed C Chen, L Pau and P Wang (Singapore: World
Scientific) pp 207–48
89. VaidyanathanM1995 Comparison of supervised MRI segmentation methods for
tumor volume determination during therapy Magn. Reson. Imaging 13 719–28
90. Verma R, Zacharaki E I, Ou Y, Cai H, Chawla S, Lee S-K, Melhem E R, Wolf R and
Davatzikos C 2008 Multiparametric tissue characterization of brain neoplasms and
their recurrence using pattern classification of MR images Acad. Radiol. 15 966–77
91. Vovk U, Pernus F and Likar B 2007 A review of methods for correction of intensity
inhomogeneity in MRI IEEE Trans. Med. Imaging 26 405–21
92. Wang S and Summers R M 2012 Machine learning and radiology Med. Image Anal.
16 933–51
93. Wang T, Cheng I and Basu A 2009 Fluid vector flow and applications in brain
tumor segmentation IEEE Trans. Biomed. Eng. 56 781–9
94. Warfield S K, Zou K H and Wells W M 2004 Simultaneous truth and performance
level estimation (STAPLE): an algorithm for the validation of image segmentation
IEEE Trans. Med. Imaging 23 903–21
95. Weickert J 1998 Anisotropic Diffusion in Image Processing 1st edn (Stuttgart:
Teubner)
96. Weizman L, Ben Sira L, Joskowicz L, Constantini S, Precel R, Shofty B and Ben
Bashat D 2012 Automatic segmentation, internal classification, and follow-up of optic
pathway gliomas in MRI Med. Image Anal. 16 177–88
75
97. Wels M, Carneiro G, Aplas A, Huber M, Hornegger J and Comaniciu D 2008 A
discriminative model-constrained graph cuts approach to fully automated pediatric
brain tumor segmentation in 3-D MRI MICCAI: Medical Image Computing and
Computer-Assisted Intervention vol 11 pp 67–75
98. Weltens C, Menten J, Feron M, Bellon E, Demaerel P, Maes F, Van den Bogaert W
and van der Schueren E 2001 Interobserver variations in gross tumor volume
delineation of brain tumors on computed tomography and impact of magnetic
resonance imaging Radiother. Oncol. 60 49–59
99. Wen P Y et al 2010 Updated response assessment criteria for high-grade gliomas:
response assessment in neurooncology working group J. Clin. Oncol. 28 1963–72
100. Wittek A, Miller K, Kikinis R and Warfield S K 2007 Patient-specific model of
brain deformation: application to medical image registration J. Biomech. 40 919–29
101. Xu Z, Asman A J, Singh E, Chambless L, Thompson R and Landman B A 2012
Collaborative Labeling of Malignant Glioma IEEE Int. Symp. on Biomedical Imaging
(Barcelona) pp 1148–51
102. Zhu Y, Young G S, Xue Z, Huang R Y, You H, Setayesh K, Hatabu H, Cao F and
Wong S T 2012 Semi-automatic segmentation software for quantitative clinical brain
glioblastoma evaluation Acad. Radiol. 19 1–9
103. Zikic D, Glocker B, Konukoglu E, Criminisi A, Demiralp C, Shotton J, Thomas O M,
Das T, Rena R and Price S J 2012 Decision Forests for Tissue-specific Segmentation of
High-grade Gliomas inMulti-channel MR MICCAI: Medical Image Computing and
Computer-Assisted Interventions (Lecture Notes in Computer Science vol 7512) (Nice:
Springer) pp 369–76
104. Zou K H, Wells W M, Kikinis R and Warfield S K 2004 Three validation metrics
for automated probabilistic image segmentation of brain tumours Stat. Med. 23
1259–82
76
105. Adler, A., Youmaran, R., Loyka, S.: Towards a measure of biometric information.
In: Proceedings of the Canadian Conference on Electrical and, Computer Engineering,
pp. 210–213 (2006)
106. Bhatnagar, J., Kumar, A.: On estimating some performance indices for biometric
identification. Pattern Recognit. 42(5), 1805–1818 (2009)
107. Bhatnagar, J., Lall, B., Patney, R.K.: Performance issues in biometric
authentication based on information theoretic concepts: a review. IETE Tech. Rev. 27,
273–285 (2010)
108. Bhatnagar, J., Kumar, A., Saggar, N.: A novel approach to improve biometric
recognition using rank level fusion. In: Proceedings of the IEEE Conference on
Computer Vision and, Pattern Recognition, pp. 1–6 (2007)
109. Cover, T.M., Thomas, J.A.: Elements of Information Theory. Wiley, New York
(1991)
110. Gallager, R.G.: Information Theory and Reliable Communication. Wiley, New
York (1968)
111. Golìc, J.D., Baltatu,M.: Entropy analysis and new constructions of biometric key
generation systems. IEEE Trans. Inf. Theory 54(5), 2026–2040 (2008)
112. Jain, A.K., Nandakumar, K., Nagar, A.: Biometric template security. EURASIP J.
Adv. Signal Process. Special issue on Pattern Recognition Methods for Biometrics
(2008)
113. Jassim, A.J., Al-Assam, H., Abbound, A.J., Sellahewa, H.: Analysis of relative
entropy, accuracy, and quality of face biometric. In: Proceedings of theWorkshop on
Pattern Recognition for IT (2010)
114. Roli, F., Didaci, L., Marcialis, G.: Adaptive biometric systems that can improve
with use. In: Ratha, N.K., Govindaraju, V. (eds.) Advances in Biometrics—
Sensors,Algorithms and Systems. Springer, Berlin (2008).
115. http://challenge.kitware.com/midas/folder/102
116. http://www.itk.org/Wiki/MetaIO/Documentation
117. http://brainweb.bic.mni.mcgill.ca/brainweb/
118. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2660387/
119. Dice, L.R.: Measures of the amount of ecologic association between species.
Ecology 26(3), 297-302 (1945)
77
120. D.L. Pham, C. Xu, J. Prince, Current methods in medical image segmentation,
Annual Review of Biomedical Engineering 2 (2000) 315-337.
121. T.F. Chan, L.A. Vese, Active contours without edges, IEEE Transactions on Image
Processing 10 (2001) 266-277.
122. P. Martin, P. Refregier, F. Goudail, F. Guerault, Influence of the noise model on
level set active contour segmentation, IEEE Transactions on Pattern Analysis and
Machine Intelligence 26 (2004) 799-803.
123. K.S. Chuang, H.L. Hzeng, S.Chen, J. Wu, T.J. Chen, Fuzzy c-means clustering
algorithms incorporating local information for image segmentation, Pattern
Recognition 40 (2007) 825-838.
124. W. Cai, S. Chen,D. Zhang, Fast and robust fuzzy c-means clustering algothms
incorporating local information for image segmentation, Pattern Recognition 40
(2007) 825- 838.
125. K. Levinski, A. Sourin, V. Zagorodnov, Interactive surface-guided segmentation of
brain MRI datam Computers in Biology and Medicine 39 (2009) 1153-1160.
126. P.A. Yushkevich, J. Piven, H.C. Hazlett, R.G. Smith, S. Ho, J. C. Gee et all.
Userguided 3D active contour segmentation of anatomical structures: significantly
improved efficiency and reliability, NeuroImage 31 (2007) 1292-1302.
127. G.D. Giannoglou, Y.S. Chatzizisis, V. Koutkias, I. Kompatsiaris, M. Papadogiorgaki,
V. Mezaris et al. A novel active contour model for fully automated segmentation of
intravascular ultrasound images: in vivo validation in human coronary arteries,
Computers in Biology and Medicine 37 (2007) 1292-1302.
128. B.N. Li, C.K. Chui, S.H. Ong, S. Chang, Interating FCM and level sets for liver tumor
segmentation, in: Proceedings of the 13th International Conference on Biomedical
Engineering, (ICBME 2008), IFMBE Proceedings 23. (2009) 202-205.
78
129. J.S. Suri, K. Liu, S. Singh, S. N. Laxminarayan, X. Zeng, L. Reden, Shape recovery
algorithms using level sets in 2-D/3-D medical imagery: a state of the art review IEEE
Transactions on Information Technology in Biomedicine 6 (2002) 8-28.
130. N. Paragios, A level set approach for shape-driven segmentation and tracking of
left ventricle, IEEE Transactions on Medical Imaging 22 (2003) 773-776.
131. I. M. Mitchell, The flexible, extensible and efficient toolbox of level set methods,
Journal of Scientific Computing 35 (2008) 300-329.
132. J.S. Suri, Two-dimensional fast magnetic resonance brain segmentation, IEEE
Engineering in Medicine and Biology Magazine 20 (2001) 84-95.
133. S. Ho, E. Bullitt, G. Gering, Level set evolution with region competition:automatic3D segmentation of brain tumors, in: Proceedings of the International Conference on
Pattern Recognition (ICPR ’02). (2002) 532-535.
134. W.K. Lei, B.N. Li, M.C. Dong, M.I. Vai,AFC-ECG: an adaptive fuzzy ECG classifier, in:
Proceedings of the 11th Word Congress on Soft Computing in Industrial Applications
(WSC11), Advances in Soft Computing 39. (2007) 189-199.
135. J.A. Sethian, Level set methods and fast marching methods, Cambridge:
Cambridge, University Press, New York, 1999.
136. S. Osher, R. Fedkiw, Level set methods and dynamic implicit surface, SpringerVerlag, New York, 2003.
137. T. McInerney, D. Terzopoulos, Deformable models in medical image analysis: a
survey, Medical Image Analysis 1 (1996) 91- 108.
138. X. Wu, S. A. Spencer, S. Shen, J. B. Fiveash, J. Duan, I.A. Brezovich, Development of
an accelerated GVF semi-automatic contouring algorithm for radiotherapy treatment
planning, Computer in Biology and Medicine 39 (2009) 650-656.
79
139. C. Xu, J. L. Prince, Snakes, shapes and gradient vector flow, IEEE Transactions on
Image Processing 7 (1998) 359-369.
140. Y. Chen, H.D Tagare, S. Thiruvenkadam, F. Huang, D. Wilson, K.S. Gopinath et all.
Using prior shapes in geometric active contours in variational framework, Journal of
Computer Vision 50 ( 2002) 315-328.
141. V. Caselles, R. Kimmel, G. Sapiro, Geodesic active contours, International Journal
of Computer Vision 22 (1997) 61-79.
142. C. Li, C. Xu, C. Gui, M. D. Fox, level set evolution without re-initialization: a new
variational formulation, in: Proceedings of the 2005 IEEE Computer Society
Conference on Computer Vision and Pattern Recognition (CVPR’05). (2005) 430-436.
143. C. Li, C. Xu, K.M. Konwar, M.D. Fox, Fast distance preserving level set evolution
for medical image segmentation, in: Proceedings of the Ninth International
Conference on Control, Automation, Robotics and Vision (ICARCV 2006) (2006) 1-7.
144. D.L. Pham, J.L. Prince, Adaptive fuzzy segmentation of magnetic resonance
images, IEEE Transactions on Medical Imaging 18 (1999) 737-752.
145. Bhattacharyya, A.: On a measure of divergence between two statistical
populations defined by their probability distribution. Bulletin of the Calcutta
Mathematical Society 35, 99–110 (1943)
146. Cap, M., Gescheidtova, E., Marcon, P., Bartusek, K.: Automatic detection and
segmentation of the tumor tissue. In: Progress in Electromagnetics Research
Symposium, pp. 53–56 (2013)
147. Dvorak, P., Bartusek, K.: Brain tumor locating in 3d mr volume using symmetry
In: Proc. SPIE 9034, Medical Imaging 2014: Image Processing, 903432 (2014)
148. Dvorak, P., Bartusek, K., Kropatsch, W.G.: Automated segmentation of brain
tumor edema in flair mri using symmetry nd thresholding. In: Progress in
Electromagnetics Research Symposium, pp. 936–939 (2013)
149. Khotanlou, H., Colliot, O., Bloch, I.: Automatic brain tumor segmentation using
symmetry analysis and deformable models. In: Conf. on Advances in Pattern
Recognition ICAPR, Kolkata, India (January 2007)
80
150. Kropatsch, W.G., Haxhimusa, Y., Ion, A.: Multiresolution image segmentations in
graph pyramids. In: Kandel, A., Bunke, H., Last, M. (eds.) Applied Graph Theory in
Computer Vision and Pattern Recognition. SCI, vol. 52, pp. 3–41. Springer, Heidelberg
(2007)
151. Liu, Y., Collins, R.T., Rothfus, W.E.: Robust midsagittal plane extraction from
normal and pathological 3-d neuroradiology image. IEEE Transactions on Medical
Imaging 20(3), 175–192 (2003)
152. Mikulka, J., Gescheidtova, E.: An improved segmentation of brain tumor, edema
and necrosis. In: Progress in Electromagnetics Research Symposium, pp. 25–28
(2013)
153. Otsu, N.: A Threshold Selection Method from Gray-level Histograms. IEEE
Transactions on Systems, Man and Cybernetics 9(1), 62–66 (1979).
http://dx.doi.org/10.1109/TSMC.1979.4310076
154. Pedoia, V., Binaghi, E., Balbi, S., De Benedictis, A., Monti, E., Minotto, R.: Glial brain
tumor detection by using symmetry analysis. In: Proc. SPIE. vol. 8314, pp. 831445-1–
831445-8 (2012), http://dx.doi.org/10.1117/12.910172
155. Ruppert, G.C.S., Teverovskiy, L., Yu, C., Falcao, A.X., Liu, Y.: A new symmetrybased
method for mid-sagittal plane extraction in neuroimages. In: International
Symposium on Biomedical Imaging: From Macro to Nano (2011)
156. Saha, B.N., Ray, N., Greiner, R., Murtha, A., Zhang, H.: Quick detection of brain
tumors and edemas: A bounding box method using symmetry. Computerized Medical
Imaging and Graphics 36(2), 95–107 (2012).
http://www.sciencedirect.com/science/article/pii/S0895611111000796
157. Uher, V., Burget, R., Masek, J., Dutta, M.: 3d brain tissue selection and
segmentation from mri. In: 2013 36th International Conference on
Telecommunications and Signal Processing (TSP), pp. 839–842 (2013)
158. Zijdenbos, A., Dawant, B.: Brain segmentation and white matter lesion detection
in mr images. Critical Reviews in Biomedical Engineering 22, 401–465 (1994).
81
Ringraziamenti
In conclusione di questa parte di studi vorrei dare dei ringraziamenti.
In Primis vorrei porgere i miei più sinceri ringraziamenti al Dott. Daniel Riccio che mi ha
dato l’occasione di poter svolgere quest’argomento di tesi, bello da approfondire e di
esser stato molto disponibile ( e direi anche molto paziente ) su tutte le difficoltà che ho
incontrato dall’inizio del tirocinio fino alla sua completa conclusione.
In seguito vorrei ringraziare la mia famiglia che mi è stata vicino: A mio padre che non
credeva fino in fondo che sarei riuscito a raggiungere tale risultato, e dopo questo giorno
mi sa che non prometterà più di dover andare, a piedi, al santuario di Pompei (circa 28
km). A mia madre che m’ha dato la forza di poter andare avanti. A Tilde che mi ha
aiutato in ciò che non capivo nello studio e fuori lo studio (nonostante sono un caso
perso!). Non poteva mancare la mia piccola Sunny che ogni giorno cerca di farmi tornare
il sorriso in un modo che solo lei sa fare. A tutti i miei parenti vicini o lontani, che ci sono
ancora o che non ci sono più; perché, forse, senza di loro sono sarei ciò che sono … come
dico sempre la vita è uguale ad una scatola di cioccolatini, non sai mai quello che ti
capita.
Fuori il nucleo familiare vorrei ringraziare i miei amici di università, il quale senza il loro
supporto non sarei (ma anche loro non sarebbero!) riuscito ad arrivare all’ambito
traguardo, cioè la LAUREA.
In particolare vorrei ringraziare: Luca, Aniello (amico di università e di gare!) ,Vittorio,
Norman, Flavio, Marco e tutto il resto dei studenti “sfortunati” a conoscermi.
Infine voglio ringraziare tutti i miei amici podisti che con la loro passione mi hanno fatto
conoscere questo bellissimo sport e di aver assaporato tutti i benefici che il podismo
porta.
Dopo tanti traguardi raggiunti nelle gare, penso che questo è uno dei traguardi più belli.
82