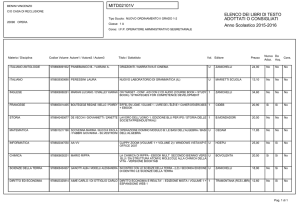
Dalle soluzioni
alla chimica del carbonio
Energia e velocità
delle reazioni chimiche
Capitolo 9
Unità 27 Energia di sistemi chimici
9.1
Energia di legame ed energia chimica
9.2
Primo principio della termodinamica
e sistemi chimici
9.3
Variazioni dell’energia interna di un
sistema
Unità 28 Funzioni di stato termodinamiche:
l’entalpia
9.4
Entalpia e calore di reazione
9.5
Reazioni esotermiche ed endotermiche
9.6
La legge di Hess
9.7
Entalpia standard di formazione
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
2
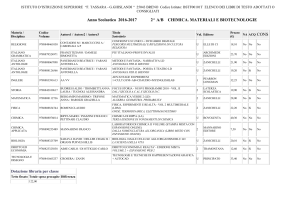
Energia e velocità
delle reazioni chimiche
Capitolo 9
Unità 29 Funzioni di stato termodinamiche:
entropia ed energia libera
9.8
Spontaneità delle reazioni chimiche ed
entropia
9.9
Ordine, disordine, entropia
9.10
Entropia molare standard
9.11
L’energia libera e la spontaneità delle
reazioni
9.12
Energia libera standard
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
3
Energia e velocità
delle reazioni chimiche
Capitolo 9
Unità 30 Cinetica chimica
9.13
Velocità delle reazioni chimiche
9.14
Velocità e concentrazione dei reagenti:
ordine di reazione
9.15
Velocità e suddivisione dei reagenti
9.16
Teoria degli urti e fattore sterico
9.17
L’energia di attivazione
9.18
Velocità e temperatura
9.19
Velocità e catalizzatori
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
4
9.1
Energia di legame ed energia chimica
Ogni reazione chimica comporta una
trasformazione energetica, perché le energie di legame
di reagenti e prodotti sono diverse.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
5
9.1
Energia di legame ed energia chimica
L’energia di un sistema chimico
associabile ai legami chimici
e alle forze intermolecolari presenti
è chiamata energia chimica.
Quanto più i legami sono forti
e la molecola è stabile,
tanto minore è la sua energia chimica.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
6
9.1
Energia di legame ed energia chimica
La reazione chimica tra fluoro F2 e acido cloridrico HCl
porta la formazione di sostanze più stabili, cloro Cl2 e acido fluoridrico HF,
in quanto la somma delle energie di legame dei prodotti
è maggiore di quella delle energie di legame dei reagenti
e la reazione avviene con una diminuzione di energia chimica.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
7
9.2
Primo principio della termodinamica
e sistemi chimici
Uno degli aspetti più importanti
delle reazioni chimiche riguarda gli scambi energetici
ad esse collegati.
La termochimica studia gli scambi di calore che
avvengono durante le reazioni chimiche.
La termodinamica è la scienza che studia i
trasferimenti di energia in un sistema.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
8
9.2
Primo principio della termodinamica
e sistemi chimici
In una trasformazione chimica
viene definito sistema l’insieme delle sostanze
che partecipano alla reazione, mentre
il recipiente di reazione, l’aria circostante e lo spazio fisico
in cui si opera costituiscono l’ambiente.
Il sistema e l’ambiente formano
ciò che in termodinamica è chiamato universo.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
9
9.2
Primo principio della termodinamica
e sistemi chimici
Ambiente
Sistema
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
10
9.2
Primo principio della termodinamica
e sistemi chimici
L’energia chimica,
è solo una delle possibili forme di energia
che un sistema chimico può possedere.
L’energia cinetica associata al movimento delle particelle
è chiamata energia termica.
L’energia totale di un sistema
è definita energia interna (U).
L’energia interna di un sistema chimico è uguale
alla somma tra l’energia chimica e l’energia termica.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
11
9.2
Primo principio della termodinamica
e sistemi chimici
Il primo principio della termodinamica
afferma che in una trasformazione chimica
l’energia totale del sistema e dell’ambiente
si conserva, ma può essere convertita
da una forma a un’altra.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
12
9.3
Variazioni dell’energia interna
di un sistema
Se i prodotti di una reazione
hanno un’energia chimica inferiore ai reagenti,
il sistema cede energia all’ambiente;
DU<0
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
13
9.3
Variazioni dell’energia interna
di un sistema
se l’energia chimica dei prodotti
è superiore a quella dei reagenti,
il sistema assorbe energia dall’ambiente.
DU>0
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
14
9.3
Variazioni dell’energia interna
di un sistema
La variazione di energia interna è uguale
all’energia scambiata tra sistema e ambiente.
Un sistema chimico può variare il proprio contenuto
energetico solo attraverso scambi di calore e lavoro.
Il primo principio
può quindi essere espresso dalla relazione
ΔU = Q + L.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
15
9.3
Variazioni dell’energia interna
di un sistema
I segni di Q e L sono stabiliti convenzionalmente:
sono positivi se portano ad un aumento di energia interna,
negativi se provocano una diminuzione dell’energia interna del sistema.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
16
In un sistema chimico l’unico modo per produrre
lavoro è con variazioni di volume.
L=pDV
DU=Q-pDV
- Diminuzione volume (compressione):
DV negativo
P positiva
L (pDV) positivo
- Aumento volume (espansione):
DV positivo
P positiva
L (pDV) negativo
Il valore di DU è
determinato dalla
direzione in cui si
muove il calore e
da chi compie il
lavoro.
Il lavoro e il calore
possono essere
convertiti l’uno
nell’altro
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
9.4
Entalpia e calore di reazione
Una reazione chimica che avviene in un recipiente rigido,
chiuso ermeticamente, che non permette variazioni di
volume, avviene a volume costante.
La variazione di energia interna (DU)
di un sistema è uguale
al calore scambiato a volume costante (QV).
DU = QV
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
18
9.4
Entalpia e calore di reazione
Generalmente le reazioni chimiche avvengono
in recipienti aperti alla pressione atmosferica (es. provette).
La P e la temperatura sono costanti , mentre i cambiamenti di volume
non sono sempre controllabili.
In questo tipo di trasformazioni,
che avvengono a pressione costante,
il calore scambiato (Qp),
è uguale alla variazione di entalpia (H).
La variazione di entalpia (ΔH) di una reazione
chimica che avviene a pressione costante
è uguale al calore scambiato (detto «calore di
reazione»).
ΔH = Hprodotti – Hreagenti = Qp
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
19
9.5
Reazioni esotermiche ed endotermiche
Una reazione che avviene con produzione di calore
viene definita reazione esotermica.
Sono reazioni esotermiche quelle per le quali
ΔH < 0.
DH= -393,5
kJ/mol
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
20
9.5
Reazioni esotermiche ed endotermiche
Una reazione che avviene con consumo di calore
viene definita reazione endotermica.
Sono reazioni endotermiche quelle per le quali
ΔH > 0.
DH= 176
kJ/mol
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
21
9.5
Reazioni esotermiche ed endotermiche
Nelle reazioni esotermiche l’energia chimica contenuta
nelle molecole si trasforma in energia termica.
Nelle reazioni endotermiche si ha trasformazione
di energia termica in energia chimica.
ESOTERMICHE: prodotti
+ stabili dei reagenti.
Legami + forti
ENDOTERMICHE:
prodotti - stabili dei
reagenti. Legami +
deboli
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
22
9.6
La legge di Hess
Secondo la legge di Hess:
la quantità di calore messa in gioco
in una reazione chimica dipende dall’energia chimica
dei reagenti e dei prodotti e non dal cammino
effettivamente percorso dalla reazione.
In altre parole,
se una reazione avviene in più stadi intermedi,
oppure attraverso un passaggio diretto,
la quantità di calore prodotta o richiesta
è sempre la stessa.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
23
9.7
Entalpia standard di formazione
La variazione di entalpia DH di una reazione dipende
dalle condizioni in cui la trasformazione si svolge.
È quindi necessario fissare condizioni di riferimento,
definite condizioni standard.
In termodinamica le condizioni standard sono:
pressione 1 bar;
temperatura 25 °C;
concentrazione 1 M.
La variazione di entalpia misurata in queste condizioni
è chiamata variazione di entalpia standard
ed è indicata con DH°.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
24
9.7
Entalpia standard di formazione
La variazione di entalpia standard di una reazione
può essere determinata utilizzando
l’entalpia standard di formazione.
L’ entalpia standard di formazione di un composto
corrisponde al calore sviluppato o assorbito
quando una mole di quel composto
nel suo stato standard
si forma a partire dagli elementi costituenti.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
25
9.7
Entalpia standard di formazione
Se si conoscono le entalpie di formazione
dei composti che partecipano a una reazione,
si può risalire alla variazione di entalpia standard
della reazione ΔH°reazione
attraverso il seguente calcolo:
Per gli elementi si stabilisce convenzionalmente
una entalpia di formazione standard = 0.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
26
9.7
Entalpia standard di formazione
-55,3kJ
-33,2x2 = 66,4 kJ
+11 kJ
La variazione di entalpia dipende solo dallo stato
iniziale e finale, non dal percorso….
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
27
9.7
Entalpia standard di formazione
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
28
Spontaneità delle reazioni chimiche
• Quando una reazione avviene
spontaneamente? (liberamente, in assenza di
interventi dall’esterno…).
• Una reazione esotermica è anche spontanea?
• Vediamo……
• Il calore ceduto o assorbito (Variazione entalpia)
NON è l’unico motore che spinge una reazione
ad avvenire o no….
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
9.8
Spontaneità delle reazioni chimiche
ed entropia
La spontaneità di una trasformazione non dipende
solo dall’energia in gioco, nel caso delle reazioni cioè
del calore ceduto o assorbito durante il loro svolgimento,
ma anche dall’entropia.
L’entropia (S) è una funzione di stato
che esprime il grado di disordine di un sistema.
Ogni sistema evolve spontaneamente
verso lo stato a massima entropia, che corrisponde
alla condizione di massima probabilità.
2° Principio Termodinamica
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
30
9.9
Ordine, disordine, entropia
Il termine «disordine» associato a un sistema fisico
va inteso come livello di dispersione di materia e energia.
Ogni sistema
è in grado di evolvere verso un certo numero
di possibili stati energetici equivalenti.
Maggiore è il numero di stati possibili
maggiore è la probabilità che l’evoluzione del sistema
comporti un incremento del disordine.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
31
9.10
Entropia molare standard
In condizioni standard di pressione e temperatura
è possibile calcolare la variazione
di entropia molare di reazione
ΔS°reazione = S°prodotti - S°reagenti
dove S° rappresenta l’entropia molare standard delle
specie chimiche coinvolte, determinabile sperimentalmente.
Poiché i sistemi evolvono spontaneamente
verso stati di maggior disordine
ΔS°reazione > 0 nei processi spontanei
ΔS°reazione < 0 nei processi non spontanei
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
32
L’energia libera
e la spontaneità delle reazioni
9.11
Spontaneità energetica o spontaneità statistica?
Esiste una grandezza unicadel grado di spontaneità di un
processo?
La spontaneità di una reazione chimica
è espressa dalla funzione di stato energia libera (G).
L’energia libera tiene conto
sia dell’entalpia H sia dell’entropia S.
G=H–T·S
dove T è la temperatura assoluta espressa in kelvin.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
33
L’energia libera
e la spontaneità delle reazioni
9.11
La variazione di energia libera è uguale alla differenza
tra la variazione di entalpia e la variazione di entropia
moltiplicata per la temperatura assoluta.
ΔG = ΔH – T · ΔS
Se il valore di ΔG è negativo, cioè se l’energia libera
diminuisce, la reazione è spontanea;
se il valore di ΔG è positivo, l’energia libera aumenta
e la reazione non è spontanea.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
34
9.11 Energia libera e spontaneità delle reazioni
Ogni fenomeno chimico con ΔG< 0 è detto esoergonico,
con ΔG> 0 è detto endoergonico.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
35
• Reazioni endotermiche possono essere spontanee
a condizione che si verifichi un aumento di entropia
e che si proceda ad alte temperature.
• Viceversa le reazioni esotermiche con diminuzione
di entropia possono essere spontanee solo a basse
temperature.
DH= - 92,2 kJ/mol
DS = -199 j/mol
Spontanea a temp.
Ambiente fino a 190°C
(463K)( T=DH/DS)
DH cessa di essere <0
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
9.12
Energia libera standard
La variazione di energia libera può essere determinata
in condizioni standard di pressione e temperatura
e per ciascuna mole di composto.
La ΔG°formazione , espressa in kJ/mol, permette di valutare
la spontaneità o meno del processo di formazione
di un composto a partire dai suoi elementi costitutivi.
Come per l’entropia standard di formazione,
anche le ΔG°formazione degli elementi
sono poste convenzionalmente pari a zero.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
37
9.13
Velocità delle reazioni chimiche
La cinetica chimica, la branca della chimica
che studia la velocità delle reazioni
e i fattori che la influenzano.
La velocità di reazione indica
il numero delle moli di reagente che si trasforma,
o il numero delle moli di prodotto
che si forma, nell’unità di tempo.
(concentrazione finale – concentrazione iniziale)
velocità
=
di reazione
(tempo finale – tempo iniziale)
∆ concentrazione
=
∆ tempo
∆[ ]
=
∆t
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
38
9.14
Velocità e concentrazione dei reagenti
Data la generica reazione:
A+B→C+D
La velocità di reazione è data dalla relazione:
v = k · [A]n · [B]m
dove dove k è una costante di proporzionalità, detta costante di velocità
e n ed m sono coefficienti determinati sperimentalmente.
La velocità di una reazione chimica
è direttamente proporzionale
al prodotto delle concentrazioni dei reagenti,
ognuna elevata a potenza avente per esponente
un coefficiente determinato sperimentalmente.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
39
9.14
Velocità e concentrazione dei reagenti
L’ordine della reazione è determinato dalla somma
degli esponenti delle concentrazioni dei reagenti
che compaiono nell’equazione della velocità.
v = k · [A] reazione di primo ordine
v = k [A]2 reazione di secondo ordine
v = k [A] [B] reazione di secondo ordine
v = k [A] [B] [C] reazione di terzo ordine
v = k [A] [B]2 reazione di terzo ordine
v = k ∙ [A]0 = k reazione di ordine zero
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
40
9.14
Velocità e concentrazione dei reagenti
La velocità delle reazioni chimiche non è costante
ma tende a diminuire nel tempo.
Solo nel caso delle reazioni di ordine zero
la velocità è indipendente dalla concentrazione dei reagenti.
Reazioni di diverso ordine mostrano variazioni differenti
delle concentrazioni nel tempo:
le reazioni di primo ordine sono più veloci delle reazioni di secondo ordine.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
41
9.15
Velocità e suddivisione dei reagenti
Affinché due sostanze possano reagire,
le loro particelle devono venire in contatto.
Maggiore è la superficie di contatto tra i reagenti,
maggiore è la velocità di reazione.
Se riduciamo il tronco di legno in trucioli la reazione è molto più veloce,
perché aumenta la superficie a contatto con l’aria.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
42
9.15
Velocità e suddivisione dei reagenti
Le reazioni che avvengono in soluzione,
o in fase gassosa, sono più veloci
di quelle che avvengono tra solidi,
in quanto ogni particella è staccata dalle altre
e la superficie di contatto tra i reagenti è massima.
La velocità di una reazione chimica aumenta
all’aumentare della suddivisione dei reagenti.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
43
9.15
Velocità e suddivisione dei reagenti
Una reazione chimica avviene
se c’è diminuzione di energia libera.
La velocità di una reazione aumenta
all’aumentare della temperatura, della suddivisione
e della concentrazione dei reagenti;
questi diminuiscono nel corso della reazione,
per cui la velocità di reazione tende a diminuire.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
44
9.16
Teoria degli urti e fattore sterico
Una reazione chimica avviene quando
tra le particelle dei reagenti si verificano urti.
Solo alcuni urti sono efficaci,
cioè riescono a rompere proprio i legami
che possono dar luogo ai nuovi composti.
Urto efficace
Urti non efficaci
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
45
9.16
Teoria degli urti e fattore sterico
Secondo la teoria degli urti,
affinché una reazione chimica possa avvenire
le particelle dei reagenti
devono scontrarsi attraverso urti efficaci;
con efficace si intende un urto
in cui le particelle collidono
con la giusta orientazione
e con sufficiente energia.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
46
9.16
Teoria degli urti e fattore sterico
Due molecole di bromuro di nitrosile NOBr reagiscono per formare
bromo Br2 e ossido di azoto NO dopo aver urtato con i loro due atomi di bromo.
Gli urti che avvengono con orientazioni diverse non determinano alcuna reazione.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
47
9.16
Teoria degli urti e fattore sterico
La probabilità che le particelle urtino nel punto giusto,
in modo che la reazione avvenga,
si chiama fattore sterico della reazione.
Il valore del fattore sterico è tanto minore di 1
quanto maggiore è il numero degli atomi
presenti nelle molecole dei reagenti.
A parità di altri fattori, la velocità di una
reazione chimica è inversamente proporzionale
al numero degli atomi delle molecole dei reagenti.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
48
9.16
Teoria degli urti e fattore sterico
Riassumendo la teoria degli urti prevede
che la velocità di reazione dipenda da:
frequenza degli urti:
maggiore è il numero di urti,
maggiore la probabilità di avere urti efficaci;
geometria dell’urto, ovvero fattore sterico;
energia cinetica delle particelle:
maggiore è la velocità delle particelle, più alta
è la probabilità di avere urti con energia sufficiente
a rompere i legami esistenti e a formarne nuovi.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
49
9.17
L’energia di attivazione
Affinché una reazione avvenga,
occorre che le molecole dei reagenti urtino
con energia almeno sufficiente a rompere i loro legami.
L’energia di attivazione di una reazione
è la quantità minima di energia
che deve essere fornita ai reagenti
perché la reazione possa avvenire.
Il sistema che si forma quando due specie
urtano nel punto giusto e con la giusta energia
è chiamato complesso attivato.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
50
9.17
L’energia di attivazione
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
51
9.18
Velocità e temperatura
A un aumento della temperatura di un sistema
corrisponde un aumento dell’energia cinetica media
delle particelle, per cui aumenta il numero delle molecole
che hanno un’energia maggiore dell’energia di attivazione.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
52
9.18
Velocità e temperatura
La velocità delle reazioni chimiche aumenta
all’aumentare della temperatura.
Quando vi sono processi infiammatori
nel nostro corpo, la temperatura corporea cresce
per aumentare la velocità delle reazioni chimiche
di difesa.
In frigorifero i cibi si conservano meglio,
perché la velocità della loro degradazione è rallentata.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
53
9.19
Velocità e catalizzatori
La velocità di una reazione potrebbe essere aumentata
diminuendone l’energia di attivazione.
Un catalizzatore
è una specie chimica che fa diminuire
l’energia di attivazione di una reazione
e la accelera senza parteciparvi direttamente
e senza essere consumata.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
54
9.19
Velocità e catalizzatori
In presenza di un catalizzatore,
l’energia di attivazione della reazione di formazione dell’acqua
è molto minore rispetto alla reazione non catalizzata
e la reazione avviene più velocemente.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
55