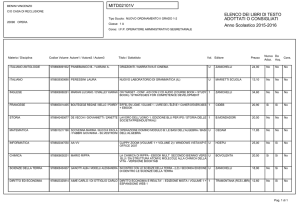
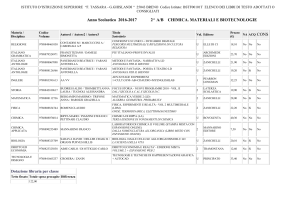
Dalla struttura atomica
alla nomenclatura
Struttura elettronica
e proprietà periodiche
Capitolo 2
Unità 6 La struttura del sistema periodico
2.1
Periodicità delle proprietà degli elementi
2.2
Sistema periodico e configurazione
elettronica degli elementi
Unità 7 Dalla configurazione alle proprietà
periodiche
2.3
Configurazione elettronica esterna
2.4
Configurazione elettronica e proprietà degli
elementi
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
2
Struttura elettronica
e proprietà periodiche
Capitolo 2
Unità 8
2.5
2.6
2.7
2.8
Proprietà periodiche degli elementi
Volume atomico e raggio atomico
Energia di ionizzazione e affinità elettronica
Elettronegatività
Il carattere metallico
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
3
2.1
Periodicità delle proprietà
degli elementi
La legge periodica afferma che:
Le proprietà degli elementi chimici
variano in modo periodico
in funzione del numero atomico
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
4
Sistema periodico e
configurazione elettronica degli elementi
2.2
Nel Sistema periodico gli elementi sono disposti in ordine di
numero atomico crescente, divisi in 7 periodi e 18 gruppi.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
5
Sistema periodico e
configurazione elettronica degli elementi
2.2
Il Sistema periodico è diviso in quattro blocchi:
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
6
Sistema periodico e
configurazione elettronica degli elementi
2.2
Il Sistema periodico è diviso in quattro blocchi:
il blocco degli orbitali s,
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
7
Sistema periodico e
configurazione elettronica degli elementi
2.2
Il Sistema periodico è diviso in quattro blocchi:
il blocco degli orbitali p,
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
8
Sistema periodico e
configurazione elettronica degli elementi
2.2
Il Sistema periodico è diviso in quattro blocchi:
il blocco degli elementi di transizione,
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
9
Sistema periodico e
configurazione elettronica degli elementi
2.2
Il Sistema periodico è diviso in quattro blocchi:
il blocco degli orbitali f.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
10
Sistema periodico e
configurazione elettronica degli elementi
2.2
In corrispondenza di ogni valore del numero quantico principale
si trovano gli orbitali s e p con quel valore di n.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
11
2.3
Configurazione elettronica esterna
Gli elettroni del guscio più esterno sono chiamati
elettroni di valenza.
Per ogni elemento la formula che indica
quanti elettroni vi sono negli orbitali s e p
con il più alto valore di n si chiama
configurazione elettronica esterna o di valenza.
Elemento
Configurazione elettronica
F
fluoro
1s2 2s22p5
Cl
cloro
1s2 2s22p6 3s23p5
Br
bromo
1s2 2s22p6 3s23p63d10 4s24p5
iodio
1s2 2s22p6 3s23p63d10 4s24p64d10 5s25p5
I
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
12
2.3
Configurazione elettronica esterna
Gli elementi dello stesso gruppo hanno
la stessa configurazione elettronica esterna.
La configurazione elettronica esterna di un elemento
si ricava dalla sua posizione nel Sistema periodico.
Per i gruppi 1 e 2 il numero di elettroni esterni
coincide con il numero del gruppo, mentre per i gruppi
dal 13 al 18 per ottenere il numero di elettroni
di valenza occorre sottrarre 10 al numero del gruppo:
elettroni di valenza = numero del gruppo – 10
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
13
2.3
Configurazione elettronica esterna
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
14
Configurazione elettronica
e proprietà degli elementi
2.4
Le proprietà chimiche degli elementi
non dipendono dal numero totale degli elettroni,
ma dalla configurazione elettronica esterna.
Le proprietà chimiche degli elementi
dello stesso gruppo, aventi la stessa
configurazione elettronica esterna, sono simili.
Le proprietà degli elementi variano con periodicità
lungo un periodo in quanto si ha una variazione periodica
della configurazione elettronica esterna degli elementi.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
15
2.5
Volume atomico e raggio atomico
Le proprietà chimiche e fisiche degli elementi
che variano in modo periodico nel Sistema periodico
sono chiamate proprietà periodiche.
Il volume atomico di un elemento
è una misura dello spazio occupato dal nucleo
e dagli elettroni dell’atomo.
Il raggio atomico è per convenzione
la metà della distanza tra i nuclei di due atomi
dello stesso elemento legati fra loro.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
16
2.5
Volume atomico e raggio atomico
Volume atomico e raggio atomico aumentano
scendendo nel gruppo e diminuiscono
andando verso destra nel periodo.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
17
2.5
Volume atomico e raggio atomico
Volume e raggio atomico aumentano scendendo
nel gruppo perché aumenta il numero quantico principale
e aumentano le dimensioni degli orbitali.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
18
2.5
Volume atomico e raggio atomico
Volume e raggio atomico diminuiscono
passando da sinistra a destra nel periodo
perché aumentando il numero dei protoni
aumenta la forza attrattiva del nucleo sugli elettroni.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
19
2.5
Volume atomico e raggio atomico
Volume e raggio atomico
sono proprietà periodiche degli elementi.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
20
2.5
Volume atomico e raggio atomico
Un catione ha dimensioni inferiori
rispetto all’atomo da cui deriva,
mentre un anione ha dimensioni superiori.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
21
2.6
Energia di ionizzazione
e affinità elettronica
L’energia di ionizzazione è l’energia necessaria
per rimuovere un elettrone da un atomo isolato.
L’energia di ionizzazione aumenta lungo il periodo
e diminuisce scendendo in un gruppo.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
22
2.6
Energia di ionizzazione
e affinità elettronica
L’energia che si scambia quando un atomo
accetta un elettrone si chiama affinità elettronica.
A + e– → A–
anione monovalente
A– + e– → A– –
anione bivalente
L’affinità elettronica varia nel Sistema periodico
come l’energia di ionizzazione:
diminuisce nel gruppo e aumenta nel periodo.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
23
2.7
Elettronegatività
L’elettronegatività di un elemento
è la tendenza che ha un atomo dell’elemento
ad attirare verso di sé gli elettroni di legame.
L’elettronegatività diminuisce nel gruppo
e aumenta nel periodo.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
24
2.7
Elettronegatività
L’elettronegatività
è una proprietà periodica degli elementi.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
25
2.7
Elettronegatività
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
26
2.8
Il carattere metallico
I metalli hanno bassa energia di ionizzazione.
I non-metalli hanno alta energia di ionizzazione.
Il carattere metallico
aumenta scendendo lungo un gruppo e
diminuisce procedendo verso destra nei periodi
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
27
2.8
Il carattere metallico
I metalli hanno bassa elettronegatività.
I non metalli hanno elevata elettronegatività.
La tendenza dei metalli a «cedere» elettroni di valenza,
li rende buoni conduttori di elettricità
La tendenza dei non metalli a «acquisire» elettroni di valenza,
li rende cattivi conduttori di elettricità.
Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016
28