Copyright “Tutti i diritti sono riservati”
Deficit di 5α-reduttasi tipo 2
A. Balsamo 1, S Bertelloni 2, G. Russo. 3
1
Dipartimento di Scienze Mediche e Chirurgiche, Unità Operativa di Pediatria, Programma di
Endocrinologia, Azienda OU di Bologna, Bologna; 2Dipartimento Materno-infantile,UO
Pediatria Universitaria, Azienda OU Pisana, Pisa; 3UO Pediatria e Medicina dell’adolescenza,
Università “Vita e Salute”, Ospedale San Raffaele, Milan.
Il deficit di 5α-reduttasi tipo 2 (esiste un tipo 1 espresso al di fuori del testicolo) (OMIM n.
264600) è un raro 46,XY DSD, trasmesso con ereditarietà autosomico-recessiva e causato da
mutazioni nel gene SRD5A2. L’anomalia genetica determina un deficit enzimatico, per cui il
testosterone (T) non può essere convertito - in tutto o in parte - nel più potente diidrotestosterone (DHT). Quest’ultimo androgeno è responsabile della virilizzazione dei genitali
esterni durante la vita intra-uterina, mentre i genitali interni sono virilizzati direttamente dal
testosterone.
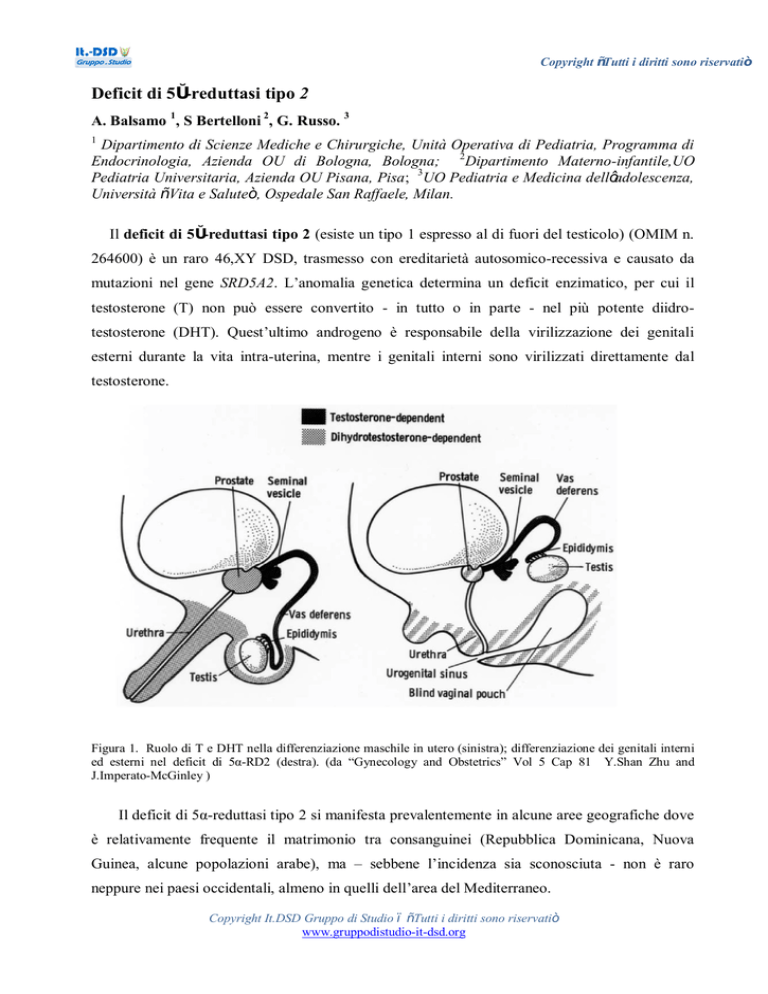
Figura 1. Ruolo di T e DHT nella differenziazione maschile in utero (sinistra); differenziazione dei genitali interni
ed esterni nel deficit di 5α-RD2 (destra). (da “Gynecology and Obstetrics” Vol 5 Cap 81 Y.Shan Zhu and
J.Imperato-McGinley )
Il deficit di 5α-reduttasi tipo 2 si manifesta prevalentemente in alcune aree geografiche dove
è relativamente frequente il matrimonio tra consanguinei (Repubblica Dominicana, Nuova
Guinea, alcune popolazioni arabe), ma – sebbene l’incidenza sia sconosciuta - non è raro
neppure nei paesi occidentali, almeno in quelli dell’area del Mediterraneo.
Copyright It.DSD Gruppo di Studio – “Tutti i diritti sono riservati”
www.gruppodistudio-it-dsd.org
Copyright “Tutti i diritti sono riservati”
Clinica
Alla nascita si ha generalmente un fenotipo esterno caratterizzato da genitali ambigui con
grave ipospadia perineo-scrotale e con recesso vaginale a fondo cieco, ma l’aspetto dei genitali
esterni può variare da un fenotipo quasi completamente femminile, con eventuale modesta
clitorido-megalia, a bambini con ipospadia e/o micropene isolati (1). I genitali interni
(epididimo, vasi deferenti, vescicole seminali) sono maschili normali. I testicoli sono endoaddominali o localizzati a vario livello lungo la loro normale via di discesa.
Alla pubertà, se i testicoli non sono stati rimossi, si ha uno sviluppo dell'apparato pilifero e
delle masse muscolari di tipo maschile, assenza di ginecomastia e mascolinizzazione dei genitali
di grado variabile in conseguenza di un’aumentata attività dell’enzima anomalo o per una
maggiore attivazione dell’isoenzima 5α-reduttasi di tipo 1. Il fenotipo clinico è comunque non
specifico, essendo ampiamente sovrapponibile a quello di altri 46,XY DSD da deficit di
produzione o azione degli androgeni, tanto che non è possibile porre una diagnosi differenziale
in base alla sola clinica (2). La maggior parte dei soggetti affetti è oligo-azoospermica e quindi
infertile, a causa del danno testicolare conseguente al criptorchidismo e alle complicazioni legate
alla chirurgia genito-urinaria; l’analisi del seme evidenzia una riduzione del numero di
spermatozoi e del volume seminale con elevata viscosità, attribuibile allo sviluppo rudimentale
della ghiandola prostatica e delle vescicole seminali (3,4).
Diagnosi
La diagnosi biochimica si basa su un elevato rapporto T/DHT secondario alla
compromissione della conversione del T in DHT. Per una corretta valutazione di tale rapporto
nei pazienti pre-puberi, è necessario stimolare la produzione di testosterone mediante
somministrazione di hCG. Con una corretta metodica di dosaggio, che deve prevedere la
separazione cromatografica degli steroidi (essendo la concentrazione del DHT circa dieci volte
inferiore rispetto a quella del T), il rapporto T/DHT è patologico se > 15-18 (arriva a > 30 nei
deficit più gravi). Tuttavia, un normale rapporto T/DHT non permette di escludere la diagnosi,
poiché tale rapporto può variare con l’entità del deficit enzimatico (in caso di deficit parziale il
rapporto può essere normale). Un elevato rapporto di metaboliti urinari 5β/5α (tetraidrocorticosterone/allotetraidro-corticosterone e etiocolanolone/androsterone) è suggestivo per
deficit di 5α-RD2, anche in età pre-puberale e in pazienti orchiectomizzati; tuttavia tale modalità
di analisi è disponibile solo in pochi centri.
Il deficit di 5 α-reduttasi può essere confermato dall’evidenza di una ridotta attività
enzimatica su fibroblasti in coltura.
Copyright It.DSD Gruppo di Studio – “Tutti i diritti sono riservati”
www.gruppodistudio-it-dsd.org
Copyright “Tutti i diritti sono riservati”
La diagnosi di certezza si ha con l’evidenza di mutazioni nel gene SRD5A2. Il gene
codificante per la 5α-RD2 è costituito da cinque esoni e quattro introni. A oggi sono state
descritte più di cinquanta mutazioni del gene. La mancanza di una completa correlazione
genotipo/fenotipo nei pazienti portatori della stessa mutazione suggerisce il coinvolgimento di
altri fattori, quali l’attività del recettore degli androgeni, i livelli di testosterone in utero o i fattori
ambientali.
Trattamento
In questi pazienti deve essere eseguita un'attenta valutazione psicologica prima di qualsiasi
trattamento chirurgico o ormonale. In conseguenza dell’esposizione in epoca pre-natale e postnatale del cervello agli androgeni, molti soggetti con deficit di 5α-RD2 (circa il 60%) cresciuti
come femmine sviluppano poi un’identità di genere maschile e cambiano il sesso in epoca
adolescenziale o adulta.
In caso di corretta e tempestiva diagnosi, è auspicabile l’attribuzione del sesso maschile e la
crescita in tale sesso. In tal caso, è essenziale la correzione precoce del criptorchidismo per
preservare la fertilità. Prima dell’intervento chirurgico correttivo d’ipospadia è consigliata
l’applicazione topica di crema al DHT, con lo scopo di migliorare le dimensioni peniene.
Non è generalmente necessaria la terapia sostitutiva con T in età puberale; può essere necessaria
la somministrazione di T intramuscolare ad alte dosi o di gel DHT per migliorare le dimensioni
peniene e lo sviluppo della peluria. L'ingrandimento massimo del pene si ottiene dopo circa sei
mesi di trattamento. La maggior parte dei pazienti riferisce una performance sessuale
soddisfacente in presenza di una dimensione peniena > 6 cm. Il trattamento con gel DHT
presenta alcuni vantaggi: è circa cinquanta volte più attivo del T, promuovendo così un più
rapido aumento della dimensione del pene; non è aromatizzato in periferia, per cui non influenza
la
maturazione
ossea
e
non
favorisce
lo
sviluppo
della
ghiandola
mammaria.
Alcuni pazienti affetti hanno avuto figli con le attuali metodiche di fertilizzazione in vitro o
d’inseminazione in utero.
In caso di attribuzione del sesso femminile, la gestione è forse ancora più complessa: la
gonadectomia in epoca pre-puberale evita la virilizzazione, ma deve essere eseguita prima di
poter avere il consenso del paziente; il mantenimento delle gonadi è probabilmente l’opzione
preferibile, con l’utilizzo alla pubertà del GnRH analogo per bloccare transitoriamente la pubertà
stessa e impedire la virilizzazione spontanea. In questo modo si può arrivare a un’età in cui il
soggetto, correttamente informato e seguito dal punto di vista psicologico, può esprimere le
proprie decisioni sul proprio presente e futuro (4).
Copyright It.DSD Gruppo di Studio – “Tutti i diritti sono riservati”
www.gruppodistudio-it-dsd.org
Copyright “Tutti i diritti sono riservati”
Bibliografia
1. Sinnecker GH, et al. Phenotypic classification of male pseudohermaphroditism due to steroid 5Reductase 2 deficiency. Am J Med Genet 1996, 63: 223-30.
2. Cheon CK. Practical approach to steroid 5alpha-reductase type 2 deficiency. Eur J Pediatr 2011,
170: 1-8.
3. Imperato-McGinley J, Zhu YS. Androgens and male physiology: the syndrome of 5a-reductase-2
deficiency. Mol Cell Endocrinol 2002, 198: 51-9.
4. Costa EMF, et al. DSD due to 5α-reductase 2 deficiency - from diagnosis to long term outcome.
Semin Reprod Med 2012, 30: 427-31.
Copyright It.DSD Gruppo di Studio – “Tutti i diritti sono riservati”
www.gruppodistudio-it-dsd.org












