Fac simile
PURIFICAZIONE PARZIALE, DOSAGGIO E CARATTERIZZAZIONE DELLA
LATTATO DEIDROGENASI (LDH) DA FEGATO DI CONIGLIO
INTRODUZIONE
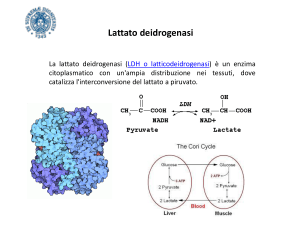
La LDH è un enzima importante nel metabolismo anaerobico del glucosio per generare ATP. La
reazione catalizzata da questo enzima è l’interconversione tra piruvato e L-lattato: in condizioni
anaerobiche, il piruvato è convertito in L-lattato, con la concomitante conversione di NADH a NAD+.
La rigenerazione di NAD+ permette il flusso metabolico continuo della via glicolitica. Tale flusso
continua finché non cessa la richiesta di energia, o finché il livello cellulare ed ematico di L-lattato
diventa eccessivamente elevato.
Piruvato + NADH + H+ L-lattato + NAD+
LDH
La LDH è un tetramero con subunità di 35 kDa. Esistono 2 tipi di subunità: la forma H prevalente nel
miocardio e la forma M prevalente nel muscolo e nel fegato. Tali subunità si possono associare per
formare cinque tipi di tetrameri (H4, H3M, H2M2, HM3, M4), tutti con attività LDH ma con diverse
affinità per i substrati e differenti risposte a effettori allosterici.
Obiettivi di questa esperienza erano: 1) ottenere una parziale purificazione della lattato deidrogenasi
(LDH); 2) caratterizzare la cinetica dell’enzima purificato; 3) usarlo in dosaggi accoppiati per la misura
di altre attività enzimatiche.
MATERIALI E STRUMENTAZIONE
20g di fegato di coniglio opportunamente conservato a -20°C;
tampone Tris-HCl 0.1 M pH 8.0;
tampone Tris-HCl 0.02 M pH 8.0 senza inibitori delle proteasi (PIC);
tampone Tris-HCl 0.02 M pH 8.0 con PIC 1X;
piruvato di sodio 30 mM;
NADH 10 mM;
lattato 50 mM;
NAD+ 10 mM;
Curva di taratura Bradford
Il dosaggio delle proteine è stato effettuato secondo il metodo Bradford (1979). L’albumina di siero di
bue a 0,1 mg/ml è stata usata come standard.
I valori di assorbanza a 595 nm, dopo aver sottratto l’assorbanza del bianco, sono riportati in funzione
della quantità di BSA presente nella soluzione (µg) (Grafico 1).
La curva ottenuta permetterà, una volta misurata l’assorbanza a 595 nm nei vari campioni in esame, di
risalire alla quantità di proteine presente in questi.
SAGGIO SPETTROFOTOMETRICO PER LDH: METODOLOGIA
L’ossidazione di NADH a NAD+ è accompagnata da decremento di assorbanza con coefficiente di
estinzione molare differenziale (∆ε) a 340 nm pari a 6,22·103 M-1cm-1 , per cui è possibile ottenere la
velocità di reazione in mM/min dividendo il ∆A340/min per 6,22 (sottintendiamo d = 1 cm); se si
moltiplica questo risultato per F, inteso come fattore di diluizione (F= Vf/Vc dove Vc è il volume del
campione e Vf è il volume finale del campione diluito) si ottengono le U/mL di enzima contenute nel
campione.
1
∆A = ∆c ⋅ ∆ε 340 ⋅ d
Attività del campione=
da cui ∆c =
∆A
∆ε 340 ⋅ d
essendo d=1 cm risulta
∆c ∆A
F
=
⋅
∆t
∆t ∆ε 340
UNITA’ DI MISURA:
∆c =
∆A
∆ε 340
1 U=1 µmol/min
mM mmoli
103 µmoli
µmoli
U
=
= 3
=
=
min l ⋅ min 10 ml ⋅ min ml ⋅ min ml
Miscela di saggio standard per attività LDH
Tampone Tris-HCl 20 mM (senza inibitori)
Piruvato 30 mM
NADH 10 mM
Campione di LDH
Portare a 1 mL con H2O milliQ
0,80 mL
0,10 mL
0,02 mL
0,01 mL
Nelle prove cinetiche, il saggio standard è stato opportunamente modificato come descritto nei risultati.
RISULTATI
PURIFICAZIONE DELLA LDH
Omogenizzazione del fegato e separazione del sopranatante (estratto grezzo)
Si taglia a pezzetti circa 20 g di fegato di coniglio (escludendo le parti con i legamenti) e lo si aggiunge
a 3 volumi di tampone Tris-HCl 0,02 M pH 8,1 con inibitori delle proteasi nel provettone del Potter
posto precedentemente in ghiaccio. Omogeneizzare il fegato e centrifugare a 10000 RPM a 4°C per 1
ora.
Precipitazione con solfato di ammonio
Prelevati 100 µl di estratto grezzo (EG) in una Eppendorff, da conservare in ghiaccio, si inizia il
frazionamento con solfato d’ammonio ((NH4)2SO4) (SA) che permetterà sia di frazionare che di
concentrare le proteine del campione. In questo modo le proteine presenti in soluzione precipitano per il
fenomeno chiamato “salting out” in cui il sale attrae verso sé le molecole di acqua di solvatazione che
stanno attorno alle proteine (SO42- e NH4+sono più affini alle molecole di acqua rispetto alle proteine),
le proteine a questo punto tendono così ad aggregarsi e quindi a precipitare:
- il sovranatante ottenuto dalla centrifugazione (EG) è messo in un Becher su ghiaccio con un agitatore
magnetico e si aggiunge SA solido fino a raggiungere il 35% di saturazione.
Quando tutto il sale si è sciolto si lascia in agitazione minima per 15 min; si trasferisce la sospensione al
35% di SA in tubi da centrifuga e si centrifuga a 10000 RPM; terminata la centrifugazione, si decanta il
sopranatante (S35) in un cilindro graduato tenuto in ghiaccio e si risospende il precipitato nel volume
minimo di tampone di estrazione Tris-HCl che dia una soluzione limpida (P35) e se ne misura il
volume; si prelevano 100 µl del precipitato al 35% di SA (P35) in una Eppendorff per i dosaggi, e si
mette a -20°C il restante P35.
- si porta il S35 al 70% di saturazione con SA solido, operando come per la precipitazione al 35%.
Al termine della centrifugazione si decanta il sopranatante (S70) in un cilindro graduato a freddo, per
misurarne il volume; si scioglie il precipitato nel volume minimo di tampone Tris-HCl (P70), e se ne
misura il volume; si mettona a parte 100 µl di S70 e 100 µl di P70 per i successivi dosaggi;
Il precipitato risospeso P70 sarà il campione da caricare sulla colonna cromatografia S-200.
-dosare le aliquote conservate (EG, P35, P70, S70) per le proteine e per l’attività LDH:
Cromatografia su colonna Sephacryl-200 (S-200)
Impaccare una colonna con la resina Sephacryl-200. Una volta pronta, sistemare la colonna in un
armadio frigorifero e mandarla a flusso a 10 mL/h con 0,5 L di tampone Tris-HCl 20 mM con PIC. A
2
questo punto, si caricano sulla colonna 1,5 mL di campione P70, si collega la pompa ad un collettore di
frazioni raccogliendo 1,4 mL/frazione. Completata l’eluizione, si procede alla lettura dell’assorbanza a
280 nm di tutte le frazioni per stimare il contenuto proteico; si procede poi al saggio dell’attività LDH
ogni tre frazioni (con la miscela di saggio precedentemente descritta) a partire dalla frazione in cui
l’assorbanza a 280 nm raggiunge il valore più alto; quando si trova attività, saggiare le frazioni una per
una fino alla scomparsa dell’attività. Si riuniscsono le frazioni con attività più alta a formare il POOL 1
in modo da escludere le frazioni che presentano assorbanza a 410 nm elevata e quindi ottenere una
soluzione in cui l’enzima è stato parzialmente purificato.
Dalle letture effettuate di assorbanza a 280nm e dell’attività enzimatica delle frazioni ottenute dalla
cromatografia su colonna Sephacryl-200 è possibile costruire un grafico per identificare le frazioni da
raccogliere per formare il POOL 1.
Cromatografia su colonna Cibacron Blue Agarose
Tabella di purificazione
La tabella di purificazione che segue mostra in forma compatta i passaggi per la purificazione
dell’enzima LDH:
Volume
(mL)
Attività
(U/mL)
Attività
totale
(U)
Concentrazione
proteica
(mg/mL)
Proteine totali
(mg)
Attività
specifica
enzima
(U/mg)
EG
P35
P70
S70
POOL 1
POOL 2
Fattore di
purificazione
Resa
(%)
1
100
SDS-PAGE
Preparato un gel di poliacrilammide al 12%, si denaturano i campioni (POOL S-200 e POOL Cibacron
Blue) con Sample Buffer 5X (in modo tale che sia diluito cinque volte) e si caricano questi ultimi sul
gel. In un dei pozzetti del gel, si caricano i marcatori di pesi molecolari grazie ai quali potremo
determinare i PM delle bande nel campione purificato.
Dopo la corsa, si colora il gel con Blue di Coomassie e si decolora con metanolo al 50%.
Figura 1: SDS-page POOL S-200 e POOL Cibacron Blue.
corsia1
corsia2
corsia3
corsia4
corsia5
Parziale caratterizzazione cinetica della LDH da fegato di coniglio
Cinetica del piruvato
3
Per valutare la cinetica della LDH relativa al piruvato sono state fatte misure di velocità iniziale su
miscele di reazione in cui si faceva variare la concentrazione di piruvato fra ---- mM e ---- mM. Con i
dati ottenuti è possibile costruire sia il grafico dei reciproci che quello di Michaelis-Menten e da questi
calcolare le relative Vmax e KM:
Da cui Vmax= -----∆A/min e KM= --- mM.
Grafico
Da cui Vmax= -----∆A/min e KM= ---mM.
Cinetica del NADH
L’analisi cinetica relativa al coenzima NADH è stata effettuata a una concentrazione fissa di piruvato di
--- mM, mentre quella del coenzima variava da --- mM a ---- mM. Coi dati ottenuti è possibile costruire
sia il grafico dei reciproci che quello di Michaelis-Menten e da questi calcolare le relative Vmax e KM.
G
Da cui Vmax= -----∆A/min e KM= --- mM.
Grafico
Da cui Vmax= -----∆A/min e KM= --- mM.
Cinetica del lattato
È stata tentata la determinazione dei parametri cinetici della reazione catalizzata dalla LDH anche nel
verso da lattato a piruvato, utilizzando una quantità di preparato enzimatico dieci volte superiore a
quella usata nel verso da piruvato a lattato, e variando sia la [lattato] a [NAD+] fissa, sia la [NAD+] a
[lattato] fissa.
Grafici
CONCLUSIONI
Nel corso della purificazione, si sono verificati alcuni inconvenienti, che hanno inficiato la buona
riuscita dell’isolamento. In particolare, il mal funzionamento di un collettore di frazioni nella
cromatografia su S-200 ha mischiato le frazioni contenenti la LDH con quelle contenenti altre proteine
a diverso PM (in particolare, emoglobina). Il fattore di purificazione e la resa finale risultano così meno
alti di quanto ci si poteva attendere anche dopo la cromatografia su Cibacron Blue.
A conferma di questo, si può osservare il risultato dell’SDS-PAGE, nella quale si riesce comunque a
distinguere una banda intorno a 35 kDa che presumibilmente è la LDH, arricchita nel passaggio di
purificazione su Cibacron Blue.
La determinazione dei parametri ottenuti dalla cinetica enzimatica si è dovuta limitare alla valutazione
delle KM per il coenzima NADH e per il substrato piruvato, mentre l’analisi cinetica nella reazione
inversa non è riuscita, a causa della bassa attività del preparato.
Due misure preliminari di attività enzimatiche diverse sono state effettuate sull’estratto grezzo di fegato
di coniglio, sfruttando le proprietà di enzima rivelatore della LDH e grazie al fatto che il pH ottimale di
questo enzima è del tutto sovrapponibile a quello degli enzimi da dosare (attività ottimale nell’intervallo
fra 7,5 e 8). In dosaggi accoppiati con la reazione rivelatrice, sono state determinate le attività degli
enzimi piruvato cinasi e L-alanina amminotrasferasi.
RIFERIMENTI BIBLIOGRAFICI
4