!
"
#$ %&
'% () (
0"
"
*+ ,' % ( ) -
"
#$ %&
", .
+ /
&12 & 34 14 0 5
2
6
' % ()
/
,' %
,
/
3<
!
,
6
,
/
4
,4 9 : -
/
,
> /
*
2 13%4 9 0
0 6
6
;
4)
<
/
/
*
,
/
14 0 5
3
/
6
,
)
/
/
<
*
/
/
/
/
,
/
<
B, "#,
B, $ ,#
/
/
B, ,
B,$ , B
%
/
/
6
14 0
<
,
/: @
/ *
AB,## , B
," ", $B
+ ;;
.3 0 6 3 /
' % () ,
* 7
8
/
/
;
/
D
,
&12 & 34 14 0 5 =
#$? #?4 )
/
%> ' %
/
/
' % ()
(
/
14 0 =
/
3
/
14 0 =
B, " , "B
B," ,##B
, ,"
B, ,$
B, " , B
B,## , B
/
*
;
/
/
,"# ,B
/ C
Indice
1.
Contenuto....................................................................... 4
2.
Conservazione ............................................................... 4
3.
Materiali e dispositivi addizionali richiesti................... 5
4.
Precauzioni generali...................................................... 5
5.
Informazioni preliminari ................................................ 6
6.
Principio della procedura del test ................................ 7
7.
Descrizione del prodotto............................................... 7
8.
Protocollo....................................................................... 8
9.
8.1
Estrazione del DNA ....................................................................... 8
8.2
Preparazione della PCR................................................................ 8
8.3
Programmazione dello strumento LightCycler ........................... 11
®
Analisi dei dati ............................................................. 14
10. Risoluzione dei problemi ............................................ 18
11. Specifiche..................................................................... 20
11.1 Sensibilità analitica...................................................................... 20
11.2 Specificità analitica...................................................................... 20
11.3 Sensibilità e specificità diagnostiche ........................................... 20
12. Avvertenze speciali per l’utilizzo del prodotto .......... 20
13. Informazioni di sicurezza ............................................ 21
14. Controllo di qualità ...................................................... 21
15. Riferimento bibliografico ............................................ 21
16. Spiegazione dei simboli .............................................. 22
artus TPMT LC PCR Kit 04/2007
3
artus® TPMT LC PCR Kit*
®
Kit da utilizzare con lo strumento LightCycler .
1. Contenuto
Etichettatura
e contenuto
Art. N. 4622063
24 reazioni
Blu
TPMT LC Master A
2 x 12 rxns
Blu
TPMT LC Master B
2 x 12 rxns
¤
Giallo
TPMT LC Mg-Sol
Rosso
TPMT LC Control AW
1 x 200 µl
Rosso
TPMT LC Control AV
1 x 200 µl
Bianco
Water (PCR grade)
1 x 1.000 µl
¤
Mg-Sol
=
1 x 400 µl
Soluzione di magnesio
2. Conservazione
I componenti dell’artus TPMT LC PCR Kit devono essere conservati a -20°C e
possono essere utilizzati fino alla data di scadenza riportata sull’etichetta.
Evitare di scongelarli e congelarli più di due volte, poiché ciò potrebbe
provocare una riduzione della sensibilità. In caso di utilizzo non regolare è
necessario congelare aliquote dei reagenti. Qualora fosse necessario
conservare i componenti a +4°C, non superare l’intervallo massimo di cinque
ore.
*
TPMT = tiopurina S-metiltransferasi.
4
artus TPMT LC PCR Kit 04/2007
3. Materiali e dispositivi addizionali richiesti
Guanti da laboratorio senza talco
Kit di estrazione del DNA (vedi 8.1 Estrazione del DNA)
Pipette (regolabili)
Puntali con filtro sterili per pipette
Agitatore vortex
Centrifuga da banco con rotore per provette di reazione da 2 ml
Color Compensation Set (Roche Diagnostics, cat. n. 2 158 850) per
l’installazione di un file Crosstalk Color Compensation
®
Capillari LightCycler (20 µl)
Cooling block LightCycler
Strumento LightCycler
®
®
Capping Tool LightCycler®
4. Precauzioni generali
Chi utilizza il prodotto deve sempre attenersi a quanto segue:
Analizzare per ogni corsa PCR non più di dodici campioni perchè
un’analisi parallela di più di dodici campioni può portare a un
comportamento atipico della curva di dissociazione della variante
eterozigote nt 238.
Utilizzare puntali con filtro sterili per pipette.
Estrarre e conservare il materiale positivo (campioni, controlli,
ampliconi) separatamente da tutti gli altri reagenti e aggiungerlo alla
mix di reazione in luogo separato.
Prima dell’inizio del test scongelare tutti i componenti a temperatura
ambiente.
Una volta scongelati agitare brevemente i componenti su vortex e
sottoporli a breve centrifugazione.
®
Operare rapidamente in ghiaccio o nel cooling block LightCycler .
artus TPMT LC PCR Kit 04/2007
5
5. Informazioni preliminari
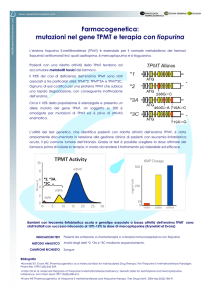
Oltre all’età, il sesso, l’alimentazione e l’interazione tra farmaci, altri fattori, in
particolare quelli genetici, possono influenzare l’attività enzimatica. E’ noto
che pazienti che a causa di modificazioni genetiche presentano un’attività
alterata dell’enzima tiopurina S-metiltransferasi (TPMT), in presenza di una
terapia con 6-tioguanina, 6-mercaptopurina o aziatoprina corrono un rischio
maggiore
(1 - 3)
di
effetti
collaterali
(p.
es.
tossicità
ematologica,
epatotossicità). Un controllo del gene TPMT consente di verificare il rischio
geneticamente determinato di effetti collaterali indotti dalla terapia. Prima
dell’inizio di una terapia si può stabilire se il paziente è portatore di una
variante genetica del gene TPMT e eventualmente si può ricorrere a una
terapia alternativa o a un dosaggio decisamente ridotto.
L’attività enzimatica della tiopurina S-metiltransferasi viene determinata, tra
l’altro, anche da modificazioni all’interno del gene TPMT. Mutamenti genetici
per esempio possono avere come conseguenza uno scambio degli
aminoacidi. La conformazione modificata dell’enzima ne influenza la sua
attività. Le più frequenti varianti genetiche nel gene TPMT riguardano i
nucleotidi (nt) 238, 460 e 719. In letteratura vengono descritti altre varianti
genetiche, che però sono state osservate raramente o solo una volta in una
popolazione. Circa il 10 % della popolazione bianca ha un’attività di TPMT
ridotta del 75 %, mentre circa lo 0,3 % non presenta un’attività enzimatica
misurabile. Analisi comparative del genotipo e del fenotipo hanno permesso di
concludere che c’è una correlazione dell’87 % fra il genotipo e l’attività
enzimatica del TPMT.
La genotipizzazione può aiutare a ottimizzare individualmente terapie
mediche. In particolare durante terapie tumorali con tiopurina, trattamenti di
malattie intestinali cronico-infiammatorie o dopo trapianti, è utile un’analisi del
gene TPMT, perché può contribuire ad abbassare il rischio di effetti collaterali
indesiderati e dei costi a questi legati (degenza ospedaliera prolungata, ecc.).
6
artus TPMT LC PCR Kit 04/2007
6. Principio della procedura del test
Per la diagnosi tramite reazione a catena della polimerasi (PCR) vengono
amplificate specifiche regioni del genoma umano. Nella real-time PCR in
tempo reale il rilevamento ha luogo con l’ausilio di sostanze fluorescenti, di
solito associate a sonde oligonucleotidiche, che si legano specificatamente
all’amplicone di PCR. L’analisi della curva di dissociazione subito dopo
l’amplificazione
della
PCR
rende
possibile
l’identificazione
e
la
differenziazione delle varianti del gene. Poiché le provette non devono essere
più aperte dopo la corsa di PCR, il rischio di contaminazione viene
decisamente ridotto (Mackay, 2004).
7. Descrizione del prodotto
Con l’artus TPMT LC PCR Kit è possibile analizzare facilmente, rapidamente
e efficacemente il DNA umano per verificare la presenza di varianti
geneticamente significative nel gene TPMT. Questa analisi permette di
valutare i rischi legati ad alcune terapie, per esempio durante il trattamento
con tiopurine.
L’analisi viene eseguita rilevando le varianti genetiche all’interno del gene
®
TPMT con l’aiuto dello strumento LightCycler . I reagenti contengono dei
primer per l’amplificazione di regioni del gene umano TPMT e delle sonde
marcate con fluorocromi per la rilevazione di varianti genetiche nelle posizioni
dei nucleotidi nt 238 nell’esone 5, nt 460 nell’esone 7 e nt 719 nell’esone 10.
Inoltre parallelamente in una reazione separata vengono eseguiti i controlli
positivi A (AW/AV) e B.
Poiché il test si basa sull’amplificazione del DNA genomico umano, i segnali di
fluorescenza nel tratto delle curve di dissociazione devono essere rilevabili
indipendentemente dalla comparsa di una variante allelica. Se non è così,
questo indica un’estrazione inefficace del DNA o un’inibizione della PCR. Per
cui in questo test genetico un ulteriore controllo interno non è necessario.
Attenzione: decisivi per l’analisi dei dati sono i segnali della curva di
dissociazione. Usando l’artus TPMT LC PCR Kit nella maggior parte dei casi
artus TPMT LC PCR Kit 04/2007
7
non è stata osservata un’amplificazione quantitativa durante la corsa del
®
LightCycler .
Ciò
comunque
non
influenza
l’analisi
della
curva
di
dissociazione.
8. Protocollo
8.1 Estrazione del DNA
Per l’estrazione del DNA dal sangue sono disponibili kit di diversi produttori.
Attenendosi al protocollo del produttore prescelto utilizzare la quantità di
campione indicata e eseguire l’estrazione del DNA conformemente alle
istruzioni. Si raccomanda l’utilizzo dei seguenti kit d’estrazione:
Campione
Kit di estrazione
Numero di catalogo
Produttore
sangue
QIAamp DNA Blood
Mini Kit (50)
51 104
QIAGEN
L’artus TPMT LC PCR Kit non deve essere utilizzato con procedure di
estrazione del DNA basate su fenolo.
Nelle procedure di estrazione del DNA che richiedono l’utilizzo di tamponi
di lavaggio contenenti etanolo, assicurarsi di eseguire una fase di
centrifugazione aggiuntiva (tre minuti, 13.000 rpm) prima dell’eluizione,
onde rimuovere residui di etanolo. Ciò impedisce eventuali inibizioni della
PCR.
8.2 Preparazione della PCR
Attenzione: per ogni corsa di PCR analizzare al massimo dodici campioni,
perché, volendo analizzare più di dodici campioni, per problemi tecnici
potrebbe presentarsi un andamento atipico della curva di dissociazione della
variante eterozigote nt 238.
Assicurarsi che il cooling block e i relativi adattatori (accessori dello strumento
®
LightCycler ) vengano raffreddati a +4°C. Posizionare negli adattatori del
®
cooling block il numero di capillari LightCycler necessario per le reazioni
desiderate. Prima dell’inizio del test tutti i reagenti devono essere scongelati
8
artus TPMT LC PCR Kit 04/2007
completamente a temperatura ambiente, ben miscelati (pipettamento ripetuto
o breve agitazione su vortex) e infine centrifugati.
Per ogni applicazione bisogna considerare i controlli positivi (TPMT LC
Control AW;
TPMT LC
Control AV
e
TPMT LC Control B)
contenuti
nell’artus TPMT LC PCR Kit e un controllo negativo (Water, PCR grade).
Per la preparazione delle reazioni di PCR attenersi al seguente schema di
pipettamento (vedi anche panoramica schematica, ):
Numero dei campioni
1. Preparazione
della Master Mix
2. Preparazione
reazione PCR
TPMT LC Master A
o
TPMT LC Master B
TPMT LC Mg-Sol
1
16 µl
2 µl
volume totale
18 µl
Master Mix
18 µl
campione
2 µl
volume totale
20 µl
Nel serbatoio in plastica di ciascun capillare pipettare 18 µl di Master Mix.
Quindi aggiungere 2 µl di DNA estratto. Analogamente, utilizzare come
controllo positivo 2 µl di TPMT LC Control A (AW/AV) o B e come controllo
negativo 2 µl di acqua (Water, PCR grade). Chiudere i capillari. Per trasferire il
contenuto del serbatoio in plastica ai capillari, centrifugare gli adattatori e i
relativi capillari in una centrifuga da banco per dieci secondi alla velocità
massima di 400 x g (2.000 rpm).
Attenzione: porre il tappo sui capillari con il Capping Tool LightCycler® al fine
di evitare delle contaminazioni.
artus TPMT LC PCR Kit 04/2007
9
Preparazione della PCR
Fig. 1
Schema del ciclo di lavoro.
*
10
Per ogni fase del pipettamento è necessario che le soluzioni
da utilizzare vengano completamente scongelate, ben
miscelate e sottoposte a breve centrifugazione.
artus TPMT LC PCR Kit 04/2007
8.3 Programmazione dello strumento LightCycler®
Per rilevare le varianti genetiche nel gene TPMT programmare sullo
®
strumento LightCycler un profilo di temperatura secondo le seguenti cinque
fasi (vedi Fig. 2 - 6):
A.
Attivazione iniziale dell’enzima Hot Start
Fig. 2
B.
Touch Down
Fig. 3
C.
Amplificazione del DNA
Fig. 4
D.
Curva di dissociazione
Fig. 5
E.
Raffreddamento
Fig. 6
Prestare particolare attenzione alle impostazioni di Analysis Mode, Cycle
Program Data e Temperature Targets. Nelle figure tali impostazioni sono
evidenziate da riquadri neri. Per ulteriori informazioni sulla programmazione
®
dello strumento LightCycler , consultare LightCycler Operator’s Manual.
Fig. 2: Attivazione iniziale dell’enzima Hot Start.
artus TPMT LC PCR Kit 04/2007
11
Fig. 3: Touch down.
Fig. 4: Amplificazione del DNA.
12
artus TPMT LC PCR Kit 04/2007
Fig. 5: Curva di dissociazione.
Fig. 6: Raffreddamento.
artus TPMT LC PCR Kit 04/2007
13
9. Analisi dei dati
Con le analisi Multicolor possono verificarsi interferenze tra i canali
fluorimetrici. Il software dello strumento LightCycler
®
contiene un file
denominato Color Compensation File, in grado di compensare queste
interferenze. Aprire il file prima, durante o al termine della corsa di PCR,
selezionando il pulsante Choose CCC File o Select CC Data. Se il Color
Compensation File non è stato installato, procedere seguendo le indicazioni
fornite in LightCycler Operator’s Manual. Dopo l’attivazione del Color
Compensation File, nei canali fluorimetrici F1, F2 e F3 compaiono segnali
separati.
Per
l’analisi
dei
risultati
della
PCR
ottenuti
con
l’artus TPMT LC PCR Kit, scegliere la funzione F2/Back-F1, per la PCR di
TPMT F3/Back-F1. Usando l’artus TPMT LC PCR Kit nella maggiorparte dei
casi non è stata osservata un’amplificazione quantitativa durante la corsa del
®
LightCycler .
I componenti dell’artus TPMT LC PCR Kit servono alla rilevazione delle
varianti genetiche (tipo selvatico o wild-type = wt; variante = var) nelle
posizioni dei nucleotidi (nt) 238, 460 e 719 nel gene TPMT. Tali varianti
genetiche possono essere determinate con l’aiuto del programma Melting
Curve. Nel fluorogramma, i punti di fusione alle temperature riportate nella
tabella seguente (vedi Tabella 1) indicano la presenza del wild-type o delle
varianti genetiche. In presenza di eterozigoti la curva mostra due picchi.
Tabella 1: Punti di fusione del wild-type (wt) e delle varianti
genetiche (var).
Master
Canale F2
Canale F3
nt
wt
var
nt
wt
var
A
238
54°C
64°C
-
-
-
B
460
57°C
47°C
719
42°C
54°C
Tenere presente che i punti di fusione possono presentare degli scarti di
± 2°C dalla temperatura indicata. Per una migliore visuale nel fluorogramma,
in molti casi è consigliabile spegnere il Digital Filter. Le figure di seguito
(vedi Fig. 7 - 9) mostrano i fluorogrammi della rilevazione dei polimorfismi alle
14
artus TPMT LC PCR Kit 04/2007
posizioni dei nucleotidi nt 238, nt 460 e nt 719 nella forma wild-type omozigote
e nella forma variante eterozigote e omozigote. I controlli positivi
(TPMT LC Control A (AW/AV) e B) contenuti nell’artus TPMT LC PCR Kit
indicano l’eterozigotia delle rispettive varianti genetiche.
Fig. 7:
Fluorogramma per la rilevazione dello scambio nucleotidico
nt 238 tramite l’artus TPMT LC PCR Kit (Master A) nel canale
fluorimetrico F2/Back-F1. NTC: non-template control
(controllo negativo).
Attenzione: per ogni corsa di PCR analizzare al massimo dodici campioni,
perché, volendo analizzare più di dodici campioni, per problemi tecnici
potrebbe presentarsi un andamento atipico della curva di dissociazione della
variante eterozigote nt 238.
Fig. 8:
Fluorogramma per la rilevazione dello scambio nucleotidico
nt 460 tramite l’artus TPMT LC PCR Kit (Master B) nel canale
fluorimetrico F2/Back-F1. NTC: non-template control
(negative control).
artus TPMT LC PCR Kit 04/2007
15
Fig. 9:
Fluorogramma per la rilevazione dello scambio nucleotidico
nt 719 tramite l’artus TPMT LC PCR Kit (Master B) nel canale
fluorimetrico F3/Back-F1. NTC: non-template control
(negative control).
E’ possibile determinare il genotipo combinando le varianti alleliche
(vedi Tabella 2). In questo caso notare che in presenza di due varianti
eterozigoti esse possono trovarsi insieme in un allele o anche in due alleli. In
ogni caso in presenza di almeno una variante genetica ci si può aspettare una
riduzione dell’attività enzimatica di TPMT.
Ci si può aspettare una normale attività enzimatica in portatori di due alleli di
wild-type, sempre premesso che nessun altro fattore non-genetico influenzi
l’attività enzimatica. Un’attività enzimatica ridotta è da aspettarsi in portatori di
almeno un allele modificato geneticamente. Per esempio in presenza di
un’eterozigotia alle posizioni nt 460 e nt 719 del genotipo TPMT*3A/*1 ma
anche TPMT*3B/*3C. Se sono interessati entrambi gli alleli aumenta il rischio
di
un
effetto
collaterale
geneticamente
condizionato.
Con
l’artus TPMT LC PCR Kit vengono analizzate le varianti nucleotidiche nelle tre
diverse posizioni nel gene TPMT, cosa che permette la rilevazione degli alleli
TPMT*1, TPMT*2, TPMT*3A, TPMT*3B e TPMT*3C.
16
artus TPMT LC PCR Kit 04/2007
Tabella 2: Varianti genetiche nel gene TPMT.
Allele
nt 238
F2
nt 460
F2
nt 719
F3
TPMT*1
TPMT*2
Attività enzimatica
normale
x
ridotta
TPMT*3A
x
TPMT*3B
x
TPMT*3C
x
nessuna attività
ridotta
x
ridotta
Da questi alleli risultano i possibili genotipi elencati nella seguente tabella
(vedi Tabella 3).
Tabella 3: Influenza del genotipo sull’attività enzimatica di TPMT.
Genotipo wild-type
omozigote
Genotipo eterozigote
o variante omozigote
Genotipo variante
omozigote
TPMT*1/*1
TPMT*1/*2
TPMT*3A/*3A
TPMT*1/*3A
TPMT*1/*3B
TPMT*1/*3C
TPMT*2/*2
TPMT*2/*3A
TPMT*2/*3B
TPMT*2/*3C
TPMT*3A/*3B
TPMT*3A/*3C
TPMT*3B/*3B
TPMT*3B/*3C
TPMT*3C/*3C
attività enzimatica
normale
attività enzimatica
ridotta
artus TPMT LC PCR Kit 04/2007
nessuna attività
enzimatica
17
10. Risoluzione dei problemi
Nessun segnale per i controlli positivi (TPMT LC Control AW/AV o B) o
per i campioni nel canale fluorimetrico F2/Back-F1 o F3/Back-F1:
Errata programmazione del profilo della temperatura dello strumento
LightCycler®.
Confrontare il profilo della temperatura con quanto indicato nel
protocollo
(vedi 8.3 Programmazione
dello
strumento
LightCycler®).
Errata preparazione della reazione PCR.
Con l’aiuto dello schema di pipettamento (vedi 8.2 Preparazione
della PCR) verificare nuovamente le fasi operative eseguite e
eventualmente ripetere la PCR.
Le condizioni per la conservazione di uno o più componenti del kit non
corrispondono a quanto indicato in 2. Conservazione o è stata superata
la data di scadenza dell’artus TPMT LC PCR Kit.
Verificare sia le condizioni di conservazione che la data di scadenza
(vedi etichetta del kit) dei reagenti e utilizzare eventualmente un
nuovo kit.
La PCR è stata inibita.
Assicurarsi
di
raccomandate
utilizzare
una
delle
(vedi 8.1 Estrazione
procedure
del
DNA)
di
e
estrazione
attenersi
scrupolosamente alle indicazioni del produttore.
Accertarsi che durante l’estrazione del DNA e prima dell’eluizione sia
stata eseguita l’ulteriore fase di centrifugazione consigliata per
eliminare eventuali residui di etanolo (vedi 8.1 Estrazione del DNA).
Ci sono perdite di DNA causate dall’estrazione.
Assicurarsi
di
raccomandate
utilizzare
una
delle
(vedi 8.1 Estrazione
procedure
del
DNA)
di
e
estrazione
attenersi
scrupolosamente alle indicazioni del produttore.
18
artus TPMT LC PCR Kit 04/2007
Nessun segnale con il TPMT LC Master A nel canale fluorimetrico
F3/Back-F1:
Il TPMT LC Master A genera solo un segnale nel canale fluorimetrico
F2/Back-F1.
Andamento atipico della curva di dissociazione in presenza del
rilevamento dello scambio nucleotidico nt 238 nel canale fluorimetrico
F2/Back-F1:
Sono stati analizzati parallelamente più di dodici campioni.
Picco di fluorescenza debole
Miscelare accuratamente i componenti prima del loro utilizzo.
Controllare le condizioni dell’amplificazione.
Preraffreddare il cooling block con i rispettivi adattatori a circa +4°C.
Raffreddare tutti i reagenti durante il pipettamento.
In caso di dubbi o problemi contattare il nostro servizio tecnico.
artus TPMT LC PCR Kit 04/2007
19
11. Specifiche
11.1 Sensibilità analitica
L’artus TPMT LC PCR Kit serve a rilevare la costituzione individuale genetica
riguardo alle varianti nt 238, nt 460 e nt 719 nel gene umano TPMT, con
®
l’ausilio della tecnologia LightCycler . Il DNA genomico umano è stato
purificato dai campioni di sangue, quantificato allo spettrofotometro e sono
state eseguite delle diluizioni seriali. Un minimo di 0,12 ng di DNA genomico
(20 copie) per PCR (corrispondente a 0,005 - 0,02 µl di sangue, a seconda del
paziente e della purificazione) è sufficiente per la rilevazione delle varianti
genetiche.
11.2 Specificità analitica
La specificità dell’artus TPMT LC PCR Kit viene garantita in primo luogo dalla
scelta dei primer e delle sonde, nonché dalle condizioni stringenti della
reazione di PCR. Primer e sonde sono stati controllati per mezzo di
un’apposita analisi di confronto delle sequenze, onde verificare l’eventuale
presenza di omologie con tutte le sequenze pubblicate nelle banche
genomiche. In seguito la specificità per la rilevazione del polimorfismo
genetico è stata assicurata sequenziando le singole varianti alleliche e
confrontando di seguito le sequenze con le banche dati internazionali.
11.3 Sensibilità e specificità diagnostiche
In base a 300 campioni di DNA e utilizzando i componenti del kit è stata
confermata la frequenza di polimorfismi nella popolazione caucasica, come
indicato nel riferimento bibliografico.
12. Avvertenze speciali per l’utilizzo del prodotto
Tutti i reagenti devono essere impiegati esclusivamente per la
diagnostica in vitro.
L’utilizzo è consentito soltanto a personale dotato delle necessarie
conoscenze e competenze in merito alle procedure della diagnostica
in vitro (EN375).
20
artus TPMT LC PCR Kit 04/2007
Per ottenere risultati PCR ottimali è assolutamente necessario
attenersi al protocollo.
Rispettare le date di scadenza dei singoli componenti, riportate sulla
confezione e sulle etichette. Non utilizzare reagenti scaduti.
13. Informazioni di sicurezza
Per
le
informazioni
di
sicurezza
riguardanti
l’artus TPMT LC PCR Kit
consultare la relativa scheda di sicurezza (material safety data sheet, MSDS),
disponibile all’indirizzo www.qiagen.com/support/msds.aspx nel comodo e
compatto formato PDF.
14. Controllo di qualità
In conformità con il sistema di gestione per la qualità di QIAGEN certificato
ISO 9001 e ISO 13485 ogni lotto dell’artus TPMT LC PCR Kit è stato testato
in base a specificità prestabilite per garantire la costante qualità del prodotto.
15. Riferimento bibliografico
(1) Andersen JB, Szumlanski C, Weinshilboum RM, Schmiegelow K.
Pharmacokinetics,
dose
adjustments,
and
6-
mercaptopurine/methotrexate drug interactions in two patients with
thiopurine methyltransferase deficiency. Acta Paediatr. 1998 Jan; 87 (1):
108 - 111.
(2) Krynetski EY, Schuetz JD, Galpin AJ, Pui CH, Relling MV, Evans WE. A
single point mutation leading to loss of catalytic activity in human
thiopurine S-methyltransferase. Proc Natl Acad Sci U S A. 1995 Feb 14;
92 (4): 949 - 953.
(3) Mackay IM. Real-time PCR in the microbiology laboratory. Clin. Microbiol.
Infect. 2004; 10 (3): 190 - 212.
(4) Schwab M, Schaffeler E, Marx C, Fischer C, Lang T, Behrens C, Gregor
M, Eichelbaum M, Zanger UM, Kaskas BA. Azathioprine therapy and
artus TPMT LC PCR Kit 04/2007
21
adverse drug reactions in patients with inflammatory bowel disease:
impact
of
thiopurine
S-methyltransferase
polymorphism.
Pharmacogenetics. 2002 Aug; 12 (6): 429 - 436.
16. Spiegazione dei simboli
Utilizzare entro
Codice del lotto
Fabbricante
Numero di catalogo
Numero di materiale
Manuale
Dispositivo medico per diagnostica in vitro
<N>
Contenuto sufficiente per <N> test
Limiti di temperatura
Soluzione di magnesio
22
artus TPMT LC PCR Kit 04/2007
artus TPMT LC PCR Kit 04/2007
23
3EF
9 /
$
9 /
$
? $." ."
.B
.# "
C H $
? $." ."#
$
0
C H$
. " .B#B"
/ 4
!
9 /
".
.#
.#
C H ".
"
. #."
"
C H
!
!#
9 /
.
. ""
C
6
.BB
. $""
.BB
(
BB. B .
.""
"
$
.
#$ %& "
.$"B
"
+ /
"
"#
. $"$
C H BB. B .
."
C H$
. "$.
B
#"#
".
$
%% " .",5
@3
.10)1 $
& 6
& 6
$
*
.
3B
.
$3
.
4 9 A 0& :9 )A C 4 ) )I
.#
.#
"
. #."
"B" 2
F
&
9
& 6
.
C H
$
31 $ #
," ?"
& F
? $." .""
2
& 6
/
G
$
A
. #.
;
'!
9 /
/
.# B
.
!% &
9 /
"
(
C H
$ #
&
.#
"
& 6
'%() -
"
9 /
?
. $ #$
6/ >
& 6
$
46
.BB
+
*
6 >
BB. B .
!
4
$
.> ,& >@ "
. $""
& 6
& 6
46
.
."
#" BB
.10)1 $
.
.
.
B