M
LE GUIDE
Fondazione Humanitas
ieloma
multiplo
Fondazione Federico Calabresi
M
ieloma multiplo
Andrea Nozza
Armando Santoro
Humanitas Cancer Center
Istituto Clinico Humanitas
Rozzano-Milano
INTRODUZIONE
N
el plasma, la parte liquida ottenuta
per centrifugazione o sedimentazione del sangue periferico, è presente
un gran numero di proteine con funzioni
ormonali, di trasporto ed anticorpale. La
loro concentrazione fisiologica varia nel
soggetto adulto da 6,5 a 8 grammi/decilitro:
l’albumina ne costituisce il 50% e le immunoglobuline il 20% circa. Un semplice esame
di laboratorio ormai utilizzato di routine,
l’elettroforesi delle sieroproteine, sfruttando
la carica elettrica delle diverse proteine, permette di separarle tra loro (zona albuminica,
zona α1, α2, β e γ) ed individuarle, evidenziandone eventuali alterazioni quantitative e
qualitative.
Prevalentemente nella zona γ dell’elettroforesi riscontriamo le Immunoglobuline
(Ig), proteine con funzione anticorpale,
fisiologicamente sintetizzate da specifiche
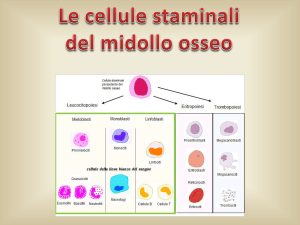
cellule del midollo osseo: le plasmacellule.
2
Normalmente le Ig aumentano in caso
di stimolazione del sistema immunitario
(infezioni, infiammazioni, neoplasie):
all’elettroforesi si riscontra un quadro di
ipergammaglobulinemia. In questi casi le Ig
sono diverse tra loro in quanto prodotte da
diverse plasmacellule midollari e l’incremento è definito policlonale.
Vi sono dei casi in cui all’elettroforesi si
evidenzia un picco nella zona gamma,
costituito cioè da immunoglobuline tutte
uguali fra loro, prodotte in assenza di cause
apparenti da un unico clone patologico di
plasmacellule. In questi casi l’incremento
è monoclonale. Il riscontro in clinica di un
picco monoclonale è definito gammopatia
monoclonale e le Ig patologiche vengono
chiamate "componente monoclonale"(CM).
3
COMPONENTE
MONOCLONALE:
COSA SIGNIFICA?
N
ella popolazione il riscontro di una
CM aumenta con l’età, passando
da meno dell’1% in soggetti di età inferiore a 35 anni all’8% circa in età superiore
a 65 anni. Nella maggior parte dei casi il
riscontro di una CM sierica avviene occasionalmente nel corso di accertamenti clinici
di routine e non sempre identifica una condizione morbosa che necessita di terapia.
Infatti le patologie che maggiormente si
correlano ad una CM sierica sono essenzialmente:
• la gammopatia monoclonale di incerto significato (MGUS), che richiede solo
periodici controlli. Queste forme erano
una volta impropriamente definite come
gammopatie monoclonali benigne, ma evidenziano invece una tendenza alla trasformazione neoplastica di circa l’8% a 5 anni e
del 15% a 10 anni;
4
• il mieloma multiplo (MM), neoplasia
ematologica che necessita nella maggior
parte dei casi di trattamenti specifici. la
macroglobulinemia di Waldenström, la malattia delle catene pesanti o leggere;
• l’amiloidosi
• la POEMS Syndrome.
Pertanto nel caso in cui venga riscontrata una
CM sierica, ci si deve sottoporre ad accertamenti atti a determinare la causa di questa
alterazione delle proteine.
Questi accertamenti comprendono una
completa routine ematologica (emocromo,
funzionalità renale ed epatica, elettroliti, calcemia, esame delle urine, immunofissazione
del siero e delle urine), radiografia dello
scheletro e prelievo di sangue midollare.
5
GAMMOPATIA
MONOCLONALE DI
INCERTO
SIGNIFICATO
(MGUS)
L
a diagnosi di MGUS è sempre una
diagnosi di esclusione effettuata
dopo un’attenta valutazione delle condizioni
cliniche del paziente, della sua anamnesi e
del risultato degli accertamenti eseguiti. Il
paziente con MGUS non presenta sintomi
specifici e gli esami ematochimici risultano
nei valori di norma, la valutazione radiologica dello scheletro non evidenzia lesioni
osteolitiche e la CM sierica è solitamente di
modica entità, con una minima quota di plasmacellule midollari. Nel corso degli anni la
MGUS può evolvere verso un MM conclamato: attualmente non si dispone di strumenti
atti a stabilire la benignità della condizione
o la probabilità che questa evolva verso il
MM, sebbene la persistenza di bassi valori
di CM sierica e la mancanza di soppressione
delle altre classi immunoglobuliche siano
fattori altamente probanti di una non evolutività clinica. Evidenze recenti in letteratura
6
dimostrano come sia possibile stratificare il
rischio di evoluzione tra le MGUS utilizzando
tre semplici parametri, che sono il tipo di CM
(IgA o IgM), l’entità della stessa CM (superiore a 1.5 g/dl) e l’eventuale alterazione del
rapporto delle catene leggere K/L sieriche
(FLC ratio).
La MGUS non richiede di alcun trattamento
ma unicamente di controlli atti a valutarne
evoluzione nel tempo: pertanto va impostato
un programma di follow-up periodico, la cui
frequenza varia tra i 6 e i 12 mesi, tempistica
correlata all'entità della CM e dall'alterazione
di alcuni fattori prognostici. Un’eventuale
progressione di malattia solitamente avviene
con un incremento della CM e/o comparsa di
dolori ossei in circa il 15% dei pazienti entro
10 anni dalla diagnosi di MGUS. Se durante
il follow-up viene confermata la stazionarietà
del quadro, i soggetti con MGUS non necessitano di alcuna terapia.
7
N
MIELOMA
MULTIPLO
el Mieloma Multiplo (MM) riscontriamo
una proliferazione incontrollata plasmacellule tumorali, che si accumulano nel midollo
osseo e producono elevate quantità di CM, riscontrabile nel nel siero e nelle urine (proteinuria di
Bence Jones). La CM solitamente è un Ig di classe
G o di classe A, (raramente di classe IgM, rarissime di classe IgD e IgE). Le cause del MM non
sono note e la sua patogenesi è ancora in via di
definizione. Fra le possibili cause vi sono fattori
ambientali, quali esposizioni a pesticidi o altri
agenti chimici, radiazioni, agenti infettivi. Esistono
sporadiche segnalazioni di MM familiare.
L’incidenza annua è di circa 3-4 casi su 100.000,
variando tuttavia da paese a paese: da 1 caso
annuo su 100.000 in Oriente, si passa a 4 casi su
100.000 nella maggior parte dei paesi occidentali.
Nella popolazione di colore si riscontra un’incidenza doppia rispetto ai bianchi.
In Italia il MM rappresenta l'1,2% di tutti i tumori
diagnosticati tra gli uomini e l'1,3% tra le donne
8
con un’incidenza, media ogni anno di 9,5 casi
ogni 100.000 uomini e 8,1 ogni 100.000 donne. Le
stime indicano un totale di 2.315 nuovi casi diagnosticati ogni anno fra i maschi e di 2.098 fra le
femmine. Il MM è una patologia dell’età avanzata,
l’età mediana alla diagnosi è di 68 anni, circa il 2%
dei pazienti all’esordio ha meno di 40 anni mentre
il 38% dei pazienti ha un'età superiore a 70 anni.
I tassi d'incidenza per MM sono abbastanza omogenei sia come distribuzione regionale sia come
andamento nel tempo. L’incidenza del MM è nel
complesso stabile mentre la mortalità è in lieve
calo.
9
PLASMOCITOMA
SOLITARIO
R
ispetto al MM, il plasmocitoma
interessa pazienti più giovani (50-55
anni). E’ per definizione una lesione singola,
solitamente localizzata a livello delle ossa della
colonna vertebrale, del bacino e dei femori o
a livello delle mucose prevalentemente del
distretto orofaringeo. In questi pazienti l’analisi del midollo osseo risulta normale, non vi
sono altre lesioni osteolitiche, non si evidenzia
nè anemia, nè insufficienza renale, nè ipercalcemia. Solo nella metà dei casi si evidenzia
una CM sierica o urinaria, che scompare con
l’asportazione del plasmocitoma.
Il trattamento è chirurgico ed eventualmente
radioterapico. Si può riscontrare un evoluzione
verso un MM anche dopo molti anni dalla diagnosi di plasmocitoma.
10
I
MIELOMA
MULTIPLO:
CLINICA
n circa il 30% dei casi la diagnosi MM risulta
occasionale, con evidenza di una CM sierica
e/o urinaria in corso di esami di controllo. Negli
altri pazienti il sintomo che maggiormente indirizza al medico è il dolore osseo. Tutti i sintomi
sono dovuti alla proliferazione delle plasmacellule
neoplastiche: dolore osseo, immunodepressione,
insufficienza midollare e sintomi legati alla CM.
Dolore osseo. Le plasmacellule neoplastiche,
tramite la produzione di varie sostanze chiamate
citochine, determinano un incremento dell’attività
degli osteoclasti, cellule coinvolte nel fisiologico
rimaneggiamento del tessuto osseo, causando
rarefazione ossea e lesioni litiche spesso multiple.
Queste lesioni sono maggiormente localizzate al
bacino, alla teca cranica ed alla colonna vertebrale,
causando spesso fratture patologiche. Il dolore
osseo è solitamente localizzato, aumenta nelle ore
notturne e peggiora con i movimenti.
Insufficienza midollare. A livello del midollo
osseo la presenza di plasmacellule tumorali deter11
mina una diminuzione del normale tessuto emopoietico midollare, con conseguente riduzione delle
normali cellule del sangue (globuli rossi, globuli
bianchi e piastrine): ciò comporta un aumentato rischio di infezioni e di emorragie, nonché di anemia.
Immunodepressione. La produzione di Ig monoclonali determina una riduzione delle normali classi
immunoglobuliniche, causando nel paziente uno
stato di immunodepressione che aumenta il rischio
di infezioni.
Componente Monoclonale (CM). La presenza
di una CM sierica e/o urinaria può causare insufficienza renale, polineuropatie periferiche, amiloidosi
e sindrome da iperviscosità. L’insufficienza renale si
manifesta alla diagnosi circa nel 20% dei casi e compare durante l’evoluzione della malattia in almeno il
50% dei pazienti: può peggiorare per l’ipercalcemia
dovuta al coinvolgimento osseo. Le manifestazioni
neurologiche in corso di MM sono varie, ma per lo
più sono polineuropatie che alterano la sensibilità e
la motilità agli arti superiori o inferiori. La presenza
della CM nel siero rende il sangue meno fluido: in
circa il 4-10% dei pazienti si evidenzia un quadro clinico definito "Sindrome da iperviscosità", caratterizzato da astenia, mal di testa, vertigini, sonnolenza,
manifestazioni emorragiche (epistassi, gengivorraggie) ed insufficienza cardiaca.
12
COME
DIAGNOSTICARE
IL MIELOMA
MULTIPLO (MM).
D
i fronte ad un sospetto di MM il
paziente dovrà eseguire esami di
laboratorio (emocromo, funzionalità renale
ed epatica, calcemia, elettroforesi ed immunoelettroforesi sierica ed urinaria), esami
radiologici (radiografia dello scheletro) e
un prelievo di sangue midollare (aspirato
midollare e biopsia ossea). Si parla di MM
quando si riscontrano una CM sierica e/o
urinaria, lesioni osteolitiche ed un infiltrato
patologico di plasmacellule nel midollo
osseo (almeno superiore al 10%). Per impostare il miglior trattamento, per valutare la
gravità e quindi la prognosi dei pazienti, si
deve definire la diffusione della malattia,
eseguire cioè una stadiazione. Il sistema
di stadiazione attualmente usato è quello
di Durie & Salmon, che si basa sui valori
della CM, dell’emoglobina e della calcemia,
sulla presenza e quantità di lesioni ossee
e di alterazioni della funzionalità renale,
13
permettendo di dividere i pazienti in tre
stadi. Parallelamente, in diversi studi clinici
è emersa l’utilità a fini prognostici di alcuni
parametri ematochimici valutati all’esordio della malattia, come il dosaggio della
proteina C reattiva, dell'albumina e della
β2-microglobulina.
14
MIELOMA
MULTIPLO:
COSA FARE?
L
approccio terapeutico ai pazienti affetti da MM è sensibilmente modificato
in questi ultimi anni: dipende essenzialmente
dallo stadio della malattia e dall’età del paziente. I pazienti in stadio iniziale (stadio I), il
più delle volte asintomatici, non necessitano
d’alcun trattamento, non diversamente da
una MGUS. Il clinico dovrà tenere in stretto
controllo il paziente evidenziando eventuali
segni di progressione (incremento della CM,
comparsa di dolori ossei, insufficienza renale,
anemizzazione). La malattia in stadio limitato
può rimanere tale per molto tempo senza
alcuna terapia specifica. Si deve inoltre sottolineare che il MM è una malattia che si può
curare ma non guarire: fino ad ora nessuno
studio clinico ha dimostrato che anticipare
il trattamento permette di ottenere benefici
in termini di efficacia, di qualità di vita e di
sopravvivenza. Pertanto il trattamento chemioterapico viene quindi riservato ai pazienti
15
con malattia sintomatica, ai pazienti in stadio
avanzato (II e III stadio). L’introduzione dei
nuovi farmaci nel prontuario terapeutico
per il MM (come talidomide, lenalidomide
e Bortezomib, spesso in combinazione con
cortisonici e/o chemioterapici) ha comportato
un miglioramento della sopravvivenza, sia nei
pazienti alla diagnosi che alla recidiva della
malattia. I pazienti con MM sintomatico vengono avviati a trattamento di prima linea e, in
casi selezionati, a successiva terapia di consolidamento ad alte dosi con supporto di cellule
staminali emopoietiche autologhe (Trapianto
autologo). Generalmente i pazienti con età
superiore a 65 anni vengono esclusi dalle procedure trapiantologiche, mentre i pazienti più
giovani, possono essere trattati con terapia ad
alte dosi previa valutazione della funzionalità
cardiaca, polmonare, renale, epatica e l’esclusione di eventuali infezioni attive. Peraltro,
va sottolineato come la presenza di insufficienza renale ed età anagrafica avanzata, non
sono controindicazioni assolute a trattamenti
intensificati. Nei pazienti di età superiore ai 65
anni, gli obbiettivi principali del trattamento
sono l’ottenimento della risposta completa,
al fine di prolungare l’intervallo libero da
malattia e la spettanza di vita e ridurre il più
16
possibile la tossicità della terapia, per non
inficiare eccessivamente sulla qualità della vita
dei pazienti. Per conseguire questi obiettivi,
la terapia deve essere adeguata non solo alle
caratteristiche della malattia, ma anche all’età
biologica e al performance status del paziente. Inoltre è importante il trattamento con
bisfosfonati (Pamidronato e Zolendronato) la
cui somministrazione mensile determina una
riduzione del rischio di fratture patologiche.
Tuttavia, inizialmente l’utilizzo di questi farmaci, soprattutto lo Zolendronato, si correlava
al rischio di sviluppare una grave complicazione odontoiatrica, ossia l’osteonecrosi
della mandibola (ONJ). Tale complicazione è
caratterizzata da un area di osso esposto nella
mascella o nella mandibola che persiste per
più di 6 settimane, associato o meno a dolore
ed edema dei tessuti molli, e insorge prevalentemente dopo un intervento odontoiatrico
(soprattutto avulsioni). Una corretta valutazione odontoiatrica preventiva prima di iniziare
il trattamento (con indicazione ad eseguire
eventuali interventi mirati) associata ad una
costante igiene orale quotidiana, hanno permesso di ridurre drasticamente l’incidenza di
questa grave complicazione.
17
I "NUOVI FARMACI"
C
ome già accennato in precedenza,
l’associazione di nuove molecole alla
classica chemioterapia, ha consentito di ottenere
notevoli benefici ai pazienti affetti da MM. Queste
molecole sono la talidomide, il Bortezomib e la
lenalidomide.
Talidomide. La talidomide negli anni cinquanta e sessanta veniva prescritto come sedativo e
antiemetico soprattutto in gravidanza. Alla fine
del 1961 venne ritirato dal commercio in seguito
all’evidenza di gravi effetti teratogeni: le donne
che avevano assunto talidomide davano alla
luce neonati con gravi alterazioni dello sviluppo
degli arti (focomelia). Peraltro, negli anni 90,
le sue proprietà antiangiogeniche e immunomodulanti ne hanno fatto farmaco efficace nel
trattamento del MM, con evidenza di risposte
anche nei pazienti pesantemente pretrattati. Da
allora la talidomide è stata ampiamente utilizzata
in questa patologia. Attualmente la talidomide è
prescrivibile nel paziente di età superiore a 65
anni con MM all’esordio nell’associazione MPT,
18
nel paziente candidabile a trapianto nello schema
VTD, o come terapia di mantenimento dopo il
trapianto. La talidomide è un farmaco che si assume per os, preferibilmente nelle ore serali: infatti
uno dei maggiori effetti collaterali è la sonnolenza
(soprattutto a dosi elevate) che tende a scomparire con il prosieguo della cura. Un altro effetto collaterale che si riscontra nei pazienti che assumono
talidomide è l’insorgenza di una Neuropatia
periferica, spesso irreversibile, caratterizzata da
riduzione della sensibilità alle dita delle mani e dei
piedi e formicolio.
Bortezomib. Il Bortezomib è un inibitore di
alcune molecole contenute nelle cellule (il proteosoma) con conseguente blocco della crescita
e conseguente morte cellulare. Il proteosoma si
trova in tutte le cellule dell’organismo ma soprattutto nelle cellule tumorali e solo in piccola parte
sulle cellule sane, dato che ne giustifica l’azione
mirata verso il MM. Il Bortezomib è disponibile
per la somministrazione endovenosa e, da pochi
mesi anche per la somministrazione sottocutanea.
Attualmente il Bortezomib è registrato in associazione a Melphalan e prednisone (schema VMP)
per il trattamento del mieloma multiplo non candidato a trapianto e in associazione a talidomide e
Desametasone (VTD) nell’induzione pretrapianto
nel paziente giovane.
19
Il Bortezomib è un farmaco molto efficace
con un ottimo profilo di tossicità: infatti il
Bortezomib, oltre ad una lieve riduzione transitoria delle piastrine, può determinare insorgenza di neuropatia periferica, spesso dolorosa a
livello delle piante dei piedi, che si risolve nella
maggioranza dei casi alla riduzione della dose o
sospensione del farmaco. Da sottolineare come
il passaggio alla somministrazione sottocutanea
riduca di molto l’insorgenza e l’entità di questo
effetto collaterale.
Lenalidomide. Questa molecola deriva dalla
talidomide rispetto alla quale ha maggiore
efficacia senza evidenza di effetti neurotossici.
Anche per la lenalidomide viene segnalato il
rischio teratogeno. Il farmaco si assume per os,
per 21 giorni consecutivi ogni 28 e il trattamento viene proseguito fino a quando la malattia
risulta responsiva. E’ un farmaco ben tollerato:
gli effetti collaterali riportati sono: riduzione dei
leucociti, globuli rossi e piastrine; comparsa di
rush cutanei e rischio di sviluppare trombosi:
quest’ultimo problema viene praticamente eliminato con una profilassi antitrombotica con aspirina a basse dosi o (in casi particolari) con eparina
a basso peso molecolare. Praticamente assente la
tossicità neurologica.
20
PAZIENTE GIOVANE:
TERAPIA AD
ALTE DOSI CON
REINFUSIONE DI
CELLULE STAMINALI
EMOPOIETICHE
PERIFERICHE
I
l paziente candidabile a tale procedura
esegue 3-4 cicli di terapia di induzione per
ridurre la massa neoplastica. Generalmente
gli schemi di induzione comprendono
Bortezomib, talidomide, Ciclofosfamide e
Desametasone, spesso in associazione, e consentono di ottenere una risposta rapida in oltre
la metà dei pazienti. In seguito viene somministrato un ciclo di terapia citoriduttiva con ciclofosfamide definita di “mobilizzazione” seguita
da somministrazione di fattore di crescita
emopoietico (G-CSF), farmaco che il paziente
effettua domiciliarmente per via sottocutanea.
La combinazione tra chemioterapia e fattore
di crescita ha lo scopo di “mobilizzare” nel
sangue periferico le cellule definite staminali
totipotenti, cellule potenzialmente in grado di
dare origine a tutte le cellule del sangue, che
normalmente sono presenti solo a livello del
midollo osseo.
21
Con un semplice prelievo del sangue si è in
grado di valutare la quantità di queste cellule
staminali circolanti nel sangue periferico e, se
i valori risultano adeguati, il paziente eseguirà una o più procedure di leucoaferesi, per
raccogliere e criopreservare le stesse cellule
staminali.
22
LA LEUCAFERESI
L
a leucaferesi è la procedura che permette di raccogliere le cellule staminali: si collega il paziente all’apparecchio per
la leucaferesi, tramite due aghi posizionati
in due vene periferiche (meglio un catetere
centrale ed una vena periferica); il sangue
viene prelevato da una vena, fatto circolare
attraverso particolari filtri contenuti nella
macchina della leucoaferesi, dove vengono
identificate e separate le cellule staminali e
quindi reinfuso attraverso il secondo accesso
vascolare. La procedura dura solitamente
tre ore e non richiede ricovero. Le cellule
raccolte vengono criopreservate, in pratica
conservate in azoto liquido (a -180 °C) fino
al giorno del trapianto.
23
CHEMIOTERAPIA
AD ALTE DOSI E
REINFUSIONE
DI CELLULE
STAMINALI
L
a fase successiva comprende la somministrazione di chemioterapia (Melphalan) ad
un dosaggio elevato e la reinfusione delle cellule
staminali emopoitiche in precedenza raccolte e
criopreservate, il cosiddetto trapianto di cellule
staminali autologhe. Il trapianto consiste nell’infusione rapida delle cellule staminali attraverso il
catetere venoso centrale.
Tutto ciò consente alcuni vantaggi:
✔ Gli elevati dosaggi di chemioterapico consentono teoricamente di eradicare la malattia dal
midollo osseo, superando la barriera della chemioresistenza delle cellule neoplastiche.
✔ La reinfusione delle cellule staminali permette
di ridurre il periodo di pancitopenia (carenza
di globuli bianchi, globuli rossi e piastrine)
dovuti alla somministrazione del chemioterapico, con conseguente riduzione del rischio
infettivo e del fabbisogno trasfusionale.
Le cellule staminali non sono “curative” ma ci
permettono di effettuare la chemioterapia a dosi
elevate, riducendone la tossicità.
24
L
TOSSICITÀ
a tossicità di questa procedura risulta
accettabile: infatti l’utilizzo delle cellule staminali periferiche, dei fattori di crescita
emopoietici e il miglioramento della terapia di
supporto (soprattutto antibiotica) consentono
di ridurre gli effetti collaterali e il periodo di
degenza di questi pazienti.
Gli effetti collaterali che si riscontrano sono
essenzialmente:
✔ Nausea e vomito, di solito di modica entità.
✔ Pancitopenia: di grado elevato, che nella
maggior parte dei casi richiede un supporto
trasfusionale e somministrazione di fattori
di crescita emopoietici, anche se generalmente per pochi giorni.
✔ Infezioni, legate alla neutropenia: per limitare il rischio infettivo i pazienti sono posti
in regime di isolamento protettivo per la
durata della neutropenia, mediamente di
una settimana.
✔ Mucosite: con dolore al cavo orale, difficoltà ad alimentarsi e diarrea.
25
Il ricovero ospedaliero per tale procedura
dura solitamente tre settimane.
In base alla risposta ottenuta dopo il trapianto, è eventualmente possibile effettuare una
secondo trapianto a distanza da 3-6 mesi dal
precedente.
26
CONSOLIDAMENTO
E MANTENIMENTO
L
a terapia di consolidamento ha l’obiettivo di migliorare ulteriormente la risposta ottenuta con le alte dosi; si basa quindi su di
un regime terapeutico altamente efficace, somministrato per un breve periodo di tempo, per
ridurne al minimo la tossicità. In seguito all’introduzione dei “nuovi farmaci” nell’armamentario terapeutico del mieloma sono stati sperimentati regimi di consolidamento comprensivi
di talidomide, Bortezomib e lenalidomide, con
conseguente aumento del numero dei pazienti
che ottenevano una risposta completa.
La terapia di mantenimento è finalizzata invece
a conservare nel tempo la risposta ottenuta e a
prolungare la sopravvivenza, senza alterare in
modo significativo la qualità di vita. Consiste in
un trattamento con un farmaco a bassi dosaggi,
per un periodo di tempo prolungato (anche
alcuni anni). Fino a 10 anni fa circa, le uniche
possibilità erano rappresentate dall’interferone
e dallo steroide, che peraltro risultavano tossi27
che e assai poco efficaci. L’impiego di talidomide
come terapia di mantenimento ha in alcuni casi
determinato un miglioramento della durata della
risposta e della sopravvivenza globale: Il problema principale relativo all’impiego di talidomide
come terapia di mantenimento a lungo termine
riguarda la sua neurotossicità, che determina
una sua sospensione nel 60% dei pazienti. La
lenalidomide in considerazione dell’assenza di
neurotossicità, appare farmaco ideale come terapia di mantenimento, con vantaggio della sopravvivenza. Peraltro, nei pazienti che assumevano
lenalidomide è emerso un incrementato rischio
di seconde neoplasie e pertanto il suo utilizzo va
attentamente valutato.
Pochi e non conclusivi dati esistono sulla terapia di mantenimento con Bortezomib, essendo
inoltre di non poco rilievo il problema della via
di somministrazione endovenosa e la sua neurotossicità. La recente disponibilità del farmaco per
via sottocutanea, e la conseguente riduzione degli
effetti collaterali potrebbe favorirne l’impiego.
28
PAZIENTI ANZIANI:
QUALE TERAPIA?
C
ome già messo in evidenza precedentemente, l’età mediana d’insorgenza del MM è di circa 68 anni. Pertanto la
possibilità di eseguire terapie aggressive con
intento curativo, rimane limitato alla minoranza di pazienti. Peraltro, l’introduzione delle
nuove molecole nella terapia del mieloma
(talidomide, Bortezomib e lenalidomide) ha
consentito di migliorare i risultati che si ottengono anche nel paziente non candidabile a
terapie intensificate.
29
RADIOTERAPIA:
QUANDO
UTILIZZARLA?
D
iversamente da altre neoplasie oncoematologiche, dove la radioterapia
viene affiancata alla chemioterapia con intento
curativo, nei pazienti affetti da MM è utilizzata
solamente a scopo sintomatico.
Il MM è una neoplasia altamente radiosensibile ma essendo una malattia sistemica, in
altre parole diffusa, si dovrebbe irradiare tutto
l’organismo, con gravi effetti collaterali per il
paziente. Questo tipo di trattamento (chiamato
Irradiazione corporea globale) è attualmente
utilizzato solo come regime preparatorio ad un
trapianto di midollo o cellule staminali allogeniche.
Solitamente la radioterapia è utilizzata per
controllare localmente la malattia, in caso di
localizzazione ossea e fratture patologiche
(soprattutto a livello delle vertebre, del bacino
e degli arti), allo scopo di ridurre o eliminare il
dolore osseo.
30
TERAPIE FUTURE
(ma non troppo...)
S
ono già in corso in molti paesi, tra
cui l’Italia, studi con nuove molecole. Infatti a breve potrebbero essere disponibili per i pazienti affetti da MM farmaci come
la Pomalidomide (altro farmaco immunomodulante derivato dalla lenalidomide) il
Carlfizomib (un nuovo inibitore del proteosoma) o anticorpi monoclonali diretti contro
proteine di superficie della plasmacellula
tumorale, farmaci diretti contro particolari
proteine regolatorie della plasmacellula.
31
I
CONCLUSIONI
n questi ultimi anni la terapia e di conseguenza
la prognosi dei pazienti affetti da MM è radicalmente modificata, permettendo di superare
l’approccio palliativo dei decenni precedenti. Nel
paziente giovane, l'utilizzo di programmi sequenziali ad alte dosi con trapianto di cellule staminali
periferiche autologhe o allogeniche ha permesso
di migliorare la qualità di vita di questi pazienti e,
in ultima analisi, di prolungarne la sopravvivenza.
Nel paziente anziano, l’approccio di associazione
tra farmaci biologici (talidomide, Borterzomib e
lenalidomide) e chemioterapia, ha consentito di
ottenere ottimi risultati, garantendo un trattamento
adeguato anche in questa categoria di pazienti ove,
fino a poco tempo fa, le cure erano unicamente
indirizzate al controllo dei sintomi. Lo sviluppo
di modalità innovative e l’introduzione di nuovi
farmaci (ma soprattutto la loro migliore “combinazione”) sarà certamente in grado di migliorare
ulteriormente ed in maniera significativa i risultati
terapeutici ottenuti in questa patologia.
32
Questo opuscolo è stato
realizzato grazie alla
Fondazione
Federico Calabresi Onlus
Via Angelo Brunetti 54 - 00186 Roma
Cell. 349/3163072
[email protected]
Banca Intesa San Paolo
Piazza di Spagna 18
00186 Roma
IBAN: IT67 E030 6903 2591 0000 0006 179
5x1000 Codice Fiscale 97355930583
Se Vi è stato di aiuto
sosteneteci a realizzarne altri!
Opuscoli pubblicati
Combattere il dolore per combattere senza il dolore
E. Arcuri
Consigli alimentari durante il trattamento oncologico
M. Antimi, A. M. Vanni
Radioterapia. Guida pratica per il paziente
U. De Paula
Quello che è importante sapere sul carcinoma del
colon-retto
G. Mustacchi, R. Ceccherini
Ipertrofia prostatica benigna: guida per il paziente
M. Lamartina, M. Rizzo, G. B. Ingargiola,
M. Pavone Macaluso
Trapianto di midollo osseo o di cellule staminali
periferiche
M. Vignetti, A. P. Iori
La dieta nel paziente con insufficienza renale cronica
B. Cianciaruso, A. Capuano, A. Nastasi
Chemioterapia... se la conosci, non la temi
T. Gamucci, S. De Marco
Sopravvivere al cancro infantile. Tutto è bene quel
che finisce bene
J. E. W. M. Van Dongen - Melman
Mieloma Multiplo
A. Nozza, A. Santoro
Neoplasie del colon-retto. Una terapia per ogni
paziente
G. Beretta, R. Labianca, A. Sobrero
Occhio... alla bocca
F. Cianfriglia, A. Lattanzi
Occhio a quel neo che cresce!
I. Stanganelli
Tumori e AIDS: prevenzione e terapia
G.D. Vultaggio, U. Tirelli
La terapia ormonale nel carcinoma mammario
Giovanna Masci, Armando Santoro
Il tumore del pancreas
Roberto Labianca, Giordano D. Beretta, Alberto Zaniboni,
Luigina Rota
I tumori dei giovani adulti - La mammella
Eugenio Cammilluzzi, Antonio Maria Alberti et al.
Perché devo smettere di fumare
Massimo Pasquini, Cora N. Sternberg
Perché proprio a me? - Come affrontare il disagio
emotivo quando si ha un tumore
Barbara Barcaccia, Teresa Gamucci
Nausea e vomito da chemioterapia: cosa fare?
Sonia Fatigoni, Mara Picciafuoco, Fausto Roila
Un aiuto al paziente con reazioni cutanee in corso
di terapia con Cetuximab
Olga Martelli, Andrea Mancuso, Samantha Marenda,
Roberto Labianca
Un gioco da ragazze - Prevenire il carcinoma della
cervice uterina con il vaccino Anti Papilloma Virus (HPV)
Rosa Giuliani, Leonardo Emberti Gialloreti,
Cora N. Sternberg
Insieme, contro il tumore del polmone
Alain Gelibter, Anna Ceribelli
L’ascite neoplastica: come, quando e perché
Giovanni Scambia, Domenica Lorusso,
Maria Claudia Masi, Antonella Pietragalla
E’ possibile stampare le Guide in formato pdf
dal sito http:///www.accmed.org/ffc
Progetto grafico, impaginazione
e illustrazioni:
© 2013 Forum Service Editore s.c. a r.l.
Via Martin Piaggio 17/6 - 16122 Genova
Finito di stampare nel mese di marzo 2013
da Pubblimax srl - Roma