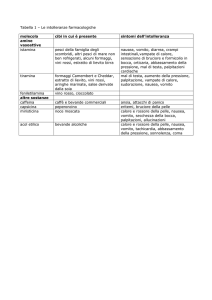
FARMACOVIGILANZA
PLASIL 10 MG COMPRESSE
PLASIL 10 MG/10 ML SCIROPPO
PLASIL 10 MG/2 ML SOLUZIONE INIETTABILE
Variazioni degli stampati relativamente agli aspetti della sicurezza
Le modifiche agli stampati sono conseguenti alla “Determinazione V&A/P/41191 (codice pratica
N1B/2014/595) del 23 aprile 2015” dell’Agenzia Italiana del Farmaco, pubblicata in G.U. Foglio
delle inserzioni n. 52 del 7 maggio 2015.
Con questa variazione l’RCP di Plasil, precedentemente unico per tutte e tre le formulazioni, viene
diviso per ogni formulazione.
Di seguito sono evidenziate soltanto le nuove variazioni introdotte nella versione attuale degli RCP in
confronto con la versione precedente.
Paragrafo
4.1 Indicazioni
terapeutiche
Plasil
RCP versione precedente
(ottobre 2014)
Plasil
RCP versione attuale
(maggio 2015)
Formulazione in compresse e sciroppo
MEDICINA GENERALE
- disturbi gastrici da medicamenti come
antimitotici, antibiotici, chemioterapici
(PAS, etionamide in particolare),
digitalici, morfina e codeina, ecc.;
- vomito
da
stati
acidosici
ed
iperazotemici;
- cefalee digestive, cefalee e disturbi
digestivi del periodo mestruale;
- disturbi digestivi psicosomatici in
soggetti ansiosi in surmenage, ecc.
GASTROENTEROLOGIA
- gastriti,
sindromi
dispepticoenterocolitiche,
coadiuvante
nelle
ulcere gastriche e duodenali;
- spasmi del piloro, disturbi da ptosi
gastrica;
- discinesie e calcolosi biliari, disturbi
digestivi nei cirrotici;
- postumi
di
colecistectomia
e
gastrectomia.
CHIRURGIA E ANESTESIOLOGIA
- nausee e vomiti da anestetici o
post-operatori.
RADIOLOGIA
- manifestazioni gastriche dei mal da
raggi e della cobaltoterapia;
- nella
esplorazione
radiologica
funzionale dell'apparato digerente.
Formulazione in compresse e sciroppo
Popolazione adulta
Plasil è indicato negli adulti per:
- Prevenzione di nausea e vomito ritardati
indotti da chemioterapia (CINV)
- Prevenzione di nausea e vomito indotti da
radioterapia (RINV)
- Trattamento sintomatico di nausea e
vomito, inclusi nausea e vomito indotti da
emicrania acuta. La metoclopramide può
essere utilizzata in associazione con
analgesici
orali
per
migliorare
l’assorbimento
degli
analgesici
nell’emicrania acuta.
Popolazione pediatrica
Plasil è indicato nei bambini di età
compresa tra 1 e 18 anni per:
- Prevenzione di nausea e vomito ritardati
indotti da chemioterapia (CINV) come
opzione di seconda linea
Formulazione iniettabile
Popolazione adulta
Plasil è indicato negli adulti per:
- Prevenzione di nausea e vomito
postoperatori (Post Operative Nausea and
Vomiting, PONV)
- Trattamento sintomatico di nausea e
vomito, inclusi nausea e vomito indotti da
emicrania acuta
- Prevenzione di nausea e vomito indotti da
1
radioterapia
(Radiotherapy
Nausea and Vomiting, RINV)
Induced
Popolazione pediatrica
Plasil è indicato nei bambini di età
compresa tra 1 e 18 anni per:
- Prevenzione di nausea e vomito ritardati
indotti da chemioterapia (Chemotherapy
Induced Nausea and Vomiting, CINV)
come opzione di seconda linea
- Trattamento di nausea e vomito
postoperatori (PONV) come opzione di
seconda linea
4.2 Posologia e
modo di
somministrazione
Formulazione in compresse e sciroppo
Adulti
Compresse: una compressa da 10 mg di
metoclopramide monocloridrato tre volte al
giorno prima dei pasti.
Sciroppo: 10 ml (10 mg di metoclopramide
monocloridrato) tre volte al giorno prima
dei pasti.
Formulazione in compresse e sciroppo
Tutte le indicazioni (pazienti adulti)
La dose singola raccomandata è di 10 mg,
ripetibile per un massimo di 3 volte al
giorno.
Non superare le dosi massime consigliate.
La dose giornaliera massima raccomandata
è di 30 mg o 0,5 mg/kg di peso corporeo.
La durata massima raccomandata del
trattamento è di 5 giorni
(---)
Prevenzione di nausea e vomito ritardati
indotti da chemioterapia (CINV)
(pazienti pediatrici di età compresa tra 1
e 18 anni)
La dose raccomandata è da 0,1 a 0,15
mg/kg di peso corporeo, ripetibile fino a tre
volte al giorno per via orale. La dose
massima in 24 ore è di 0,5 mg/kg di peso
corporeo.
Tabella di dosaggio
Età
Peso
corporeo
1-3
10-14 kg
anni
Dose
1 mg
3-5
anni
15-19 kg
2 mg
5-9
anni
20-29 kg
2,5 mg
9-18
anni
30-60 kg
5 mg
15-18
anni
Oltre 60 kg
10 mg
Frequen
za
Fino a 3
volte al
giorno
Fino a 3
volte al
giorno
Fino a 3
volte al
giorno
Fino a 3
volte al
giorno
Fino a 3
volte al
giorno
2
(---)
La siringa dosatrice per uso orale inclusa
nella confezione dello sciroppo è graduata
in mg e permette di somministrare la giusta
quantità
di
metoclopramide.
La
corrispondenza al peso corporeo è
dettagliata nella tabella di dosaggio. La
dose è ottenuta tirando lo stantuffo fino alla
corrispondente tacca in mg.
L’uso della siringa per uso orale è limitato
alla somministrazione di questo sciroppo.
La siringa dosatrice deve essere sciacquata
dopo ogni uso.
Non tenere la siringa dosatrice immersa
nella bottiglia. (solo formulazione in
sciroppo)
(---)
La durata massima del trattamento è di 5
giorni per la prevenzione di nausea e
vomito ritardati indotti da chemioterapia
(CINV)
(---)
Si consiglia la somministrazione del
farmaco alle dosi indicate, preferibilmente
prima dei pasti.
(---)
Le compresse non sono adatte all’utilizzo
nei bambini con peso inferiore a 61 kg.
Altre forme farmaceutiche/dosaggi possono
essere
più
appropriate
per
la
somministrazione in questa popolazione.
(solo formulazione in compresse)
(---)
Modo di somministrazione:
Deve essere rispettato un intervallo minimo
di 6 ore fra due somministrazioni, anche in
caso di vomito o rigetto della dose (vedere
paragrafo 4.4).
Nel trattamento di pazienti anziani la
posologia deve essere attentamente
stabilita dal medico che dovrà valutare una
eventuale
riduzione
dei
dosaggi
sopraindicati.
Popolazioni speciali
Anziani
Nei pazienti anziani, occorre considerare
una riduzione della dose in base alla
funzionalità renale e epatica e alla
suscettibilità generale.
Insufficienza renale
Vedere il paragrafo 4.4. per il trattamento In pazienti con malattia renale in fase finale
di pazienti con insufficienza epatica o (Clearance della creatinina ≤ 15 ml/min), la
renale.
dose giornaliera deve essere ridotta del
75%.
In pazienti con insufficienza renale da
moderata a grave (Clearance della
creatinina 15-60 ml/min), la dose
giornaliera deve essere ridotta del 50%
3
(vedere paragrafo 5.2).
Insufficienza epatica
In pazienti con grave insufficienza epatica,
la dose deve essere ridotta del 50% (vedere
paragrafo 5.2).
(---)
Plasil non deve essere utilizzato nei
bambini al di sotto dei 16 anni di età (v.
Controindicazioni). L’uso di PLASIL non è
raccomandato in bambini ed adolescenti di
età compresa tra 16 e 18 anni.
4.2 Posologia e
modo di
somministrazione
Altre forme farmaceutiche/dosaggi possono
essere
più
appropriati
per
la
somministrazione in queste popolazioni
specifiche.
(solo
formulazione
in
compresse)
Popolazione pediatrica
La metoclopramide è controindicata in
bambini di età inferiore a 1 anno (vedere
paragrafo 4.3).
Questa formulazione non è adatta per la
somministrazione in questa popolazione.
(solo formulazione in compresse)
Formulazione iniettabile
Formulazione iniettabile
Adulti
La somministrazione endovenosa del La soluzione può essere somministrata per
farmaco deve avvenire lentamente, nel via endovenosa o intramuscolare.
tempo di almeno tre minuti.
Le dosi endovenose devono essere
somministrate per bolo lento (almeno 3
Soluzione iniettabile: una fiala da 2 ml (10 minuti).
mg di metoclopramide monocloridrato) per
via
intramuscolare
o
endovenosa.
L'iniezione può essere ripetuta.
La fiala si apre senza limetta. A causa del
potenziale rischio di gravi reazioni
cardiovascolari incluso l’arresto cardiaco,
la somministrazione della soluzione
iniettabile deve essere effettuata solo
quando sono a disposizione idonee
attrezzature per la rianimazione (v.
paragrafo 4.8 Effetti indesiderati, Patologie
cardiache e vascolari).
(---)
eliminati
Tutte le indicazioni (pazienti adulti)
Per la prevenzione di nausea e vomito
postoperatori (PONV) si raccomanda una
dose singola di 10 mg.
Per il trattamento sintomatico di nausea e
vomito, inclusi nausea e vomito indotti da
emicrania acuta e per la prevenzione di
nausea e vomito indotti da radioterapia
(RINV): la dose singola raccomandata è di
10 mg, ripetibile per un massimo di 3 volte
al giorno
La dose massima raccomandata è di 30 mg
o 0,5 mg/kg di peso corporeo.
4
La durata del trattamento iniettabile deve
essere la più breve possibile per poi passare
alla somministrazione per via orale o rettale
il prima possibile.
(---)
Tutte le indicazioni (pazienti pediatrici di
età compresa tra 1 e 18 anni)
La dose raccomandata è da 0,1 a 0,15
mg/kg di peso corporeo, ripetibile fino a tre
volte al giorno per via endovenosa. La dose
massima in 24 ore è di 0,5 mg/kg di peso
corporeo.
Tabella di dosaggio
Età
Peso
corporeo
1-3
10- 14 kg
anni
Dose
Frequenza
1 mg
Fino a
volte
giorno
Fino a
volte
giorno
Fino a
volte
giorno
Fino a
volte
giorno
Fino a
volte
giorno
3-5
anni
15-19 kg
2 mg
5-9
anni
20-29 kg
2,5 mg
9-18
anni
30-60 kg
5 mg
15-18
anni
Oltre
kg
60 10 mg
3
al
3
al
3
al
3
al
3
al
La durata massima del trattamento è di 48
ore per il trattamento di nausea e vomito
determinati come postoperatori (PONV)
La durata massima del trattamento è di 5
giorni per la prevenzione di nausea e
vomito ritardati indotti da chemioterapia
(CINV)
Non superare le dosi massime consigliate.
Si consiglia la somministrazione
farmaco alle dosi indicate
(---)
Modo di somministrazione:
Deve essere rispettato un intervallo minimo
di 6 ore fra due somministrazioni (vedere
paragrafo 4.4).
La fiala si apre senza limetta.
del
Popolazioni speciali
Anziani
Nel trattamento di pazienti anziani la Nei pazienti anziani, occorre considerare
posologia deve essere attentamente una riduzione della dose in base alla
stabilita dal medico che dovrà valutare una
5
eventuale
riduzione
sopraindicati.
dei
dosaggi funzionalità renale e
suscettibilità generale.
epatica
e
alla
Insufficienza renale
Vedere il paragrafo 4.4. per il trattamento In pazienti con malattia renale in fase finale
di pazienti con insufficienza epatica o (Clearance della creatinina ≤ 15 ml/min), la
renale.
dose giornaliera deve essere ridotta del
75%.
In pazienti con insufficienza renale da
moderata a grave (Clearance della
creatinina 15-60 ml/min), la dose
giornaliera deve essere ridotta del 50%
(vedere paragrafo 5.2).
Insufficienza epatica
In pazienti con grave insufficienza epatica,
la dose deve essere ridotta del 50% (vedere
paragrafo 5.2).
Popolazione pediatrica
Plasil non deve essere utilizzato nei La metoclopramide è controindicata in
bambini al di sotto dei 16 anni di età (v. bambini di età inferiore a 1 anno (vedere
Controindicazioni). L’uso di PLASIL non è paragrafo 4.3).
raccomandato in bambini ed adolescenti di
età compresa tra 16 e 18 anni.
Radiologia del tratto gastrointestinale
Da una a due fiale da 2 ml (10 mg di
metoclopramide monocloridrato), 10 minuti
prima dell'inizio dell'esame, somministrate
per via i.m. o e.v.
4.3
Controindicazioni
eliminato
Pazienti affetti da feocromocitoma, malattia epilettica,
…
e
altre
affezioni
extrapiramidali conclamate o in corso di
terapia con anticolinergici.
-
Feocromocitoma
confermato
o
presunto, a causa del rischio di episodi
di grave ipertensione
Epilessia (aumento della frequenza e
dell’intensità delle crisi)
Non è consigliabile l’uso del prodotto nei soggetti che abbiano già evidenziato
discinesie tardive da farmaci.
Storia di discinesia tardiva indotta da
neurolettici o metoclopramide
Associazione con levodopa a causa di un antagonismo reciproco.
Associazione con levodopa o agonisti
dopaminergici (vedere paragrafo 4.5)
(---)
-
Storia nota di metemoglobinemia con
metoclopramide o di deficit di NADH
citocromo b5 reduttasi
Bambini al di sotto dei 16 anni.
-
Uso nei bambini al di sotto di 1 anno di
età a causa dell’aumentato rischio di
disturbi
extrapiramidali
(vedere
paragrafo 4.4)
6
Primo trimestre di gravidanza
allattamento (vedere paragrafo 4.6).
e
La metoclopramide è controindicata nei
pazienti in trattamento con farmaci
potenzialmente in grado di determinare
reazioni
extrapiramidali
(antimonoaminossidasi, neurolettici come
fenotiazine, butirrofenoni, tioxanteni, ecc.).
4.4 Avvertenze
speciali e
precauzioni
d’impiego
La somministrazione in pazienti che
soffrono di depressione deve avvenire solo
dopo aver valutato il beneficio atteso e i
rischi potenziali.
… (---)
eliminati
eliminato
Disturbi neurologici
... Queste reazioni si verificano in genere
all’inizio del trattamento e possono
verificarsi
dopo
una
singola
somministrazione. La metoclopramide deve
essere immediatamente sospesa in caso di
sintomi extrapiramidali.
Tali reazioni avverse si risolvono Questi effetti sono generalmente del tutto
completamente con la sospensione del reversibili
dopo
l’interruzione
del
trattamento.
trattamento ...
(---)
Il
trattamento
prolungato
con
metoclopramide può causare discinesia
tardiva, potenzialmente irreversibile, in
particolare negli anziani.
... (---)
... Il trattamento deve essere interrotto se
compaiono sintomi di discinesia tardiva.
Come per i neurolettici, si può verificare
una sindrome maligna da neurolettici
(NMS) caratterizzata da ipertermia,
disturbi extrapiramidali, instabilità del
sistema nervoso autonomico ed aumento
del CPK. Pertanto è necessaria cautela in
caso di comparsa di febbre, uno dei sintomi
di NMS, e metoclopramide va sospesa in
caso di sospetto di NMS.
E’ stata segnalata la sindrome neurolettica
maligna
con
metoclopramide
in
associazione ai neurolettici come anche in
monoterapia con metoclopramide (vedere
paragrafo 4.8). In caso di sintomi di
sindrome
neurolettica
maligna,
la
metoclopramide deve essere interrotta
immediatamente e deve essere istituito il
trattamento adeguato.
Metoclopramide non è consigliata nei
pazienti epilettici poiché le benzamidi
possono abbassare la soglia epilettica.
(---)
eliminato
Occorre particolare cautela in pazienti con
patologie neurologiche concomitanti e in
pazienti trattati con altri farmaci che
agiscono sul sistema nervoso centrale
(vedere paragrafo 4.3).
7
(---)
I sintomi del morbo di Parkinson possono
essere esacerbati dalla metoclopramide.
Metemoglobinemia
…metoclopramide deve essere interrotta … la metoclopramide deve essere interrotta
immediatamente e permanentemente ed immediatamente e permanentemente e
adottate appropriate misure.
devono essere adottate appropriate misure
(come il trattamento con blu di metilene).
(---)
Patologie cardiache
Sono
stati
riferiti
gravi
effetti
cardiovascolari indesiderati, inclusi casi di
collasso circolatorio, grave bradicardia,
arresto
cardiaco
e
prolungamento
dell’intervallo
QT
a
seguito
di
somministrazione
di
metoclopramide
iniettabile, in particolare per via
endovenosa (vedere paragrafo 4.8).
(---)
Si deve prestare particolare cautela nella
somministrazione di metoclopramide, in
particolare per via endovenosa agli anziani,
a pazienti con disturbi della conduzione
cardiaca (compreso il prolungamento
dell’intervallo QT), a pazienti con
squilibrio elettrolitico non corretto,
bradicardia e a pazienti che assumono altri
farmaci noti per prolungare l’intervallo QT.
Le dosi endovenose devono essere
somministrate in bolo lento (almeno della
durata di 3 minuti) al fine di ridurre il
rischio di effetti avversi (p. es., ipotensione,
acatisia).
Particolare cautela deve essere adottata nel
trattamento di pazienti con insufficienza
epatica o renale, nei quali la
metabolizzazione e l'eliminazione della
metoclopramide può essere sostanzialmente
compromessa. In tali pazienti si
raccomanda una riduzione del dosaggio.
L’uso di PLASIL non è raccomandato in
bambini ed adolescenti di età compresa tra
16 e 18 anni.
4.5 Interazioni
con altri
medicinali ed
altre forme di
interazione
Insufficienza renale e epatica
Nei pazienti con insufficienza renale o con
grave insufficienza epatica, si raccomanda
una riduzione del dosaggio (vedere
paragrafo 4.2).
eliminato
Associazioni controindicate
Associazioni controindicate
Levodopa: levodopa e metoclopramide si Levodopa o agonisti dopaminergici e
antagonizzano vicendevolmente.
metoclopramide
si
antagonizzano
vicendevolmente (vedere paragrafo 4.3).
8
Associazioni da tenere in considerazione:
Associazioni da tenere in considerazione
Farmaci deprimenti il SNC (derivati della Farmaci deprimenti il sistema nervoso
morfina, ipnoinducenti, ansiolitici, …):
centrale
(derivati
della
morfina,
ansiolitici, …)
Gli effetti sedativi dei farmaci deprimenti il Gli effetti sedativi dei farmaci deprimenti il
SNC e della metoclopramide risultano sistema nervoso centrale e della
potenziati.
metoclopramide risultano potenziati.
Neurolettici:
Metoclopramide potrebbe avere un effetto
additivo con i neurolettici (fenotiazine,
butirrofenoni, tioxanteni ecc.) per quanto
riguarda i disturbi extrapiramidali.
Neurolettici
La metoclopramide potrebbe avere un
effetto additivo con altri neurolettici nel
caso di disordini extrapiramidali.
(---)
Farmaci serotoninergici
L’utilizzo di metoclopramide con farmaci
serotoninergici come gli SSRI può
aumentare il rischio di sindrome
serotoninergica.
Ciclosporina: Metoclopramide aumenta la
biodisponibilità della ciclosporina. E’
necessario un attento monitoraggio delle
concentrazioni plasmatiche di ciclosporina.
(---)
4.6 Fertilità,
gravidanza e
allattamento
L'uso del prodotto nel primo trimestre di
gravidanza è controindicato. Per quanto
riguarda
l'impiego
del
prodotto
nell’ulteriore periodo, si tenga presente che
prodotti antiemetici in genere devono
essere somministrati in gravidanza soltanto
nei casi di sintomatologia conclamata, per
la quale non sia possibile un intervento
alternativo e non nei frequenti e semplici
casi di emesi gravidica e tanto meno con
fini preventivi di essa.
Ciclosporina
La
metoclopramide
aumenta
la
biodisponibilità della ciclosporina (Cmax
del 46% ed esposizione del 22%). È
necessario un attento monitoraggio delle
concentrazioni plasmatiche di ciclosporina.
Le conseguenze cliniche sono incerte.
Forti inibitori del CYP2D6
I
livelli
di
esposizione
della
metoclopramide
aumentano,
quando
somministrata in concomitanza a forti
inibitori del CYP2D6 come fluoxetina e
paroxetina. Benché la significatività clinica
sia incerta, i pazienti dovrebbero essere
monitorati per reazioni avverse.
Gravidanza
Una vasta quantità di dati su donne in
gravidanza (più di 1.000 esiti di
esposizione) indica assenza di tossicità
malformativa
e
fetotossicità.
Se
clinicamente necessario, la metoclopramide
può essere utilizzata durante la gravidanza.
A causa delle proprietà farmacologiche
(come per altri neurolettici), in caso di
somministrazione di metoclopramide alla
fine della gravidanza, non si può escludere
la sindrome extrapiramidale nel neonato. La
metoclopramide dovrebbe essere evitata
alla fine della gravidanza. Se si utilizza la
metoclopramide, si deve istituire un
monitoraggio neonatale.
9
La metoclopramide è escreta nel latte
materno, quindi non deve essere
somministrata durante l'allattamento. In
alternativa,
ricorrere
all'allattamento
artificiale.
Allattamento
La metoclopramide è escreta nel latte
materno a bassi livelli. Non si possono
escludere reazioni avverse nel bambino
allattato
al
seno.
Pertanto
la
metoclopramide non è raccomandata
durante l’allattamento al seno. Si deve
prendere in considerazione l’interruzione
della metoclopramide nelle donne che
allattano al seno.
4.7 Effetti sulla
capacità di
guidare veicoli e
sull’uso di
macchinari
In alcuni soggetti la metoclopramide
compromette la capacità di guidare veicoli
o di usare macchinari poiché può
determinare riduzione dell'attenzione con
sonnolenza durante la guida.
4.8 Effetti
collaterali
Patologie del sistema nervoso e disturbi Patologie del sistema nervoso
…
psichiatrici
…
Altre reazioni che possono verificarsi:
convulsioni;
Raro: Convulsioni in particolare in pazienti
epilettici
discinesia tardiva, durante o dopo …; Non nota: Discinesia tardiva che può essere
persistente, durante o dopo …
Patologie endocrine
Durante trattamenti prolungati, …
Patologie sistemiche e condizioni relative
alla sede di somministrazione
reazioni
allergiche,
compresa
anafilassi
La
metoclopramide
può
causare
sonnolenza, capogiri, discinesia e distonie
che possono alterare la visione e interferire
anche con la capacità di guidare veicoli e
utilizzare macchinari.
eliminato il solo riferimento a
terapie prolungate
Disturbi del sistema immunitario
Non comune: Ipersensibilità
Non nota: Reazione anafilattica (incluso
shock anafilattico in particolare con la
formulazione endovenosa)
Patologie cardiache e vascolari
bradicardia
Patologie cardiache
Non comune: Bradicardia, in particolare
con la formulazione endovenosa
blocco cardiaco particolarmente con Non nota: blocco atrioventricolare, arresto
la somministrazione endovenosa
sinusale in particolare con la formulazione
endovenosa; prolungamento dell’intervallo
QT dell’elettrocardiogramma; torsade de
pointes;
(---)
Patologie vascolari
Non nota: Shock, sincope dopo la
somministrazione per via iniettabile,
ipertensione acuta nei pazienti con
feocromocitoma (vedere paragrafo 4.3)
(---)
Patologie gastrointestinali
Comune: Diarrea
10
4.9 Sovradosaggio
Segni e sintomi
Sintomi
Si
possono
verificare
disturbi Possono verificarsi sintomi extrapiramidali,
extrapiramidali … ed allucinazioni.
…,
allucinazioni
e
arresto
cardiorespiratorio.
Trattamento
Gestione
Il trattamento dei disturbi extrapiramidali è In caso di sintomi extrapiramidali correlati
solamente sintomatico (…).
o non a sovradosaggio, il trattamento è
solamente sintomatico (…).
(---)
Un trattamento sintomatico e un continuo
monitoraggio
delle
funzionalità
cardiovascolare e respiratoria deve essere
praticato in base allo stato clinico.
11