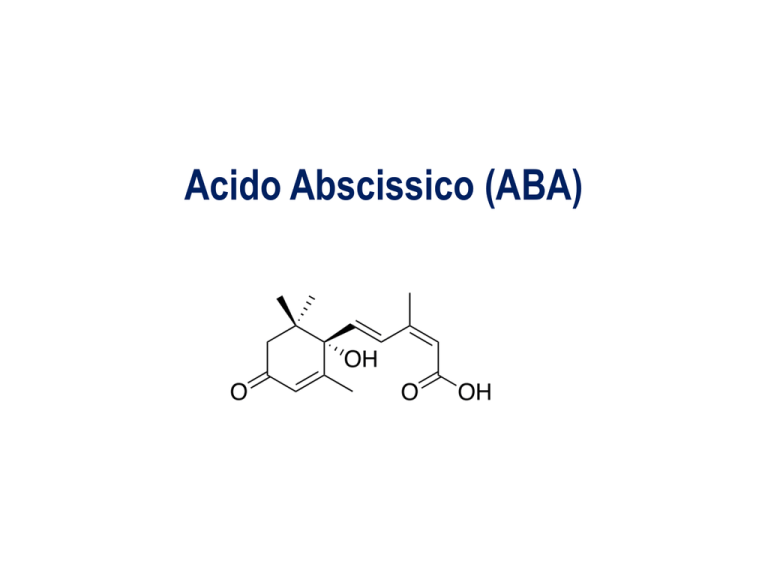
Acido Abscissico (ABA)
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
Qualità del seme
Dormienza
Germinazione
ABA controlla molti processi
fisiologici nelle piante.
Sviluppo
Acido Abscissico
Espressione genica
Risposte a
stress biotici
Apertura stomatica
Tolleranza agli stress
Struttura e biosintesi di ABA
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
Struttura di ABA
L’orientamento del gruppo –COOH sul C-2 di ABA origina gli isomeri cis e trans. ABA possiede inoltre un
C asimmetrico in posizione 1’ dell’anello originando gli enantiomeri S (+) e R (-); in natura è presente solo
la forma (S)-cis cerchiata in rosso.
Biosintesi di ABA
ABA è un sesquiterpenoide. È sintetizzato nei cloroplasti delle foglie a partire dal carotenoide
zeaxantina.
Zeaxantina
ABA
Zeaxantina è abbondante
nei tessuti verdi, mentre
può essere limitante per la
sintesi radicale di ABA
(amiloplasti).
La zeaxantina epossidasi (ZEP) converte la
zeaxantina a violaxantina
ABA2
Piante mutate di tabacco a livello del gene codificante per ZEP mancano di
ABA e perdono rapidamente acqua
Tabacco WT
Mutante aba2
Stomi chiusi
Stomi aperti
Contenuto idrico fogliare
I 9-cis-epossicarotenoidi sono scissi in xantossina dall’enzima NCED
NCED = 9-cisepossicarotenoide
diossigenasi
xantossina
ABA2
Il gene codificante NCED fu identificato per la prima volta
nel mutante vp14 di mais
Il mutante vp14 perde rapidamente acqua dalle foglie ed è viviparo, ossia mostra precoce germinazione
dei semi sulla pannocchia in fase di maturazione (vedi figura).
Le foglie del mutante vp14 perdevano
aqua più rapidamente del wild-type a
causa dei ridotti livelli di ABA.
vp14
Wild-type
seme
viviparo
I geni NCED sono indotti dalla siccità e durante la maturazione dei semi
NCED agisce sulla faccia stromatica dei tilacoidi dove sono localizzati i carotenoidi. La xantossina diffonde dal
cloroplasto nel citoplasma.
L’aumento nell’espressione di NCED è
correlato strettamente con l’aumento
dei livelli di ABA
L’aumento nei livelli di
mRNA è rivelato entro
30 minuti dal distacco
della foglia dalla pianta
di Phaseolus vulgaris.
Durante la maturazione dei
semi di tabacco
l’espressione dei geni NCED
aumenta e successivamente
diminuisce.
Giorni dopo l’impollinazione
La conversione della xantossina ad ABA richiede l’intervento di due enzimi
La xantossina è convertita dall’enzima SDR (Short-chain Dehydrogenase/Reductase) in aldeide abscssica. L’enzima
SDR è codificato dal gene ABA2 in Arabidopsis. L’aldeide è ossidata ad ABA da una specifica ossidasi (AAO = ABA
Aldheyde Oxydase). Le foglie di alcuni mutanti incapaci di produre il cofattore Mo appassiscono.
WT
SDR
Il mutante aao3 mostra
appassimento
aba2
WT
Il mutante aba2 germina in
condizioni non idonee (NaCl).
MS = terreno di cultura Murashige e Skoog
aao3
Catabolismo di ABA
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
I livelli di ABA aumentano drammaticamente a seguito di stress idrico
I livelli di ABA sono controllati tramite la biosintesi (regolazione tessuto- e segnale-specifica degli enzimi) e dai
metabolismi di inattivazione. La biosintesi di ABA oltre che dipendere da processi di sviluppo (semi in maturazione) è
fortemente influenzata da condizioni di stress idrico. In queste situazioni la concentrazione di ABA può aumentare fino a
50 volte in poche ore. Il distacco della foglia dalla pianta simula lo stress idrico, mentre la reidratazione simula il ritorno
alla normalità caratterizzato dal declino dei livelli di ABA.
ABA si accumula
Reidratazione
La foglia è distaccata
dalla pianta e lasciata
a TA per circa 24 ore.
La foglia è reidratata per
immersione in acqua.
ABA
Vie di inattivazione irreversibile e reversibile di ABA
L’ABA è idrossilato da monoossigenasi ad 8’-idrossi ABA, acido faseico e acido 4’-diidrofaseico; questa inattivazione è
irreversibile. L’ABA può essere coniugato con glucosio da glucosil transferasi; il glucoside può essere scisso da –
glucosidasi.
Inattivazione irreversibile
(8’-idrossilasi )
Reidratazione
Segnali di sviluppo
[ABA]
Inattivazione reversibile
L’ABA è inattivato dalla 8’-idrossilasi, codificata dal gene CYP707A
I geni CYP707A codificano per l’enzima 8’-idrossilasi che inattiva irreversibilmente l’ABA. Tali geni sono sovraespressi a
seguito del trasferimento di una plantula di Arabidopsis da una condizione di stress idrico (bassa umidità) ad una
condizione di alta umidità. Il gene CYP707A1 è sovraespresso nelle cellule di guardia dell’epidermide fogliare, mentre il
gene CYP707A3 è sovraespresso in altri tessuti della foglia, indicando ruoli diversi nel catabolismo di ABA.
Bassa umidità (UR 60%)
(stress idrico)
Alta umidità (UR 90%)
(condizioni ambientali ottimali)
Plantule transgeniche
di Arabidopsis
contenenti il gene
reporter GUS fuso col
promotore di
CYP707A.
L’inatttivazione irreversibile di ABA è necessaria alla germinazione dei semi
La perdita di funzione di uno dei
geni CYP707A riduce la capacità
germinativa, espressa come % di
emergenza della radichetta. La
perdita di funzione di due geni
CYP707A abolisce quasi del
tutto la capacità germinativa.
Wild type
Mutante singolo
Mutante doppio
L’inattivazione reversibile di ABA per glicosilazione
attivo biologicamente
(poco polare)
β-glucosidasi
ABA glucosiltransferasi
Inattivo biologicamente
(maggiormente polare e
trasportabile)
ABA-glucosil estere (ABA-GE) è una forma inattiva di conservazione e di trasporto
ABA-GE è una forma inattiva, più polare e più facilmente trasportabile sia attraverso lo xilema (ABA radicale) che il
floema (ABA fogliare). In alternativa, è conservato nel vacuolo.
Accumulo di ABA e omeostasi
Sono processi strettamente controllati da fattori ambientali e dallo sviluppo
NCED
9-cisepossicarotenoidi
xantossina
ABA
Stress idrico
Segnali di sviluppo (dormienza)
Reidratazione
Segnali di sviluppo
(germinazione)
I movimenti di ABA tra organi e cellule
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
L’ABA sintetizzato in radici sottoposte a siccità è trasportato alle foglie via xilema
Pianta ben idratata
con stomi aperti ed
elevata velocità di
traspirazione.
Pianta soggetta a
stress idrico con stomi
chiusi e bassa velocità
di traspirazione.
Nelle piante sottoposte a stress idrico a livello radicale la concentrazione di
ABA xilematico trasportato dalle radici alle foglie è più elevata (fino a 3000
volte, in dipendenza della specie).
A seguito dello stress idrico l’ABA si accumula nelle venature fogliari e nelle
cellule di guardia
Le plantule trasformate di Arabidopsis erano sottoposte a stress idrico per via radicale registrando ai vari tempi
l’emissione di luce dovuta alla luciferasi. I geni indotti da ABA iniziavano ad essere espressi dopo 2 ore nello xilema
dell’ipocotile, dopo 4 ore nello xilema dei cotiledoni e dopo 6 ore in tutta la superficie dei cotiledoni stomi inclusi.
Un reporter realizzato con un promotore
inducibile da ABA fuso con la luciferasi,
era usato per visualizzare i livelli di ABA.
Immagine dell’attività
luciferasica.
Immagine dell’attività
luciferasica, fusa con
un’immagine in campo
chiaro.
ABA è un acido debole ed esiste in forma dissociata (ABA-) e non dissociata
Apoplasto, pH 5.5
Citoplasma , pH 7
Nel citoplasma delle cellule (pH 7) l’ABA è
presente sotto forma dissociata o carica
(anione ABA-).
ABA-
ABA- + H+
ABAH
Nello
spazio
infraparete
(apoplasto),
caratterizzato da pH acido (5,5), l’ABA è
presente sotto forma non dissociata (ABAH). I
movimenti di ABA dipendono soprattutto dalla
forma in cui si trova l’ormone.
ABAH
ABA- + H+
Lo stress idrico favorisce la dissociazione dell’ABAH
Lo stress idrico porta ad alcalinizzazione del
pH del succo xilematico (a circa pH 7)
favorendo la formazione della forma dissociata
nell’apoplasto e quindi impedendo l’entrata
dell’ormone nella cellula.
Il movimento di ABA- attraverso la membrana dipende da specifici trasportatori
Il genoma di Arabidopsis contiene geni codificanti per i trasportatori appartenenti alla famiglia ABC (ATP-binding
cassette). Nell’ambito della famiglia ABC è stata individuata una sottofamiglia denominata AtABCG, implicata in vari
processi di trasporto, anche se la funzione di molti trasportatori appartenenti a tale sottofamiglia resta ignota. È stato
dimostrato che il gene AtABCG25, codifica per un trasportatore di ABA localizzato nel plasmalemma delle cellule di
Arabidopsis.
ABA-
Il gene AtABCG25,
espresso nelle venature
fogliari di plantule di
Arabidopsis, codifica per
un trasportatore (out) di
ABA.
Pattern di espressione di AtABCG25pro::GUS
Control
10 μM ABA
Il gene AtABCG25 è
indotto da ABA.
In foglie di piante transgeniche di Arabidopsis che sovraesprimono il gene AtABCG25 la perdita
di acqua conseguente al distacco, è ritardata.
AtABCG40 è un trasportatore di ABA espresso nelle cellule di guardia
Nel mutante con perdita di
funzione abcg40 le cellule di
guardia sono meno sensibili
all’ABA. Il mutante risulta così
più suscettibile alla siccità.
ABA-induced
stomatal closure
Percezione e signaling di ABA
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
I recettori PYR/PYL/RCAR
I recettori PYR1 sono stati scoperti durante uno screening genetico/chimico effettuato su semi di
Arabidopsis per composti con effetto simile all’ABA tra cui l’agonista denominato pirabactina (PYR). Ciò
permise l’identificazione del gene PYR1 e venne dimostrato che la proteina da esso codificata lega
specificamente ABA.
PYR1
Studi su mutanti 2x, 3x e 4x di Arabidopsis hanno dimostrato l’esistenza di una famiglia di recettori PYR indicata con
l’acronimo PYL (PYR1-Like). E’ stato successivamente dimostrato che il recettore PYR1, a seguito del legame con ABA,
è in grado di interagire con una fosfatasi (PP2C). La porzione che interagisce con PP2C è stata denominata RCAR
(Regulatory Componentes of ABA Receptors). Per questo motivo il recettore è stato ridenominato PYR/PYL/RCAR o più
semplicemente PYR/RCAR.
Semi di piante wild-type di
Arabidopsis
sonowild-type
incapacidi
Semi di piante
di germinaresono
su mezzo
Arabidopsis
incapaci
ABA.
dicontenente
germinare su
mezzo
contenente ABA.
Il mutante abi1 (ABAinsensitive)
germina
su mezzo
Il mutante
abi1 (ABAcontenente
Il gene
insensitive)ABA.
germina
su ABI1
mezzo
codifica
per laABA.
fosfatasi
PP2C.
contenente
Il gene
ABI1
codifica per la fosfatasi PP2C.
I mutanti insensibili alla
pirabactina
sono anche
I mutanti insensibili
allainsensibili
all’ABA
e possono
così insensibili
pirabactina
sono anche
germinare
su
mezzo
contenente
all’ABA e possono così
l’ormone.
germinare su mezzo contenente
l’ormone.
Il ruolo di PP2C
PYR1
Recettori PYR/RCAR
Inibizione della fosfatasi
(in assenza di ABA la fosfatasi è attiva)
ABA
Fosfatasi
Fosfatasi PP2C
Lo studio dei mutanti abi ha mostrato che la mutazione rende i semi non dormienti e causa appassimento nella pianta.
Pertanto tale mutazione diminuisce la sensibilità all’ABA, suggerendo che la fosfatasi PP2C abbia un ruolo inibitorio nel
signaling di ABA. Piante di Arabidopsis sovraesprimenti i geni ABI hanno una ridotta della sensibilità all’ABA,
PYR1
confermando il ruolo inibitorio di PP2C. I recettori PYR/RCAR, Recettori
a seguitoPYR/RCAR
del legame con ABA, interagiscono con PP2C
inibendone l’attività enzimatica. QualiABA
sono i bersagli di PP2C?
Inibizione della fosfatasi
Fosfatasi
PP2CPP2C
Le proteina chinasiFosfatasi
SnRK2 sono i bersagli
delle
P
Le chinasi SnRK2 (Sucrose Non-fermenting
Related Kinase2) agiscono come regolatori
positivi nella via di signaling di ABA causando la
fosforilazione di fattori di trascrizione (TF) che in
questo modo si attivano e vanno ad indurre
l’espressione dei geni regolati da ABA.
SnRK2 è attiva in
presenza di ABA
TF
P
P
Ion
channel
Proteina chinasi (SnRK2)
Chinasi
SnRK2
TF
P
Risposte ad ABA
In assenza di ABA PP2C defosforila
SnRK2 inativandola; in presenza di
ABA, PP2C è inattiva
I recettori CHLH
I recettori CHLH sono localizzati nei plastidi. E’ tuttora sconosciuto il loro meccanismo di azione.
Potrebbero essere implicati nel trasporto di ABA all’interno del plastidio. Tuttavia tale proteina sembra
possedere domini con più funzioni in quanto controlla anche la sintesi della clorofilla e regola la
complessa via del segnale tra nucleo e plastidi.
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
I recettori GTG
Si tratta di proteine GPCR (G protein-coupled receptor) localizzate sul plasmalemma. L’ABA,
combinandosi al dominio localizzato al di fuori della cellula, determina un cambiamento conformazionale
del dominio interno e quindi della proteina G. Quest’ultima funziona come un interruttore che
potenzialmente attiva una serie di metabolismi intracellulari.
Esistono tuttavia alcuni dati contrastanti circa la loro funzione di recettori per ABA.
ABA
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
Un modello delle interazioni di ABA con i tre tipi di possibili recettori
Tutti questi tipi di recettori sembrano coinvolti nel meccanismo di chiusura stomatica ABA indotto e nei relativi flussi
ionici (indicati in figura per semplicità con A- channel). Tuttavia le interazioni nella via di segnale a monte dei recettori
restano ancora oscure.
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
Molti messaggeri secondari
partecipano al signaling di ABA
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
L’ABA controlla l’apertura stomatica causando la riduzione del volume delle
cellule di guardia
Quando gli stomi sono aperti, le piante perdono acqua per traspirazione.
L’ABA prodotto durante lo stress idrico causa la chiusura delle cellule di
guardia ed impedisce la loro riapertura conservando l’acqua nella pianta.
ABA
Rima stomatica
PARETE CELLULARE
L’ABA causa l’espulsione
di anioni e di potassio
dalle cellule di guardia
K+
AK+
H2O
H2O
K+
A-
K+
H2O
K+
ABA
A-
A-
K+
K+
A-
APERTO
A-
L’ABA causa l’apertura di canali ionici sul
plasmalemma e sul tonoplasto, il rilascio di ioni
fuori dalla cellula e la inattivazione della pompa
protonica (in rosso).
A-
K+
H2O
H2O
H2O
K+
A-
K+
H2O
H2O
H2O
K+
K+
APERTO
K+
H2O
Dopo il rilascio degli ioni
dalla cellula indotto da
ABA
K+ K+
H2O
K+
H2O
A-
L’acqua segue il
movimento degli
ioni per osmosi
H2O
H2O
ABA
ABA
ABA
La chiusura dello stoma
indotta da ABA
A-
K+
K+
A- A-
A-
H2O
H2O
K+
K+
K+
A-
K+
K+
H2O
AH2O
AH
O
2
La pompa protonica è riattivata generando
H2O
Lo ione potassio
un gradiente di
e iperpolarizzazione
e gli anioni sono
H2protoni
O
+
H2O K+ riassorbiti.
della membrana
plasmatica.
K
K+
A
+
H
+
K+
K+ H
K+
A-
A-
CHIUSO
HO
CHIUSO
CHIUSO
K+
K + A+
H
Il volume delle cellule di guardia si riduce eHla+ rima stomatica
si chiude.
2
H2O
ABA
ABA
Quando
inattivato
l’ABA
La pompa protonica è riattivata generando
Lo ione potassio
gradiente
di protoni
e iperpolarizzazione
Laun
pompa
protonica
è riattivata
generando
e gli anioni sono
Lo ione potassio
membrana
plasmatica.
undella
gradiente
di protoni
e iperpolarizzazione
riassorbiti.
e gli anioni
sono
della membrana plasmatica.
H+
riassorbiti. H+
viene
H+
ABA
CHIUSO
CHIUSO
H+
K+
H+ K +
+
H
K+
A-
H+
K+
K+H+A-
K+
A-
H+
Il movimento dell’acqua
durante l’apertura
K + A-
K+
A-
A-
K+
H+
H2O
K+
H+
H2O
K+
H+
H2O
A-
L’acqua segue gli
ioni per osmosi.
Rima stomatica
K+
A-
K+
H2O
La riapertura dello stoma
H2O
A-
K+
A-
K+
H2O
APERTO
K+
Il volume delle cellule di
guardia aumenta e lo stoma
si apre.
K+
A-
H2O
K+
A-
A-
K+
H2O
K+
A-
H2O
A-
K+
H2O
H2O
H2O
Le cellule di guardia rispondono all’ABA con l’aumento del Ca2+ nel citosol
[Ca2+]cyt (nM)
ABA
calcio
No ABA control
Apertura
stomatica
Aperto ------------------------------------------Chiuso
Livelli di calcio citoplasmatico all’interno delle cellule di guardia
mediante immagini a fluorescenza (rosso = aumento della
concentrazione di calcio).
ABA
PARETE CELLULARE
Come fa l’ABA a stimolare
l’aumento nel [Ca2+]cyt?
APERTO
I livelli di calcio citosolico [Ca2+]cyt dipendono
dall’entrata dello ione attraverso il plasmalemma
e dal rilascio dello ione dal vacuolo.
L’ABA stimola l’aumento dei livelli di calcio
citoplasmatico attivando i canali del calcio sia
sul plasmalemma che sul tonoplasto.
Ca2+
APERTO
L’aumento della [Ca2+]cyt aiuta a
coordinare l’azione di parecchi
canali ionici
Il calcio attiva i canali ionici, forse
attraverso specifiche protein chinasi
dipendenti dal calcio (CDPKs =
Calcium-Dependent Protein
Kinases).
Ca2+
K+
AEntrata
K+
Pompa
protonica
Uscita
K+
Le CDPKs contribuiscono ai movimenti del calcio nelle cellule di guardia
La chiusura stomatica indotta da
ABA è bloccata nei mutanti cpk.
Le correnti dei canali anionici
sono ridotte nei mutanti cpk.
L’attività dei canali per gli anioni
è ridotta nei mutanti cpk3-1 cpk61 rispetto al wild-type.
CDPKs = Calcium-Dependent Protein Kinases
La depolarizzazione del plasmalemma e l’aumento del pH
causano il movimento in uscita dei K+
ABA
PARETE CELLULARE
APERTO
Il movimento degli anioni fuori dalla cellula causa la depolarizzazione
del plasmalemma. L’ABA causa inoltre l’aumento di pH del citosol.
La depolarizzazione del plasmalemma e l’aumento di pH del citosol
determinano l’attivazione dei canali in uscita del potassio che sono
sensibili a variazioni di voltaggio e di pH.
K+
A-
K+
K+
Anche ROS e ossido nitrico contribuiscono all’aumento del [Ca2+]cyt
ABA
PARETE CELLULARE
NO
APERTO
H2 O 2
Ca2+
ABA
Riepilogo della chiusura stomatica ABA indotta
ClA- channel
K+in channel
K+
H2O
L’ABA scatena l’aumento degli ioni Ca2+ nel citosol,
con conseguente attivazione dei canali degli anioni
che consentono al Cl- di lasciare la cellula. L’ABA
attiva i canali in uscita del potassio (K+out) dalla
cellula mentre inibisce i canali in entrata del potassio
(K+in) nella cellula. Il risultato netto è un grande
movimento di ioni fuori dalla cellula.
Come gli ioni lasciano le cellule di guardia, l’acqua
fuoriesce per osmosi determinando la loro riduzione
di volume e la chiusura della rima stomatica.
L’ABA stimola il metabolismo dei lipidi di membrana
In analogia con quanto accade nelle cellule animali l’ABA stimolerebbe l’attivazione delle proteine G
attraverso i recettori GTG; queste attiverebbero fosfolipasi C di membrana producendo inositolo
trifosfato e diacilglicerolo. Questi composti agirebbero come messaggeri secondari nel signaling di
ABA. Studi in Arabidopsis con DNA antisenso per bloccare l’espressione delle fosfolipasi C hanno
dimostrato che l’attività di questo enzima è essenziale per consentire la risposta di ABA.
Abscissic acid
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
Sommario del controllo di ABA sul turgore delle cellule di guardia
Il turgore delle cellule di guardia è regolato da una complessa rete di interazioni: messaggeri secondari, pH,
potenziale di membrana, fosforilazione di proteine, attività di canali ionici ed altro!!
ABA
PARETE CELLULARE
NO
InsP3
DAG
H2 O 2
PP2C
Ca2+
CDPK
K+
K+
A-
K+
K+
SnRK2
L’ABA regola l’espressione genica
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
A valle dei processi di trasduzione del segnale, l’ABA regola
l’espressione genica
Geni coinvolti nel
signaling
L’ABA regola l’espressione di
numerosi geni durante la maturazione
e l’acclimatazione delle piante allo
stress (idrico, salino e da basse
temperature). Circa il 10% del
genoma di Arabidopsis è regolato da
ABA e da vari stress e tale
regolazione genica contribuisce ad un
miglior adattamento delle piante
all’ambiente.
Geni specifici della
maturazione del seme
Geni indotti da
disidratazione e stress
Geni coinvolti nel
metabolismo di ABA
I fattori di trascrizione sono i bersagli principali di CDPKs e SnRK2s
ABA
PYR1
PP2C
SnRK2
P
SnRK2
CDPK
Risposte ad ABA
P
TF
In alcuni processi è stato possibile
dimostrare la stimolazione diretta
della trascrizione da parte di ABA
mediata da fattori di trascrizione.
Sono state caratterizzate quattro
classi principali di sequenze
regolatrici collegate all’induzione
genica da parte di ABA e le proteine
che si legano a tali sequenze:
1.
2.
3.
4.
bZIP (leucina zipper)
B3
MYB
famiglie MYB
Molti TFs regolati da ABA sono regioni basiche del tipo leucina Zipper (bZIP)
La sequenza del DNA promotore a cui si legano i bZIP è denominata ABRE (ABA-Responsive Element).
Regione basica che Leucina Zipper
si lega al DNA
(Dimerizzazione)
Una proteina bZIP
legante il DNA
I geni ortologhi Vp1 e ABI3 codificano specifici TFs
Il mutante vp1 di mais è viviparo; i mutanti abi3, 4 e 5 di Arabidopsis sono insensibili all’ABA.
abi
Questi fattori di trascrizione sono altamente espressi nei
semi e si legano alla sequenza (CATGCA(TG)) che è
largamente presente nei promotori dei geni espressi dai
semi di mais e Arabidopsis.
vp1
Vp1 = Viviparous1; ABI = ABA Insensitive
Modello di regolazione dell’espressione genica da parte di ABA
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
Effetti dell’ABA sulla fisiologia e sullo
sviluppo
www.plantcell.org/cgi/doi/10.1105/tpc.110.tt1210
L’ABA controlla la maturazione dei semi, la dormienza e la disidratatazione
La dormienza dei semi
e la tolleranza alla
disidratazione
sono
correlate con elevati
livelli di sintesi e di
accumulo di ABA.
La germinazione
coinvolge invece il
catabolismo di ABA e la
sintesi di GA.
GA
ABA
germinazione
maturazione
seme
Formazione
dell’embrione
plantula
Accumulo delle
riserve
Mobilizzazione
delle riserve
Tolleranza alla
disidratazione
Distensione
cellulare
Dal seme alla plantula
Variazione del contenuto di ABA e delle riserve durante l’embriogenesi
Giorni dopo la fioritura
Stadi I, II, III
Embriogenesi
Stadio IV
Stadio V
Sviluppo del seme
Dormienza
Diminuzione
sintesi di RNA e
proteine
Accumulo di proteine di riserva
Accumulo di lipidi
_Accumulo
_ _ ______________
___
di ABA
Differenziazione
dell’asse
embrionale e dei
cotiledoni
Divisione cellulare
Duplicazione del DNA
Distensione cellulare
Giorni dopo la fioritura
Disidratazione
La viviparità nelle piante è spesso dannosa, ma diviene necessaria in alcune situazioni
La viviparità consiste nella germinazione dei semi sulla pianta. Tale comportamento può riscontrarsi in natura nei
cereali in fase di pre-raccolta, in concomitanza con condizioni climatiche favorevoli soprattutto in termini di umidità. Un
caso singolare è quello delle mangrovie in cui il seme germina sul frutto ancora attaccato alla pianta.
Viviparità nella
mangrovia con
produzione di una
plantula con radici
e foglie preformate
(propagulo)
Viviparità in spighe di grano WT. La spiga B mostra uno stadio
molto avanzato di viviparità indotto in laboratorio. Il fenomeno in
campo è meno manifesto, come mostrato dalla spiga C (freccia).
Le due spighe non vivipare in A sono mostrate come termine di
paragone.
L’ABA inibisce la viviparità e favorisce la tolleranza alla disidratazione
Semi mutanti nella sintesi di ABA o nel signaling (ABA insensitive) dell’ormone non sono tolleranti alla
disidratazione e mostrano viviparità.
Mutante vp1 di Zea mays
Triplo mutante SnRK2 (snrk2.2, 2,3,
2.6) di Arabidopsis
siliqua
Vp1 = Viviparous1
(mutante insensibile all’ABA)
L’ABA controlla la chiusura degli stomi in risposta allo stress idrico
Le cellule di guardia degli stomi rappresentano la via d’ingresso della CO2 e di uscita dell’H2O. Le cellule
di guardia rispondono all’ABA secondo il meccanismo prima descritto.
C
CO2
Lo stress idrico promuove la crescita della radice a spese
della crescita del fusto
Plantule di mais erano trapiantate su un mezzo (vermiculite) contenente diverse quantità di acqua in
modo da simulare uno stress idrico. Si nota che aumentando lo stress idrico la radice si accresceva
maggiormente mentre la crescita del fusto era completamente inibita.
Aumentando lo stress idrico
L’ABA promuove la crescita radicale e sopprime la ramificazione
Lo stress idrico
sopprime la
crescita di radici
laterali, mentre la
crescita della
radice primaria è
mantenuta.
Le radici laterali
riprendono a
crescere dopo
innaffiatura.
L’ABA è necessario per la crescita della radice primaria
in condizioni di stress idrico
In condizioni di stress idrico la crescita radicale del
mutante di mais vp5 (deficiente in ABA) era
fortemente compromessa.
Ben innaffiate
Sottoposte a stress idrico
Fluridone (FLU), un inibitore della sintesi di
ABA, interferisce con la crescita radicale in
condizioni di stress idrico.
Alcune piante possono tollerare la disidratazione estrema
Controllo ben innaffiato
Poche piante come le
“resurrection plants” qui
raffigurate possono vivere a
seguito di perdite del 90% del
loro contenuto idrico.
Mancanza di acqua per 5 giorni
Innaffiata
Craterostigma
plantagineum
Dicotiledone
Sud Africa
Gli studi sulla tolleranza alla
disidratazione delle piante possono
contribuire alle nostre conoscenze
delle risposte cellulari alla
disidratazione.
Innaffiata
Selaginella tamariscina
Pteridofite
Asia
L’ABA induce l’espressione di geni che proteggono le cellule
dai danni da siccità
Osmoprotettori
(zuccheri, prolina,
glicina, betaina)
Difesa da stress
ossidativo – perossidasi,
superossido dismutasi
Funzioni di chaperone
(HSPs, LEA s)
Movimenti di acqua
ed ioni (aquaporine,
canali ionici)
L’ABA promuove la senescenza fogliare in modo indipendente dall’etilene
Sebbene ABA sia stato isolato per la prima volta da foglie in abscissione e collegato con tale processo,
fu dimostrato in seguito che è l’etilene l’ormone primariamente coinvolto nella senescenza. Tuttavia, pur
non avendo un ruolo primario, l’ABA appare coinvolto nella senescenza ad esempio inducendo la
produzione di etilene.
L’ABA si accumula nelle gemme dormienti
Nelle specie legnose le gemme rappresentano l’organo svernante. Tali gemme non si accrescono
durante l’inverno manifestando così uno stato di dormienza. Si è ritenuto che tale dormienza sia
imputabile all’accumulo di ABA nelle gemme, ma non ci sono prove definitive che dimostrino tale ipotesi.












