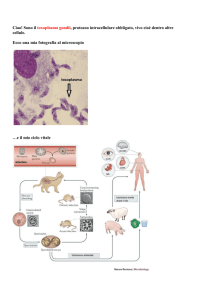
CRIPTOSPORIDIOSI
Si tratta di un piccolo coccidiomorfo (Classe
Sporozoasida; Famiglia Cryptosporidiidae) a diffusione
cosmopolita che infetta il bovino, la pecora, la capra, il
cavallo, i cervidi ed uomo.
Recenti studi molecolari hanno mostrato che esistono
genotipi di Cryptosporidium ospite specifici
Oltre a C. parvum anche C. bovis è stato identificato,
mediante metodiche molecolari, come una specie che
infetta i bovini
Ciclo biologico
1.
2.
3.
4.
Liberazione di sporozoiti infettivi;
schizogonia (moltiplicazione asessuata);
gametogonia (formazione di gameti);
fecondazione;
5.
6.
formazione della parete dell’oocisti;
sporogonia e sporulazione endogena.
L’infezione si verifica in seguito all’ingestione di piccole
oocisti (4-5 micron) contenenti 4 sporozoiti.
Si liberano nell’intestino e si attaccano al margine microvilloso
degli enterociti (ileo +++) dove si trasformano in trofozoiti.
I microvilli intestinali formano nel punto di contatto con il
protozoo un’area di fusione che dà origine a una “ lamella di
ricambio ” attraverso la quale avviene lo scambio di materiale
nutritivo.
In seguito i microvilli congiungendosi all’apice formano un
“vacuolo parassitario” che avvolge il protozoo.
Cryptosporidium spp.
Schizonti nell’estremità apicale delle cellule
intestinali
Recettività e sensibilità
giovane età: massima incidenza tra i soggetti di 3-15 gg;
adulti: solo se immunodepressi;
la recettività diminuisce con l’aumentare dell’età;
la dose di oocisti ingerite non è mai proporzionale alla
sintomatologia;
• non sempre il colostro protegge gli animali dall’infezione
•
•
•
•
• Feci eliminate dai neonati;
• lambimento delle pareti del
box imbrattate con le feci;
• infezione autogena;
• acqua e alimenti contaminati
con le feci;
• oocisti eliminate dagli animali
adulti portatori-eliminatori;
• leccamento della mammella,
fianchi, perineo, ecc;
• inalazione delle oocisi nelle
forme respiratorie;
Fonti d’infezione
Resistenza
• A temperatura ambiente (18-20°C) resistono per un
anno;
• le oocisti rimangono infettanti per 2-6 mesi a 4°C;
• ha scarsa resistenza
• al disseccamento (65°C x 30’)
• al congelamento (-18°C x 24h).
• Invasione degli enterociti da parte del parassita;
Patogenesi
• distruzione delle cellule assorbenti;
• sostituzione delle cellule danneggiate con cellule
la cui funzione assorbente ed enzimatica è
ridotta;
• aumento della pressione osmotica nel lume
intestinale a causa del mancato assorbimento;
• dilatazione del lume intestinale;
• risposta dell’ospite con infiltrazione della lamina
propria di cellule infiammatorie;
Sintomatologia
• il principale segno clinico è la diarrea improvvisa;
• la diarrea può essere accompagnata da altre manifestazioni
cliniche in relazione all’età del soggetto, allo stato immunitario e
alle condizioni ambientali;
• perdita dell’appetito, dimagramento e disidratazione;
• se non insorgono complicazioni si ha risoluzione spontanea
nell’arco di 8-10 gg;
• non esistono segni patognomonici che permettano di differenziare
la criptosporidiosi da altri enteropatogeni;
• se le condizioni ambientali sono avverse e il managemant
dell’allevamento non è ottimale l’evoluzione è rapida con morte
dei soggetti nel giro di 24-48 h.
.
Lesioni macroscopiche
• A livello addominale:
ipotrofia del mesentere; infarto dei gangli regionali
• A livello abomasale:
latte indigerito sotto forma di coaguli.
• Intestino tenue:
enterite, iperemia, contenuto giallastro acquoso.
• Grosso intestino: accumulo di gas.
Diagnosi
• clinica
• istologica
• parassitologica
• immunologica
Diagnosi clinica
• Non è specifica;
• i segni clinici, la sintomatologia e l’epidemiologia non sono
sufficenti per differenziarla da altri enteropatogeni;
• enteropatogeni frequentemente associati a criptosporidiosi
sono:
Giardia, E. coli, Rotavirus, Coronavirus, Parvovirus,
Salmonella.
Diagnosi parassitologica
• Ricerca delle oocisti nelle feci:
sedimentazione e flottazione mediante l’uso di
-sol. saccarosio di Sheather;
-solfato di zinco;
-cloruro sodico;
poco sensibile;
Diagnosi parassitologica
•
Strisci di feci colorati con
tecnica di Heine:
-fucsina fenicata oocisti
incolori su sfondo rosso
(osservare subito il
preparato ad immersione);
•
Strisci di feci colorati con
la Ziehl-Nielsen modificata
secondo Herkinson:
-fucsina fenicata
-decolorazione con H2SO4
-colorazione di contrasto
con verde
malachite.
oocisti color rosso
Diagnosi parassitologica
Queste metodiche non consentono l’identificazione
della specie e sono utili solo in caso di infezione in cui
generalmente vengono eliminate un numero molto
elevato di oocisti (500.000/gr).
Immunità
• I. innata: esiste un’immunità innata nei ruminanti domestici
secondo quanto riferito da alcuni autori, tuttavia i veri
meccanismi non sono noti per cui occorrerebbero ulteriori
indagini;
• i. acquisita: le IgM compaiono nei neonati infetti al 7°
giorno e aumentano fino al 30°mantenendosi elevate per
un lungo periodo. Le IgG e le IgA compaiono al 15°giorno
di vita. In seguito vengono prodotte le IgAS a livello
intestinale. La loro cinetica dipende dall’età in cui l’animale
si è infettato, presentando valori più elevati negli animali
che si sono infettati in età più avanzata.
Diagnosi immunologica
• Non è specifica per l’impossibilità di
distinguere tra Ac dovuti all’infezione e
Ac assunti con il colostro;
• in umana sono disponibili tests di
immunofluorescenza indiretta con Ac
monoclonali.
• test ELISA: più sensibile, non è tuttavia
indispensabile ,in quanto I soggetti con
sintomatologia in atto eliminano
numerose oocisti facilmente
evidenziabili anche con le normali e
meno costose tecniche di colorazione. Il
test potrebbe trovare applicazione nei
monitoraggi per l’identificazione dei
portatori asintomatici importante dal
punto di vista epidemiologico.
Prime segnalazioni in Italia
• 1972 Mandelli e Coll.: nell’intestino di giovani
tacchini,nella borsa di Fabrizio dei polli e nelle
cavità rino-sinusali delle quaglie;
• 1982 Canestri e Trotti: nei vitelli, bufalotti e uomo;
• 1984 Genchi e Coll.: nei vitelli della Lombardia;
• 1985 Leoni: negli agnelli della Sardegna;
• Malattia emergente dell’allevamento intensivo;
• facilitata dall’alta densita di animali, dall’enorme
quantità di oocisti già sporulate eliminate con le feci e
dalla presenza di malattie gastroenteriche
concomitanti (Rotavirus, Coronavirus, E.coli,
Salmonelle, ecc.);
• riveste un importante ruolo nell’insorgenza delle
sindromi diarroiche dei giovani animali;
• si può manifestare in seguito a trattamenti cortisonici;
• nell’uomo può presentarsi in contemporanea con
patologie immunosoppressive come l’AIDS;
La prevalenza negli animali è altamente variabile avendo
un range da 0% al 75%;
La maggior parte delle infezioni sono in relazione all’età,
3-15 giorni di vita.
Il periodo prepatente è considerato di 3-10 gg.;
Il periodo di patenza può variare da 3 a 35 gg.;
É un’infezione cosmopolita presente sia nei luoghi con
clima freddo che temperato.
•Prevalenze in Italia:
- 26,4% in Abruzzo (Canestri Trotti et al. 1982);
- 27% in Lombardia (Genchi et al. 1984);
- 33,0% in Lombardia (Boni et al., 1988);
- 11,6% in Piemonte (Ferrari et al., 1991);
- 33,7% in Sardegna (Scala, Garippa 1994).
•Prevalenze all’estero:
- 14,0% in Inghilterra (Snodgrass et al., 1986);
- 14,4% in Svizzera (Spillman et al., 1986);
- 5,6% in USA (Sobieh et al., 1987);
- 25,0% in Bulgaria (Khalacheva et al., 1988
Risultati
DISTRETTO
% CAPI POSITIVI
%ALLEVAMENTI POSITIVI
Arborea (OR)
38,2% (89/233)
71,4% (30/42)
S.M. la Palma-Porto Torres (SS)
26,5% (22/83)
53,3 (8/15)
Ozieri-Chilivani (SS)
25 % (13/52)
66,6% (4/6)
CLASSE D’ETA’
PREVALENZA
da 0 a 10 giorni
35,3%
da 11 a 20 giorni
52,7%
da 21 a 30 giorni
21,6%
da 31 a 40 giorni
18,9%
Terapia
- sulfonamidi
- il lasacocid
- arprinocid
- paromomicina 25-100 mg/Kg/die per 11gg.
- decochinato 2,5 mg/Kg/die per 4 settimane
- alofuginone (dose efficace vicino a quella tossica)
riducono l’emissione oocistica, ma non controllano la
sintomatologia
Terapia
Il trattamento sintomatico riduce gli elevati tassi di
mortalità
- reidratazione con soluzioni isotoniche;
- antidiarroici che non inibiscano la peristalsi;
- probiotici per ricostituire la flora intestinale;
- vitamine K, B1, B6 , PP e A;
- antibiotici;
Profilassi
• Evitare il contatto con animali infetti (isolamento);
• attenzione alle acque di scolo infette si depurano non con la
clorazione, ma solo con la microfiltrazione;
• fare in modo che I neonati nonsiano stabulati in aree
precedentemente occupate da neonati infetti;
• buona alimentazione delle madri soprattutto durante la fase
terminale della gravidanza;
• monitorare temperatura e umidità evitando condizioni
estreme;
• somministrazione di colostro in modo razionale nelle prime
ore di vita;
• attuazione di una razionale vaccinazione delle madri.
Profilassi vaccinale
E’ stato sperimentato un vaccino costituito
da oocisti liofilizzate che somministrato subito
dopo la nascita riducono significativamente
la durata media della diarrea e del periodo
di eliminazione delle oocisti.