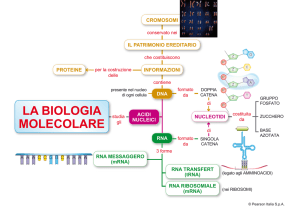
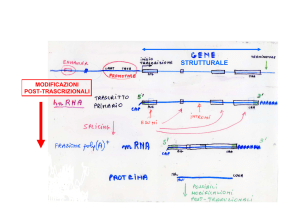
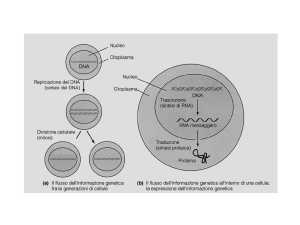
RNA REGOLATORI Oltre ai fattori di regolazione proteici, anche alcuni particolari tipi di RNA possono contribuire alla regolazione dell’espressione genica di un mRNA bersaglio, cambiandone la struttura secondaria o agendo sulla sua traduzione e degradazione. Il riboswitch Una prima semplice modalità di regolazione mediata da RNA è la presenza nel filamento 5’-­‐UTR (regione importante per la modulazione della traduzione) di un elemento denominato riboswitch. Un riboswitch è un dominio di RNA con una sequenza in grado di modificare la propria conformazione in base al legame di un elemento segnalatore, come un piccolo metabolita. Questo va a legarsi sulla cosiddetta regione aptamerica1, cambiando l’appaiamento delle basi e/o la struttura secondaria e modulando in cis la traduzione e la degradazione del filamento. Un esempio nei batteri è la produzione di glucosammina-­‐6-­‐P: l’mRNA dell’enzima che la sintetizza partendo da Fru-­‐6P e Gln possiede una regione in grado di legare il prodotto enzimatico GlcN6P: il legame con il metabolita la fa diventare un ribozima attivo che catalizza il taglio dello stesso mRNA in cui è contenuta, agendo con meccanismo a feedback negativo. I ncRNA L’appaiamento delle basi offre un meccanismo efficace perché un RNA controlli l’attività dell’altro. Questa regolazione avviene grazie ad alcuni tipi di ncRNA, RNA non codificanti che spesso assumono strutture secondarie complesse e sono codificati in regioni sia intra-­‐ che extra-­‐
geniche. Nel gruppo dei ncRNA possono essere distinte numerose famiglie: – lncRNA – miRNA – siRNA – piRNA – rasiRNA – sRNA – etc. 1 Una sequenza aptamerica è una sequenza in grado di legare una molecola o una proteina. s
Analizziamo ora alcuni dei meccanismi attraverso cui i ncRNA modulano l’espressione genica. I miRNA e l’RNA interference Un generico filamento antisenso è in grado di bloccare la trascrizione semplicemente appaiandosi al suo filamento bersaglio complementare e impedendo la sintesi proteica. Oltre al semplice meccanismo sterico però, negli organismi si osserva un meccanismo di silenziamento indotto da un filamento antisenso più complesso, mediato dai miRNA. I microRNA, miRNA (o stRNA, small temporal RNA), sono RNA regolatori a singolo filamento lunghi dalle 19 alle 25 bp; si stima che il genoma umano contenga circa 1000 siti codificanti miRNA. Sono in grado di appaiarsi con un RNA target, agendo da molecole guida nel silenziamento genico in un meccanismo noto come RNA interference. Biogenesi dei miRNA I miRNA hanno origine da lunghi precursori primari, i pri-­‐miRNA, che vengono trascritti dalla RNApol II; i pri-­‐miRNA possiedono tratti autocomplementari, e assumono spontaneamente una struttura che contiene da una a sei forcine con appaiamenti imperfetti. I miRNA si possono distinguere in base alla localizzazione genomica in: • miRNA esonici in trascritti non codificanti; • miRNA intronici in trascritti non codificanti; • miRNA intronici in trascritti codificanti. Il pri-­‐miRNA deve andare incontro a diversi passaggi di maturazione: • Nel Microprocessor Complex nucleare, Drosha, una RNasi III2 , riduce il pri-­‐miRNA in frammenti precursori di circa 70-­‐80 bp, i pre-­‐miRNA3; • i pre-­‐miRNA vengono esportati nel citoplasma dall’Exportin 5 nucleare; • Dicer, un’altra RNasi III, riduce il pre-­‐miRNA ad un solo doppio filamento di ~22 basi con estremità a singolo filamento (miRNA:miRNA* duplex); • infine una subunità di Dicer con attività elicasica separa i due filamenti, liberando i miRNA. I miRNA maturi si rinvengono sempre come componenti del complesso RISC (RNA-­‐Induced-­‐
Silencing-­‐Complex); secondo una serie di processi non del tutto chiariti, solo uno dei due filamenti del 2
3
Le RNasi III sono una famiglia di endonucleasi che agiscono su RNA a doppio filamento (dsRNA). i pre-­‐miRNA di origine intronica possono saltare questo passaggio. duplex di miRNA verrà incorporato in RISC, quello con l’appaiamento più stabile al 5’, l’altro verrà degradato (miRNA*, indicato con l’asterisco). Oltre ai miRNA nel complesso RISC si trovano proteine della famiglia Argonauta (Ago), che svolgono le funzioni di taglio/inibizione del complesso RISC. Azione dei miRNA I miRNA esercitano la loro funzione sia a livello trascrizionale (nel nucleo) che post-­‐
trascrizionale (nel citoplasma). A livello post-­‐trascrizionale, RISC usa il miRNA come guida per analizzare l’mRNA in cerca di piccole regioni di omologia. Sebbene non sia richiesto una totale complementarietà, è fondamentale il corretto appaiamento di una sequenza denominata miRNA seed, che comprende 7 nucleotidi dell’mRNA in posizione 2-­‐8 dall’estremità 5’ del miRNA. La sequenza di appaiamento sull’mRNA target è posta sulla 3’-­‐UTR4; ad ogni filamento si può legare più di un miRNA sia dello stesso tipo sia di tipi diversi con effetto cooperativo, ed ogni miRNA si può appaiare a più di un tipo di mRNA. Questo conferisce a questo meccanismo di regolazione una notevole potenzialità combinatoria. 4 Questo vale per gli animali; nelle piante invece in genere è nella sequenza codificante. A seconda che l’appaiamento sia perfetto o imperfetto, l’RNAi può procedere in due modi: • un appaiamento completo porterà al taglio nucleasico del filamento e conseguente digestione, e risulterà quindi in una riduzione sia dell’mRNA codificante sia del prodotto proteico; • un appaiamento incompleto si tradurrà in un’inibizione del processo di traduzione, con riduzione del prodotto proteico ma normale quantità di mRNA codificante. Sono stati osservati diversi meccanismi con cui RISC può interferire con la traduzione: Ago è omologo a eIF4E, cui può quindi impedire il legame al filamento di mRNA; ma potrebbe anche ostacolare la circolarizzazione del trascritto, indurre una deadenilazione, sequestrare l’mRNA nei P body 5 o impedire l’associazione della subunità ribosomale 60S. Mentre l’appaiamento completo è spesso riscontrabile nelle piante (che fanno maggior uso dei siRNA), negli animali l’appaiamento incompleto è più comune. I miRNA hanno un bassissimo tasso di mutazione. Costituiscono un potente meccanismo di regolazione fine dell’espressione genica e si ipotizza che la loro comparsa abbia permesso una notevole innovazione morfologica negli organismi, e di conseguenza la nascita di organi complessi; infatti, rapidi burst evolutivi di innovazione morfologica si associano spesso alla comparsa di nuovi microRNA, che poi rimangono notevolmente conservati lungo i phyla e scompaiono molto raramente. A livello trascrizionale si è osservato che i dsRNA da cui derivano i miRNA possono portare anche all’attivazione della trascrizione genica, anche se la repressione della traduzione è il risultato più comune. In un meccanismo definito attivazione genica indotta da miRNA, o RNAa, il dsRNA si lega a promotori dell’espressione genica portando a un’aumentata attività di trascrizione o traduzione. I siRNA Un altro meccanismo di regolazione che converge sempre sul complesso RISC è quello mediato dai siRNA. I siRNA (Short Interference RNA) sono simili ai miRNA, di lunghezza dai 21 ai 23 nucleotidi e invariabilmente di origine esogena (o trasposonica). L’interferenza mediata da siRNA è sempre mediata da un dsRNA che viene trasportato nella cellula. In C. elegans il filamento esogeno viene frammentato da Dicer (DCR1) in una serie di siRNA primari. Questi, complessati con il fattore RDE1 (omologo alla famiglia Ago) in complessi simili ai RISC, potranno andare a riconoscere altre molecole di dsRNA uguali alla prima (autosilencing), legandovisi e permettendo ad una RNA polimerasi RNA dipendente (RpRd) che non necessita di primer di sintetizzare nuovi filamenti complementari. I nuovi dsRNA verranno a loro volta frammentati, generando altri siRNA secondari e amplificando la risposta. I siRNA secondari formano complessi RISC uguali a quelli che mediano l’azione dei miRNA. 5 Aggregati riboproteici citoplasmatici coinvolti nel turn-­‐over dell’RNA Questo tipo di RNAi costituisce pertanto un meccanismo di difesa verso elementi potenzialmente pericolosi come virus e trasposoni; in alcuni organismi, come le piante, la risposta non è limitata alla sola cellula dove è avvenuta l’infezione, ma può propagarsi per via sistemica alla pianta, grazie all’amplificazione della risposta dovuta all’azione della della RpRd; i siRNA primari e secondari potranno poi migrare fra le cellule tramite i plasmodesmi. L’RNAi nella pratica sperimentale L’RNAi costituisce un potente strumento per modulare in laboratorio l’espressione genica. In un procedimento chiamato knock-­‐down (l’espressione genica viene ridotta, ma non abolita come nel knock-­‐out), doppi filamenti di RNA costruiti a partire da un gene di interesse possono essere introdotti in un organismo, nel quale verranno riconosciute come RNA esogeno e innescheranno la produzione di siRNA. Un’organismo nel quale questa manipolazione ha avuto notevole successo è C. elegans, nel dsRNAsemplice: delivery
quale è possibile introdurre i dsRNA in maniera estremamente methods
• mediante microiniezioni; • mettendoli in soluzione nel mezzo di coltura; • inserendo la sequenza di interesse in un plasmide con cui posso trasformare batteri che poi 2. Soaking
1. Microinjection
vengono dati da mangiare al nematode; • ingegnerizzando nematodi transegnici in cui il singolo filamento è trascritto di seguito ad una sequenza complementare invertita, in modo che l’RNA prodotto si ripieghi a forcina a formare il dsRNA6. 4. Transgene
3. Feeding
Nei mammiferi bisogna tenere in considerazione che lunghi dsRNA innescano la risposta interferonica (una forma d’immunità innata evolutasi come protezione verso agenti virali esogeni); bisognerà quindi impiegare dsRNA di lunghezza inferiore a 26bp, che non presentano questo problema. I lncRNA I long non-­‐coding RNA (lncRNA, o macro ncRNA) sono ncRNA dalla lunghezza superiore ai 200 nt. Originano dai numerosissimi trascritti di RNA (quattro volte gli mRNA codificanti) che vengono normalmente processati con splicing, capping e poliadenilazione, ma non possiedono ORF al loro interno. Nel genoma sono spesso codificati in regioni che si sovrappongono sul filamento senso o antisenso a sequenze codificanti. Sono coinvolti in numerosi processi a ogni livello dell’espressione genica7. Ogni trascritto non codificante ha di per se una potenzialità regolativa in cis che esplica rimanendo legato al filamento stampo durante la trascrizione, o appaiandovisi in seguito. E’ cos’ in grado di influenzare l’espressione dei geni vicini, ad esempio scalzando proteine regolatrici o mantenendo il filamento aperto, oppure legando attivatori e inibitori trasferendoli sulla sequenza di DNA (tether model). 6 Il filamento rispiegato così prodotto è denominato più propriamente shRNA, short hairpin RNA. 7 vedere A. Pauli, J. L. Rinn, Non-­‐coding RNAs as regulators of embryogenesis. Inoltre può agire anche in trans: • come mediatore per l’aggregazione di complessi proteici (scaffold model) come avviene per il complesso della telomerasi che richiede un TERC per organizzarsi (TElomerase RNA Component); • legandosi al filamento in maniera aspecifica per reclutare modificatori della cromatina (guide model). Questo secondo meccanismo sembra essere coinvolto nell’inattivazione del cromosoma X; • facendo da “esca” (RNA decoy) per determinati fattori di trascrizione che legherebbero il DNA, inibendone l’azione; • legando uno o più miRNA bloccandone così l’azione di silenziamento sugli mRNA codificanti (miRNA sponge). REVIEWS
La capacità regolatoria dei macro ncRNA scaturisce in ciascun esempio dalla capacità di stabilire numerose interazioni con proteine di vario genere, RNA e DNA anche in maniera combinata. Questo suggerisce l’ipotesi che i lncRNA agiscano da scaffold modulari8, con domini discreti in grado di interagire con elementi regolatori di varia natura (RNA, DNA o proteine) portandoli in prossimità gli uni degli altri e formando un unico complesso funzionale. 8 M. Guttman, J. L. Rinn, Modular regulatory principles of large non-­‐coding RNA. Figure 5 | RNAs modulate chromatin. A | Models of gene regulation by cis- and trans-acting long non-coding RNAs
(lncRNAs). Aa | In cis (left), the process of transcription can displace DNA-bound factors that inhibit (left) or activate
(right) transcription of a neighbouring gene (process of transcription). Ab | Alternatively, nascent non-coding
transcripts can function as tethers for chromatin-modifying complexes and/or transcriptional regulators, which can
have either activating (left) or repressive (right) activities (tether model). Ac | Trans-acting non-coding RNAs (ncRNAs)
can serve as platforms for the assembly of protein complexes (scaffold model). In this model, target sites are specified
L’RNA sarebbe adatto a questo ruolo, essendo un substrato evolutivamente più “malleabile” rispetto alle proteine, e consentendo la selezione di discreti domini di interazione. L’RNA può infatti essere più facilmente mutato e selezionato senza interferire eccessivamente con la sua funzionalità. Il modello delle interazioni modulari potrebbe trovare un riscontro nell’osservazione di una serie di pacchetti altamente conservati inframmezzati da regioni ad alto tasso di mutazione che consentirebbero la nascita di nuovi domini. I piRNA I piRNA, la classe di piccoli ncRNA maggiormente presente negli eucarioti, sono in grado di formare complessi assieme alle proteine piwi (P-­‐element induced wimpy testis); la loro biogenesi non è stata ancora interamente chiarita, ma originano da pathway distinti da quelli dei miRNA e dei siRNA. I rasiRNA sono una sottospecie di piRNA. Le proteine piwi associate al piRNA svolgono un’azione di silenziamento su svariati trasposoni soprattutto in sede di spermatogenesi; il dominio piwi che ha attività dsRNasica è conservato nelle proteine della famiglia Argonauta. Gli sRNA procariotici I batteri contengono fino a un centinaio di piccoli RNA regolatori, gli sRNA. La loro attività è mediata dalla formazione di un doppio filamento con un mRNA bersaglio, anche se in genere funzionano anche se non sono perfettamente complementare all’RNA bersaglio. L’azione degli sRNA appaiati è mediata dalla proteina Hfq, in grado di agire sulla traduzione e sulla degradazione degli mRNA. I piccoli RNA batterici sono responsabili anche un sistema di difesa acquisito contro le infezioni virali, mediato da un gruppo di corte ripetizioni palindromiche detto CRISPR (Clusters of Regularly Interspersed Short Palindromic Repeats). Il trascritto di CRISPR viene usato insieme ad un sistema di processamento costituito da otto proteine Cas. Piccole sequenze di RNA esogeno (spacers) possono essere processate ed integrate in mezzo alle sequenze in tandem di CRISPR. Il trascritto di CRISPR viene quindi espresso e processato in un brevi RNA di ~50 bp, che conterranno gli spacers derivati da precedenti esposizioni ad un RNA esogeno (ad esempio di origine virale) e silenzieranno la replicazione del fago con un meccanismo simile all’RNAi eucariotica.