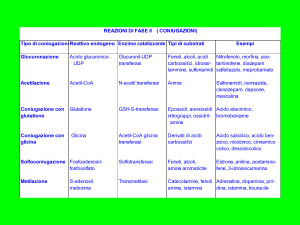
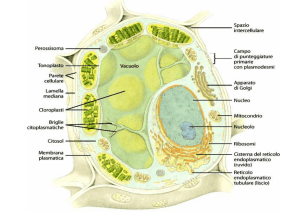
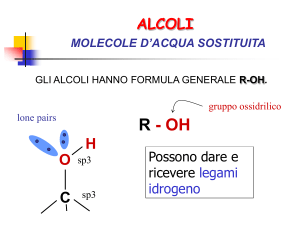
Fenoli
I fenoli contengono uno o più gruppi OH legati ad atomi di carbonio
dell’anello aromatico e presentano un comportamento intermedio fra
quello degli alcoli e quello degli acidi. Così i fenoli formano sali con NaOH
(fenati) che non sono decomposti dall’H2O.
✔ Stato fisico
I fenoli più semplici sono liquidi o solidi bassofondenti, gli altri sono tutti
solidi.
✔ Solubilità
Il fenolo è in parte solubile in H2O, mentre i fenoli polivalenti sono solubili
in H2O.
Acidità dei Fenoli
Acidità di vari Fenoli
Forte Acidità dei Nitro Fenoli orto e para Sostituiti
Le Reazioni dei Fenoli: La Sostituzione
Elettrofila Aromatica
Reazioni di riconoscimento dei
fenoli
1. Saggio al FeCl3
2. Reazione di Liebermann (indofenoli)
3. Reazioni di copulazione
4. Reazione delle ftaleine
Riconoscimento dei fenoli
1. Saggio al FeCl3
I fenoli reagiscono con FeCl3 formando composti colorati per la presenza di
complessi tra l’OH fenolico ed il Fe+++.
I fenoli monovalenti danno una colorazione violetta, gli orto-difenoli verde-scuro, i
meta-difenoli rosso-violetta, invece i para-difenoli danno colorazioni fuggevoli in
quanto vengono rapidamente ossidati a chinoni.
Il saggio è dato anche da altre sostanze lievemente acide: enoli, acidi Idrossammici.
E’ negativo per i nitrofenoli
Riconoscimento dei fenoli
2. Reazione di Liebermann
I fenoli aventi la posizione para libera reagiscono con NaNO2 ed H2SO4
conc. per dare l’indofenolo che può assumere una diversa colorazione a
seconda dell’ambiente acido o basico.
OH
NaNO2
H2SO4
O
N
OH
NO
NOH
O
H+
- H2O
O
N
chinonossima
+ fenolo
HO
N
OH
H2SO4
O
O
N
O Na
NaOH
N
indofenolo
OH
Riconoscimento dei fenoli
3. Reazione di copulazione
I fenoli, in ambiente alcalino (NaOH) copulano con i
sali di diazonio per dare coloranti azoici.
Tale saggio è specifico per quei fenoli che hanno la
posizione para o una delle posizioni orto libera.
Riconoscimento dei fenoli
4. Reazione delle ftaleine
I fenoli aventi la posizione para libera reagiscono con l’anidride ftalica in presenza di
H2SO4 conc. Per dare una sostanza colorata in ambiente basico (NaOH) la fenolftaleina.
Applicazione : Paracetamolo
Applicazione : Sinefrina Tartrato
Derivati cristallini dei fenoli
A. Esteri
1. Acetilderivati
2. Benzoati, p-Nitro-benzoati, 3,5-dinitrobenzoati
3. p-Toluensolfonati
B. Ariluretani
C. 2,4-Dinitrofenileteri
D. Acidi Arilossacetici
Derivati cristallini dei fenoli
A.1. Esteri Acetilderivati
ArOH
H3COC-N
(CH3CO)2O +
N
N
+ ArOCOCH3
+ CH3COOH
Si forma inizialmente uno ione acilammonio instabile più disponibile all’attacco nucleofilo
da parte del fenolo
A .2. Benzoati, p-nitro e 3,5-dinitro benzoati
O
Ar
-
+ O
Cl
H+
O
OAr
+
O
H + -Cl + Ar
O
Cl
La reazione è nota come quella di Shotten-Baumann e si esegue dibattendo a
freddo il fenolo con cloruro di benzoile in ambiente basico per i seguenti motivi:
1.
2.
3.
4.
Neutralizzare l’HCl che si forma;
Mantenere in soluzione l’ac. benzoico
Impedire la precipitazione del PhOH;
Per catalizzare la reazione
Derivati cristallini dei fenoli
A.3. Esteri p-toluensofonati
O
ArOH + Cl - S
O
CH3
HCl + ArO- S
O
B. Ariluretani
Reazione analoga a quella vista per gli alcoli
O
CH3
C. 2,4 Dinitrofenileteri
O2N
O2N
ArO Na + Cl
NO2
NaCl + ArO
NO2
D. Acidi Arilossacetici (pH non troppo basico)
O + H2C
OCH2COOH + Cl-
COOH
Cl
Si potrebbe avere una reazione competitiva di sostituzione nucleofila dell’acido monocloro
acetico da parte dello ione ossidrilico
OH
H2C
Cl
COOH
HO
CH2 COOH
acido glicolico
Bromoderivati
I fenoli sono reattivi verso la SE
OH
OH
Br
Br
+ 3 HBr
+ 3Br2
Br
OH
OH
Br
CH3
CH3
+ 2 HBr
+ 2Br2
Br
o-cresolo
OH
OH
Br
Br
+ 3 HBr
+ 3Br2
CH3
CH3
Br
m-cresolo
Soluzione di Bromo
Br2 + H2O + Br
Br3
oppure Br5