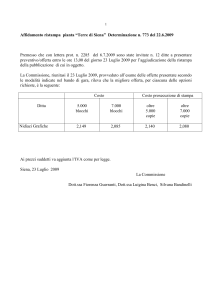
Tabella C
TABELLA C - STUDI OSSERVAZIONALI
(EX DETERMINAZIONE AIFA 20.03.2008 E DELIBERAZIONE R T 158/2004)
Premessa
Tutti gli studi osservazionali da intraprendere presso l’Azienda Sanitaria Firenze devono essere
sottoposti alla valutazione del Comitato Etico.
E’ di competenza del CEL l’espressione di parere sugli studi epidemiologici e osservazionali
non farmacologici sia non interventistici che interventistici. Come definito dalla Deliberazione
R.T. 158/2004, gli studi osservazionali non interventistici sono gli studi centrati sulla rilevazione
e l’elaborazione dei dati di problemi o patologie nei quali ai pazienti non si applica nessuna
procedura supplementare di diagnosi o monitoraggio ed in cui l’analisi dei dati raccolti è
condotta con metodi epidemiologici.
Sono detti studi osservazionali interventistici, gli studi che comportano anche minime procedure
supplementari non previste dalla corrente prassi assistenziale.
E’ di competenza del CESCM l’espressione di parere sugli studi osservazionali farmacologici.
La sopracitata deliberazione regionale 158/2004 stabilisce come inderogabile condizione
perché uno studio farmacologico sia definito osservazionale,che l’eventuale terapia
farmacologia sia stabilizzata, o comunque prescritta indipendentemente dallo studio stesso.
Data la natura osservazionale degli studi non sono necessarie polizze assicurative aggiuntive
rispetto a quelle già previste per la normale pratica clinica.
Qualora lo studio osservazionale riguardi un farmaco, esso deve soddisfare le seguenti
condizioni:
1/3
Tabella C
- Il farmaco deve essere prescritto nelle indicazioni d’uso autorizzate all’immissione in
commercio in Italia
- La prescrizione del farmaco in esame deve essere parte della normale pratica clinica
- La decisione di prescrivere il farmaco al singolo soggetto deve essere del tutto
indipendente da quella di includere il paziente stesso nello studio.
- Le procedure diagnostiche e valutative devono corrispondere alla pratica clinica corrente
Per la valutazione del protocollo, si richiede al Promotore di fornire la seguente
documentazione.
- n. 2 copie della richiesta di autorizzazione o lettera di intenti (vedi Art. 1.1.): la richiesta
deve essere completa anche dell’offerta economica relativa al compenso per paziente e ogni
altro eventuale onere aggiuntivo a carico dello sponsor
- 2 copie della dichiarazione del proponente sulla natura osservazionale dello studio
(appendice 1 Determinazione 20.03.2008)
- 2 copie del modulo di Informazione e di Consenso del paziente completi di data e numero
di versione (solo per gli studi nei quali vi sia un rapporto diretto con i soggetti)
- 2 copie del protocollo di studio completo di data e numero di versione
- 2 copie del riassunto del protocollo in italiano
- 2 copie della lista delle informazioni da raccogliere (CRF)
- 2 copie Elenco dei Centri partecipanti allo studio
- 2 copie della descrizione delle procedure utili a garantire la confidenzialità delle
informazioni
- proposta di convenzione relativa agli aspetti finanziari (se prevista) - l’Azienda Sanitaria
di Firenze ha recepito la convenzione disposta dalla Regione Toscana versione
13.02.200913.02.2009
–
(allegato C).
Tutta la documentazione elencata dovrà essere fornita anche in formato elettronico (CD
o tramite invio all’indirizzo e-mail: [email protected])
Per la valutazione del protocollo, si richiede allo Sperimentatore di fornire la seguente
2/3
Tabella C
documentazione :
- n. 2 copie della richiesta di autorizzazione alla sperimentazione (vedi allegato a, a1 e a2)
- n. 2 copie della dichiarazione sui rapporti di tipo economico con lo Sponsor
3/3