medicina
Farmaci
a DNA
Dopo anni di false partenze, una nuova generazione
di vaccini e medicine per HIV, influenza e altre malattie
difficili da trattare sta affrontando i trial clinici
di Matthew P. Morrow e David B. Weiner
Stuart Bradshaw
D
ieci anni fa, alcuni ricercatori dei National Institutes of Health misero a confronto due nuovi e promettenti tipi di vaccino
per capire quale dei due poteva offrire la protezione migliore contro il virus dell’immunodeficienza
umana (HIV) che causa l’AIDS. Uno dei due era costituito da anelli di DNA chiamati plasmidi, ciascuno dei quali aveva un gene per una delle cinque proteine dell’HIV. L’obiettivo di questo vaccino
era innescare la produzione di proteine virali nei
soggetti vaccinati, in modo da provocare una reazione protettiva da parte delle cellule immunitarie. Il secondo vaccino invece sfruttava un altro
virus, l’adenovirus, come vettore per un singolo
gene dell’HIV che codifica per una proteina virale. L’idea era di usare un virus «sicuro» per catturare l’attenzione delle cellule immunitarie, orientando la reazione verso la proteina dell’HIV.
All’epoca, uno di noi (Weiner) lavorava sui vaccini a DNA già da otto anni e sperava di ottenere
una chiara dimostrazione della capacità dei plasmidi di immunizzare contro un patogeno. Ma i risultati furono un duro colpo per chi puntava su questa
prima generazione di vaccini a DNA. I soggetti del
primo test mostrarono una risposta immunitaria
debole o nulla alle cinque proteine dell’HIV, mentre
chi aveva ricevuto il vaccino basato sull’adenovirus manifestò reazioni più forti. Ai ricercatori parwww.lescienze.it
ve chiaro che gli adenovirus fossero i candidati migliori per lo sviluppo di vaccini per l’HIV.
I risultati non sorpresero del tutto chi si occupava di vaccini a DNA, visto che altri trial clinici avevano mostrato deboli risposte, ma delusero
comunque perché c’erano buoni motivi per credere che i vaccini a plasmide fossero sicuri ed efficaci. Convinti che l’idea di partenza restasse valida, i
ricercatori hanno fatto un passo indietro, tornando
a studiare come migliorare l’efficacia della tecnologia. E oggi questi sforzi stanno dando dei frutti.
Una nuova generazione di vaccini basati su plasmidi sta dimostrando, negli animali e nell’uomo,
che si può indurre la risposta desiderata mantenendo la sicurezza e le altre caratteristiche che rendono così attraente la scelta del DNA. L’uso stesso
della tecnologia a DNA si sta espandendo verso altre forme di terapia immunitaria e come mezzo per
somministrare farmaci. Nella loro forma matura,
vaccini e terapie basati sul DNA potrebbero funzionare per il trattamento di diverse malattie che
per ora non hanno cure efficaci.
Oggi come ieri, una buona idea
Nei primi anni novanta, quando l’idea di usare
il DNA per l’immunizzazione cominciò a prendere
piede, la sua elegante semplicità fu subito evidente. I componenti fondamentali del vaccino, cioè i
in sintesi
■ Da
tempo che si spera in
un successo di vaccini
e terapie basati su anelli
di DNA detti plasmidi nella
cura e la prevenzione delle
malattie, ma i primi test si
sono stati deludenti.
■ Recenti
miglioramenti dei
plasmidi e nuovi metodi di
somministrazione ne hanno
però aumentato
enormemente l’efficacia.
■ Vaccini
e terapie usati oggi
per gli animali e nelle
ultime fasi delle
sperimentazioni sull’uomo
dimostrano che i plasmidi
stanno raggiungendo il loro
potenziale.
LE SCIENZE 91
Gene
selezionato
Geni virali
Plasmide
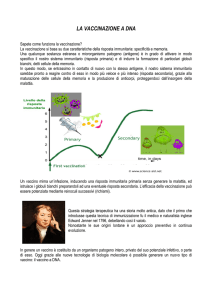
Che siano pensati per curare o per prevenire una
malattia, i farmaci a DNA sono fatti di plasmidi –
piccoli anelli di DNA – progettati per veicolare un
determinato gene nelle cellule. Una volta che i
plasmidi sono all’interno, le cellule producono la
proteina codificata dal gene. Nel caso di un vaccino
antivirale a DNA (illustrazione), le proteine virali
prodotte stimolano una risposta immunitaria che
previene l’infezione futura da parte di quel virus.
PRODUZIONE DELLE PROTEINE DEL VACCINO
Un vaccino a DNA somministrato attraverso la pelle entra, o
«transfetta», le cellule dell’epidermide e alcune cellule immunitarie.
Le cellule transfette producono la proteina virale codificata dal
plasmide, cioè un antigene. Un numero sempre più grande di cellule
immunitarie ingloba le proteine dell’antigene che escono dalle cellule
transfette.
Antigene
Plasmidi
del vaccino
Linfonodo
Cellula
dell’epidermide
Cellule
transfette
LE RISPOSTA
DELLE CELLULE IMMUNITARIE
Le cellule immunitarie che
portano l’antigene (le
cosiddette cellule
presentanti l’antigene) si
spostano verso i linfonodi,
dove l’interazione con altre
cellule immunitarie produce
anticorpi e linfociti T killer su
misura per le proteine virali e
per ogni virus che le esibirà
in futuro.
LE SCIENZE
Cellula
presentante
l’antigene
Cellule
immunitarie
Anticorpi
Linfociti T killer
Virus bloccati
plasmidi costruiti per introdurre geni che codificano per una o più proteine di un patogeno, avrebbero indotto le cellule del paziente a produrre quelle proteine, ma non avrebbero avuto le istruzioni
per produrre l’intero patogeno, così il vaccino non
avrebbe potuto dar vita al patogeno stesso.
Quando un plasmide entra in una cellula ospite – la cosiddetta transfezione – i meccanismi che
di norma decodificano il DNA leggono il gene del
plasmide, producendo la proteina desiderata, che
poi può essere rilasciata all’esterno della cellula in
modo molto simile alle particelle virali. Fuori dalla
cellula, le proteine specifiche del patogeno sono riconosciute dal sistema immunitario come estranee.
Il sistema immunitario quindi può essere «convinto» del fatto che l’organismo sia infetto, innescan-
92 Cellule
immunitarie
506 ottobre 2010
le analisi per capire che cosa è andato storto: molti
indizi sembrano indicare che l’adenovirus sia stato un importante fattore di insuccesso. Nei soggetti
con una preesistente immunità all’AdHu5 (un comune virus del raffreddore), il sistema immunitario
potrebbe aver attaccato il vaccino. Rimane ancora
da capire perché alcuni soggetti vaccinati siano risultati più suscettibili all’infezione da HIV.
La rinascita del dna
Precision Graphics
Virus
do il riconoscimento e le reazioni immunitarie a
lungo termine contro la proteina estranea. L’introduzione di un solo anello di DNA che trasporta un
gene può dunque indurre l’immunità.
Oltre alla loro sicurezza e semplicità, i vaccini
a DNA offrono una serie di vantaggi. La loro produzione è molto più veloce rispetto ad altri vaccini
tradizionali, come quello dell’influenza, che richiedono la manipolazione e la coltura di virus «vivi», in un processo che dura un minimo di 4-6 mesi. Il DNA è stabile a temperatura ambiente, quindi
i vaccini a DNA non necessitano di una refrigerazione costante, uno dei problemi per il trasporto e
l’immagazzinamento di molti vaccini, specialmente nei paesi in via di sviluppo.
Per chi progetta i vaccini, il DNA ha un altro
vantaggio che negli ultimi anni ha avuto un peso
nel riaprire la porta a questa tecnologia. Il sistema
immunitario non riconosce come estranei i plasmidi, quindi tecnicamente il vaccino non provoca
alcuna risposta immunitaria. Solo le proteine codificate dai plasmidi, una volta prodotte dalle cellule, attirano l’attenzione delle sentinelle immunitarie. In questo modo, i plasmidi si possono usare
più volte nello stesso paziente per somministrare
diversi geni senza il rischio che l’organismo sviluppi l’immunità nei confronti del vettore del DNA
e attacchi il vaccino.
Purtroppo, nei primi test sui vaccini a DNA la
debolezza della risposta immunitaria rappresentò
un problema serio. La ragione principale probabilmente era l’esiguo numero di cellule raggiunte dai
plasmidi; inoltre, quelle poche cellule non producevano una sufficiente quantità delle proteine codificate. Il risultato era una stimolazione insufficiente del sistema immunitario.
Ma la tecnologia concorrente incontrò un problema ancora peggiore. Nel 2007, l’azienda farmaceutica Merck aveva avviato la sperimentazione di
un vaccino per l’HIV che sfruttava un adenovirus
(AdHu5) per trasportare i geni del virus dell’HIV.
Alla luce della forte risposta immunitaria suscitata
dagli adenovirus in precedenti studi, il trial (chiamato STEP) aveva acceso molte speranze e interessi. Erano coinvolti circa 3000 soggetti HIV-negativi, che avevano ricevuto il vaccino o il placebo.
Con il progredire del trial, però, emerse una differenza preoccupante tra i due gruppi: i soggetti
che avevano ricevuto il vaccino non erano protetti meglio rispetto a quelli che avevano ricevuto il
placebo. Anzi, erano più vulnerabili. Alla fine, su
914 pazienti vaccinati, 49 erano diventati HIV-positivi, mentre nel gruppo del placebo il risultato era
stato di 33 HIV-positivi su 922. Il trial è stato interrotto nell’estate del 2009, e sono ancora in corso
Precision Graphics
Come funzionano i farmaci a DNA
Negli anni che hanno portato al trial STEP, chi
era rimasto convinto del potenziale della piattaforma a DNA ha lavorato sodo per risolvere i complessi problemi che avevano limitato l’efficacia della prima generazione di vaccini basati su plasmidi.
Gli sforzi si sono concentrati sul miglioramento di
ogni aspetto dell’attività dei plasmidi: nuovi metodi per farli entrare nelle cellule, nuovi modi per
produrre una maggiore quantità di proteine, e l’aggiunta di elementi che aumentano la risposta immunitaria alle proteine codificate dai vaccini.
I nuovi metodi di somministrazione dei vaccini
sono tra i risultati più importanti ottenuti, perché
raggiungono un numero molto più grande di cellule, tra cui le cellule immunitarie, che inglobano
il plasmide. Per esempio, cerotti transdermici e altri sistemi senza aghi, come Gene Gun o il Bioject,
che usano l’aria compressa per iniettare il vaccino,
introducono i plasmidi nell’epidermide, dove c’è
un’alta concentrazione di sentinelle immunitarie
dette «cellule presentanti l’antigene». Questi metodi spingono fisicamente i plasmidi in molte più
cellule rispetto all’iniezione con l’ago. Per ottenere
un risultato simile con un ago nel muscolo o nella
pelle, l’iniezione può essere seguita dall’elettroporazione, una serie di scariche elettriche che causano l’apertura temporanea dei pori nella membrana
cellulare, facilitando l’entrata dei plasmidi. L’elettroporazione può aumentare di 1000 volte l’assorbimento dei plasmidi da parte delle cellule.
Anche i costrutti gene-plasmide sono stati migliorati, perfezionando la sequenza di DNA dei geni trasportati. Per esempio, l’ottimizzazione dei
codoni modifica l’espressione delle istruzioni del
gene in modo che siano eseguite più velocemente
dalla cellula. Nel codice genetico, gli amminoacidi
(i mattoni delle proteine) sono specificati da gruppi di tre «lettere» di DNA che compongono un codone. Alcuni amminoacidi sono codificati da più
di un codone, ma in genere le cellule favoriscono
uno solo dei codoni sinonimi, traducendolo con
più efficienza rispetto agli altri. Scegliere i codoni ottimali aumenta quindi la produzione cellulare
della proteina desiderata. Ulteriori revisioni della
sequenza genica possono migliorare stabilità e acwww.lescienze.it
Aumentare il potere del DNA
Le tecnologie che potenziano l’efficacia dei vaccini e delle terapie basati sui plasmidi
hanno rinnovato la speranza per il successo dell’approccio a DNA. I miglioramenti
aumentano l’assorbimento dei plasmidi da parte delle cellule, incrementano la
produzione delle proteine per cui codificano i plasmidi e intensificano la risposta
immunitaria a queste proteine.
SOMMINISTRAZIONE MIGLIORATA
Iniezione senza ago
Sistemi a elettroporazione
Alto assorbimento
da parte delle cellule
Cellula immunitaria
Cellule
dell’epidermide
Cellule
dell’epidermide
Cellule dei
muscoli
Alto
assorbimento
da parte delle cellule
I sistemi senza ago fanno arrivare il vaccino
nell’epidermide, dove sono concentrate le cellule
immunitarie. Rispetto all’ago, gli iniettori
introducono una quantità maggiore di plasmidi
nell’epidermide e nelle cellule immunitarie.
Poro temporaneo
Una stimolazione elettrica, detta
elettroporazione, può aumentare l’assorbimento
dei plasmidi somministrati con un ago.
La stimolazione causa l’apertura temporanea
di pori cellulari da cui entrano i plasmidi.
Progettazione ottimizzata dei plasmidi
Le istruzioni per sintetizzare una proteina codificate da
un plasmide si possono specificare con diverse
sequenze di «lettere» di DNA. Tuttavia, scegliere
determinate sequenze può aumentare la quantità di
proteine generate.
La migliore sequenza genica
Alta
produzione
di proteine
Gene
adiuvante
Gene
dell’antigene
Migliorata stimolazione
immunitaria
I geni dei plasmidi possono codificare per sostanze
che stimolano le cellule immunitarie, dette adiuvanti.
Gli adiuvanti prodotti insieme agli antigeni
incrementano le risposte immunitarie al vaccino.
Migliorata risposta immunitaria alla proteina
curatezza degli RNA messaggero trascritti dai geni e letti dalla cellula per assemblare la proteina, e
possono accelerare la produzione della proteina.
La prima sequenza genica trascritta dalla cellula è la cosiddetta sequenza leader, che si trova vicina all’inizio di ogni gene e codifica per la parte
iniziale di una proteina: l’ottimizzazione di questa
sequenza può migliorare la stabilità delle proteine risultanti. Alcune sequenze leader possono anche avere la funzione di marcatore, segnalando alla cellula la proteina da produrre: un risultato utile
perché permette alle cellule immunitarie di trovare le proteine estranee all’interno e all’esterno delle
cellule transfette. Le due opzioni suscitano diversi
tipi di risposte immunitarie, e la loro combinazione migliora l’immunità generata dal vaccino.
LE SCIENZE 93
94 LE SCIENZE
Una tecnologia multiuso
La capacità di introdurre in sicurezza i geni nelle cellule e di far produrre in modo efficace proteine alle cellule apre la strada a numerose potenziali
terapie. In realtà, molti trattamenti basati sul DNA
sono più avanti dei vaccini a DNA nella corsa a
un uso clinico diffuso. Diversamente dai farmaci
classici ,che spesso si basano su piccole molecole, le terapie a DNA veicolano un gene per trattare una malattia. Ma a differenza delle terapie geniche tradizionali, il plasmide non si integra in modo
definitivo nel genoma del paziente e non resta in
modo definitivo nelle cellule. In questo modo si
evitano le complicazioni che hanno ostacolato lo
sviluppo delle terapie geniche.
506 ottobre 2010
Dimostrare il potenziale del DNA
Attualmente sono in fase di studio su esseri umani vaccini e terapie basate su plasmidi per numerose malattie, e alcuni prodotti sono già stati
approvati per gli animali. La tabella qui sotto elenca una selezione dei prodotti in fase di sperimentazione sull’uomo e le corrispondenti malattie, o i
prodotti veterinari già in commerci.
PRODOTTO
OBIETTIVO TERAPEUTICO NELLE SPERIMENTAZIONI CLINICHE SULL’UOMO
IN COMMERCIO (per gli animali)
Vaccini per prevenire
malattie
■ HIV
■ Influenza
■ V
irus
Trattamenti che
stimolano la risposta
immunitaria per malattie
già in corso
■ Epatite
■ Melanoma
Terapie che producono
le proteine necessarie
■ Insufficienza
(3 vaccini)
(2 vaccini)
Nile Virus (cavalli)
della necrosi ematopoietica
infettiva (salmoni di allevamenti)
C
(cani)
■ Tumori
indotti dal virus del papilloma umano
al fegato
■ Melanoma
■ Tumore
cardiaca congestizia
di crescita da immunodeficienza
combinata grave legata al cromosoma X
■ Patologie circolatorie degli arti (3 trattamenti)
■ Melanoma
■ D
eficit
Ritorno al futuro
Negli ultimi dieci anni, sono state concluse o
avviate decine di sperimentazioni cliniche sull’uomo di terapie e di vaccini a DNA. In particolare, le
versioni a plasmide dei vaccini influenzali mostrano alcuni benefici già evidenziati dall’approccio a
DNA. Un vaccino anti-influenzale sviluppato dal
nostro gruppo, attualmente in fase di sperimentazione umana, si è dimostrato efficace nel proteggere cavie animali da ceppi più comuni di influenza e dall’influenza aviaria H5N1. Il vaccino dà
questa protezione a largo spettro perché i plasmidi contengono le cosiddette «sequenze consenso»
dei geni dei virus influenzali, grazie a cui le proteine virali somigliano alle proteine di molti ceppi influenzali diversi tra loro. Questi vaccini potrebbero
mettere fine alle discrepanze tra i vaccini dell’influenza stagionale e i ceppi influenzali che emergono ogni anno.
Il ceppo influenzale H1N1 dell’anno scorso, che
ha causato una pandemia globale ha sottolineato
l’urgenza di un nuovo approccio ai vaccini. Una
versione sperimentale a DNA di vaccino per H1N1
prodotta dall’azienda farmaceutica VICAL è stata messa a punto in sole due settimane a maggio
2009. Se fosse stato testato e autorizzato in anticipo, il vaccino si sarebbe potuto produrre in grande
quantità almeno due mesi prima della disponibilità
www.lescienze.it
■ West
■ HIV
gica a DNA evidenzia il potenziale delle piattaforme a DNA di nuova generazione nei casi in cui altri approcci hanno fallito.
Dall’alto in basso: Klaus Boller, Photo Researchers, Inc.; James Cavallini, Photo Researchers, Inc.; Steve Gschmeissner, Photo Researchers, Inc.
Matthew P. Morrow e David B.
Weiner lavorano insieme
all’Università della Pennsylvania,
dove Morrow è un ricercatore postdottorato. Dieci anni di ricerca
sull’HIV hanno portato Morrow a
studiare vaccini e immunoterapie a
DNA. Weiner, professore di patologia
e medicina, è direttore del progetto
di ricerca sui vaccini e la terapia
genica dell’università. Pioniere della
tecnologia dei vaccini a DNA, Weiner
è stato il primo a far arrivare vaccini
basati su plasmide fino alla
sperimentazione clinica. Inoltre è
stato consulente della Food and
Drug Administration e di aziende
che fanno ricerca sui farmaci basati
su plasmidi.
Come capita spesso con le nuove tecnologie, i
primi successi delle terapie basate su plasmidi sono
stati ottenuti negli animali. Nei maiali, per esempio, è stata già autorizzata una terapia per prevenire gli aborti spontanei. Somministrato alle scrofe gravide sfruttando l’elettroporazione, il plasmide
entra nelle cellule, che in seguito producono un ormone per il rilascio dell’ormone della crescita che a
sua volta aiuta la sopravvivenza dei feti. Il successo di questi trattamenti è interessante anche perché
per animali così grandi è necessaria una sola iniezione, il che promette bene per terapie umane.
Attualmente sono in corso diversi trial clinici per
terapie destinate all’uomo (si veda la tabella nella
pagina a fronte). In uno, per esempio, si veicolano
geni che codificano per fattori di crescita in grado
di attivare cellule staminali per la cura dell’insufficienza cardiaca congestizia. Un altro trial sta testando un plasmide che codifica per il fattore di
crescita IGF-1, allo scopo di curare il deficit di crescita in pazienti con immunodeficienza combinata
grave legata al cromosoma X. Una terza sperimentazione riguarda un problema circolatorio, l’ischemia critica degli arti, difficile da trattare. Questa terapia sfrutta fattori codificati da un plasmide per
far crescere nuovi vasi sanguigni, nella speranza di
prevenire la necessità di un’amputazione.
Una diversa categoria di trattamenti, nota come
immunoterapia biologica a DNA, combina i migliori aspetti di terapie e di vaccini a DNA veicolando un gene che induce l’organismo a sviluppare una risposta immunitaria contro una malattia in
corso, come un tumore o un’infezione virale cronica. Per esempio, un trial riguarda DNA che codifica per proteine virali in modo da indurre le cellule
immunitarie ad attaccare i tumori causati dal virus
del papilloma umano (HPV). I risultati iniziali mostrano che il 50 per cento dei pazienti sviluppa la
risposta delle cellule T alle proteine dell’HPV e che
oltre il 90 per cento produce alti livelli di anticorpi. Un altro trial sta testando un’immunoterapia a
DNA contro il virus dell’epatite C. I significativi risultati preliminari di entrambi i trial sono incoraggianti, attualmente infatti non sono disponibili terapie immunitarie efficaci né per i tumori dovuti a
HPV né per l’epatite C.
In quest’ambito, le applicazioni veterinarie sono ancora più avanzate, e una terapia a DNA che
si è dimostrata efficace contro il melanoma nei cani sta suscitando molto interesse tra chi si occupa
di cancro nell’uomo. Il trattamento contro il melanoma canino, prodotto da Merial, aumenta di sei
volte la sopravvivenza media dei cani con melanoma in stato avanzato rispetto a quelli che non
ricevono la terapia. Questa immunoterapia biolo-
Cortesia Matthew P. Morrow (Morrow); cortesia David B. Weiner (Weiner)
gli autori
Un ultimo importante miglioramento riguarda
gli adiuvanti, sostanze aggiunte ai vaccini per potenziare la risposta immunitaria. In alcuni casi, un
adiuvante può indirizzare la risposta immunitaria, per esempio favorendo la produzione di cellule
T, che cercano e distruggono le cellule infettate da
un patogeno, invece della produzione di anticorpi, che cercano di bloccare l’ingresso dei patogeni
nelle cellule. Un composto chiamato Vaxfectin,
per esempio, ha aumentato di 200 volte la risposta anticorpale a un vaccino a DNA contro l’influenza. Un altro adiuvante, il Resiquimod, è usato con vaccini a DNA per provocare una risposta
immunitaria forte che includa sia gli anticorpi sia
le cellule T.
Un altro interessante aspetto della tecnologia
per i vaccini a DNA è che non bisogna aggiungere gli adiuvanti alla formulazione finale del vaccino, eliminando così eventuali problemi nel mantenimento della giusta emulsione e della stabilità del
composto: i ricercatori possono inserire il gene per
la molecola dell’adiuvante nel plasmide del vaccino. Le cellule che inglobano il plasmide produrranno l’adiuvante insieme alle proteine del vaccino. Quando gli adiuvanti codificati dai geni sono
aggiunti ai vaccini a DNA, anche nel caso in cui il
plasmide sia stato già ottimizzato, come descritto
prima, l’adiuvante può incrementare ulteriormente
la risposta immunitaria di cinque o più volte.
Questi vaccini basati su plasmidi progettati sono molto diversi dai semplici costrutti che codificavano proteine dei primi anni della piattaforma
a DNA. Con l’ottimizzazione dei plasmidi e il miglioramento dei metodi di somministrazione, questa tecnologia era pronta per il ritorno all’inizio del
trial STEP. Inoltre, l’approccio basato sul DNA promette di andare oltre la classica vaccinazione, e si
potrebbe sfruttare per somministrare farmaci e terapie immunitarie contro i tumori.
■ Morte
del vaccino standard. I primi trial sull’uomo stanno
portando a risultati incoraggianti.
Il potenziale dei vaccini e delle terapie a DNA
per malattie che non hanno alternative efficaci ha
rimesso in corsa il DNA anche per il vaccino contro
l’HIV. In un trial clinico si sta sperimentando Pennvax-B, vaccino che contiene tre geni virali dell’HIV
e geni che codificano per molecole adiuvanti somministrato per elettroporazione. Altri due vaccini
sono testati in una strategia che sfrutta i plasmidi per indurre le cellule immunitarie a riconoscere
le proteine dell’HIV, per poi somministrare un altro
tipo di vaccino che potenzia la prima risposta immunitaria. Uno di essi, GeoVax, è somministrato
con un vaccino di potenziamento basato su un virus chiamato «virus vaccinico Ankara modificato».
Il Vaccine Research Center dei National Institutes
of Health sta testando un diverso vaccino a DNA
per l’HIV, usando come potenziamento uno dei due
vaccini contro l’HIV basati sull’adenovirus.
Il fatto che molti vaccini e terapie a DNA siano già usati negli animali e siano alle ultime fasi di sperimentazione nell’uomo per malattie difficili da trattare mostra quanto lontana sia arrivata
la tecnologia dei plasmidi. I grandissimi progressi
fatti in questo campo negli ultimi dieci anni hanno
portato alla sperimentazione clinica di alcuni dei
più creativi approcci a vaccini e terapie. Sotto questo aspetto, chi di noi ha puntato su questa tecnologia fin dall’inizio, non può che essere orgoglioso nel vederla emergere da un’infanzia difficile e
guardare a un luminoso futuro.
■
dei feti (maiali)
➥ Letture
DNA Vaccines for HIV: Challenges
and Opportunities. Hokey D.A. e
Weiner D.B., in« Springer Seminars in
Immunopathology», Vol.28, n. 3, pp.
267-279, novembre 2006.
Electroporation of Synthetic DNA
Antigens Offers Protection in
Nonhuman Primates Challenged with
Highly Pathogenic Avian Influenza
Virus. Laddy D.J. e altri, in «Journal of
Virology», Vol.83, n. 2, pp. 4624-4630,
maggio 2009.
DNA Vaccines: Precision Tools for
Activating Effective Immunity
Against Cancer. Rice J. e altri, in
«Nature Reviews Cancer», Vol.8, n. 2,
pp.108-120, febbraio 2008.
LE SCIENZE 95





![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)


![ESTRAZIONE DNA DI BANANA [modalità compatibilità]](http://s1.studylibit.com/store/data/004790261_1-44f24ac2746d75210371d06017fe0828-300x300.png)