Rivista Italiana di Genetica e Immunologia Pediatrica - Italian Journal of Genetic and Pediatric Immunology
Anno II numero 4 - ottobre 2010 | direttore scientifico: Carmelo Salpietro - direttore responsabile: Giuseppe Micali
Home page
Numeri precedenti
Norme editoriali | Stampa l'articolo
1 2 3 4 5 6 7 8 9 10
Motore di ricerca
◀ Indietro pagina 4 Avanti ►
Scoliosi: aspetti clinici e genetici
Ilaria Sanzarello, Giovanna Elisa Calabrò, Stefania Marvaso, Maria Concetta Cutrupi
UOC di Genetica ed Immunologia Pediatrica Università di Messina
Introduzione
Il termine scoliosi deriva dal greco “skolios” (obliquo) ed indica una complessa
deformità strutturale della colonna vertebrale che modifica il suo asse fisiologico nei
tre piani dello spazio (Fig. 1): sul piano frontale si verifica un movimento di flessione
laterale, sul piano sagittale un’alterazione delle curve fisiologiche e sul piano assiale
uno spostamento in rotazione.
In accordo con la classificazione della Scoliosis Research Society distinguiamo,
dunque, una scoliosi non strutturata e una scoliosi strutturata (Tab. 1).
La deviazione della colonna vertebrale nel caso di scoliosi posturale è visibile
soprattutto quando il soggetto sta in piedi. In posizione distesa, essa si riduce
completamente.
Le cause di questo tipo di scoliosi possono essere diverse e riconducibili, in prima
istanza, alla mancanza di un adeguato movimento o al mantenimento di posizioni
scorrette troppo a lungo.
Ci riferiamo, in particolare, all’ipercifosi, detta anche “dorso curvo”,
un’accentuazione della normale curvatura della colonna a livello del torace che si
evidenzia mettendo il paziente di profilo.
Essa è dovuta ad una postura scorretta, spesso di origine familiare, che può essere
corretta durante la crescita
Fig. 1 Posizioni anomale della colonna vertebrale - Fig. 2 Scoliosi
La scoliosi, dunque, è una deformità che colpisce la colonna vertebrale (Fig. 2), è
una curva o complesso di curve del rachide estrinsecantesi prevalentemente su un
piano frontale, con una deformità strutturale (con più o meno evidenti alterazioni
estetiche) che si rileva attraverso una rotazione sul proprio asse delle vertebre (Fig.
3) evidenziabile, sulla schiena del paziente, da una protuberanza detta gibbo (Fig.
4); tale deformità è fissa, permanente e non può quindi essere modificata
volontariamente dal paziente che ne è affetto.
Tale deviazione è accompagnata anche da una torsione della colonna su se stessa
che coinvolge, oltre alla spina dorsale, le articolazioni, i legamenti, la muscolatura
paravertebrale e, nei casi più gravi, gli organi interni, ad esempio quelli cardiorespiratori, e le viscere, causando, quindi, problemi funzionali, oltre che estetici.
L’85% delle scoliosi sono considerate idiopatiche, cioè di origine sconosciuta.
Si ritiene che siano numerosi i fattori coinvolti nell’insorgenza ed evoluzione della
scoliosi: genetici, neurologici, biochimici, metabolici, di sviluppo, muscolari.
Secondo i dati recenti della ricerca scientifica, i fattori neurologici sembrano essere
quelli maggiormente responsabili della patologia ed in particolare incidono sul
controllo della stabilità e dell’equilibrio della colonna.
L’ipercifosi si può associare anche ad un’alterazione dei corpi vertebrali la cui causa,
a parte eventuali traumi, può essere collegata ad un’osteocondrosi, o osteocondrite
delle cartilagini (malattia di Scheuermann). In questi casi, i sintomi sono un
persistente mal di schiena e la posizione “curva” delle spalle (Fig. 5).
Vi sono però anche altri cause che possono determinare la scoliosi posturale come:
la dismetria degli arti inferiori, la lussazione dell’anca, le lesioni endorachidee o i
difetti della muscolatura del tronco che possono provocare dolori vertebrali o
muscolari.
In questi casi, la terapia consiste nell’eliminazione delle cause, ad esempio
compensando l’accorciamento dell’arto con l’applicazione di rialzi, eliminando i dolori
vertebrali o rinforzando la muscolatura del tronco attraverso esercizi specifici.
Fig. 3 Il rachide ruota attorno all'asse longitudinale e alla rotazione si associa
la torsione delle singole vertebre: come conseguenza si ha:lo spostamento dei
corpi vertebrali verso il lato convesso della curva;lo spostamento dei processi
spinosi versoil lato concavo della curva ed il gibbo costale - Fig. 4
Protuberanza detta Gibbo
E’ importante distinguere la scoliosi intesa come dismorfismo o deformazione
strutturale permanente della colonna vertebrale, che si evidenzia in modo chiaro
attraverso l’esame radiografico dalla scoliosi posturale (Fig. 5), detta anche
paramorfismo, che si riferisce semplicemente ad un atteggiamento viziato che, pur
determinando una deviazione laterale della colonna, non comporta alcuna
deformazione permanente e può essere corretta attraverso interventi volontari.
Fig. 5 Scoliosi posturale e caratteristica posizione “curva” delle spalle
Distinta dalla scoliosi posturale è la scoliosi strutturale, che provoca una
deformazione permanente della colonna vertebrale.
Ne esistono due tipi, una primaria, che riguarda la maggior parte dei casi (80%),
chiamata anche idiopatica, dal momento che non se ne conoscono ancora
esattamente le cause.
L’altra secondaria o congenita dovuta a patologie conosciute, anche se piuttosto
rare, che riguardano malformazioni ossee della colonna vertebrale, dell’anca o di un
arto inferiore, la cui gravità varia da caso a caso.
Scoliosi primaria e scoliosi idiopatica dell’adolescente (AIS)
La Scoliosi Idiopatica dell'Adolescente (AIS), definita come una curvatura strutturale,
laterale e rotatoria della colonna vertebrale, rappresenta la forma di scoliosi più
diffusa: ne sarebbero affette tra le 2-4 persone ogni 1000.
Si tratta di una malattia ad evoluzione molto rapida che si sviluppa nel corso della
pubertà fino alla maturità ossea, quando gli adolescenti stanno attraversando il
periodo di maggiore crescita della statura, infatti colpisce dall'1 al 3% dei soggetti in
una popolazione compresa fra i 10 e i 16 anni, con un rapporto di prevalenza nel
sesso femminile rispetto a quello maschile di 4 a 1.
Colpisce in particolare i soggetti longilinei ed astenici. Si arresta, generalmente,
quando l’attività delle cartilagini di accrescimento dei corpi vertebrali cessa,
diventando fissa una volta raggiunta l’età adulta.
L’eziologia dell’AIS, nonostante sia oggetto di studio da parecchi anni, rimane a
tutt’oggi sconosciuta.
Le teorie elaborate negli anni hanno incluso la possibilità di un’influenza genetica,
metabolica, ormonale, neuromuscolare e biomeccanica.
Alcuni di questi fattori sembrano infatti essere responsabili dell’insorgenza della
patologia, altri sembrano contribuire alla progressione della gravità della curva.
Appurata la causa genetica la patogenesi della scoliosi idiopatica va valutata in
rapporto all’età e alla sede. In rapporto all’età d’insorgenza distinguiamo le seguenti
forme di scoliosi idiopatica:
1) Infantile: 0-3 anni;
2) Giovanile: 4 anni – inizio pubertà (in media 10 anni nella femmina e 12 anni nel
maschio) ;
3) dell’adolescenza: inizio pubertà – maturazione ossea (10-16 anni)
La forma infantile (2%), da non confondere con quella congenita, si manifesta
generalmente nel primo anno di vita ed è molto rara.
E’ nella maggioranza dei casi una curva toracica che colpisce prevalentemente i
maschi ed è di gran lunga più frequente in Inghilterra risolvendosi spontaneamente
senza alcun trattamento (resolving structural scoliosis) ; in pochi casi progredisce
nella crescita fino a curve strutturali gravemente rigide con prognosi sfavorevole:
l’esame clinico oltre alla presenza del gibbo mostra una deformazione, talvolta
grave, del capo e del volto (plagiocefalia) con cranio a forma di parallelogramma e
appiattimento della fronte che risulta arretrata.
La forma giovanile (5-10 %) si evidenzia più frequentemente tra i 6 e 8 anni
fermandosi nell’evoluzione e rievolvendo all’inizio della pubertà.
La forma adolescenziale (80-85 %) coincide con l’inizio della crescita puberale (in
media 10 anni nelle femmine e 12 anni nei maschi) evolvendosi in questo periodo,
detto della rapida crescita puberale della colonna, di durata intorno ai 4-5 anni; è in
questo intervallo di tempo che avviene lo sviluppo sessuale e la maturità ossea della
colonna vertebrale.
La scoliosi idiopatica può presentare clinicamente e radiologicamente vari tipi di
curve che si diversificano in:
- toracica semplice con apice T8 o T9;
- toraco-lombare semplice con apice T11 o T12 o L1
- lombare semplice con apice L2 o L3;
- toraco-lombare doppia con due curve di senso opposto;
- toracica doppia (descritta da Moe) rara;
- altre molto rare.
La deformità estetica varia a seconda della curva: è più grave nella curva toracica e
toraco-lombare semplice, meno grave nelle curve della toraco-lombare doppia, dove
i gibbi, le spalle e il bacino si equilibrano e l’unica alterazione presente è
l’accorciamento del tronco.
Eziologia
Dal punto di vista eziologico l’osservazione di una stretta correlazione tra le fasi di
crescita dell’adolescente e l’evoluzione della curva scoliotica, fa degli ormoni della
crescita i candidati più ovvi nel ruolo di fattori eziologici della patologia.
I meccanismi alla base della crescita sono estremamente complessi e coinvolgono
l’interazione di numerosi fattori ormonali. Tra questi, ormoni come la tiroxina, gli
ormoni sessuali e l’ormone somatotropo (GH) sono certamente tra i più significativi.
L’ipotesi si basa sul concetto che, inducendo una più rapida crescita, ad esempio
delle strutture anteriori rispetto a quelle posteriori, questo indurrebbe uno
spostamento rotatorio significativo dei corpi vertebrali quindi una condizione di
instabilità che potrebbe favorire il processo scoliotico.
In modo particolare è stato osservato come il GH, quando somministrato in terapia,
si associ, seppur sporadicamente, ad un rapido aumento della curvatura scoliotica.
Tuttavia ciò non chiarirebbe il ruolo del GH nell’eziologia della AIS.
Nell’indagine tra le possibili cause responsabili dell’insorgenza della AIS sembrano
evidenziarsi, negli ultimi anni, numerose evidenze riguardo l’associazione della
stessa con patologie neurologiche.
Le ipotesi sono state quelle di ricondurre l’insorgenza della patologia scoliotica ad
una disfunzione del sistema nervoso centrale.
La scoliosi pare infatti associarsi a malformazioni cerebellari (malattia di Chiari tipo
I), a danni diretti della colonna dorsale e del corno posteriore del midollo spinale e a
danni compressivi midollari, come la siringomielia.
Tuttavia rimane fortemente controverso se attribuire a questi fattori una
responsabilità eziologica nell’insorgenza della AIS o ritenerli piuttosto conseguenza
della patologia stessa.
Recenti evidenze hanno rivolto la loro attenzione al ruolo della ghiandola pineale
nell’eziologia della AIS.
L’iniziale interesse nei confronti di questa ghiandola risale ad un lavoro che
evidenziava la presenza di una curvatura della colonna, con rotazione vertebrale, in
polli che avevano subito un intervento di pinealectomia.
L’ipotesi veniva poi supportata da un altro lavoro che attribuiva alla melatonina,
ormone secreto proprio dalla ghiandola pineale, un importante ruolo
nell’impedimento dello sviluppo del processo scoliotico.
Questi lavori trovavano supporto anche in studi di Machida et al. dove si attribuiva, a
bassi livelli di melatonina, un’ingravescenza della curvatura scoliotica in adolescenti
affetti da AIS. L’ipotesi è stata ripresa da Cheung et al. in uno studio che, prendendo
spunto dal precendente lavoro di Thillard, valutava, in polli sottoposti a
pinealectomia, l'effetto di soppressione della melatonina sullo sviluppo di una
curvatura scoliotica.
L’ipotesi, inizialmente confermata, non ha però trovato supporto in un successivo
lavoro dello stesso Cheung dove l’intervento veniva effettuato su primati e in cui,
nonostante la soppressione di melatonina, non si sviluppava una scoliosi.
Recentemente un ulteriore approfondimento sull’argomento è stato offerto da un
gruppo di ricercatori cinesi che hanno posto in correlazione il polimorfismo genico
del recettore 1B per la melatonina (MT2) con l’insorgenza della AIS, sostenendo che
un deficit recettoriale per la melatonina, quindi un alterato pathway di trasmissione
del segnale, possa essere la causa di una disfunzione osteoblastica e quindi di
anomalie di crescita scheletrica osservabili, appunto, anche nei pazienti con AIS.
Nonostante l’AIS sia oggetto di studio da parecchi anni, la sua eziologia rimane,
tutt’oggi, ancora sconosciuta.
Tuttavia il ruolo fondamentale dei fattori genetici nella patogenesi della stessa è
stato ormai ampiamente confermato: in questi ultimi anni e ancor più di recente, si è
confermata l’ipotesi ereditaria come causa della malattia.
Si era già precedentemente osservato, studiando gli alberi genealogici dei soggetti
scoliotici, che l’incidenza della deformità in alcuni gruppi familiari era nettamente
superiore alla media (familiarità della scoliosi).
Oggi numerosi lavori scientifici affermano che la malattia è conseguenza di una
predisposizione genetica multifattoriale a trasmissione, principalmente, autosomica
dominante con penetranza incompleta.
Alla fine degli anni ’90 Carr A (J Bone Joint Surg, 1990) ed Kesling KL et al. (Spine
1997) hanno studiato la possibile correlazione tra alcuni geni candidati e lo sviluppo
di Scoliosi Idiopatica. Dai loro lavori è emerso un rischio di insorgenza della
patologia pari al 76 % in gemelli monozigoti, del 36 % in gemelli dizigoti, dell’11% in
parenti di primo grado, del 2, 4 e del 1, 4 % rispettivamente in parenti di secondo e
terzo grado.
Tuttavia, se alcuni studi suggeriscono una modalità di trasmissione autosomica
dominante, altri la ricollegano a meccanismi X-linked. Più genericamente, sulla base
della grande variabilità di presentazione della patologia scoliotica in membri della
stessa famiglia, si tende oggi a considerare la AIS una patologia a trasmissione
poligenica e multifattoriale.
Le attuali metodologie di screening genetico hanno consentito, specialmente con
metodiche di clonazione posizionale o analisi di linkage, di identificare determinati
loci cromosomici e correlarli allo sviluppo di questa patologia.
Questi lavori hanno permesso di escludere i geni per il collagene di tipo I (COLα1) e
II (COLα2); per l’elastina (ELN) e per l’aggrecano (ACAN). Sembrerebbero essere,
invece, coinvolti nella patogenesi della AIS altri loci genici localizzati rispettivamente
su il cromosoma 17p11 e il 19p13 (Fig.6).
Due lavori revisionati dalla più recente letteratura hanno evidenziato l’associazione
tra l’alterazione del gene della matrilina (MATN 1), una proteina extracellulare del
connettivo, e l’insorgenza della scoliosi idiopatica. I risultati ottenuti mostrano la
presenza di un legame tra l'allele 103 bp del gene MATN1 e la scoliosi idiopatica.
In realtà, si evince dagli studi, è più corretto parlare di una predisposizione genica
alla scoliosi che potrebbe manifestarsi solo in concomitanza di altri fattori genetici ed
ambientali.
La ricerca degli ultimi anni ha rivolto la sua attenzione, anche, sull’attività degli
estrogeni nell’eziologia della AIS.
A tal proposito nello studio condotto da Wu et al. (Spine, 2006) è stato dimostrato
che il polimorfismo del gene del sito Xbal, recettore dell'estrogeno, è associato ad un
aumentato rischio di sviluppare la AIS. Anche Tang et al. (Spine, 2006), in un
recente lavoro, confermano la relazione tra espressione recettoriale estrogenica ed
aumento di progressione della curva scoliotica.
Fig. 6 Loci genici (17p11 e il 19p13) coinvolti nella patogenesi dell’AIS
Un altro importante campo di indagine sulla ricerca eziologica dell’insorgenza della
AIS è quello della biomeccanica. La stabilità della colonna vertebrale si basa infatti
sull’integrità strutturale delle sue componenti specifiche (corpi vertebrali, disco ed
elementi legamentosi).
Tale integrità rende l’intera colonna vertebrale un’unità biomeccanica.
E’ chiaro che, qualora una delle componenti strutturali o dei meccanismi utili a
garantire i normali meccanismi biomeccanici vada incontro a delle alterazioni, si
creano le condizioni predisponenti l’insorgenza di AIS.
Numerosi studi sono presenti in letteratura sull’analisi delle componenti strutturali
della colonna vertebrale e delle loro eventuali alterazioni. Hadley-Miller et al. (J Bone
Joint Surg, 1994) riscontrarono delle importanti anomalie nelle fibre elastiche dei
legamenti spinali in soggetti affetti da deformità scoliotica rispetto ai controlli sani.
Un’anomala percentuale del contenuto di glicosaminoglicani e fibre collagene nel
nucleo polposo dei dischi intervertebrali in pazienti che avevano AIS è stata invece
dimostrata da Pedrini et al. (J Lab Clin Med, 1973).
Anche i piatti vertebrali sono stati oggetto di studio ad parte di Zhu et al. (Paediatr
Int, 2006) che evidenziarono una ipertrofia condrocitaria della porzione anteriore del
disco intervertebrale nei soggetti con AIS.
Altre ipotesi eziopatogenetiche hanno infine interessato l’analisi delle fibre muscolari
dei muscoli paraspinali, dimostrandone un’alterazione della distribuzione in pazienti
affetti da AIS (Spencer GS et al. 1976).
A tal proposito un particolare studio sulla sindrome di Marfan ha dimostrato una
possibile associazione tra la disfunzione muscolare e legamentosa, propria di questa
patologia, e l’insorgenza della AIS.
Tale ipotesi, però, non trova supporto da altri lavori della recente letteratura.
Se da un lato le alterazioni muscolari, legamentose o midollari della colonna
vertebrale instaurano un importante squilibrio nelle fasi di crescita della colonna,
dall’altro l’analisi dei suddetti cambiamenti porta ad affermare che questi possano
più verosimilmente essere conseguenti al processo scoliotico che altera la forza
meccanica applicata ai dischi.
Tali ipotesi biomeccaniche, pur non potendo essere annoverate tra le cause
responsabili dell’insorgenza della patologia scoliotica, sembrerebbero contribuire
notevolmente a una progressione della deformità vertebrale in collaborazione con
altri fattori.
Alla luce di quanto ad oggi riportato in letteratura, l’opinione corrente è pertanto
quella di classificare la scoliosi idiopatica dell’adolescente come una malattia
genetica complessa, la cui insorgenza deriva dall’associazione di una determinata
predisposizione genica con l’influenza di fattori ambientali e biomeccanici
responsabili della caratteristica deformità della colonna vertebrale.
Diagnosi e Terapia
La diagnosi della scoliosi si basa sulla ricerca di segni clinici precisi che vengono
suddivisi in primari e secondari e sull’esclusione delle altre cause, come le
malformazioni vertebrali e le malattie neuromuscolari, che rappresentano il 15 % di
tutte le scoliosi.
Da un punto di vista diagnostico è fondamentale valutare se si è alle prese con un
paziente affetto da scoliosi strutturale o da semplice atteggiamento scoliotico.
Il paziente scoliotico, o con scoliosi sospetta, deve essere esaminato in tre
posizioni: in stazione eretta, flesso in avanti, adagiato su un lettino in posizione
supina.
Osservando il soggetto in stazione eretta (Fig.7, 8) si può osservare bene
l'eventuale asimmetria del livello orizzontale delle spalle e dei fianchi, l'asimmetria
dei triangoli della taglia, la presenza di eventuali deformazioni a carico del torace e
del bacino; e inoltre la sede della curva, il suo verso, la presenza o meno di curve di
compenso.
Le scapole possono essere alte o alate per la spinta ricevuta posteriormente dal
gibbo costale.
Per mezzo di uno speciale filo a piombo può essere valutato un eventuale squilibrio
tra il tronco e le pelvi. Il filo a piombo va appoggiato a livello della 7a vertebra
cervicale (prominente), facendolo poi cadere nella piega interglutea.
Esaminando il paziente flesso in avanti (Fig. 9) è possibile valutare l'incurvamento
dei processi spinosi e soprattutto l'entità del gibbo costale, "ad occhio" o tramite uno
speciale apparecchio, composto da una livella unita ad una scala graduata, che va
appoggiata sul dorso del paziente, misurando con un lato sull'apice della
prominenza del gibbo, la distanza in centimetri dall'emitorace controlaterale.
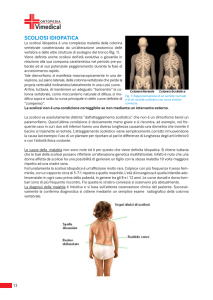
Lo scoliometro (Fig.10) può ancora essere considerato un utile supporto diagnostico
in quanto permette di misurare con facilità e rapidità il grado di inclinazione assiale
del tronco provocato dalla deformità vertebrale.
E’ sufficiente far flettere il soggetto in avanti, in posizione di “bending”, posare lo
scoliometro sul dorso con il segno “0” in corrispondenza delle spinose e leggere il
grado di inclinazione.
Un’inclinazione maggiore di 7° ha dimostrato un valore predittivo positivo del 96%
per curve maggiori di 10°.
Osservando il paziente adagiato su un lettino in posizione supina è possibile
misurare la lunghezza degli arti inferiori ma soprattutto valutare la conformazione
globale del rachide ed il trofismo della muscolatura paravertebrale.
E' quindi importante valutare l'elasticità o grado di correggibilità della curva
scoliotica, trazionando il paziente per il capo e facendogli compiere movimenti di
lateralità del tronco.
Tuttavia è chiaro che, se l'esame clinico è il primo indispensabile strumento che ci
consente di sospettare concretamente la presenza di una scoliosi, solo l'esame
radiografico ci fornirà tutti gli elementi di certezza che ci permetteranno un giudizio
completo.
L'esame radiografico consente infatti di misurare l'entità della curva scoliotica e la
componente di rotazione-torsione dei corpi vertebrali.
Le radiografie standard in ortostatismo del rachide (AP e LL) sono la base di
partenza per una valutazione (in caso di sospetta dismetria degli arti inferiori, è
consigliabile eseguire un secondo esame radiografico in clinostatismo e "lateral
bending" con inclinazione laterale del tronco, dal momento che in caso di scoliosi
funzionale la curva si corregge spontaneamente).
Di norma, nella proiezione in antero-posteriore la colonna vertebrale appare
rettilinea. In assetto sagittale invece (proiezione latero-laterale) la colonna presenta
delle curve fisiologiche a convessità anteriore (lordosi) ed a convessità posteriore
(cifosi) (Fig.11).
La presenza di deviazioni della colonna sul piano frontale (scoliosi) si ripercuote
anche sul piano sagittale con un'alterazione dell'assetto normale del rachide.
In presenza di scoliosi (toraciche e/o lombari) la cifosi toracica e la lordosi lombare
possono essere ridotte od anche invertite.
L'esame radiografico va studiato per evidenziare tutte le componenti della deformità
scoliotica: entità della curva, variazioni dell'assetto sagittale, rotazione vertebrale.
Fig.10 Lo Scoliometro
La misurazione della deviazione scoliotica viene espressa in gradi secondo l’angolo
di Cobb (Fig.12; 13): quest'angolo si ottiene tracciando due rette tangenti
rispettivamente alle limitanti della prima ed ultima vertebra colpite da scoliosi; le due
perpendicolari a queste rette si intersecano formando un angolo che indica l'entità in
gradi della deviazione scoliotica.
Fig. 11 in rosso l'assetto sagittale teorico corretto
Il 7-8% degli adolescenti presenta una scoliosi compresa tra i 5 e gli 11° di Cobb. Il
2-3% degli adolescenti presenta una scoliosi compresa tra gli 11 ed i 20° di Cobb. Lo
0, 3%-0, 5% degli adolescenti presenta una scoliosi compresa tra i 20 ed i 30° di
Cobb (l'1, 2% delle femmine e lo 0, 1% dei maschi).
Solo lo 0, 2-0, 3% degli adolescenti presenta una deviazione superiore ai 30° di
Cobb. Una curva scoliotica richiede trattamento solo se maggiore dei 30-40° di
Cobb, per cui l'incidenza delle scoliosi che richiedono trattamento è dello 0, 2-0, 3%.
Fig.12 Angolo di Cobb
Il completamento dell’indagine diagnostica si pone infine con il test di Risser (Fig.14)
che valuta il grado di ossificazione della cresta iliaca per stabilire l'età ossea (che
non sempre coincide con quella cronologica) del paziente. Normalmente
l'ossificazione inizia dalla spina iliaca anteriore superiore procedendo posteriormente
fino alla spina iliaca posteriore superiore; al termine della crescita si ha una fusione
completa con l'ala iliaca. Per la classificazione Risser ha suddiviso l'accrescimento
in cinque gradi: 1+ quando l'ossificazione è intorno al 25%; 2+ quando è intorno al
50%; 3+ quando la copertura è di circa il 75%; 4+ quando si ha l'ossificazione
completa del tratto e 5+ quando si ha la fusione completa del nucleo apofisario con
l'ileo (fine dell'accrescimento e stabilità pressoché definitiva della curva scoliotica).
Fig.13 Elementi di valutazione radiografica - Misurazione della curva sec. Cobb
La terapia della scoliosi idiopatica può essere incruenta o chirurgica . La terapia
chirurgica va prospettata per le curve gravi significatamene maggiori di 40 gradi,
dove a secondo della gravità clinica, l’insufficienza respiratoria, l’aspetto estetico
inaccettabile, l’insuccesso di un corsetto e il progredire delle curve nella vita adulta,
costituiscono l’indicazione più appropriata. La terapia incruenta è tutt’ora
essenzialmente basata sul busto ortopedico, unico mezzo efficace per la scoliosi
idiopatica progressiva. Le complicazioni della terapia con busto non sono frequenti; il
problema più comune è quello psicologico. Nel trattamento di questi pazienti sono
necessari notevoli attitudini da parte del curante; la famiglia e il medico devono
essere di supporto al bambino in questo periodo di stress. Un’altra complicanza
frequente è rappresentata dalle piaghe: queste, di solito, sono causate da
costruzione o adattamento non accurati del busto. L’irritazione della pelle può aversi
al di sotto della presa pelvica e può essere dovuta ad una traspirazione eccessiva o
ad allergia. Se l’irritazione persiste, la rimozione del busto per pochi giorni è
sufficiente a risolvere l’erosione cutanea. Anche l’allergia al materiale plastico o al
cuoio è frequente: in questo caso si dovrà foderare internamente la presa pelvica
con spugne sintetiche (Alimed, Pelide, Plastazolo). A volte può presentarsi una
meralgia parestesica per eccessiva pressione, sulla spina iliaca antero-superiore,
del nervo cutaneo laterale della coscia: l’intorpidimento regredisce facilmente con
adeguata rimozione della compressione in detta sede.
Scoliosi secondaria
Si distinguono dalla scoliosi idiopatica gli altri casi di scoliosi, distinti come
secondari, a ben precisa patogenesi, già classificati dalla Scoliosis Research Society
(Tab.2).
La Scoliosi secondaria o congenita è dovuta a patologie conosciute, anche se
piuttosto rare, che riguardano malformazioni ossee della colonna vertebrale,
dell’anca o di un arto inferiore, la cui gravità varia da caso a caso. Può, inoltre,
essere associata a sindromi neuromuscolari (la si osserva, ad esempio, in alcune
malattie come la paralisi cerebrale, la distrofia muscolare, la poliomielite, l’ipotonia
congenita, l’atrofia muscolo-spinale e l’atassia di Friedrich), alle displasie
scheletriche e ad altre malattie genetiche rare, come la sindrome di Marfan e la
Neurofibromatosi tipo 1 (NF1).
La NF1 (OMIM: 162200), anche detta Malattia di Von Recklinghause, è una tra le
più comuni malattie autosomiche dominanti con una incidenza di 1 su 2500–3000
nati ed una prevalenza di circa 1 su 4000–5000 individui nella popolazione generale.
Il 50% circa dei casi sono sporadici. E’ una malattia ad espressività molto variabile
(soprattutto interfamiliare) e penetranza quasi completa ed età dipendente (è
completa oltre i 5-6 anni). Il gene malattia, di circa 60 esoni, è localizzato sul
cromosoma 17 (17q11.2) (Fig. 15) e codifica per una proteina, la neurofibromina
(Fig.16), regolatrice della crescita e differenziazione cellulare. Ad oggi si conoscono
oltre 450 mutazioni (delezioni, inserzioni, duplicazioni, sostituzioni nucleotidiche) a
carico del gene NF1 ma senza una reale associazione genotipo-fenotipo, fatta
eccezione per le ampie delezioni associate ad un fenotipo
severo con ritardo mentale e dismorfismi facciali. Nel 2007 M. Upadhyaya et al.
proposero, sull’American Journal of Human Genetics, un’altra importante
correlazione genotipo-fenotipo, ossia la delezione c.2970-2972 delAAT sull’esone 17
del gene NF1 e l’assenza di neurofibromi cutanei. La NF1 è una malattia genetica
multisistemica che si presenta con segni clinici che possono interessare vari organi
(cute, sistema nervoso periferico, scheletrico e cardiovascolare) e con possibili
complicazioni di varia natura e gravità (vascolari, tumorali) che compaiono nel
tempo.
Clinicamente, è caratterizzata da tre tipi di manifestazioni: (1) segni clinici principali
(che si manifestano nella grande maggioranza degli individui affetti e fanno parte dei
criteri diagnostici) : macchie caffè latte (>6), efelidi (lentigginosi) ascellare, inguinale
e/o della base del collo o del tronco, noduli iridei di Lisch e neurofibromi; (2) segni
clinici accessori (presenti in una discreta percentuale di individui affetti, ma non tali
da entrare a far parte dei criteri diagnostici) : macrocefalia, statura al 10°–25°
percentile, anomalie toraciche (pectus excavatum o carenatum), ipertelorismo; (3)
complicanze (variabili e poco frequenti, ma spesso gravi ed invalidanti) : disturbi
cognitivi e dell’apprendimento, neurofibroma plessiforme, scoliosi, displasia delle
ossa lunghe, complicanze neurologiche, ipertensione arteriosa, malformazioni
cardiovascolari.
Fig.14 Test di Risser
Il segno clinico patognominico della NF1 è rappresentato dalle macchie caffè-latte
(Fig.17), primo segno della malattia, di forma variabile, di diametro fra 10 e 30 mm, a
margini netti e di colore uniforme. Compaiono alla nascita o entro il 1° anno d’età e
aumentano di n° e/o dimensioni fino al 5°-6° anno di vita. Sono diffuse a tutta la
superficie corporea, con predilezione per tronco e arti, e risparmio di volto e regioni
palmo-plantari. Sono presenti nel 95% delle persone con NF1. Per costituire un
criterio clinico devono essere almeno 6 e con di diametro superiore a 5 mm prima
della pubertà e oltre il 15 mm in età adulta.
Fig. 15-16 Gene NF1 (17q11.2) e Neurofibromina
Altre manifestazioni cutanee presenti nella NF1 sono:
- lentigginosi nelle aree di frizione cutanea (ascelle e inguine) o freeckling ascellari o
inguinali (Fig. 18) : aree iperpigmentate del tutto simili alle macchie caffè latte ma di
dimensioni inferiori, di 2-3 mm di diametro, presenti alla nascita o che compaiono nei
primi 6-7 anni di vita. Possono localizzarsi anche alla base del collo, sul tronco, a
livello delle zone periorale e perioculare. Sono in genere il secondo segno che
compare, dopo i 2-3 anni, e sono presenti nell’85% delle persone con NF1.
Fig. 17 Macchie caffè latte in una nostra paziente affetta da NF1
- neurofibromi cutanei o sottocutanei (Fig.19) : piccole masserelle molli elastiche
che compaiono in genere alla pubertà, raramente prima dei 7 anni o durante la
gravidanza, il che suggerisce un’influenza ormonale. Possono essere isolati o, più
frequentemente multipli, in alcuni casi molto numerosi; sono tumori benigni dei nervi
periferici e non interessano altri tessuti, ma possono crescere e comprimere i tessuti
circostanti, come il neurofibroma spinale. I neurofibromi sottocutanei costituiscono
un fattore di rischio di presenza di sottostante neuro fibroma plessiforme o di un
tumore maligno della guaina dei nervi periferici il cui acronimo inglese è MPNST
(malignant peripheral nerve sheath tumour). I neurofibromi sono presenti nel 98%
degli adulti con NF1. Per costituire un segno clinico devono essere 2 o più.
Fig. 18 Freckling ascellare ed inguinale in nostre pazienti affette da NF1
Nei pazienti con NF1 possono essere presenti anche i seguenti segni clinici:
- neurofibromi plessiformi (Fig. 20) che sono tumori benigni che però infiltrano non
solo il nervo ma anche i tessuti circostanti causando compressione e modificazioni
dell’anatomia di tessuti ed organi. E’ un segno clinico precoce. E’ presente nel 30%
delle persone con NF1. Anche un solo neurofibroma plessiforme è sufficiente per
essere considerato segno diagnostico.
Fig. 19 Neurofibromi cutanei in nostre pazienti adulte affette da NF1
- noduli iridei di Lisch (Fig. 21): amartomi asintomatici presenti sulla superficie
dell’iride, visibili solo con la “lampada a fessura” come masse tridimensionali
traslucide, punteggiate da cellule contenenti melanina. Compaiono in genere dopo i
5-6 anni. Sono presenti nel 95% delle persone con NF1. Non hanno alcun significato
clinico se non diagnostico quando sono due o più.
- glioma delle vie ottiche: tumore benigno a bassa crescita interessante le vie ottiche
(nervo e talora anche il chiasma ottico) a comparsa entro i primi 10 anni di vita. E’
presente nel 15% dei bambini con NF1 ed individuabile solo con Risonanza
magnetica o TAC cerebrale. Solo nel 2-5% dei casi può dare problemi oculari
(diminuzione della vista, strabismo, protrusione del globo oculare), pubertà precoce
o progredire, e di solito questo succede entro l’età di 6 anni, raramente dopo e
comunque entro i 10 anni.
- displasia scheletrica: anomalia di alcune ossa lunghe (tibia, fibula) che tendono a
rompersi e a non ripararsi, dando luogo ad un aspetto radiologico tipo
“pseudoartrosi”, o dell’osso sfenoide. Sono anomalie già presenti alla nascita ma
infrequenti (5% delle persone con NF1).
Tra le complicanze che si riscontrano più frequentemente nei pazienti con NF1
figurano quelle ortopediche quali:
1) La Scoliosi o cifoscoliosi con curva a piccolo raggio comprendente da 5 a 6
vertebre
2) La Pseudoartrosi congenita di tibia, da molti considerata una manifestazione
tipica della malattia
Il trattamento più appropriato della scoliosi neurofibromatosica è l’artrodesi
immediata, eseguita in qualsiasi età in cui viene diagnosticata la deformità. Il busto
non è efficace per correggere queste curve scoliotiche. La cifoscoliosi evolutiva,
complicata da problemi neurologici compressivi midollari, non costituisce una
indicazione alla laminectomia che potrebbe condurre ad un peggioramento della
paresi e una rapida evoluzione della deformità.
La diagnosi di Neurofibromatosi, ad oggi, è essenzialmente clinica, e si basa sui
criteri diagnostici internazionali NIH, pubblicati nel 1988. La diagnosi di NF1 si pone
in presenza di 2 o più dei seguenti criteri diagnostici (Tab. 3).
Fig. 20-21 Neurofibroma plessiforme e Noduli Iridei di Lisch
La diagnosi clinica, in alcuni casi, può essere confermata dalla diagnosi molecolare
finalizzata all’identificazione delle mutazioni a carico del gene NF1. Può essere
utilizzata la tecnica del Test della Proteina Troncata (PTT) la cui sensibilità è
relativamente elevata in quanto, l’80% circa delle mutazioni NF1 sono da
sfasamento del registro di lettura che comportano appunto una proteina più corta.
Per la sua complessità, tuttavia, il PTT viene limitato ai casi sporadici. La FISH
(Fluorescent In Situ Hibrydization) viene utilizzata per le ampie delezioni (< 10%) e
quando c’è il sospetto clinico di delezione, (fenotipo severo), anche nei casi familiari.
Nei casi familiari si può ricorrere anche all’analisi di linkage. Negli ultimi anni ci si è
molto concentrati su un’altra tecnica per l’identificazione delle mutazioni NF1: la
DHPLC (Denaturing HighPperformance Liquid Chromatography) che risultata in
grado di identificare il maggior numero di mutazioni del gene NF1 rispetto la PTT.
La diagnosi molecolare di NF1, tuttavia, è resa difficile da diversi limiti quali le
dimensioni del gene, differenti tipi di mutazione e la reale assenza di una
correlazione tra tipo di mutazione e decorso clinico della malattia. Fa eccezione la
ricerca delle microdelezioni che sembrano essere associate ad un fenotipo più grave
ed ad un maggiore rischio di tumori. Il ricorso alla diagnosi prenatale, ad oggi, è
limitato dall’imprevedibilità del fenotipo essendo la NF1 una malattia genetica ad
espressione molto variabile, soprattutto interfamiliare.
La varietà dell’espressione clinica, il rischio di tumori e l’imprevedibilità
dell’evoluzione impongono un monitoraggio attento ed un approccio multidisciplinare
dei pazienti con NF1, in cui il genetista rappresenta il “regista” nella gestione
generale del paziente affetto da NF1 e nella valutazione dei parenti e del loro rischio
di ricorrenza, ma sempre in stretta collaborazione con gli altri specialisti, al fine di
garantire ai pazienti affetti un adeguato follow up ed una migliore qualità di vita.
Tab. 3 Criteri diagnostici NIH, 1988
Bibliografia
1) Heary RF, Madhavan K. Genetics of scoliosis. Neurosurgery. 2008 Sep;63 (3
Sup) :222-7.
2) Wick JM, Konze J, Alexander K, Sweeney C. Infantile and juvenile scoliosis: the
crooked path to diagnosis and treatment. AORN J. 2009 Sep;90 (3) :347-76.
3) Malfair D, Flemming AK, Dvorak MF, Munk PL, Vertinsky AT, Heran MK, Graeb
DA. Radiographic evaluation of scoliosis: review. AJR Am J Roentgenol. 2010
Mar;194 (3 Suppl) :S8-22.
4) Iris Busscher, Frits Hein Wapstra, Albert G Veldhuizen. Predicting growth and
curve progression in the individual patient with adolescent idiopathic scoliosis:
design of a prospective longitudinal cohort study. BMC Musculoskeletal Disorders
2010, 11:93
5) Weinstein SL, Dolan LA, Cheng JC, Danielsson A, Morcuende JA. Adolescent
idiopathic scoliosis. Lancet. 2008 May 3;371 (9623) :1527-37.
6) Yong F, Wong HK, Chow KY Prevalence of adolescent idiopathic scoliosis among
female school children in Singapore. Ann Acad Med Singapore. 2009 Dec;38 (12)
:1056-63
7) Parent S, Newton PO, Wenger DR. Adolescent idiopathic scoliosis: etiology,
anatomy, natural history, and bracing. Instr Course Lect 2005; 54: 529–36
8) Glancy GL. Advances in idiopathic scoliosis in children and adolescents. Adv
Pediatr. 2007;54:55-66
9) Allen DB (1996) Safety of human growth hormone therapy: current topics. J
Pediatr 128:S8–S13
10) Ono A, Ueyama K, Okada A, Echigoya N, Yokoyama T, Harata S (2002) Adult
scoliosis in syringomyelia associated with Chiari I malformation. Spine 27:E23–E28
11) Thillard MJ (1959) Deformation de la colonne vertebrale consecutives a
l’epiphysectomie chez le poussin. C Rend Acad SC 248:1238–1240
12) Machida M, Dubousset J, Imamura Y, Iwaya T, Yamada T, Kimura J (1993) An
experimental study in chickens for the pathogenesis of AIS. Spine 18:1609–1615
13) Man GC, Wang WW, Yeung BH, Lee SK, Ng BK, Hung WY, Wong JH, Ng TB,
Qiu Y, Cheng JC. Abnormal proliferation and differentiation of osteoblasts from girls
with adolescent idiopathic scoliosis to melatonin. J Pineal Res. 2010 Aug;49 (1)
:69-77. Epub 2010 May 27
14) Morcuende JA, Minhas R, Dolan L, et al. Allelic variants of human melatonin 1A
receptor in patients with familial adolescent idiopathic scoliosis. Spine 2003; 28:
2025–28
15) Bagnall KM, Raso VJ, Hill DL, et al. Melatonin: a possible role in idiopathic
scoliosis. Spine 1996;21:1974–8
16) Machida M, Dubousset J, Imamura Y, Iwaya T, Yamada T, Kimura J (1995) Role
of melatonin deficiency in the development of scoliosis in pinealectomised chickens.
J Bone Joint Surg [Br] 77:134–138
17) Cheung KM, Lu DS, Poon AM, Wang T, Luk KD, Leong JC (2003) Effect of
melatonin suppression on scoliosis development in chickens by either constant light
or surgical pinealectomy. Spine 28:1941–1944
18) Carr AJ (1990) Adolescent AIS in identical twins. J Bone Joint Surg [Br] 72:1077
19) Kesling KL, Reinker KA (1997) Scoliosis in twins: a meta-analysis of the
literature and report of six cases. Spine 22:2009–2014
20) Miller NH, Justice CM, Marosy B, Zhang J, Wilson AF. Familial idiopathic
scoliosis: evidence of autosomal susceptibility loci. Paper presented at the 38th
Annual meeting of the Scoliosis Research Society Sept 10–13, 2003; Quebec,
Canada
21) Justice CM, Miller NH, Marosy B, Zhang J, Wilson AF. Familial idiopathic
scoliosis: evidence of an X-linked susceptibility locus. Spine 2003; 28: 589–94
22) Justice CM, Miller NH, Marosy B, Zhang J, Wilson AF (2003) Familial AIS:
evidence of an X-linked susceptibility locus. Spine 28:589–594
23) Wise CA, Barnes R, Gillum J, Herring JA, Bowcock AM, Lovett M (2000)
Localization of susceptibility to familial AIS. Spine 25:2372–2380
24) Cowell HR, Hall JN, Mac Ewen GD: Genetic Aspects of idiopathic scoliosis. Clin
Orthop 1972, 86:121.
25) Czeizel A, Bellyei A, Barta O, Magda T, Molnar L (1978) Genetics of adolescent
AIS. J Med Genet 15:424–427
26) Wynne-Davies R (1968) Familial (idiopathic) scoliosis. A family survey. J Bone
Joint Surg [Br] 50:24–30
27) Ward K, Ogilvie J, Argyle V, Nelson L, Meade M, Braun J, Chettier R. Polygenic
inheritance of adolescent idiopathic scoliosis: a study of extended families in Utah.
Am J Med Genet A. 2010 May;152A (5) :1178-88
28) Fendri K, Patten S, Zaouter C, Parent S, Kaufman G, Labelle H, Edery P,
Moldovan F. Recent advances in the study of candidate genes for adolescent
idiopathic scoliosis. Stud Health Technol Inform. 2010;158:3-7
29) Cohen DS, Solomons CS, Lowe TG (1985) Altered platelet calmodulin activity in
AIS. Orthop Trans 9:106
30) Salehi LB, Mangino M, De Serio S et al (2002) Assignment of a locus for
autosomal dominant AIS (IS) to human chromosome. 17p11. Hum Genet
111:401–404
31) Alden KJ, Marosy B, Nzegwu N, Justice CM, Wilson Alexander F, Miller Nancy H
(2006) Idiopathic scoliosis: identification of candidate regions on chromosome
19p13. Spine 31 (16) :1815–1811
32) Chan V, Fong GCY, Luk KDK, Yip B, Lee MK, Wong MS et al (2002) A genetic
locus for adolescent AIS linked to chromosome 19p13.3. Am J Hum Genet
71:401–406
33) Montanaro L, Parisini P, Greggi T, Di Silvestre M, Campoccia D, Rizzi S, Arciola
CR. Evidence of a linkage between matrilin-1 gene (MATN1) and idiopathic scoliosis.
Scoliosis. 2006 Dec 18;1:21
34) Chen Z, Tang NL, Cao X, Qiao D, Yi L, Cheng JC, Qiu Y. Promoter
polymorphism of matrilin-1 gene predisposes to adolescent idiopathic scoliosis in a
Chinese population. Eur J Hum Genet. 2009 Apr;17 (4) :525-32. Epub 2008 Nov 5
35) Wu J, Qiu Y, Zhang Le, Sun Q, Qiu X, He Y (2006) Association of estrogen
receptor gene polymorphisms with susceptibility to adolescent idiopathic scoliosis.
Spine 31 (10) :1131–1136
36) Tang NL, Yeung HY, Lee KM, et al. A relook into the association of the estrogen
receptor [alpha] gene (PvuII, XbaI) and adolescent idiopathic scoliosis: a study of
540 Chinese cases. Spine 2006; 31: 2463–68
37) Hadley-Miller N, Mims B, Milewicz DM (1994) The potential role of the elastic
fiber system in adolescent AIS. J Bone Joint Surg [Am] 76:1193–1206
38) Pedrini VA, Ponseti IV, Dohrman SC (1973) Glycosaminoglycans of
Home page
intervertebral disc in AIS. J Lab Clin Med 82:938–950
39) Zhu F, Qui Y, Han HY (2006) Histomorphometric study of the spinal growth
plates in idiopathic scoliosis and congenital scoliosis. Paediatr Int 48 (6) :591–598
40) Spencer GS, Eccles MJ (1976) Spinal muscle in scoliosis. The proportion and
size of type 1 and type 2 skeletal muscle fibres measured using a computercontrolled microscope. J Neurol Sci 30:143–154
41) Glard Y, Pomero V, Collignon P, Skalli W, Jouve JL, Bollini G. Sagittal balance in
scoliosis associated with Marfan syndrome: a stereoradiographic three-dimensional
analysis. J Child Orthop. 2008 Mar;2 (2) :113-8. Epub 2008 Feb 23
42) Smith RM, Pool RD, Butt WP, Dickson RA (1991) The transverse plane deformity
of structural scoliosis. Spine 16:1126–1129
43) Wajchenberg M, Lazar M, Cavaçana N, Martins DE, Licinio L, Puertas EB,
Landim E, Zatz M, Ishida A.Genetic aspects of adolescent idiopathic scoliosis in a
family with multiple affected members: a research article. Scoliosis. 2010 Apr 7;5:7
44) Iris Busscher, Frits Hein Wapstra, Albert G Veldhuizen. Predicting growth and
curve progression in the individual patient with adolescent idiopathic scoliosis:
design of a prospective longitudinal cohort study. BMC Musculoskeletal Disorders
2010, 11:93
45) Weinstein SL, Dolan LA, Cheng JC, Danielsson A, Morcuende JA. Adolescent
idiopathic scoliosis. Lancet. 2008 May 3;371 (9623) :1527-37.
46) Bruyneel AV, Chavet P, Ebermeyer E, Mesure S. Idiopathic scoliosis: relations
between the Cobb angle and the dynamical strategies when sitting on a seesaw. Eur
Spine J. 2010 Sep 19
47) Lonner BS, Auerbach JD, Sponseller P, Rajadhyaksha AD, Newton PO.
Variations in pelvic and other sagittal spinal parameters as a function of race in
adolescent idiopathic scoliosis. Spine (Phila Pa 1976). 2010 May 1;35 (10) :E374-7
48) Giovanna Elisa Calabrò, Maria Concetta Cutrupi, Annamaria Salpietro, Valeria
Ferraù, Caterina Munafò, Romina Gallizzi, Silvana Briuglia.. Neurofibromatosis type
1: genetic and clinical aspects. Italian Journal of Genetic and Pediatric Immunology.
Ann II, num.1, gennaio 2010
49) Calvieri s. e Giustini S. Neurofibromatosi di tipo 1. Piccin editore. 2004
50) M. Upadhyaya et al. An Absence of Cutaneous Neurofibromas Associated with a
3-bp Inframe Deletion in Exon 17 of the NF1 Gene (c.2970-2972 delAAT) : Evidence
of a Clinically Significant NF1 Genotype-Phenotype Correlation. Am. J. Hum. Genet.
2007;80:140–151.
51) Rosalie E Ferner. Neurofibromatosis . European Journal of Human Genetics
(2007) 15, 131–138
52) National Institutes of Health Consensus Development Conference Statement:
Neurofibromatosis. Arch Neurol (Chicago) 1988; 45: 575– 578
53) E. Buteica et al. Genetic and clinical considerations in six cases with
neurofibromatosis type 1. Romanian Journal of Morphology and Embryology 2007,
48 (3) :243–248
54) Dugoff L, Sujansky E: Neurofibromatosis type 1 and pregnancy. Am J Med
Genet 1996; 66: 7– 10
55) Huson SM, Harper PS, Compston DAS: Von Recklinghausen neurofibromatosis:
clinical and population study in South East Wales. Brain 1988; 111: 55– 81
56) Steven L. Carroll and Nancy Ratner. How Does the Schwann Cell Lineage Form
Tumors in NF1? Glia. 2008 November 1; 56 (14) : 1590–1605
57) Hagel C, Zils U, Peiper M, Kluwe L, Gotthard S, Friedrich RE, Zurakowski D, von
DA, Mautner VF. Histopathology and clinical outcome of NF1-associated vs. sporadic
malignant peripheral nerve sheath tumors. J Neurooncol 2007;82:187–192.
58) S. Pinson. Neurofibromatosis type I. Orphanet encyclopedia. May 2002
59) Bajenaru ML, Garbow JR, Perry A et al: Natural history of neurofibromatosis
1-associated optic nerve glioma in mice. Ann Neurol 2005; 57: 119–127.
60) Karl McKeever et al. An epidemiological, clinical and genetic survey of
Neurofibromatosis type 1 in children under sixteen years of age. Ulster Med J 2008;
61) National Institutes of Health Consensus Development Conference Statement:
Neurofibromatosis. Arch Neurol (Chicago) 1988; 45: 575– 578
1 2 3 4 5 6 7 8 9 10
◀ Indietro pagina 4 Avanti ►
Scarica l'articolo: pagina 4.pdf
Sommario 10 pagine
Direttore scientifico
Trimestrale di divulgazione scientifica dell'Associazione Pediatrica di Immunologia e Genetica
Legge 7 marzo 2001, n. 62 - Registro della Stampa Tribunale di Messina n. 3/09 - 11 maggio 2009
Carmelo Salpietro - Direttore responsabile
Giuseppe Micali - Segreteria redazione
Basilia Piraino - Piera Vicchio
Direzione-Redazione: UOC Genetica e Immunologia Pediatrica - AOU Policlicnico Messina