Comunicazione cellulare
1) Se le cellule sono in contatto diretto tra loro, esse possono
comunicare attraverso l’interazione tra una molecola di
superficie di una cellula e recettori presenti sulla superficie
delle cellule adiacenti (comunicazione cellula-cellula).
2) Se le cellule sono distanti, una cellula può rilasciare segnali
chimici che vengono poi riconosciuti da recettori presenti
sulla superficie di altre cellule
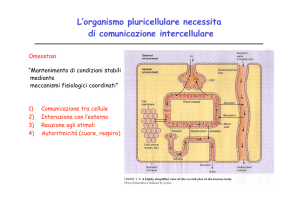
Esistono due meccanismi fondamentali di comunicazione
cellulare, in cui la trasmissione del segnale avviene per
interazione tra molecole e recettori.
1) Le cellule nervose comunicano tra loro e con altri tipi di
cellule attraverso modificazioni elettrochimiche delle loro
membrane. L’arrivo di un potenziale di azione a una sinapsi
provoca il rilascio di neurotrasmettitori che, a loro volta, si
legano a recettori sulla membrana della cellula postsinaptica
alla quale è trasmesso il segnale.
2) In un secondo meccanismo di comunicazione intercellulare
la trasmissione del segnale è regolata da messaggeri chimici i
cui recettori si trovano sulle membrane di cellule che
possono essere anche molto distanti dalla cellula che secerne
la molecola di regolazione
Esistono diverse molecole che funzionano come
MESSAGGERI CHIMICI, trasmettendo
segnali da cellula a cellula:
1) ORMONI
2) FATTORI DI CRESCITA
La capacità delle cellule di trasformare una
interazione recettore/ligando in una
modifica funzionale o di espressione genica
è detta TRASDUZIONE DEL SEGNALE
I messaggeri sono:
• Amminoacidi
• Peptidi
• Proteine
• Acidi grassi
• Lipidi
• Nucleosidi o nucleotidi
I messaggeri di natura idrofila si legano a
uno o più recettori specifici sulla cellula
bersaglio.
I messaggeri di natura idrofobica agiscono su
recettori nucleari o citosolici la cui funzione è
quella di regolare l’espressione di geni
specifici (Es: ormoni steroidei, retinoidi)
La capacità del recettore di distinguere il suo ligando
specifico tra migliaia di altre molecole dipende dalla
combinazione di due caratteristiche del sito di legame:
1) La FORMA
2) La POSIZIONE strategica delle catene laterali di aa al
suo interno
AFFINITA’ DEL RECETTORE
Il rapporto tra la concentrazione del ligando in
soluzione e il numero di molecole di recettore
occupate costituisce una descrizione qualitativa
dell’affinità del recettore.
Se a basse concentrazioni di ligando, tutto il
recettore è occupato possiamo affermare che il
recettore ha un’alta affinità per il ligando e
viceversa.
L’affinità del recettore può
quantitativamente in termini di:
essere
descritta
Kd= costante di dissociazione
è la concentrazione di ligando libera necessaria a
saturare la metà dei siti di legame del recettore (10–410 –9 mM).
Dunque Kd esprime la concentrazione di ligando in
grado di indurre una data risposta cellulare.
(i recettori con affinità alta per i loro ligandi → Kd
molto bassa)
Down-regolazione del recettore
Sebbene ogni recettore abbia una caratteristica affinità
per il proprio ligando, i recettori rispondono non tanto a
una determinata concentrazione del ligando ma piuttosto
a variazioni della sua concentrazione.
Quando la presenza del ligando e l’occupazione dei
recettori persistono per un certo periodo di tempo, la
cellula va incontro a un processo di adattamento e cioè
si desensibilizza e non risponde più al ligando. A questo
punto, per ristimolare la cellula, è necessario che la
concentrazione del ligando aumenti.
La
down-regolazione
recettore è dovuta:
(desensibilizzazione)
del
1) Modifiche del recettore che ne riducono l’affinità
per il ligando
2) Modifiche del recettore che ne abbassano la
capacità di indurre modificazioni di alcune
funzioni cellulari
La desensibilizzazione del recettore è anche la base
del fenomeno della tolleranza.
I recettori possono essere classificati in
diverse categorie a seconda della loro
modalità di azione:
• CANALI IONICI LIGANDO-DIPENDENTI
• RECETTORI INTRACELLULARI
• RECETTORI SULLA MEMBRANA
PLASMATICA
•Recettori associati a Proteine G
•Recettori associati a PK
Proteine G proteina che lega un nucletide guanina
1) Proteine G grandi eterotrimeriche, costituite
da 3 subunità (Gα, Gβ, Gγ)
2) Proteine G piccole monomeriche, es. la
proteina RAS
Gs= stimolatori della trasduzione del segnale
Gi= inibitori della trasduzione del segnale
Il recettore per un dato ligando può esistere in diverse
isoforme, che hanno differenti affinità per il ligando
come pure per una particolare proteina G.
Diverse isoforme di un recettore possono coesistere
nella stessa membrana o possono trovarsi sulla
membrana di diversi tipi di cellule bersaglio.
• Le più diffuse proteine G inducono il rilascio
e la produzione dei II messaggeri ( cAMPioni calcio)
cAMP
Proteine G e cAMP
La fosfodiesterasi assicura che la
trasduzione del segnale venga
prontamente interrotta quando si abbassa
la concentrazione extracellulare del
ligando.
PKA, proteina
chinasi A
Catalizza la fosforilazione
di diversi substrati
La PKA fosforila una serie di proteine cellulari,
trasferendo un gruppo fosfato da una molecola
di ATP a una serina o una treonina presente nel
sito di fosforilazione della proteina.
L’aumento dei livelli di cAMP può avere diversi effetti:
Ad alte concentrazioni di cAMP
nel muscolo scheletrico o nel fegato viene attivato il catabolismo
del glicogeno;
nel muscolo cardiaco un innalzamento dei livelli di cAMP fa
aumentare le contrazioni cardiache;
nel muscolo liscio, al contrario, la contrazione muscolare viene
inibita, favorendone il rilassamento;
nelle piastrine ne impedisce la mobilizzazione durante la
coagulazione del sangue;
nelle cellule epiteliali dell’intestino causa la secrezione di sali e
acqua nel lume intestinale.
Inibitori della fosfodiesterasi: metilxantine Caffeina e Teofillina
Il malfunzionamento della trasduzione del
segnale mediata da proteine G causa gravi
patologie nell’uomo.
La tossina colerica ha un dominio enzimatico in
grado di modificare chimicamente la proteina
Gs, rendendola incapace di idrolizzare il GTP in
GDP. Gs non si spegne, i livelli di cAMP
rimangono alti e le cellule intestinali
continuano a secernere grosse quantità di
acqua e sali.
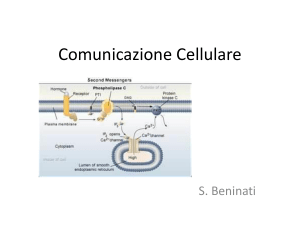
Molte proteine G utilizzano come
secondi messageri inositolo trifosfato
e diacilglicerolo.
’80 Berridge
Proteine G e
IP3-DAG
FURA-2
(indicatore del
calcio)
Cellula di surrene
non stimolata
Cellula di surrene
stimolata da
angiotensina
Gli ioni calcio hanno un ruolo essenziale nella
regolazione di un gran numero di funzioni
cellulari. La regolazione è basata su variazioni
della concentrazione del calcio nel citosol in
risposta a segnali esterni.
Nello stato di riposo, la concentrazione citosolica
del calcio è intorno a 1x10-4 mM; nei fluidi
extracellulari e nel sangue è circa 1,2 mM.
DIVERSI MECCANISMI DI REGOLAZIONE DEL Ca++
(4)
(3)
(6)
m.cardiaco,m.scheletrico,
(7) neuroni.
(2)
(5)
(1)
In alcuni casi il calcio modifica l’attività delle
proteine legandosi direttamente ad alcune di
queste; più frequentemente, però, svolge la sua
funzione attraverso la calmodulina.
Quando un determinato stimolo fa aumentare la
concentrazione citosolica del calcio (da 10-4 a 10-3mM),
questo si lega alla calmodulina.
La maggior parte delle proteine che legano la
calmodulina sono enzimi della classe delle proteine
chinasi e proteine fosfatasi. La risposta indotta in una
cellula bersaglio da un aumento della concentrazione
di calcio dipende dalle proteine in grado di legare la
calmodulina presenti in quella cellula.
L’ossido nitrico (NO) è una importante molecola
segnale del sistema cardiovascolare.
L’NO accoppia la stimolazione di recettori
associati a proteine G sulle cellule endoteliali al
rilassamento della muscolatura liscia dei vasi
sanguigni.
L’ossido nitrico è una molecola di gas tossica
con emivita breve, prodotta dalla conversione
dell’aa arginina a NO e citrullina ad opera
dell’enzima NO sintetasi.
REGOLAZIONE PARACRINA
Furchgott,
Ignarro, Murad
Nobel 1998
Il meccanismo per cui la stimolazione delle
cellule endoteliali da parte dell’acetilcolina
induce il rilassamento della muscolatura liscia
spiega anche il meccanismo di azione di una
sostanza chimica, la nitroglicerina. Questa
sostanza viene somministrata a pazienti con
angina allo scopo di ridurre la costrizione delle
arterie coronariche.