Patologia generale – prof. Ezio Laconi
Valeria Piredda
Lezione 21 – 20/11/2012 – Parte 1
Abbiamo già sottolineato il tema delle metastasi (che riprenderemo quando parleremo delle
diverse fasi del processo neoplastico), che sono la componente che domina nel quadro clinico una
volta che vengono individuate: la patologia locale (o primaria) può essere un problema anche
abbastanza serio, ma molto meno di quanto lo possano essere le lesioni metastatiche.
Spesso si tratta di un’evoluzione della popolazione cellulare neoplastica con caratteristiche che
possono essere più aggressive dal punto di vista della capacità e della rapidità di crescita, della
possibilità di un’ulteriore diffusione a distanza: si possono determinare delle metastasi secondarie,
ulteriori, che non partono dalla neoplasia primaria ma dalle lesioni metastatiche. Spesso non c’è il
tempo perché tutto questo avvenga, perché la progressione neoplastica può portare a sintomi
gravi dal punto di vista clinico, ed intervenendo si spera che la terapia sia efficace, anche se
purtroppo non sempre questo succede.
Il problema neoplasie è ancora intatto dal punto di vista dell’impatto che ha sulla mortalità nella
specie umana, nonostante si stia lavorando da molti decenni su questo problema. Questa è
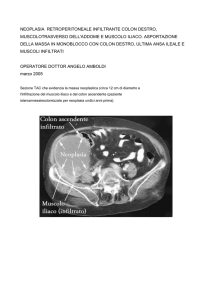
l’immagine di una lesione metastatica dal punto di vista istologico, una metastasi di una neoplasia
epiteliale nel polmone, potete vedere come la parte centrale sia diversa, in quanto necrotica.
L’immagine ci indica che abbiamo una crescita espansiva, cioè questa cellule si sovrappongono le
une alle altre fino al punto in cui raggiungono una determinata dimensione (parliamo di 1 o 2
mm); la parte centrale di questa lesione inizia ad entrare in sofferenza, per il semplice motivo che
non gli arriva più abbastanza nutrimento. Di conseguenza spesso abbiamo delle cellule che al
centro di queste formazioni combattono la loro battaglia per ricavare ossigeno a materiali
nutritivi a sufficienza.
Quello neoplastico è un tessuto in cui questi processi avvengono continuamente, cioè si verifica la
selezione di elementi cellulari che hanno un fenotipo sempre più resistente a condizioni
ambientali che sarebbero proibitive per le cellule normali, in confronto alle quali hanno delle
caratteristiche di sopravvivenza superiori. Queste cellule hanno infatti più risorse delle altre
cellule perché vivono situazioni più difficili, soprattutto dal punto di vista dell’apporto
dell’ossigeno e delle sostanze nutritive, della necrosi, dell’infiammazione, tutte condizioni che
sono caratteristiche delle neoplasie solide (ma non solo) : per questa serie di motivi diventa un
grosso problema combatterle.
Carcinoma of the lung. It is a bulky mass that extends into surrounding lung
parenchyma.
Quest’immagine ci aiuta invece a caratterizzare il concetto della eterogeneità: vediamo una
neoplasia maligna in cui non c’è una cellula che sia uguale all’altra (questo non significa che le
cellule di un tessuto normale siano identiche tra loro, infatti anche queste presentano delle
differenze (pur molto contenute), ad esempio in termini di Dna: con il metodo di sequenziamento
del
genoma siamo stati capaci di averne riscontro). In questo caso abbiamo una grande
eterogeneità: dal processo di divisione di una cellula madre hanno origine due cellule figlie che
non sono né identiche ad essa né tra di loro. La diversità delle cellule deve essere considerata in
ambito terapeutico, perlomeno dal punto di vista teorico, cioè nella fase di elaborazione delle
strategie che ci possono aiutare a curare queste patologie, in modo da tener conto che ci troviamo
davanti ad una popolazione di cellule eterogenea.
In questa diapositiva ci sono delle figure mitotiche che sono una delle caratteristiche della
patologia neoplastica, anche se non è vero che i tessuti neoplastici proliferano come regola più dei
tessuti normali. Infatti ci sono tessuti normali che si replicano a velocità comparabili se non
superiori a quelle dei tessuti neoplastici: il nostro organismo è in grado di produrre circa 2 milioni
di globuli rossi al secondo, che è una velocità supersonica. Nessuno dei tessuti neoplastici è in
grado di fare ciò, la loro prerogativa è quella di avere una crescita sregolata. Un’altra
caratteristica è quella di avere delle figure mitotiche spesso anomale: si possono individuare nuclei
di diverse dimensioni, aumentati di volume rispetto al citoplasma, caratteristica che si riscontra
molto frequentemente. Le cellule sono molto addossate tra loro, presentano dei nuclei molto chiari
con nucleoli prominenti, ed in generale sono molto diverse le une dalle altre.
Qui vedete delle mitosi anomale, addirittura una mitosi tripolare, questo significa che molto
probabilmente da quell’evento risulteranno tre cellule e non due, ed è possibile che tutte quante
non siano compatibili con la sopravvivenza, cioè una, due o tutte quante potrebbero andare
incontro a morte dopo la divisione mitotica. Il fatto che queste cellule siano così sregolate dal
punto di vista della loro crescita, ovviamente le espone al rischio di perdita cellulare: il tessuto
neoplastico non è un tessuto che cresce in maniera florida, coordinata.
Ci sono delle situazioni in cui siamo costretti a fare la stadiazione dei tumori, un processo che ci
serve quando facciamo degli studi sulla patologia neoplastica: se per esempio vogliamo misurare
l’effetto di una terapia antineoplastica è evidente che non lo possiamo misurare su un singolo
paziente, ma occorre un gruppo consistente di persone trattate con una terapia di nuova
applicazione, il cui effetto può essere confrontato con quello di un’altra, preesistente ed eseguita
fino ad allora. Possiamo così confrontare due gruppi di pazienti di cui uno viene trattato con la
nuova terapia, l’altro con la vecchia, allo scopo di confrontare i risultati: per fare ciò dobbiamo
prendere dei pazienti che siano il più omogenei possibile, che si trovino più o meno tutti allo
stesso stadio. Un’alternativa sarebbe creare due gruppi in ciascuno dei quali ci siano dei pazienti
in stadio iniziale, in stadio intermedio e in stadio terminale e osservare i benefici della terapia
nuova (applicata al primo gruppo) in rapporto a quelli ottenuti dalla terapia preesistente
(applicata al secondo gruppo).
Per conoscere in quale stadio della malattia si trovano i pazienti abbiamo bisogno della
stadiazione, che si basa su criteri il più obiettivi possibile, quindi più facilmente misurabili in
modo tale che il medico possa fondare sui risultati ottenuti le sue decisioni future. Per questo
prima di poter definire una terapia più efficace rispetto ad un’altra ci si deve accertare di avere a
che fare con pazienti comparabili dal punto di vista dello stadio clinico, in modo tale che i numeri
dei pazienti che hanno tratto beneficio da una cura piuttosto che dall’altra sia un dato certo e
fondato.
Attualmente si sta cercando di sviluppare delle terapie personalizzate in campo neoplastico,
perché si parte dal presupposto che ogni neoplasia sia una storia a sé: per questo non è semplice
raggruppare molte neoplasie definendole tutte uguali per poi confrontarle ad altri gruppi di
neoplasie anch’esse considerate tutte uguali tra loro. Queste complicate operazioni sono però
quelle su cui basiamo i risultati clinici, le terapie che stiamo attualmente utilizzando e anche
quelle che applicheremo in futuro: un medico è tenuto a sapere che gli studi sono basati su questo
approccio, che ha indiscutibilmente i suoi limiti, ma ci serve appunto per stadiare quanto più
precisamente i tumori e capire, a seconda dello stadio in cui si trova il paziente, che tipo di terapia
deve essere applicata. Infatti anche nell’ambito dello stesso tipo di neoplasia,a seconda dello stadio
in cui si trova( es. iniziale/terminale) posso avere la necessità di un tipo differente di terapia.
Staging of Malignant Neoplasms
Stag
e
Definition
Tis
In situ, non-invasive (confined to epithelium)
T1
Small, minimally invasive within primary organ site
T2
N0
Larger, more invasive within the primary organ site
Larger and/or invasive beyond margins of primary
organ site
Very large and/or very invasive, spread to adjacent
organs
No lymph node involvement
N1
Regional lymph node involvement
N2
Extensive regional lymph node involvement
N3
More distant lymph node involvement
M0
No distant metastases
M1
Distant metastases present
T3
T4
In questa tabella ci sono degli importanti fattori di riferimento nella pratica quotidiana, non
semplici da ricavare. T si riferisce alla neoplasia primaria, N al coinvolgimento dei linfonodi, M
alla presenza o meno di metastasi. Cominciamo da Tis, carcinoma in situ: espressione usata
soprattutto per neoplasie di un epitelio di rivestimento in cui è facile stabilire se la neoplasia non
ha sconfinato la membrana basale e quindi è ancora in situ, oppure no, mentre è più difficile da
utilizzare per altri tipi di neoplasie.
Poi si passa a T1, T2, T3 O T4 a seconda dell’organo, quindi della sede. Il criterio può essere quello
della grandezza, cioè una quanto una neoplasia avanza, ma sono importanti anche la
localizzazione e la molteplicità. Ad esempio nell’intestino T1,2,3,4 sono legati al grado di
invasione della parete intestinale, più il tumore ha invaso gli strati sottostanti più si avanza come
T. Per una neoplasia al polmone, al fegato o al pancreas contano la grandezza, la molteplicità e la
localizzazione.
A N0 siamo in uno stadio senza linfonodi coinvolti, a N1 cominciano ad esserlo i linfonodi
regionali, a N2 abbiamo un coinvolgimento esteso dei linfonodi regionali a N3 una metastasi
presente a distanza.
M0 indica che non c’è metastasi, mentre a M1 questa è presente.
Dal punto di vista della biologia del tumore la localizzazione linfonodale si può già considerare
metastasi: nel caso in cui le cellule si siano già spostate dalla sede primitiva alla prima stazione
linfonodale si tratta già di una neoplasia che si è diffusa a distanza. Si comincia a parlare di
metastasi del linfonodo (o di qualunque altro organo) quando le cellule cominciano a crescere al
suo interno.
Le metastasi si possono diffondere per via ematica o linfatica o anche per altre vie, e ovviamente i
linfonodi in cui le cellule possono essere trovate sono quelli tributari del territorio da cui proviene
la cellula che ha dato origine al processo (che vi sarà arrivata ovviamente tramite il circolo
linfatico)
Mentre lo staging si rifà alla classificazione TNM, il grading si riferisce invece ad un altro
parametro, più che altro morfologico: indica quanto la neoplasia è differenziata. Qui ci tengo a
precisare che quando parliamo di una neoplasia ben differenziata non significa che questa sia
“più neoplasia” di una non differenziata, ma che è più simile al tessuto di origine: questo è un
elemento prognostico positivo, perché significa che si è allontanata meno dal tessuto da cui si è
originata, presentando una struttura simile ad esso. Man mano che la neoplasia si differenzia
dalle caratteristiche strutturali del tessuto di origine perde queste caratteristiche e viene definita
moderatamente, scarsamente o del tutto indifferenziata. In questo caso posso definirla con il
termine anaplastica, che significa che le cellule non hanno più nessuna somiglianza col tessuto di
partenza. Le cellule neoplastiche hanno perso qualsiasi tipo di riferimento, stanno andando in una
direzione che non esiste, quindi possono andare a parare ovunque, compreso il fatto che si
allontanano dalle caratteristiche originarie.
L’entità della neoplasia sta a indicare di che patologia parliamo dal punto di vista quantitativo, ci
informa sulle dimensioni del problema che stiamo affrontando.
I numeri sono relativi a delle statistiche effettuate negli Stati Uniti, che sono ritenute più precise,
tuttavia anche negli altri Paesi occidentali sono abbastanza omogenee, pur con le variazioni sul
tema. Analizzando il numero di morti totali si riscontra che il cancro rappresenta la seconda causa
di morte in assoluto nei Paesi occidentali, con 1 individuo su 4
che muore di patologia
neoplastica. Quindi il cancro non è una patologia rara, ma questo dato si contrappone al fatto che
spesso viene considerato come il risultato di eventi rari, di mutazioni: c’è una contraddizione
apparente, ci si potrebbe chiedere come degli eventi poco frequenti siano a capo di patologie così
comuni. Le patologie cardiovascolari rappresentano la prima causa di morte, ma se andiamo a
considerare le diverse età il cancro diventa la prima causa di morte dopo i quarant’anni e lo
rimane fino agli ottanta. Quindi il cancro è la prima causa di morte nella classi di età in cui si
muore più spesso.
Dai 40 ai 59 anni muoiono 54mila maschi e 50mila femmine, tra i 60 e i 79 anni questo numero
si triplica per i maschi e raddoppia nelle femmine. La categoria in cui di gran lunga si muore di
più per cancro è quella compresa tra i 60 e gli 80 anni. I dati della tabella ci indicano che
l’incidenza dei tumori aumenta con l’età, tra una fascia d’età e l’altra parliamo addirittura di
diversi ordini di grandezza.
Il discorso che faremo sulla patologia neoplastica , sia dal punto di vista eziologico che della
patogenesi, riguarda i tumori che si sviluppano dopo i 40-50 anni, perché di quelli che insorgono
prima non sappiamo praticamente niente. Le informazioni che abbiamo a disposizione riguardano
i tumori che si sviluppano in età avanzata.
Per quanto riguarda la probabilità di sviluppare una neoplasia nel corso della vita, se
consideriamo tutti gli organi messi insieme, nel sesso maschile si avvicina a 1 su 2: il 50% dei
maschi potrebbe avere una diagnosi di patologia neoplastica; nel sesso femminile c’è una
probabilità superiore a 1 su 3.
C’è un sproporzione tra quelli che vengono diagnosticati e quelli che muoiono di patologia
neoplastica, per le semplice ragione legata al fatto che non tutti quelli che sviluppano la patologia
vanno incontro a morte: ad esempio il carcinoma basocellulare (o basialioma), un tumore che si
presenta con un’alterazione morfologica della cute, è compatibile con la sopravvivenza del
paziente, sia perché poco invasivo, sia perché ci accorgiamo subito di esso. Se un tumore uguale si
sviluppa nel fegato o nel pancreas quando ce ne accorgiamo in genere è troppo tardi, perché la
patologia neoplastica non dà segno di sé, non c’è nessun sintomo a meno che le nostre cellule che
crescono all’interno di un organo non diano delle complicazioni dal punto di vista meccanico,
come la compressione di un nervo o di un vaso.
Per incidenza di una patologia neoplastica si intende il numero di soggetti che arrivano
all’osservazione da parte del medico, ci sono però degli altri tumori che non vengono
diagnosticati, di cui non ci accorgiamo mai: si può morire di altre cause senza sapere di avere un
tumore.
Ci sono degli studi che affermano che dopo i 60-70 anni i tumori alla prostata, alla mammella,
alla tiroide, sono frequentissimi: hanno un’incidenza reale (che considera tutti i casi, non solo
quelli che arrivano all’osservazione del medico) per singolo tessuto che supera il 50-60%. Tutti
questi dati ci portano a considerare il cancro come un patologia che è insita, siamo fatti in
maniera tale da essere molto suscettibili.
Questo è un grafico che mostra le curve di incidenza e di mortalità per cancro negli anni tra il
1975 e il 2005. Il primo dato che possiamo ricavarne è che l’incidenza è circa doppia rispetto alla
mortalità, in entrambi i sessi. Non tutti quelli che sviluppano neoplasie muoiono a causa di esse.
Inoltre a parità di età il sesso maschile sviluppa più facilmente neoplasie rispetto al sesso
femminile.
Nel corso degli anni l’incidenza subisce una variazione, a differenza della mortalità. Nei primi
anni ’90 si riscontra un aumento dell’incidenza dei tumori nel sesso maschile seguito da una
riduzione a livelli notevoli. Possiamo fare delle ipotesi ragionevoli per spiegare questo fenomeno:
la spiegazione più plausibile è che questo aumento di incidenza sia legato all’introduzione di
metodiche di screening per il cancro della prostata. L’aumento è molto rapido perché uno
screening di massa riesce a registrare un numero di casi
molto elevato; la diminuzione è
altrettanto rapida perché dopo aver scoperto in un breve arco di tempo un gran numero di casi,
da quel momento in poi incomincerò a scoprirne di nuovi.
I primi anni scoprirò quelli in più, cioè se in precedenza il mio limite di evidenziazione della
neoplasia era 5cm, e con il nuovo metodo scendo a 1 cm, immediatamente scopro tutti i nuovi
cancri compresi tra 1 e 5 cm, che prima non ero in grado di individuare. Dopodiché comincio a
scoprire solamente quelli di 1cm, riducendomi nuovamente all’incidenza originaria.
L’incidenza è sempre il risultato di influenze che tendono ad aumentarla, ed altre che tendono a
diminuirla, quindi questa curva non è facile da interpretare perché esprime dei dati registrati sulla
popolazione umana che è esposta a tanti influssi di natura diversa.