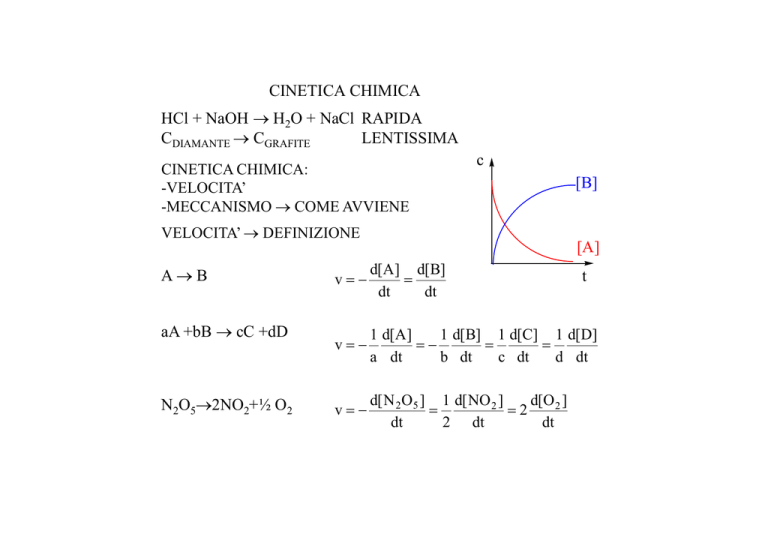
CINETICA CHIMICA
HCl + NaOH → H2O + NaCl RAPIDA
CDIAMANTE → CGRAFITE
LENTISSIMA
CINETICA CHIMICA:
-VELOCITA’
-MECCANISMO → COME AVVIENE
c
VELOCITA’ → DEFINIZIONE
A→B
aA +bB → cC +dD
N2O5→2NO2+½ O2
[B]
[A]
v=−
d[A] d[B]
=
dt
dt
v=−
1 d[A]
1 d[ B] 1 d[C] 1 d[D]
=−
=
=
a dt
b dt
c dt
d dt
v=−
d[ N 2 O5 ] 1 d[ NO 2 ]
d[O 2 ]
=
=2
dt
2 dt
dt
t
VELOCITA’ DI REAZIONE → DIPENDE DA:
- CONCENTRAZIONE DEI REAGENTI
- TEMPERATURA
- RADIAZIONI, CATALIZZATORI
DIPENDENZA da CONC.
A+B→C+D
v=
k[A]α[B]β
Reazione di ordine α in A
“
di ordine β in B
“
di ordine complessivo α + β
α, β determinati sperimentalmente
k = costante di velocità
α, β ordine di reazione
α, β ≠a, b
A→B
t = 0 [A] = c0
t
[A] = c
ln c = -kt
c0
Reazioni del I ordine
d[A ]
d[A ]
v=−
= k[A ] → −
= kdt
dt
[A]
c d[ A ]
t
∫c 0 [A] = − ∫0 kdt
c
lnc
c = e-kt
c0
lnc0
ln c = ln c0 – kt
c0
c = c0 e-kt
k
t
14C → 14N +e- decadimento nucleare τ= tempo di dimezzamento
t=0
t=τ
c = c0
c = c0/2
ln
c
c/2
= − kt → ln
= − ln 2 = − kτ
c0
c0
τ=
ln 2 0,693
=
k
k
t
Reazioni del II ordine
A+B→C+D
v = - d[A] =k[A][B]
dt
A→B
v = - d[A] = k[A]2
dt
[A] = [B] = c v = - dc = kc2 → dc = -kt
dt
c2
t=0
∫
c0
c = c0
t=τ
c
c = c0/2
t
dc
= −∫ kdt
2
0
c
→ 2 – 1 = 1 = kτ →
c0 c0 c0
1 – 1 = kt
c c0
τ= 1 1
kc0
MECCANISMO DI REAZIONE
REAZIONI → URTI ANELASTICI (TEORIA delle COLLISIONI)
MECCANISMO di REAZIONE → in uno STADIO SINGOLO
→ in PIU’ STADI (ognuno con la sua k)
NO(g) + O3 (g) → NO2 (g) + O2 (g) in uno stadio
O3 (g) → O2 (g) + O (g)
O3 (g) + O (g) → 2 O2 (g)
_____________________
2 O3 (g) → 3 O2 (g)
in due stadi
reazione complessiva
k1 k2
A→B →C
B = intermedio di reazione
k1
1) NO2(g) + F2 (g) → NO2F (g) + F (g) stadio lento
k2
2) F (g) + NO2(g) → NO2F (g)
__________________________
2 NO2(g) + F2 (g) → 2 NO2F (g)
stadio veloce
v1 = k1[NO2][F2]
v2 = k2[NO2][F]
v2 > v 1 v = v 1
DIPENDENZA da T
TEORIA delle COLLISIONI →
REAZIONE = URTO ANELASTICO
Perché due molecole reagiscano:
-devono collidere v = f(c, T)
- “
“ con energia sufficiente (KE) → urti efficaci
Es.
H2 + Cl2 → 2 HCl
rottura vecchi legami (H-H, Cl-Cl) + formazione nuovi legami (H-Cl)
↓
barriera energetica da superare = Energia di attivazione (Eatt)
Perché due molecole reagiscano devono avere
KE > Eatt
Quante sono le molecole in grado di reagire (NE?)
E
att
−
NE
= e RT
N
Equazione di Arrhenius
k = A× e
−
Eatt
RT
A = fattore di frequenza
lnK
lnk = c −
Eatt
RT
1/T
TEORIA DELLO STATO DI TRANSIZIONE
A2 + B2 2AB
A
B
A
B
+
A
kd =A e
-Ea’/RT
ki = A’e
B
+
B
A
B
↑
Complesso attivato
-Ea/RT
A
A
B
CATALIZZATORE
→ fa variare la velocità di una reazione
→ non influenza la natura dei prodotti
→ non figura nell’equazione stechiometrica
→ (non influenza la posizione dell’equilibrio)
Catalisi:
- omogenea
- eterogenea
Selettività
ENZIMI
COSTANTE DI EQUILIBRIO
kd
A + B C+ D
ki
→
v = kd[A][B]
←
v = ki[C][D]
c
[C], [D]
→ ←
All’equilibrio
v=v
kd[A]eq[B]eq = ki[C]eq[D]eq
[A], [B]
t
K eq
k d [C]eq[D]eq
=
=
k i [A]eq [B]eq
Derivazione termodinamica
aA+ b B c C + dD
∆GREAZ= Σi νi Gi - Σi νiG i = cGC+ dGD –aGA-bGB
PROD
REAG
GA = G°A + RT ln PA
GC = G°C + RT ln PC
GB = G°B + RT ln PB
GD = G°D + RT ln PD
∆GREAZ= c (G°C + RT ln PC) +d (G°D + RT ln PD)
– a (G°A + RT ln PA) –b (G°B + RT ln PB)
∆G°REAZ
∆GREAZ= cG°C +dG°D – aG°A –bG°B +
cRT ln PC + dRT ln PD- aRT ln PA- bRT ln PB
∆GREAZ= ∆G°REAZ + RT(c ln PC + d ln PD- a ln PA- b ln PB) =
c
d
a
b
= ∆G°REAZ + RT(ln PC + ln PD - ln PA - ln PB ) =
PCcPDd
=∆G°REAZ+RTln a b=∆GREAZ
PA PB
aA+ b B c C + dD
PCcPDd
∆GREAZ=∆G°REAZ+RTln a b
PA PB
REAZIONE SPONTANEA
∆GREAZ < 0
LA REAZIONE PROCEDE DA SINISTRA VERSO DESTRA
∆G°REAZ = cost
∆GREAZ → 0
∆GREAZ = 0
ALL’ EQUILIBRIO:
PCcPDd
∆GREAZ=∆G°REAZ+RTln a b = ∆G°REAZ + RT lnKP = 0
PA PB
∆G°REAZ = - RTln KP
ALL’ EQUILIBRIO:
PCcPDd
KP =
= costante
PAaPBb
∆G°<0 K >1
∆G°>0 K <1
aA+ b B c C + dD
ALL’EQUILIBRIO
∆G = 0 ∆G° = - RT ln KP
T = cost KP = cost
KP = f(T)
PCc PDd
Kc = a b
PA PB
ALL’EQUILIBRIO
KP>> 1 FAVORITI i PRODOTTI REAZIONE SPOSTATA verso DESTRA
KP<< 1 FAVORITI i REAGENTI REAZIONE SPOSTATA verso SINISTRA
____________________________________________________________________________________________________________________________________
GA = G°A + RTln cA = G°A + RTln[A]
c cC c dD [C]c [D]d
Kc = a b =
c A c B [A]a [B]b
aA+ b B c C + dD
PCcPDd
KP =
PAaPBb
PV = nRT
cCccDd
Kc = ______
cAacBb
PA = cART
PB = cBRT
c = n P = nRT = c RT
V
V
PC = cCRT
PD = cDRT
∆ν
PCcPDd (cCRT)c(cDRT)d cCccDd __________=K
(RT)c(RT)d
KP =_____=______________=_______
c(RT)
PAaPBb (cART)a(cBRT)b cAacBb (RT)a(RT)b
KP = KC.(RT)∆ν
KC = KP.(RT)-∆ν
↑
KC
∆ν = c+d-(a+b)
3 H2 (g) + N2(g) 2 NH3 (g)
∆ν = −2 KP = KC
.(RT)∆ν =
KC
KP =
.(RT)−2
2
PNH
3
PH3 . PN
2
2
KC =
2
cNH
3
cH3 . cN
2
2
__________________________________________________________________________________________________________________________________________________________________________
H2 (g) + I2(g) 2HI (g)
PHI2
KP =
PH
∆ν = 0 KP = KC
.
2
PI2
__________________________________________________________________________________________________________________________________________________________________________
SO2 + ½ O2 SO3
KP =
PSO
3
PSO . PO1/2
2
2 SO2 + O2 2 SO3
2
KP' = KP
KP' =
2
2
PSO
3
2 . P
PSO
O
2
2
IN SOLUZIONE KC
HClO H+ + ClO-
Kc =
c H + c ClO −
c HClO
[H + ][ClO − ]
=
[HClO]
4-
Fe2+ + 6 Cl- FeCl64-
[FeCl6 ]
K=
[Fe2+][Cl-]6
____________________________________________________
EQUILIBRI IN FASE ETEROGENEA
C(s) + O2 (g) CO2(g)
KP =
PCO
2
PO
2
AgCl(s) Ag+(aq) + Cl-(aq)
K = [Ag+].[Cl-]
PRINCIPIO DI LE CHATELIER
3 H2 (g) + N2(g) 2 NH3 (g)
KP =
KP, KC = cost
2
PNH
3
KC =
PH3 . PN
2
2
2
cNH
cH3 . cN
2
2
AUMENTO di PN2, PH2 l’EQUILIBRIO si sposta verso DESTRA
AUMENTO di PNH3 l’EQUILIBRIO si sposta verso SINISTRA
PH2= xH2.Ptot
PN2= xN2.Ptot
PNH3= xNH3.Ptot
VARIAZIONE DI Ptot?
KP =
2
PNH
2
Kx =
2
xNH
3
.
x H32 x N2
Ptot
NH3,
H2, N2
2
xNH
3
=
=
3 .
.
3.
.
x
(x
P
)
(x
P
)
tot
H2
H2
PN2
N2 tot
3
PH3 .
(x NH .Ptot)2
3
2
. -2
(P
)
tot
K
.
x Ptot
=
x N (Ptot)4
2
3
NON E’ UNA VERA COSTANTE
TERMODINAMICA
KP = KX.P∆ν
νi = coefficienti
PROD
REAG
Stechiometrici
____________________________________________________
2 H2 (g) + O2(g) 2 H2O (g)
PH2O
KP = 2
∆ν = −1
KP = KX.P−1
PH2 . PO
2
2
REAZIONE FAVORITA DA AUMENTO P
____________________________________________________
∆ν = Σi νi − Σi νi
PCl5 (g) PCl3(g) + Cl2(g)
∆ν = 1 KP = KX.P
KP =
REAZIONE SFAVORITA DA AUMENTO P
PPCl. PCl
3
2
PPCl
5
____________________________________________________
C(s) + O2(g) CO2 (g)
∆ν = 0 KP = KX
KP =
VARIAZIONI DI P NON HANNO
EFFETTO SULL’EQUILIBRIO
PCO
PO
2
2
N.B. per il calcolo di ∆ν
contano i coeff. delle
sostanze gassose
EFFETTO DELLA TEMPERATURA
∆G° = - RT ln K = ∆H°-T∆S° d ln K ∆H°
∆H° ∆S°
+
⇒
=
RT
R
dT
RT 2
∆H° ∆S°
ln K1 = −
+
RT1
R
ln K = −
ln K 2 = −
ln
lnK
∆S°
R
-∆H°
R
∆H° < 0
1/T
∆H° ∆S°
+
RT2
R
∆H° > 0
K2
∆H° 1 1 ∆H° T2 − T1 ∆H°∆T
=−
− =
=
K1
R T2 T1
R T2 T1 RT2T1
ENDOTERMICA
ESOTERMICA
∆H° > 0
∆H° < 0
T2 > T1
T2 > T1
K2 > K1
K2 < K1
kd
A + B C+ D
ki
K eq
→
v = kd[A][B]
←
v = ki[C][D]
→ ←
All’equilibrio v = v
kd[A]eq[B]eq = k-i[C]eq[D]eq
k d [C]eq [D]eq
=
=
k i [A]eq [B]eq
kd = e
ki = e
-Ea/RT
-Ea’/RT
kd
Ae− E a / RT
A −( E a −E 'a ) / RT
K eq =
=
= e
= Be −∆H / RT
'
k i A' e − E a / RT A'
d ln K eq
∆H
∆H
ln K eq = B'−
⇒
=
RT
dT
RT 2
REAZIONI IN SOLUZIONE
- ACIDO-BASE SCAMBIO DI PROTONI
HA + B A- + BH+
- REDOX SCAMBIO DI ELETTRONI
AOX + BRED ARED + BOX
- REAZIONI DI SOLUBILIZZAZIONE
AgCl(s) Ag+(aq) + Cl-(aq)
- REAZIONI DI COMPLESSAZIONE
Fe2+ + 6 Cl- FeCl64-
REAZIONI ACIDO-BASE
ARRHENIUS
ACIDO LIBERA IONI H+
BASE LIBERA IONI OHHCl → H+ + ClNaOH → Na+ + OHNH3 + H2O → NH4OH
NH4OH NH4+ + OH-
ACIDO
BASE
BRÖNSTED E LOWRY
ACIDO SPECIE CAPACE DI DONARE IONI H+
BASE SPECIE CAPACE DI ACCETTARE IONI H+
HA A- + H+
B + H+ BH+
ACIDO BASE CONIUGATA
BASE
HA + B
A- +
ACIDO1 BASE2
ACIDO CONIUGATO
BH+
BASE1 ACIDO 2
HNO2 + H2O NO2- + H3O+
acido1 base2 base1 acido2
H3O+ = IONE IDRONIO
(OSSONIO)
NH3 + H2O NH4+ + OHbase1 acido2 acido1 base2
OH- = IONE OSSIDRILE
NaOH → Na+ + OH-
LEWIS
ACIDO SPECIE CAPACE DI ACCETTARE LONE PAIRS
BASE SPECIE CAPACE DI DONARE LONE PAIRS
H+
N
N
2s
2p
3
H
B
sp
H
H
2
F
H
+
N
H
H
H
H
H
F
F
B
N
H
F
F
B
F
N
H
H
[A-][H3O+]
ACIDO
HA + H2O
+ H3
Ka =
[HA]
DEBOLE
-][H+]
[A
+
HA A + H
Ka =
[HA]
-][H O+]
[F
3
= 6,6 x10-4
HF + H2O F- + H3O+ KHF =
[HF]
A-
HCN + H2O ACIDO FORTE
CN-
[CN-][H3O+]
KHCN =
= 6,17 x10-10
[HCN]
HA + H2O → A- + H3O+
HA → A- + H+
BASE DEBOLE
BASE FORTE
+
H3O+
O+
B + H2O BH+
+
OH-
[BH+][OH-]
Kb=
[B]
NaOH → Na+ + OH- ← MONOPROTICA
Ba(OH)2 → Ba+2 + 2 OH- ← DIPROTICA
2 H2O H3O+ + OH-
KW = [H3O+][OH-] = 10-14
Acqua pura [H3O+] = [OH-] KW = [H3O+]2 = 10-14
_________
O+]
[H3
____________
= √ KW = √ 10-14 = 10-7
pH = -log [H3O+]
Acqua pura :
[H3O+] = [OH-] = 10-7 pH = -log [H3O+]= -log 10-7 = 7
SOLUZIONE ACIDA [H3O+] > [OH-]
[H3O+] > 10-7 pH < 7
SOLUZIONE BASICA [H3O+] < [OH-]
[H3O+] < 10-7 pH > 7
0 < pH < 14
KW
+
pOH = − log[OH − ] = − log
=
−
log
K
+
log[
H
O
] = 14 − pH
W
3
+
[ H 3O ]
CALCOLO DEL pH
Acido forte: HCl 0,1 M pH = ?
HCl + H2O → Cl- + H3O+
0,1 M
→ 0,1 M
[H3O+] = 0,1 M = 10-1 M
Base forte:
0,1 M
pH = - log [H3O+] = 1
NaOH 0,01 M pH = ?
NaOH → Na+ + OH0,1 M → 0,1 M
[OH-] = 0,1 M = 10-1 M
0,1 M
pOH = - log [OH-] = 1
KW
10 −14
[ H 3O ] =
= −1 = 10 −13 M
−
[OH ] 10
+
pH = - log [H3O+] = 14 – pOH = 13
ACIDO DEBOLE
0,1 M HCN Ka= 6,17 x 10-10
O+
CN-
HCN + H2O H3 +
c
10-7
/
c-x
x
x
[CN-][H3O+]
x2 ~ x2
KHCN =
=
[HCN]
c-x
c
[H3O+] = x = Ka × c = 0,1× 6,17 ×10
Ka<10-3
−10
c>10-3
= 7,8 x10-6
pH = - log [H3O+] = - log(7,8 x10-6) = 5,11
~
HCN + H2O H3O+ + CN[CN-][H3O+]
(αc)2
α2c
K
=
=
HCN
c(1-α)
αc
αc
=
[HCN]
c(1-α)
1-α
α2c
Ka
[H 3O + ] 7,8x10 −6
6,17 ×10 −10
−5
α=
=
= 7,8 ×10 α =
=
= 7,8x10 −5
c
0,1
c
0,1
BASE DEBOLE
0,1 M NH3 KB= 1,8 x 10-5
+
OH-
NH3 + H2O NH4 +
c-x
x
x
2
[NH4+][OH-]
x
Kb =
=
[NH3]
c-x
−5
[OH ] = x = K × c = 1,8 ×10 × 0,1 = 1,34 ×10
−
b
pOH = -log [OH-] = -log (1,34 x 10-3)= 2,87
pH = 14- pOH = 11,13
KW
10 −14
[ H 3O ] =
=
= 7,5 × 10 −12 M
−
−3
[OH ] 1,34 × 10
+
pH = - log [H3O+] = - log (7,5 x10-12) = 11,13
−3
~
x2
c
ACIDI POLIPROTICI
H2S + H2O HS-
+ H2O HS-
S2-
O+
+ H3
+ H3
O+
[HS-][H3O+]
Ka1 =
[H2S]
Ka1 > Ka2
[S2-][H3O+]
Ka2 =
[HS-]
H3PO4 + H2O H2PO4- + H3O+
[H 2 PO 4-][H 3O + ]
K a1 =
[H 3PO 4]
H2PO4- + H2O HPO42- + H3O+
[HPO 42-][H 3O + ]
K a2 =
[H 2PO 4-]
HPO42- + H2O PO43- + H3O+
[PO43-][H3O+]
Ka3 =
[HPO42-]
Ka1 > Ka2 > Ka3
HNO2 + H2O NO2- + H3O+
acido1 base2 base1 acido2
[NO2-][H3O+]
Ka =
[HNO2]
NO2- + H2O HNO2 + OHbase1 acido2 acido1 base2
[HNO2][OH-]
Kb =
[NO2-]
Lo ione NO2- è la base coniugata dell’acido HNO2
[HNO2][OH-]
[NO2-][H3O+]
x
Ka x K b =
= [H3O+][OH-] =KW
[NO2 ]
[HNO2]
KW
Kb =
Ka
Ka =
KW
Kb
IDROLISI SALINA
NaOH = base forte
NaNO2 → deriva da
HNO2 = acido debole
NaNO2 → Na+ +NO2NO2- + H2O HNO2 + OHNa+ + H2O NaOH + H+
pH basico
[HNO2][OH-]
Ki= Kb =
[NO2-]
= KW
Ka
ACIDO FORTE + BASE DEBOLE
NH4Cl → NH4+ + ClNH4+ + H2O NH3 + H3O+
NH3 + H2O NH4+ + OH-
pH acido
[NH3][H3O+] = K
Ki= Ka =
W
[NH4+]
Kb
[NH4+][OH-]
Kb =
[NH3]
SOLUZIONE TAMPONE
ACIDO DEBOLE (HA) + un suo SALE con BASE FORTE (NaA)
Es. HF + NaF, HNO2 + NaNO2
HA + H2O A- + H3O+
dissociazione acido: parziale
NaA→ Na+ +AA- + H2O HA + OH-
dissociazione sale: totale
idrolisi sale: parziale
cA= conc. dell’acido
cS= conc. del sale
HA + H2O A- + H3O+
cA
cS
[A-][H3O+]
Ka =
[HA]
[H3O+] = Ka x
[HA]
cA
- = Ka x
[A ]
cS
c
c
c
pH = − log[H 3O + ] = − log K a A = − log K a − log A = pK a + log S
cS
cS
cA
pH = pK a + log
cS
cA
cS = cA
pH = pKa
Aggiungiamo cH moli di un acido forte HAf (cH<< cS, cA)
HAf + H2O → Af- + H3O+
cH
HA + H2O A- + H3O+
cA
cS
cH
cA +cH
cS- cH ?
[A-][H3O+]
Ka =
[HA]
pH = pK a + log
=
(cS - cH)[H3O+]
(cA + cH)
cS − c H
c
≅ pK a + log S
cA + cH
cA
[ H 3O + ] = K a
(c A + c H )
(c S − c H )
cA,cS<<cH
BASE DEBOLE B (cB)
+ suo SALE con ACIDO FORTE BHCl ( cS )
BHCl → BH+ + ClB + H2O BH+ + OHcB
cS
[BH+][OH-]
Kb =
[B]
[OH − ] = K b
pOH = − log[OH − ] = pK b + log
pH=14-pOH
cS
cB
[B]
cB
=
K
b
cS
[ BH + ]
FATTORI CHE INFLUENZANO LA FORZA
DEGLI ACIDI E DELLE BASI
IDRURI :LUNGO IL PERIODO
LiH < BeH2< CH4 < NH3 < H2O < HF
CARATTERE ACIDO →
LUNGO IL GRUPPO
H2O < H2S < H2Se < H2Te
HF< HCl < HBr < HI
BASI : NH3 > H2O > HF
OSSIACIDI:
HClO > HBrO > HIO
Cl-O-H > Br-O-H > I-O-H
HClO4 >HClO3 > HClO2 > HClO
CF3COOH > CH3COOH
H2SO4 >H2SO3
SOSTANZE ANFOTERE - ANFOLITI
Al(OH)3 + 3 H3O+ Al3+ + 6 H2O
Al(OH)3 + OH- Al(OH)4- AlO2- + 2 H2O
H2O + NH3 NH4+ + OHH2O + HCl → Cl- + H3O+
H2PO4- + H3O+ → H3PO4 + H2O
H2PO4- + OH- → HPO42-+ H2O
NH2-R-COOH
__________
AMINOACIDI
________________
NH2-R-COOH + OH- → NH2-R-COO- + H2O
__________
________________
________________
NH2-R-COOH + H3O+ → NH3+-R-COOH + H2O
__________
__________
EQUILIBRI DI SOLUBILITA’
H2O
C6H12O6(S) → C6H12O6(aq)
H2O
NaCl(S) → Na+(aq) + Cl-(aq)
s = solubilità = MMAX
sC6H12O6= [C6H12O6]MAX
sNaCl= [Na+]MAX = [Cl-]MAX
AgCl(S) Ag+(aq) + Cl-(aq)
KS= [Ag+][Cl-]
Ag2S 2Ag+ + S2-
KS= [Ag+]2[S2-]
Mg(OH)2 Mg2+ + 2OH-
KS= [Mg2+][OH-]2
Ca3(PO4)2 3Ca2+ + 2PO43- KS= [Ca2+]3[PO43-]2
s = f(T)
KS= f(T)
AgCl(S) Ag+(aq) + Cl-(aq)
s
s
KS= [Ag+][Cl-] =s2
Ag2S 2Ag+ + S22s
KS= [Ag+][Cl-]=2,8x10-10
s= [Ag+] = [Cl-]
s = K s = 2,8 ×10 −10 = 1,7 ×10 −5 M
KS= [Ag+]2[S2-]=(2s)2(s)= 4s3
s
s
Al(OH)3 Al3+ + 3OHs
3s
=3
Ks
4
KS= [Al3+] [OH-]3 = s(3s)3 = 27s4
Ks
s=
27
4
EFFETTO DELLO IONE A COMUNE
Soluzione satura AgCl da solo
AgCl(S) Ag+(aq) + Cl-(aq)
s
s
KS= [Ag+][Cl-] =s2
s = K s = 1,7 × 10 −5 M
Soluzione satura AgCl + 0,1 M NaCl
NaCl → Na+ + ClcNaCl cNaCl
AgCl(S) Ag+(aq) + Cl-(aq)
s
s + cNaCl
KS= [Ag+][Cl-]= s(s+cNaCl)
cNaCl>>s
s+cNaCl≈ cNaCl
KS=s. cNaCl
cNaCl= 0,1 M
s = KS /cNaCl= 2,8x10-10/0,1= 2,8x10-9 M
EFFETTO DEL PH SULLA SOLUBILITA’
IDROSSIDI
Mg(OH)2 Mg2+ + 2OHs = [Mg 2+ ] =
KS= [Mg2+][OH-]2
Ag2S 2Ag+ + S2-
KS= [Ag+]2[S2-]
in ambiente acido
S2- + H+ →HSHS- + H+ → H2S
CaCO3 Ca2+ + CO32-
KS= [Ca2+][CO32-]
CO32- + 2 H+ → H2CO3 → CO2 +H2O
KS
[OH − ]2
NaCl → Na+ + ClAgNO3 → Ag+ + NO3Ag+ +Cl- → AgCl↓
KS= [Ag+]sat[Cl-]sat
[Ag+] [Cl-]> KSsi ha precipitazione
[Ag+] [Cl-]< KSnon si ha precipitazione
ELETTROCHIMICA
Celle galvaniche (PILE)
∆G < 0
Energia
chimica
∆G > 0
Celle elettrolitiche
Energia
elettrica
PILA → dispositivo che utilizza una REAZIONE REDOX
SPONTANEA (∆G < 0) per produrre ENERGIA ELETTRICA
Energia chimica → Energia elettrica
PILE
Cu2+ + Zn0 → Cu0 + Zn2+
Cu2+ + 2 e-→ Cu0
Zn0 → Zn2+ + 2 e-
A
Zn
-
Cu
+
KCl
Cl-
Zn
K+
Cu2+
SO42Zn2+ SO42Zn
EPILA = E+ - E->0
Zn2+ + 2e-
Cu2+ SO42Cu2+ + 2e-
Zn(s)Zn2+(aq) Cu2+(aq) Cu(s)
Cu
EPILA = E+ - EE+ , E- dipendono :
- dalla concentrazione delle specie ossidate e ridotte
- dalla loro natura chimica
POTENZIALE STANDARD di un semielemento
→Tutte le specie hanno attività unitaria
filo di Pt
Si può misurare la f.e.m. di una pila
non il potenziale dei singoli semielementi
H2
Elettrodo standard a idrogeno
2H+ + 2 e- → H2 (g)
(Pt) H2(g) (1atm) H+ (1M)
[H+]= 1 M
EH+/H = 0
2
PH2 = 1 atm
1M
specie ossidata
specie ridotta
F2 (g) + 2e 2F-(aq)
H2O2 (aq) + 2H+(aq) + 2e 2H2O(l)
MnO4-(aq) + 8H+(aq) + 5e Mn2+(aq) + 4H2O(l)
Au3+(aq) + 3e Au(s)
Cl2 (g) + 2e 2Cl-(aq)
Cr2O72-(aq)+ 14H+(aq)+6e 2Cr3+(aq) + 7H2O(l)
O2 (g) + 4H+(aq) + 4e 2H2O(l)
ClO4-(aq) + 2H+(aq) + 2e ClO3-(aq) + H2O(l)
Pt2+(aq) + 2e Pt(s)
NO3-(aq) + 4H+(aq) + 3e NO(g) + H2O(l)
Ag+(aq) + e Ag(s)
Cu2+(aq) + 2e Cu(s)
2H+(aq) + 2e H2(g)
Fe2+(aq) + 2e Fe(s)
Cr3+(aq) + 3e Cr(s)
Zn2+(aq) + 2e Zn(s)
Al3+(aq) + 3e Al(s)
Mg2+(aq) + 2e Mg(s)
Na+(aq) + e Na(s)
K+(aq) + e K(s)
Li+(aq) + e Li(s)
E0 (V)
+2.87
+1.77
+1.51
+1.50
+1.36
+1.33
+1.23
+1.23
+1.20
+0.96
+0.80
+0.34
+0.00
-0.44
-0.74
-0.76
-1.66
-2.36
-2.71
2.93
-3.05
EPILA = E+ - EE+ , E- dipendono :
- dalla natura chimica delle specie ossidate e ridotte → E°
- dalla loro concentrazione
E = E0 +
a
RT a ox
0,0592
ln
= E0 +
log ox
nF a red
n
a red
Equazione di Nernst
R = 0,0821 atm.l.K-1= 8,31 J .K-1
T = 298 K
F= 96500 C
2,3 conversione da ln a log
per le specie in soluzione: concentrazione (M)
a = attività per i gas: pressione P
per i solidi puri: 1
2H+ +2e-→ H2
EH+/H2
= E0
H+ /H2
Pt, H2H+
2
+ 2
0,0592 a H+ 0,0592 [H ]
+
log
=
log
2
a H2
2
PH2
Cu2+ + e- →Cu+
ECu2+/Cu+
= E0
Cu2+ /Cu+
Pt Cu2+, Cu+
[Cu2+ ]
+ 0,0592log
[Cu+ ]
Pt
Cu2+,
Cu+
MnO4- +5e- +8H+ →Mn2+ + 4H2O
Pt KMnO4, MnSO4, H2SO4
E MnO4−/Mn2+
= E 0MnO− /Mn2+
4
0,0592 [MnO4− ][H+ ]8
+
log
5
[Mn2+ ]
Pt
KMnO4
MnSO4
H2SO4
E = E0 +
RT aox
0,0592
aox
ln
log
= E0 +
nF ared
n
ared
Zn(s)Zn2+(aq) Cu2+(aq) Cu(s)
A
-
e-
+
Cu
Zn
EPILA = E+ - ECu2+
Zn2+
Zn Zn2++2e-
+ Cu2+ + 2 e-→ Cu0
-
Zn0 → Zn2+ + 2 e-
0,0592
log[Cu2+ ]
2
E+ = ECu2+ /Cu = E0
+
E- = EZn2+/Zn = E0
+
Cu2 + /Cu
Zn2+ /Zn
Cu2++2e- Cu
0,0592
log[Zn2+ ]
2
PILA → dispositivo che utilizza una REAZIONE REDOX
SPONTANEA (∆G < 0) per produrre ENERGIA ELETTRICA
Energia chimica → Energia elettrica
G= H-TS dG= dH-TdS-SdT
H= E+PV dG= dE+PdV+VdP-TdS-SdT
T= costante SdT=0
P= costante VdP=0
dG= dE+PdV-TdS
dE=δQ-δW
δQ=TdS
(reversibile)
dG=δQ-δW+ TdS-PdV= - δW +PdV
δW=PdV+δWelettr
dG=-δWelettr
∆G° = -nFE°PILA = -nF(E°+-E°+)
∆G° = -RTlnK= nFE°
E0
∆G = -Welettr=-nFEpila
∆G0
−
= E0PILA = E0+ − E0nF
∆G0
RT
=ln K
PILA = −
nF
nF
∆G = nFEpila EPILA = E+ - EOx1 + n1e- Red1
Red2 Ox2 + n2e-
E1=E+ E2= E-
x n2
x n1
______________________________________________________________________________________________
n= n1n2
n2 Ox1 +n1Red2 n2 Red1 + n1Ox2
G = G° +RT ln a
∆GREAZ= Σi νi Gi - Σi νiGi
PROD
∆G°1=G°Red1- G°Ox1
REAG
∆G°2=G°Red2- G°Ox2
E1> E2
∆G = n2(∆G°1-RTln n1(∆G°2−RTln
=-nFEpila
n= n1n2
∆G 0 RT a
∆G 0 RT a
∆G
Ox1
Ox 2
1
2
+ n1
=
E PILA = −
= −n 2
−
ln
−
ln
nF
nF
nF a Red1
nF
nF a Red2
RT a Ox1
RT a Ox 2
0
0
− E2 + −
= E PILA
= − E1 +
ln
ln
n1F a Red
n 2 F a Red
1
2
RT a Ox1
0
E1 = E1 +
ln
nF a Red
1
a dOx
RT
E2 = E02 +
ln b 2
nF a Red2
∆G0
−
= E0PILA = E0+ − E0nF
∆G0 RT
E PILA = −
=
ln K
nF nF
0
Ox1 + n1e- Red1
Red2 Ox2 + n2e-
x n2
x n1
__________________________----------------__________________________
n= n1n2
n2 Ox1 +n1Red2 n2 Red1 + n1Ox2
EPILA= 0
→
∆GREAZ=0
n2
n1
a
a
∆G REAZ
∆G
RT
Re d Ox
E PILA = −
=−
−
ln n 1 n 2
nF
nF
nF a Ox2 a Re1 d
1
2
n1
2
n1
a nRed
a
a nRe2 d a Ox
1 Ox 2
0
1
2
=K
∆G = − RT ln n n
n2
n1
a Ox1 a Red 2
a Ox2 1 a Re1 d 2
0
∆G° = -RTlnK= nFE°
=0
K=
°
PILE A CONCENTRAZIONE
-
Cu [Cu2+]- [Cu2+]+ Cu +
0,0592
log[Cu2+ ]
2
Cu2+ + 2 e-→ Cu0
ECu2+/Cu = E0
+ Cu2+ + 2 e-→ Cu0
E + = E0
+
0,0592
log[Cu2+ ]+
2
E − = E0
+
0,0592
log[Cu2+ ]−
2
Cu2+ /Cu
Cu2+ /Cu
- Cu0 → Cu2+ + 2 e-
Cu2+ /Cu
+
0,0592
0,0592 [Cu2+ ]+
2
+
2
+
EPILA = E+ - E =
(log[Cu ]+ − log[Cu ]− ) =
log
2
2
[Cu2+ ]−
[Cu2+]+ > [Cu2+]-
EPILA>0
Driving force: ∆GMIX
ELETTROLISI
e-
Energia elettrica → Energia chimica
A-
Reazioni non spontanee (∆G>0)
C+
Elettrolisi di NaCl
Sale fuso
C+ = Na+ A- = ClPolo - Na+ + e- → Na
Polo + Cl- → ½ Cl2 + eNaCl → ½Cl2 + Na
_ _________________________________________________________________________
Soluzione acquosa
C+ = Na+, H+ A- = Cl- , OHPolo - Na+ + e- → Na
H+ + e- → ½ H2
Polo + Cl- → ½ Cl2 + e2OH- → ½O2 +2e- + H2O
LEGGI DI FARADAY
-La quantità di sostanza che viene ossidata o ridotta ad un
elettrodo è proporzionale alla quantità di elettricità passata
w = we.Q = we.I.t
we = equivalente elettrochimico
-Uguali quantità di carica Q determinano la deposizione di un
uguale numero di equivalenti di specie ossidate o ridotte.
PEQ = PM/z
PEQ = PA/z
1F = 96500 C 1 equivalente
H+ +e- →1/2 H2
Fe2+ +2e- →Fe
Al3+ +3e- → Al
F = NA.e-
1 eq = 1 mole → 1F = NA e1 eq = 1/2 mole → 1F = NA e1 eq = 1/3 mole → 1F = NA e-
ACCUMULATORI
Carica: elettrolisi
+
e
PbO2
Pb
H2SO4
Pb PbSO4, H2SO4PbO2
E°PbO2/Pb2+> E° Pb2+/Pb
+
Pb2+ +2e- → Pb
-
Pb2+ +2H2O → PbO2 +2e- +4H+
___________________________ ___________________________ ___________________________
2Pb2+ +2H2O → PbO2 +Pb +4H+
Scarica: pila
Pb
-
e
H2SO4
+
PbO2
+
PbO2 +2e- +4H+ → Pb2+ +2H2O
- Pb →Pb2+ +2e__________________________
PbO2 +Pb +4H+→2Pb2+ +2H2O