Test di agglutinazione diretta
Agglutinazione su vetrino per ricerca antigeni
sospensione in sol. fisiologica della colonia sospetta o del tampone clinico, preparazione
controllo e test (50µl campione + 50µl antisiero), mix e osservazione entro 4 min
Milk ring test per ricerca anticorpi contro Brucella abortus
latte crudo in tubo (altezza 30-50mm), aggiunta 30 µl di antigene inattivato e colorato
ogni 2 ml di latte, incubazione a 37°C per 1h, osservazione eventuale colorazione sulla
superficie del liquido o all’interfaccia latte-crema
Test di agglutinazione indiretta
Agglutinazione indiretta passiva con sferette di lattice
Individuazione di Staphylococcus aureus
Particelle coperte di fibrinogeno e immunoglobuline G (IgG): il fibrinogeno lega la coagulasi di
superficie e le IgG si legano alla proteina A
Agitare il reagente test per 10 sec, preferibilmente su vortex, porre una goccia di reagente test
sulla card per ogni saggio da eseguire, trasferire una o più colonie nella goccia di reagente e
mixare bene per 20 sec, agitare la card in verticale e osservare immediatamente per
agglutinazione
Se agglutinazione non è chiara ripetere il test con il reagente di controllo (BSA)
Individuazione di Salmonella
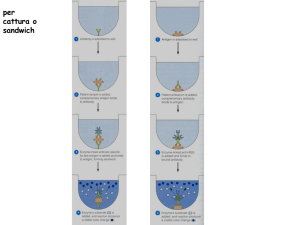
1. Omogeneizzare brodo di arricchimento, prelevare 1 goccia di coltura e trasferirla sulla card,
omogeneizzare il reagente, aggiungere 1 goccia ad ogni campione da saggiare e mescolare bene
con ansa, agitare 2-3 volte la card e osservare per la presenza di agglutinazione entro 2 minuti
2. Porre 1 goccia di soluzione salina sulla card per ogni campione da saggiare, emulsionare una
colonia nella soluzione ed escludere autoagglutinazione, omogeneizzare il reagente,
aggiungere 1 goccia ad ogni campione da saggiare e mescolare bene con ansa, agitare 2-3 volte
la card e osservare per la presenza di agglutinazione entro 2 minuti
Test ELISA competitivo per individuazione di antigeni
Estrazione con tampone/solvente fornito, rispettando la diluizione consigliata, per 30’ a
temperatura ambiente e chiarificazione
Porre 20 µl di anticorpo specifico in ogni pozzetto, aggiungere:
50 µl di estratto e sue diluizioni portate a 50 µl con H2O
(ad esempio estratto+H2O:40+10, 30+20, 20+30, 10+40)
controlli (campione = 0 µl)
eventuali standard
Reazione per 15 min, poi aggiunta di antigeni coniugati (30 µl) e reazione per 15 min
Aggiunta del substrato per l’enzima (10 µl) e lettura della colorazione sviluppata (λ variabile
secondo il substrato usato)